类胡萝卜素是自然界分布范围最广的一种天然色素,广泛存在于光合细菌、古细菌、真菌、藻类、植物和动物中。大多数水产动物富含类胡萝卜素且大量沉积在表皮,形成了多样的体色,在动物伪装、求偶和警示等过程中具有重要作用。基于这些重要的生理生态作用,研究人员认为,动物沉积类胡萝卜素形成体色与动物个体适应能力有着密切联系,选择压力对体色表型具有较大影响,故体色表型的遗传机制受到了关注。类胡萝卜素体色遗传基础分为吸收、代谢和沉积3个方面,在生物化学过程中,吸收要通过物质跨膜转运来完成,代谢的主要方式是氧化,沉积则主要通过蛋白结合来实现,这3个方面的生化过程较为简单[1]。然而,参与类胡萝卜素跨膜转运、氧化和蛋白结合的基因众多,功能类似的基因同源关系较远,且因动物类胡萝卜素依赖食物摄入,环境因素对基因功能影响较大,这些因素给基因功能鉴定带来诸多困难。此外,类胡萝卜素还是免疫、抗氧化和维生素A合成等核心细胞学过程的关键分子,在抗应激、免疫调节、能量调控和生殖发育中发挥了重要作用,这些重要的生理功能也给基因功能鉴定带来了额外的困难。
虽然面临诸多困难,但鉴于吸收、代谢和沉积等方面的分子基础是解析类胡萝卜素生态适应、理解体色表型塑造和解释类胡萝卜素代谢环境适应的根本,相关研究还是取得较多进展[2]。目前,主流观点认为,类胡萝卜素产生的体色在生态适应上具有优势,是机体适应能力强的体现,代表了细胞呼吸链等核心能力,需要加强分子层次证据收集,形成在生态学、细胞学和分子生物学方面等多层次的综合解释,建立完整的理论体系。本文结合水产动物类胡萝卜素组成的特点,总结了类胡萝卜素在动物机体内代谢的分子机制,阐述了参与类胡萝卜素转运、转化和沉积的主要基因,及其功能、作用和进化过程,展望了其研究趋势,以期为水产动物类胡萝卜素体色形成的分子基础研究提供科学参考。
1 类胡萝卜素的结构
类胡萝卜素是一类四萜类化合物,由多烯链连接两个末端基团[3](图1),其颜色随着共轭双键的数目不同而变化,常为黄色、橙色、红色和紫色。通常情况下,共轭双键的数目越多,颜色越偏向红色,氧化程度越高,颜色也越偏向红色。根据是否含有氧元素,可以将类胡萝卜素分为胡萝卜素(carotene)和胡萝卜醇(carotenol)两类。前者不含氧元素是碳氢化合物,其主要种类为α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素(β,ψ-胡萝卜素)和番茄红素,大约存在50种天然胡萝卜素[1,4];后者含有氧元素,主要种类有β-隐黄素、叶黄素、玉米黄素、虾青素、岩藻黄素和多甲藻黄素,其氧原子以羟基、羰基、醛基、羧基、环氧基和呋喃氧基等形式存在。有些胡萝卜醇能够以脂肪酸酯、糖苷、硫酸盐和蛋白复合体形式存在。截至2018年,已经报道了大约800多种胡萝卜醇[1,4]。常见的胡萝卜素和胡萝卜醇结构见图2。
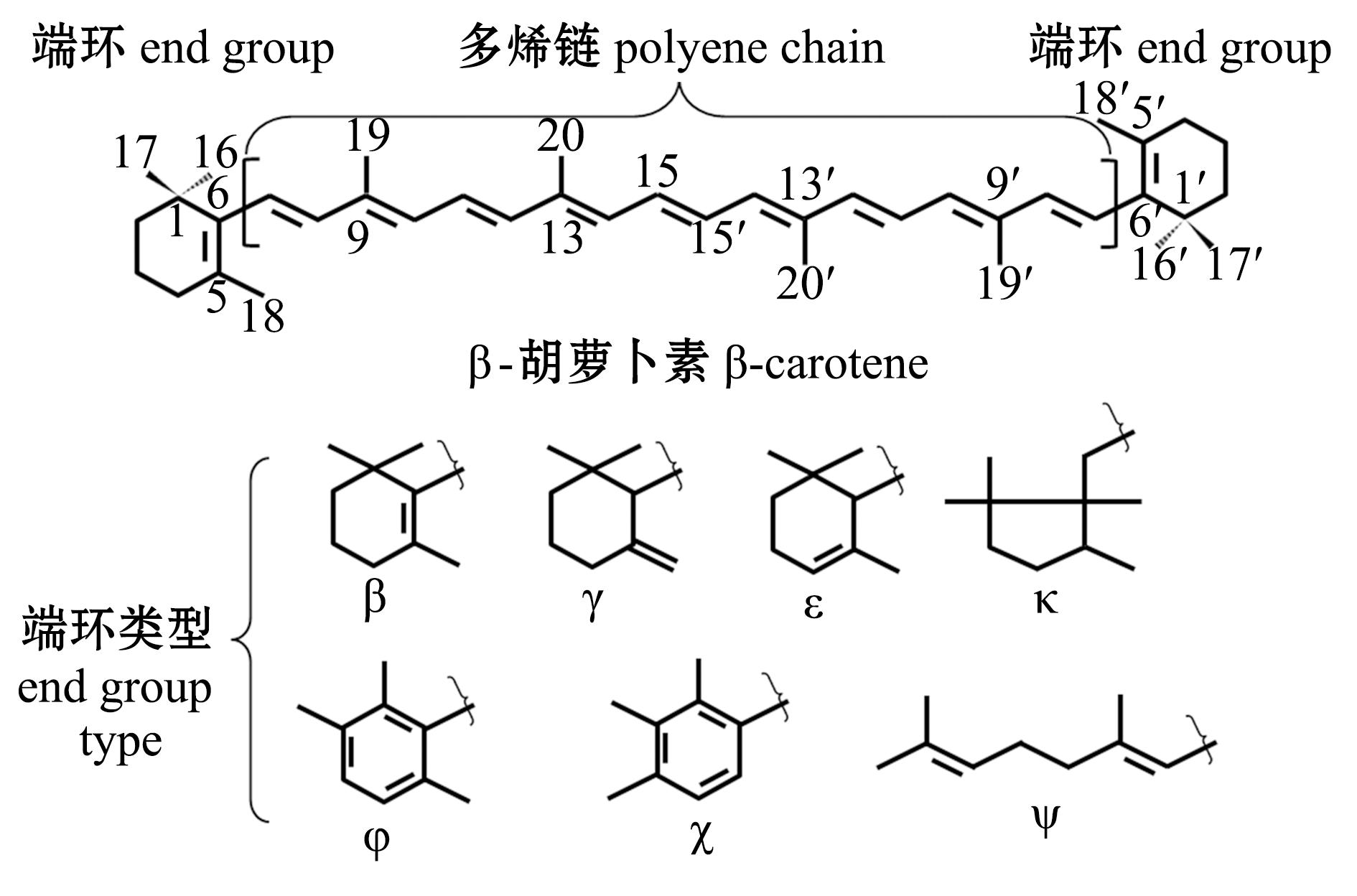
图1 类胡萝卜素的基础结构[3]
Fig.1 Basic structure of carotenoids[3]
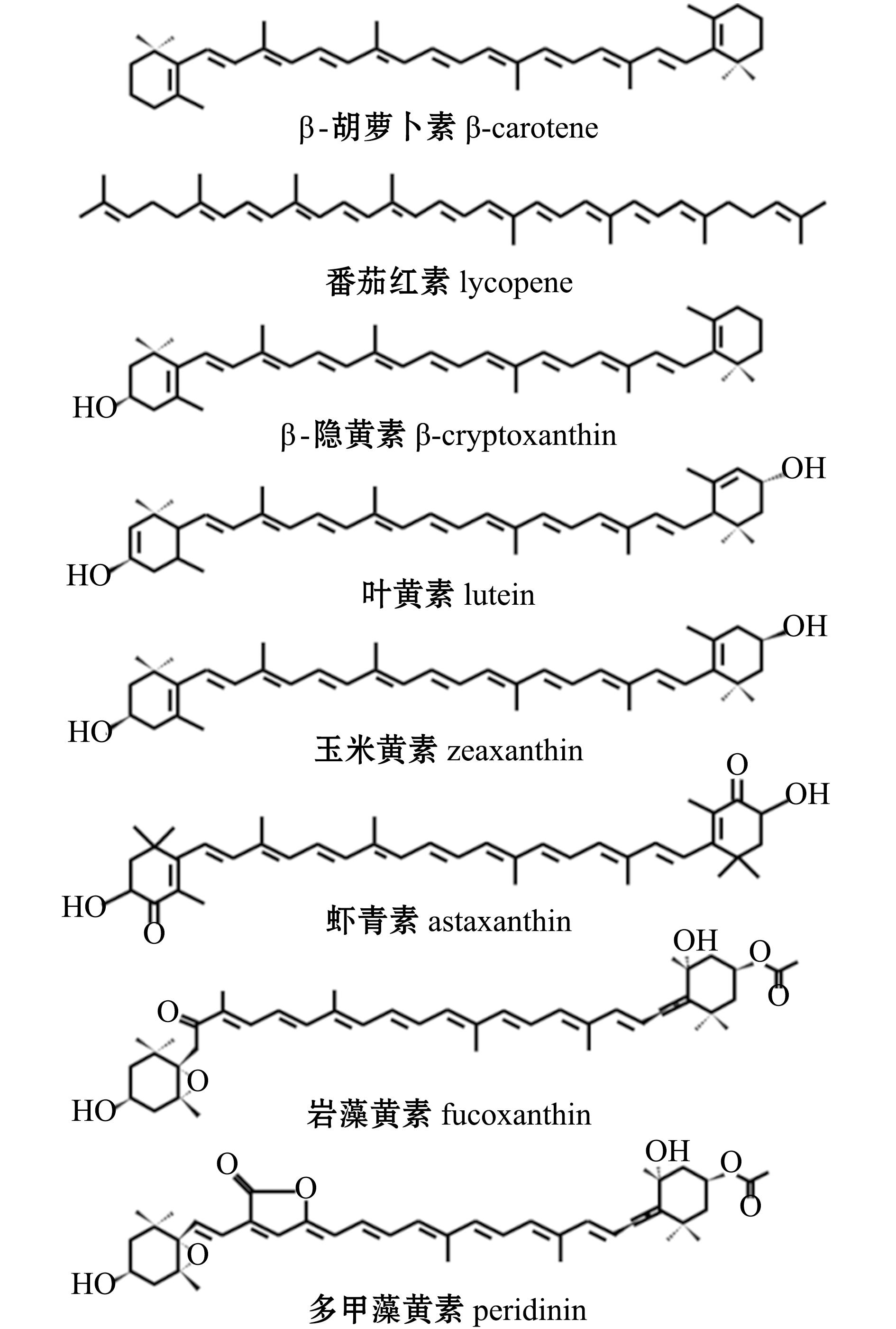
图2 典型的胡萝卜素和胡萝卜醇结构[3]
Fig.2 Typical structures of carotene and carotenol[3]
2 水产动物类胡萝卜素主要种类及应用
几乎所有动物都不能从头合成类胡萝卜素,而需从食物中获取。有些动物可以将吸收的类胡萝卜素进行氧化、还原、转双键、氧化裂解双键和裂解环氧键等代谢转化[5]。若类胡萝卜素末端基团是未修饰的紫罗兰酮环,如α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素(β,ψ-胡萝卜素)和β-隐黄质等,则可作为维甲酸的前体,称为维生素A原。类胡萝卜素具有光保护、抗氧化、增强免疫和促进生殖等多种生物学功能,因此,在水产生物养殖中具有重要作用。
2.1 水产动物类胡萝卜素的主要种类
水产动物的类胡萝卜素主要来源于藻类,在食物链传递中发生多次生物转化,其种类繁多。常见的水产动物类胡萝卜素为β-胡萝卜素、岩藻黄素、多甲藻黄素、硅藻黄素、别藻黄素和虾青素[5]。
双壳类等滤食性海洋无脊椎动物主要摄食硅藻,其主要类胡萝卜素是岩藻黄素,岩藻黄素含有丙二烯基(allenic bond)、羰基、乙酰基和环氧键等几个功能基团。双壳类能将岩藻黄素的丙二烯基转化为炔键、水解环氧键和氧化裂解双氧键[5],也可将多甲藻中甲藻黄素进行生物转化。
虾青素是典型的甲壳动物类胡萝卜素。多数甲壳动物均能将β-胡萝卜素转化为虾青素。转化过程的中间产物依次为海胆酮、3-羟基海胆酮、角黄素和金盏花红素。许多甲壳动物的C3(C3′)羟化作用无空间立体选择性,因此,甲壳动物的虾青素是光学异构体的混合物[5]。
鲤科鱼类可以将玉米黄素经金盏花黄素(adonixanthin)和碘黄质(idoxanthin)转化为3S,3′S-虾青素。以玉米黄素为主要类胡萝卜素的螺旋藻可用来增加红色鲤和金鱼的体色[5]。然而,鲑科鱼类、真鲷、鳕、金枪鱼和鰤等不能将β-胡萝卜素或玉米黄素合成虾青素,这些鱼类中的虾青素完全来自其食物中的甲壳动物。几种海水鱼皮肤和鱼鳍上的亮黄色物质是金枪鱼黄素(tunaxanthin,ε,ε-胡萝卜素-3、3′-醇),由虾青素经玉米黄素转化形成。
2.2 类胡萝卜素在水产动物中的应用
红色水产品深受消费者青睐,改善水产品体色品质进行差异化供给是一个很好的市场策略。水产动物的红色主要由类胡萝卜素在表皮、肌肉等组织中沉积所致(表1)。类胡萝卜素具有良好的抗氧化、抗衰老和抗癌等功能,已成为一种重要的食品添加剂[6]。饲料中添加类胡萝卜素能显著提升甲壳动物的体色,也能刺激水产动物免疫系统,提高抗逆能力,促进生长和性腺发育,显著提高繁殖性能并能抑制性早熟[6]。当前,水产养殖业深受抗生素滥用的困扰,类胡萝卜素能增强免疫和抗逆的功能是解决这一问题的方案之一。类胡萝卜素在水产养殖中已广泛应用,常用的种类主要是β-胡萝卜素和虾青素。在饲料中添加质量分数为50~100 mg/kg的虾青素就具有明显的增色效果,β-胡萝卜素则需要2~4倍的添加量才能获得同等效果[7]。类胡萝卜素主要源自植物和真菌提取,价格较高,限制了其在水产养殖中的应用。开发供应充足、价格实惠的类胡萝卜素源是解决这一问题的有效方法之一。亚马逊流域的毛瑞榈(Mauritia flexuosa)和红木(Bixa orellana)富含类胡萝卜素类,在禽类、金鱼和三文鱼养殖中取得了较好的应用效果。岩藻黄素是自然界中含量最丰富的类胡萝卜素,占到总类胡萝卜素的10%[7],大型藻类富含硅藻黄素。这些材料都是非常具有潜力的类胡萝卜素源。
表1 水产动物的主要类胡萝卜素种类
Tab.1 Major carotenoids in some species of fishery organisms
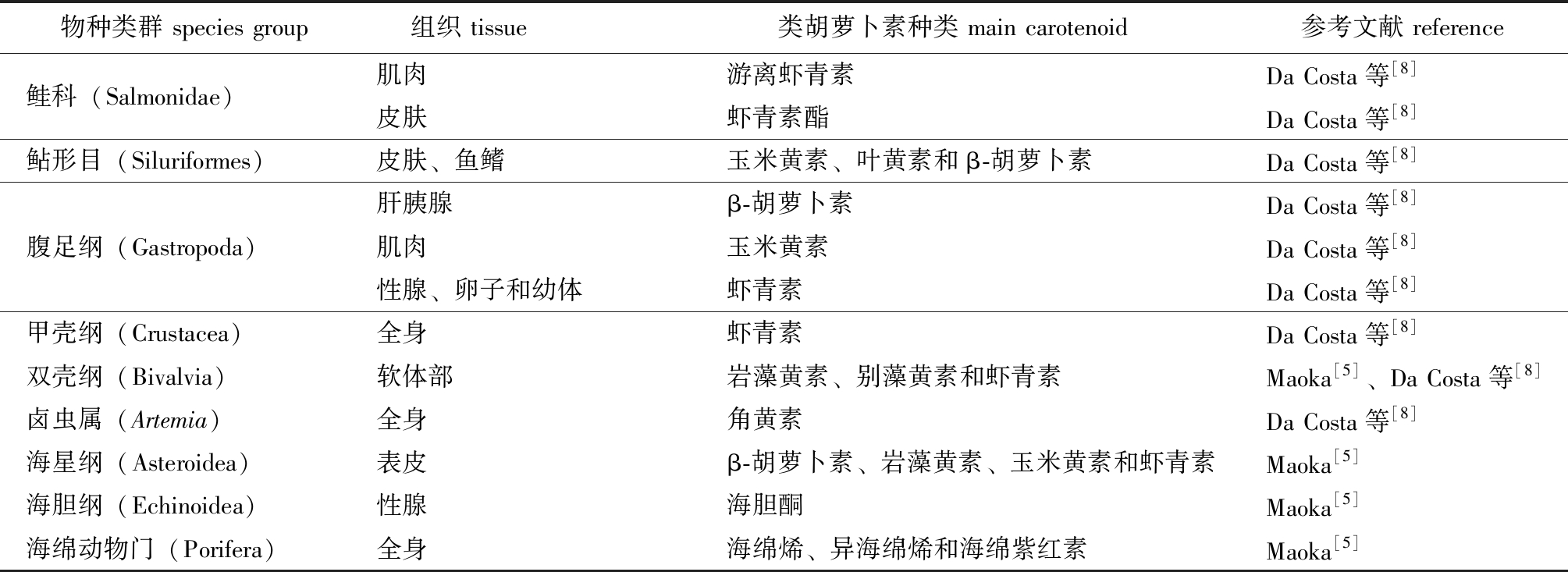
物种类群 species group 组织 tissue 类胡萝卜素种类 main carotenoid 参考文献 reference鲑科(Salmonidae)肌肉游离虾青素Da Costa等[8]皮肤虾青素酯Da Costa等[8]鲇形目(Siluriformes)皮肤、鱼鳍玉米黄素、叶黄素和β-胡萝卜素Da Costa等[8]肝胰腺β-胡萝卜素Da Costa等[8]腹足纲(Gastropoda)肌肉玉米黄素Da Costa等[8]性腺、卵子和幼体虾青素Da Costa等[8]甲壳纲(Crustacea)全身虾青素Da Costa等[8]双壳纲(Bivalvia)软体部岩藻黄素、别藻黄素和虾青素Maoka[5]、Da Costa等[8]卤虫属(Artemia)全身角黄素Da Costa等[8]海星纲(Asteroidea)表皮β-胡萝卜素、岩藻黄素、玉米黄素和虾青素Maoka[5]海胆纲(Echinoidea)性腺海胆酮Maoka[5]海绵动物门(Porifera)全身海绵烯、异海绵烯和海绵紫红素Maoka[5]
3 类胡萝卜素的吸收机制
目前,对哺乳动物类胡萝卜素吸收机制的研究较为深入。虽然水产动物的类胡萝卜素吸收机制报道较少,但类胡萝卜素吸收机制在动物中比较保守,哺乳类的研究结果可作为水产动物的有益参考。哺乳动物类胡萝卜素吸收的主要部位是小肠,在小肠内类胡萝卜素与双亲性、疏水性化合物(如胆盐、胆固醇、脂肪酸、单酰甘油三酯和磷脂等)形成微胶粒,而后通过肠道刷状缘经淋巴系统进入血液。天然类胡萝卜素多以脂肪酸酯的形式存在,经胰羧酸酯脂肪酶分解成游离胡萝卜素醇后被肠道吸收[9]。
3.1 类胡萝卜素吸收的影响因素
类胡萝卜素来源、饲料组分和加工过程均影响对类胡萝卜素的吸收效率。经过萃取和微胶囊处理的类胡萝卜素比原态类胡萝卜素的吸收效率高[9]。饲料中的脂质利于类胡萝卜素形成微胶粒,因而能促进对类胡萝卜素的吸收[9]。晶体状态或与蛋白结合的类胡萝卜素难以进入微胶粒,故比脂滴和生物膜中的类胡萝卜素吸收率低。轻度加热和加工能破坏植物细胞壁、结合蛋白和细胞器,可将类胡萝卜素释放出来利于吸收。维生素C和E能提高胃肠道中类胡萝卜素的稳定性利于其吸收,而纤维、油酸、植物甾醇和甾烷醇酯会降低类胡萝卜素的吸收[9]。但有关水产动物吸收类胡萝卜素的影响因素研究尚未见报道。
3.2 类胡萝卜素的吸收机制及关键分子
早期研究认为,类胡萝卜素的吸收形式是简单扩散,但后来发现其吸收具有选择性和饱和现象[10],易化扩散才是其主要的吸收方式[9]。参与类胡萝卜素吸收的分子见图3。B类清道夫受体(scavenger receptor B1,SR-B1)是类胡萝卜素易化扩散的载体之一,也是最早鉴定的类胡萝卜素跨膜转运载体。敲除SR-B1基因后,小鼠小肠的胡萝卜素和胡萝卜醇的吸收均显著降低[11]。决定簇36(cluster determinant 36,CD36)也被证明是类胡萝卜素的转运载体,参与了肠道上皮细胞类胡萝卜素的跨膜转运[12]。CD36和SR-B1均为跨膜糖蛋白,具有一个较大的胞外功能域。CD36和SR-B1三级结构同源建模表明,贯穿整个分子的大空腔可能是转运脂质的通道[13-14]。这两种蛋白以分子模式而非特异表位识别配体,因此,其配体种类多样。CD36的配体包括类胡萝卜素、长链脂质、脂蛋白、血小板反应素-1、胶原蛋白、凋亡细胞、淀粉样蛋白B和感染疟疾的红细胞[15]。SR-B1能结合高密度脂蛋白(HDLs),并进行胆固醇的跨膜转运[15]。CD36和SR-B1序列保守性较高,在许多水产动物的转录组中也发现了同源基因,但其表达水平在不同体色品系间无显著性差异[16-17]。
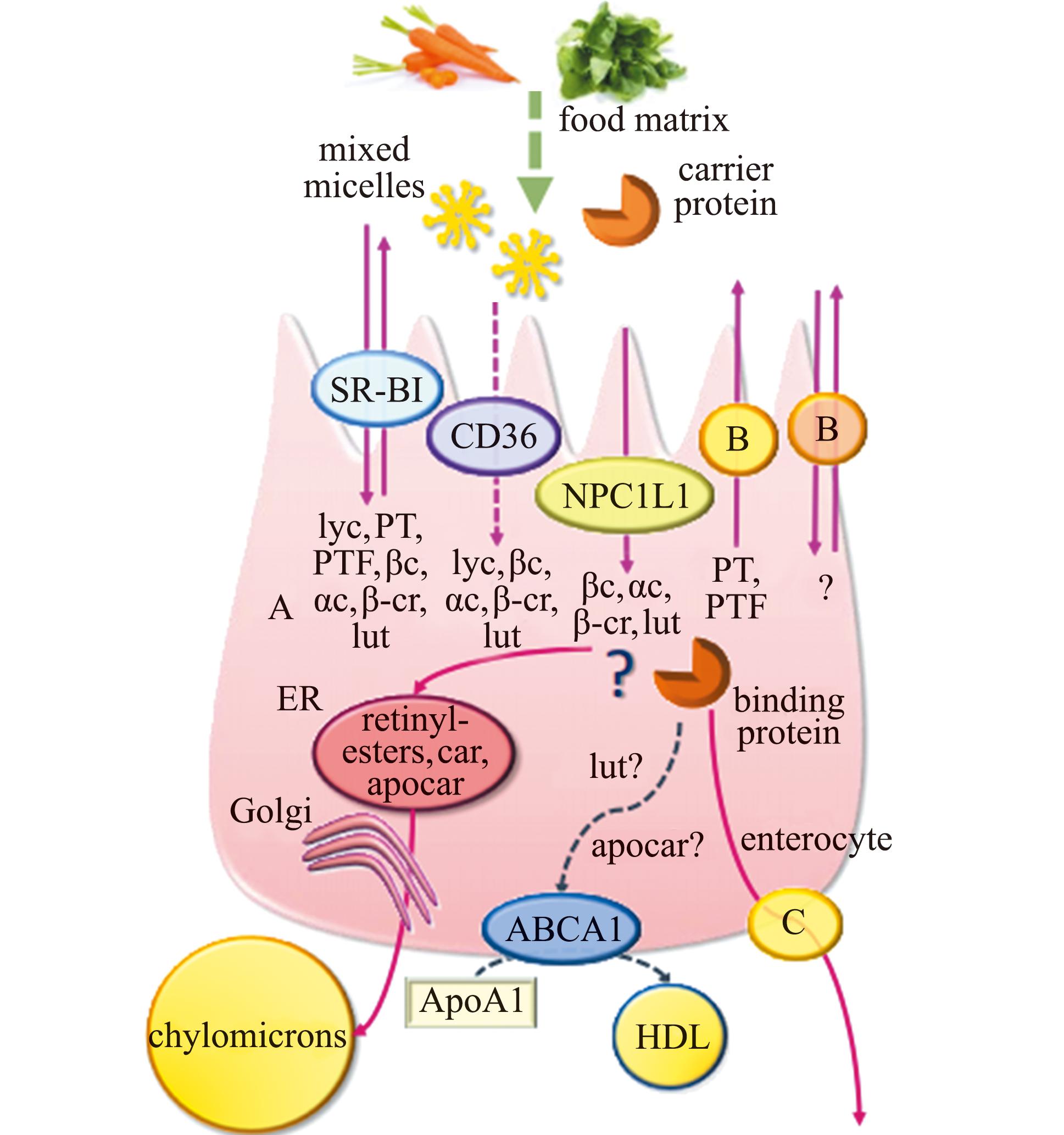
PTF—植物氟烯;lyc—番茄红素;βc—β-胡萝卜素;αc—α-胡萝卜素;β-cr—β-隐黄素;lut—叶黄素;car—类胡萝卜素;apocar—脱辅基类胡萝卜素;A—被动扩散;B—未知游离端转运蛋白;C—未知基底段转运蛋白;?—假定的途径;ER—内质网;HDL—高密度脂蛋白;ApoA1—载脂蛋白A1;SR-BI、CD36和NPC1L1—3种膜转运蛋白。
PTF—phytofluene;lyc—lycopene;βc—β-carotene;αc—α-carotene;β-cr—β-cryptoxanthine;lut—lutein;car—carotenoids;apocar—apocarotenoids;A—passive diffusion;B—unidentified apical transporter;C—unidentified basolateral efflux transporter;?—putative pathway;ER—endoplasmic reticulum;HDL—high density lipoprotein;ApoA1—apolipoprotein A1;SR-BI,CD36,and NPC1L1—three transport proteins.
图3 肠上皮细胞吸收类胡萝卜素示意图[18]
Fig.3 Schematic diagram of carotenoid absorption in an enterocyte[18]
SR-B1转运类胡萝卜素的功能在进化上高度保守。果蝇(Drosophila melanogaster)的同源物ninaD蛋白与复眼色素缺失有关,该蛋白可以跨膜转运玉米黄素和β-胡萝卜素[19]。ninaD基因的非同意突变会导致果蝇缺乏类胡萝卜素、维甲酸和维生素E[19]。家蚕(Bombyx mori)的ninaD是类胡萝卜素在蚕丝中积累的关键因素,突变后会产生白色蚕茧的表型[15]。金丝雀(Serinus canaria)羽毛和皮肤呈色同样需要SR-B1基因,该基因突变失活后产生隐性白色羽毛的表型,且白色突变体血液和组织的类胡萝卜素水平极低,机体严重缺乏维生素A[20]。
ATP盒式转运蛋白(ATP cassette transporter protein,ABC)也参与了类胡萝卜素的跨膜转运[21]。家鸡(Gallus gallus)ABC蛋白家族的ABCG5/G8参与了叶黄素的转运,且进入肠上皮细胞的类胡萝卜素可被ABCA1重新转运到肠道中[21]。ABCG5突变会影响血液循环中叶黄素和胆固醇含量[21]。中华锯齿米虾(Neocaridina denticulata sinensis)不同体色品系间ABCG和ABCB家族的数个基因存在显著性差异[16-17,22],且RNA干扰ABCG2基因后,米虾复眼色素细胞、体表色素细胞数量及色素颗粒分布均发生显著性变化[23]。此外,ABCG2的SNP位点与米虾体色、类胡萝卜素含量存在关联[22]。ABC跨膜转运类胡萝卜素为主动转运,这表明机体可主动控制细胞内类胡萝卜素的含量。
4 类胡萝卜素在肠上皮细胞中的代谢
4.1 类胡萝卜素的降解
肠上皮细胞可以将β-胡萝卜素转化为维生素A[9],该反应的催化酶称为类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenase,CCD)。CCD有两类,首先鉴定发现的是可以分解C15,C15′双键的BCO1(β-胡萝卜素加氧酶1)[24],后又发现了裂解C9′,C10′双键的BCO2[25]。BCO可将氧分子中的两个氧原子都加入产物中,但催化中的关键步骤目前仍不清楚[9]。重组的BCO1还可将开环番茄红素催化为非环类视黄醇,在维生素A严重缺乏时可维持维甲酸信号通路的正常功能[26]。BCO2的底物种类繁多,除β-胡萝卜素外,还有开环番茄红素、玉米黄素、叶黄素和角黄素[9]。BCO2的底物具有种属特异性,鼠和人的BCO2可将脱辅基类胡萝卜素转为二羰基化合物,但是鸡的BCO2则不能催化该反应[9]。BCO1和BCO2主要在肠道表达[27]。BCO1是一个单体、可溶性的胞质酶,可与细胞质中生物膜、脂滴和蛋白相互作用,从而获取底物[27];而BCO2位于线粒体内膜上,依赖信号肽定位于线粒体内膜[28]。对鼠BCO1和BCO2的功能缺失研究表明,BCO1主要产生维生素A,BCO2功能缺失导致肝脏线粒体内膜上胡萝卜醇积累[29]。BCO1或BCO2功能缺失均会导致动物肝脏和脂肪等组织中积累大量的类胡萝卜素[30]。
BCO1和BCO2的功能在进化中是高度保守的。通常认为,类胡萝卜素积累对机体有诸多益处,BCO1能够供给机体维生素A,而BCO2的功能则一直不明。BCO2功能缺失与氧化应激存在关联[9],会导致机体组织处于氧化应激状态,并降低线粒体呼吸率[31]。在脊椎动物胚胎发育中,BCO2能防止类胡萝卜素的毒性[32]。水产动物BCO基因与体色关系密切,通常浅色体色的个体具有较高的BCO表达量,如白色闭壳肌的虾夷扇贝(Patinopecten yessoensis)BCO-like 1表达水平显著高于橙色个体[33]。在脊尾白虾(Exopalaemon carinicauda)中敲除BCO基因会加深肝胰腺的颜色[34-35]。遗传分析表明,BCO与虾夷扇贝[33]和马氏珍珠贝(Pinctada fucata martensii)[36]体色性状关联。
在肠上皮细胞内,BCO1产生的视黄醛大部分被还原为视黄醇,经视黄醇结合蛋白2转运到内质网上形成视黄酯,此为视黄醇的主要形式[37]。维甲酸(维生素A酸)是类激素物质,含量极少,可激活维甲酸受体(RAR)并对细胞产生深远的影响[38]。RAR与维甲酸X受体(RXR)形成的聚合物结合到一些保守DNA基序(维甲酸响应元件)上来控制转录。人类基因组大约有500个维甲酸的靶基因[39]。哺乳类通过细胞色素P450依赖的羟化酶来严格调控组织的维甲酸含量[40]。
视黄醇也可转化为视黄醛,主要由胞质乙醇脱氢酶(ADH)和微粒体上的视黄醇脱氢酶(RDH)催化完成[41],NAD(H)和NADP(H)是这两种酶的辅因子,该反应是可逆的,方向取决于辅因子的氧化状态。在生理条件下,胞质中的NAD/NADH值为700,而NADP/NADPH值为0.005,这两类酶以NAD作为氧化剂氧化视黄醇,以NADPH作为还原剂还原视黄醛。RDH1和RDH10是类视黄醇代谢的主要酶,在维持成体类视黄醇稳态中具有重要作用[42]。DHRS3是一个关键的视黄醛还原酶,其蛋白表达水平受维甲酸信号通路控制,在维持胚胎和新生儿维甲酸水平中具有重要作用[9]。
视黄醇酯化利于肠上皮细胞类视黄醇稳态维持[9]。有两类酶可以催化形成视黄酯,分别为卵磷脂视黄醇乙酰基转移酶(LRAT)和乙酰辅酶A视黄醇乙酰基转移酶(ARAT)。脊椎动物的LRAT已经被克隆,相对分子质量为25 000,通过C端的单跨膜螺旋锚定在内质网上。LRAT属于古老的NlpC/P60巯基肽酶蛋白超家族,该家族在人类基因组中有7个基因成员,其结构类似木瓜蛋白酶。虽然ARAT尚未被克隆鉴定,但LRAT缺陷鼠与野生型相比维生素A吸收仅下降了10%,且仍然能够形成视黄酯,表明ARAT真实存在[9]。
4.2 类胡萝卜素氧化
许多水产动物具有将类胡萝卜素氧化的修饰能力,在组织沉积后使之呈现黄色、橙色和红色[43]。参与氧化的酶称为酮酶(ketolase),能够在末端环上添加羟基和酮基,主要在肝脏细胞中表达[20]。多数情况下,体色表型由类胡萝卜素氧化决定,其氧化代谢的遗传研究备受关注[2]。类胡萝卜素酮化速度快,且中间产物与酶结合在一起,故难以检测。推测可能存在3种酮化过程。
第一种方式是在β-紫罗兰酮环的C4位置发生两次羟化反应,消耗两分子NADH和两分子O2。第二轮羟化反应形成的乙二醇会自动脱水在C4形成酮基,且已在P450催化过程中得到了证明[2]。该酮化方式应存在C4发生一次羟化的中间产物,但尚未见报道。在金丝雀中发现的一种C4羟基化的类胡萝卜素——异虾青素(4,4′-双羟基-ε、ε-类胡萝卜素-3、3′-二酮)是上述中间产物结构最类似的物质[2]。异虾青素是由金丝雀叶黄素B(canary xanthophyll B)在C4位置羟基化而来。虾青素和异虾青素是等电位的,可在酶的作用下相互转化。这虽能证明C4可羟基化,但C4是否发生两次羟基化仍难确定。
第二种方式是在β-紫罗兰酮环C3和C4位置去饱和。羟基化与去饱和的催化机制类似,很多羟化酶同时具有这两种功能[2]。氧活化铁中心的轻微移动就可实现羟基化向去饱和的改变。去饱和终产物为酮-醇异构体,会自发地转化为酮。尽管C3—C4去饱和的中间产物尚未被发现,但由于羟基化和去饱和反应的催化机制是保守的,去饱和催化仍是一种需要关注的催化方式。
第三种方式是羟基化后进行脱氢反应,将C4羟基转化为酮基[2]。羟基脱氢是细胞内一种常见的反应。目前,尚未发现C4发生一次羟化的中间产物,羟基化酶和脱氢酶在空间上应该非常接近,很有可能是一个酶复合体,甚至会融合成一个酶。由于缺少中间产物的证据,虽然有很多人反对存在这种酮化方式的假说,但羟化酶和脱氢酶之间的耦联程度和性质是这种酮化方式最有力的证据。
5 动物类胡萝卜素酮化的催化酶
5.1 类胡萝卜素酮化酶
类胡萝卜素酮化酶能够在末端环C4位置添加酮基,虽然催化反应单一,但是酮化酶种类繁多。目前,已知的类胡萝卜素酮化酶一共有6类,分别为CrtW、CrtO、CrtS、CYP2J19、CYP3A80和CYP384A1[2]。海洋细菌的CrtW、微藻CrtO及鸟与龟的CYP2J19等3类酶具有专一的酮化酶活性,直接在β-紫罗兰酮环C4位置添加一个酮基[2]。CrtW和CrtO是膜脂肪酸去饱和酶超家族成员,具有一个较大的疏水区,至少跨膜两次,有3个保守组氨酸基序,共含有8个组氨酸残基。该家族成员含有铁离子但不含血红素,组氨酸残基作为铁离子的配体是催化的必需残基[2]。
合成3-羟基,4-酮基类胡萝卜素(如金盏花红素、虾青素和3-羟基海胆酮)时需要羟化酶和酮化酶共同作用,分别在C3羟基化和C4酮基化[2]。红酵母的CrtS、叶螨的CYP384A1和两栖类的CYP3A80都属于CYP3A家族,具有类胡萝卜素C4-酮化酶/C3-羟化酶的活性,可以单独催化形成3-羟基,4-酮基类胡萝卜素。红酵母CrtS先在C4位置进行双羟基化,再在C3位置进行一次羟基化,合成3-羟基,4-酮基类胡萝卜素;某些情况下产生缺少羟基的4-酮基类胡萝卜素(如海胆酮和角黄素)[44]。红酵母、叶螨和西拉毒蛙(Ranitomeya sirensis)中的酮化类胡萝卜素谱一致,这表明CYP3A的酮化/羟化的双重功能是保守的[2]。
鸟类的CYP2J19是动物中第一个被鉴定出来的类胡萝卜素酮化酶,可将食物来源的黄色类胡萝卜素氧化为红色类胡萝卜素。CYP2J19位点与金丝雀的黄、红羽毛表型关联,与斑胸草雀(Poephila guttata)的黄、红喙表型也关联[45]。龟类具有CYP2J19的直系同源物,但是鳄和蜥蜴基因组中未发现直系同源物[44]。西部锦龟(Chrysemys picta bellii)(表皮具有红色/橙色斑点)的CYP2J19主要在红色表皮和视网膜中表达[44]。鸟类和龟类在2.5亿年前就已分化,可能独立进行了CYP2J19的进化,该基因可使羽毛或甲片中呈现红色[46]。对CYP2J19的进化分析表明,参与类胡萝卜素转运和代谢的基因具有共同的祖先分子,在进化中保守[46]。基因或基因组复制可能赋予了某些分子专一进行类胡萝卜素代谢的能力。
CYP2J19是羊膜动物通过基因复制进化而来的基因[44]。两栖类虽然无CYP2J19基因,但另外一种P450 CYP3A80进化出了类胡萝卜素的酮化能力[43]。西拉毒蛙CYP3A80的底物结合位点与β-胡萝卜素具有非常好的适配度,且在红色个体和黄色个体中该基因表达量存在显著性差异[43]。红酵母和叶螨的CYP3A也具有类胡萝卜素酮化酶的功能[2],哺乳类的CYP3A则在视黄酸和视黄酰酚胺(视黄酸的衍生物)β-紫罗兰酮环的C4位置引入酮基团[47]。目前,有关水产动物酮化酶的研究报道较少,在桡足类中根据类胡萝卜素代谢谱的提示,利用在转录组寻找高表达同源序列的方法,发现了几个P450羟化酶,可能是潜在类胡萝卜素酮化酶[48]。
5.2 线粒体内膜泛醌合成酶
经RNA测序、定量PCR和原位杂交等试验表明,CYP2J19和CYP3A80存在于肝细胞线粒体内膜,且内膜富集有高浓度的红色类胡萝卜素,这表明线粒体尤其是线粒体内膜负责进行类胡萝卜素氧化[2]。基于此,Hill等[49]提出了线粒体内膜氧化类胡萝卜素的假说。由于酮化类胡萝卜素和泛醌分子结构上的高度类似,该假说认为类胡萝卜素的氧化与泛醌的生物合成共用了相同的催化机制和酶系。
泛醌(Ubiquinone,UQ),又称辅酶Q(CoQn),是有氧呼吸的电子和质子运输载体,将两者从线粒体基质运输到线粒体膜间隙。UQ由一个多氧芳香平面环和10个类异戊二烯单位的多烯链组成。UQ的芳香环来自酪氨酸和苯丙氨酸,类异戊二烯由乙酰Co-A来源的异戊二烯聚合而成[50]。从头合成类胡萝卜素的生物也通过乙酰Co-A合成多烯链,与UQ的合成途径相同[50]。但UQ高度脂溶性的特性导致其无法从食物中获得,因此,动物机体必须自身合成[50]。
Cotingin是从庞帕杜伞鸟(Xipholena punicea)羽毛中分离而来的类胡萝卜素。与虾青素同为仅有的两种最高氧化形态的类胡萝卜素,这两种类胡萝卜素端环C6-C5-C4-C3结构与UQ非常类似[47](图4)。UQ端环的这些位置是其与合成酶的结合位点,故虾青素可与UQ合成酶发生相互作用。许多细菌的类胡萝卜素羟化酶CrtD与UQ生物合成的羟化酶Coq6同源,这表明类胡萝卜素和UQ具有相似的分子构象[47]。
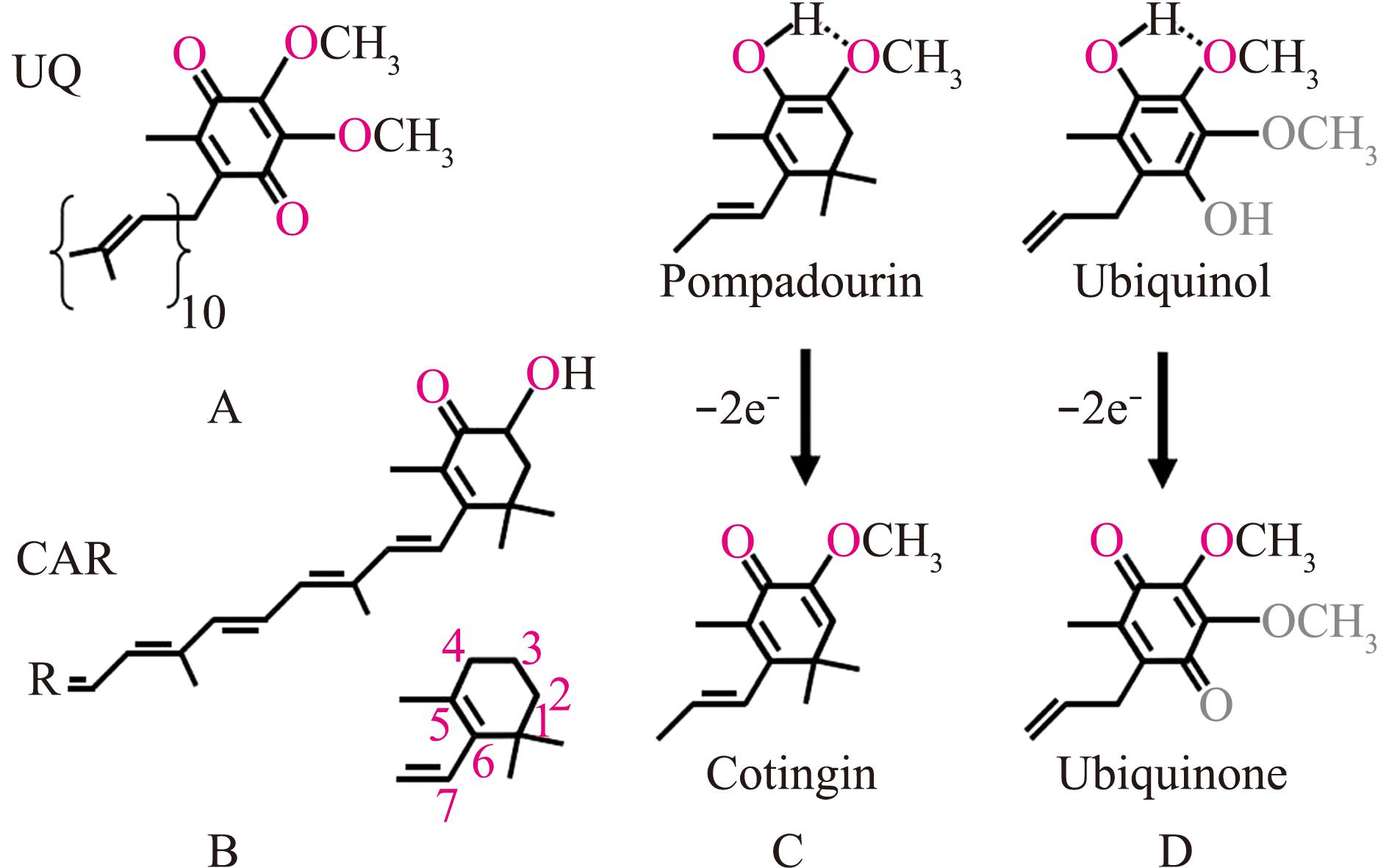
泛醌(A)的端环为对称结构,其甲基基团能够决定泛醌氧化还原复合体与泛醌结合的构象。胡萝卜素酮醇(B)与胡萝卜素相比多一个酮基和羟基。类胡萝卜素Pompadourin氧化为Cotingin的过程(C)与泛醇氧化为泛醌的过程(D)极为相似。
UQ (A)has mirror symmetry across the end ring with the exception of the methyl group,which determines the binding configuration of this pigment with UQ redox complexes.The stereochemistry of the methyl group is maintained in carotenoids (B).The process of oxidation of pompadourin to cotingin (C)is very similar to the process of oxidation of panthenol to ubiquinone (D).
图4 泛醌和泛醇与类胡萝卜素端环的结构比较[47]
Fig.4 Structural comparison of quinone and panthenol with carotenoid terminal rings[47]
参与UQ端环羟化的酶共有Coq6、Coq7和Coq?(未知的羟化酶)3种羟化酶。Coq7在C5催化,说明其不是类胡萝卜素羟基化酶。Coq6和Coq?的催化位置在C4,说明这两种酶可能参与了类胡萝卜素的羟化。苯基芳香羟化酶有多种起源,分属不同的酶家族,包括P450家族和膜脂肪酸去饱和酶家族,这两个酶家族都通过去除氢原子进行芳香环羟基化。
C4酮化物可能与线粒体膜发生相互作用或经脂质转运体从线粒体中逸出[47]。离开线粒体的类胡萝卜素进入分泌系统,并进行脂化或进入新生成的VLDL颗粒。电子传递链中复合体Ⅰ和复合体Ⅲ之间存在UQ的底物通道。因此,虾青素转变为Pompadourin后可以被转运出线粒体内膜,或者沿着UQH2的通道转移至复合体Ⅲ的Q0结合位点[47]。
目前,除CYP2J19和CYP3A80外,其他参与类胡萝卜素代谢的基因鲜有报道。但众多类胡萝卜素呈色的动物为基因鉴定提供了便利。高通量基因组测序可比较不同种属或不同体色表型个体间的QTL(quantitative trait loci,数量性状座位),以此来定位体色表型的基因座位;或通过比较同一个体不同颜色表皮的转录组来筛选候选基因[2]。
6 参与类胡萝卜素运输及沉积的主要蛋白
在哺乳动物中,类胡萝卜素进入乳糜颗粒后经循环系统运输到肝脏等各组织器官,肝脏将吸收的类胡萝卜素组装到脂蛋白后分泌到血液中。不同类胡萝卜素在极低密度脂蛋白(VLDL)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)间的分布不均匀。疏水性胡萝卜素主要分布在LDL,而亲水性胡萝卜醇更容易与HDL结合。外周组织细胞通过SR-B1从HDL中获取玉米黄素和叶黄素,通过LDL受体介导的内吞作用从LDL中获取β-胡萝卜素[51]。不同组织中类胡萝卜素种类和数量差别巨大。谷胱甘肽-S-转移酶P1(GSTP1)是已知结合玉米黄素和叶黄素的蛋白[51]。
上述几种蛋白与类胡萝卜素结合专一性不高且无定量关系。但在一些物种中存在与类胡萝卜素特异结合且具定量关系的蛋白,称为胡萝卜素蛋白(caroteno protein)。由于胡萝卜素蛋白与类胡萝卜素在构象上互补,通过次级键相互作用,常导致类胡萝卜素吸收光谱发生改变。与胡萝卜素蛋白结合的典型类胡萝卜素种类是双酮类胡萝卜素,胡萝卜素蛋白能够在细胞和机体内转运和沉积类胡萝卜素。
6.1 甲壳蓝蛋白
甲壳蓝蛋白是被研究最透彻的胡萝卜素蛋白,最初从龙虾外壳中分离获得。该蛋白能结合虾青素,最大光吸收峰为630 nm,呈蓝色,在有机溶剂中甲壳蓝蛋白与虾青素分离。重组表达的甲壳蓝蛋白能够结合虾青素,且所有性质与天然甲壳蓝蛋白相同,为解析其结合机制提供了便利。
甲壳蓝蛋白的天然形式是α-甲壳蓝蛋白,相对分子质量为320 000,为水溶性蛋白,可结合16个虾青素分子。在低离子强度下,α-甲壳蓝蛋白会解离成相对分子质量为40 000的异二聚体,称为β-甲壳蓝蛋白。组成β-甲壳蓝蛋白的亚基共有5种:A1、C1和C2亚基的相对分子质量为21 000;A2和A3亚基的相对分子质量为19 000。但编码基因仅有两种,分别为CRCN-C和CRCN-A,5种亚基是由翻译后裂解所致[52]。CRCN-C和CRCN-A编码蛋白序列与载脂蛋白家族高度保守,具有该家族结合疏水性配体的β-桶形结构[52]。
β-甲壳蓝蛋白结合两个虾青素分子。两个虾青素分子部分重叠,其发光团相互作用引起的激子耦合聚集效应是光谱偏移的主要因素[52]。虾青素端环非常接近蛋白亚基的组氨酸,形成氢键具有电子极化效应,端环与多烯链共平面扩展了发光团的共轭效应,这两者也会导致光谱偏移[52]。目前,尚无α-甲壳蓝蛋白晶体高分辨率衍射结构。
6.2 Asteriarubin蛋白
Asteriarubin是一种从多棘海盘车(Asterias rubens)分离的虾青素结合蛋白,相对分子质量为43 000,有4个亚基,结合虾青素时的最大吸收峰是555~570 nm,呈紫色[53]。该蛋白结合的类胡萝卜素主要是虾青素和虾青素乙酰化类似物(7,8-去氢虾青素和7,8,7′,8′-四氢叶酸),其氨基酸序列与甲壳蓝蛋白无同源性,与数据库中其他序列也无相似性。Asteriarubin蛋白只含有一个类胡萝卜素分子,无发光团间的聚集效应[53]。分子聚集和发光团间的相互作用不是该蛋白发生吸收光谱偏移的原因。
6.3 Linckiacyanin蛋白
Linckiacyanin是一种从蓝指海星(Linckia laevigata)分离得到的蓝色类胡萝卜素结合蛋白,具有两个吸收峰,分别为395、612 nm[54]。该蛋白结合的类胡萝卜素主要是虾青素(3S,3′S 异构体),也含有玉米黄素和羟基枝晶黄素(hydroxyclathriaxanthin)。前体蛋白亚基较小,相对分子质量只有6 000,自然状态的Linckiacyanin蛋白较大,相对分子质量超过1 000 000,具有复杂的四级结构,至少含有200个类胡萝卜素分子。圆二色谱结果表明,类胡萝卜素分子的发光团间有非常强的激子相互作用,是该种蛋白发生光谱偏移的主要原因。
6.4 虾卵绿蛋白(Ovoverdin)
虾卵绿蛋白是一种分布在龙虾卵巢和卵子中的虾青素结合蛋白(脂卵黄蛋白)。该蛋白在可见光范围内的吸收峰为460 nm和640 nm,可能是该蛋白分子内虾青素在两种不同的微环境中所致。460 nm吸收峰由脂蛋白脂质产生,无定量关系,而640 nm吸收峰为虾青素与蛋白质结合产生[55]。
7 存在问题及展望
目前,水产动物类胡萝卜素吸收、转化和沉积机制研究尚处于模仿模式动物机制阶段,研究内容大多为克隆和鉴定模式动物的同源基因,鲜有系统的机制阐述和功能基因验证,极少有新基因报道,研究创新性不足。水产动物类胡萝卜素吸收、转化和沉积机制需要采用新方法突破水生环境对研究的限制,充分利用水产动物具有丰富体色突变体的特点开展研究。
7.1 基于基因-表型关联分析研究胡萝卜素的吸收、代谢机制
类胡萝卜素吸收保守性较强,基于同源分子的序列保守性,大部分水产动物的同源分子序列都已获得,基本有mRNA表达的数据。水产动物摄入类胡萝卜素的种类和数量受环境影响较大,且难以有效控制;吸收类胡萝卜素的分子功能鉴定较困难,基因与类胡萝卜素吸收种类和数量之间的因果关系几乎无法建立。哺乳类的全基因组关联研究(GWAS)和候选基因关联研究已确定SR-B1和CD36的SNP位点与类胡萝卜素血液浓度间的相关性。笔者也发现,ABCG2的SNP位点与米虾体色、类胡萝卜素含量存在关联。这些研究提示,基因与表型关联分析是研究水产动物类胡萝卜素吸收、代谢机制的有效途径,而且可为富含类胡萝卜素的良种选育提供遗传数据。
7.2 基于多组学联合技术筛选鉴定新的酮化酶基因
在类胡萝卜素吸收、代谢和沉积的研究中,筛选和验证类胡萝卜素转化基因的难度最大。类胡萝卜素转化的中间产物含量低、测定难是主要的限制因素,因此,能鉴定出来的类胡萝卜素转化酶数量较少,主要集中在裂解酶BCO1和BCO2上。目前,水产动物基因敲除手段已初步开始应用,为关键基因的验证提供了一个新选择,也是分析因果关系的一个有效手段。经典方法是根据类胡萝卜素种类和数量推断催化机制来确定酮化酶种类,该方法能够发现新的酮化酶,但工作量巨大且催化中间产物难以测定,较少在水产动物中开展。酮化酶的催化机制是保守的,其催化功能域在序列上也具有保守性,水产动物酮化酶的获得主要通过序列同源比对来实现,随着代谢组、转录组技术的进步,三者数据的结合为发现水产动物新的酮化酶提供了便利。
7.3 基于单细胞转录组技术解析类胡萝卜素的沉积过程
类胡萝卜素只有与CBP(carotenoid-binding protein)结合后才能在细胞或组织中大量沉积。许多水产动物的CBP能够改变类胡萝卜素的吸收波峰,产生非常多样的颜色,这为CBP的分离纯化提供了便利。蛋白分离纯化是获得CBP的主要途径,但由于工作量大、效率低下,目前,在水产动物中还缺少这方面的研究。
水产动物色素细胞种类多样,大多数色素细胞只含有一类色素,其色素体结构形态与色素种类密切相关。大多数红色素和黄色素细胞都含有类胡萝卜素,色素细胞的色素体是类胡萝卜素沉积的主要靶点,也是发现新CBP的主要研究对象。目前,对脊椎动物黑色体的形成过程已研究得较为清楚,而对其他色素体的研究尚处于空白,这极大地限制了对类胡萝卜素沉积过程的研究。近期兴起的单细胞转录组和空间转录组技术有望能为研究色素体的发生过程和蛋白组成提供解决方案。单细胞转录能检测单个色素细胞的转录子,高效鉴别不同种类的CBP和类胡萝卜素转化酶,获得造成色素细胞色素差异的关键基因;同时,比较不同发生阶段色素细胞的单细胞转录组能够解析色素体发生的过程。这两个方面都能极大地促进类胡萝卜素沉积过程的研究。由于大部分色素细胞直径大于40 μm,超过了单细胞转录组测序的要求,在进行测序细胞制备时可采用药物或激素方法使色素细胞聚集收缩,以满足测序组的要求。单细胞测序平台本身可通过提取细胞核的手段解决大细胞测序困境。色素细胞较大的体积在进行空间转录组测序时则成为一个有利条件,较大细胞能承载更多的测序位点,RNA区分度增加,利于RNA的组织定位。空间转录组和单细胞转录组数据能够相互验证,这两种方法是解析色素合成和沉积的有力工具。
7.4 筛选和构建水产动物体色遗传材料
比较不同体色水产动物转录组或比较表皮有色部分和无色部分转录组,会获得大量差异基因,而多数差异基因与色素吸收、转运和代谢无直接关系,反而与细胞外基质、微丝微管、色素颗粒移动、脂质与糖代谢、蛋白折叠和降解等具有紧密关系。这表明天然体色突变体材料遗传背景相对复杂,需要在构建纯系和杂交家系等材料的基础上进行遗传分析以确定体色性状的遗传基础,这样才能发现关键差异基因。虾夷扇贝闭壳肌颜色性状的QTL定位就是一个成功的例子,其体色表型容易识别且具有较高的遗传相关性,容易构建纯系和杂交家系等遗传材料。因此,构建遗传材料对于解析各种体色变异及体色形成机制具有重要意义。
水产动物大多能繁殖大量后代,具有较高的突变率,因此,天然存在大量的突变体。但目前灵活高效且成本较低的基因分型手段缺乏,限制了水产动物体色突变体的遗传筛查。GT-Seq(Genotyping-in-thousands by sequencing)是一种靶向基因重测序技术,其原理是在利用PCR靶向扩增目的DNA片段的同时,添加能够标识个体信息的Barcode,再利用二代测序高通量的特点实现SNP或SSR的高通量低成本分型。因其检测位点可以自主设计和自由组合,故较适合进行水产动物体色候选基因的分型。在用GT-Seq对大量水产动物突变体进行基因分型基础上,快速建立体色纯系,非常利于体色关键基因的鉴定。
动物类胡萝卜素吸收、转运和代谢的基本规律在不同类群间保守性较高,高通量测序数据提供了大量的候选基因。筛选和鉴定具体体色突变体形成的关键基因是未来研究的重点和难点,单细胞测序、突变体的遗传筛选和体色遗传材料的构建是解决这一问题的重要途径。总之,众多关键基因的解析必将丰富和完善动物类胡萝卜素的利用机制,加深对动物体色在生理、生态、遗传和进化等方面的认识。
[1] WEAVER R J,SANTOS E S A,TUCKER A M,et al.Carotenoid metabolism strengthens the link between feather coloration and individual quality[J].Nature Communications,2018,9(1):73.
[2] TOEWS D P L,HOFMEISTER N R,TAYLOR S A.The evolution and genetics of carotenoid processing in animals[J].Trends in Genetics,2017,33(3):171-182.
[3] BRITTON G,LIAAEN-JENSEN S,PFANDER H.Carotenoids: handbook[M].Basel,Switzerland:Springer Science &Business Media,2004.
[4] NAKANO T,WIEGERTJES G.Properties of carotenoids in fish fitness:a review[J].Marine Drugs,2020,18(11):568.
[5] MAOKA T.Carotenoids in marine animals[J].Marine Drugs,2011,9(2):278-293.
[6] YANG Y,KIM B,LEE J Y.Astaxanthin structure,metabolism,and health benefits[J].Journal of Human Nutrition &Food Scienc,2013,1(1003).
[7] NIU J,TIAN L X,LIN H Z,et al.Carotenoids in aquaculture:an overview[J].Journal of Animal Science and Biotechnology,2011,2(1):44-58.
[8] DA COSTA D P,MIRANDA-FILHO K C.The use of carotenoid pigments as food additives for aquatic organisms and their functional roles[J].Review in Aquaculture,2020,12(3):1567-1578.
[9] VON LINTIG J,MOON J,LEE J,et al.Carotenoid metabolism at the intestinal barrier[J].Biochimica et Biophysica Acta (BBA)—Molecular and Cell Biology of Lipids,2020,1865(11):158580.
[10] WIDJAJA-ADHI M A K,LOBO G P,GOLCZAK M,et al.A genetic dissection of intestinal fat-soluble vitamin and carotenoid absorption[J].Human Molecular Genetics,2015,24(11):3206-3219.
[11] SHYAM R,VACHALI P,GORUSUPUDI A,et al.All three human scavenger receptor class B proteins can bind and transport all three macular xanthophyll carotenoids[J].Archives of Biochemistry and Biophysics,2017,634:21-28.
[12] ACTON S,RIGOTTI A,LANDSCHULZ K T,et al.Identification of scavenger receptor SR-BI as a high density lipoprotein receptor[J].Science,1996,271(5248):518-520.
[13] RODRIGUEZA W V,THUAHNAI S T,TEMEL R E,et al.Mechanism of scavenger receptor class B type I-mediated selective uptake of cholesteryl esters from high density lipoprotein to adrenal cells[J].The Journal of Biological Chemistry,1999,274(29):20344-20350.
[14] YU M,LAU T Y,CARR S A,et al.Contributions of a disulfide bond and a reduced cysteine side chain to the intrinsic activity of the high-density lipoprotein receptor SR-BI[J].Biochemistry,2012,51(50):10044-10055.
[15] SAKUDOH T,KUWAZAKI S,IIZUKA T,et al.CD36 homolog divergence is responsible for the selectivity of carotenoid species migration to the silk gland of the silkworm Bombyx mori[J].Journal of Lipid Research,2013,54(2):482-495.
[16] HUANG Y Y,ZHANG L L,WANG G D,et al.De novo assembly transcriptome analysis reveals the genes associated with body color formation in the freshwater ornamental shrimps Neocaridina denticulate sinensis[J].Gene,2022,806:145929.
[17] LIN S,ZHANG L L,WANG G D,et al.Searching and identifying pigmentation genes from Neocaridina denticulate sinensis via comparison of transcriptome in different color strains[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2022,42:100977.
[18] REBOUL E.Mechanisms of carotenoid intestinal absorption:where do we stand?[J].Nutrients,2019,11(4):838.
[19] KIEFER C,SUMSER E,WERNET M F,et al.A class B scavenger receptor mediates the cellular uptake of carotenoids in Drosophila[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(16):10581-10586.
[20] TOOMEY M B,LOPES R ![]() P M,et al.High-density lipoprotein receptor SCARB1 is required for carotenoid coloration in birds[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(20):5219-5224.
P M,et al.High-density lipoprotein receptor SCARB1 is required for carotenoid coloration in birds[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(20):5219-5224.
[21] HILL G E,JOHNSON J D.The vitamin A-redox hypothesis:a biochemical basis for honest signaling via carotenoid pigmentation[J].The American Naturalist,2012,180(5):E127-E150.
[22] 林师.中华锯齿米虾色素沉积相关基因的发掘与证明[D].厦门:集美大学,2017.
LIN S.Searching and identifying pigmentation genes from Neocaridina denticulata sinensis[D].Xiamen:Jimei University,2017.(in Chinese)
[23] LU X Q,ZHANG L L,WANG G D,et al.Functional analysis of ABCG2 gene in pigment transport of Neocaridina denticulata sinensis[J].Gene,2022,844:146810.
[24] DELA SE A C,NARAYANASAMY S,RIEDL K M,et al.Substrate specificity of purified recombinant human β-carotene 15,15′-oxygenase (BCO1)[J].The Journal of Biological Chemistry,2013,288(52):37094-37103.
A C,NARAYANASAMY S,RIEDL K M,et al.Substrate specificity of purified recombinant human β-carotene 15,15′-oxygenase (BCO1)[J].The Journal of Biological Chemistry,2013,288(52):37094-37103.
[25] DELA SE A C,SUN J,NARAYANASAMY S,et al.Substrate specificity of purified recombinant chicken β-carotene 9′,10′-oxygenase (BCO2)[J].The Journal of Biological Chemistry,2016,291(28):14609-14619.
A C,SUN J,NARAYANASAMY S,et al.Substrate specificity of purified recombinant chicken β-carotene 9′,10′-oxygenase (BCO2)[J].The Journal of Biological Chemistry,2016,291(28):14609-14619.
[26] KELLY M E,RAMKUMAR S,SUN W Z,et al.The biochemical basis of vitamin A production from the asymmetric carotenoid β-cryptoxanthin[J].ACS Chemical Biology,2018,13(8):2121-2129.
[27] AMENGUAL J,WIDJAJA-ADHI M A K,RODRIGUEZ-SANTIAGO S,et al.Two carotenoid oxygenases contribute to mammalian provitamin A metabolism[J].The Journal of Biological Chemistry,2013,288(47):34081-34096.
[28] RAGHUVANSHI S,REED V,BLANER W S,et al.Cellular localization of β-carotene 15,15′ oxygenase-1 (BCO1) and β-carotene 9′,10′ oxygenase-2 (BCO2) in rat liver and intestine[J].Archives of Biochemistry and Biophysics,2015,572:19-27.
[29] WU L,GUO X,LYU Y,et al.Targeted metabolomics reveals abnormal hepatic energy metabolism by depletion of β-carotene oxygenase 2 in mice[J].Scientific Reports,2017,7(1):14624.
[30] GUO X,WU L,LYU Y,et al.Ablation of β,β-carotene-9′,10′-oxygenase 2 remodels the hypothalamic metabolome leading to metabolic disorders in mice[J].The Journal of Nutritional Biochemistry,2017,46:74-82.
[31] PALCZEWSKI G,WIDJAJA-ADHI M A,AMENGUAL J,et al.Genetic dissection in a mousemodel reveals interactions between carotenoids and lipid metabolism[J].Journal of Lipid Research,2016,57(9):1684-1695.
[32] ASSON-BATRES M A,ROCHETTE-EGLY C.Biochemistry of retinoid signaling II[M].Berlin/Heidelberg,Germany:Springer,2016.
[33] LI X,WANG S Y,XUN X G,et al.A carotenoid oxygenase is responsible for muscle coloration in scallop[J].Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids,2019,1864(7):966-975.
[34] SUN Y Y,YAN C C,LIU M F,et al.CRISPR/Cas9-mediated deletion of one carotenoid isomerooxygenase gene (EcNinaB-X1) from Exopalaemon carinicauda[J].Fish &Shellfish Immunology,2020,97:421-431.
[35] SUN Y Y,LIU M F,YAN C C,et al.CRISPR/Cas9-mediated deletion of β,β-carotene 9′,10′-oxygenase gene (EcBCO2) from Exopalaemon carinicauda[J].International Journal of Biological Macromolecules,2020,151:168-177.
[36] LEI C,LI J H,ZHENG Z,et al.Molecular cloning,expression pattern of β-carotene 15,15-dioxygenase gene and association analysis with total carotenoid content in pearl oyster Pinctada fucata martensii[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2019,229:34-41.
[37] CHELSTOWSKA S,WIDJAJA-ADHI M A,SILVAROLI J A,et al.Molecular basis for vitamin A uptake and storage in vertebrates[J].Nutrients,2016,8(11):676.
[38] PETKOVICH M,BRAND N J,KRUST A,et al.A human retinoic acid receptor which belongs to the family of nuclear receptors[J].Nature,1987,330(6147):444-450.
[39] BALMER J E,BLOMHOFF R.Gene expression regulation by retinoic acid[J].Journal of Lipid Research,2002,43(11):1773-1808.
[40] ZHONG G,HOGARTH C,SNYDER J M,et al.The retinoic acid hydroxylase Cyp26a1 has minor effects on postnatal vitamin A homeostasis,but is required for exogenous at RA clearance[J].The Journal of Biological Chemistry,2019,294(29):11166-11179.
[41] KEDISHVILI N Y.Enzymology of retinoic acid biosynthesis and degradation:thematic review series:fat-soluble vitamins:vitamin A[J].Journal of Lipid Research,2013,54(7):1744-1760.
[42] OBROCHTA K M,KROIS C R,CAMPOS B,et al.Insulin regulates retinol dehydrogenase expression and all-trans-retinoic acid biosynthesis through FoxO1[J].The Journal of Biological Chemistry,2015,290(11):7259-7268.
[43] TWOMEY E,JOHNSON J D,CASTROVIEJO-FISHER S,et al.A ketocarotenoid-based colour polymorphism in the sira poison frog Ranitomeya sirensis indicates novel gene interactions underlying aposematic signal variation[J].Molecular Ecology,2020,29(11):2004-2015.
[44] TWYMAN H,VALENZUELA N,LITERMAN R,et al.Seeing red to being red:conserved genetic mechanism for red cone oil droplets and co-option for red coloration in birds and turtles[J].Proceedings Biological Sciences,2016,283(1836):20161208.
[45] WYBOUW N,KURLOVS A H,GREENHALGH R,et al.Convergent evolution of cytochrome P450s underlies independent origins of keto-carotenoid pigmentation in animals[J].Proceedings Biological Sciences,2019,286(1907):20191039.
[46] VOROBYEV M.Coloured oil droplets enhance colour discrimination[J].Proceedings Biological Sciences,2003,270(1521):1255-1261.
[47] JOHNSON J D,HILL G E.Is carotenoid ornamentation linked to the inner mitochondria membrane potential?A hypothesis for the maintenance of signal honesty[J].Biochimie,2013,95(2):436-444.
[48] MOJIB N,AMAD M,THIMMA M,et al.Carotenoid metabolic profiling and transcriptome-genome mining reveal functional equivalence among blue-pigmented copepods and appendicularia[J].Molecular Ecology,2014,23(11):2740-2756.
[49] HILL G E,HOOD W R,GE Z Y,et al.Plumage redness signals mitochondrial function in the house finch[J].Proceedings Biological Sciences,2019,286(1911):20191354.
[50] OZEIR M,MÜHLENHOFF U,WEBERT H,et al.Coenzyme Q biosynthesis:Coq6 is required for the C5-hydroxylation reaction and substrate analogs rescue Coq6 deficiency[J].Chemistry &Biology,2011,18(9):1134-1142.
[51] THOMAS S E,HARRISON E H.Mechanisms of selective delivery of xanthophylls to retinal pigment epithelial cells by human lipoproteins[J].Journal of Lipid Research,2016,57(10):1865-1878.
[52] KEEN J N,CACERES I,ELIOPOULOS E E,et al.Complete sequence and model for the C1 subunit of the carotenoprotein,crustacyanin,and model for the dimer,beta-crustacyanin,formed from the C1 and A2 subunits with astaxanthin[J].Febs Journal,2010,202(1):31-40.
[53] BERNHARD K,ENGLERT G,MEISTER W,et al.Carotenoids of the carotenoprotein asteriarubin.Optical purity of asterinic acid[J].Helvetica Chimica Acta,1982,65(7):2224-2229.
[54] ZAGALSKY P F,HAXO F,HERTZBERG S,et al.Studies on a blue carotenoprotein,linckiacyanin,isolated from the starfish Linckia laevigata (Echinodermata:Asteroidea)[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1989,93(2):339-353.
[55] RENSTRØM B,RØNNEBERG H,BORCH G,et al.Animal carotenoids—27.further studies on the carotenoproteins crustacyanin and ovoverdin[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1982,71(2):249-252.