厚壳贻贝(Mytilus coruscus)是中国重要的海产经济贝类[1],由于其具有较高的适应外界环境和生存繁殖能力,广泛分布于中国渤海、黄海和东海海岸,浙江省舟山市嵊泗县是其主要产区[2]。贻贝的生活史包括浮游生活和底栖附着两部分[3]。在贻贝幼虫的眼点幼虫时期会经历纤毛环脱落、游泳能力丧失的变态发育过程,随后进入附着生长的稚贝时期,这一过程称为“附着变态”[3]。当稚贝的生活环境发生变化而不利于生存和生长时,为寻找新的生态位,稚贝会自行切断足丝并完成下一次附着,被称为“二次附着”[4]。附着变态和二次附着过程均会被生物被膜诱导,这两个阶段的顺利完成直接关系到人工选育的保苗和包苗环节。因此,研究海洋细菌生物被膜对厚壳贻贝附着的调控机制,对于改善经济贝类海水养殖条件,尤其是提高贝类苗种的产出具有极其重要的理论和实践意义。
细菌生物被膜是由聚集在实体表面的细菌细胞和水合性胞外基质构成[5]。一般认为,生物被膜结构随细菌种类、附着基性质及环境中营养物质不同而有所差异。在Habash等[6]的研究中,将成熟细菌生物被膜从内到外分为基质层(substratum)、条件层(conditioning film)、连接层(linking film)和主体生物被膜层(bulk of biofilm)。其中,细菌自身产生的胞外多聚物如胞外多糖、糖蛋白等与其他各种代谢物共同包裹在细菌群落外围,保证了生物被膜中细菌的存活。已有研究表明,细菌生物被膜的形成受多种因素的调节,包括群体感应系统[7]、环二鸟苷酸系统[8]、多糖调控系统[9]和细菌分泌物等[10]。
海洋微生物形成的生物被膜在许多海洋无脊椎动物的附着和变态过程中均起着十分重要的调控作用。如科氏交替单胞菌(Alteromonas cowelliana)、霍乱弧菌(Vibrio cholerae)和假交替单胞菌(Pseudoalteromonas sp.)生物被膜中的化学诱导物能够诱导太平洋牡蛎(Crassostrea giga)的附着变态[11]。单一细菌生物被膜对华美盘管虫(Hydroides elegans)和厚壳贻贝同样具有附着诱导能力[12-13]。细菌生物被膜在其群落演替过程中,细菌密度、群落结构、代谢活动及其代谢产物均具有影响海洋无脊椎动物附着或变态的能力,然而有关其具体诱导机制的研究却鲜见报道。
细菌胞外活性物质是诱导海洋无脊椎动物附着和变态的原因之一,如细菌糖类、脂类及蛋白质能够通过不同方式影响生物被膜的诱导活性。研究表明,藻酸盐、可拉酸和脂多糖均能够提高海假交替单胞菌(Pseudoalteromonas marina)(以下简称“P.marina”)生物被膜诱导贻贝附着的能力[14-15],而纤维素则表现出相反的结果[16]。添加棕榈酸(十六烷酸)、硬脂酸(十八烷酸)、油酸(十八烯酸)及3种脂肪酸的混合物可抑制生物被膜的形成,促进贻贝幼虫附着变态[17]。此外,生物被膜中外源添加的鞭毛蛋白同样可提高贻贝的附着能力[18]。由此可见,通过改变生物被膜胞外活性物质调控贻贝附着变态是相关研究的重要手段。
胞外囊泡(outer membrane vesicles,OMVs)是普遍存在于真核细胞及原核细胞中的一种由磷脂双分子层密闭包裹的纳米级球形结构(直径为10~300 nm),其包含脂多糖、磷脂、外膜蛋白和核酸,同时也包含细胞周质中的部分成分[19],这些丰富的化学物质使其具有复杂的生理生化功能。研究发现,OMVs能够参与群体感应和生物被膜形成[20]。OMVs作为一种重要的细胞膜外结构,参与到铜绿假单胞菌(Pseudomonas aeruginosa)[21]、金黄色葡萄球菌(Staphylococcus aureus)[22]和幽门螺杆菌(Helicobacter pylori)[23]等细菌生物被膜的形成。已有研究表明,藤黄紫假交替单胞菌(Pseudoalteromonas luteoviolacea)、溶解噬纤维菌(Cellulophaga lytica)、海水芽孢杆菌(Bacillus aquimaris)和华氏葡萄球菌(Staphylococcus warneri)4种能够产生OMVs的海洋细菌生物被膜可以诱导华美盘管虫幼虫附着,进一步研究发现,纯化的OMVs仍然具有附着诱导活性[12]。然而,OMVs对其他海洋无脊椎动物附着及细菌生物被膜形成的影响有待探究。
本研究中,从生物被膜的细菌密度、膜厚和胞外产物等生物学特性角度探讨了外源添加OMVs对P.marina生物被膜形成及其诱导厚壳贻贝稚贝附着的影响,以期为利用生物被膜提高贻贝育苗成功率提供科学依据。
1 材料与方法
1.1 材料
试验用贻贝稚贝采自浙江省嵊泗养殖场,壳长为(0.88±0.16)mm,壳高为(0.55±0.12)mm。将稚贝带回实验室暂养1周后进行附着试验。暂养期间,养殖水温为18 ℃,使用气石持续充氧,每两天更换一次过滤海水,海水盐度控制在30,每天喂食湛江等鞭金藻一次。
试验用细菌P.marina是从浙江省嵊泗县枸杞岛海域自然生物被膜中筛选获得的菌株。OMVs从P.marina菌液中提取得到。
1.2 方法
1.2.1 细菌培养、OMVs的提取 参照Yang等[3]的方法,蘸取细菌保种液划线于ZoBell 2216E培养基平板上,25 ℃下培养得到单菌落。挑取菌落置于1 L液体培养基中,在25 ℃恒温培养箱中以200 r/min振荡培养18 h,随后参照Fredriksen等[24]的方法,在4 ℃下以8 000×g离心处理10 min,将上清液与菌体分离。
分离后的上清液以20 000×g高速离心,回收沉淀。菌体沉淀使用30 mL浓度为0.05 mol/L的Tris-HCl缓冲液(pH 8.0)重悬,置于56 ℃水浴锅中持续加热45 min,使细菌灭活;再加入50 mg/mL的溶菌酶,使溶液终质量浓度为1 mg/mL,冰浴0.5 h,用超声破碎菌体,以5 000×g离心去除细菌碎片;将上清液转移至新的离心管中,以80 000×g离心处理75 min,收集沉淀。将上清液和菌体离心后的沉淀采用浓度为50 mmol/L HEPES+150 mmol/L NaCl的混合液重悬,依次加入不同浓度的OptiPrep-iodixanol梯度细胞分离液(浓度依次为50%、45%、40%、35%、30%、25%,以200 000×g高速离心,回收全部50%浓度的液体层,再以200 000×g离心1 h,沉淀即为提取的OMVs,将沉淀于4 ℃下保存用于后续的检测。
1.2.2 OMVs的浓度及形态鉴定 取1 mL 4 ℃下保存的OMVs用PBS溶液重悬,制作BCA蛋白浓度标准曲线,采用酶标仪在562 nm处检测吸光值,并计算OMVs中的蛋白含量。用12% SDS-PAGE电泳检测OMVs蛋白图谱,蛋白上样量为20 μg,经过固定、增敏、银染和显色后拍摄蛋白胶图像。采用四氧化锇对OMVs进行负染,用透射电子显微镜(Transmission Electron Microscope,TEM)在500、200、100 nm比例尺下拍摄OMVs的囊泡形态。采用纳米颗粒跟踪分析(Nanoparticle Tracking Analysis,NTA)系统统计提取OMVs的粒径大小。
1.2.3 细菌密度计数 取10 μL菌液于100 mL液体培养基中,在25 ℃恒温培养箱中以200 r/min振荡培养18 h。菌液以1 000×g离心去除培养基,并保留菌体,加入50 mL灭菌过滤海水清洗3次。最后,菌体用灭菌过滤海水重悬,取10 μL菌悬液稀释100倍后,用移液枪吸取1 mL液体,经孔径为0.22 μm的滤膜过滤,得到含有菌体的滤膜,将滤膜浸没在10 g/L吖啶橙染液中染色5 min,晾干后用Olympus BX51显微镜计算细菌细胞数量。每组计数结果包含10个均匀视野,每组重复测试3次。
1.2.4 细菌生物被膜的制备 菌悬液经计数后,得到细菌总密度。在含有无菌玻片的灭菌培养皿中添加菌悬液,用灭菌过滤海水定容至20 mL,使初始细菌密度为1×108 cells/mL。加入不同浓度的OMVs,使其终质量浓度分别为0、0.1、1、10、20 μg/mL,18 ℃避光条件下培养48 h得到细菌生物被膜,以空白灭菌玻片作为空白组。
1.2.5 厚壳贻贝稚贝的附着 将制成的生物被膜分别置于干净的灭菌培养皿中,加入20 mL灭菌过滤海水。用移液管吸取10只稚贝,均匀放入皿中生物被膜两侧,空白对照为灭菌载玻片,每组设置9个生物学重复,分别记录每组稚贝的附着率。
1.2.6 生物被膜形态及激光共聚焦拍摄 采用激光共聚焦扫描显微镜(Confocal Laser Scanning Microscopy,CLSM)进行图像拍摄。用相应荧光染料进行胞外产物染色,荧光染料使用浓度见表1,方法参考文献[25]。将培养好的细菌生物被膜采用体积分数为5%的甲醛溶液固定24 h后,再用生理盐水稀释甲醛溶液。滴加100 μL荧光染料,在黑暗条件下染色15 min后,用生理盐水冲洗生物被膜表面多余染料,待表面水分晾干后进行拍摄。每组设置3个生物学重复,从每组随机选10个视野用于拍摄和数据分析。
表1 染色采用的荧光染料
Tab.1 Fluorescent dyes used in dyeing
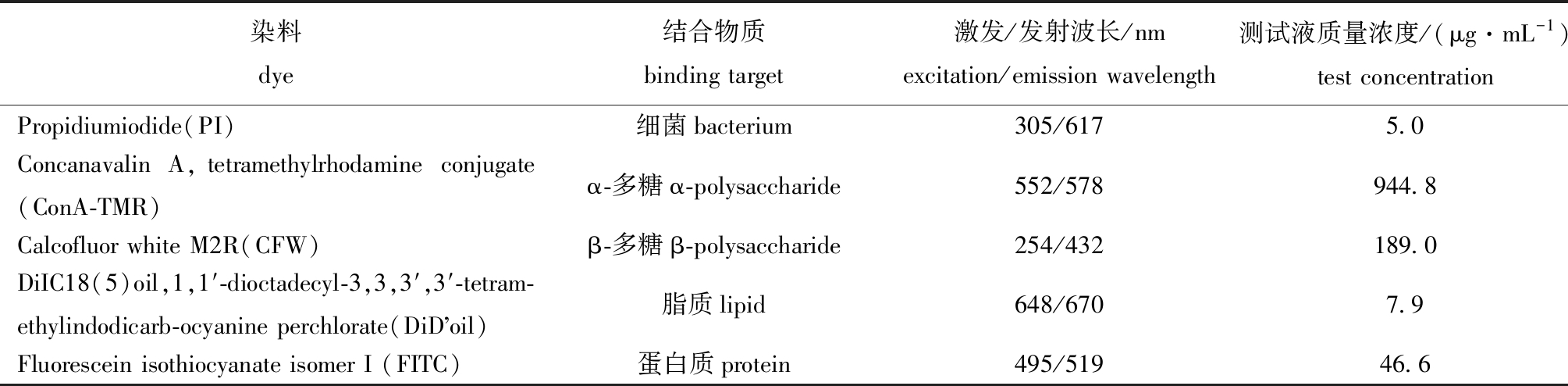
染料dye结合物质binding target激发/发射波长/nmexcitation/emission wavelength测试液质量浓度/(μg·mL-1)test concentrationPropidiumiodide(PI)细菌bacterium305/6175.0Concanavalin A,tetramethylrhodamine conjugate (ConA-TMR)α-多糖α-polysaccharide552/578944.8Calcofluor white M2R(CFW) β-多糖β-polysaccharide254/432189.0DiIC18(5)oil,1,1′-dioctadecyl-3,3,3′,3′-tetram-ethylindodicarb-ocyanine perchlorate(DiD oil)脂质lipid648/6707.9Fluorescein isothiocyanate isomer I (FITC)蛋白质protein495/51946.6
1.3 数据处理
采用JMP软件进行差异性分析和作图,采用ImageJ 1.8.0.112软件分析CLSM图像及生物量,采用SPSS 25.0软件进行相关性分析。
2 结果与分析
2.1 OMVs的形态观察和蛋白图谱鉴定
采用密度梯度离心法提取OMVs,用BCA法测得OMVs中的蛋白质量浓度为712.1 μg/mL。为检测OMVs的完整性,采用TEM拍摄囊泡形态并用SDS-PAGE检测OMVs中的蛋白图谱。结果显示,从菌体中提取的OMVs具有完整球状结构(图1),观察发现,其丰度较高,囊泡密集,能够用于后续试验。蛋白胶结果经过银染显示出明显的蛋白条带,OMVs蛋白相对分子质量为18 000~130 000,表明OMVs蛋白谱分布较广,蛋白含量丰富,与上清液相比,菌体中含有更多的OMVs水平(图2)。由于从上清液中提取的OMV含量较少,故未进行透射电镜拍摄。
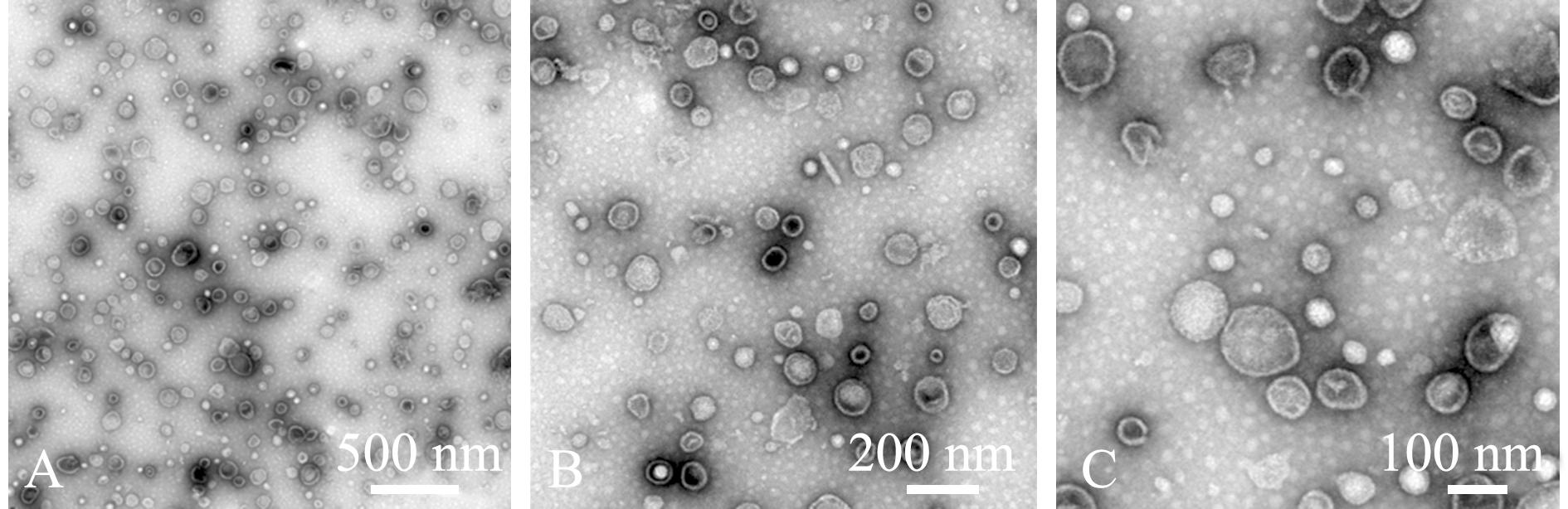
图1 OMVs的TEM图像
Fig.1 TEM images of OMVs
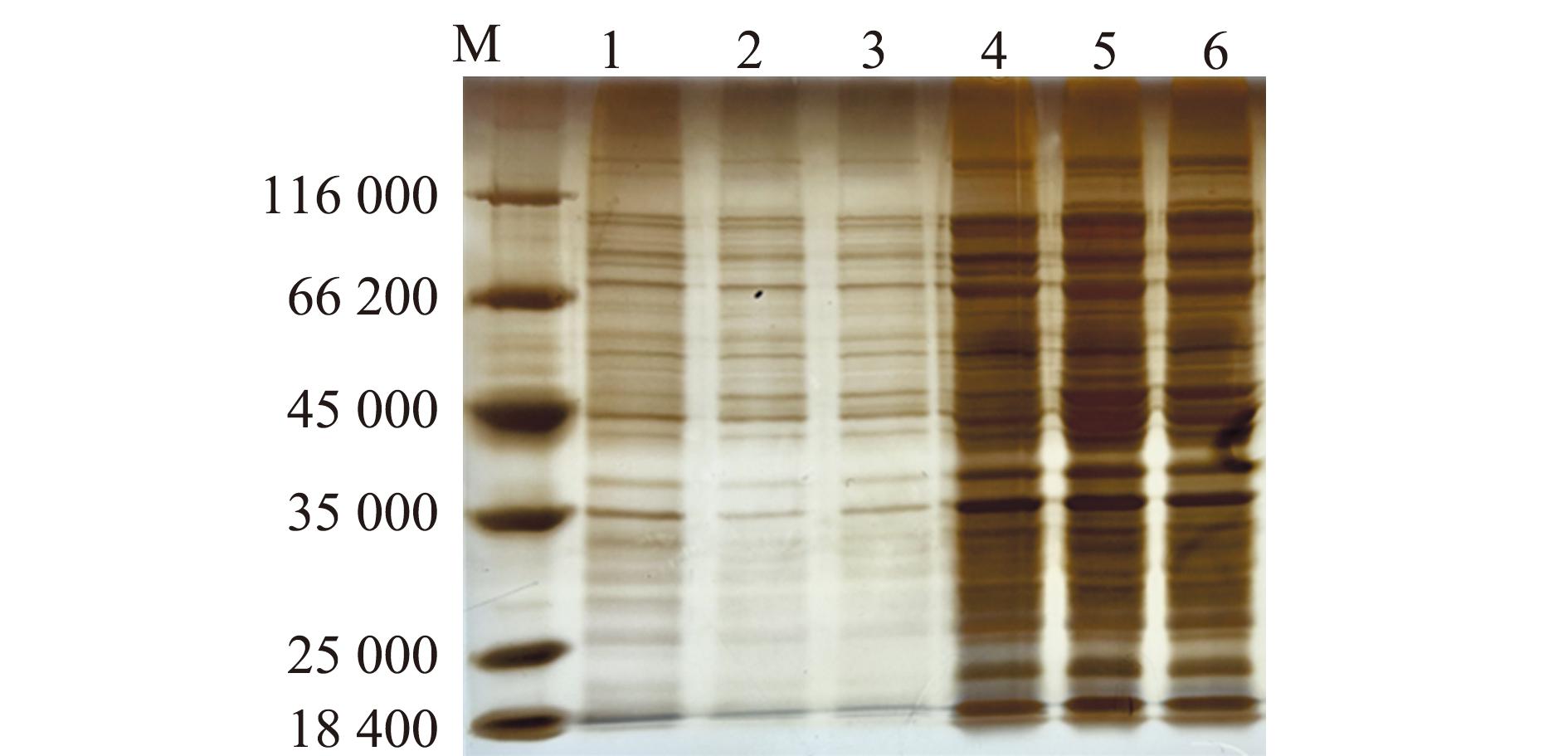
M为蛋白marker;1、2、3为上清液中提取的OMVs;4、5、6为菌体中提取的OMVs。
M is the protein marker;1,2 and 3 are OMVs extracted from supernatant;4,5 and 6 are OMVs extracted from bacterial cells.
图2 SDS-PAGE蛋白图谱
Fig.2 SDS-PAGE identification of the protein pattern of OMVs
2.2 OMVs粒径检测
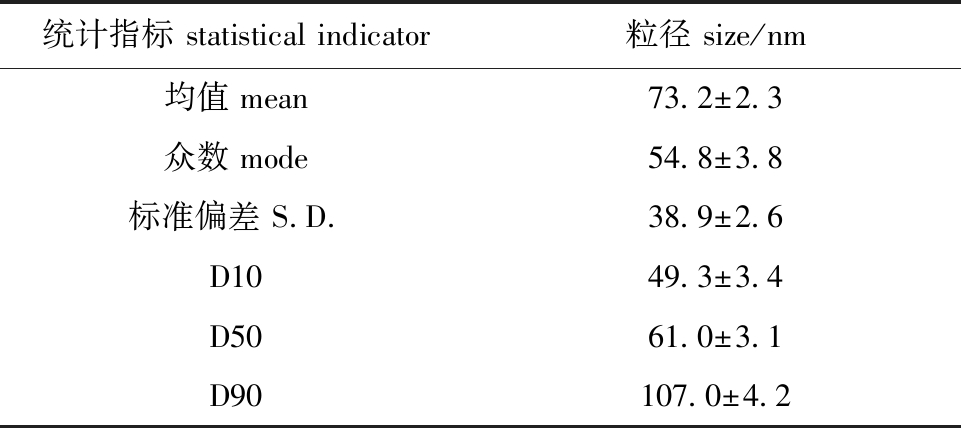
采用纳米颗粒跟踪分析技术,跟踪颗粒运动轨迹以获取囊泡粒径信息。结果显示,OMVs的囊泡粒径监测峰值为58 nm(图3(a)),囊泡粒径强度分布在37.6~118.0 nm(图3(b))。经统计,OMVs粒径规格主要为(54.8±3.8)nm,囊泡平均粒径为(73.2±2.3)nm,其中(49.3±3.4)~(107.0±4.2)nm的颗粒含量占OMVs总数的80%(表2)。
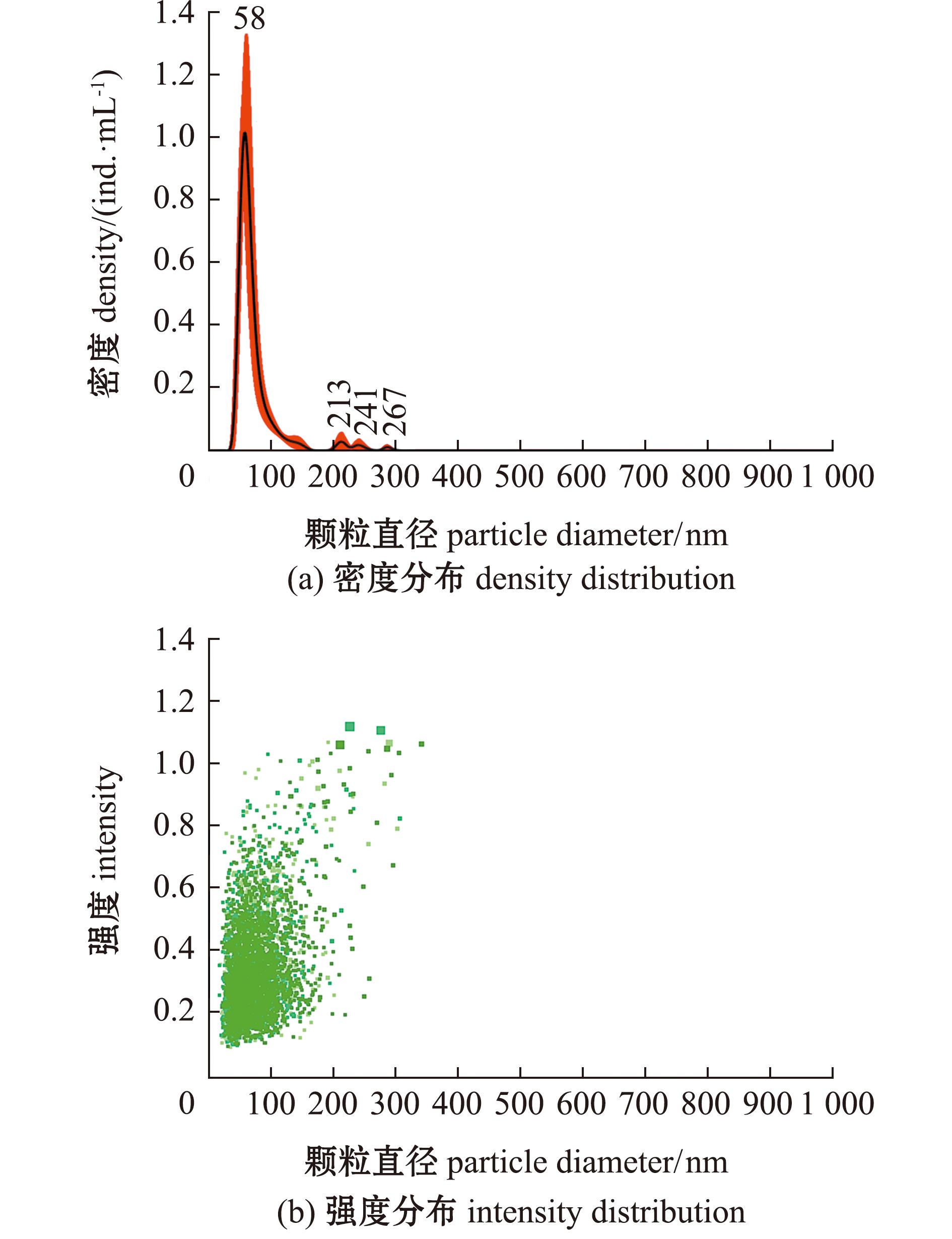
图3 基于NTA法检测的OMVs密度及强度分布
Fig.3 Density and intensity of OMVs detected by NTA method
表2 OMVs的粒径分布
Tab.2 Particle size distribution of OMVs
注:D10、D50和D90分别为粒径规格分布为10%、50%和90%的范围。
Note:D10,D50,and D90 represent particle sizes with a cumulative distribution of 10%,50% and 90%,respectively.
统计指标 statistical indicator粒径 size/nm均值 mean73.2±2.3众数 mode54.8±3.8标准偏差 S.D.38.9±2.6D1049.3±3.4D5061.0±3.1D90107.0±4.2
2.3 贻贝稚贝的附着
添加4种浓度的OMVs与P.marina生物被膜共培养后,诱导贻贝稚贝的附着。结果显示:当添加10 μg/mL OMVs时,生物被膜表现出最高的附着诱导活性,此时稚贝的附着率(56.42%)显著高于空白组(9.12%)和P.marina组(34.85%)(P<0.05),且较P.marina组的附着率增加了21.57%(图4(a));生物被膜细菌密度随OMVs浓度的增加呈增长趋势(P<0.05),而10、20 μg/mL OMVs添加组细菌密度则无显著性差异(P>0.05)(图4(b))。
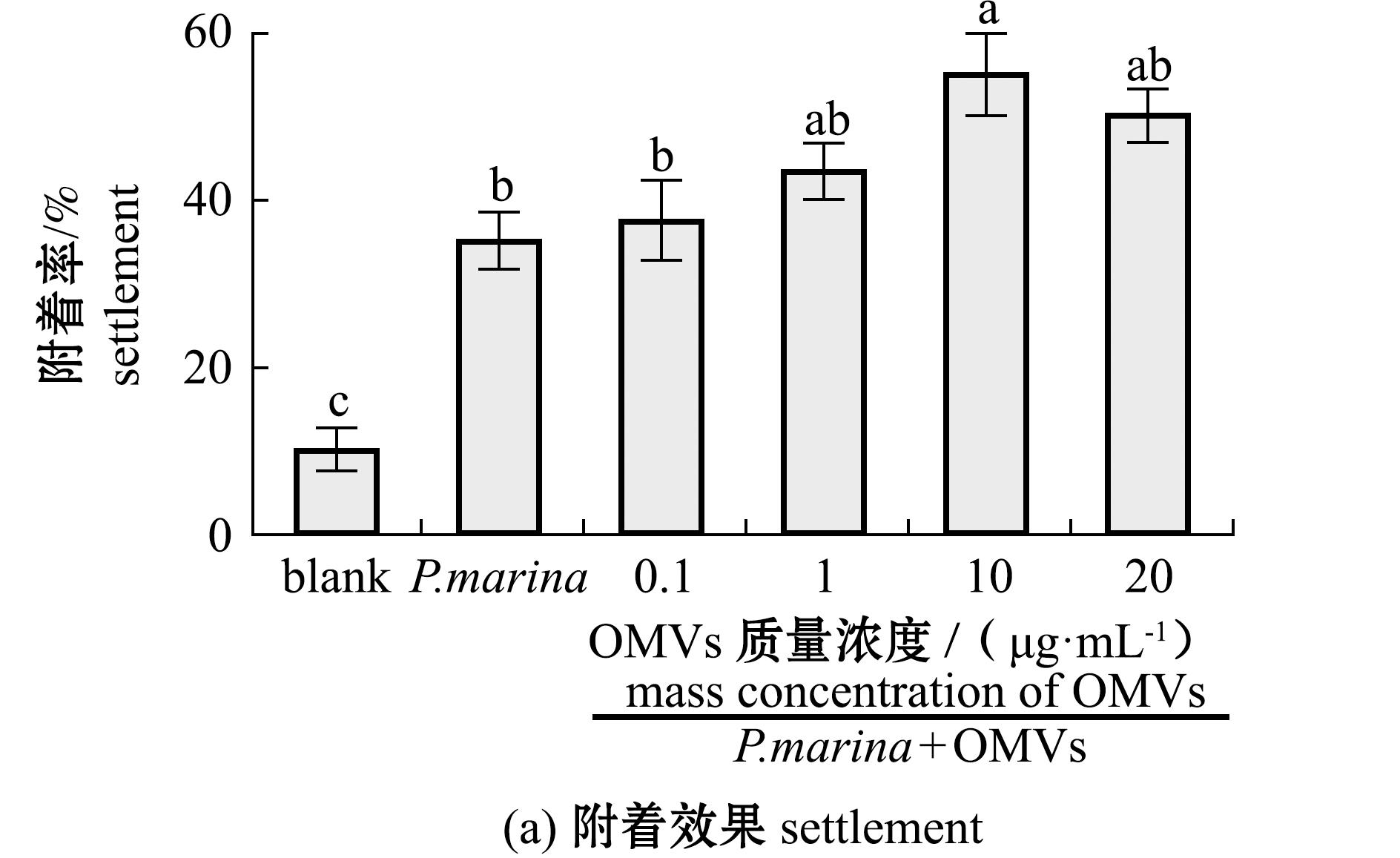
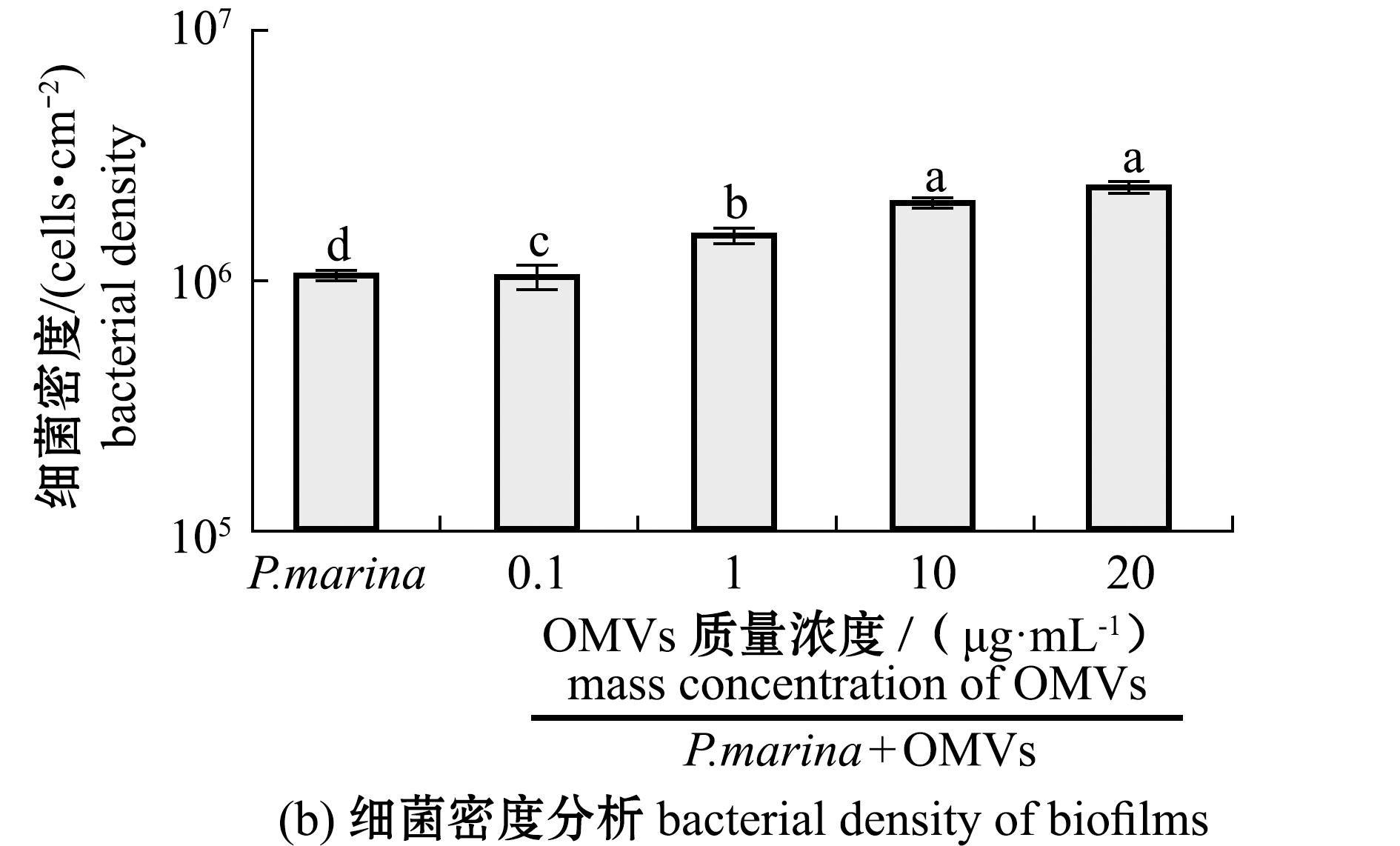
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图4 添加不同浓度OMVs后形成的生物被膜诱导稚贝附着的效果和细菌密度分析
Fig.4 Analysis of addition of different concentrations of OMVs to biofilms on the settlement of Mytilus coruscus plantigrades and the bacterial density of biofilms
2.4 细菌分布和生物被膜膜厚的变化
CLSM分析结果显示:细菌生物被膜细菌密度及膜厚均随OMVs浓度的升高而增加;P.marina生物被膜上细菌分布均匀,添加OMVs后生物被膜形成能力增加,与单一生物被膜相比,OMVs与P.marina共培养条件下形成的生物被膜上细菌菌体聚集程度增高(图5(a)),生物被膜厚度增加(图5(b)),并与添加OMVs的质量浓度呈正相关;当OMVs质量浓度达到20 μg/mL时,膜厚达到最大值,为5.54 μm。
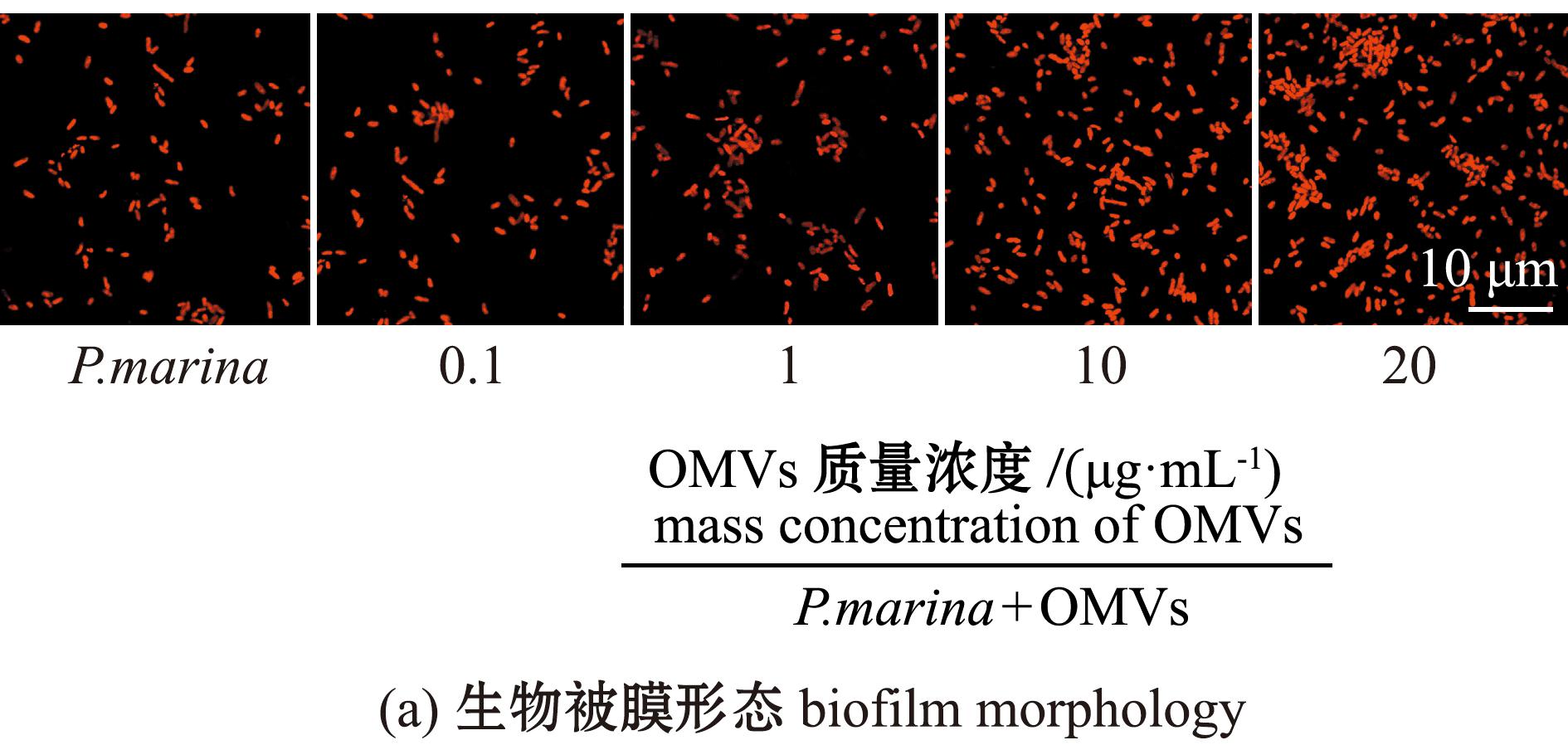
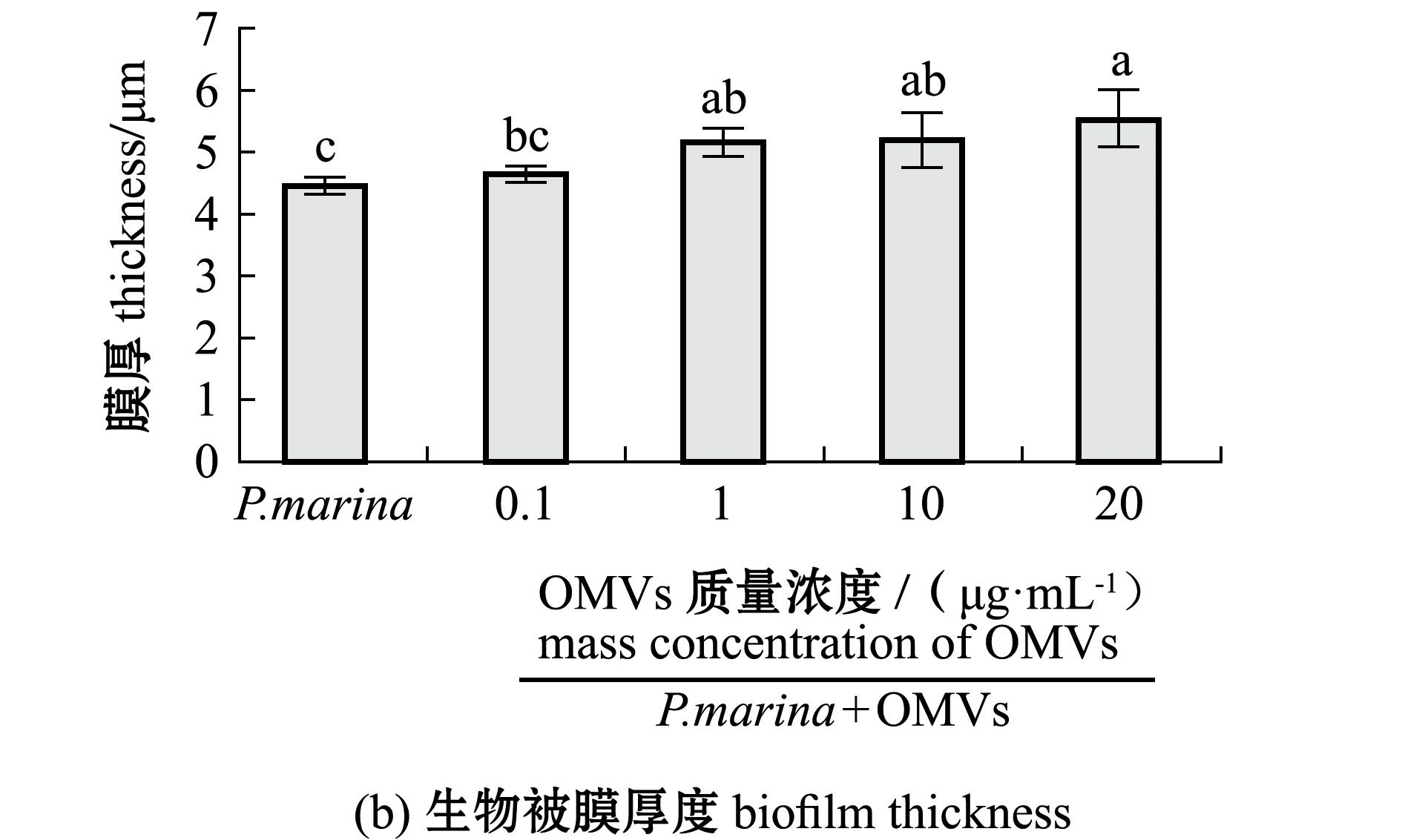
图5 添加不同质量浓度OMVs后形成的生物被膜形态和膜厚
Fig.5 Morphology and thickness of the biofilm cultured in the mediun containing different concentrations of OMVs
2.5 生物被膜的多糖、脂质和蛋白质含量差异
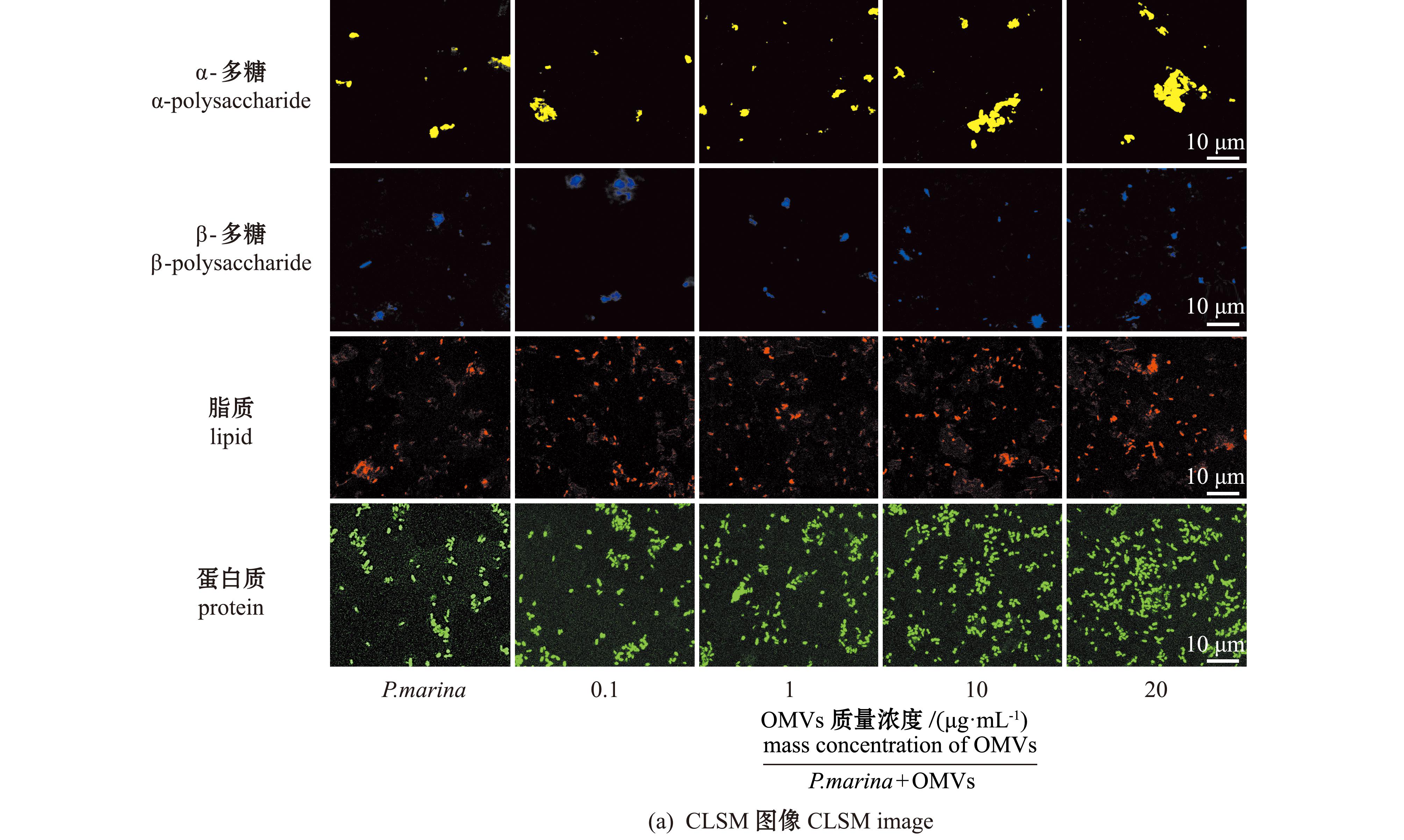
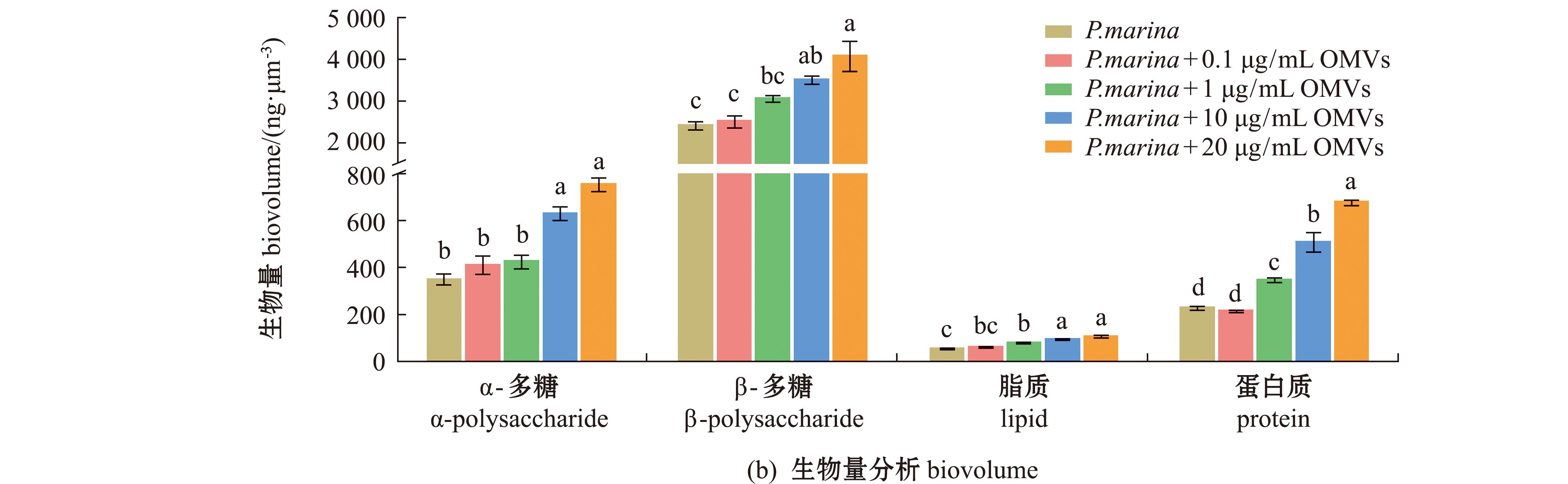
为进一步探索OMVs加入生物被膜后,生物被膜表面活性物质的变化,采用激光共聚焦显微镜观察了生物被膜中多糖、脂质及蛋白质含量的变化。结果显示:随着OMVs质量浓度的增加,生物被膜中胞外多糖、脂质及蛋白质含量均呈现上升趋势;当OMVs质量浓度达到20 μg/mL时,各物质含量均显著高于单一生物被膜组(P.marina组)(P<0.05),且α-多糖、β-多糖、脂质和蛋白质含量分别增加了115.95%、96.05%、98.74%和199.54%(图6)。
标有不同字母者表示同一指标下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters in the same index are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences.
图6 添加OMVs后P.marina生物被膜上α-多糖、β-多糖、脂质和蛋白质含量的CLSM图像和生物量
Fig.6 CLSM images and biovolumes of α-polysaccharide,β-polysaccharide,lipid and protein of P.marina biofilm cultured in the mediun containing different concentrations of OMVs
2.6 稚贝附着率与生物被膜细菌密度、多糖、脂质和蛋白质含量的相关性
从表3可见,添加OMVs后的细菌生物被膜诱导贻贝稚贝附着的活性,仅与生物被膜中脂质含量的变化显著相关(P<0.05),而与细菌密度、α-多糖、β-多糖和蛋白质变化无显著相关性(P>0.05)。
表3 稚贝附着率与生物被膜细菌密度、α-多糖、β-多糖、脂质和蛋白质含量的相关性分析
Tab.3 Correlation analysis between the settlement of plantigrades and the bacterial density,and the concentrations of α-polysaccharide,β-polysaccharide,lipid and protein

注:*表示显著相关;r—相关系数;P—P值。
Note:* indicates a significant correlation;r—correlation ratio;P—P-value.
细菌密度 densityα-多糖 α-polysaccharideβ-多糖 β-polysaccharide脂质 lipid蛋白质 proteinrPrPrPrPrP附着率 settlement0.9060.3400.8500.0610.8750.0530.9130.030∗0.8560.064
3 讨论
3.1 OMVs提取、纯化和鉴定
OMVs是一种充满周质物质的囊球结构,由革兰氏阴性菌从外膜产生并释放到细胞外环境中[26]。细菌在生长和感染宿主的过程中均会产生OMVs,并参与物质运输,如毒素、毒力因子及核酸等物质,其作为细菌重要的外泌体结构近年来被广泛研究[22]。目前,关于胞外囊泡的提取方法较多,但尚未形成统一的分离富集技术标准,且不同分离方法对OMVs的浓度、纯度及生物活性的影响不尽相同。本研究中,参照Fredriksen等[24]的方法,提取菌体和上清液中的OMVs,经SDS-PAGE鉴定其蛋白谱分布较广,蛋白含量丰富,这与其在脑膜炎奈瑟菌(Neisseria meningitidis)中的提取结果类似,表明与上清液提取方法相比,菌体提取的方法更适用于P.marina中OMVs的提取。同时,成熟的OMVs携带多种生物活性物质,其中蛋白类物质是OMVs中重要成分之一,对革兰氏阴性菌OMVs的蛋白组成分析发现,其内腔中含有包括外膜蛋白、周质蛋白,以及对宿主黏附入侵能力相关的毒力因子等大量蛋白质,这些物质在很大程度上影响OMVs的活性[27]。本研究中提取的OMVs结构完整、纯度高且蛋白谱分布较广,可为后续生物被膜及贻贝稚贝附着试验提供具有活性的OMVs。
3.2 OMVs在生物被膜诱导贻贝附着过程中的作用
近年来研究发现,OMVs能够介导多种生物学功能,如诱导疾病发生、保护细菌存活及参与细菌群落内物质转运[28]。由于细菌生物被膜能够诱导海洋无脊椎动物附着[2,12],OMVs作为细菌生物被膜的重要组分[29],推测其能够参与附着调控。本研究中,OMVs可增强P.marina生物被膜对厚壳贻贝稚贝附着的诱导活性,这与Freckelton等[12]在无脊椎动物华美盘管虫中的研究结果相一致。藤黄紫假交替单胞菌、溶解噬纤维菌、海水芽孢杆菌和华氏葡萄球菌等这些能够产生OMVs的菌株均能够诱导华美盘管虫附着,单独纯化的OMVs同样具有附着诱导活性[12,30]。这些结果证实,OMVs是诱导海洋无脊椎动物附着的天然化学信号之一。作者所在实验室最新研究证实,OMVs能诱导厚壳贻贝稚贝附着,T6SS尖峰蛋白基因vgrG缺失导致了贻贝附着诱导活性下调,且伴随着OMVs的产生降低[31];进一步试验发现,OMVs外源性回补至基因vgrG缺失突变菌中,其形成的生物被膜诱导活性并未出现显著上调,有意思的是,通过同时回补T6SS尖峰蛋白和OMVs,突变菌形成生物被膜的诱导活性能够恢复到基因敲除前的水平,表明T6SS尖峰蛋白能够募集OMVs,从而介导厚壳贻贝稚贝的附着[31]。
3.3 OMVs对生物被膜形成的影响
为探究OMVs对生物被膜的影响机制,本研究中分析比较了添加不同质量浓度OMVs的P.marina生物被膜形成能力,结果发现,随着OMVs浓度的增加,细菌生物被膜形成能力增强,OMVs能固定到生物被膜上面。近期研究发现,T6SS可以招募细菌分泌到细菌表面,铜绿假单胞细菌H3-T6SS分泌PQS结合效应蛋白TseF来识别和招募OMV到细菌细胞表面;杀虫贪铜菌(Cupriavidus necator)分泌脂多糖(LPS)结合效应蛋白TeoL来招募OMV[26]。而黄色黏球菌(Myxococcus xanthus)的OMVs具有增加细胞生长阶段的细胞外膜延伸及生物被膜阶段的细胞连接作用[32]。对假单胞菌(Pseudomonas putida)的研究发现,OMVs的合成能力增加后,加强了细菌细胞表面疏水性,这有助于生物被膜的形成[33]。由此推测,OMVs可能同样通过增强P.marina细胞间作用力的方式促进生物被膜的形成。
3.4 脂质对贻贝稚贝附着的影响
OMVs主要由外膜蛋白、磷脂和脂多糖组成,并充满了周质和细胞质成分,如肽聚糖、蛋白质、核酸、群体感应信号和金属离子[26]。本研究中,在生物被膜形成过程中加入OMVs后,CLSM图像显示多糖、脂质和蛋白质含量显著增加,这可能是因为OMVs加入后影响了细菌细胞的黏附性进而增加生物被膜量造成的。OMVs携带多种细菌细胞分泌物,是一种独特的细菌分泌途径,被称为“O型”分泌系统(TOSS)[34],使肽聚糖、磷脂和外膜蛋白等物质富集到生物被膜表面,增加了各物质的检测含量。相关性分析显示,生物被膜中脂质含量变化与贻贝附着率显著相关,推测OMVs通过脂质调控厚壳贻贝稚贝附着。众所周知,脂类物质调控许多细胞代谢过程,影响生物被膜胞外基质的分泌[35]。以往的实验室研究证明,LPS可直接诱导厚壳贻贝幼虫附着变态,在此过程中,LPS具有直接诱导作用,通过介导生物被膜分泌的可拉酸等胞外产物的生成来影响幼虫从浮游向底栖生活的转变[15];脂肪酸合成基因tesA的缺失,直接导致生物被膜的脂类组成发生改变和下调,最终导致厚壳贻贝幼虫变态率下降超过80%[35]。而溶解噬纤维菌(Cellulophaga lytica)生物被膜中LPS为诱导华美盘管虫附着变态的活性分子也同样被证实[29]。由此推测,OMVs可能通过调控生物被膜中LPS的变化影响厚壳贻贝稚贝附着。然而,关于OMVs与生物被膜LPS、稚贝附着的关系还有待进一步探究。
综上所示,在P.marina生物被膜形成过程中,添加OMVs会增加生物被膜形成能力及胞外α-多糖、β-多糖、蛋白和脂质的分泌,并推测OMVs通过生物被膜胞外脂质调控厚壳贻贝稚贝附着。此研究为解析OMVs在海洋细菌生物被膜形成中的作用机制及进一步探究生物被膜与海洋贝类附着间的互作关系具有积极意义,同时,也为利用生物被膜提高厚壳贻贝育苗成功率、推动其人工养殖产业的发展提供了有益参考。
4 结论
1)在P.marina中成功提取到OMVs,从菌体中提取获得的OMVs含量比上清液中高。
2)添加OMVs可增加P.marina生物被膜的细菌密度和膜厚,提高生物被膜中α-多糖、β-多糖、蛋白质和脂质的含量,且能促进细菌生物被膜的形成。
3)添加OMVs可提高P.marina生物被膜对厚壳贻贝稚贝附着的诱导能力,且稚贝附着诱导活性与生物被膜中脂质含量的变化显著相关。
[1] 尤仲杰,徐善良,谢起浪.浙江沿岸的贝类资源及其增养殖[J].东海海洋,2000,18(1):50-56.
YOU Z J,XU S L,XIE Q L.Shellfish resources and its cultivation and proliferation along Zhejiang coast[J].Donghai Marine Science,2000,18(1):50-56.(in Chinese)
[2] 周轩,郭行磐,陈芋如,等.低湿度表面的海洋附着细菌对厚壳贻贝附着的影响[J].大连海洋大学学报,2015,30(1):30-35.
ZHOU X,GUO X P,CHEN Y R,et al.Effects of bacterial biofilms formed on low surface wettability on settlement of plantigrades of the mussel Mytilus coruscus[J].Journal of Dalian Fisheries University,2015,30(1):30-35.(in Chinese)
[3] YANG J L,SHEN P J,LIANG X,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms[J].Biofouling,2013,29(3):247-259.
[4] CARL C,POOLE A J,VUCKO M J,et al.Optimising settlement assays of pediveligers and plantigrades of Mytilus galloprovincialis[J].Biofouling,2011,27(8):859-868.
[5] COSTERTON J W,CHENG K J,GEESEY G G,et al.Bacterial biofilms in nature and disease[J].Annual Review of Microbiology,1987,41:435-464.
[6] HABASH M,REID G.Microbial biofilms:their development and significance for medical device-related infections[J].The Journal of Clinical Pharmacology,1999,39(9):887-898.
[7] 肖梦圆,武瑞赟,谭春明,等.群体感应系统及其抑制剂对细菌生物被膜调控的研究进展[J].食品科学,2020,41(13):227-234.
XIAO M Y,WU R Y,TAN C M,et al.Recent advances in understanding the role of quorum sensing system and quorum sensing inhibitors in regulating bacterial biofilm formation[J].Food Science,2020,41(13):227-234.(in Chinese)
[8] 涂春田,汪洋,易力,等.信号分子调控细菌生物被膜形成的分子机制[J].生物工程学报,2019,35(4):558-566.
TU C T,WANG Y,YI L,et al.Roles of signaling molecules in biofilm formation[J].Chinese Journal of Biotechnology,2019,35(4):558-566.(in Chinese)
[9] PASSOS DA SILVA D,MATWICHUK M L,TOWNSEND D O,et al.The Pseudomonas aeruginosa lectin LecB binds to the exopolysaccharide Psl and stabilizes the biofilm matrix[J].Nature Communications,2019,10:2183.
[10] QI L J,CHRISTOPHER G F.Role of flagella,type IV pili,biosurfactants,and extracellular polymeric substance polysaccharides on the formation of pellicles by Pseudomonas aeruginosa[J].Langmuir,2019,35(15):5294-5304.
[11] HASHIMOTO K,ELY VASQUEZ H,KITAMURA H,et al.Larval settlement of the Pacific oyster Crassostrea gigas in response to marine microbial films and monospecies bacterial films[J].Sessile Organisms,2017,34(2):21-27.
[12] FRECKELTON M L,NEDVED B T,HADFIELD M G.Induction of invertebrate larval settlement,different bacteria,different mechanisms?[J].Scientific Reports,2017,7:42557.
[13] 杨金龙,慎佩晶,王冲,等.微生物膜对厚壳贻贝稚贝附着的影响[J].水产学报,2013,37(6):904-909.
YANG J L,SHEN P J,WANG C,et al.Effects of biofilms on settlement of plantigrades of the mussel Mytilus coruscus[J].Journal of Fisheries of China,2013,37(6):904-909.(in Chinese)
[14] 陈慧娥,贺康,贺楚晗,等.藻酸盐对海假交替单胞菌生物被膜形成及厚壳贻贝附着变态的影响[J].大连海洋大学学报,2022,37(4):620-626.
CHEN H E,HE K,HE C H,et al.Effects of alginate on biofilm formation of Pseudoalteromonas marina and larval settlement and metamorphosis of the mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2022,37(4):620-626.(in Chinese)
[15] 吴静娴,李嘉政,胡晓梦,等.脂多糖对细菌生物被膜形成及厚壳贻贝幼虫变态的影响[J].水产学报,2022,46(11):2134-2142.
WU J X,LI J Z,HU X M,et al.Effects of lipopolysaccharide on bacterial biofilm formation and metamorphosis of mussel larvae[J].Journal of Fisheries of China,2022,46(11):2134-2142.(in Chinese)
[16] 梁箫,童欢,彭莉华,等.纤维素对海洋细菌生物被膜形成及厚壳贻贝幼虫附着变态的调控[J].大连海洋大学学报,2020,35(1):75-82.
LIANG X,TONG H,PENG L H,et al.Regulation of formation of biofilms and larval settlement and metamorphosis of mussel Mytilus coruscus by cellulose[J].Journal of Dalian Ocean University,2020,35(1):75-82.(in Chinese)
[17] 梁箫,丁文扬,张驰,等.3种脂肪酸对生物被膜形成及厚壳贻贝幼虫附着变态的影响[J].大连海洋大学学报,2021,36(4):580-586.
LIANG X,DING W Y,ZHANG C,et al.Effects of three fatty acids on biofilm formation and settlement and metamorphosis of hard shelled mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2021,36(4):580-586.(in Chinese)
[18] 蔡雨珊,张秀坤,竹攸汀,等.海假交替单胞菌(Pseudoalteromonas marina)鞭毛蛋白对生物被膜形成及厚壳贻贝附着的影响[J].海洋学报,2021,43(4):75-83.
CAI Y S,ZHANG X K,ZHU Y T,et al.Effects of Pseudoalteromonas marina flagellin on biofilm formation and settlement of Mytilus coruscus[J].Haiyang Xuebao,2021,43(4):75-83.(in Chinese)
[19] BONNINGTON K,KUEHN M.Breaking the bilayer:OMV formation during environmental transitions[J].Microbial Cell,2017,4(2):64-66.
[20] TURNBULL L,TOYOFUKU M,HYNEN A L,et al.Explosive cell lysis as a mechanism for the biogenesis of bacterial membrane vesicles and biofilms[J].Nature Communications,2016,7:11220.
[21] RENELLI M,MATIAS V,LO R Y,et al.DNA-containing membrane vesicles of Pseudomonas aeruginosa PAO1 and their genetic transformation potential[J].Microbiology,2004,150(Pt 7):2161-2169.
[22] IM H,LEE S J,SOPER S A,et al.Staphylococcus aureus extracellular vesicles (EVs):surface-binding antagonists of biofilm formation[J].Molecular BioSystems,2017,13(12):2704-2714.
[23] YONEZAWA H,OSAKI T,KURATA S,et al.Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation[J].BMC Microbiology,2009,9(1):1-12.
[24] FREDRIKSEN J H,ROSENQVIST E,WEDEGE E,et al.Production, characterization and control of MenB-vaccine “Folkehelsa”:an outer membrane vesicle vaccine against group B meningococcal disease[J].NIPH Ann,1991,14(2):67-79.
[25] GONZ LEZ-MACHADO C,CAPITA R,RIESCO-PEL
LEZ-MACHADO C,CAPITA R,RIESCO-PEL EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
[26] REMIS J P,WEI D G,GORUR A,et al.Bacterial social networks:structure and composition of Myxococcus xanthus outer membrane vesicle chains[J].Environmental Microbiology,2014,16(2):598-610.
[27] KIM Y S,CHOI E J,LEE W H,et al.Extracellular vesicles, especially derived from Gram-negative bacteria, in indoor dust induce neutrophilic pulmonary inflammation associated with both Th1 and Th17 cell responses[J]. Clin Exp Allergy,2013,43(4):443-454.
[28] SCHWECHHEIMER C,KUEHN M J.Outer-membrane vesicles from gram-negative bacteria:biogenesis and functions[J].Nature Reviews Microbiology,2015,13(10):605-619.
[29] FRECKELTON M L,NEDVED B T,CAI Y S,et al.Bacterial lipopolysaccharide induces settlement and metamorphosis in a marine larva[J].Proceedings of the National Academy of Sciences of the United States of America,2022,119(18): e2200795119.
[30] WANG J S,ZHANG W,WANG X Y,et al.Mussel settlement mediated by bacterial VgrG proteins via extracellular outer membrane vesicles[J].International Biodeterioration &Biodegradation,2023,180:105595.
[31] LI C F,ZHU L F,WANG D D,et al.T6SS secretes an LPS-binding effector to recruit OMVs for exploitative competition and horizontal gene transfer[J].The ISME Journal,2022,16(2):500-510.
[32] BAUMGARTEN T,SPERLING S,SEIFERT J,et al.Membrane vesicle formation as a multiple-stress response mechanism enhances Pseudomonas putida DOT-T1E cell surface hydrophobicity and biofilm formation[J].Applied and Environmental Microbiology,2012,78(17):6217-6224.
[33] GUERRERO-MANDUJANO A,HERN NDEZ-CORTEZ C,IBARRA J A,et al.The outer membrane vesicles:secretion system type zero[J].Traffic,2017,18(7):425-432.
NDEZ-CORTEZ C,IBARRA J A,et al.The outer membrane vesicles:secretion system type zero[J].Traffic,2017,18(7):425-432.
[34] KUMAR P,LEE J H,BEYENAL H,et al.Fatty acids as antibiofilm and antivirulence agents[J].Trends in Microbiology,2020,28(9):753-768.
[35] HU X M,ZHANG J B,DING W Y,et al.Reduction of mussel metamorphosis by inactivation of the bacterial thioesterase gene via alteration of the fatty acid composition[J].Biofouling,2021,37(8):911-921.