半滑舌鳎(Cynoglossus semilaevis)是一种暖温带大型底栖鱼类,常年分布于中国渤海和黄海海区[1-2]。因其体质量增长快、肉质细腻和营养价值高,深受消费者喜爱[3]。近年来,随着养殖规模的高度集约化和养殖环境的恶化,半滑舌鳎病害频发。体表溃疡综合症、烂鳍烂尾病和腹水病是当前半滑舌鳎养殖中主要的流行性疾病,在这些病例中常分离出细菌性病原,如创伤弧菌(Vibrio vulnificus)[4]、哈维氏弧菌(V.harveyi)[5]、鳗弧菌(V.anguillarum)[6]和副溶血性弧菌(V. parahaemolyticus)[7]等。
维罗纳假单胞菌(Pseudomonas veronii)是革兰氏阴性杆菌,属于假单胞菌属,该菌主要分布于土壤表面、水体中及动植物体内,具有较强的环境适应力,可用于污染土壤的生物修复等方面[8-9]。牟新涛等[10]和刘波等[11]分别对从植物及土壤中分离出的维罗纳假单胞菌进行了相关研究,并结合细菌的生物学特性解释了该细菌在环境中发生的重要变化。胡秀彩等[12]从鲫鳃中分离到一株维罗纳假单胞菌,但该细菌的生理生态学功能有待进一步研究。目前,关于维罗纳假单胞菌的致病性研究尚未见报道。
2020年天津某养殖场水产养殖生产过程中,半滑舌鳎出现死亡情况,死亡率为10%左右,患病鱼症状表现为掉鳞、充血和皮肤溃烂等。为确定患病半滑舌鳎发病原因,从病鱼内脏器官中分离出优势菌株,通过16S rRNA基因测序、生理生化鉴定、药敏试验和生长曲线测定对分离菌株进行分类地位鉴定和生物学特征分析,并利用人工感染试验和组织病理学观察研究分离菌株对半滑舌鳎的致病性,以期为该鱼维罗纳假单胞菌病的防控提供参考。
1 材料与方法
1.1 材料
患病半滑舌鳎体质量为20~40 g,体长为15~23 cm,取自天津市某海水养殖场。健康半滑舌鳎体质量为(20±5)g,体长为(17±2)cm,购自天津市海升水产养殖有限公司,在水温23 ℃、pH 7.5和盐度20的饲养条件下,暂养14 d后进行人工感染试验。
主要试剂:微量生化管和营养琼脂均购自杭州天合微生物试剂有限公司;铜绿假单胞菌(ATCC10145)和荧光假单胞菌(ATCC13525)购自北纳生物培养库;抗生素药敏纸片购自北京索莱宝科技有限公司;PCR试剂、pMD18-T和大肠杆菌DH5ɑ感受态细胞均购自宝生物工程(大连)有限公司;细菌DNA提取试剂盒、DNA凝胶提取试剂盒和16S rRNA基因引物均购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 细菌的分离与纯化 首先对半滑舌鳎病鱼样品进行显微观察,未发现有寄生虫。病鱼体表杀菌消毒之后,用无菌解剖器对患病鱼进行解剖,取其肝脏组织,无菌划线接种于2216E固体培养基,30 ℃下恒温培养24 h后,挑取形状、颜色一致的单个菌落进行分离纯化,重复划线接种培养2~3次,获得纯培养的菌株。将纯化的菌株接种于2216E液体培养基中扩大培养后,加入甘油至终体积分数为15%,保存于-80 ℃超低温冰箱中。
1.2.2 生理生化试验 对分离纯化的单个菌落进行革兰氏染色,染色后在显微镜下观察。将分离菌株接种于微生物生化管中,30 ℃下培养48 h,观察并记录。
1.2.3 16S rRNA序列分析 使用细菌DNA提取试剂盒提取分离菌的DNA模板[13-14],以细菌通用引物进行16S rRNA基因的PCR扩增。引物序列如下:27F(5′AGAGTTTGATCATGCTCAG 3′),1492R(5′GGTACCTTGTGTACGACTT 3′)。PCR反应体系(共50 μL):2×Taq DNA聚合酶25 μL,上、下游引物各1 μL,模板2 μL,超纯水21 μL。PCR扩增程序:95 ℃下预变性4 min;94 ℃下变性1 min,55 ℃下退火1 min,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延长10 min。扩增产物经10 g/L琼脂糖凝胶电泳检测,阳性产物送生工生物工程(上海)股份有限公司进行测序。将所测分离菌的16S rRNA基因序列在NCBI数据库中进行BLAST同源性比对。使用MEGA 7.0软件构建系统进化树。
1.2.4 人工感染试验 取健康半滑舌鳎60尾,随机分为6组,每组10尾。 采用平板计数法确定原菌悬液浓度,并分别将菌液稀释为3.3×109、3.3×108、3.3×107、3.3×106、3.3×105 CFU/mL 5个浓度,浸泡感染半滑舌鳎4 h,对照组鱼用无菌生理盐水浸泡。试验期间连续充氧,水温保持在23 ℃,每天观察记录试验鱼发病和死亡情况,连续观察14 d,濒死鱼在无菌条件下进行病原菌分离鉴定。
1.2.5 组织病理学观察 分别取病鱼鳃、肠道、肝脏和脾脏组织置于Bouin氏固定液中,室温下固定8~12 h。然后脱水、浸蜡、包埋、切片和苏木素-伊红染色,风干后在光学显微镜下观察并拍照。
1.2.6 药敏试验 采用标准K-B纸片扩散法[15]对分离菌株进行32种抗菌药物的敏感性检测,采用涂布法接种分离菌株于2216E固体培养基上,30 ℃下培养24 h后测量抑菌圈直径,试验设3个平行并取其平均值。根据药敏纸片说明书,判定分离菌株的耐药程度。
1.2.7 生长曲线的测定 为测定菌株CLPV-114在不同温度(32、37、42 ℃)、pH(5、6、7、8、9)和氯化钠质量浓度(20、30、50 mg/L)下的生长情况,制备了基础性海洋细菌培养基MBM(配方为胰蛋白胨10 g/L+酵母提取物5 g/L+磷酸铁0.01 g/L,均为质量浓度)。用1 mol/L氢氧化钠或1 mol/L盐酸将培养基的pH调节到不同试验值。将纯培养的菌液按照1%接种量接种到基础培养基MBM中,分别置于不同温度的摇床中培养28 h,每组设3个平行,每隔2 h测定一次OD600 nm值,取其平均值作为最终结果。以培养时间为横坐标、OD600 nm为纵坐标绘制生长曲线。
2 结果与分析
2.1 生理生化鉴定
从患病半滑舌鳎肝脏分离出的病原菌在2216E固体培养基上生长,形成半透明、圆形、表面光滑、边缘完整、直径为(1.0±0.2)mm的淡黄色菌落。革兰氏染色结果显示,该分离菌株为革兰氏阴性菌,形态呈杆状。将分离菌株命名为CLPV-114。生理生化试验显示,该菌株在42 ℃下生长,在4 ℃下不生长,分离菌株的硝酸盐还原和甲基红试验结果为阳性,V-P试验和ONPG试验结果为阴性,可水解阿拉伯糖、木糖、甘露糖、蔗糖、山梨醇和肌醇,可利用葡萄糖产酸,可产生精氨酸双水解酶、苯丙氨酸转氨酶、氧化酶和丙二酸盐(表1)。
表1 CLPV-114菌株的生理生化鉴定结果
Tab.1 Physiological and biochemical characteristics of strain CLPV-114

注:+表示结果为阳性;—表示结果为阴性;nd表示结果不确定。
Note:+,positive;—,negative;nd,not determined.
试验项目test item菌株CLPV-114菌株AF064460菌株 ATCC13525菌株ATCC10145革兰氏染色 gram reaction————氧化酶 oxidase++++甲基红试验 methyl red test+nd+-V-P试验 V-P test—nd——精氨酸双水解酶 arginine dihydrolase++++硝酸盐还原 nitrate reductase++—+苯丙氨酸转氨酶phenylalanine aminotransferase++——丙二酸盐 malonate++—+木糖 xylose+++—阿拉伯糖 arabinose+++—甘露糖 mannose+++—ONPG试验ONPG test—+——蔗糖 sucrose++——山梨醇 sorbitol+++—肌醇 inositol++——葡萄糖 glucose++++4 ℃生长growth at 4 ℃—nd+—42 ℃生长growth at 42 ℃+nd—+
2.2 16S rRNA序列分析
扩增得到菌株CLPV-114的16S rRNA序列长度为1 500 bp(图1),其GenBank登录号为MF457898,并与NCBI数据库中的现有序列进行了比对。结果发现,分离菌株CLPV-114与GenBank 登录号分别为AF064460、AY144583的维罗纳假单胞菌的一致性较高,分别为99.47%和99.51%。系统发育进化树显示,菌株CLPV-114与维罗纳假单胞菌自然聚为一支(图2)。
M—2 000 ladder marker;1—PCR产物。
M—2 000 ladder marker;1—PCR product.
图1 分离菌株CLPV-114 的PCR电泳产物
Fig.1 PCR electrophoresis products of strain CLPV-114
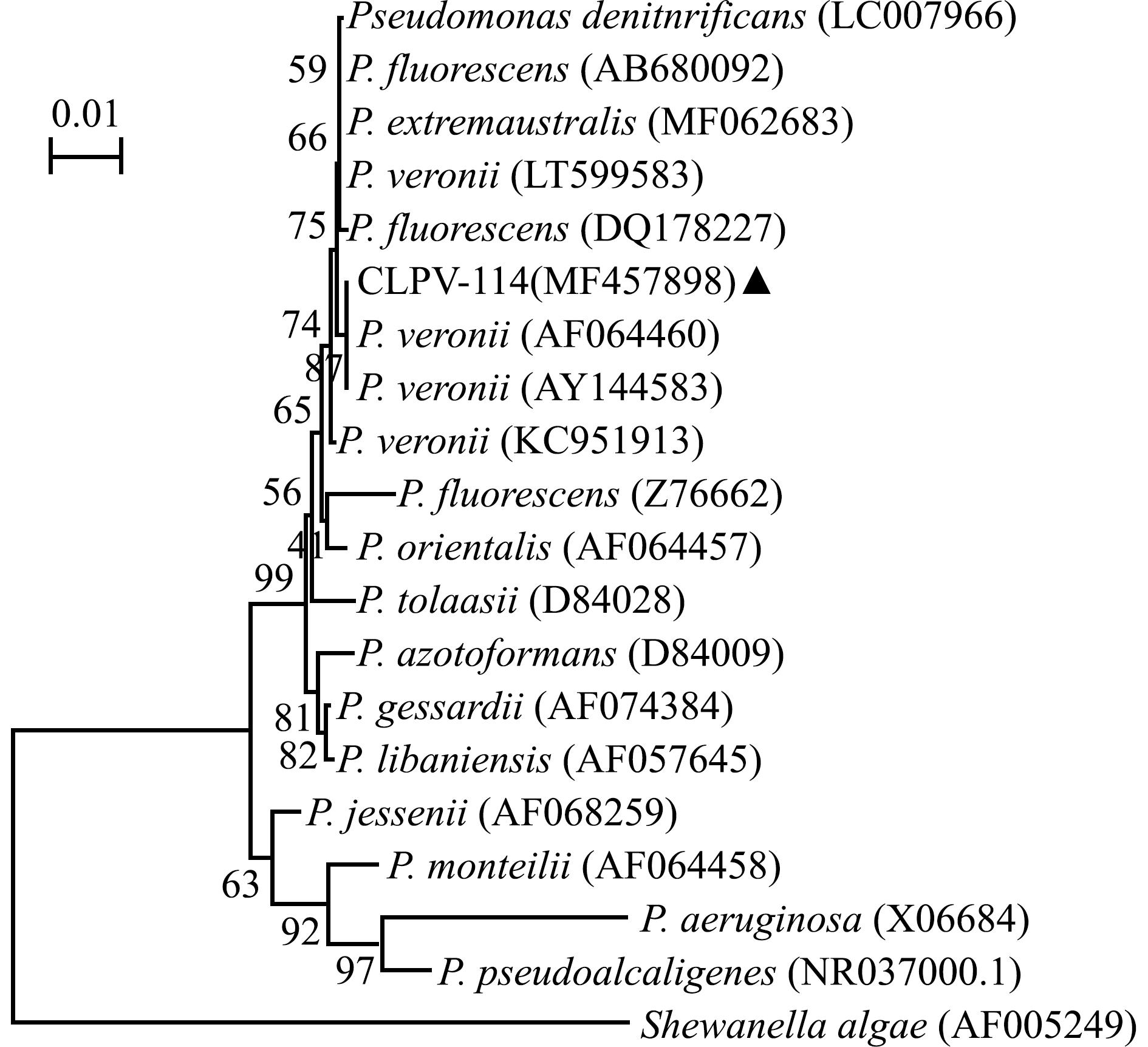
图2 基于菌株16S rRNA序列构建的系统进化树
Fig.2 Phylogenetic tree constructed based on 16S rRNA sequences of strains
综合生理生化特征和16S rRNA基因序列分析,鉴定CLPV-114菌株为维罗纳假单胞菌。
2.3 人工感染试验
人工感染半滑舌鳎的主要症状与自然发病的半滑舌鳎症状基本一致,主要表现为鱼体反应较迟钝、大面积体表掉鳞和鳍条基部充血(图3)。分别用浓度为3.3×109、3.3×108、3.3×107、3.3×106、3.3×105 CFU/mL的CLPV-114菌液浸泡感染4 h后,半滑舌鳎的死亡率分别为100%、60%、30%、20%和10%,对照组在试验期间无病理变化和死亡现象(表2)。采用BLISS法计算得知,CLPV-114菌株对半滑舌鳎的半数致死剂量(LD50)为1.3×107 CFU/mL。

▼表示体表鳞片脱落;↑表示鳍条基部充血。
▼,exfoliation of body surface scales;↑,hyperemia at thebase of the fins.
图3 半滑舌鳎自然患病临床症状与人工感染发病症状
Fig.3 Clinical symptoms of naturally diseased and artificially infected Cynoglossus semilaevis
表2 人工感染试验
Tab.2 Results of artificial infection
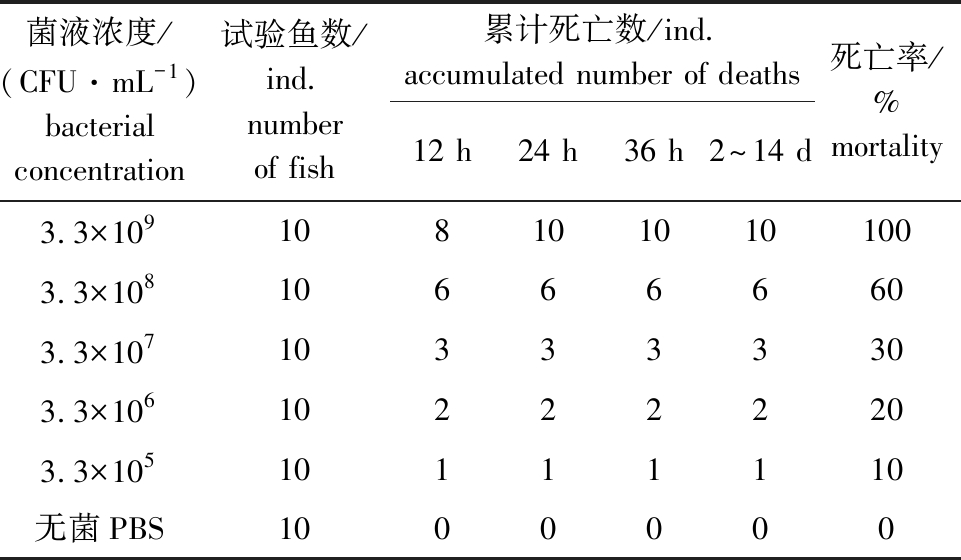
菌液浓度/(CFU·mL-1)bacterial concentration试验鱼数/ind.number of fish累计死亡数/ind.accumulated number of deaths12 h24 h36 h2^14 d死亡率/%mortality3.3×1091081010101003.3×108106666603.3×107103333303.3×106102222203.3×10510111110无菌PBS1000000
2.4 组织病理学观察
组织病理学观察显示,人工感染半滑舌鳎各组织器官均有不同程度的病理改变。其中,鳃丝血管中心充血,炎性细胞浸润(图4A);肠黏膜层与固有层分开、出血和肠绒毛脱落(图4B);肝细胞核固缩、组织坏死,肝脏中观察到外渗血液(图4C);脾脏出血,含铁血黄素沉积(图4D)。
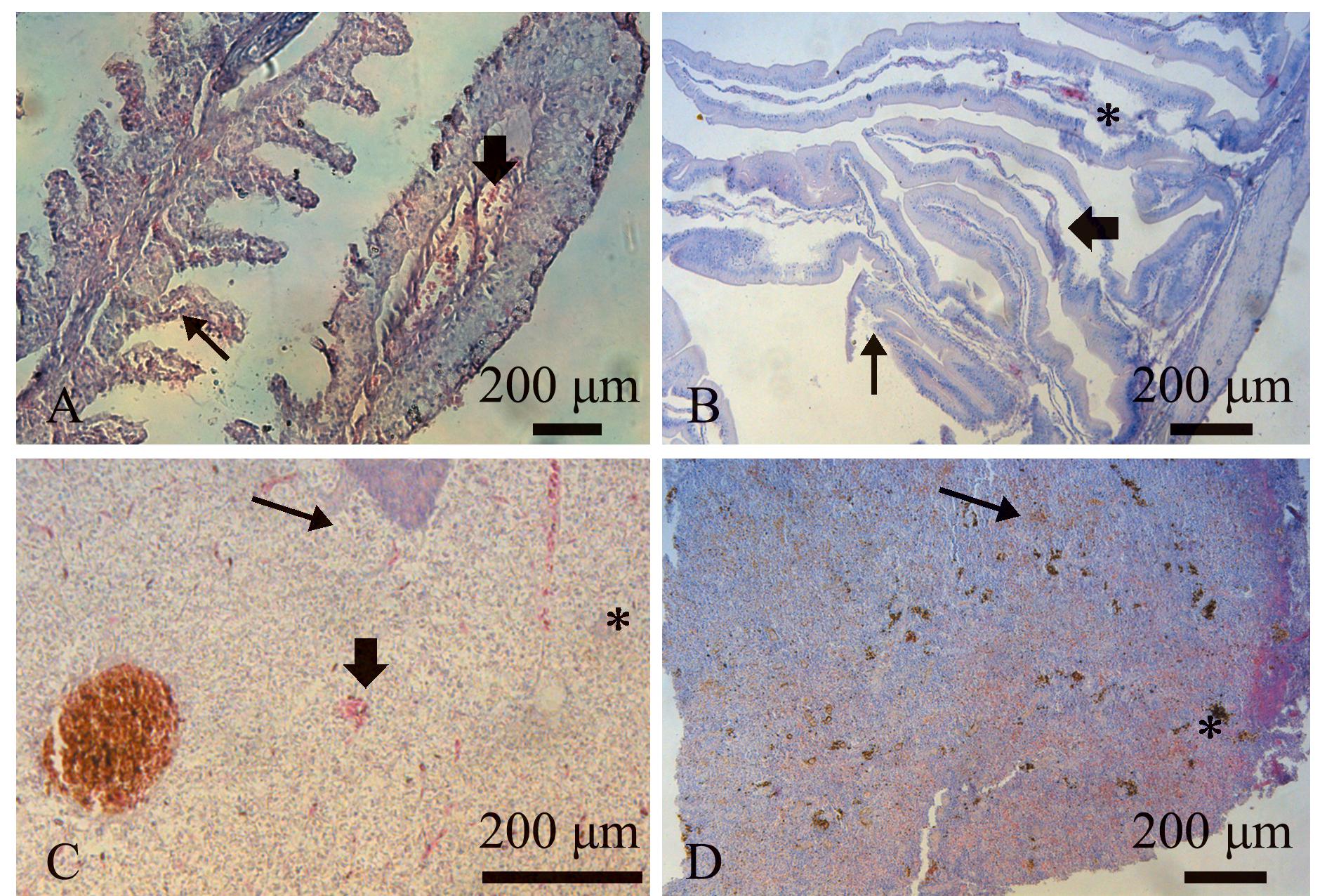
A—鳃丝中心血管充血( ),炎细胞浸润(↑);B—固有层塌陷(
),炎细胞浸润(↑);B—固有层塌陷( ),肠绒毛脱落(↑),出血(*);C—出血(
),肠绒毛脱落(↑),出血(*);C—出血( ),细胞核固缩(→),组织坏死(*);D—含铁血黄素沉积(*),出血(→)。
),细胞核固缩(→),组织坏死(*);D—含铁血黄素沉积(*),出血(→)。
A—dilatation and vascular congestion in the central filament vessel( ),inflammatory cell infiltration(↑);B—enlargement of the glomerular capsule(
),inflammatory cell infiltration(↑);B—enlargement of the glomerular capsule( ),disappearance of glomerular structure(↑),hemorrhage(*);C—hemorrhage(
),disappearance of glomerular structure(↑),hemorrhage(*);C—hemorrhage( ),nuclear pyknosis(→),focal necrosis(*);D—hemosiderin deposition(*),hemorrhage(→).
),nuclear pyknosis(→),focal necrosis(*);D—hemosiderin deposition(*),hemorrhage(→).
图4 半滑舌鳎感染CLPV-114菌株后的组织病理学观察
Fig.4 Pathohistological observation of Cynoglossus semilaevis infected with the strain CLPV-114
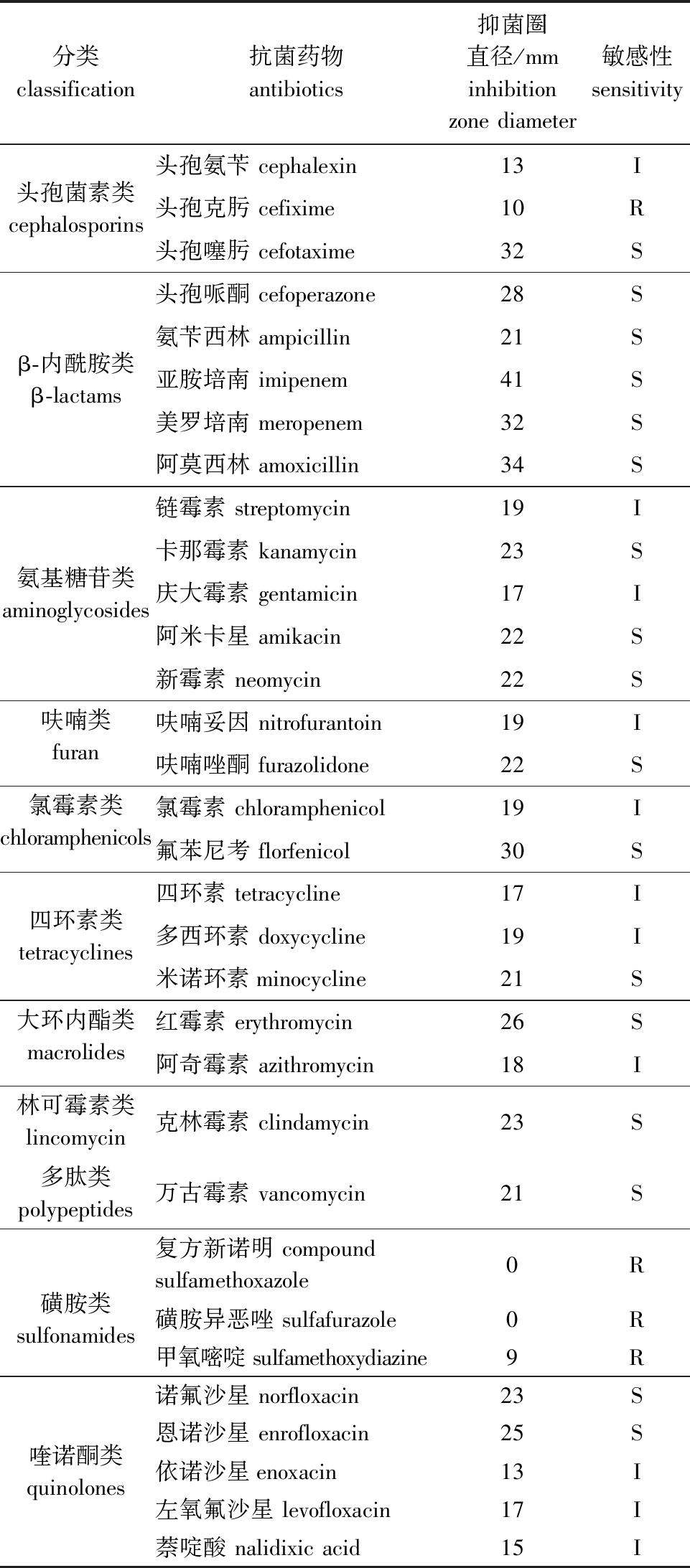
2.5 药敏试验
采用药敏纸片法测定分离菌CLPV-114对32种抗菌药物的敏感性。结果表明,CLPV-114菌株对阿莫西林、氨苄西林、头孢哌酮、亚胺培南和氟苯尼考等17种药物高度敏感,对呋喃妥因、氯霉素、阿奇霉素、四环素和庆大霉素等11种药物中度敏感,对头孢克肟、磺胺异恶唑、复方新诺明和甲氧嘧啶4种药物耐药(表3)。
表3 药敏试验结果
Tab.3 Results of drug sensitivity test
注:S—高度敏感;I—中度敏感;R—耐药。
Note:S—sensitivity;I—intermediary;R—resistant.
分类classification 抗菌药物antibiotics抑菌圈直径/mminhibition zone diameter敏感性sensitivity头孢氨苄 cephalexin13I头孢菌素类 cephalosporins头孢克肟 cefixime10R头孢噻肟 cefotaxime32S头孢哌酮 cefoperazone28S氨苄西林 ampicillin21Sβ-内酰胺类 β-lactams亚胺培南 imipenem41S美罗培南 meropenem32S阿莫西林 amoxicillin34S链霉素 streptomycin19I卡那霉素 kanamycin23S氨基糖苷类 aminoglycosides庆大霉素 gentamicin17I阿米卡星 amikacin22S新霉素 neomycin22S呋喃类 furan呋喃妥因 nitrofurantoin19I呋喃唑酮 furazolidone22S氯霉素类 chloramphenicols氯霉素 chloramphenicol19I氟苯尼考 florfenicol30S四环素 tetracycline17I四环素类 tetracyclines多西环素 doxycycline19I米诺环素minocycline21S大环内酯类 macrolides红霉素 erythromycin26S阿奇霉素 azithromycin18I林可霉素类 lincomycin克林霉素 clindamycin23S多肽类 polypeptides万古霉素 vancomycin21S复方新诺明 compound sulfamethoxazole0R磺胺类 sulfonamides磺胺异恶唑 sulfafurazole0R甲氧嘧啶 sulfamethoxydiazine9R诺氟沙星 norfloxacin23S恩诺沙星 enrofloxacin25S喹诺酮类 quinolones依诺沙星enoxacin13I左氧氟沙星 levofloxacin17I萘啶酸 nalidixic acid15I
2.6 CLPV-114菌株的生长特性
从图5(a)可见:在37 ℃下培养,6~18 h内的维罗纳假单胞菌CLPV-114生长速率最快,终密度最高;在42 ℃下菌株生长受到抑制,且终密度相对较低。从图5(b)可见:当pH为7时,培养的维罗纳假单胞菌CLPV-114生长最旺盛,终密度最高;当pH为8时,细菌也有较高的密度,生长潜伏期略有延长;当pH分别为5、6、9时,细菌的生长始终处于潜伏期,密度基本保持不变。从图5(c)可见:培养的维罗纳假单胞菌CLPV-114在20~50 mg/L氯化钠浓度范围内均能生长,其中,在氯化钠质量浓度为30 mg/L时增殖最快,在氯化钠质量浓度为20、50 mg/L时生长略有抑制。维罗纳假单胞菌CLPV-114在最适条件下的生长曲线显示了细菌生长的4个不同阶段,分别为潜伏期(0~6 h)、对数增长期(6~12 h)、稳定期(12~24 h)和衰亡期(24 h后)(图5(d))。
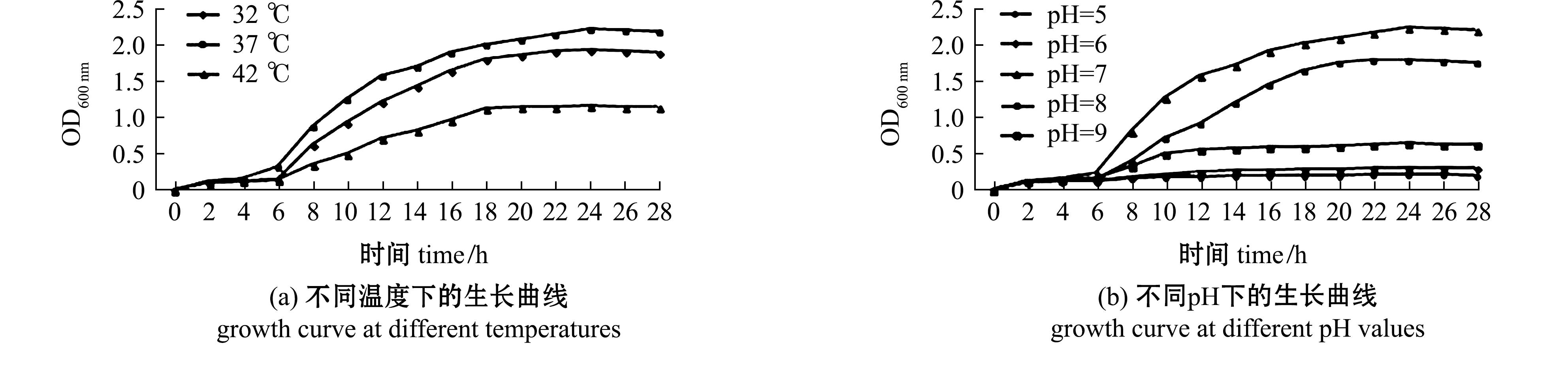
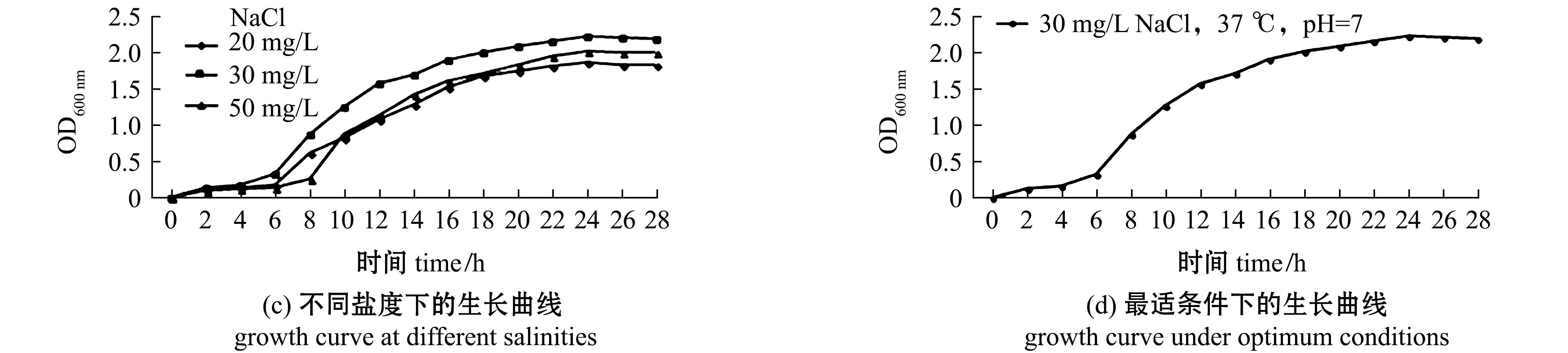
图5 分离菌株CLPV-114的生长特性
Fig.5 Growth characteristics of the isolate strain CLPV-114
3 讨论
3.1 维罗纳假单胞菌的分离鉴定
部分假单胞菌是水产动物和人类的条件性致病菌,其中,铜绿假单胞菌和荧光假单胞菌是目前已知会导致人和水生动物感染最常见的假单胞菌[16-18]。维罗纳假单胞菌是一种革兰氏阴性、杆状、荧光、可移动的细菌,最早从法国的天然泉水中分离出来[19]。根据16S rRNA序列分析,维罗纳假单胞菌曾被归入荧光假单胞菌属[20]。本研究中,从患病的半滑舌鳎中首次分离鉴定到维罗纳假单胞菌,该分离株CLPV-114具有还原硝酸盐的重要生化特性,该菌的生化特性与维罗纳假单胞菌(AF064460)模式菌株相似[21]。CLPV-114菌株的主要生化特性,包括在42 ℃能生长、在4 ℃不能生长,以及产生硝酸还原酶等生化特性,可以将其与荧光假单胞菌区分开来。本研究中,分离株的氧化酶产生、山梨醇发酵、蔗糖分解3项结果与胡秀彩等[12]结果不同,推测出现偏差可能与宿主来源、环境适应等因素有关。此外,系统发育分析显示,CLPV-114菌株与维罗纳假单胞菌的亲缘关系最近,自然聚为一支。综合生理生化特征和16S rRNA基因序列分析,鉴定CLPV-114菌株为维罗纳假单胞菌。
3.2 维罗纳假单胞菌的致病性
胡秀彩等[12]从鲫鳃中分离到一株维罗纳假单胞菌,但该细菌的生理生态学功能有待进一步研究。目前,尚未见有关于维罗纳假单胞菌致病性的相关报道。本研究中,人工感染CLPV-114分离株后,半滑舌鳎的临床症状与自然患病半滑舌鳎症状相似,CLPV-114菌株的LD50为1.3×107 CFU/mL,根据Santos等[22]的标准,该菌对半滑舌鳎具有中等毒性,能够引起广泛的组织病理学变化,这表明该菌株具有致病性。前期研究表明,温度、pH和氯化钠浓度变化会影响细菌的生长,并发现最佳的生长条件是氯化钠质量浓度为30 mg/L、pH为7~8、温度为0~50 ℃,且最适温度取决于地理条件[23-24],本研究结果与上述研究结果基本一致。从人工感染试验可以看出,感染CLPV-114菌液后的12 h内,半滑舌鳎开始大量死亡,而在24 h后不再死亡,说明CLPV-114菌株潜伏期短,可能与急性感染有关,特别是在过度拥挤或水质较差的养殖环境中,可能会对鱼类产生更强的致病性。
3.3 维罗纳假单胞菌的药物敏感性
目前,抗生素已被公认为是治疗水生动物疾病和由细菌感染引起的人类疾病的潜在选择[25]。本研究中,分离株CLPV-114对大部分抗生素敏感,包括β-内酰胺类、喹诺酮类、呋喃类、四环素类、氨基糖苷类和大环内酯类,但对磺胺类药物耐药。在养殖生产中,使用抗菌类药物来预防和治疗细菌性疾病是最简单和便捷的方法,也可以投喂一些增强机体免疫力的中草药[26]。药物敏感性试验对合理选择抗菌药物不仅具有重要的指导意义,而且能够避免因滥用抗生素导致的细菌耐药性增强。目前,尚未见维罗纳假单胞菌对抗生素的敏感性和耐药机制的有关报道,因此,本研究中的药敏结果可为维罗纳假单胞菌感染的水产动物选择治疗药物提供有益参考。在药物敏感性试验中有一些药物如氯霉素、红霉素等是水产养殖的禁用药,在生产实践中需要注意用药规范,合理用药。
4 结论
1)本研究中首次从患病半滑舌鳎体内分离到一株优势菌株CLPV-114,综合生理生化特征和16S rRNA序列分析,鉴定其为维罗纳假单胞菌。
2)分离菌株维罗纳假单胞菌对半滑舌鳎具有致病性,该菌株对头孢哌酮、卡那霉素和呋喃唑酮等9大类28种抗生素敏感,对磺胺类抗生素有耐药性。因此,生产实践中可合理选择药物用于维罗纳假单胞菌感染引起的水生动物疾病防治。
[1] HAN Z R,SUN J F,LV A J,et al.Isolation,identification and characterization of Shewanella algae from reared tongue sole,Cynoglossus semilaevis Günther[J].Aquaculture,2017,468:356-362.
[2] WANG Y Z,SUN J F,LV A J,et al.Histochemical distribution of four types of enzymes and mucous cells in the gastrointestinal tract of reared half-smooth tongue sole Cynoglossus semilaevis[J].Journal of Fish Biology,2018,92(1):3-16.
[3] CHEN Z Q,YAO Z X,LIN M,et al.Study on pathogen of skin ulcer disease of half-smooth tongue sole(Cynoglossus semilaevis)[J].Journal of Fisheries of China,2012,36(5):764.
[4] 刘亚婷.半滑舌鳎对创伤弧菌感染的免疫应答研究[D].保定:河北农业大学,2021.
LIU Y T.Immune response of half-smooth tongue sole to Vibrio vulnificus infection[D].Baoding:Hebei Agricultural University,2021.(in Chinese)
[5] 徐浩.基于转录组学的半滑舌鳎抗哈维氏弧菌相关基因的筛选及表达分析[D].上海:上海海洋大学,2019.
XU H.Screening and expression analysis of genes related to Vibrio harveyi resistance in Chinese tongue sole (Cynoglossus semilaevis) based on transcriptomics[D].Shanghai:Shanghai Ocean University,2019.(in Chinese)
[6] DU M,CHEN S L,LIU Y H,et al.MHC polymorphism and disease resistance to Vibrio anguillarum in 8 families of half-smooth tongue sole (Cynoglossus semilaevis)[J].BMC Genetics,2011,12:78.
[7] 李文悦,左志晗,张晶晶,等.半滑舌鳎溃疡病病原菌的分离、鉴定及其致病性分析[J].水产学报,2020,44(4):672-680.
LI W Y,ZUO Z H,ZHANG J J,et al.Isolation and identification of pathogens of ulcer disease in Cynoglossus semilaevis[J].Journal of Fisheries of China,2020,44(4):672-680.(in Chinese)
[8] SWAIN P,BEHURA A,DASH S,et al.Serum antibody response of Indian major carp,Labeo rohita to three species of pathogenic bacteria:Aeromonas hydrophila,Edwardsiella tarda and Pseudomonas fluorescens[J].Veterinary Immunology and Immunopathology,2007,117(1/2):137-141.
[9] NAM I H,CHANG Y S,HONG H B,et al.A novel catabolic activity of Pseudomonas veronii in biotransformation of pentachlorophenol[J].Applied Microbiology and Biotechnology,2003,62(2):284-290.
[10] 牟新涛,李永,李强军,等.三峡库区云阳县三种类型马尾松林微生物区系及优势种群分析Ⅱ.林地空气、叶面和树皮表面[J].林业科学研究,2010,23(5):762-769.
MOU X T,LI Y,LI Q J,et al.Analysis on microbial flora in three types of Pinus massoniana forests in Yunyang County of the Three Gorges Reservoir AreaⅡ.Microflora in woodland air,leaf and bark surface[J].Forest Research,2010,23(5):762-769.(in Chinese)
[11] 刘波,蓝江林,林营志,等.土壤甲胺磷抗性细菌种群特征脂肪酸生物标记的分析[J].生态毒理学报,2009,4(5):734-744.
LIU B,LAN J L,LIN Y Z,et al.Characteristics of PLFA biomarkers for acephatemet resistant bacteria isolated from the soils[J].Asian Journal of Ecotoxicology,2009,4(5):734-744.(in Chinese)
[12] 胡秀彩,边延峰,胡宏晓,等.鲫鱼鳃中维罗纳假单胞菌的分离与鉴定[J].西南农业学报,2014,27(1):439-441.
HU X C,BIAN Y F,HU H X,et al.Isolation and identification of Pseudomonas veronii from gills of crucian carp(Carassius carassius)[J].Southwest China Journal of Agricultural Sciences,2014,27(1):439-441.(in Chinese)
[13] CHENG Z W,SUN P F,JIANG Y F,et al.Kinetic analysis and bacterium metabolization of α-pinene by a novel identified Pseudomonas sp.strain[J].Journal of Environmental Sciences,2012,24(10):1806-1815.
[14] QUEIPO-ORTU O M I,DE DIOS COLMENERO J,MACIAS M,et al.Preparation of bacterial DNA template by boiling and effect of immunoglobulin G as an inhibitor in real-time PCR for serum samples from patients with brucellosis[J].Clinical and Vaccine Immunology:CVI,2008,15(2):293-296.
O M I,DE DIOS COLMENERO J,MACIAS M,et al.Preparation of bacterial DNA template by boiling and effect of immunoglobulin G as an inhibitor in real-time PCR for serum samples from patients with brucellosis[J].Clinical and Vaccine Immunology:CVI,2008,15(2):293-296.
[15] DE LA CUESTA-ZULUAGA J J,S NCHEZ-JIMÉNEZ M M,MART
NCHEZ-JIMÉNEZ M M,MART NEZ-GARRO J,et al.Identification of the virB operon genes encoding the type IV secretion system,in Colombian Brucella canis isolates[J].Veterinary Microbiology,2013,163(1/2):196-199.
NEZ-GARRO J,et al.Identification of the virB operon genes encoding the type IV secretion system,in Colombian Brucella canis isolates[J].Veterinary Microbiology,2013,163(1/2):196-199.
[16] BAUER A W,KIRBY W M M,SHERRIS J C,et al.Antibiotic susceptibility testing by a standardized single disk method[J].American Journal of Clinical Pathology,1966,45:493-496.
[17] ROSSOLINI G M,MANTENGOLI E.Treatment and control of severe infections caused by multiresistant Pseudomonas aeruginosa[J].Clinical Microbiology and Infection:the Official Publication of the European Society of Clinical Microbiology and Infectious Diseases,2005,11(sup 4):17-32.
[18] HIRAKAWA Y,SASAKI H,KAWAMOTO E,et al.Prevalence and analysis of Pseudomonas aeruginosa in chinchillas[J].BMC Veterinary Research,2010,6:52.
[19] GAIKWAD V J.Antibacterial targets in Pseudomonas aeruginosa[J].International Journal of Pharmaceutics,2011,2(3):159-164.
[20] ELOMARI M,COROLER L,HOSTE B,et al.DNA relatedness among Pseudomonas strains isolated from natural mineral waters and proposal of Pseudomonas veronii sp.nov[J].International Journal of Systematic Bacteriology,1996,46(4):1138-1144.
[21] ANZAI Y,KIM H,PARK J Y,et al.Phylogenetic affiliation of the pseudomonads based on 16S rRNA sequence[J].International Journal of Systematic and Evolutionary Microbiology,2000,50:1563-1589.
[22] SANTOS Y,TORANZO A E,BARJA J L,et al.Virulence properties and enterotoxin production of Aeromonas strains isolated from fish[J].Infection and Immunity,1988,56(12):3285-3293.
[23] AUGUSTIN J C,CARLIER V.Modelling the growth rate of Listeria monocytogenes with a multiplicative type model including interactions between environmental factors[J].International Journal of Food Microbiology,2000,56(1):53-70.
[24] SALLAM K I.Antimicrobial and antioxidant effects of sodium acetate,sodium lactate,and sodium citrate in refrigerated sliced salmon[J].Food Control,2007,18(5):566-575.
[25] KOKOU F,SASSON G,MIZRAHI I,et al.Antibiotic effect and microbiome persistence vary along the European seabass gut[J].Scientific Reports,2020,10:10003.
[26] 吴亚楠,柳鹏,李强,等.复方中草药对仿刺参免疫力和抗病力的影响[J].大连海洋大学学报,2011,26(4):338-343.
WU Y N,LIU P,LI Q,et al.Effects of a compound Chinese herbal medicine on immunity and disease resistance in sea cucumber Apostichopus japonicus[J].Journal of Dalian Ocean University,2011,26(4):338-343.(in Chinese)