鱼类对水环境的温度变化很敏感,大多数鱼类都有适宜生存的温度范围,当水温低于鱼类耐受范围时,低温胁迫会直接影响其生长、代谢和繁殖,甚至造成鱼类死亡[1-3]。据报道,冬季寒流的侵袭会使黄姑鱼(Nibea albiflora)和罗非鱼(Oreochromis mossambicus)等经济鱼类大规模死亡,造成巨大的经济损失[4]。因此,研究鱼类低温耐受机制在水产养殖和种质资源保护方面具有重要的意义。
斑马鱼(Danio rerio)属于广温性鱼类,能够耐受低至6 ℃或超过38 ℃的季节性温度波动,还可以在低温(8 ℃)中短期生存,较适合成为鱼类低温耐受机制研究的模型[5]。低温胁迫会刺激鱼的机体产生大量活性氧(ROS),如果不及时清除会打破氧化和抗氧化平衡,造成生物体氧化损伤[2],而少量ROS作为信号分子可在免疫和代谢中起到重要作用[1]。正常情况下,抗氧化系统能够将鱼机体内的ROS维持在较低水平。在鱼类抗氧化系统中发挥重要作用的酶,主要包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)[2]。另有研究发现,过量的ROS会诱导鱼类启动细胞凋亡[6]。短期低温胁迫通过机体细胞凋亡的级联反应来清除受损细胞,以维持内环境的稳定和正常生理活动[6]。凋亡细胞如果不能被吞噬细胞及时清除,就会导致凋亡细胞大量积累,最终引起组织结构和功能的损害[7]。
Caspase家族在细胞凋亡中起到关键作用,其中,Caspase3介导的信号传递途径存在于绝大多数的细胞凋亡反应过程中[8]。低温会诱导青鳉(Oryzias latipes)鳃组织发生细胞凋亡[9];军曹鱼(Rachycentron canadum)和斜带石斑鱼(Epinephelus coioides)的细胞凋亡途径受到低温的调控,从而引起caspase家族、bcl-2(B-cell lymphoma-2)、bax(bcl-2-associated X)等凋亡基因表达发生变化[10-11]。
因此,检测氧化、抗氧化和细胞凋亡的相关指标能够反映鱼类低温耐受能力。
组蛋白去乙酰化酶8(histone deacetylase 8,HDAC8)可特异性调控组蛋白和非组蛋白赖氨酸残基乙酰化状态[12]。有研究表明,HDAC8在包括巨噬细胞在内的多种免疫细胞的分化、激活和凋亡中发挥了作用[13]。HDAC8负向调控转录bcl-2家族,干扰bcl-2修饰因子(bcl-2 modifying factor,BMF),从而影响结肠癌细胞凋亡[14]。HDAC8的抑制会导致T细胞淋巴瘤中线粒体细胞色素C释放和caspase3的激活,促进细胞凋亡[15]。在肝癌细胞中也发现,敲降hdac8会影响细胞增殖和凋亡,引起细胞凋亡途径中bax的上调[16]。在低温驯化斑马鱼成纤维(ZF4)细胞的RNA-seq数据中发现,hdac8的转录水平显著降低[17],这提示hdac8可能与低温相关。随后李飞[18]敲降了ZF4细胞的hdac8,发现caspase3表达水平显著上调,促进了细胞凋亡。然而,hdac8是否会通过细胞凋亡参与鱼类低温耐受机制尚不清楚。
本研究中探究了敲除hdac8基因对斑马鱼低温耐受能力的影响,首先检测野生型(WT)和hdac8基因敲除(hdac8-/-)斑马鱼在低温下的半数致死时间(the median lethal time,LT50);接着对低温胁迫下WT和hdac8-/-斑马鱼的鳃丝、肝脏及骨骼肌切片进行HE染色并观察组织结构损伤;然后在28 ℃和8 ℃下,检测了WT和hdac8-/-斑马鱼ROS、丙二醛(MDA)及三磷酸腺苷酶(ATP)的含量;最后通过实时荧光定量PCR(RT-qPCR),检测了抗氧化相关基因(sod、cat和gpx)和凋亡相关基因(caspase3、caspase9、bcl-2、bax和bcl-2/bax)在低温胁迫下转录水平的变化,以期为鱼类低温耐受机制的研究提供数据参考。
1 材料与方法
1.1 材料
试验鱼:上海海洋大学水产种质资源发掘与利用教育部重点实验室已成功构建hdac8-/-斑马鱼模型[19]。WT和hdac8-/-斑马鱼养殖在曝气处理的循环水中,水温稳定在(28±1)℃,pH为7.0~7.8。照明系统按照14 h光周期和10 h暗周期交替进行。
试剂:苏木素伊红(HE)染色试剂盒(E607318)购自生工生物工程(上海)股份有限公司;活性氧检测试剂盒(S0033S)、ATP检测试剂盒(S0026)购自上海碧云天生物技术有限公司;丙二醛检测试剂盒(A003-1)购自南京建成生物工程研究所;ClarityTM Western ECL Substrate显影液(17050601)购自Bio-Rad公司;NC膜0.45 μm(abs960)购自Abisn公司;HDAC8抗体(orb329785)购自Biorbyt公司;TRIzolTM Reagent(15596026)购自赛默飞世尔科技(中国)有限公司;TransScript® Uni All-One First-Strand cDNA Synthesis Super Mix for qPCR One-Step gDNA Removal(AU341)、Perfectstart® Green qPCR SuperMix(AQ601)购自全式金生物公司。
1.2 方法
1.2.1 低温耐受能力检测 取3月龄WT和hdac8-/-斑马鱼各20尾置于装有10 L循环水的鱼缸中,将鱼缸置于培养箱中,用渔网隔开鱼缸。依照Hu等[20]设计的逐级降温策略(图1),从28 ℃以1 ℃/h的速度缓慢降低到18 ℃并驯化12 h,再以0.5 ℃/h匀速降低到12 ℃并驯化12 h,最后以0.5 ℃/h匀速降到8 ℃。当斑马鱼出现失去平衡现象时,迅速捞出置于28 ℃循环水中,若不能恢复正常,即视为死亡,并记录死亡时间。半数致死时间指冷处理(8 ℃)开始至每组斑马鱼死亡一半的时间。
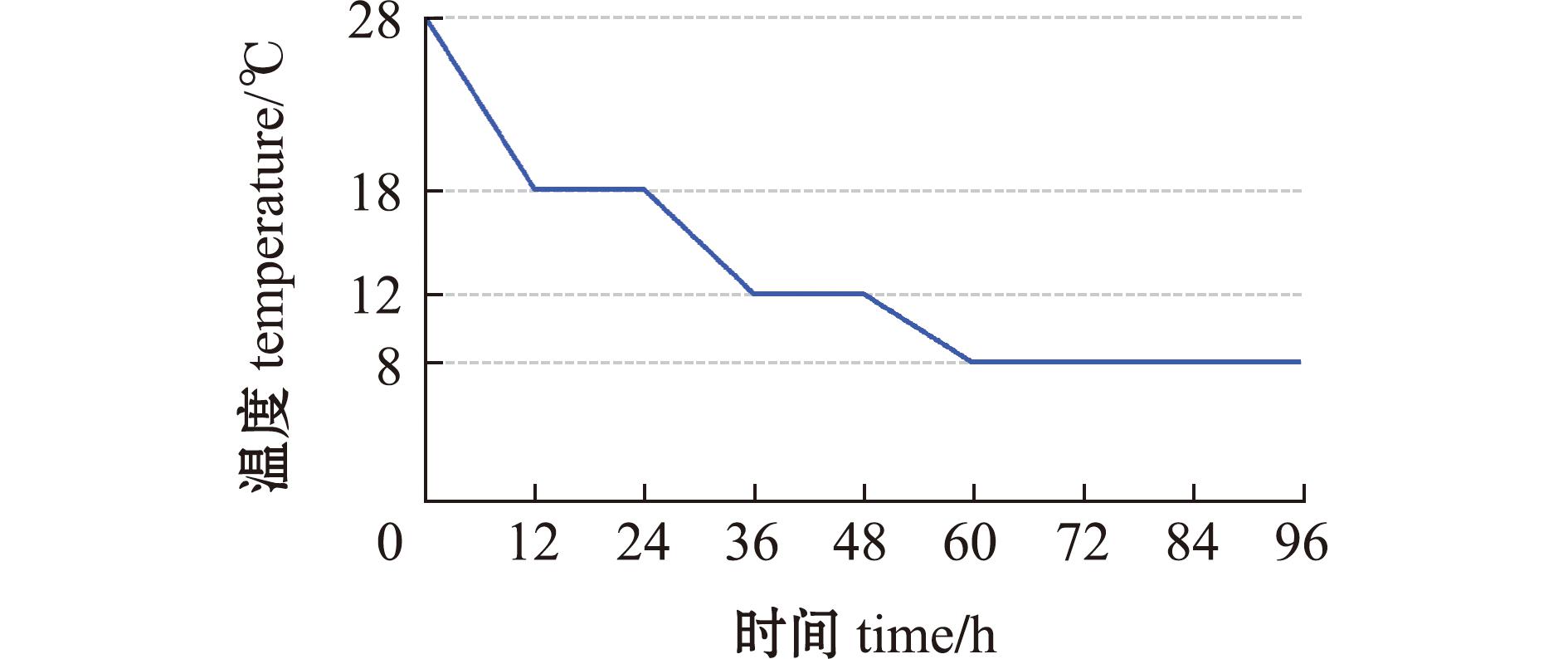
图1 降温策略
Fig.1 Cooling strategy
将10月龄的WT和hdac8-/-斑马鱼进行低温处理4 h,用质量浓度为168 mg/L麻醉剂(三卡因)麻醉,迅速转移到体式显微镜下解剖,取鳃丝、肝脏、肌肉和脑组织用于后续试验。
1.2.2 组织学分析 将鳃丝和肝脏用体积分数为4%的多聚甲醛在4 ℃下固定24 h;肌肉用体积分数为4%的多聚甲醛在4 ℃下固定48 h,置于梯度乙醇中脱水。经二甲苯透明后,进行石蜡包埋。将包埋材料进行横向连续切片,切片厚度为7 μm。使用苏木素伊红(HE)染色,中性树胶封片。
1.2.3 蛋白表达分析 将脑组织加入RIPA细胞裂解液研磨,超声提取总蛋白。用多功能酶标仪测定蛋白浓度后,用SDS-PAGE凝胶电泳(电泳程序设置为180 V,1 h)分离蛋白。将蛋白转移到NC膜(电泳程序设置为100 V,1 h)后,用封闭液封闭2 h。按照1∶2 000比例用封闭液稀释β-actin和HDAC8抗体,在4 ℃下摇床孵育过夜。用TBST清洗NC膜3次后,加入HRP标记的二抗稀释液(1∶2 000),在摇床上孵育2 h,再用TBST清洗3次。使用显影液化学发光(ECL)试剂盒显色后,在Amersham Imager 680下拍照检测。
1.2.4 氧化应激损伤相关指标检测 取斑马鱼全鱼,按照活性氧检测试剂盒(S0033S)和丙二醛检测试剂盒(A003-1)说明书方法检测ROS和MDA含量。取肌肉组织,按照ATP检测试剂盒(S0026)说明书检测ATP含量。
1.2.5 基因表达量分析 采用TRIzol法提取斑马鱼全鱼的总RNA,按照反转录试剂盒说明书合成cDNA。参考Wu等[21]方法设计抗氧化相关基因(sod、cat和gpx)引物;利用NCBI网站BLAST设计凋亡相关基因(caspase3、caspase9、bax和bcl-2)引物(表1)。以斑马鱼β-actin为内参,检测WT和hdac8-/-斑马鱼中抗氧化及凋亡相关基因的相对表达量,每个样品设置3个技术重复,采用2-ΔΔCt方法计算基因表达量[17]。
表1 试验引物及其序列
Tab.1 Primer sequences used in this study

基因 gene 引物序列 primer sequence(5′-3′)sodF: GGCCAACCGAT GTGTTAGAR: CCAGCGTTGCCAGTTTTTAGcatF: AGGGCAACTGGGATCTTACAR: TTTATGGGACCAGACCTTGGgpxF: ACCTGTCCGCGAAACTATTGR: TGACTGTTGTGCCTCAAAGCcaspase3F: GATCGCAGGACAGGCATGAAR: TGCGCAACTGTCTGGTCATTcaspase9F: TTCTTCAGCGGCACAGGTTAR: GTCTGGTTGCCTTGCTCTGTAbaxF: CAGGGTGGATGGGACGGAATR: TTGCGAATCACCAATGCTGTGbcl-2F: AATGGAGGTTGGGATGCCTTR: CCAAGCCGAGCACTTTTGTThdac8F: GGCTTATTGAAATACATGAGGGTCGR: CCACCGGACAGTCATAACCCβ-actionF: CTTTGAGCAGGAGATGGGAACCR: GATTCCATACCCAGGAAGG
1.3 数据处理
本试验中所有试验均设置3个样品重复,试验数据采用平均值±标准差(mean±S.D.)表示。采用Image J软件对Western blot试验结果进行定量分析;采用Origin软件对试验数据进行单因素方差分析(one-way ANOVA),采用Duncan 法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 敲除hdac8基因对斑马鱼低温耐受能力的影响
对WT 和 hdac8-/-斑马鱼进行低温(8 ℃)处理,检测其低温耐受能力。从图2可见:相较于WT斑马鱼,hdac8-/-斑马鱼的存活时间明显缩短,其LT50为14.5 h,而WT斑马鱼则为21.5 h;WT和hdac8-/-斑马鱼的体质量或体长与存活时间之间无显著相关性(P>0.05)。这表明,敲除hdac8基因降低了斑马鱼的低温耐受能力。
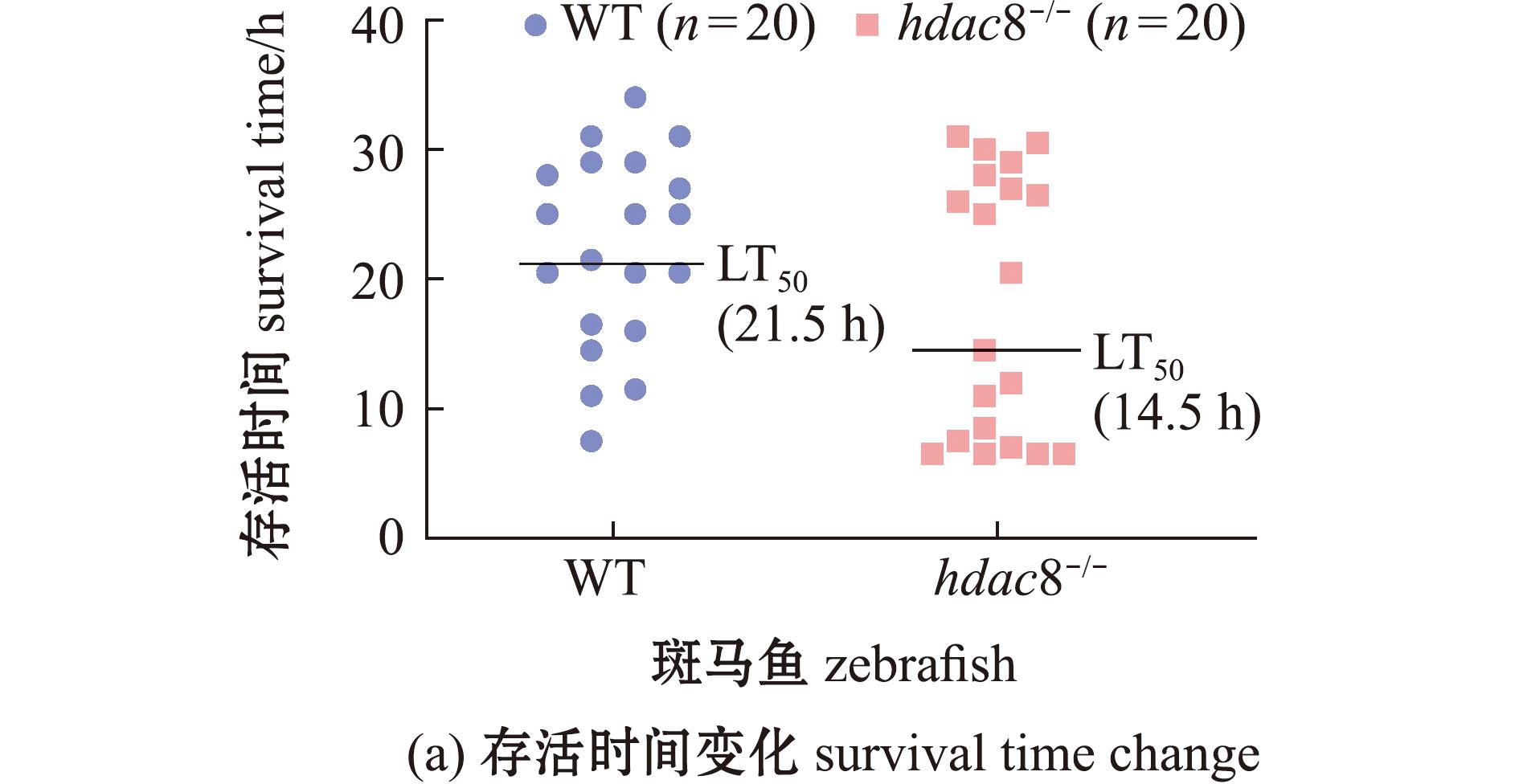
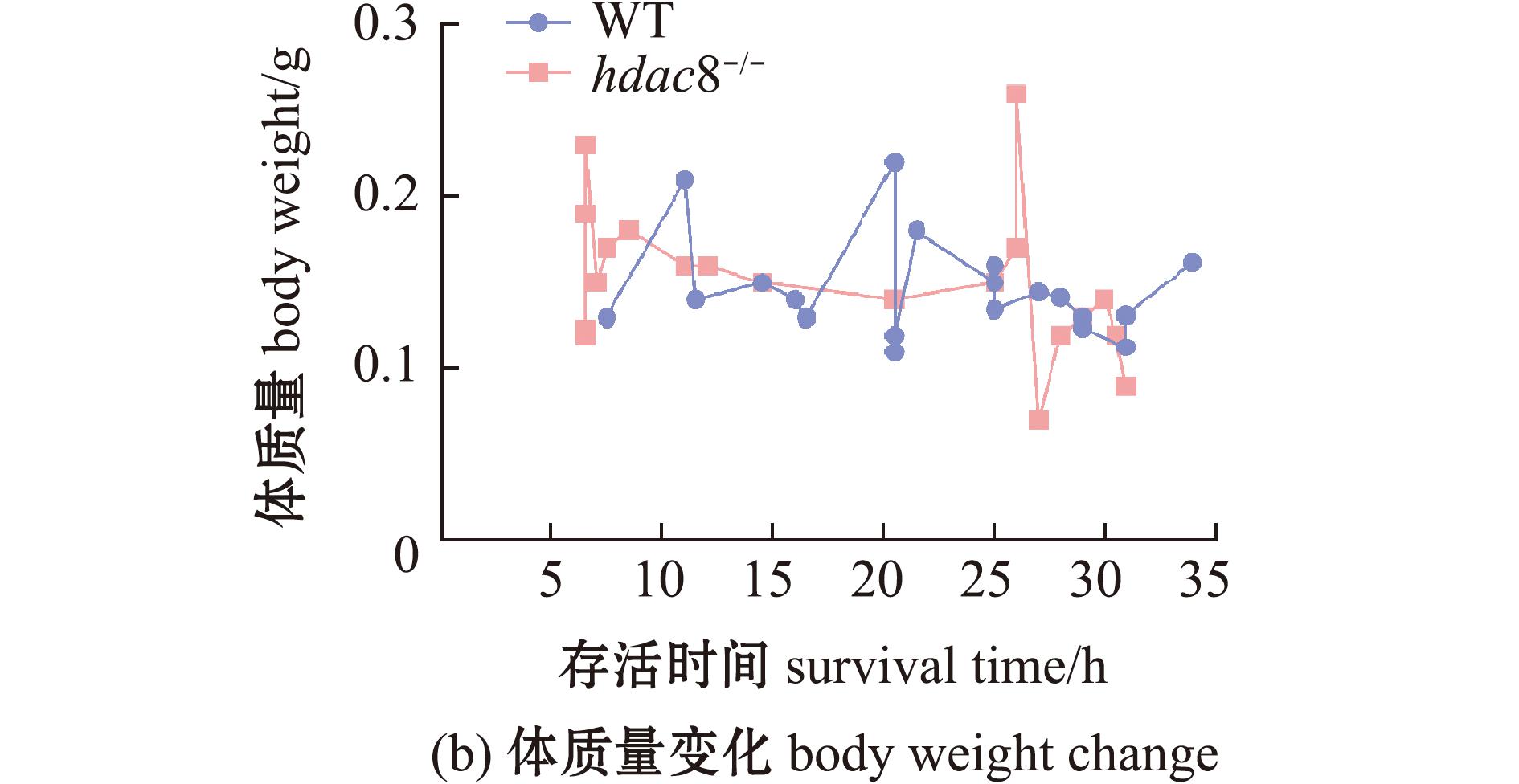
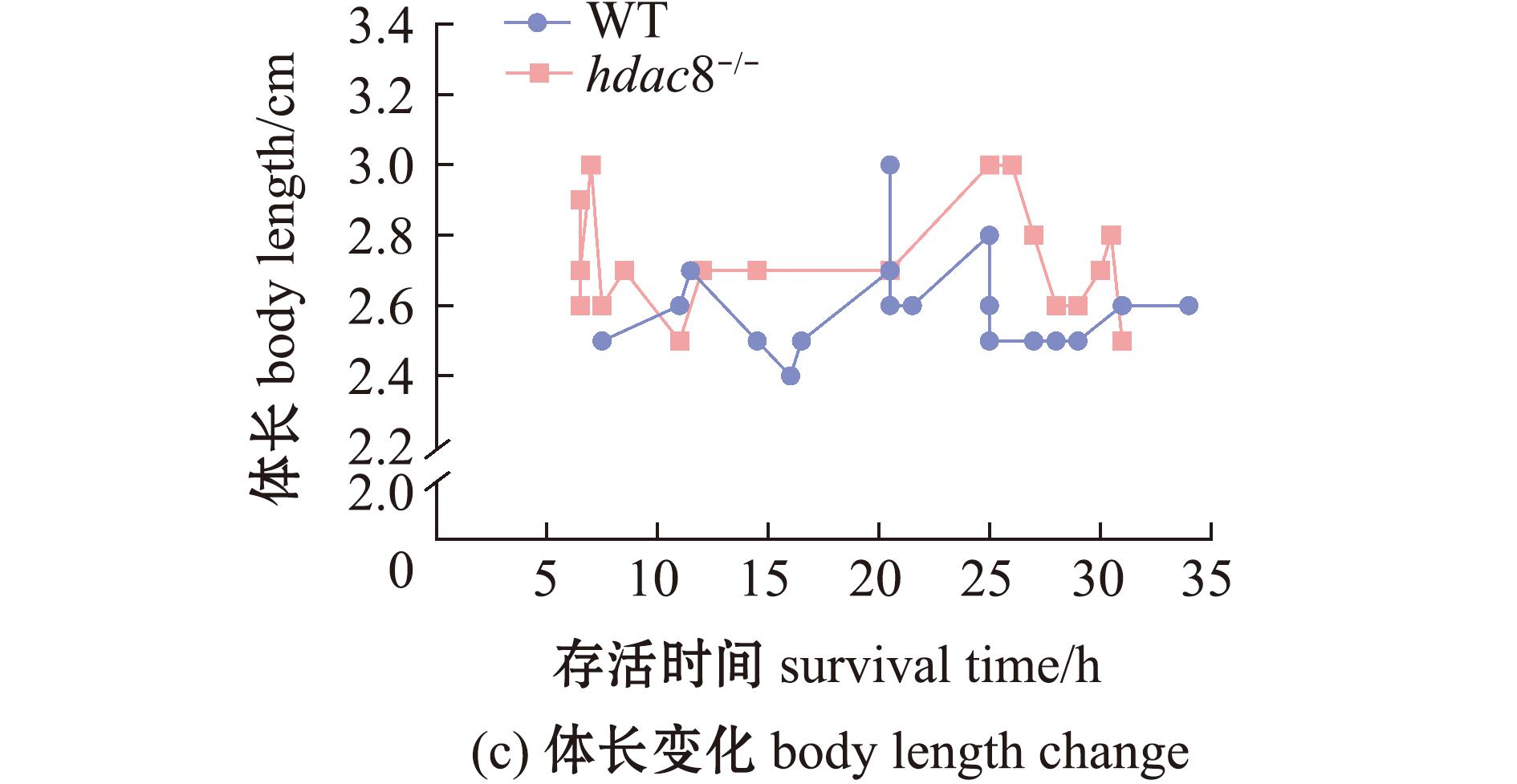
图2 斑马鱼低温耐受能力检测
Fig.2 Low temperature tolerance testing of Danio rerio
2.2 低温胁迫下斑马鱼hdac8基因和蛋白表达变化
WT斑马鱼在低温(8 ℃)下处理4 h,取28、8 ℃的斑马鱼脑组织进行RT-qPCR和Western blot,检测低温下hdac8 mRNA和蛋白的表达改变。从图3可见,相较于28 ℃,低温胁迫后的斑马鱼hdac8 mRNA和蛋白表达均发生了显著降低(P<0.05)。
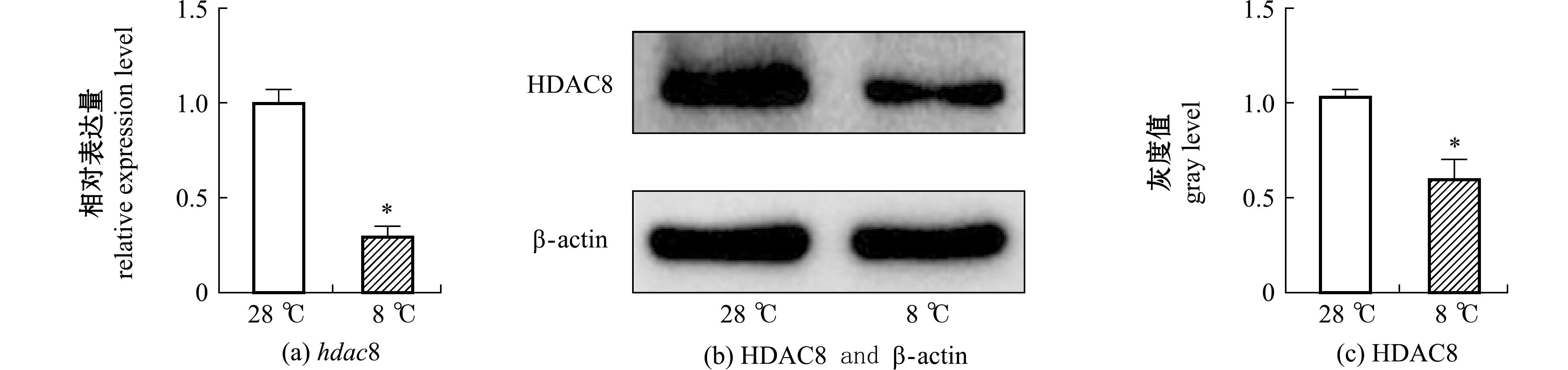
*表示与对照组有显著性差异(P<0.05)。 *means significant difference compared with the control (P<0.05).
图3 低温胁迫下斑马鱼hdac8 mRNA和HDAC8蛋白表达的变化
Fig.3 Changes in hdac8 mRNA expression and HDAC8 protein level of Danio rerio exposed to low temperature stress
2.3 低温胁迫下hdac8-/-斑马鱼的组织学观察
WT和hdac8-/-斑马鱼低温(8 ℃)处理4 h,取鳃丝、肝脏及骨骼肌切片进行HE染色。低温胁迫下,WT和hdac8-/-斑马鱼的鳃丝均出现不同程度的鳃小片折叠破损,hdac8-/-斑马鱼在黑色圆圈处出现明显断裂现象,鳃小片间分界模糊(图4A、D);WT和hdac8-/-斑马鱼的肝脏均出现大量空泡,hdac8-/-斑马鱼在黑色箭头处出现更明显的大空泡(图4B、E);WT和hdac8-/-斑马鱼的骨骼肌均出现少量空隙,hdac8-/-斑马鱼出现更多空隙,在黑色圆圈处间隙较大(图4C、F)。
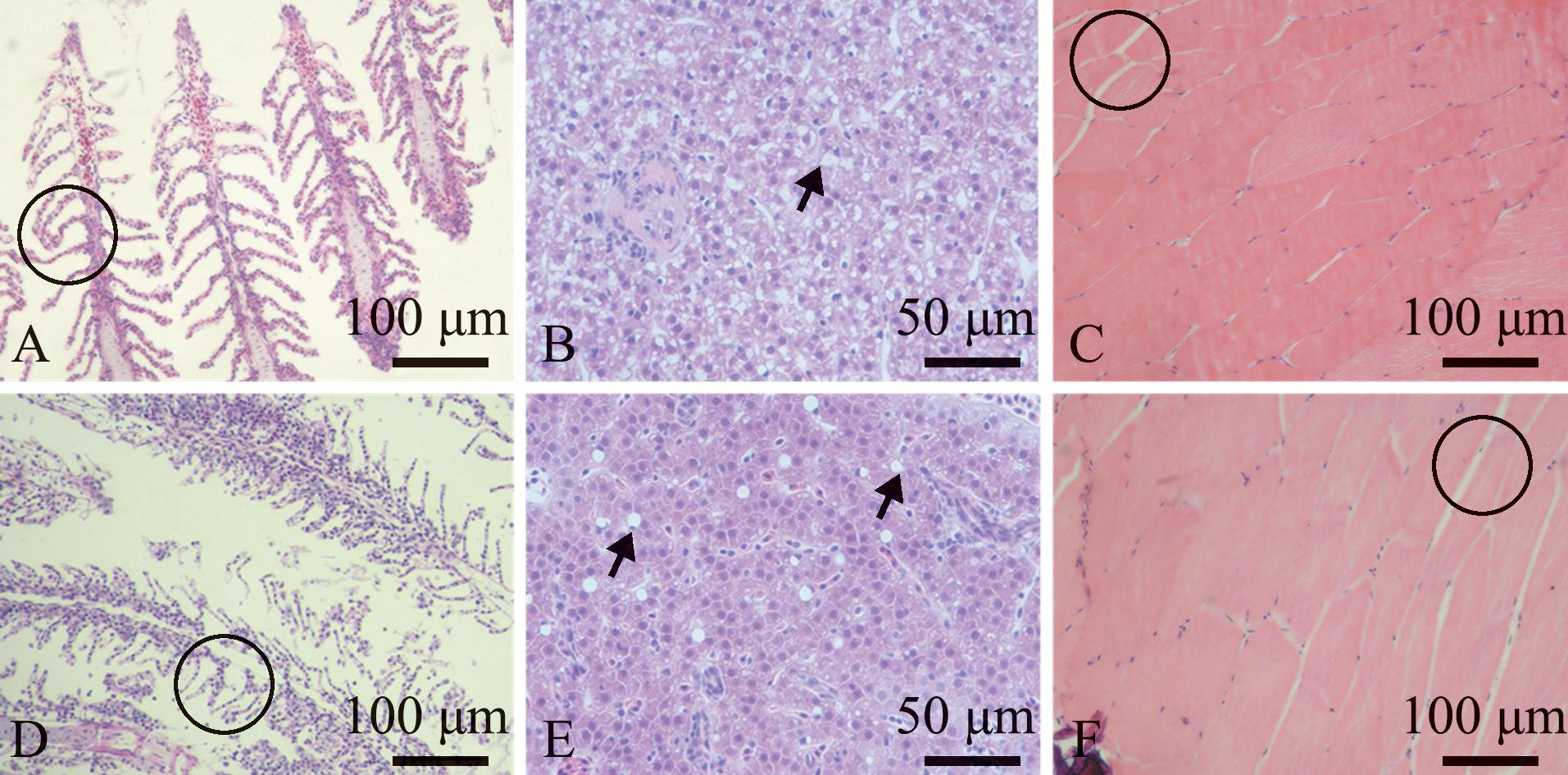
A~C为WT斑马鱼;D~F为hdac8-/-斑马鱼。A和D为鳃丝,黑色圆圈处对应鳃小片折叠破损;B和E为肝脏,箭头处对应空泡;C和F为肌肉,黑色圆圈处对应肌原纤维间产生的空隙。
A-C,WT zebrafish;D-F,hdac8-/-zebrafish.A and D,gill filaments,the black circle corresponds to the folded damage of the gills;B and E,liver,the black arrow corresponds to the cavitation;C and F,skeletal muscle,and the black circle corresponds to the space created between myofibrils.
图4 低温胁迫下斑马鱼的组织学观察
Fig.4 Histological observations of Danio rerio exposed to low temperature stress
2.4 低温胁迫下敲除hdac8后斑马鱼的氧化应激
WT和hdac8-/-斑马鱼低温(8 ℃)处理4 h后,取28 ℃和8 ℃的斑马鱼全鱼进行ROS和MDA含量检测,取肌肉组织进行ATP含量检测。从表2可见:28 ℃下,WT和hdac8-/-斑马鱼之间ROS和MDA水平无显著性差异(P>0.05),低温(8 ℃)处理后,两组鱼的ROS和MDA水平均显著增加(P<0.05),且 hdac8-/-斑马鱼的ROS和MDA水平相较于WT斑马鱼有显著升高(P<0.05);28 ℃下,hdac8-/-斑马鱼的ATP水平显著低于WT斑马鱼(P<0.05),低温处理后,WT和hdac8-/-斑马鱼的ATP水平均显著降低(P<0.05)。这表明,敲除hdac8会加重斑马鱼氧化应激损伤,导致线粒体膜受损,影响ATP的产生。
表2 低温胁迫下斑马鱼ROS、MDA和ATP含量的变化
Tab.2 Changes in ROS,MDA and ATP contents in Danio rerio exposed to low temperature stress

注:同列中标有不同小写字母者表示同一温度下不同斑马鱼之间有显著性差异(P<0.05);标有不同大写字母者表示同一种斑马鱼不同温度间有显著性差异(P<0.05);标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column within the same temperature are significantly different between WT and hdac8-/- zebrafish at the 0.05 probability level;The means with different capital letters within the same column within the same zebrafish are significantly different at different temperatures at the 0.05 probability level,and the means with the same letter are not significant differences between groups.
温度 temperature/℃组别 group相关荧光强度 ROSMDA/(μmol·mg-1 prot)ATP/(μmol·L-1)28WT斑马鱼565.55±79.78aA0.73±0.03aA166.64±4.49aAhdac8-/-斑马鱼593.77±64.89aA0.79±0.03aA80.58±1.16bA8WT斑马鱼1 803.83±154.33aB0.84±0.01aB126.25±12.33aBhdac8-/-斑马鱼3 225.78±126.22bB0.89±0.02bB49.69±9.68bB
2.5 低温胁迫下敲除hdac8后抗氧化基因的变化
将WT和hdac8-/-斑马鱼低温处理4 h后,取28、8 ℃的斑马鱼全鱼进行凋亡相关基因mRNA水平检测。从图5可见:28 ℃下,WT和hdac8-/-斑马鱼的sod、cat和gpx mRNA水平均无显著性变化(P>0.05);8 ℃下,其sod、cat和gpx的 mRNA水平均显著升高(P<0.05),且hdac8-/-斑马鱼这3个基因的mRNA水平均显著高于WT斑马鱼(P<0.05)。这表明,低温胁迫引起hdac8-/-斑马鱼的抗氧化相关基因上调,进行抗氧化清除ROS。
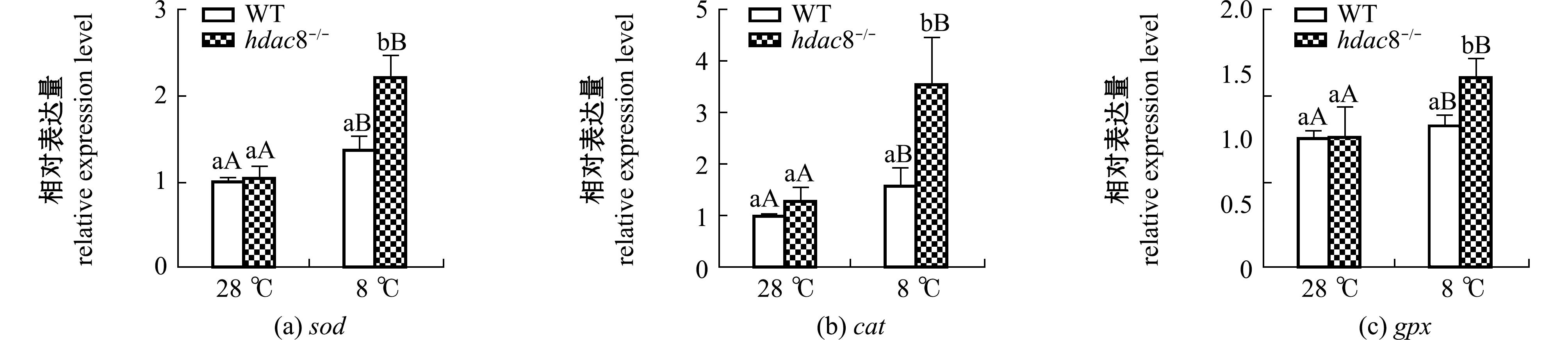
标有不同小写字母者表示同一温度下不同斑马鱼之间有显著性差异(P<0.05);标有不同大写字母者表示同一种斑马鱼不同温度间有显著性差异(P<0.05);标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters within the same temperature are significantly different between WT and hdac8-/- zebrafish at the 0.05 probability level;The means with different capital letters within the same zebrafish are significantly different at different temperatures at the 0.05 probability level,and the means with the same letter are not significant differences between groups,et sequentia.
图5 低温胁迫下斑马鱼抗氧化相关基因表达的变化
Fig.5 Changes in antioxidant related genes expression level in Danio rerio exposed to low temperature stress
2.6 低温胁迫下敲除hdac8后凋亡基因的变化
将WT和hdac8-/-斑马鱼低温处理4 h后,取28、8 ℃的斑马鱼全鱼进行抗氧化相关基因mRNA水平检测。从图6可见,28 ℃下,hdac8-/-斑马鱼caspase3的 mRNA水平显著上调(P<0.05),其他凋亡基因无显著性变化(P>0.05);8 ℃下,WT和hdac8-/-斑马鱼的caspase3、caspase9和bax的 mRNA水平均显著升高(P<0.05),且hdac8-/-斑马鱼的caspase3、caspase9、bax和bcl-2 mRNA水平均显著高于WT斑马鱼(P<0.05);无论在哪个温度下,hdac8-/-斑马鱼的bcl-2/bax值均显著低于WT斑马鱼(P<0.05)。这表明,hdac8可能通过抑制细胞凋亡参与低温应激过程。
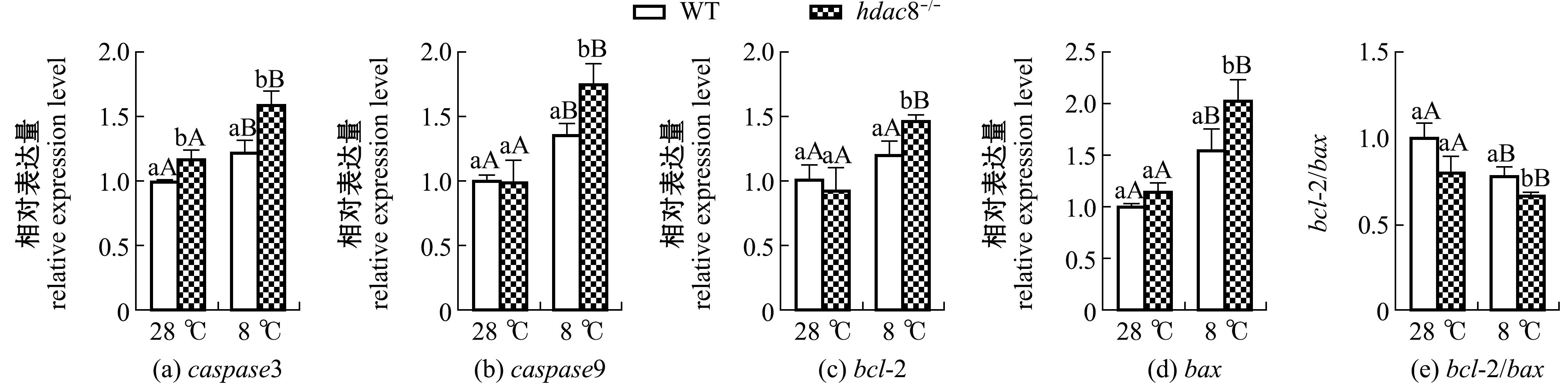
图6 低温胁迫下斑马鱼凋亡相关基因表达的变化
Fig.6 Changes in apoptosis related genes expression level in Danio rerio exposed to low temperature stress
3 讨论
3.1 敲除hdac8基因对斑马鱼低温胁迫下行为和组织损伤的影响
低温胁迫会影响鱼类生长、代谢和繁殖,严重时会造成鱼类死亡[1,22]。有研究发现,鱼类的行为是环境压力下最直观的反应,鱼类受到短时间的低温胁迫会出现剧烈运动,随着胁迫时间的延长,鱼类会慢慢减少游动[23]。本研究中,低温胁迫试验显示,在8 ℃下处理2 h时,hdac8-/-斑马鱼基本停止游动,并停留在鱼缸底部,而WT斑马鱼在胁迫6 h后仍能缓慢游动,且hdac8-/-斑马鱼的LT50显著缩短。此外,WT和hdac8-/-斑马鱼的体质量和体长与存活时间之间无显著相关性。这些数据说明,敲除hdac8会减弱斑马鱼的低温耐受能力,但可能不是通过调控生长发育过程影响其耐温性能。
鱼类中鳃和肝脏是低温胁迫的主要靶器官[24]。本研究中组织学分析发现,低温下hdac8-/-斑马鱼鳃丝和肝脏受到的损伤比WT斑马鱼更严重。黄姑鱼在低温胁迫下鳃丝也出现了类似的损伤现象,该研究同时还发现,低温处理后出现异常生理行为,可能是因为鳃丝受损引发的缺氧,进而影响呼吸效率,最终造成死亡[24]。克氏原螯虾(Procambarus clarkii)在低pH胁迫下,鳃的上皮细胞剥落,肝胰腺出现许多空泡[25],此组织损伤现象与本研究结果类似。本研究中,敲除hdac8基因会加重低温胁迫下的组织损伤,笔者推测,hdac8基因可能在保护机体组织免受低温损伤过程中起着一定作用。
3.2 敲除hdac8基因对斑马鱼低温胁迫下抗氧化能力的影响
低温胁迫下,鱼类会产生大量的ROS,不及时清理就会造成机体氧化应激反应[2]。抗氧化系统和MDA常被作为ROS氧化损伤的衡量指标[21]。SOD能够清除体内活性氧自由基,CAT和GPx能够清除过氧化氢,以防止羟基自由基和多余的ROS产生[2]。生物体积累过量的ROS会攻击生物膜,发生脂质过氧化反应,并产生MDA等脂质过氧化产物。积累过多的MDA会改变细胞膜的流动性和通透性,对细胞、组织及生物体产生危害[1]。在低温胁迫对日本对虾(Marsupenaeus japonicus)的研究中发现,随着胁迫时间的延长对虾体内MDA含量显著增加,并对鳃和肝胰腺产生损伤[26]。本研究中,hdac8-/-斑马鱼在低温胁迫下ROS和MDA含量显著高于WT斑马鱼;WT和hdac8-/-斑马鱼的抗氧化系统在短期应激过程中,抗氧化相关基因mRNA水平出现增加的趋势。这些结果表明,在短期低温刺激后,机体内积累过量的ROS,使斑马鱼脂质过氧化程度增强,而抗氧化系统积极抵御氧化应激来适应温度变化,但敲除hdac8引发了低温胁迫下更加激烈的氧化应激反应。在花鳅(Cobitis sinensis)、鲤(Cyprinus carpio)和军曹鱼中也发现,短期冷应激会上调鱼类抗氧化通路以清除ROS,随着胁迫时间的延长,相关抗氧化酶的水平会恢复到正常值[10,27-28]。但极限温度下,随着胁迫时间的延长并不会出现抗氧化酶的恢复期,笔者推测,敲除hdac8基因可能导致斑马鱼在低温下更易积累ROS。
3.3 敲除hdac8基因对斑马鱼低温胁迫下凋亡相关基因的影响
ROS过量积累不仅会引起氧化应激,还会通过激活内源性细胞凋亡途径(线粒体途径)导致细胞凋亡[6]。在低温下,鱼类体内细胞能快速启动凋亡并形成凋亡小体,以维持内环境稳定。Bcl-2家族主要调控线粒体途径的细胞凋亡,bcl-2和bax是这个家族的两个重要基因。bcl-2/bax比值的降低代表细胞凋亡启动,进一步刺激caspase9,导致caspase3的激活[29-30]。在瓦氏黄颡鱼(Pelteobagrus fulvidraco)低氧胁迫中发现,bcl-2/bax比值的增加可抑制细胞凋亡并保护细胞,这可能是鱼类在进化中适应的一种保护机制[31]。另有研究发现,hdac8与调控凋亡的Bcl-2家族和Caspase家族密切相关,hdac8的缺失或抑制对细胞凋亡有促进作用[14-16]。本研究中,28 ℃下hdac8-/-斑马鱼的caspase3 mRNA水平显著高于WT斑马鱼,而8 ℃下hdac8-/-斑马鱼的caspase3和caspase9 mRNA水平相较于WT斑马鱼显著增加,且bcl-2/bax比值显著降低。这说明,敲除hdac8后斑马鱼低温胁迫下细胞凋亡的程度更高,可能是通过内源性线粒体途径激活凋亡,从而促进细胞凋亡。在高温和低氧应激下杂色鲍(Haliotis diveraicolor)的caspase3 mRNA表达显著上升,且caspase3与氧化应激响应相关[32],这与本研究中的结果相类似。由此可见,hdac8-/-斑马鱼凋亡水平的升高可能与hdac8-/-斑马鱼的ATP含量显著减少相关。线粒体膜功能的紊乱和损伤也会引起线粒体细胞色素C的释放,激活caspase3介导的凋亡[33]。笔者推测,由于大量ROS和MDA的积累破坏了斑马鱼的细胞膜,造成线粒体损伤,导致ATP的产生减少和线粒体细胞色素C的释放,从而促进细胞凋亡。以上研究表明,hdac8可能通过调控细胞凋亡在低温耐受机制中发挥作用,其具体作用机制有待进一步研究。
4 结论
1)在低温胁迫下,hdac8-/-斑马鱼相较于WT斑马鱼游泳能力减弱,LT50显著缩短,表明敲除hdac8减弱了斑马鱼的低温耐受能力。
2)在低温胁迫下,hdac8-/-斑马鱼组织结构损伤和氧化应激损伤比WT斑马鱼更严重,表明敲除hdac8加重了低温下斑马鱼的氧化损伤。
3)敲除hdac8后,斑马鱼caspaspe3显著上调;在低温胁迫下,hdac8-/-斑马鱼多个凋亡相关基因表达显著上调,表明hdac8可能通过调控细胞凋亡途径影响斑马鱼低温耐受能力。
[1] WANG H M,WANG Y,NIU M H,et al.Cold acclimation for enhancing the cold tolerance of zebrafish cells[J].Frontiers in Physiology,2022,12:813451.
[2] WILHELM FILHO D.Reactive oxygen species,antioxidants and fish mitochondria[J].Frontiers in Bioscience,2007,12(1):1229-1237.
[3] 龙华.温度对鱼类生存的影响[J].中山大学学报(自然科学版),2005,44(sup 1):254-257.
LONG H.The effect of temperature on fish survival[J]Acta Scientiarum Naturalium Universitatis Sunyatseni(Natural Science Edition),2005,44(sup 1):254-257.(in Chinese)
[4] SONG H,XU D,TIAN L,et al.Overwinter mortality in yellow drum (Nibea albiflora):insights from growth and immune responses to cold and starvation stress[J].Fish &Shellfish Immunology,2019,92:341-347.
[5] YAN Q Q,LI W H,GONG X T,et al.Transcriptomic and phenotypic analysis of CRISPR/Cas9-mediated gluk2 knockout in zebrafish[J].Genes,2022,13(8):1441.
[6] CHEN K,LI X,SONG G,et al.Deficiency in the membrane protein Tmbim3a/Grinaa initiates cold-induced ER stress and cell death by activating an intrinsic apoptotic pathway in zebrafish[J].Journal of Biological Chemistry,2019,294(30):11445-11457.
[7] CHENG C H,GUO Z X,WANG A L.The protective effects of taurine on oxidative stress,cytoplasmic free-Ca2+ and apoptosis of pufferfish (Takifugu obscurus) under low temperature stress[J].Fish &Shellfish Immunology,2018,77:457-464.
[8] ASADI M,TAGHIZADEH S,KAVIANI E,et al.Caspase-3:structure,function,and biotechnological aspects[J].Biotechnology and Applied Biochemistry,2022,69(4):1633-1645.
[9] 胡玲红,王映,王化敏,等.不同温度胁迫对青鳉鳃凋亡的影响[J].大连海洋大学学报,2021,36(6):929-936.
HU L H,WANG Y,WANG H M,et al.Effects of different temperature stress on gill apoptosis of medaka Oryzias latipes[J].Journal of Dalian Ocean University,2021,36(6):929-936.(in Chinese)
[10] 李豫,黄建盛,陈有铭,等.低温胁迫对军曹鱼幼鱼血清生化指标、肝脏抗氧化酶活性及凋亡相关基因表达量的影响[J].广东海洋大学学报,2022,42(5):18-26.
LI Y,HUANG J S,CHEN Y M,et al.Effects of low-temperature stress on serum biochemical,antioxidant enzymes activities and apoptosis-related gene expression in liver of juvenile cobia(Rachycentron canadum)[J].Journal of Guangdong Ocean University,2022,42(5):18-26.(in Chinese)
[11] SUN Z,TAN X,XU M,et al.Liver transcriptome analysis and de novo annotation of the orange-spotted groupers (Epinephelus coioides) under cold stress[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2019,29:264-273.
[12] KIM J Y,CHO H,YOO J,et al.Pathological role of HDAC8:cancer and beyond[J].Cells,2022,11(19):3161.
[13] YAO Y L,HAO F,TANG L C,et al.Downregulation of HDAC8 expression decreases CD163 levels and promotes the apoptosis of macrophages by activating the ERK signaling pathway in recurrent spontaneous miscarriage[J].Molecular Human Reproduction,2020,26(7):521-531.
[14] KANG Y,NIAN H,RAJENDRAN P,et al.HDAC8 and STAT3 repress BMF gene activity in colon cancer cells[J].Cell Death &Disease,2014,5(10):e1476.
[15] BALASUBRAMANIAN S,RAMOS J,LUO W,et al.A novel histone deacetylase 8 (HDAC8)-specific inhibitor PCI-34051 induces apoptosis in T-cell lymphomas[J].Leukemia,2008,22(5):1026-1034.
[16] TIAN Y,WONG V W,WONG G L,et al.Histone deacetylase HDAC8 promotes insulin resistance and β-catenin activation in NAFLD-associated hepatocellular carcinoma[J].Cancer Research,2015,75(22):4803-4816.
[17] 姜蓬垒.斑马鱼细胞低温驯化中的表观遗传调控机制研究[D].上海:上海海洋大学,2018.
JIANG P L.The role of epigenetic mechanisms in cold acclimation of zebrafish cells[D].Shanghai:Shanghai Ocean University,2018.(in Chinese)
[18] 李飞.斑马鱼hdac8基因的克隆和功能研究[D].上海:上海海洋大学,2020.
LI F.Study on epigenetic regulation mechanism of zebrafish cells in low temperature domestication cloning and functional study of hdac8 gene from zebrafish[D].Shanghai:Shanghai Ocean University,2020.(in Chinese).
[19] 罗贝贝,罗军涛,韩丽洁,等.hdac8基因敲除对斑马鱼运动能力的影响[J].生物学杂志,2023,40(3):74-79.
LUO B B,LUO J T,HAN L J,et al.Effects of hdac8 gene knockout on locomotion capacity of zebrafish[J].Journal of Biology,2023,40(3):74-79.(in Chinese)
[20] HU P,LIU M L,LIU Y M,et al.Transcriptome comparison reveals a genetic network regulating the lower temperature limit in fish[J].Scientific Reports,2016,6:28952.
[21] WU S M,LIU J H,SHU L H,et al.Anti-oxidative responses of zebrafish (Danio rerio) gill,liver and brain tissues upon acute cold shock[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2015,187:202-213.
[22] QIU J,WANG W N,WANG L J,et al.Oxidative stress,DNA damage and osmolality in the Pacific white shrimp,Litopenaeus vannamei exposed to acute low temperature stress[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2011,154(1):36-41.
[23] PANG X,FU S J,ZHANG Y G.Acclimation temperature alters the relationship between growth and swimming performance among juvenile common carp (Cyprinus carpio)[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2016,199:111-119.
[24] 罗胜玉.低温胁迫对黄姑鱼生理生化指标和Hsp70基因表达模式的影响[D].舟山:浙江海洋大学,2016.
LUO S Y.Effects of low temperature stress on physiological and biochemical indexes and Hsp70 gene expression pattern of Nibea albiflora[D].Zhoushan:Zhejiang Ocean University,2016.(in Chinese)
[25] 陶易凡,强俊,王辉,等.低pH胁迫对克氏原螯虾鳃和肝胰腺酶活力及组织结构的影响[J].中国水产科学,2016,23(6):1279-1289.
TAO Y F,QIANG J,WANG H,et al.Acute toxicity of low-pH stress and its effect on enzyme activity and histological structure of gill and hepatopancreas in Procambarus clarkii[J].Journal of Fishery Sciences of China,2016,23(6):1279-1289.(in Chinese)
[26] 于振兴,任宪云,邵慧鑫,等.低温胁迫对日本对虾抗氧化系统和细胞凋亡的影响[J].渔业科学进展,2022,43(2):157-166.
YU Z X,REN X Y,SHAO H X,et al.Effect of low temperature stress on antioxidant system and apoptosis of Marsupenaeus japonicus[J].Progress in Fishery Sciences,2022,43(2):157-166.(in Chinese)
[27] 丁小,赵云龙,李艳娇,等.急性温度胁迫对花鳅抗氧化酶活性及丙二醛含量的影响[J].江西水产科技,2021(6):14-17.
DING X,ZHAO Y L,LI Y J,et al.Effects of acute temperature stress on antioxidant enzyme activity and malondialdehyde content of Misgurnus anguillicaudatus[J].Jiangxi Fishery Sciences and Technology,2021(6):14-17.(in Chinese)
[28] XU W J,LI H Y,WU L Y,et al.Genetically based physiological responses to overwinter starvation in gibel carp (Carassius gibelio)[J].Frontiers in Endocrinology,2020,11:578777.
[29] KRATZ E,EIMON P M,MUKHYALA K,et al.Functional characterization of the Bcl-2 gene family in the zebrafish[J].Cell Death &Differentiation,2006,13(10):1631-1640.
[30] WANG Y,WANG H M,HU L H,et al.Leptin gene protects against cold stress in Antarctic toothfish[J].Frontiers in Physiology,2021,12:740806.
[31] 郑翔.低氧胁迫对瓦氏黄颡鱼肠道氧化应激、细胞凋亡及其微生物组成的影响[D].南京:南京师范大学,2021.
ZHENG X.Effects of hypoxia stress on intestinal oxidative stress,apoptosis and microbial composition of Pelteobagrus vachelli[D].Nanjing:Nanjing Normal University,2021.(in Chinese)
[32] 卢锡琴,张丽莉,黄世玉,等.杂色鲍caspase-3基因的克隆及其在发育、弧菌感染、高温和缺氧应激中的表达分析[J].大连海洋大学学报,2022,37(3):411-419.
LU X Q,ZHANG L L,HUANG S Y,et al.Cloning and expression analysis of caspase-3 gene in development,immune and stress of variously colored abalone Haliotis diversicolor[J].Journal of Dalian Ocean University,2022,37(3):411-419.(in Chinese)
[33] KALPAGE H A,BAZYLIANSKA V,RECANATI M A,et al.Tissue-specific regulation of cytochrome c by post-translational modifications:respiration,the mitochondrial membrane potential,ROS,and apoptosis[J].The FASEB Journal,2019,33(2):1540-1553.