心脏作为脊椎动物的重要器官,为生物正常代谢和生命活动提供氧气和营养物质[1]。而在心脏形成的复杂过程中,许多关键步骤和调控网络受到环境、基因和转录等多方面的影响[2]。心脏由心房细胞、心室细胞和起搏细胞等多种不同的细胞类型组成,细胞间相互合作以确保心脏正常运转和全身血液循环的顺畅。在这个过程中,一些转录因子包括心脏特异性同源盒基因(NKX2)、肌细胞增强因子2(MEF2)、GATA结合蛋白因子(GATA)、T 盒转录因子 (Tbx)、心脏和神经嵴衍生蛋白因子(Hand)和同源异型基因(Hox)等参与心脏相关分子信号通路[3-4]。其中,Hox基因最初在果蝇中发现,其在构建动物身体结构中发挥高度保守的作用[5-7]。Hox基因家族编码一系列关键的转录因子,对许多发育过程有重要的作用。通过对各种突变体小鼠、斑马鱼等模型的分析发现,许多Hox蛋白可能在类似的发育途径中拥有共同的靶点和功能,单个的Hox基因也具有独特的功能[8]。Hox基因与许多器官形成、系统发育有关,包括与胸腺、甲状腺和甲状旁腺发育相关的Hox3基因[9],与肺部发育相关的Hox5基因[10],人类中与恶性癌症及其耐药性有关的Hoxb3基因等[11]。然而,Hox基因表达和功能的调控是非常复杂的,在心脏发育中的研究仍然相对较少。
斑马鱼(Danio rerio)作为一种经典的模式生物,可以用来模拟先天性疾病,继而研究心血管疾病形成的分子基础。斑马鱼与人类基因一致性高达85%,其发育周期短,能够在短时间内获得大量的透明胚胎并进行观察。斑马鱼心脏发育过程相对保守[12],采取与哺乳动物相似的策略组装形成心脏[13],包括中胚层(lateral plate mesoderm,LPM)两侧的心脏祖细胞(cardiovascular progenitor cells,CPCs)起源,以及中胚层细胞分化为第一心域祖细胞(FHF)、第二心域祖细胞(SHF)和神经嵴祖细胞(NCC)等过程[14-15]。斑马鱼的心脏发育经历线型心管的融合、心房心室的环化形成及房室间隔与瓣膜小叶等特殊结构的形成过程,最终发育成具有正常功能的心脏[3,16]。此外,神经嵴细胞也参与心脏的动脉级膈膜形成,对胚胎内胚层起调节作用[17]。目前,斑马鱼已广泛应用于先天性心脏病研究[18],但一些关键基因及调控网络仍不清晰[19]。
研究表明,小鼠中Hoxb3基因与神经嵴和咽弓(PAs)的模式结构形成有关,Hoxb3基因突变体表现出第二咽弓发育不全及面部骨骼与神经缺损[20],这可能与神经嵴细胞的迁移不足有关。此外,小鼠中的Hoxb3基因可以在后脑转录抑制Hoxb1的表达,维持菱形体4和5的前后一致性[21]。同时,Hoxb3、Hoxa9和Hoxb4在脊椎动物中对调节造血干细胞和祖细胞的分化、细胞增殖发挥重要作用。缺失Hoxb3基因的突变体小鼠表现出造血干细胞再生能力的损伤[22]。在斑马鱼中,hoxb3a由多个转录本介导,受多个启动子驱动,这种独特的基因结构提供了一种新的机制,以确保此基因在后脑和脊髓的重叠和组织特异性表达[23-24]。目前,hoxb3a在斑马鱼心脏发育上的功能尚未见报道。
本研究中,通过基因敲降技术、荧光表征、实时荧光定量PCR和整体胚胎原位杂交技术对斑马鱼hoxb3a基因在心脏发育过程中的作用进行分析,观察hoxb3a基因敲降组与对照组斑马鱼心脏表型的差异及相关基因的差异表达情况,以期为心脏发育机制研究及该基因在心脏和神经嵴发育中的功能提供科学参考。
1 材料与方法
1.1 材料
试验用野生型(wild type,WT)斑马鱼为上海海洋大学斑马鱼平台的AB品系,转基因斑马鱼品系Tg(myl7:EGFP,表示心肌细胞被绿色荧光蛋白标记;flk:mcherry,表示心内膜被红色荧光蛋白标记)由北京大学张博教授惠赠。本试验操作依据上海海洋大学动物伦理相关规定(IACUC 20171009)进行。
本实验室有完善的斑马鱼养殖自循环水系统,水温为28.5 ℃,pH为7.0~8.0,且养殖水均经过紫外消毒和曝气处理。斑马鱼在专用的配鱼缸中交配产卵,产卵后置于28.5 ℃恒温培养箱中培养。
试验用主要仪器:小型离心机(Eppendorf Centrifuge 5424)、PCR仪(BIO-RAD)、荧光定量PCR仪(Roche,LightCycler 480 Ⅱ 实时荧光定量PCR仪)、紫外分光光度计(Thermo Scientific 2000C)、正置荧光显微镜(ZEISS,Axio Imager 2)和显微注射仪(Harward Apparatus,PLI-100A)。
1.2 方法
1.2.1 基因敲降技术与显微注射 将一雌一雄斑马鱼置于配鱼缸中,加上隔板,次日把隔板去除,等待斑马鱼产卵。将收集好的一细胞期斑马鱼胚胎依次排布在注射皿(用30 g/L琼脂糖凝胶配制注射皿)上,选取约100枚胚胎,利用显微注射器将注射样品hoxb3a Morpholino注射到受精卵一细胞期的动物极中,记为hoxb3a morphant试验组,以100枚未注射的同批次胚胎作为对照,记为WT,此后将胚胎置于28 ℃培养箱中培养,注射后4、24、48、72 h取样观察胚胎并换水。
基因沉默技术(Morpholino,以下简称“MO”)购于美国GeneTool公司。使用前将其溶解于 RNase-free H2O 中,终浓度为1 mmol/L。本研究中hoxb3a MO的序列为5′CGTAGTAGGTCGTTTTCTGCATTTC 3′,用于显微注射的剂量为hoxb3a MO 8 pg/胚胎。
1.2.2 实时荧光定量 PCR(qPCR) 收集试验所需斑马鱼胚胎置于2 mL RNase Free的离心管中,取受精后3 d(day post fertilization,dpf)的试验组和对照组斑马鱼胚胎,每管5~10枚,每组设3个生物学重复,加入0.3 mL/管 RNA裂解液及数枚磁珠,放至匀浆仪上振荡,充分裂解胚胎。此后按照Eastep Super Total RNA Extraction Kit对胚胎裂解物进行总RNA提取,将提取后的RNA置于-80 ℃超低温冰箱中保存。使用宝日医生物技术(北京)有限公司的反转录试剂盒将提取的斑马鱼对照组与试验组的 RNA (1 μg)反转录为cDNA,于-80 ℃超低温冰箱中保存备用。
利用NCBI网站Primer Blast软件设计荧光定量PCR引物(https://www.ncbi.nlm.nih.gov/tools/primer-blast/),引物长度为100~200 bp。每个反应设3个复孔,以样本的cDNA为模板进行扩增。试验用qPCR引物见表1。
表1 qPCR引物序列信息
Tab.1 qPCR primer sequence information

基因 gene 引物序列 primer sequence(5′-3′)β-actinF:TGCAAAGCCGGATTCGCTGGR:AGTTGGTGACAATACCGTGCnkx2.5F:TCCAACCTTCACAGTCCAACAGCAAR:TCACCAAGCTCTGATGCCATGTAGTgata4F:CGCACTTCGACAGCTCCGTACTR:AGTCCACAGGCATTGCACAGGTAAislet1F:AAGCGTCTAATCTCGTTGTGR:ATCCCGTATAACCTGATGTAGTCnppaF:ATTATGAAGACAGCAACACCR:GTCAAATCCATCCGAGGGmeis2bF:GTGAACTAGGAGATGGCTTGGR:TGCGTGAGATGTTGGAAGAGfgf8aF:GTGCAAGTTCTGGCCAACAAGR:CTTGCCAATCAGTTTCCCCCsmad4F:CAAACGGAGCTCATCCCAGTR:CCACAGACGTGCGTAGATGAcx43F:CCTGGCGCATGTCTTCTACCR:GAGATGGAGCTCAACGTCGC
符合标准的qPCR引物按照以下体系在实时荧光定量PCR仪器中进行试验。反应体系(20 μL):Light Cycler®480 SYBR Green 1 Master 10 μL,正、反向引物各1 μL,cDNA模版1 μL,无菌水7 μL。反应程序:95 ℃下变性10 s,60 ℃下退火30 s,72 ℃下变性1 min,共进行40个循环。采用2-ΔΔCt计算基因相对表达量。
1.2.3 斑马鱼整体胚胎原位杂交 在斑马鱼基因编码区(CDS)区域利用NCBI Primer Blast设计探针引物,将探针RNA原液保存于-80 ℃冰箱中备用。收集受精后3 d的野生型与试验组斑马鱼胚胎各50枚,用体积分数为4%的多聚甲醛进行固定,将固定过的斑马鱼胚胎利用梯度乙醇(30%、50%、70%、 100%)脱水过夜;第2天,采用梯度乙醇对斑马鱼胚胎依次复水,用10 μg/mL的蛋白酶K对胚胎处理后进行预杂交试验,然后加入质量浓度为1 ng/μL的探针,在杂交炉中进行杂交过夜;第3天,对胚胎进行封闭,加入抗地高辛的抗体,在4 ℃下摇床过夜;第4天,使用NBT/BCIP显色液对胚胎进行显色,观察胚胎出现特异性蓝紫色信号后立即用PBST终止显色,后续进行拍照。试验用探针引物序列见表2,划线为T7序列。
表2 原位杂交探针引物序列信息
Tab.2 In situ hybridization probe primer sequence information
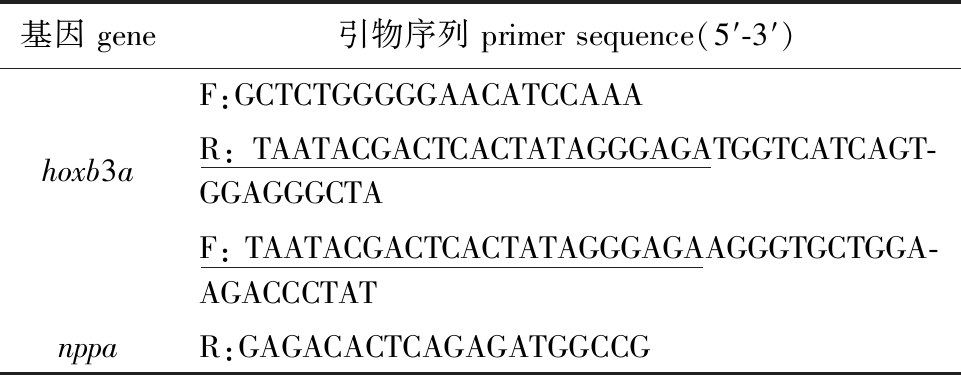
基因 gene引物序列 primer sequence(5′-3′)F:GCTCTGGGGGAACATCCAAAhoxb3aR:TAATACGACTCACTATAGGGAGATGGTCATCAGT-GGAGGGCTAF:TAATACGACTCACTATAGGGAGAAGGGTGCTGGA- AGACCCTATnppaR:GAGACACTCAGAGATGGCCG
2 结果与分析
2.1 斑马鱼Hoxb3a的进化位置
系统进化树分析发现,Hox蛋白按照不同亚型严格聚类,人类、小鼠等物种同属Hoxb3,进化距离较近,而Hoxa1、Hoxb4、Hoxb3三者间进化距离相对较远(图1)。
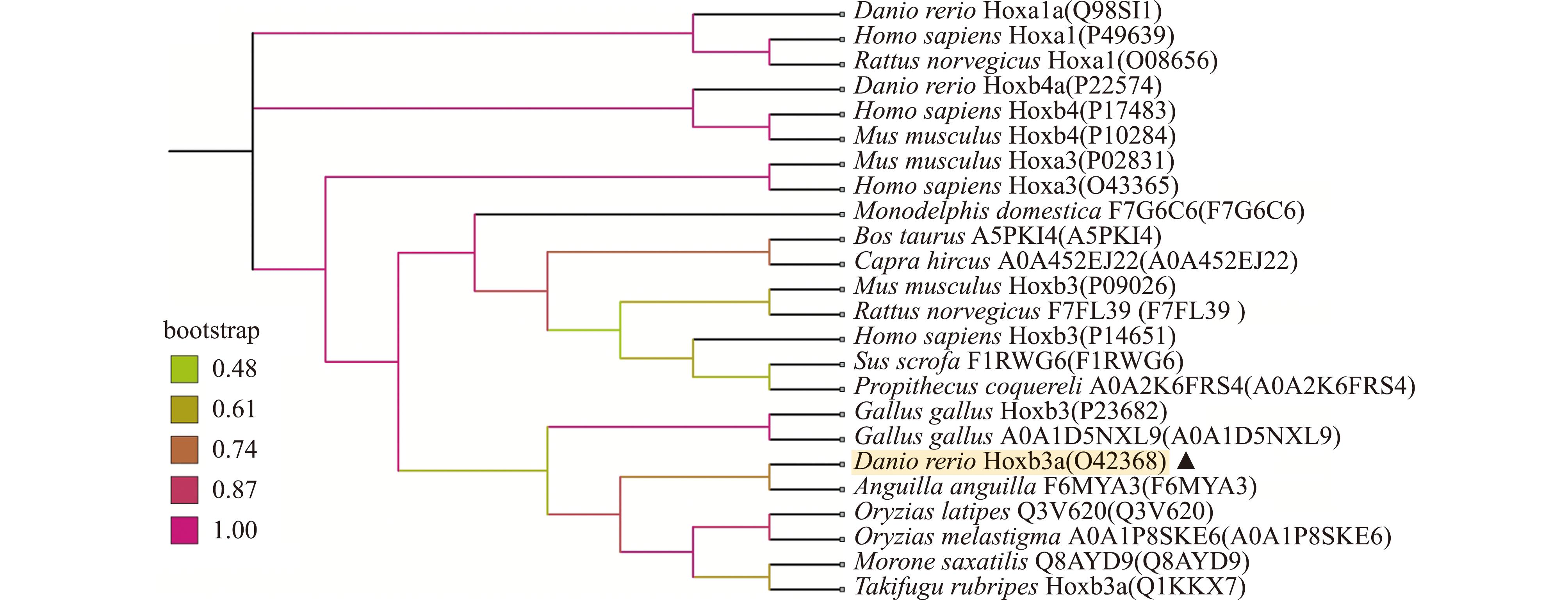
图1 基于NJ法构建的Hoxb3a氨基酸序列进化树
Fig.1 Phylogenetic tree of Hoxb3a amino acid sequence constructed based on the NJ method
将斑马鱼与其他物种的Hoxb3氨基酸序列进行BLASTP比对显示,在DNA结合结构域非常保守(图2,红框)。斑马鱼hoxb3a基因编码417个氨基酸,它不仅在具有DNA结合功能的同源结构域与哺乳动物高度相似,在其他区域也相对保守,说明斑马鱼hoxb3a基因在进化上相对保守,便于研究发育过程中的保守机制。

图2 斑马鱼Hoxb3a氨基酸序列与其他物种的比对
Fig.2 Comparison of Hoxb3a amino acid sequence between zebrafish and other species
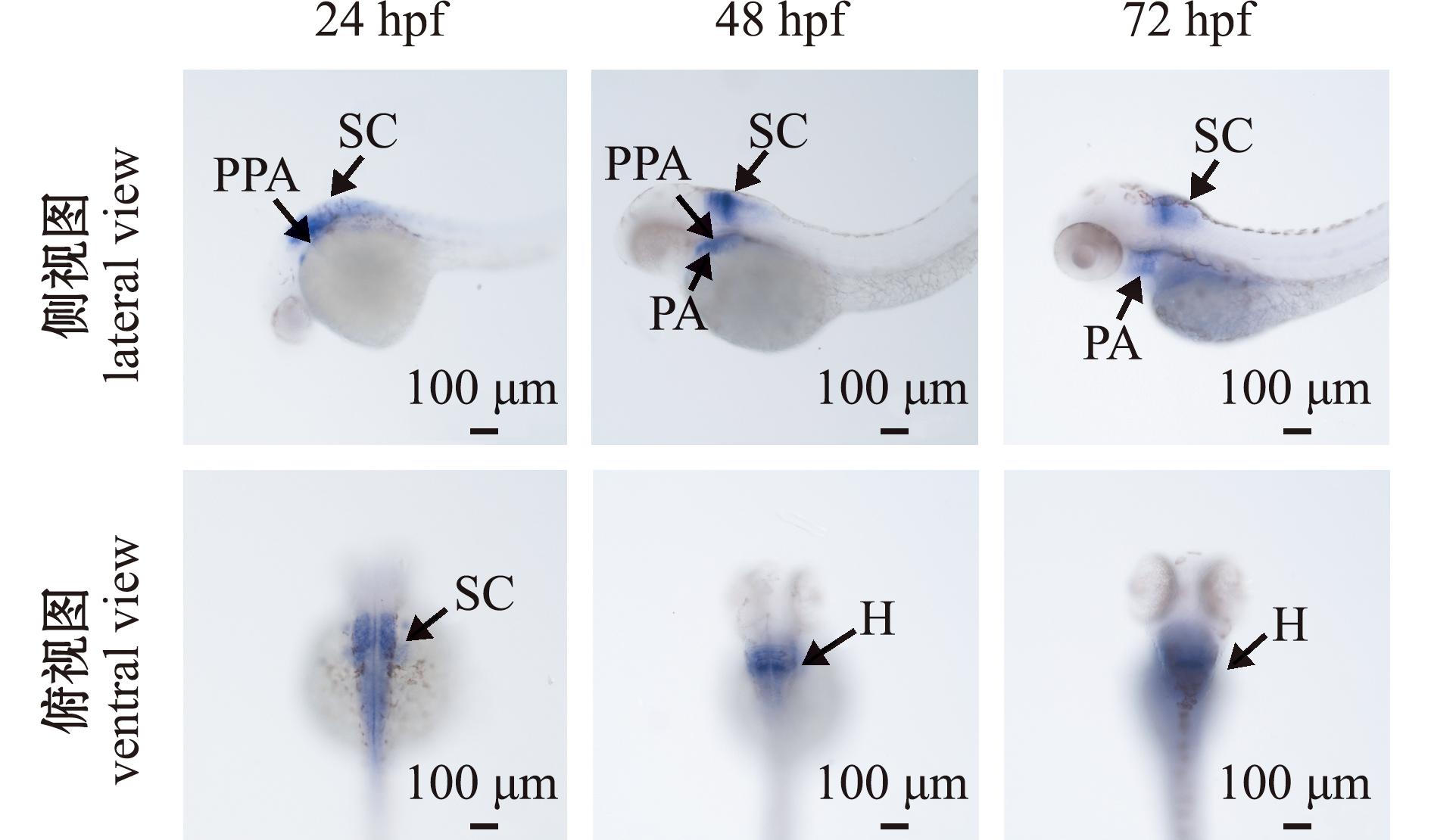
PPA—后咽弓;PA—咽弓;SC—脊髓;H—后脑。
PPA—posterior pharyngeal arch;PA—pharyngeal arch;SC—spinal cord;H—hindbrain.
图3 hoxb3a基因在野生型胚胎24、48、72 hpf时期的原位杂交表达图谱
Fig.3 In situ hybridization expression map of hoxb3a gene in wild-type embryos at 24,48 and 72 hpf
2.2 斑马鱼hoxb3a基因的时空表达谱
运用原位杂交技术,检测了hoxb3a基因在野生型斑马鱼胚胎中不同时期的表达定位(图 3)。受精后24 h(hour post fertilization,hpf)时,hoxb3a基因表达在后咽弓、脊髓和中脑位置;48 hpf时,随着神经嵴细胞的迁移和分化过程,hoxb3a基因表达区域从中脑向后脑迁移,并且内胚层区域也有一些表达;72 hpf时,hoxb3a基因表达区域扩大,不仅在后脑和后部的神经管中表达,同时在胸鳍与咽弓、鳃部也有表达。原位杂交结果提示,hoxb3a基因通过神经嵴细胞迁移参与心脏组织的形成。
2.3 斑马鱼hoxb3a基因沉默后对心脏结构的影响
为研究hoxb3a基因的功能,对hoxb3a基因敲降结果显示,hoxb3a morphant试验组胚胎在受精后3 d,与对照组(图4A)相比出现心包腔肿大、环化异常和静脉窦淤血的现象(图4D)。利用转基因斑马鱼品系Tg(myl7:EGFP,flk:mcherry)对3 dpf斑马鱼胚胎心脏进行观察,荧光图像显示,二者的心脏在心脏环化和心脏形态等方面有差异(图4B、C、E、F)。统计分析显示,与对照组相比,hoxb3a morphant试验组胚胎的心脏环化角度显著增大(P<0.01)(图4G),而心室长度则未显示出显著变化(P>0.05)(图4H)。
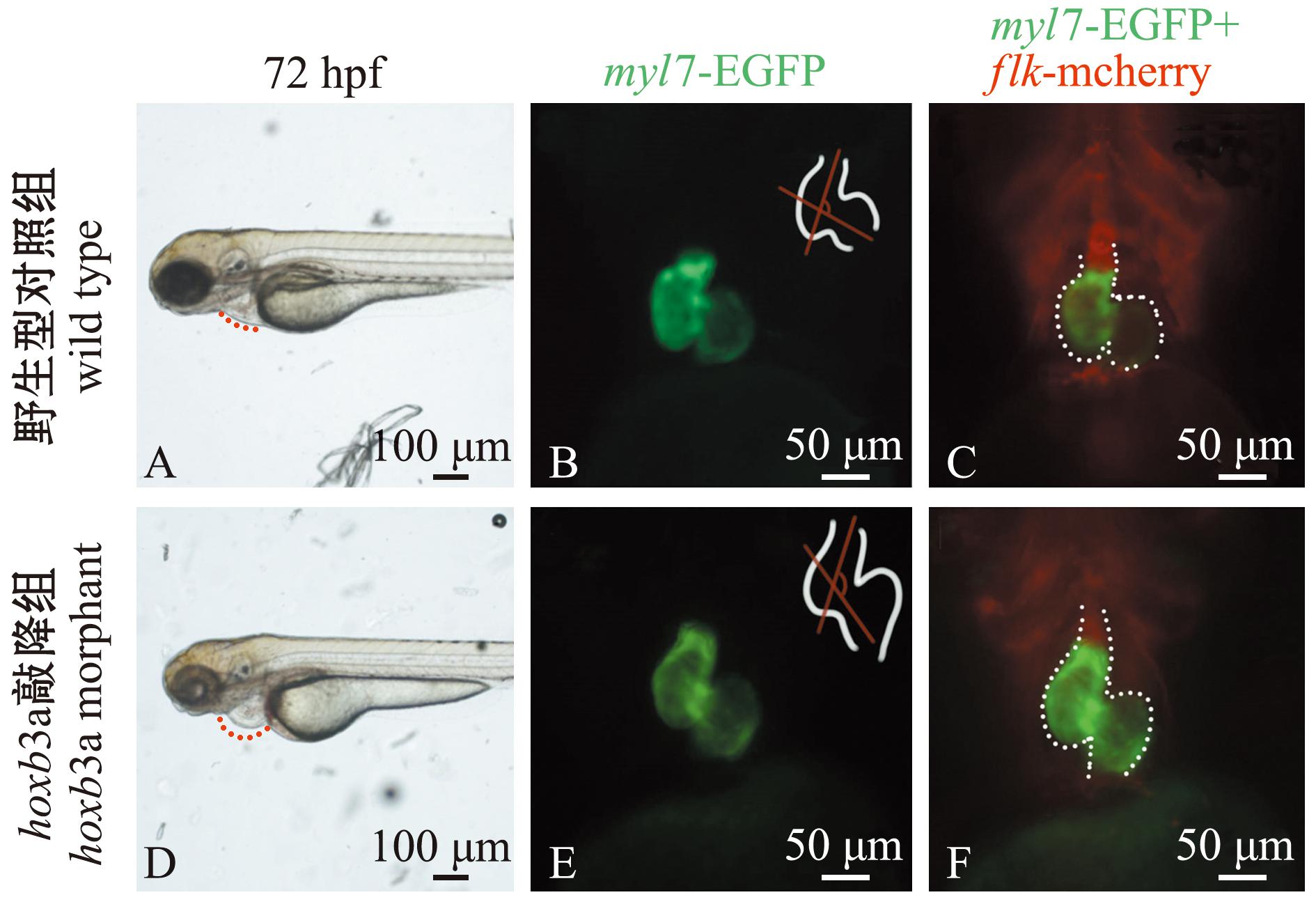
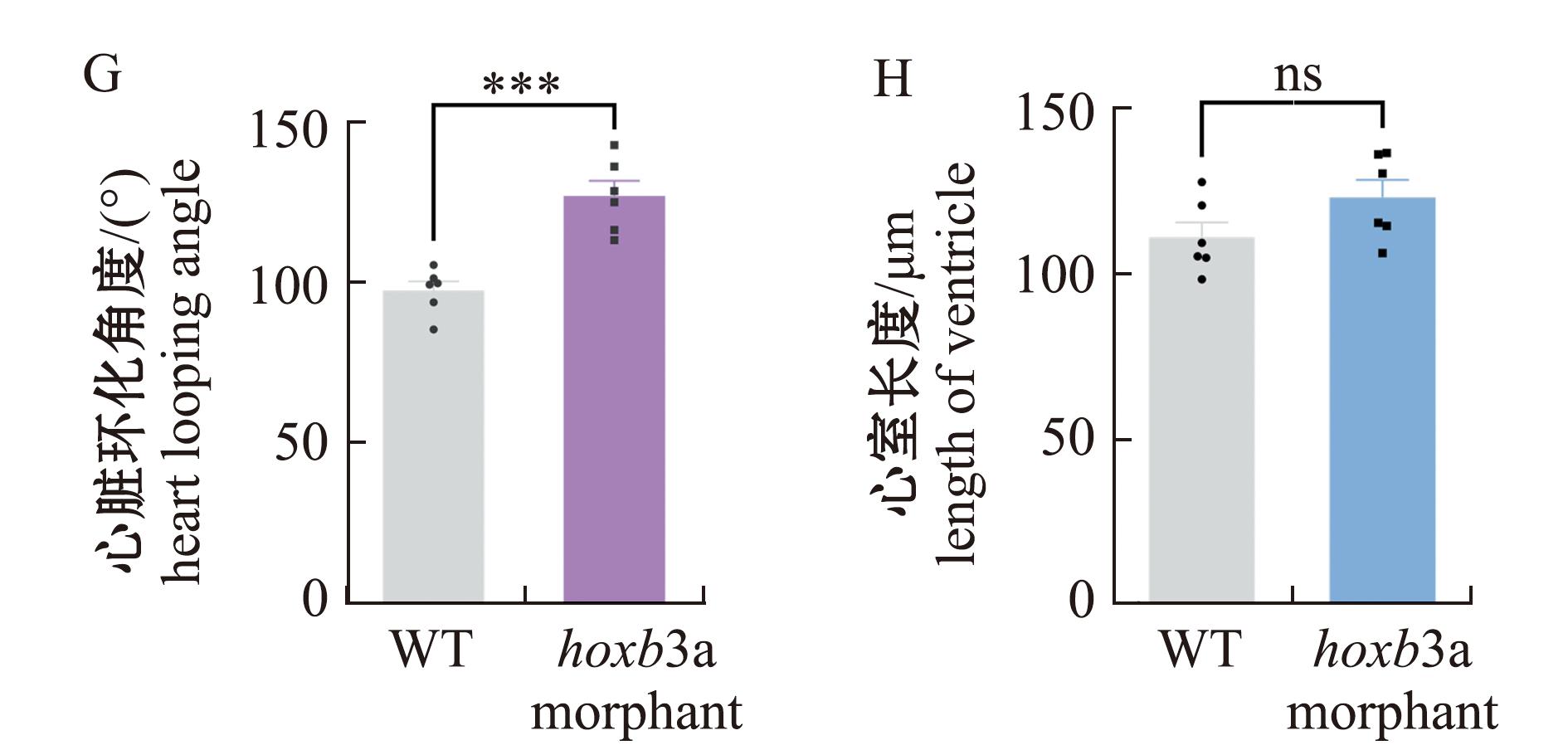
A—3 dpf时,野生型对照组斑马鱼胚胎的光镜图;B—野生型斑马鱼心脏的绿色荧光图(腹面观,头在上);C—野生型斑马鱼心脏红绿荧光图(腹面观,头在上);D—注射了8 ng hoxb3a Morpholino胚胎的光镜图;E—hoxb3a morphant组斑马鱼在3 dpf 时期的心脏绿色荧光图(腹面观,头在上);F—hoxb3a morphant组斑马鱼心脏的红绿荧光图(腹面观,头在上);G—对照组与hoxb3a morphant组鱼的心脏环化角度(n=6),***表示组间有极显著性差异(P<0.001);H—对照组与hoxb3a morphant组鱼的心室长度(n=6)。
A—light microscopic micrograph of embryos of wild-type zebrafish in the control group at 3 dpf;B—green fluorescence of wild-type zebrafish heart (ventral view,head at the top);C—red and green fluorescence of wild-type zebrafish heart (ventral view,head at the top);D—light microscopic micrograph of embryos in jected with 8 ng hoxb3a Morpholino in experimental group;E—green fluorescence map of hoxb3a morphant heart at 3 dpf (ventral view,head on top);F—red-green fluorescence map of hoxb3a morphant zebrafish heart (ventral view,head on top);G—heart looping angle in control vs hoxb3a morphant group (n=6),***indicates significant differences between groups (P<0.001);H—ventricular length in control vs hoxb3a morphant group(n=6).
图4 斑马鱼hoxb3a基因敲降导致的心脏异常发育
Fig.4 Knockdown of hoxb3a gene in zebrafish causes abnormal heart development
2.4 斑马鱼hoxb3a启动子转录结合位点及CpG 岛预测
利用Methprimer-Design预测CpG 岛,结果发现,hoxb3a启动子区域存在GC含量大于50%的区域,其长度分别为 190 bp(936~1 126 碱基位置)和 313 bp(1 127~1 439碱基位置)的CpG 岛(图5(a))。采用AliBaba 2.1软件预测转录因子结合位点发现,出现HNF-1、GATA-1等多个重要的转录因子结合位点(图5(b))。表明该基因的启动子序列可能具有复杂的转录功能,且发挥不同的转录作用,具有转录结合的潜力。

图(a)中蓝色显示区域为hoxb3a基因启动子区域中CpG岛预测位置;图(b)中红色碱基为该基因的序列信息,红色方框内为转录因子名称及预测的结合位点位置信息。
the predicted location of the CpG island in the promoter region of the hoxb3a gene in blue in Fig.(a);the sequence information of the gene in red bases and the transcription factor name and predicted binding site location in red boxes in Fig.(b).
图5 斑马鱼hoxb3a基因的CpG岛预测及转录因子结合位点预测
Fig.5 CpG island prediction and transcription factor binding site prediction of zebrafish hoxb3a gene
2.5 hoxb3a敲降导致的心脏关键基因表达变化
hoxb3a morphant试验组出现心脏结构异常的结果,表明hoxb3a基因参与了心脏发育的早期过程。使用qPCR检测hoxb3a morphant试验组和对照组中心脏标志基因的表达水平,结果显示,心脏祖细胞相关基因nkx2.5、腔室分化关键基因nppa、神经嵴及体节发育相关基因fgf8a均有显著升高(图6(a))。通过原位杂交试验检测基因的表达,结果显示:nppa基因在野生型斑马鱼的心室和心房中表达,在房室间隔(AVC)中不表达;而在hoxb3a morphant组中nppa基因异常表达,同时心房和心室形态改变(图6(b))。
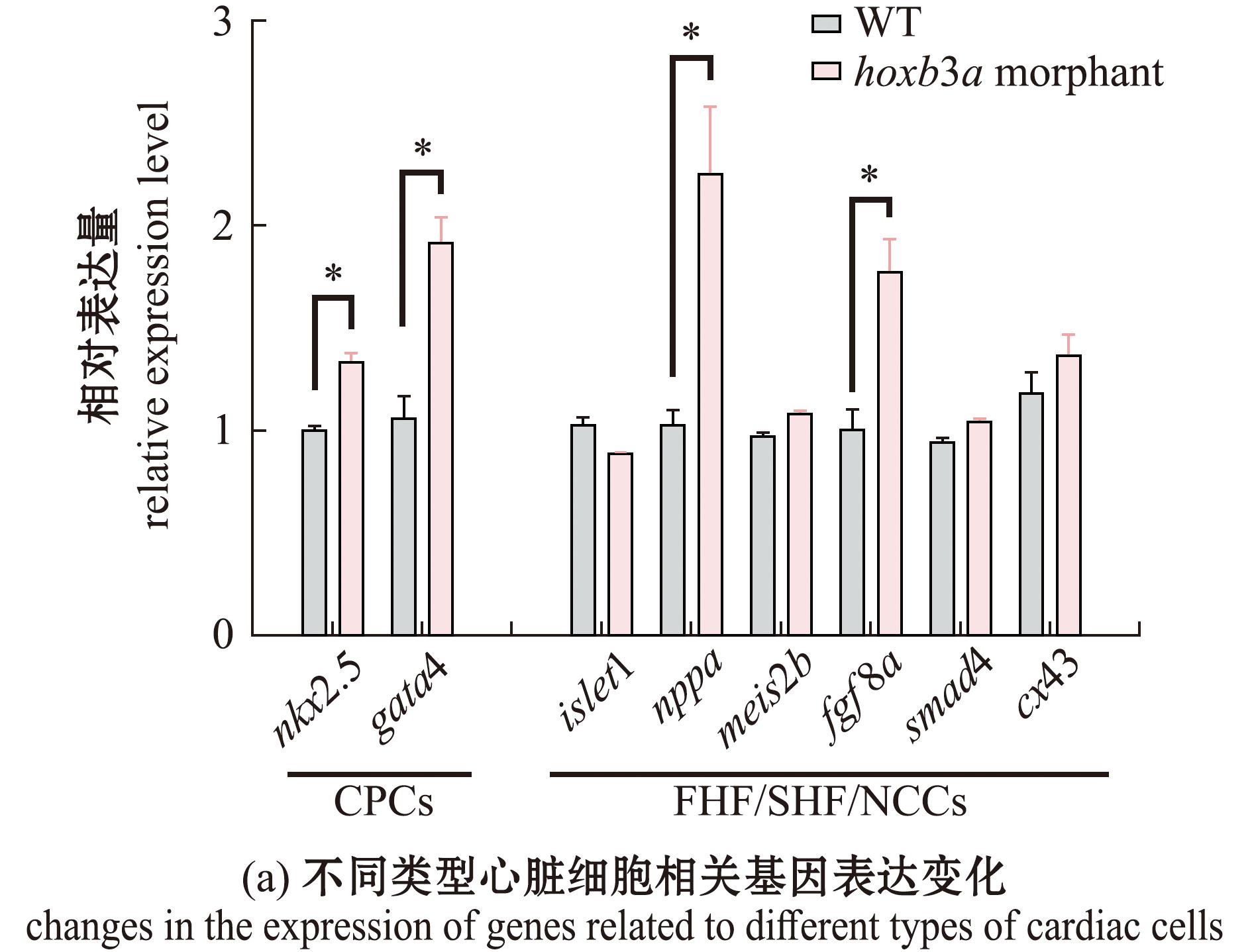
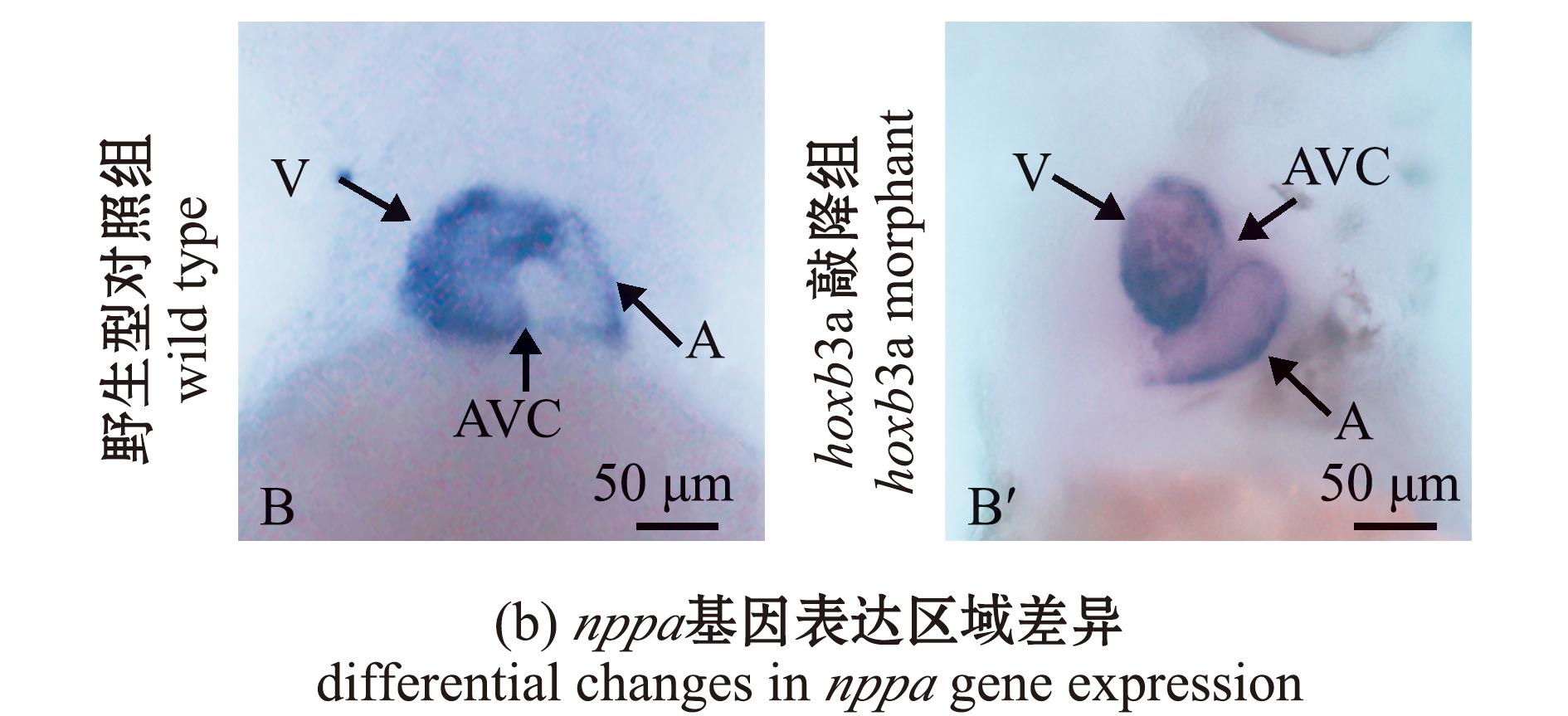
*表示组间存在显著性差异(P<0.05);A表示心房,V表示心室,AVC表示房室间隔。
*,indicates significant difference between groups (P<0.05);A indicates atrium,V indicates ventricle,and AVC indicates atrioventricular septum.
图6 3 dpf时心脏相关基因在hoxb3a morphant中的表达量变化
Fig.6 Expression level variation of heart-related genes in hoxb3a morphant at 3 dpf
3 讨论
3.1 斑马鱼中hoxb3a基因对心脏形态的影响
脊椎动物的心脏发育模式在物种间具有高度的保守性[25],而斑马鱼因其早期胚胎透明、产卵量大和经济实惠的优点,常用于早期心血管发育的研究。Hox基因具有时空共线性的特点,位于该基因组上 3′端的基因,可以调控身体前端器官发育[26]。几十年来,研究者对Hox基因调控脊椎动物轴向骨骼发育与进化的研究较多[27],而对Hox调节心脏发育的研究较少。本研究中,通过基因敲降试验发现,hoxb3a基因表达变化对斑马鱼心脏发育产生较大影响,hoxb3a morphant基因敲降组胚胎在受精后3 d时,出现心包腔肿大、心脏环化角度异常和血液循环受损等表型。这表明,hoxb3a的基因沉默影响了心脏下游相关基因的表达,损害了心脏正常发育过程。本研究结果揭示了hoxb3a基因在斑马鱼心脏发育和神经嵴形成中的重要作用,为了解斑马鱼早期心脏发育提供了新的线索。
本研究中,结合Hoxb3氨基酸序列比对及系统进化分析显示,hoxb3a基因在进化中相对保守,斑马鱼hoxb3无加倍的重复基因,可能是在基因复制积累后又丢失了重复基因,并获取新的适应功能,这有助于适应复杂性的进化[28-29]。深入了解hoxb3a的进化和表达模式,可以帮助研究者更好地理解其在发育和进化中的重要作用。基因敲降技术可以减少或部分消除目标基因的表达,从而探究该基因在生物学过程中的作用。通过将这种技术应用到斑马鱼模型中,有助于深入研究心脏发育和早期的相关疾病[30]。本研究中原位杂交结果表明,hoxb3a基因的表达在斑马鱼不同组织中呈现出多样性,其在早期发育中对于中脑和后脑的形成具有作用,提示其可能控制着颅骨和颌骨的形成和定位。此外,hoxb3a在咽弓中有表达,说明hox基因对于胚胎器官形成的过程具有重要意义。
3.2 hoxb3a基因对心脏发育转录调控的影响
心脏是脊椎动物发育过程中形成的第一个功能器官,早期心脏发育异常可能会出现一系列先天性心脏疾病。斑马鱼模型为研究早期心脏形态发生和先天性疾病机制提供了便利[31]。心脏的发育最初起源于侧板中胚层两侧的心脏祖细胞。这些细胞随着发育的进行分化为第一心域祖细胞、第二心域祖细胞和神经嵴心脏祖细胞,并分别发挥不同的分化功能,形成成熟的心脏结构。本研究中,利用斑马鱼模型发现,hoxb3a基因敲降会对斑马鱼早期心脏发育过程产生影响。通过CpG岛预测及转录因子结合位点预测显示,hoxb3a基因启动子区存在CpG 岛及一些重要的转录因子结合位点。这提示,hoxb3a基因可能在早期发挥转录调控作用,如果在CpG岛附近出现甲基化会抑制基因的转录并导致基因沉默。通过在斑马鱼中敲降hoxb3a基因的表达,发现下游心脏发育相关基因的表达量出现变化。这表明,心脏形成过程中CPCs、FHF、SHF和NCCs相关基因的表达受到影响,包括nkx2.5、gata4、nppa与fgf8a基因。
有研究显示,心脏和咽部骨骼肌起源于一个共同的发育池,称为心咽区。在哺乳动物中,心咽区的早期发育受心脏和咽中胚层发育所需的一组保守因子的调控,包括nkx2.5和Islet1[32-33]。而gata4作为一种锌指蛋白转录调节因子,可以指导中胚层的发育,在心脏谱系分化过程中具有关键功能,甚至可以决定心脏的命运转变[33]。本研究中发现,在hoxb3a基因敲降组中,心脏祖细胞相关基因nkx2.5和gata4的表达量升高,表明其可能在胚胎发育早期影响了心脏祖细胞的迁移过程。此外,心脏腔室分化相关基因nppa在hoxb3a敲降组斑马鱼胚胎中表达量显著升高。nppa基因作为心脏疾病的生物标志物,可以编码心房利钠肽激素,对斑马鱼心脏腔室发育过程至关重要[34]。本研究中,利用原位杂交试验对3 dpf的斑马鱼胚胎nppa基因表达量进行表征,hoxb3a敲降组中nppa基因的表达区域有变化且伴随表达量升高,这一点与qPCR中nppa基因的表达情况相一致。由于基因的敲降,hoxb3a敲降组斑马鱼胚胎中的nppa基因在心房心室均有大量表达,在房室间隔处也出现了表达,笔者猜测这可能影响了心脏腔室的分化并导致心脏环化状态的改变。由此推测,hoxb3a与nppa基因可能存在潜在的调控关系,hoxb3a基因在心脏正常环化形成和心脏房室间隔规范形成方面具有重要作用。此外,有研究表明,fgf8a基因的突变会对第二心域祖细胞和流出道的形成产生敏感性继而影响心脏的发育,这为hoxb3a敲降组斑马鱼中异常的心脏表型提供了解释[35]。本研究中,fgf8a基因的表达量明显升高,可能是由于hoxb3a基因敲降后,一些心脏转录因子活性有所变化,影响了第二心域祖细胞的迁移与分化,并造成心脏形成的失败及心功能的损伤。
综上所述,斑马鱼hoxb3a基因与早期心脏发育有关。hoxb3a基因在斑马鱼心脏发育中扮演着重要的角色,其缺失或异常表达可能会导致心脏发育异常。本研究结果为进一步探究Hox基因家族在心脏发育中的作用提供了重要的线索,为基因治疗和预防心脏先天性疾病提供了新的思路。
4 结论
1)斑马鱼与脊椎动物Hoxb3a氨基酸比对结果显示,其间具有较高的保守性,斑马鱼Hoxb3a与人、大鼠和小鼠的氨基酸序列在调控DNA结合的同源框结构域高度保守,具有相似的蛋白功能。
2)通过对斑马鱼中的hoxb3a基因进行敲降,发现敲降组斑马鱼胚胎在受精后3 d时,出现了心包腔肿大、心脏环化异常和泵血异常等表型,表明hoxb3a基因对心脏发育过程有影响。
3)通过显微注射、实时荧光定量PCR和胚胎原位杂交等试验技术,揭示了hoxb3a基因通过影响心脏相关基因nkx2.5、gata4、nppa与fgf8a的表达,参与斑马鱼早期心脏发育的过程。
[1] GITTENBERGER-DE GROOT A C,CALKOEN E E,POELMANN R E,et al.Morphogenesis and molecular considerations on congenital cardiac septal defects[J].Annals of Medicine,2014,46(8):640-652.
[2] BRUNEAU B G.The developmental genetics of congenital heart disease[J].Nature,2008,451(7181):943-948.
[3] BUCKINGHAM M,MEILHAC S,ZAFFRAN S.Building the mammalian heart from two sources of myocardial cells[J].Nature Reviews Genetics,2005,6(11):826-835.
[4] VINCENT S D,BUCKINGHAM M E.How to make a heart[J].Current Topics in Developmental Biology, 2010, 90:1-41.
[5] BERTRAND N,ROUX M,RYCKEBÜSCH L,et al.Hox genes define distinct progenitor sub-domains within the second heart field[J].Developmental Biology,2011,353(2):266-274.
[6] AHMAD S M.Conserved signaling mechanisms in Drosophila heart development[J].Developmental Dynamics,2017,246(9):641-656.
[7] TAO Y, SCHULZ R A.Heart development in Drosophila[J].Seminars in Cell &Developmental Biology,2007,18(1):3-15.
[8] VIEUX-ROCHAS M,MASCREZ B,KRUMLAUF R,et al.Combined function of HoxA and HoxB clusters in neural crest cells[J].Developmental Biology,2013,382(1):293-301.
[9] MANLEY N R, CAPECCHI M R.Hox group 3 paralogs regulate the development and migration of the thymus,thyroid,and parathyroid glands[J].Developmental Biology,1998,195(1):1-15.
[10] BOUCHERAT O,MONTARON S,BÉRUBÉ-SIMARD F A,et al.Partial functional redundancy between Hoxa5 and Hoxb5 paralog genes during lung morphogenesis[J].American Journal of Physiology:Lung Cellular and Molecular Physiology,2013,304(12):L817-L830.
[11] ZHU S M,YANG Z,ZHANG Z,et al.HOXB3 drives WNT-activation associated progression in castration-resistant prostate cancer[J].Cell Death &Disease,2023,14(3):215.
[12] ZAFFRAN S,KELLY R G.New developments in the second heart field[J].Differentiation,2012,84(1):17-24.
[13] LIU J D,STAINIER D Y R.Zebrafish in the study of early cardiac development[J].Circulation Research,2012,110(6):870-874.
[14] PRUMMEL K D,HESS C,NIEUWENHUIZE S,et al.A conserved regulatory program initiates lateral plate mesoderm emergence across chordates[J].Nature Communications,2019,10:3857.
[15] DEVINE W P,WYTHE J D,GEORGE M,et al.Early patterning and specification of cardiac progenitors in gastrulating mesoderm[J].eLife,2014,3:e03848.
[16] BROWN D R,SAMSA L A,QIAN L,et al.Advances in the study of heart development and disease using zebrafish[J].Journal of Cardiovascular Development and Disease,2016,3(2):13.
[17] HUTSON M R,KIRBY M L.Neural crest and cardiovascular development:a 20-year perspective[J].Birth Defects Research Part C:Embryo Today:Reviews,2003,69(1):2-13.
[18] LIU Y J,CHEN S,ZÜHLKE L,et al.Global birth prevalence of congenital heart defects 1970—2017:updated systematic review and meta-analysis of 260 studies[J].International Journal of Epidemiology,2019,48(2):455-463.
[19] 刘云,王丛丛,郭亚南,等.海七鳃鳗pma-miR-200 c-3 p对斑马鱼心脏发育的作用研究[J].大连海洋大学学报,2016,31(5):510-515.
LIU Y,WANG C C,GUO Y N,et al.Functional effects of pma-miR-200 c-3 p of sea lamprey on heart development of zebrafish[J].Journal of Dalian Ocean University,2016,31(5):510-515.(in Chinese)
[20] ZHANG H R,XIE J J,SO K K H,et al.Hoxb3 regulates Jag1 expression in pharyngeal epithelium and affects interaction with neural crest cells[J].Frontiers in Physiology,2021,11:612230.
[21] WONG E Y M,WANG X A,MAK S S,et al.Hoxb3 negatively regulates Hoxb1 expression in mouse hindbrain patterning[J].Developmental Biology,2011,352(2):382-392.
[22] MAGNUSSON M,BRUN A C M,LAWRENCE H J,et al.Hoxa9/hoxb3/hoxb4 compound null mice display severe hematopoietic defects[J].Experimental Hematology,2007,35(9):1421.e1-1421.e9.
[23] HADRYS T,PUNNAMOOTTIL B,PIEPER M,et al.Conserved co-regulation and promoter sharing of hoxb3a and hoxb4a in zebrafish[J].Developmental Biology,2006,297(1):26-43.
[24] MACHON O,MASEK J,MACHONOVA O,et al.Meis2 is essential for cranial and cardiac neural crest development[J].BMC Developmental Biology,2015,15:40.
[25] HAMI D,GRIMES A C,TSAI H J,et al.Zebrafish cardiac development requires a conserved secondary heart field[J].Development,2011,138(11):2389-2398.
[26] SOUIDI A,JAGLA K.Drosophila heart as a model for cardiac development and diseases[J].Cells,2021,10(11):3078.
[27] MALLO M.Shaping Hox gene activity to generate morphological diversity across vertebrate phylogeny[J].Essays in Biochemistry,2022,66(6):717-726.
[28] HOLLAND P W H.Evolution of homeobox genes[J].Wiley Interdisciplinary Reviews:Developmental Biology,2013,2(1):31-45.
[29] GAUNT S J.The significance of Hox gene collinearity[J].The International Journal of Developmental Biology,2015,59(4/5/6):159-170.
[30] BLUM M,DE ROBERTIS E M,WALLINGFORD J B,et al.Morpholinos:antisense and sensibility[J].Developmental Cell,2015,35(2):145-149.
[31] KEMMLER C L,RIEMSLAGH F W,MORAN H R,et al.From stripes to a beating heart:early cardiac development in zebrafish[J].Journal of Cardiovascular Development and Disease,2021,8(2):17.
[32] TOVAR J A.The neural crest in pediatric surgery[J].Journal of Pediatric Surgery,2007,42(6):915-926.
[33] SONG M Y,YUAN X F,RACIOPPI C,et al.GATA4/5/6 family transcription factors are conserved determinants of cardiac versus pharyngeal mesoderm fate[J].Science Advances,2022,8(10):eabg0834.
[34] GRASSINI D R,LAGENDIJK A K,DE ANGELIS J E,et al.Nppa and Nppb act redundantly during zebrafish cardiac development to confine AVC marker expression and reduce cardiac jelly volume[J].Development,2018:dev.160739.
[35] PAFFETT-LUGASSY N,NOVIKOV N,JEFFREY S,et al.Unique developmental trajectories and genetic regulation of ventricular and outflow tract progenitors in the zebrafish second heart field[J].Development,2017,144(24):4616-4624.