凡纳滨对虾(Litopenaeus vannamei)为中国重要的甲壳类养殖对象。凡纳滨对虾粗蛋白质含量接近20%,比南极磷虾高出近20%[1],脂肪含量较低,以不饱和脂肪酸为主,故其营养价值较高。然而,对虾捕捞后极易受到内源酶和微生物的影响,导致其发生腐败、变质,影响其食用安全和商业价值。
微冻保鲜技术是一种利用低温技术使食品中部分水形成冰晶来保存食物的方法。微冻保鲜技术不仅能比冷藏保鲜更有效抑制内源酶活性及微生物的生长代谢活动、延长食品的保质期,而且能比冻藏保鲜更好地维持食品品质,因此,在水产品低温保鲜领域具有较好的应用前景[2]。然而,微冻在食品内部产生冰晶的形态、大小具有不稳定性,会使细胞内部的各种理化反应受到更为复杂的影响,导致食品解冻后质地软化、汁液损失增加;部分耐寒腐败微生物在低温条件下依旧可以进行代谢活动,对肌肉品质的新鲜度造成不利影响。因此,探究凡纳滨对虾在微冻贮藏过程中的肌肉代谢特征,可以进一步揭示对虾肌肉在贮藏过程中发生的变化。
代谢组学是利用各种技术手段对某一特定生物系统中代谢产物的种类、数量及其变化规律进行系统研究的方法。在食品领域,非靶向代谢组学已被用于探索食物及其原材料的代谢机制。赵萍等[3]通过非靶向代谢组学,研究了冷藏过程中大鲵(Andrias davidianus)肌肉中差异代谢物的种类与变化规律,并发现了肌酸、L-组氨酸和L-谷氨酸等7种潜在的生物标志物;Yu等[4]通过非靶向代谢组学探究了经电子束辐照处理后的中华管鞭虾(Solenocera melantho)在不同冷藏时间点的代谢差异,从分子角度论证了辐照可以延长肌肉的保质期且不会影响其食品安全。徐昙烨等[5]通过UPLC-MS 代谢组学技术研究了品质易逝期贝类的代谢规律,发现湿藏36 h后活体虾夷扇贝(Patinopecten yessoensis)的代谢产物与新鲜样品具有显著性差异,能比传统指标更灵敏地反映活体贝类的实际状态。本研究中,利用LC-MS非靶向代谢组学结合多元统计方式筛选差异代谢物,对其涉及的代谢通路进行分析,并将关键代谢物与品质指标进行相关性分析,以期为揭示凡纳滨对虾在微冻贮藏过程中的代谢规律提供科学参考。
1 材料与方法
1.1 材料
试验用虾为购于广东省广州市华润万家超市的鲜活凡纳滨对虾,体质量为(13±1)g。
仪器设备:液相色谱仪(Ultimate 3000,美国Thermo 公司);质谱仪(Q Exactive,美国Thermo 公司);H1850R台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);Sunrize吸光酶标仪(瑞士Tacan公司);QTS 25型质构仪(英国CNS FARNELL公司)。
试剂:甲醇、乙腈为色谱级(美国Thermo 公司),氯仿为色谱级(上海沃凯药业有限公司),2-氯-L-苯丙氨酸为色谱级[阿拉丁试剂(上海)有限公司],甲酸为色谱级(东京化成工业株式会社),甲酸铵为色谱级(德国Sigma公司)。Bradford蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 样品采集 将鲜活对虾迅速运送至实验室,用冰猝死后用流动水清洗、沥干,除去虾头,装入密封袋。将处理好的虾贮藏于-3 ℃的恒温培养箱中。代谢组样品分别于贮藏0、10、20、30 d时取样,每组样品各取2 g置于冻存管中,用液氮速冻后置于冰箱中以待后续的非靶向代谢组分析;品质试验样品分别于贮藏0、5、10、15、20、25、30 d时取样,以待后续品质试验分析。
1.2.2 代谢组样品前处理 称量100 mg样品于离心管中,加入1 mL 组织提取液[含75%的甲醇-氯仿(二者的体积比为9∶1)和25%的H2O]。加入3颗钢珠后置于组织研磨器中研磨(50 Hz)1 min,重复上述步骤2次。将样本于室温下超声30 min后,静置于冰水浴30 min。离心(12 000 r/min,4 ℃)15 min后取上清液进行浓缩干燥。所得物质加入200 μL 2-氯-L-苯丙氨酸溶液(4 mg/L,用体积分数为50%的乙腈配制)复溶,过膜后将滤液加入检测瓶中,进行LC-MS检测。为校正混合样品分析结果的偏差、平衡测定仪器的状态及数据处理所产生的误差,从提取好的所有待测样本中取部分混合成QC样本(quality control,QC),与其余待测样本一起进行分析,并在测序过程中用以评价系统的稳定性。
1.2.3 LC-MS分析条件 色谱条件:ACQUITY UPLC® HSS T3(2.1×150 mm,1.8 μm)色谱柱,流速为0.25 mL/min,柱温为40 ℃,进样量为2 μL。正离子模式:流动相为0.1%甲酸乙腈(A)和0.1%甲酸水(B)(均为体积分数)。梯度洗脱程序:0~1 min,2% A;1~9 min,2%~50% A;9~12 min,50%~98% A;12~13.5 min,98% A;13.5~14 min,98%~2% A;14~20 min,2% A。负离子模式:流动相为乙腈(C)和5 mmol 甲酸铵水(D)。梯度洗脱程序:0~1 min,2% C;1~9 min,2%~50% C;9~12 min,50%~98% C;12~13.5 min,98% C;13.5~14 min,98%~2% C;14~17 min,2% C[6]。
质谱条件:分别采用正、负离子扫描模式,正离子喷雾电压为3.50 kV,负离子喷雾电压为-2.50 kV;鞘气流速(arbitrary)为30,辅助气流速为10;毛细管温度为325 ℃;一级离子扫描范围为81~1 000(m/z),分辨率为70 000,MS/MS分辨率为17 500[7]。
1.2.4 贮藏品质试验
1)持水力。参考刘淑慧[8]的方法并稍作改动。取(2.0±0.2)g虾肉于滤纸上,以1 500 g常温离心10 min,记录样品的初始质量(M)与离心后的质量(m)。持水力(%)计算公式为
持水力=m/M×100%。
(1)
2)质构。参考Chen等[9]的方法并稍作改动。虾在完全解冻后去壳,采用QTS-25 型质构仪,在TPA模式下测定第二腹节虾肉的硬度、弹性,选取探头TA44,测试速度为1 mm/s,触发力为5.0 g,测试距离为5 mm。
3)pH。参考Elvira López-Caballero等[10]的方法并稍作改动。称取(2.0±0.2)g虾肉于离心管中,加入20 mL蒸馏水,匀浆10 s,采用pH计进行测定。重复测定3次,取其平均值。
4)肌原纤维蛋白(myofibrillar protein,MP)含量。参考曹淑敏等[11]的方法并稍作改动。取(2.0±0.2)g第一腹节虾肉于离心管中,加入20 mL浓度为50 mmol/L的KCl(4 ℃)后均质10 s,以8 000 r/min(4 ℃)离心5 min。取沉淀加入20 mL浓度为0.6 mol/L的KCl(含20 mmol/L Tris-马来酸)(pH 7.0),均质10 s后将样品于4 ℃下静置1 h,以8 000 r/min(4 ℃)离心10 min,所得上清液即为MP溶液。使用Bradford试剂盒对提取的MP溶液进行测定。
5)疏水性和浊度。参考张喜才[12]对疏水性进行测定的方法。用20 mmol/L的磷酸缓冲溶液(pH 7.0)稀释上述制备的MP溶液至1 mg/mL,取1 mL稀释后的蛋白溶液(对照取1 mL磷酸缓冲溶液),加入200 μL溴酚蓝溶液(1 mg/mL,用无水乙醇配制),室温下振荡15 min,4 ℃下以2 000 g离心15 min,取上清液加入磷酸缓冲溶液稀释10倍后,于595 nm处测定吸光度A值。疏水性(μg/mg prot)计算公式为
疏水性=200 μg×(A对照-A样品)/A对照。
(2)
参考鲁小川[13]对浊度进行测定的方法。用20 mmol/L的磷酸缓冲溶液(pH 7.0)稀释上述制备的MP溶液至5 mg/mL,取5 mL稀释后的蛋白溶液在55 ℃下水浴30 min(空白组取5 mL磷酸缓冲溶液),冰浴冷却后用磷酸缓冲溶液将该溶液稀释至1 mg/mL,于600 nm处测定吸光度A值。浊度计算公式为
浊度=A样品-A空白。
(3)
1.2.5 差异代谢物的筛选及其相关分析 通过Proteowizard 3.0.8789软件包将获得的代谢组数据整理得到mzXML格式。采用R XCMS软件包对峰进行检测、过滤和对齐处理,得到物质定量列表。采用公共数据库HMDB、PubChem、KEGG及苏州帕诺米克生物医药科技有限公司自建物质库进行物质的鉴定。采用R软件包Ropls对样本数据进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA)并作图。结合VIP值、FC值和P 值对样本筛选差异代谢物,通过Pathway 数据库进行代谢通路富集分析。采用SPSS 25.0软件进行Pearson相关性分析。
1.3 数据处理
所有品质指标均重复测定3~6次,试验结果均以平均值±标准差(mean±S.D.)表示。采用JMP 14.3.0软件进行方差分析和Tukey HSD多重比较,显著性水平设为0.05。采用Origin 2021软件作图。
2 结果与分析
2.1 质控与PCA分析结果
采用无监督主成分分析(unsupervised PCA)对不同微冻时间下凡纳滨对虾的肌肉代谢产物进行降维分析。从图1可见:QC样本紧密聚集在一起,说明仪器采集数据时能保持较高的稳定性;不同贮藏时间的肌肉样本间均无重复堆叠,说明各个样本间的数据可以明确区分。
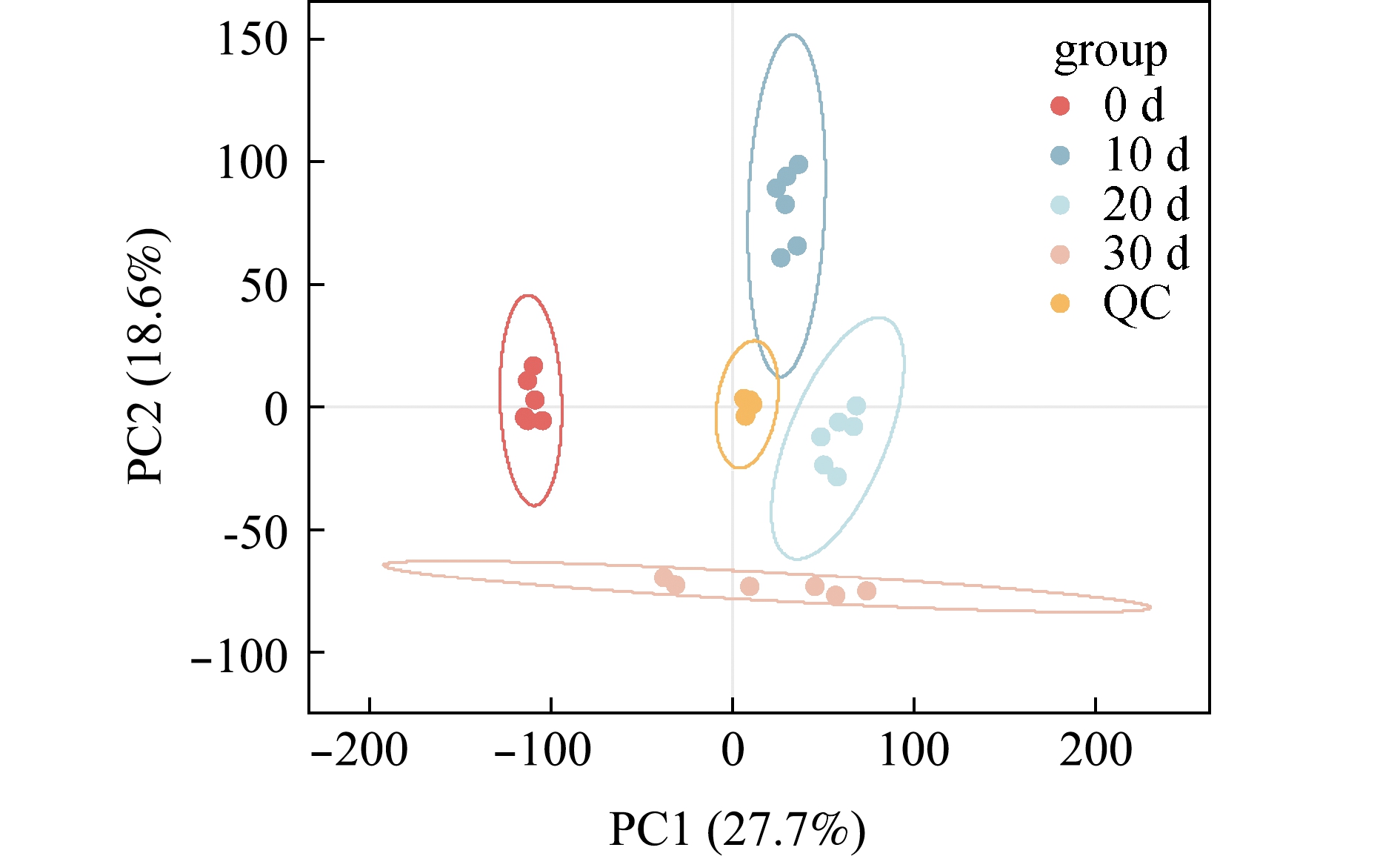
图1 QC样本与贮藏0、10、20、30 d试验样本的PCA得分
Fig.1 PCA score plot of QC group and experimental group in storage for 0,10,20 and 30 day
从图2可见:0 d vs 10 d、0 d vs 20 d和0 d vs 30 d的主成分累积贡献率(R2X)分别达到62.1%、65.9%和65.3%,均超过50%,说明其拟合性较好,所建立模型较为可靠;不同贮藏时间的对虾肌肉样品与对照组0 d相比,存在显著的远离趋势,说明随着贮藏时间的变化,对虾肌肉中代谢物与新鲜样品存在明显差异。
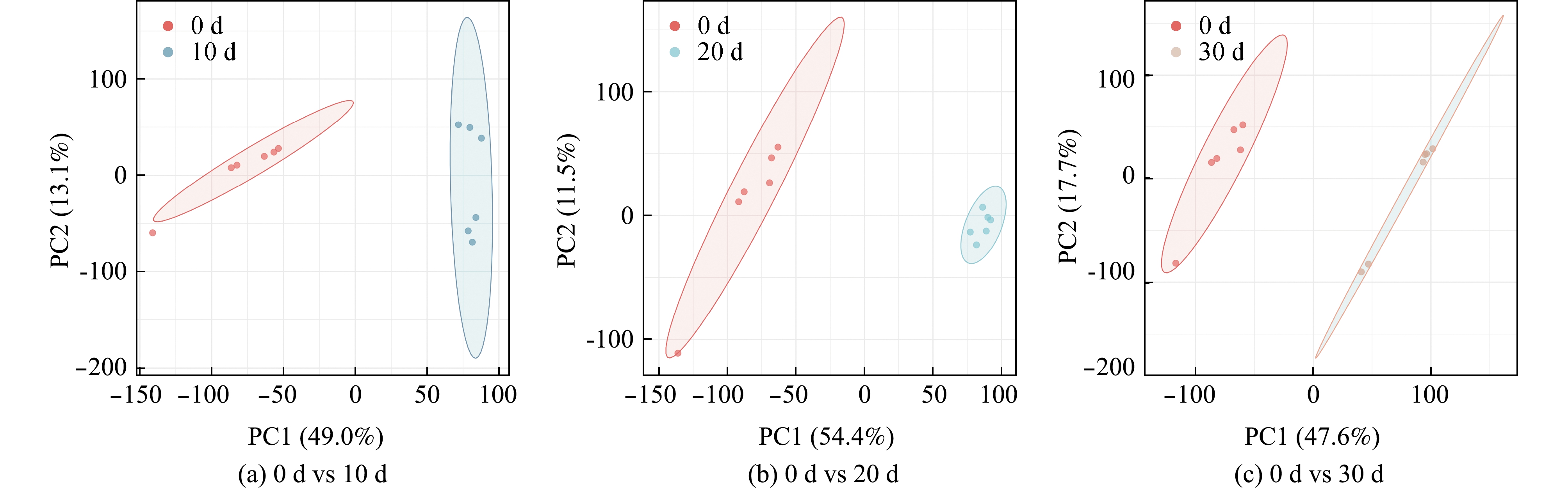
图2 PCA得分
Fig.2 PCA score plot
2.2 OPLS-DA分析结果
OPLS-DA模型可进一步揭示不同微冻贮藏时间下各组样品间的代谢差异。从图3(a)~(c)可见,贮藏10、20、30 d组的肌肉样本均与0 d组样品分别位于两侧,表明不同贮藏时期的样本中代谢物均较新鲜样品具有明显差异。采用200次响应的置换检验对OPLS-DA模型进行有效性验证,结果如图3(d)~(f)所示,3个对比组的交叉验证直线斜率均较大,说明未出现过拟合现象。这表明,该模型可用于进一步分析。
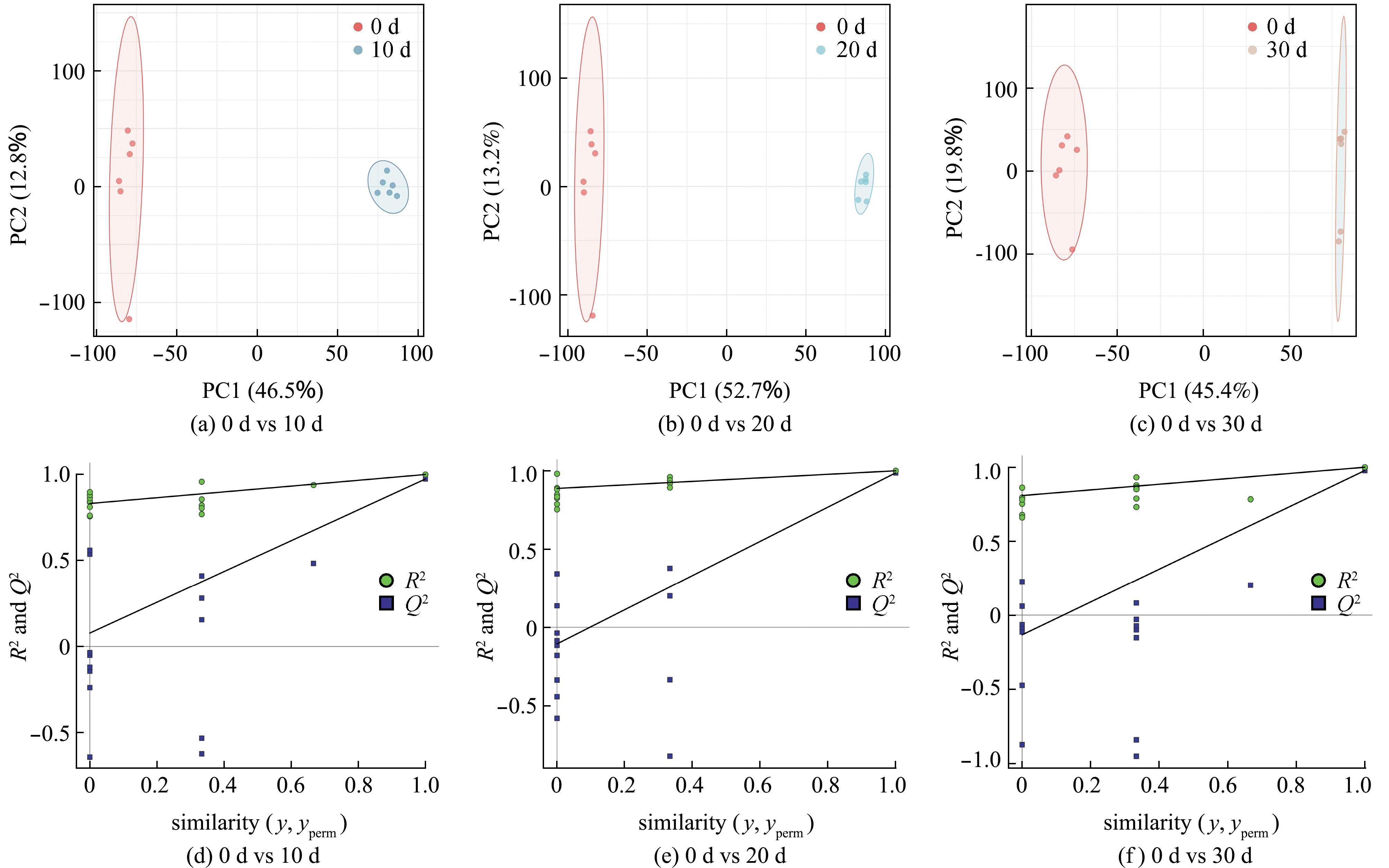
图3 OPLS-DA得分与响应排序检验
Fig.3 OPLS-DA score plots and response ranking test
2.3 不同微冻时间下对虾肌肉中差异代谢物的筛选与分类
基于OPLS-DA模型,本试验中以VIP>1.2、P<0.05作为筛选差异代谢物的标准,在0 d vs 10 d、0 d vs 20 d和0 d vs 30 d这3组中分别获得122、148和174种差异代谢物。为分析3组数据中具有代表性的差异代谢物,将其中共有的差异代谢物进行汇总(表1)。
表1 不同微冻贮藏时间下差异代谢物的筛选结果
Tab.1 Screening results of differential metabolites in Pacific white shrimp at various superchilling storage periods

类别 classification代谢物 metabolite代谢物峰面积 perk area of the metabolites0 d10 d20 d30 d氨基酸类及其衍生物 amino acids and their derivativesL-赖氨酸 L-lysine3.76×1081.43×1092.20×1092.13×109(2s)-2-{[1-羧乙基]氨基}戊酸酯(2s)-2-{[1-(r)-carboxyethyl]amino}pentanoate7.38×1076.07×1086.77×1084.86×108L-缬氨酸 L-valine1.47×1093.67×1095.54×1096.67×109N-乙酰基-L-苯丙氨酸 N-acetyl-L-phenylalanine1.77×1061.44×1073.63×1072.63×107L-天冬氨酸 L-aspartic acid1.35×1084.23×1071.71×1075.43×106酵母氨酸 saccharopine3.86×1082.61×1093.92×1093.55×109阿斯巴甜 aspartame4.80×1062.56×1083.69×1083.36×108甲亚氨基谷氨酸 formiminoglutamic acid8.50×1067.85×1079.12×1071.17×108不对称二甲基精氨酸 asymmetric dimethylarginine5.95×1071.83×1082.51×1083.68×108N2-γ-谷氨酰基谷氨酰胺 N2-gamma-glutamylglutamine2.17×1076.00×1078.40×1077.61×107脲基琥珀酸 ureidosuccinic acid1.21×1083.03×1071.55×1071.43×107吲哚乳酸 indolelactic acid1.35×1066.19×1061.50×1074.81×107瓜氨酸 citrulline1.02×1071.22×1083.78×1079.40×107精氨酸琥珀酸 argininosuccinic acid8.00×1078.82×1081.21×1092.31×109D-鸟氨酸 D-ornithine7.85×1085.72×1095.72×1096.44×109D-4′-磷酸泛酸酯 D-4′-phosphopantothenate1.59×1062.17×1073.35×1072.96×107L-蛋氨酸 L-methionine7.61×1081.78×1091.90×1091.70×109哌啶酸 pipecolic acid5.19×1091.06×10101.20×10101.09×1010亚氨基精氨酸 iminoarginine1.29×1084.96×1087.66×1088.46×108白三烯 C4 leukotriene C41.68×1082.49×1071.89×1076.78×106Γ-谷氨酰丙氨酸 gamma-glutamylalanine1.21×1083.92×1084.42×1083.27×108N-乙酰亮氨酸 N-acetylleucine7.86×1065.93×1071.44×1081.27×108Β-丙氨酰-L-赖氨酸 Beta-alanyl-L-lysine1.65×1075.67×1076.68×1078.16×107氧化谷胱甘肽 oxidized glutathione2.00×1082.59×1073.60×1071.70×107L-胱硫氨酸 L-cystathionine2.24×1071.36×1081.58×1082.42×1082-酮-6-乙酰氨基二酸酯 2-Keto-6-acetamidocaproate2.31×1083.51×1076.76×1072.94×107麦角硫因 ergothioneine1.14×1073.59×1088.08×1084.70×108(2s,5s)-反式羧甲基脯氨酸 (2s,5s)-trans-carboxymethylproline3.32×1086.97×1092.33×1091.46×109糖类及其衍生物 carbohydrates and their derivatives海藻糖 trehalose2.21×1094.08×1082.83×1081.40×108N-乙酰基-D-氨基葡萄糖 N-acetyl-D-glucosamine1.67×1075.89×1079.58×1071.30×108葡萄糖酸 gluconic acid5.17×1072.52×1083.44×1084.68×1082-氨基-2-脱氧-D-葡萄糖酸酯 2-amino-2-deoxy-D-gluconate2.16×1068.40×1072.21×1082.72×108N-乙酰胞壁酸酯 N-acetylmuramate1.29×1061.07×1072.36×1074.96×107天冬氨酸糖胺 aspartylglycosamine1.62×1056.25×1064.69×1064.49×106磷酸二羟基丙酮 dihydroxyacetone phosphate3.02×1083.22×1072.50×1072.66×107有机酸类及其衍生物organic acids and their derivatives3-(甲硫基)丙酸 3-methylthiopropionic acid1.82×1065.44×1066.13×1071.42×108棕榈油酸 palmitoleic acid3.13×1072.53×1069.03×1051.32×106N-乙酰基-L-2-氨基-6-氧代咪酸酯 N-acetyl-L-2-amino-6-oxopimelate1.62×1089.30×1081.09×1091.68×10912-羟基十二烷酸 12-hydroxydodecanoic acid3.32×1066.28×1061.05×1071.02×107氧代戊二酸 oxoglutaric acid5.75×1062.08×1082.57×1081.42×108棕榈酸 palmitic acid1.32×1072.14×1061.84×1061.01×106抗坏血酸盐 ascorbate6.26×1081.34×1092.09×1092.38×1091-丁烯-1,2,4-三羧酸酯 (Z)-but-1-ene-1,2,4-tricarboxylate9.51×1071.95×1083.20×1084.13×108柠檬酸 citric acid9.87×1071.08×1091.50×1091.18×1099,10-环氧十八烯酸 9,10-epoxyoctadecenoic acid5.20×1061.63×1071.67×1071.47×1072-氨基- 2-脱氧异分支酸酯 2-amino-2-deoxyisochorismate1.37×1071.02×1082.16×1082.01×108
表1(续) 不同微冻贮藏时间下差异代谢物的筛选结果
Tab.1 (cont.) Screening results of differential metabolites in Pacific white shrimp at various superchilling storage periods
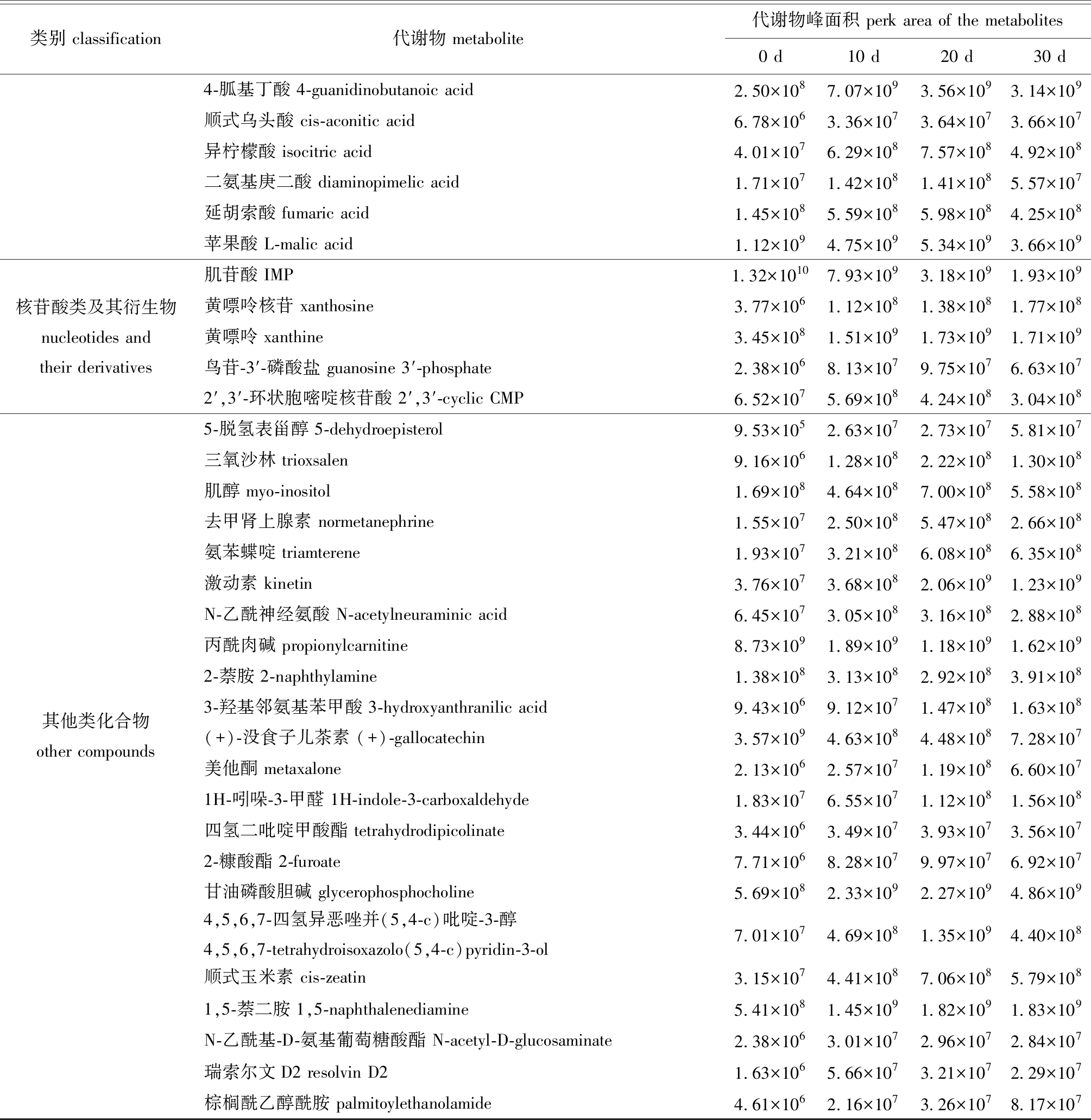
类别 classification代谢物 metabolite代谢物峰面积 perk area of the metabolites0 d10 d20 d30 d4-胍基丁酸 4-guanidinobutanoic acid2.50×1087.07×1093.56×1093.14×109顺式乌头酸 cis-aconitic acid6.78×1063.36×1073.64×1073.66×107异柠檬酸 isocitric acid4.01×1076.29×1087.57×1084.92×108二氨基庚二酸 diaminopimelic acid1.71×1071.42×1081.41×1085.57×107延胡索酸 fumaric acid1.45×1085.59×1085.98×1084.25×108苹果酸 L-malic acid1.12×1094.75×1095.34×1093.66×109核苷酸类及其衍生物 nucleotides and their derivatives肌苷酸 IMP1.32×10107.93×1093.18×1091.93×109黄嘌呤核苷 xanthosine3.77×1061.12×1081.38×1081.77×108黄嘌呤 xanthine3.45×1081.51×1091.73×1091.71×109鸟苷-3′-磷酸盐 guanosine 3′-phosphate2.38×1068.13×1079.75×1076.63×1072′,3′-环状胞嘧啶核苷酸 2′,3′-cyclic CMP6.52×1075.69×1084.24×1083.04×108其他类化合物other compounds5-脱氢表甾醇 5-dehydroepisterol9.53×1052.63×1072.73×1075.81×107三氧沙林 trioxsalen9.16×1061.28×1082.22×1081.30×108肌醇 myo-inositol1.69×1084.64×1087.00×1085.58×108去甲肾上腺素 normetanephrine1.55×1072.50×1085.47×1082.66×108氨苯蝶啶 triamterene1.93×1073.21×1086.08×1086.35×108激动素 kinetin3.76×1073.68×1082.06×1091.23×109N-乙酰神经氨酸 N-acetylneuraminic acid6.45×1073.05×1083.16×1082.88×108丙酰肉碱 propionylcarnitine8.73×1091.89×1091.18×1091.62×1092-萘胺 2-naphthylamine1.38×1083.13×1082.92×1083.91×1083-羟基邻氨基苯甲酸 3-hydroxyanthranilic acid9.43×1069.12×1071.47×1081.63×108(+)-没食子儿茶素 (+)-gallocatechin3.57×1094.63×1084.48×1087.28×107美他酮 metaxalone2.13×1062.57×1071.19×1086.60×1071H-吲哚-3-甲醛 1H-indole-3-carboxaldehyde1.83×1076.55×1071.12×1081.56×108四氢二吡啶甲酸酯 tetrahydrodipicolinate3.44×1063.49×1073.93×1073.56×1072-糠酸酯 2-furoate7.71×1068.28×1079.97×1076.92×107甘油磷酸胆碱 glycerophosphocholine5.69×1082.33×1092.27×1094.86×1094,5,6,7-四氢异恶唑并(5,4-c)吡啶-3-醇4,5,6,7-tetrahydroisoxazolo(5,4-c)pyridin-3-ol7.01×1074.69×1081.35×1094.40×108顺式玉米素 cis-zeatin3.15×1074.41×1087.06×1085.79×1081,5-萘二胺 1,5-naphthalenediamine5.41×1081.45×1091.82×1091.83×109N-乙酰基-D-氨基葡萄糖酸酯 N-acetyl-D-glucosaminate2.38×1063.01×1072.96×1072.84×107瑞索尔文D2 resolvin D21.63×1065.66×1073.21×1072.29×107棕榈酰乙醇酰胺 palmitoylethanolamide4.61×1062.16×1073.26×1078.17×107
从表1可见,在微冻贮藏过程中凡纳滨对虾共有的差异代谢物为79种,其中,包含28种氨基酸类及其衍生物、7种碳水化合物及其衍生物、17种有机酸类及其衍生物、5种核苷酸类及其衍生物和22种其他类化合物。
氨基酸类其衍生物中,少部分代谢物(2-酮-6-乙酰氨基二酸酯、氧化谷胱甘肽、白三烯C4、脲基琥珀酸和L-天冬氨酸)显著下调,这一类物质往往在前10 d减少最为显著,随后在20 d时部分代谢物略有增长,贮藏至30 d时,总体均呈现减少趋势。(2s)-2-[(1-羧乙基)氨基]戊酸酯与瓜氨酸均在第10天时显著上调,在其余贮藏时间内呈现出不规则的波动变化。除上述代谢物外,L-蛋氨酸、D-鸟氨酸和L-赖氨酸等绝大部分氨基酸类代谢物均在0~20 d内显著增加,在20~30 d内呈小幅度增加的趋势。碳水化合物类及其衍生物中,海藻糖和磷酸二羟基丙酮随着贮藏时间的延长显著下调,且该变化在0~10 d内最为显著;而天冬氨酸糖胺、N-乙酰基-D-氨基葡萄糖和葡萄糖酸等其余5种代谢物含量则在整个贮藏过程中显著增加,与海藻糖、磷酸二羟基丙酮呈现相反的变化趋势。有机酸类及其衍生物中,含量显著减少的代谢物为棕榈油酸和棕榈酸,在0~10 d内呈大幅下降趋势,而在10~30 d内表现出小幅下降趋势;而其余有机酸类代谢物含量均在0~10 d内显著增加,且在贮藏后期仍不断上升。核苷酸类及其衍生物中,除肌苷酸(IMP)随贮藏时间的延长逐渐减少外,其余4种核苷酸类代谢物均在整个贮藏过程中显著上调。在其他类化合物中,除(+)-没食子儿茶素、丙酰肉碱外,其余代谢物均显著上调。
2.4 KEGG通路富集
将筛选出的79种差异代谢物映射到KEGG数据库中进行代谢通路富集分析。从图4可见,富集差异极显著的前5条代谢通路分别为氨基酸生物合成、组氨酸与嘌呤衍生生物碱生物合成、赖氨酸生物合成、柠檬酸循环,以及鸟氨酸、赖氨酸和烟酸衍生生物碱生物合成。在氨基酸生物合成中涉及的代谢物最多,包括L-赖氨酸、L-天冬氨酸、柠檬酸在内共计16种差异代谢物,在前10条代谢通路中,氨基酸类代谢通路最多,共有6条,这表明在贮藏过程中,对虾肌肉中蛋白品质发生了显著改变。富集的差异代谢物中,氧代戊二酸、L-赖氨酸、L-天冬氨酸、柠檬酸和异柠檬酸等5种差异代谢物参与了4条以上的代谢通路。涉及的代谢通路越多,说明其在调控对虾肌肉的代谢物和代谢途径变化中越重要[14]。由此可见,上述5种差异代谢物可作为监测凡纳滨对虾在微冻贮藏过程中品质变化的潜在生物标志物。

图4 差异代谢通路富集气泡(前10)
Fig.4 Enrichment bubble diagram of differential metabolic pathway(top 10)
2.5 凡纳滨对虾微冻贮藏期间品质指标的变化
2.5.1 持水力 在微冻贮藏期间,对虾肌肉的持水力显著下降(P<0.05),在贮藏30 d时,虾肉持水力达到了41.75%±1.42%,比新鲜样品降低了68.31%,说明此时虾肉持水力显著下降(表2)。在长期微冻贮藏过程中,外界因素引起的温度细微波动极易产生重结晶现象,使得细胞膜结构受损[15],进而导致样品肌肉持水力下降。
表2 微冻过程中凡纳滨对虾品质指标的变化
Tab.2 Changes in quality indices during superchilling storage of Litopenaeus vannamei
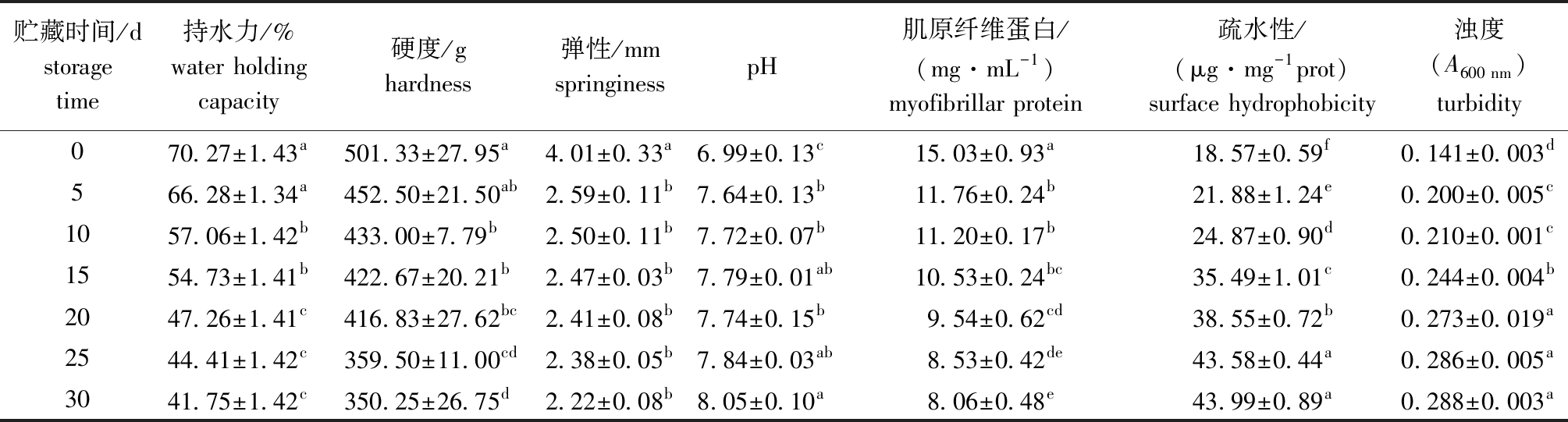
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are no significant differences.
贮藏时间/dstorage time持水力/%water holding capacity硬度/ghardness弹性/mmspringinesspH肌原纤维蛋白/(mg·mL-1)myofibrillar protein 疏水性/(μg·mg-1prot)surface hydrophobicity浊度(A600 nm)turbidity070.27±1.43a501.33±27.95a4.01±0.33a6.99±0.13c15.03±0.93a18.57±0.59f0.141±0.003d566.28±1.34a452.50±21.50ab2.59±0.11b7.64±0.13b11.76±0.24b21.88±1.24e0.200±0.005c1057.06±1.42b433.00±7.79b2.50±0.11b7.72±0.07b11.20±0.17b24.87±0.90d0.210±0.001c1554.73±1.41b422.67±20.21b2.47±0.03b7.79±0.01ab10.53±0.24bc35.49±1.01c0.244±0.004b2047.26±1.41c416.83±27.62bc2.41±0.08b7.74±0.15b9.54±0.62cd38.55±0.72b0.273±0.019a2544.41±1.42c359.50±11.00cd2.38±0.05b7.84±0.03ab8.53±0.42de43.58±0.44a0.286±0.005a3041.75±1.42c350.25±26.75d2.22±0.08b8.05±0.10a8.06±0.48e43.99±0.89a0.288±0.003a
2.5.2 质构 凡纳滨对虾的肌肉硬度在微冻贮藏期间显著下降(P<0.05),弹性则在贮藏前5 d迅速下降(P<0.05),在5 d后下降趋势变缓(P>0.05)(表2)。这表明,微冻贮藏过程中肌肉在嗜冷微生物与内源酶的作用下,组织结构受损,致使对虾肌肉软化、弹性减少。
2.5.3 pH 随着微冻贮藏时间的延长,对虾肌肉的pH显著上升(P<0.05),在第30天时pH超过7.95(表2),表明此时对虾肌肉已严重腐败,达到感官拒绝点[16]。这是由于在长期贮藏过程中,对虾肌肉在微生物和内源酶作用下,体内蛋白质会发生复杂的氧化还原反应,并降解产生氨、胺等碱性物质,从而使对虾肌肉的pH由中性逐渐向碱性偏移。
2.5.4 MP含量 与禽肉类相比,水产肉类的肌原纤维蛋白含量更高。对虾肌肉中的MP含量在微冻过程中逐渐减少,由初始的(15.03±0.93)mg/mL下降至贮藏末期的(8.06±0.48)mg/mL(表2)。在微冻贮藏过程中,肌动蛋白、肌钙蛋白和肌联蛋白等均会在自溶酶的作用下发生降解,影响到虾肉中肌原纤维蛋白的含量,并对肌肉质构产生不利影响。此外,部分水分冻结导致的细胞损伤也可能对蛋白质的结构产生影响,盐溶性蛋白在微冻贮藏过程中的不稳定性比水溶性蛋白更高,更容易变性,这也可能是影响虾肉持水力的重要因素[17]。
2.5.5 疏水性与浊度 在微冻贮藏过程中,对虾肌肉的疏水性和浊度均随贮藏时间的延长显著增加(P<0.05)(表2)。
2.6 代谢物与品质指标的相关性
将参与代谢通路最多的5种代谢物(氧代戊二酸、L-赖氨酸、L-天冬氨酸、柠檬酸和异柠檬酸)与上述品质指标进行相关性分析。从图5可见:氧代戊二酸与所有品质指标相关性均不显著(P>0.05);L-赖氨酸、L-天冬氨酸与品质指标均呈现出极显著相关性(P<0.01),且两者与持水力、弹性和MP 3个品质指标的相关系数r的绝对值均超过0.925;柠檬酸与弹性、pH、MP和浊度4个指标均呈现出良好的相关性(P<0.05);异柠檬酸仅与弹性、浊度呈现出显著相关性(P<0.05)。

图5 代谢物与对虾肌肉品质指标的相关性分析
Fig.5 Pearson correlation analysis between metabolites and muscle quality indices in the shrimp
3 讨论
3.1 微冻贮藏过程中凡纳滨对虾代谢物的变化规律
代谢变化是影响对虾肌肉品质的重要因素。本研究中通过非靶向代谢组学技术,鉴定了凡纳滨对虾在微冻贮藏过程中代谢信息的变化。通过对差异代谢物的定性、定量分析,选取氨基酸类、碳水化合物类、有机酸类和核苷酸类代谢物进行深入讨论。
3.1.1 氨基酸类及其衍生物 氨基酸类代谢物在对虾肌肉中发生的变化,往往与肌肉中蛋白质发生的复杂生化反应密切相关。在贮藏过程中,对虾富含的蛋白质在内源性酶和微生物的共同作用下,往往会发生氧化、降解,生成肽与氨基酸等小分子物质,进而影响到食品品质[18]。天冬氨酸作为鲜味氨基酸之一,是水产品中呈味物质的重要组成部分,其含量会在一定程度上影响对虾肌肉的风味特征,因此,本研究中L-天冬氨酸的减少反映出对虾肌肉在贮藏过程中风味改变和营养流失。除此之外,本研究中L-蛋氨酸、D-鸟氨酸和L-赖氨酸等绝大部分氨基酸类代谢物在0~20 d内显著增加,这些代谢物在贮藏中后期的变化往往受到微生物的腐败代谢影响。L-蛋氨酸可赋予食品苦味[19],经分解代谢易生成具有异味的二甲基硫化物等物质,导致贮藏末期产品品质劣化[20]。L-赖氨酸在贮藏过程中含量有所上升的结果与Shumilina等[19]的报道类似。本研究中,所涉及的氨基酸类代谢物中参与了6条主要的代谢通路,其中,L-天冬氨酸与L-赖氨酸共同参与了氨基酸生物合成、赖氨酸生物合成、2-氧羧酸代谢,以及鸟氨酸、赖氨酸和烟酸衍生生物碱生物合成这4条代谢通路,说明这两种差异代谢物的变化在肌肉代谢过程中受到多种因素的调控。在上述4条代谢通路中,L-天冬氨酸可在多种酶的催化作用下,通过不同的代谢途径转换为L-赖氨酸,这可能说明在贮藏过程中,腐败微生物可以将宿主体内氨基酸类的营养分子作为自己的碳源[21],并在代谢过程中转换生成其他氨基酸类代谢物。
3.1.2 碳水化合物类及其衍生物 碳水化合物是微生物碳源的重要来源,通过碳水化合物代谢途径,肌肉中的碳水化合物被微生物利用、分解,进而为其生长繁殖提供能量。本研究表明,在检测到的碳水化合物类代谢物中,海藻糖和磷酸二羟基丙酮含量随着贮藏时间的延长逐渐减少。王晓晋等[22]研究表明,海藻糖可作为腐败菌的碳源,为其生长繁殖提供能量。磷酸二羟丙酮作为糖酵解的重要中间产物[23],其含量的降低表明糖酵解代谢在对虾肌肉中增强。在本研究的富集通路分析中,磷酸二羟丙酮参与了氨基酸的生物合成代谢通路,表明该代谢产物可能通过多种反应,与多种氨基酸、有机酸类物质实现相互转换。本研究中葡萄糖酸等碳水化合物类代谢物含量则随着贮藏时间的延长逐渐增加。葡萄糖酸作为葡萄糖的代谢产物[24],其含量的增加表明碳水化合物类物质在肌肉中被消耗,造成食品营养损失。
3.1.3 有机酸类及其衍生物 本研究表明,有机酸类及其衍生物中,棕榈油酸和棕榈酸含量随着贮藏时间的延长逐渐减少。作为单不饱和脂肪酸,棕榈油酸易受到温度的影响发生氧化。据报道,水产品富含多不饱和脂肪酸,在不同的保藏、加工过程中,由微生物和酶促氧化引起的脂质降解很容易导致共轭二烯/三烯、过氧化物、醛和酮等次级脂质氧化产物的形成[25],这些成分易使肌肉降解并产生酸败,同时产生腐败气味,令产品可食用性下降。绝大部分有机酸类代谢物(如氧代戊二酸、柠檬酸和4-胍基丁酸等)在贮藏过程中均随着贮藏时间的延长逐渐增加,这部分物质主要来源于腐败菌的生长繁殖和内源酶引起的多种生化反应[14],且其含量的增加可加重产品的异味,使其感官品质下降。本研究中,有机酸类含量均在0~10 d显著增加,且在贮藏后期仍不断上升;同时,鉴定出柠檬酸、异柠檬酸和苹果酸等典型的柠檬酸循环中间产物共5种,这些代谢物的变化表明,腐败菌具有显著的碳水化合物分解代谢的作用[25]。Lou等[26]研究表明,腐败菌在宿主机体中往往会参与三羧酸(TCA)循环等多种代谢通路,从而生成多种有机酸类代谢物。在本研究的代谢通路富集分析中,这些有机酸类代谢物均参与了柠檬酸循环,也证实了微生物能够利用该途径为自身提供所需能量。
3.1.4 核苷酸类及其衍生物 在水产品中,ATP在多种酶的催化下分解、脱氨,进而生成肌苷酸。作为重要的鲜味物质,其变化被认为是重要的新鲜度指示指标[27]。本研究中,对虾肌肉中的肌苷酸在贮藏过程中逐渐减少,这说明对虾肌肉新鲜度下降,其中的肌苷酸已经逐渐转变为次黄嘌呤等腐败产物。黄嘌呤核苷可由肌苷酸合成[28],本研究表明,对虾肌肉中的黄嘌呤核苷含量随着贮藏时间的延长而增加,与肌苷酸变化趋势相反,表明黄嘌呤核苷的积累可能是由肌苷酸转化而来,说明对虾肌肉发生了劣变。
3.2 关键代谢物与品质指标的相关性分析
本研究中,基于代谢物的筛选与KEGG通路分析表明,氧代戊二酸、柠檬酸、异柠檬酸、L-赖氨酸和L-天冬氨酸可以作为凡纳滨对虾在微冻贮藏过程中指示代谢变化的关键代谢物,将其与持水力、质构、pH、MP、疏水性和浊度进行相关性分析。持水力可以反映出肉类组织结构的受损程度。质构是评价水产品食用价值的重要因素。pH的测定是水产品品质评价中最常用的物理方法之一。表面疏水性反映疏水基团在蛋白质分子中的暴露程度,通过溴酚蓝可以对肌原纤维蛋白的构象变化进行监测,并表征疏水位点的暴露情况。一般而言,疏水基团处于蛋白质内部,因此,样品越新鲜,其疏水性越低。浊度可反映肌原纤维蛋白的聚集程度,揭示其空间构象的变化情况。本研究表明,在微冻贮藏过程中,对虾肌肉中的L-赖氨酸与持水力、硬度、弹性和MP呈现出极显著负相关,与pH、疏水性和浊度则呈现出极显著正相关,L-天冬氨酸与上述品质指标则呈现相反趋势。这类代谢产物的变化,代表宿主体内蛋白质发生了劣变,这与本研究中的MP、疏水性和浊度3个蛋白质指标的变化表现出极高的一致性。此外,蛋白质劣化也会致使肌肉组织结合力下降,不利于宿主细胞结构的稳态。本研究中,持水力、硬度与弹性指标在贮藏中显著下降,也能证明这一观点。pH波动与水产品死后的组织变化、肌肉代谢有关,蛋白质在微生物与酶的影响下会产生碱性代谢产物,使得贮藏后肌肉获得较高的pH。柠檬酸与弹性、MP表现出显著负相关,与pH、浊度表现出显著正相关;异柠檬酸与弹性表现出显著负相关,与浊度表现出显著正相关。TCA循环通过氧化葡萄糖和脂肪酸产生二氧化碳为微生物提供能量。本研究中,柠檬酸与异柠檬酸的积累代表对虾肌肉中的腐败微生物对营养物质的消耗,肌肉中蛋白质被水解后,空间结构发生改变,使其蛋白质品质发生劣变[29]。
4 结论
1)本研究中以凡纳滨对虾为研究对象,基于液相色谱-质谱(LC-MS)的非靶向代谢组学揭示了其肌肉在微冻贮藏过程中的代谢变化,从分子角度探索了贮藏30 d内凡纳滨对虾的代谢特征。 PCA模型与OPLS-DA模型分析表明,贮藏10、20、30 d后的样品与新鲜对虾肌肉存在显著代谢差异。
2)通过筛选与分析,在整个贮藏过程中鉴定出79种显著差异代谢物;KEGG分析表明,贮藏中富集代谢通路以氨基酸类代谢通路为主,其中,氧代戊二酸、L-赖氨酸、L-天冬氨酸、柠檬酸和异柠檬酸涉及多条富集代谢通路,可作为揭示微冻对虾肌肉中代谢变化的潜在生物标志物。
3)关键代谢物与品质指标的相关性分析显示,L-赖氨酸、L-天冬氨酸、柠檬酸和异柠檬酸可作为监测凡纳滨对虾在微冻贮藏中品质变化的潜在生物标记物。
[1] 李婉君.南极磷虾与南美白对虾营养与滋味成分比较[D].上海:上海海洋大学,2015.
LI W J.Nutritional and flavor components analysis of Antarctic krill and white shrimp[D].Shanghai:Shanghai Ocean University,2015.(in Chinese)
[2] 马海霞,李来好,杨贤庆,等.水产品微冻保鲜技术的研究进展[J].食品工业科技,2009,30(4):340-344.
MA H X,LI L H,YANG X Q,et al.Research progress of superchilling storage technique for aquatic product[J].Science and Technology of Food Industry,2009,30(4):340-344.(in Chinese)
[3] 赵萍,刘俊霞,兰阿峰,等.基于UPLC-MS非靶向代谢组学分析大鲵肉冷藏过程中代谢物的变化[J].食品科学,2022,43(22):267-280.
ZHAO P,LIU J X,LAN A F,et al.Analysis of metabolites in giant salamander meat during cold storage based on UHPLC-MS non-targeted metabonomics[J].Food Science,2022,43(22):267-280.(in Chinese)
[4] YU Q,PAN H,SHAO H,et al.UPLC/MS-based untargeted metabolomics reveals the changes in muscle metabolism of electron beam irradiated Solenocera melantho during refrigerated storage[J].Food Chemistry,2022,367:130713.
[5] 徐昙烨,田元勇,李亚烜,等.基于UPLC-MS方法的品质易逝期活品虾夷扇贝代谢组学研究[J].大连海洋大学学报,2021,36(4):637-645.
XU T Y,TIAN Y Y,LI Y X,et al.Metabolomics of live Yesso scallop Patinopecten yessoensis during quality determination period by UPLC-MS method[J].Journal of Dalian Ocean University,2021,36(4):637-645.(in Chinese)
[6] ZELENA E,DUNN W B,BROADHURST D,et al.Development of a robust and repeatable UPLC-MS method for the long-term metabolomic study of human serum[J].Analytical Chemistry,2009,81(4):1357-1364.
[7] WANT E J,MASSON P,MICHOPOULOS F,et al.Global metabolic profiling of animal and human tissues via UPLC-MS[J].Nature Protocols,2013,8(1):17-32.
[8] 刘淑慧.重组罗非鱼肉的制备工艺及有机酸改善其品质的研究[D].海口:海南大学,2019.
LIU S H.Study on preparation process of restructured tilapia meat and improvement of its quality by organic acids[D].Haikou:Hainan University,2019.(in Chinese)
[9] CHEN S J,TAO F Y,PAN C,et al.Modeling quality changes in Pacific white shrimp (Litopenaeus vannamei) during storage:comparison of the arrhenius model and random forest model[J].Journal of Food Processing and Preservation,2020,45(1):e14999.
[10] ELVIRA L PEZ-CABALLERO M,MART
PEZ-CABALLERO M,MART NEZ-ALVAREZ O,DEL CARMEA G
NEZ-ALVAREZ O,DEL CARMEA G MEZ-GUILL
MEZ-GUILL N M,et al.Quality of thawed deepwater pink shrimp (Parapenaeus longirostris) treated with melanosis-inhibiting formulations during chilled storage[J].International Journal of Food Science &Technology,2007,42(9):1029-1038.
N M,et al.Quality of thawed deepwater pink shrimp (Parapenaeus longirostris) treated with melanosis-inhibiting formulations during chilled storage[J].International Journal of Food Science &Technology,2007,42(9):1029-1038.
[11] 曹淑敏,赵亚,石启龙.添加剂对南美白对虾冻藏期间蛋白质变性的影响[J].食品与发酵工业,2016,42(10):99-104.
CAO S M,ZHAO Y,SHI Q L.Effects of additives on protein denaturation of Penaeus vannamei during frozen storage[J].Food and Fermentation Industries,2016,42(10):99-104.(in Chinese)
[12] 张喜才.石斑鱼冷藏过程中品质评价、蛋白变化以及内源性蛋白酶作用机制研究[D].上海:上海海洋大学,2020.
ZHANG X C.Study on quality evaluation, protein changes and mechanism of endogenous protease of grouper ( Epinephelus coioides) during refrigerated storage[D].Shanghai:Shanghai Ocean University,2020.(in Chinese)
[13] 鲁小川.孜然精油对微冻贮藏羊肉保鲜效果及机理的研究[D].重庆:西南大学,2020.
LU X C.Study on the fresh-keeping technology and mechanism of cumin essential oil on mutton during superchilling storage[D].Chongqing:Southwest University,2020.(in Chinese)
[14] 金文刚,赵萍,刘俊霞,等.基于GC-MS代谢组学分析大鲵肉冷藏过程中肌肉代谢产物差异[J].食品科学,2022,43(24):192-201.
JIN W G,ZHAO P,LIU J X,et al.Analysis of muscle metabolites of giant salamander (Andrias davidianus) meat during cold storage based on gas chromatography-mass spectrometry metabolomics[J].Food Science,2022,43(24):192-201.(in Chinese)
[15] 杨帆,万金庆,厉建国.微冻贮藏虾仁的水分迁移与品质变化[J].食品与发酵工业,2019,45(20):68-74.
YANG F,WAN J Q,LI J G.Study on water migration and quality changes of shrimp in hyper-chilling storage[J].Food and Fermentation Industries,2019,45(20):68-74.(in Chinese)
[16] GOKOGLU N,GUMUS B,CEYLAN A,et al.Storage in ice incorporated antimelanotic agent and its effects on melanosis and quality of giant red shrimp (Aristaeomorpha foliacea)[J].Food Bioscience,2022,46:101599.
[17] GUDJ NSD
NSD TTIR M,LAUZON H L,MAGN
TTIR M,LAUZON H L,MAGN![]() SSON H,et al.Low field nuclear magnetic resonance on the effect of salt and modified atmosphere packaging on cod (Gadus morhua) during superchilled storage[J].Food Research International,2011,44(1):241-249.
SSON H,et al.Low field nuclear magnetic resonance on the effect of salt and modified atmosphere packaging on cod (Gadus morhua) during superchilled storage[J].Food Research International,2011,44(1):241-249.
[18] 吴盈茹,廖月琴,杜琪,等.盐浓度对冷藏即食中华管鞭虾肌肉品质的影响[J].食品工业科技,2023,44(2):90-97.
WU Y R,LIAO Y Q,DU Q,et al.Effect of salt concentration on muscle quality of frozen ready-to-eat Penaeus chinensis[J].Science and Technology of Food Industry,2023,44(2):90-97.(in Chinese)
[19] SHUMILINA E,CIAMPA A,CAPOZZI F,et al.NMR approach for monitoring post-mortem changes in Atlantic salmon fillets stored at 0 and 4 ℃[J].Food Chemistry,2015,184:12-22.
[20] CIAMPA A,PICONE G,LAGHI L,et al.Changes in the amino acid composition of Bogue (Boops boops) fish during storage at different temperatures by 1H-NMR spectroscopy[J].Nutrients,2012,4(6):542-553.
[21] 尹德凤,张莉,张大文,等.生鲜肉类产品中腐败细菌研究[J].农产品质量与安全,2018(3):21-29.
YIN D F,ZHANG L,ZHANG D W,et al.Study on spoilage bacteria in fresh meat products[J].Quality and Safety of Agro-Products,2018(3):21-29.(in Chinese)
[22] 王晓晋,郭全友,姜朝军.轻微加工即食对虾优势腐败菌鉴定及碳源代谢动力学[J].中国食品学报,2019,19(5):243-252.
WANG X J,GUO Q Y,JIANG C J.Carbonsource metabolism dynamics and identification of dominant spoilage bacteria in lightly preserved ready-to-eat shrimp[J].Journal of Chinese Institute of Food Science and Technology,2019,19(5):243-252.(in Chinese)
[23] 梅鑫,宋玉颜,田维素,等.复合绿茶对高脂血症小鼠有机酸代谢的影响[J].食品研究与开发,2022,43(11):79-91.
MEI X,SONG Y Y,TIAN W S,et al.Effect of compound green tea on organic-acid metabolism in hyperlipidemic mice[J].Food Research and Development,2022,43(11):79-91.(in Chinese)
[24] LIU T,QIAO N,NING F J,et al.Identification and characterization of plant-derived biomarkers and physicochemical variations in the maturation process of Triadica cochinchinensis honey based on UPLC-QTOF-MS metabolomics analysis[J].Food Chemistry,2023,408:135197.
[25] CHENG J H,SUN D W,PU H B,et al.Suitability of hyperspectral imaging for rapid evaluation of thiobarbituric acid (TBA) value in grass carp (Ctenopharyngodon idella) fillet[J].Food Chemistry,2015,171:258-265.
[26] LOU X W,HAI Y W,LE Y,et al.Metabolic and enzymatic changes of Shewanella baltica in golden pomfret broths during spoilage[J].Food Control,2023,144:109341.
[27] LI J T,ZHOU G H,XUE P,et al.Spoilage microbes’ effect on freshness and IMP degradation in sturgeon fillets during chilled storage[J].Food Bioscience,2021,41:101008.
[28] KOYAMA Y,TOMODA Y,KATO M,et al.Metabolism of purine bases,nucleosides and alkaloids in theobromine-forming Theobroma cacao leaves[J].Plant Physiology and Biochemistry,2003,41(11/12):977-984.
[29] LV Y C,YIN X Y,WANG Y,et al.The prediction of specific spoilage organisms in Harbin red sausage stored at room temperature by multivariate statistical analysis[J].Food Control,2021,123:107701.