麒麟菜(Eucheuma)是一种大型海洋经济藻类,广泛分布于中国海南省和东南亚沿海地区[1]。琼枝麒麟菜(Eucheuma gelatinae)经济效益好,易养殖,既可作为众多海珍品的优质饵料,也可在一定程度上净化海域环境[2]。琼枝麒麟菜中富含多糖类物质,具有降血糖[3]、降血脂[4]和抗肿瘤[5]等生物活性功能。Zhong等[3]将从裙带菜(Undaria pinnatifida)中提取的多糖通过DEAE-Sepharosefast-Flow分离纯化得到UP-3和UP-4组分,体外试验显示,其纯化组分对α-葡萄糖苷酶有显著抑制作用,其IC50值分别达到了(113.4±0.3)、(50.5±3.5)μg/mL,远低于阳性对照组阿卡波糖[(337.3±20.7)μg/mL],在动物试验中也能显著降低血糖水平。张婧婧等[6]研究发现,蜈蚣藻(Grateloupia filicina)多糖能够降低由四氧嘧啶造成的高血糖模型小鼠体内的血糖浓度,且高剂量组(0.8 mL/kg)效果与药物剂量组相接近。这些结果表明,海藻多糖具有较好的降血糖功效,未来可在降血糖食品与药品方面发挥重要作用。
琼枝麒麟菜作为一种富含活性多糖的海藻原料,具有较高的研究意义和应用价值。琼枝麒麟菜多糖的生物功能活性常受到其组成、结构和构象的影响,因此,将琼枝麒麟菜粗多糖及其纯化多糖进行分离并对其构效关系进行研究,对琼枝麒麟菜多糖的开发和利用至关重要。通常提取海藻多糖的方法有热水浸提法、物理破碎法、酶解法及复合法等。复合法中的超声波辅助酶法与其他提取方法相比,结合了酶解提取法与物理提取法的优势,使多糖得率更高[1]。本研究中,对采用超声波辅助酶法提取的琼枝麒麟菜多糖进行进一步分离纯化,并对比研究粗多糖和纯化组分的分子量、单糖组成、初步结构及降血糖活性,以期为琼枝麒麟菜多糖的进一步开发利用提供参考。
1 材料与方法
1.1 材料
原料与试剂:琼枝麒麟菜(海南昌江海域);木瓜蛋白酶(酶活性≥2.0×105 U/mg)、纤维素酶(酶活性≥30 U/mg)(上海源叶生物科技有限公司);无水乙醇、DEAE-52纤维素和刚果红(广州近海生物科技有限公司);葡萄糖醛酸、硼砂和葡萄糖标准品(索莱宝科技有限公司);α-淀粉酶(400 U/g)、α-葡萄糖苷酶(0.2 U/mL)(广州威佳科技有限公司);14种单糖标准品、1-苯基-3-甲基-5-吡唑啉酮(PMP)(广州领驭生物科技有限公司);阿卡波糖片(每片含阿卡波糖50 mg)(拜耳医药保健有限公司);对硝基苯-α-D-吡喃葡萄糖(PNPG)(合肥博美生物科技有限责任公司)。
主要仪器与设备:Sunrise-basic Tacan SUNRISE酶标仪(瑞士TECAN公司);UV2550紫外可见分光光度计、IRAffinity-1红外光谱仪(日本岛津公司);UPLC-MS/MS液相色谱质谱联用仪(美国沃特世公司);Bruker icon扫描电子显微镜(美国BRUKER公司)。
1.2 方法
1.2.1 琼枝麒麟菜粗多糖的制备 称取约2 g琼枝麒麟菜粉末,加入超纯水,料液比为1∶100(g∶mL)→调节pH至5.0→超声处理33 min(超声波功率234 W)→加入一定量的酶(木瓜蛋白酶与纤维素酶的质量比为2∶1)→ 67 ℃下恒温酶解1.5 h→灭酶→离心(10 000 r/min,15 min)→取上清液,测定多糖含量→旋转蒸发浓缩→用95%乙醇沉淀(体积分数),4 ℃下过夜→离心取沉淀→冷冻干燥[1],即得粗多糖(记为 EGP)。
1.2.2 琼枝麒麟菜粗多糖的分离纯化 将DEAE-52纤维素活化[7],采用湿法装柱(2.6 cm×50 cm),用3倍柱体积的超纯水进行平衡[8]。取120 mg上述制备的粗多糖溶于20 mL超纯水中,上样于已装柱的DEAE-52纤维素中,依次采用超纯水及0.2、0.4、0.6、0.8、1.0 mol/L浓度的NaCl进行洗脱,每管收集5 mL洗脱液,每个浓度收集40管,采用苯酚-硫酸法示踪,以管数为横坐标,490 nm下的吸光度为纵坐标绘制洗脱曲线[9]。根据洗脱曲线,收集洗脱液,对洗脱液旋转蒸发浓缩,除超纯水外,其他浓度的收集液均采用截留分子量为200的透析袋,于4 ℃冰箱透析48 h以除去盐成分,冷冻干燥,得琼枝麒麟菜纯化多糖。
1.2.3 多糖理化性质测定 采用BCA法测定蛋白质含量,以牛血清白蛋白(BSA)为标准品,根据吸光值推算出蛋白质浓度,得到标准曲线为 y=0.765 6x+0.543 2(R2=0.998 6);采用硫酸咔唑法[10]测定糖醛酸含量,以葡萄糖醛酸为标准品,得到标准曲线为y=3.975 5x+0.013 8(R2=0.997 6);采用氯化钡-明胶比浊法[11]测定硫酸根含量,以硫酸钾为标准品,得到标准曲线为y=0.833 7x-0.000 1(R2=0.995 7)。
1.2.4 琼枝麒麟菜多糖的结构表征
1)分子量测定。采用HPGPC法测定多糖分子量。配制质量浓度为5 mg/L的14种葡聚糖标准混合品和多糖样品,使用0.22 μm微孔滤膜过滤,根据保留时间,由Waters ACQUITY APC系统计算分子量。色谱条件:色谱柱为Waters Ultranhydrogel线性柱(7.8 mm×300 mm);流动相为25 mmol/L Na2HPO4+2 mmol/L NaH2PO4+0.05% NaN3缓冲液;检测器采用示差折光检测器(RID);柱温为35 ℃,流速为0.8 mL/min,进样量为10 μL。
2)单糖组成。采用PMP衍生,HPLC法测定单糖组成[12]。精确称量10 mg样品,加入5 mL浓度为2 mol/L的TFA,使用N2排空气,封管。于110 ℃烘箱中水解2 h,水解后加入0.4 mL水解液和0.4 mL甲醇,于70 ℃水浴锅中反应,用N2吹干后加入0.4 mL浓度为0.3 mol/L NaOH。加入0.4 mL PMP甲醇溶液衍生,80 ℃水浴2 h,加入0.4 mL HCl中和,再加入氯仿,离心去除氯仿相,过0.45 μm微孔膜过滤,利用HPLC进样分析。
色谱条件:色谱柱为AGILENT EC-C18(2.7 μm,2.1 mm×50 mm);流动相A为50 mmol/L乙酸铵缓冲液(pH 8.0),流动相B为乙腈;柱温35 ℃,流动速度为0.4 mL/min,进样量为2 μL。
质谱扫描条件:特征离子扫描模式(SIR),ESI+喷雾电压为2.0 kV,锥孔电压为30 V;离子源温度为150 ℃,脱溶剂温度为500 ℃;脱溶剂气(N2)流速为1 000 L/h。用SIR模式检测离子(荷质比):481.09、495.1,510.1、511.08、525.06。
3)红外光谱分析。称取约1 mg多糖样品与干燥溴化钾混匀,研磨压片,在4 000~500 cm-1区间内扫描[13]。
4)刚果红试验。配制质量浓度为2 mg/L的样品多糖溶液,加入2 mL浓度为80 mmol/L的刚果红,再滴加浓度为1 mol/L的NaOH,使不同溶液中NaOH的终浓度为0~0.5 mol/L,并通过紫外扫描测定各浓度的最大吸收波长[14]。
5)扫描电镜(SEM)观察。取干燥琼枝麒麟菜粗多糖及其纯化多糖放入样品盘中,镀一层金膜,在扫描电镜下观察不同倍数的多糖样品[15]。
1.2.5 体外降血糖活性测定
1)对α-淀粉酶抑制活性的测定。用浓度为0.1 mol/L的磷酸缓冲溶液(pH 6.8)分别配制1 U/mL的α-淀粉酶溶液和质量分数为1%的淀粉溶液,将淀粉溶液在100 ℃水浴锅中煮沸糊化15 min。吸取0.5 mL的α-淀粉酶溶液加入试管中,再分别加入不同浓度的样品溶液和1 mL 0.1 mol/L的磷酸缓冲溶液(pH 6.8),将试管放入37 ℃水浴锅中水浴10 min。吸取0.5 mL的淀粉溶液,37 ℃水浴孵化15 min,加入1 mL DNS试剂,100 ℃下煮沸5 min,再加入4 mL去离子水稀释,冷却至室温后测定540 nm波长下吸光度,记为A1。以水替代酶液,测得的吸光度记为A2;以水替代样品,测得的吸光度记为A3;以水代替酶液和样品,测得的吸光度记为A4。以阿卡波糖为阳性对照,多糖对α-淀粉酶的抑制率计算公式[16]为
α-淀粉酶抑制率=1-[(A1-A2)/(A3-A4)]×100%。
(1)
2)对α-葡萄糖苷酶抑制活性的测定。将琼枝麒麟菜粗多糖样品分别配制成质量浓度为2、1、0.5、0.25、0.125 mg/mL的待测溶液。配制浓度为2.5 μmol/L的PNPG溶液、0.2 mol/L 的Na2CO3溶液和0.2 U/mL的α-葡萄糖苷酶溶液。吸取1.2 mL浓度为0.1 mol/L的磷酸缓冲液(pH 6.8)和0.3 mL不同浓度的多糖样品,加入0.25 mL的α-葡萄糖苷酶溶液,置于37 ℃水浴锅中水浴孵化10 min。孵化结束后加入0.25 mL PNPG溶液,37 ℃水浴孵化20 min,再加入1 mL浓度为0.2 mol/L的Na2CO3溶液终止反应,测定405 nm波长下的吸光度,记为A1。以水替代样品、酶液测得的吸光度分别记为A0和A2。多糖对α-葡萄糖苷酶的抑制率计算公式[17]为
α-葡萄糖苷酶抑制率=1-(A1-A2)/A0×100%。
(2)
1.3 数据处理
每个试验均设置3个生物学重复。试验数据以平均值±标准差(mean±S.D.)表示;采用SPSS 20软件对数据进行方差分析和组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 粗多糖的DEAE-52纤维素柱层析分离纯化
琼枝麒麟菜粗多糖EGP经DEAE-52纤维素层析柱,分别用超纯水及0.2、0.4、0.6、0.8、1.0 mol/L浓度的NaCl进行洗脱,采用苯酚-硫酸法得到洗脱曲线如图1所示,在超纯水及0.2、1.0 mol/L的NaCl洗脱液下得到3个洗脱峰,分别命名为EGP-1、EGP-2、EGP-3。由DEAE-52的分离原理和其作为阴离子交换柱性质可知,EGP-1为中性多糖,EGP-2和EGP-3为酸性多糖,分别收集3个洗脱峰,旋蒸蒸发浓缩,将EGP-2和EGP-3浓缩后再透析48 h,去除其中的盐成分,最后冷冻干燥得到3个组分的多糖。
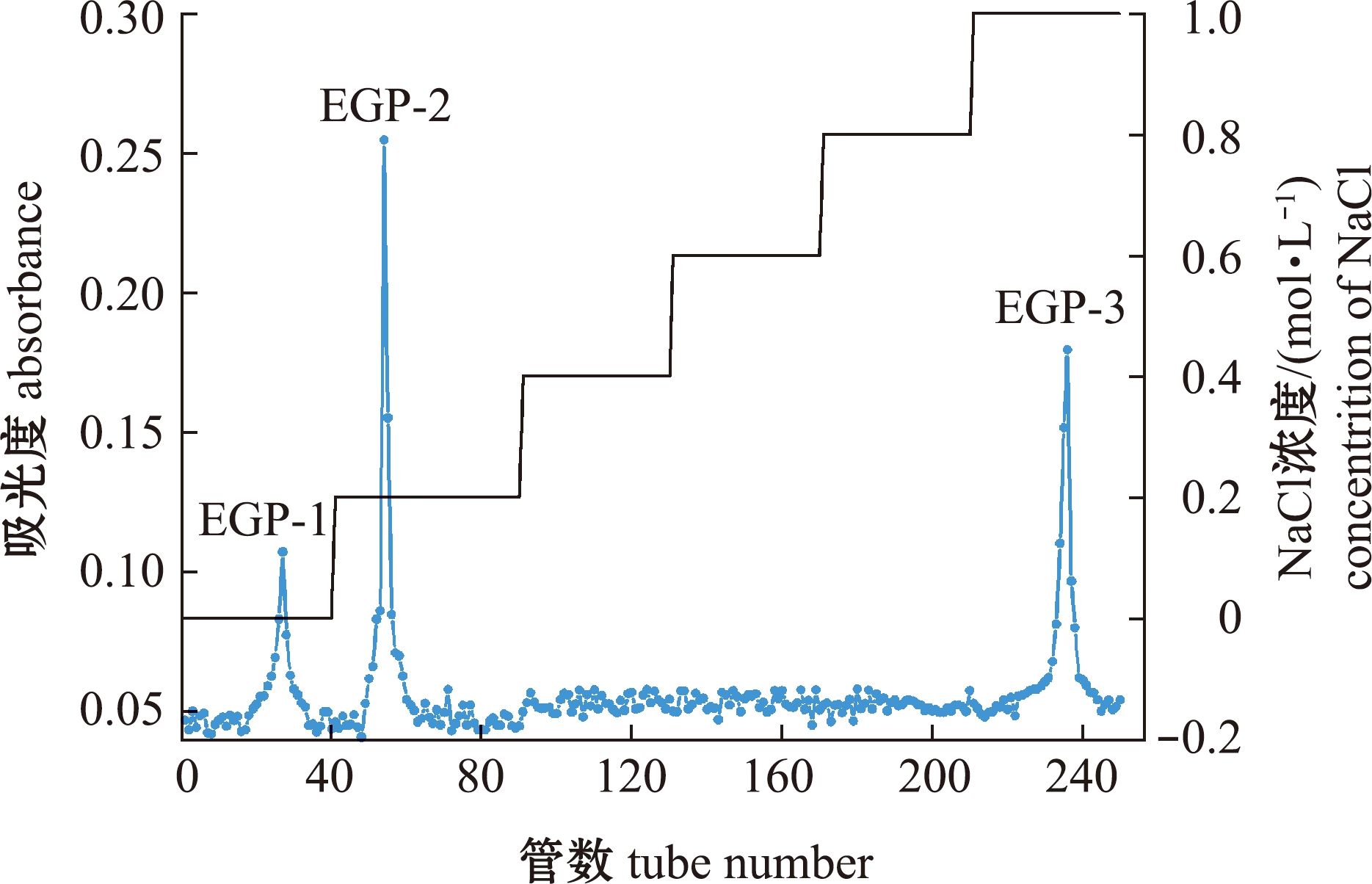
图1 琼枝麒麟菜多糖在DEAE-52柱层析下的洗脱曲线
Fig.1 Elution curve of Eucheuma gelatinae polysaccharide on DEAE-52 ion exchange column
2.2 琼枝麒麟菜多糖的理化性质
从表1可见:经过DEAE-52柱层析后,纯化多糖EGP-1的蛋白质含量与未纯化多糖EGP相比有了显著降低(P<0.05),而EGP-2、EGP-3未检测出蛋白质含量;除EGP-1的糖醛酸含量外,3个纯化多糖的糖醛酸和硫酸根含量均较EGP显著提高(P<0.05)。
表1 粗多糖及其纯化多糖的理化性质
Tab.1 Physicochemical properties and contents of crude polysaccharide and purified polysaccharide %
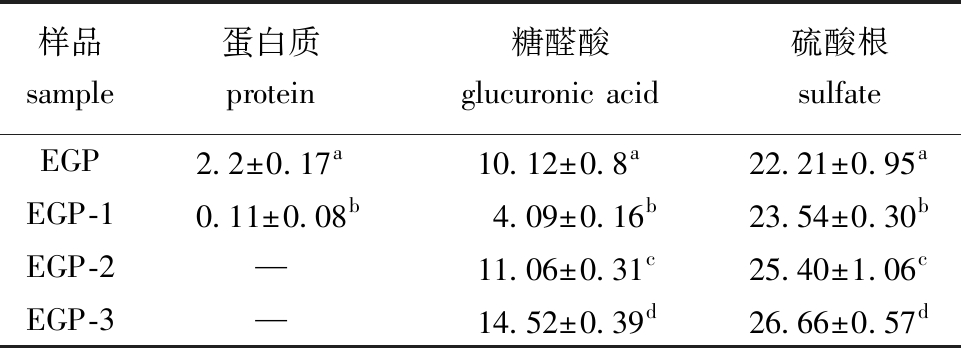
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
样品sample蛋白质protein糖醛酸glucuronic acid 硫酸根sulfateEGP2.2±0.17a10.12±0.8a22.21±0.95aEGP-10.11±0.08b4.09±0.16b23.54±0.30bEGP-2—11.06±0.31c25.40±1.06cEGP-3—14.52±0.39d26.66±0.57d
2.3 琼枝麒麟菜多糖的结构表征
2.3.1 各多糖组分的分子量 从表2可见,经过DEAE-52纯化得到的3个组分EGP-1、EGP-2、EGP-3与EGP相比,其重均分子量(Mw)显著降低(P<0.05),其中EGP-1下降程度最大。
表2 粗多糖及其纯化多糖的相对分子质量
Tab.2 Molecular mass of crude polysaccharide and purified polysaccharide
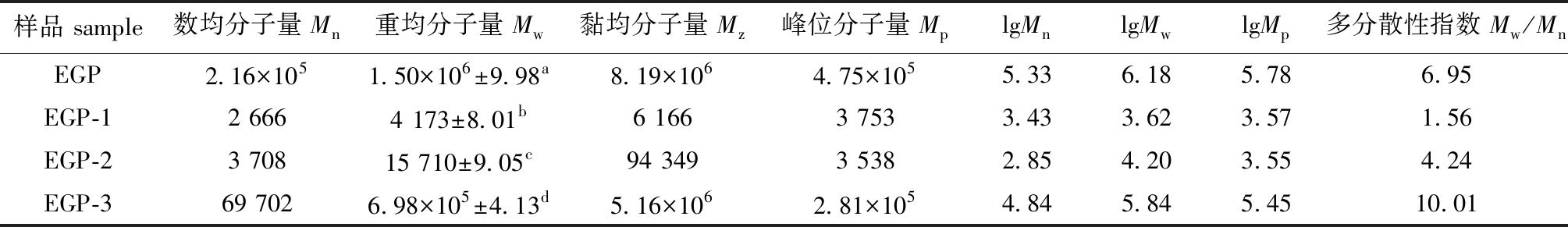
样品 sample数均分子量 Mn重均分子量 Mw黏均分子量 Mz峰位分子量 MplgMnlgMwlgMp多分散性指数 Mw/MnEGP2.16×1051.50×106±9.98a8.19×1064.75×1055.336.185.786.95EGP-12 6664 173±8.01b6 1663 7533.433.623.571.56EGP-23 70815 710±9.05c94 3493 5382.854.203.554.24EGP-369 7026.98×105±4.13d5.16×1062.81×1054.845.845.4510.01
2.3.2 各多糖组分的单糖组成 14种标准品单糖为古洛糖醛酸(GulUA)、甘露糖醛酸(ManUA)、葡萄糖醛酸(GlcUA)、半乳糖醛酸(GalUA)、甘露糖(Man)、氨基半乳糖(GalN)、半乳糖(Gal)、氨基葡萄糖(GlcN)、葡萄糖(Glc)、鼠李糖(Rham)、岩藻糖(Fuc)、核糖(Rib)、木糖(Xyl)和阿拉伯糖(Ara),分别记为1~14。从图2可见,EGP及其纯化组分的单糖组成中,EGP、EGP-1和EGP-2不包括葡萄糖醛酸,EGP-1和EGP-2不包括核糖。表3为EGP及其纯化组分的单糖组成摩尔比。
表3 粗多糖及其纯化组分的单糖组成摩尔比
Tab.3 Monosaccharide composition molar ratio of crude polysaccharide and purified components
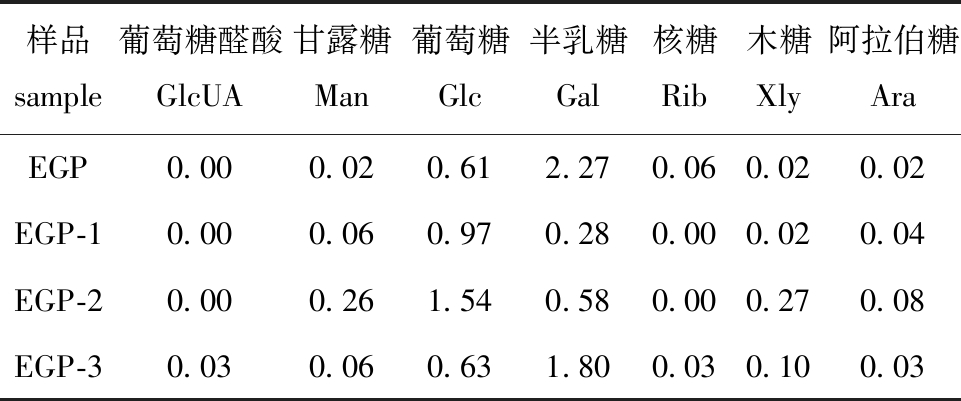
样品 sample葡萄糖醛酸 GlcUA甘露糖 Man葡萄糖 Glc半乳糖 Gal核糖 Rib木糖 Xly阿拉伯糖 AraEGP0.000.020.612.270.060.020.02EGP-10.000.060.970.280.000.020.04EGP-20.000.261.540.580.000.270.08EGP-30.030.060.631.800.030.100.03
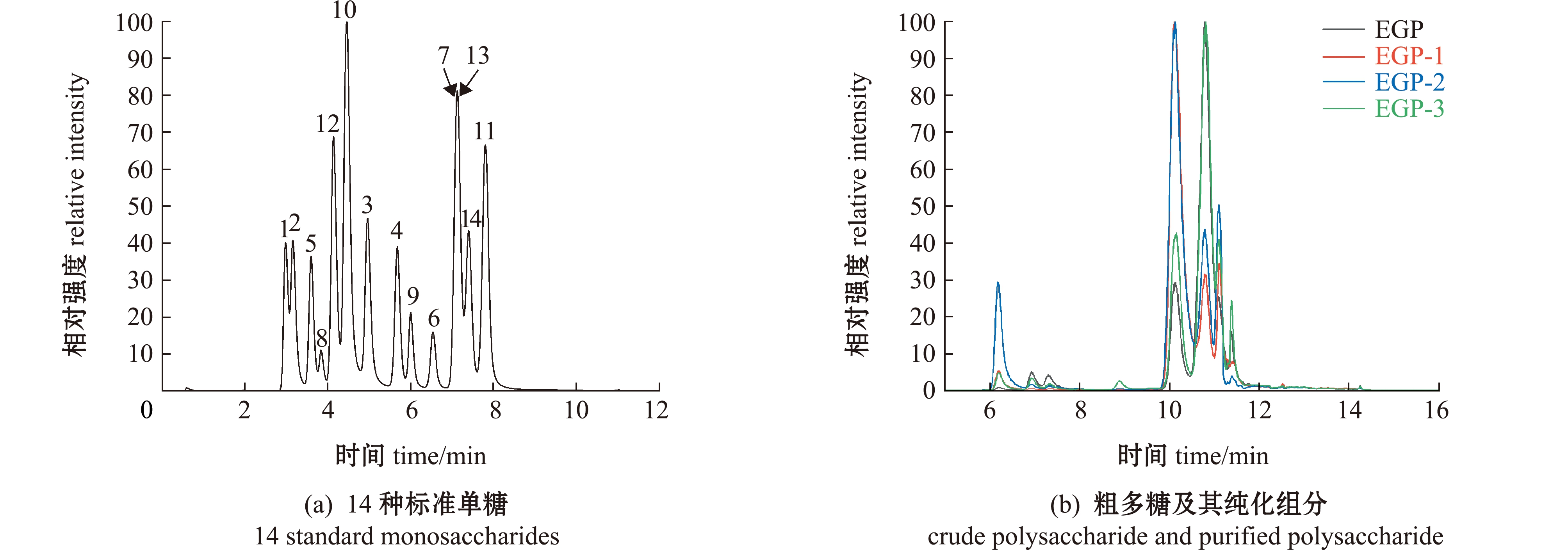
图2 14种标准单糖、琼枝麒麟菜粗多糖及其纯化多糖的LC-MS图谱
Fig.2 LC-MS spectra of 14 standard monosaccharides,crude polysaccharide and purified polysaccharide from Eucheuma gelatinae
2.3.3 红外光谱 从图3可见,总体上4种多糖仅吸收峰的位置与强度略有差别,说明粗多糖与各纯化组分的结构大致相似[18],与单糖组成分析相一致。其中,在3 444.87 cm-1附近有一较明显的宽吸收峰,为O—H伸缩振动,是典型的糖类特征峰[19];在2 926.01 cm-1处的强吸收峰为C—H伸缩振动峰[20];在1 637.56 cm-1处的吸收峰由羧基官能团中的C![]() O拉伸引起[21];在1 535.34 cm-1处的吸收峰由O—H弯曲振动引起;在1 411.89 cm-1处的吸收峰为C-H弯曲振动吸收或—COOH收缩振动吸收[22];在1 234.41 cm-1处的吸收峰为S
O拉伸引起[21];在1 535.34 cm-1处的吸收峰由O—H弯曲振动引起;在1 411.89 cm-1处的吸收峰为C-H弯曲振动吸收或—COOH收缩振动吸收[22];在1 234.41 cm-1处的吸收峰为S![]() O伸缩振动,表明存在硫酸基[23];在1 149.57、1 041.56 cm-1处的吸收峰是吡喃型糖苷特征吸收峰[24]。
O伸缩振动,表明存在硫酸基[23];在1 149.57、1 041.56 cm-1处的吸收峰是吡喃型糖苷特征吸收峰[24]。
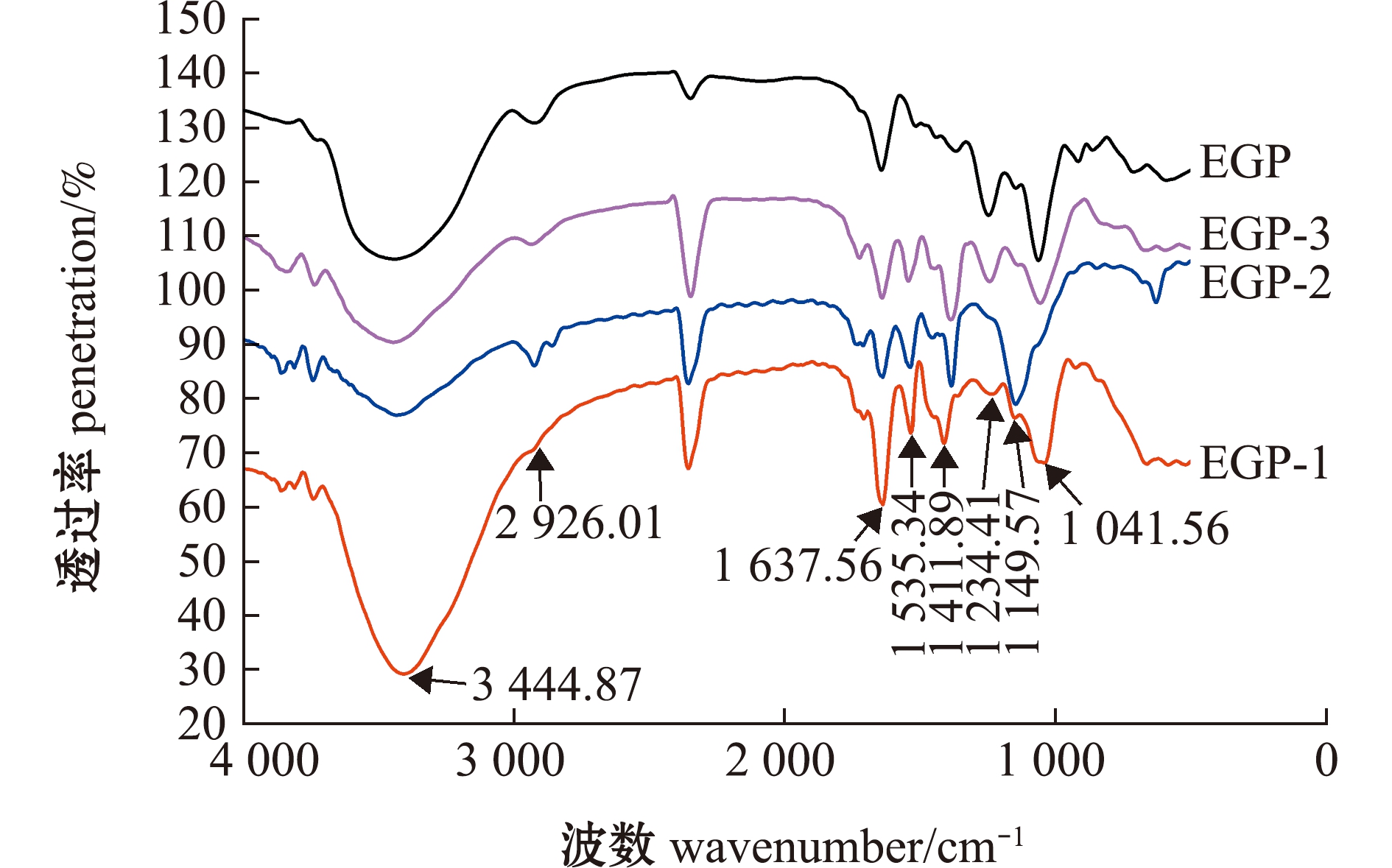
图3 粗多糖及其纯化多糖的红外光谱
Fig.3 Infrared spectrogram of crude polysaccharide and purified polysaccharide
2.3.4 刚果红试验结果 从图4可见,EGP与EGP-1的最大吸收波长呈现先增加后减少的趋势,存在红移现象,EGP-2、EGP-3与纯的刚果红溶液变化趋势相同,未出现红移现象。由此可见,EGP与EGP-1具有三螺旋结构,EGP-2、EGP-3中不含三螺旋结构。

图4 粗多糖及其纯化多糖的刚果红试验谱
Fig.4 Congo red spectrum of crude polysaccharide and purified polysaccharide
2.3.5 扫描电镜观察 从图5可见:EGP为碎片状、粒状,整体呈现出不完整的分散状态,放大倍数后可看到褶皱状的片状结构,表面存在少许小颗粒;EGP-1整体较为完整,但存在裂缝,表面凹凸不平,在放大1 000倍后可看到表面存在着各种小颗粒,放大5 000倍下则更明显,这可能是由于多糖内部存在交联,或者是在冷冻干燥时多糖内部分子间的盘卷曲折所导致;EGP-2为絮状,且含有少量柱状枝条,呈现出中间集中、周边分散的状态,放大5 000倍后可以清晰地看到其表面的絮状小颗粒呈卷曲式附着在柱状枝条上,形成一种类似于花束的形态;EGP-3是由大量细小的纤维细丝状结构盘曲形成的集束形态,其边缘存在少量片状结构,放大 5 000倍后可以看到清晰的细条状结构,这表明EGP-3存在大量的分子,内部结构疏松[25],与相对分子质量的测定结果相吻合。

图5 粗多糖及其纯化多糖的电镜扫描
Fig.5 Electronic microscope scanning of crude polysaccharide and purified polysaccharide
2.4 体外降血糖活性
2.4.1 对α-淀粉酶的抑制效果 从图6可见:相同浓度的4种多糖对α-淀粉酶的抑制作用均低于阳性对照组,但均表现出一定的抑制效果;4种多糖对α-淀粉酶的抑制作用均存在剂量正相关性;当质量浓度为0~4 mg/mL时,EGP-3的抑制效果最高,EGP的抑制效果最低,当质量浓度大于4 mg/mL时,抑制效果依次为EGP-3>EGP-1>EGP-2>EGP。4种多糖EGP、EGP-1、EGP-2、EGP-3对α-淀粉酶抑制的IC50值分别为12.24、7.04、8.42、2.15 mg/mL,表明纯化后多糖相比粗多糖的活性均有增加,且EGP-3的抑制效果最优。
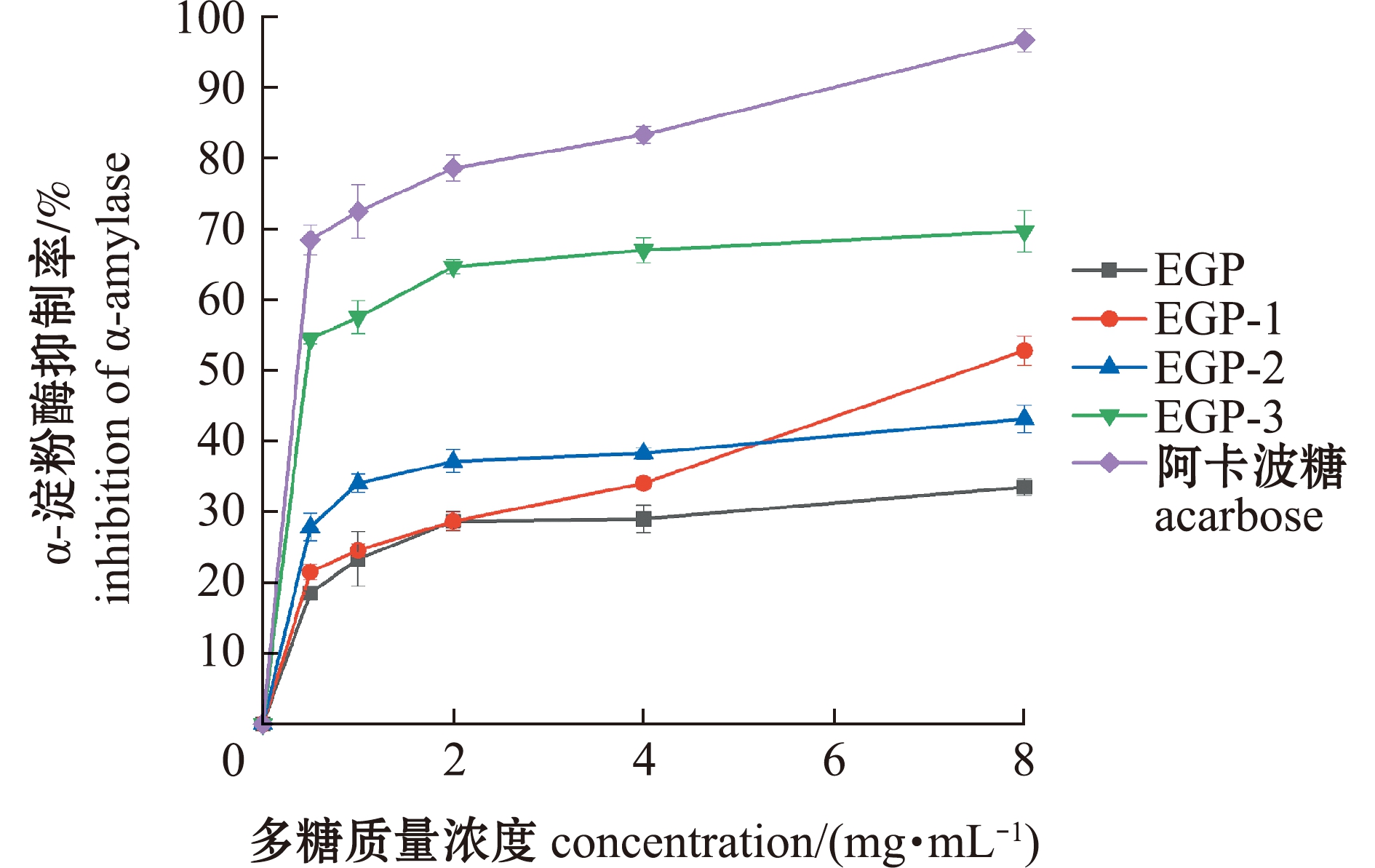
图6 粗多糖及其纯化多糖对α-淀粉酶的抑制效果
Fig.6 Inhibition of α-amylase by crude polysaccharide and purified polysaccharide
2.4.2 对α-葡萄糖苷酶的抑制效果 从图7可见:4种多糖对α-葡萄糖苷酶的抑制效果虽不及阳性对照组,但均有较好的表现;4种多糖对α-葡萄糖苷酶的抑制作用均存在剂量正相关性;当质量浓度为0~0.125 mg/mL时,EGP-3效果最优,EGP抑制效果最差,当质量浓度为0.5~2.0 mg/mL时,抑制效果依次为EGP-3>EGP-2>EGP-1>EGP。4种多糖EGP、EGP-1、EGP-2、EGP-3对α-葡萄糖苷酶抑制的IC50值分别为3.69、1.97、1.43、0.62 mg/mL。
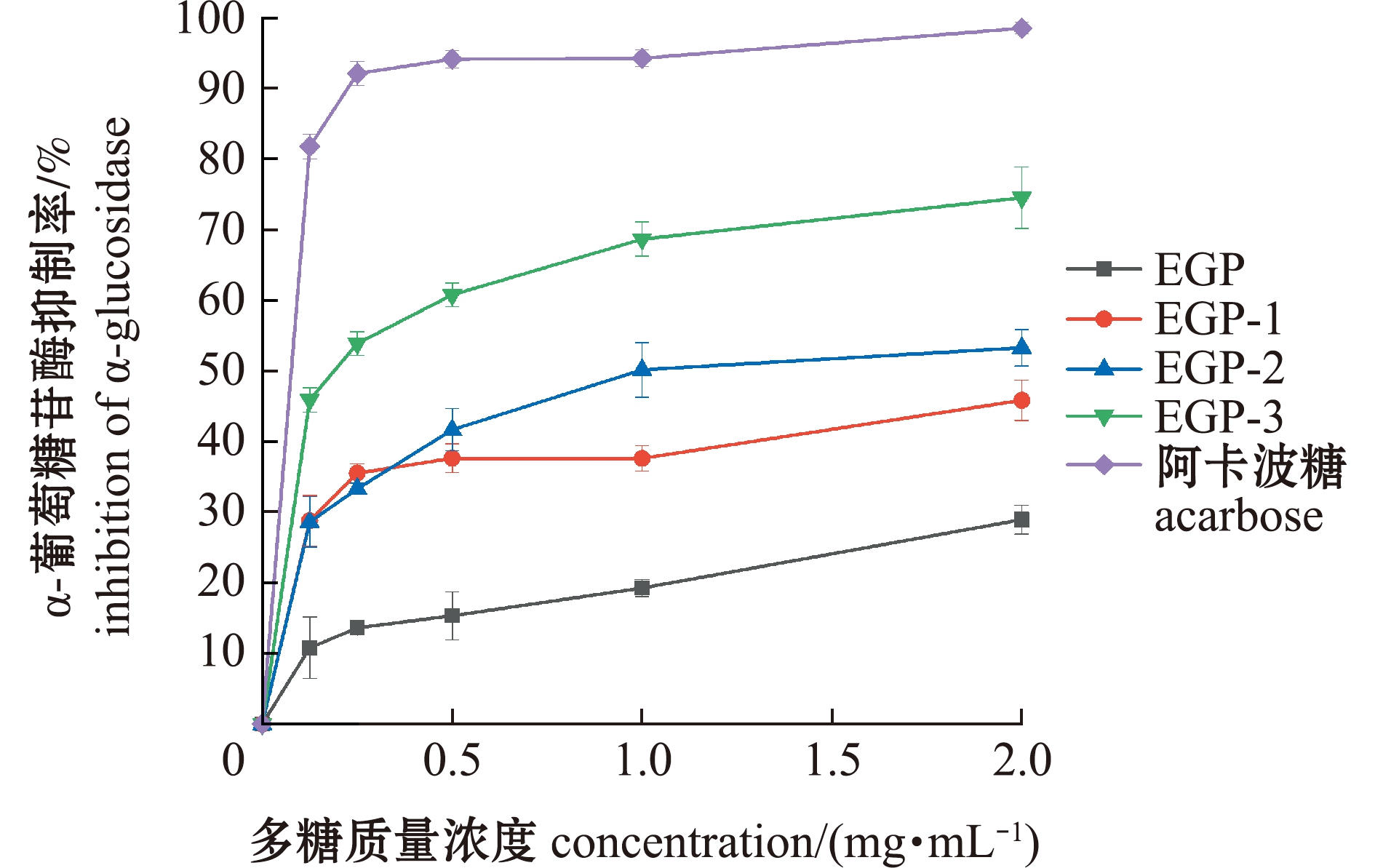
图7 粗多糖及其纯化多糖对α-葡萄糖苷酶的抑制效果
Fig.7 Inhibition of α-glucosidase by crude polysaccharide and purified polysaccharide
3 讨论
3.1 琼枝麒麟菜多糖的结构表征
侯萍等[26]采用热水提取法获得的琼枝麒麟菜粗多糖主要由木糖、岩藻糖和半乳糖组成,摩尔比为1.00∶1.69∶1.18。叶绍明[27]研究发现,麒麟菜主要由半乳糖组成,包括少量艾杜糖、木糖、葡萄糖及塔罗糖。本研究中,测得的琼枝麒麟菜粗多糖主要由甘露糖、葡萄糖、半乳糖、木糖和阿拉伯糖组成,摩尔比为0.02∶0.61∶2.27∶0.06∶0.02,与此前文献报道均不相同,推测本研究的3种纯化多糖可能为新型多糖,在生物活性方面可能发挥其他独特作用。在琼枝麒麟菜多糖放大500倍的扫描电镜谱图中可看到褶皱状的片状结构,且粗多糖EGP和纯化组分EGP-1表面均存在少许小颗粒,推测其内部可能存在斥力[28],或是在冷冻干燥时多糖内部分子间的盘卷曲折所导致。
3.2 琼枝麒麟菜多糖的体外降血糖活性
唾液淀粉酶与胰淀粉酶在促进食物碳水化合物代谢过程中发挥着至关重要的作用,降低淀粉酶活性可有效降低人体的血糖和血脂水平,达到预防血糖过高的目的[29]。本研究表明,琼枝麒麟菜3个纯化组分对α-淀粉酶抑制的IC50均低于EGP,即纯化组分抑制效果更好,其中EGP-3抑制效果最优。
水解葡萄糖苷键的关键酶是α-葡萄糖苷酶,也是机体内糖原代谢过程的关键酶。研究表明,抑制α-葡萄糖苷酶的酶活,可以有效抑制葡萄糖的释放,减少小肠对葡萄糖的吸收,达到预防Ⅱ型糖尿病的目的[30]。与琼枝麒麟菜各组分多糖对α-淀粉酶的抑制效果一致,本研究中3种纯化组分对α-葡萄糖苷酶的抑制效果也优于EGP,且EGP-3的抑制效果最优,这表明低分子量多糖表现出的活性更强。由琼枝麒麟菜多糖的结构可知,纯化多糖EGP-1、EGP-2、EGP-3较EGP的分子量均有不同程度的降低,硫酸根含量也显著升高。Dou等[31]通过圆二色谱等方法发现,黑莓多糖能够诱导α-葡萄糖苷酶的刚性结构(如α螺旋)和环状结构(如无规则卷曲)发生变化,与α-葡萄糖苷酶结合抑制其活性,且超声降解处理后,低分子量的黑莓多糖对α-葡萄糖苷酶的抑制能力更强,这与本研究结果一致。由此推测,在多糖的分子量减少过程中,多糖的羟基、硫酸基等活性基团逐渐暴露出来,分子之间的作用力被减弱,空间结构松散等,使得多糖的降血糖活性得到增强[32]。
4 结论
1)4种琼枝麒麟菜多糖中EGP-3的糖醛酸含量和硫酸根含量最高。扫描电镜观察显示,EGP呈现碎片状和粒状结构,EGP-1整体较完整、表面凹凸不平,EGP-2呈絮状结构,EGP-3为细小的纤维丝状结构。
2)刚果红染料与EGP和EGP-1可以形成复合物,光谱发生红移现象,表明这两种多糖具有三螺旋结构。4种多糖的红外光谱显示,其官能团大致相同,主要为吡喃型硫酸多糖。
3)4种多糖EGP、EGP-1、EGP-2和EGP-3均可抑制α-淀粉酶和α-葡萄糖苷酶的活性,且EGP-3的IC50值最低,降血糖效果更优。
[1] 李继伟,杨贤庆,许加超,等.超声波辅助酶法提取琼枝麒麟菜多糖及其理化性质研究[J].南方农业学报,2020,51(12):3030-3039.
LI J W,YANG X Q,XU J C,et al.Ultrasound-assisted enzymatic extraction and physicochemical properties of polysaccharide from Eucheuma gelatinae[J].Journal of Southern Agriculture,2020,51(12):3030-3039.(in Chinese)
[2] 杨湘勤,丁敬敬,黄勃,等.琼枝麒麟菜养殖方式及其效益分析[J].渔业现代化,2015,42(6):16-19,25.
YANG X Q,DING J J,HUANG B,et al.The techniques of Eucheuma gelatinae culture model and economic benefit analysis[J].Fishery Modernization,2015,42(6):16-19,25.(in Chinese)
[3] ZHONG Q W,ZHOU T S,QIU W H,et al.Characterization and hypoglycemic effects of sulfated polysaccharides derived from brown seaweed Undaria pinnatifida[J].Food Chemistry,2021,341:128148.
[4] 李来好,戚勃,杨少玲.麒麟菜膳食纤维的降血脂功能[J].中国水产科学,2008,15(6):943-949.
LI L H,QI B,YANG S L.Functional effect of dietary fiber from Eucheuma on reducing serum lipids[J].Journal of Fishery Sciences of China,2008,15(6):943-949.(in Chinese)
[5] 于娟,纪海玉,王玉芳,等.麒麟菜多糖体内抗肿瘤机理研究[J].现代食品科技,2017,33(5):14-19.
YU J,JI H Y,WANG Y F,et al.Study on anti-tumor mechanism of Eucheuma polysaccharide in vivo[J].Modern Food Science and Technology,2017,33(5):14-19.(in Chinese)
[6] 张婧婧,刘秋凤,吴成业.蜈蚣藻多糖降血糖及降血脂活性的研究[J].福建水产,2014,36(1):21-28.
ZHANG J J,LIU Q F,WU C Y.Study on activities of hyperglycemia and hyperlipemia of polysaccharides from Grateloupia filicina[J].Journal of Fujian Fisheries,2014,36(1):21-28.(in Chinese)
[7] 野津,张文森,王知斌,等.DEAE-52在中药多糖分离纯化中的应用[J].化学工程师,2019,33(11):43-45,22.
YE J,ZHANG W S,WANG Z B,et al.Application of DEAE-52 in the separation and purification of polysaccharides from Traditional Chinese Medicine[J].Chemical Engineer,2019,33(11):43-45,22.(in Chinese)
[8] 裴若楠.石花菜多糖的提取、分离纯化及其生物活性研究[D].上海:上海海洋大学,2020.
PEI R N.Study on extraction,purification and biological activity of polysaccharide from Gelidium[D].Shanghai:Shanghai Ocean University,2020.(in Chinese)
[9] 管修媛.池沼公鱼多糖分离纯化及抗凝血活性的初步研究[D].长春:吉林农业大学,2015.
GUAN X Y.Isolation,purification and anticoagulant activity of polysaccharide from pond male fish[D].Changchun:Jilin Agricultural University,2015.(in Chinese)
[10] 朱翠玲,陈亮,周瑾怡,等.不同提取方法对小麦麸皮多糖化学组分及免疫调节活性的影响[J].食品工业科技,2019,40(7):17-23.
ZHU C L,CHEN L,ZHOU J Y,et al.Effect of different extraction methods on chemical composition and immnuoregulative activity of polysaccharides from wheat bran[J].Science and Technology of Food Industry,2019,40(7):17-23.(in Chinese)
[11] 王薇.三种蜈蚣藻多糖的提取分离及结构研究[D].青岛:中国海洋大学,2012.
WANG W.Extraction,separation and structure study of polysaccharides from three species of centipede algae[D].Qingdao:Ocean University of China,2012.(in Chinese)
[12] 刘悦.芳香烃受体相关的色氨酸代谢及检测方法研究[D].北京:中国农业科学院,2012.
LIU Y.Study on tryptophan metabolism related to aromatic hydrocarbon receptor and its detection method[D].Beijing:Chinese Academy of Agricultural Sciences,2012.(in Chinese)
[13] 徐雅琴,刘柠月,李大龙,等.蓝靛果多糖功能特性、结构及抗糖基化活性[J].食品科学,2020,41(2):8-14
XU Y Q,LIU N Y,LI D L,et al.Functional properties,structure and anti-glycosylation activity of polysaccharide from blue honeysuckle fruit(Lonicera caerulea L.)[J].Food Science,2020,41(2):8-14(in Chinese)
[14] LIU W,WANG H,YU J P,et al.Structure,chain conformation,and immunomodulatory activity of the polysaccharide purified from Bacillus Calmette Guerin formulation[J].Carbohydrate Polymers,2016,150:149-158.
[15] YU Z Y,LIU L,XU Y Q,et al.Characterization and biological activities of a novel polysaccharide isolated from raspberry (Rubus idaeus L.) fruits[J].Carbohydrate Polymers,2015,132:180-186.
[16] YU Z Y,LIU L,XU Y Q,et al.Microwave-assisted extraction of polysaccharides from Moringa oleifera Lam.leaves:characterization and hypoglycemic activity[J].Industrial Crops and Products,2017,100:1-11.
[17] SUN H Q,YU X F,LI T,et al.Structure and hypoglycemic activity of a novel exopolysaccharide of Cordyceps militaris[J].International Journal of Biological Macromolecules,2021,166:496-508.
[18] SUN L Q,WANG L,LI J,et al.Characterization and antioxidant activities of degraded polysaccharides from two marine Chrysophyta[J].Food Chemistry,2014,160:1-7.
[19] 辛泉伯,罗薇,孙可澄,等.除蛋白方式对湛江等鞭金藻多糖的组成、结构特征和体外抗肿瘤活性的影响[J].大连海洋大学学报,2019,34(3):428-435.
XIN Q B,LUO W,SUN K C,et al.Compositional characteristics and in vitro antitumor activities of polysaccharides from alga Isochrysis zhanjiangensis treated with different deproteinizing methods[J].Journal of Dalian Ocean University,2019,34(3):428-435.(in Chinese)
[20] 周兴涛.植物乳杆菌NCU116胞外多糖抗肿瘤及调节肠道屏障功能机制的初探[D].南昌:南昌大学,2018.
ZHOU X T.Preliminary study on the mechanism of extracellular polysaccharide of Lactobacillus plantarum NCU116 in anti-tumor and regulating intestinal barrier function[D].Nanchang:Nanchang University,2018.(in Chinese)
[21] 宋甜甜,吴迪,张赫男,等.ARTP诱变猴头菌株的发酵菌丝体多糖理化性质及体外免疫活性[J].菌物学报,2018,37(6):794-804.
SONG T T,WU D,ZHANG H N,et al.Physicochemical properties and immunological activities in vitro of mycelial polysaccharides from Hericium erinaceus mutants induced by atmospheric and room temperature plasma[J].Mycosystema,2018,37(6):794-804.(in Chinese)
[22] 胡爱军,李杨,郑捷,等.鹰嘴豆非淀粉多糖的分离纯化及结构表征[J].食品科学,2019,40(8):22-26.
HU A J,LI Y,ZHENG J,et al.Separation,purification and structural analysis of non-starch polysaccharides from chickpea seeds[J].Food Science,2019,40(8):22-26.(in Chinese)
[23] 廖滢,袁雯瑜,郑雯珂,等.石斛酸性多糖官能团与自由基清除活性的相关性[J].中药材,2015,38(11):2281-2284.
LIAO Y,YUAN W Y,ZHENG W K,et al.Correlation between functional groups and radical scavenging activities of acidic polysaccharides from Dendrobium[J].Journal of Chinese Medicinal Materials,2015,38(11):2281-2284.(in Chinese)
[24] 杨勇,邓银华,韩巧红,等.喜树果多糖的理化性质和抗氧化活性研究[J].天然产物研究与开发,2017,29(10):1717-1722.
YANG Y,DENG Y H,HAN Q H,et al.Study on physicochemical properties and antioxidant activity of polysaccharide from Camptotheca acuminata fruit[J].Natural Product Research and Development,2017,29(10):1717-1722.(in Chinese)
[25] 李美凤,袁明昊,邹仕赟,等.松露多糖的提取、分离纯化和结构鉴定[J].食品与发酵工业,2020,46(16):196-200.
LI M F,YUAN M H,ZOU S Y,et al.Extraction,separation,purification and structure identification of polysaccharides from truffles[J].Food and Fermentation Industries,2020,46(16):196-200.(in Chinese)
[26] 侯萍,马军,陈燕,等.几种海藻粗多糖的理化性质及结构特征分析[J].热带海洋学报,2018,37(2):55-62.
HOU P,MA J,CHEN Y,et al.Analysis of physicochemical properties and structure characteristics of several crude algal polysaccharides[J].Journal of Tropical Oceanography,2018,37(2):55-62.(in Chinese)
[27] 叶绍明.麒麟菜多糖的提取工艺、结构测定及抗病毒活性研究[D].广州:暨南大学,2003.
YE S M.Study on extraction technology,structure determination and antiviral activity of Eucheuma polysaccharide[D].Guangzhou:Jinan University,2003.(in Chinese)
[28] 史瑞琴,梁静静,李大伟,等.小球藻多糖的分离纯化及理化性质[J].食品科学,2020,41(20):61-67.
SHI R Q,LIANG J J,LI D W,et al.Isolation,purification and physicochemical properties of polysaccharides from Chlorella[J].Food Science,2020,41(20):61-67.(in Chinese)
[29] 谭青云,袁永俊,王丹,等.不同提取方式对铁皮石斛多糖及体外降血糖的影响[J].食品科技,2019,44(6):202-206.
TAN Q Y,YUAN Y J,WANG D,et al.Effects of different extraction methods on polysaccharide of Dendrobium candidum and its hypoglycemic effect in vitro[J].Food Science and Technology,2019,44(6):202-206.(in Chinese)
[30] 肖瑞希,陈华国,周欣.植物多糖降血糖作用及机制研究进展[J].食品科学,2019,40(11):254-260.
XIAO R X,CHEN H G,ZHOU X.Recent progress in understanding of hypoglycemic effect and underlying mechanism of plant polysaccharides[J].Food Science,2019,40(11):254-260.(in Chinese)
[31] DOU Z,CHEN C,FU X.The effect of ultrasound irradiation on the physicochemical properties and α-glucosidase inhibitory effect of blackberry fruit polysaccharide[J].Food Hydrocolloids,2019,96:568-576.
[32] 程斌.海带硫酸多糖的提取纯化降解及活性研究[D].曲阜:曲阜师范大学,2009.
CHENG B.Study on extraction,purification,degradation and activity of sulfated polysaccharide from kelp[D].Qufu:Qufu Normal University,2009.(in Chinese)