断肢在甲壳动物[1]、棘皮动物[2]和扁形动物[3]等多个无脊椎动物类群中较常见,是动物一种逃避捕食者的适应性行为机制[4]。已有研究表明,断肢可以分散捕食者的注意力[5],逃离种内竞争[6],减少伤害[5,7],从而增加动物生存的概率。甲壳动物是目前断肢研究开展最广泛的群体,其中,以虾蟹类自切附肢最常见[8],在虾蟹的五对附肢中,一对螯足是多功能的进攻和防御器官,这也使其最容易发生断肢[9]。虽然螯足断肢能提高甲壳动物的存活率,但也有研究表明,一个或多个螯足的丢失可能会导致长期的能量损失,包括生长、运动能力、觅食效率和交配成功率等功能的下降,并且更易感染疾病[10-15]。因此,甲壳动物螯足断肢后亟须通过再生来弥补这些劣势。
附肢再生是指肢体断肢后,全部或部分重新生长的现象,是动物的一种自我保护机制[9]。已有研究表明,甲壳动物螯足的再生是一个激素调节的过程[16],主要依赖于蜕皮激素、成纤维细胞生长因子和视黄醇,它们通过蜕皮激素受体、成纤维细胞生长因子受体和视黄醇X受体发挥调控作用[7]。近年来,有关附肢再生的研究主要集中在断肢和再生组织形态发育[8]、分子调控机理[17]及激素调控机理[8]等方面,而有关螯足断肢及再生对经济甲壳类行为影响的研究较少。
三疣梭子蟹(Portunus trituberculatus)是中国重要的海水养殖经济蟹类之一,2021年养殖产量达10.5万t[18]。三疣梭子蟹生性好斗,在育苗和养殖过程中的攻击和相残易造成蟹损伤和断肢,同类残食情况也十分严重[19]。有研究表明,在土塘养殖过程中,三疣梭子蟹断肢率高达30%[20]。争斗和断肢也成为制约三疣梭子蟹集约化、高效养殖技术创新的重要瓶颈[20]。目前,虽然有关蟹类断肢的机制研究,以及断肢和再生对蟹生长、存活及摄食等影响的应用研究较多[10-11],但断肢和再生对摄食和攻击行为影响的研究较少,且已有研究主要限定于定性描述上,定量研究极少。本研究中,通过建立高效无损的螯足胁迫断肢方法,采用EthoVision XT行为跟踪系统定量探究螯足断肢及再生对蟹摄食和攻击行为的影响,以期为三疣梭子蟹的健康、高效养殖提供数据支持。
1 材料与方法
1.1 材料
试验用200只规格均匀的三疣梭子蟹(体质量为18.34 g±2.56 g)购自宁波启新水产专业合作社养殖场(121°83′E,29°69′N),暂养于宁波海洋研究院海水增养殖重点实验室。参照沈洁等[21]的判断方法,从中挑选处于蜕皮期间(C期)的120只三疣梭子蟹,将其暂养于循环水水槽(长×宽×高为30 cm×50 cm×40 cm,水深为30 cm)中,水槽中间用亚克力隔板隔开,每个小水槽放置4只三疣梭子蟹。所有水槽均充分曝气,水温为(24±2)℃,盐度为26±2,pH为7.8±0.2,溶解氧>5 mg/L。
1.2 方法
1.2.1 高温胁迫断肢方法 螯足断肢采用高温胁迫法,具体操作为点燃乙醇灯,双手佩戴一次性丁腈手套,用体积分数为75%的医用乙醇对手套及镊子消毒后,用无菌纱布擦干。一只手自下而上握紧三疣梭子蟹,大拇指和食指捏住其背部和腹部(背部朝着试验者),使其能露出活动的螯足。用生理盐水对将要断肢螯足进行冲洗,将镊子置于乙醇灯外焰上面加热,约10 s,温度约升至650 ℃后,迅速碰触螯足长节,蟹会产生应激性反应,螯足自根节处自动断裂,断裂处平滑完整,蟹伤口处会流出少量血淋巴,但伤口很快会愈合(图1)。
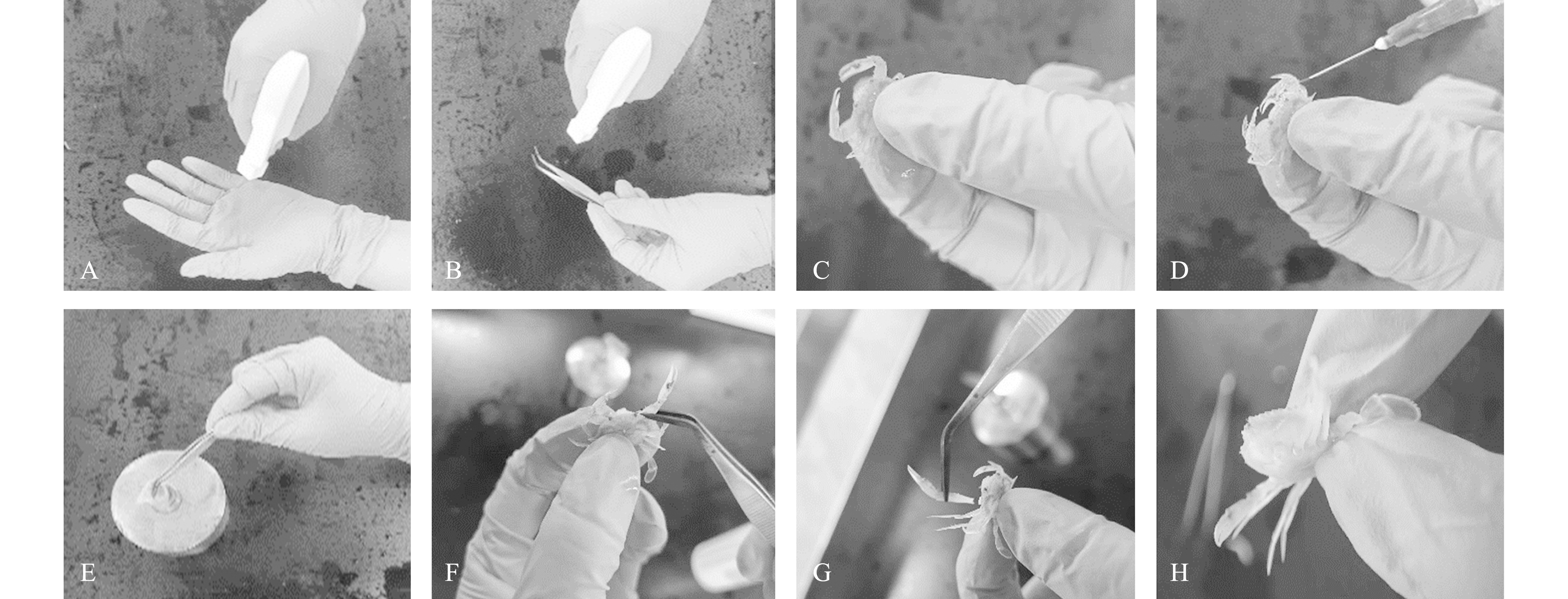
A~B—用体积分数为75%的乙醇对丁腈手套和镊子消毒;C—抓取一只三疣梭子蟹,大拇指和食指捏住其背部和腹部(背部朝着试验者),使其露出活动的螯足;D—用生理盐水对将要断肢的螯足进行冲洗;E—加热镊子至发红(约10 s,温度升至650 ℃);F—迅速碰触螯足长节使其断肢;G—螯足自根节处自动断裂;H—螯足断肢截面形成。
A and B—disinfect nitrile gloves and forceps with 75% alcohol;C—the crab is grasped with its back up and pinched between the thumb and forefinger,allowing the active chelicerae to be exposed to the operators;D—saline is used to rinse the chelicerae that will be amputated;E—heat the forceps until it turns red (approximately 10 s,temperature rises to 650 ℃);F—quickly touch the long segment of the chelicerae using the heated forceps to make it amputate;G—the chelicerae break off spontaneously from the root joint;H—chelicerae amputation form.
图1 高温胁迫断肢方法操作步骤
Fig.1 Procedures for autotomy under high temperature stress
1.2.2 螯足断肢后三疣梭子蟹生长和摄食率的测定 从暂养的120只三疣梭子蟹中挑选健康有活力、四肢健全、规格均匀的蟹60只。将60只蟹随机分成两个处理组,分别投喂花蛤肉和杂鱼,每个处理组30只蟹,每个处理组再分成3个小组,即对照组(无断螯组)、断一螯组和断两螯组,每个小组10只蟹,称重并记录全甲宽、全甲长和体高。随后进行断肢处理:对照组(无断螯组)的蟹保留健全的双螯足,断一螯组的蟹缺失1个螯足(左右随机),断两螯组的蟹缺失2个螯足,螯足断肢后再次称重。
在生长试验期间,每天观察蟹的存活情况,捞出死蟹,并将蜕皮的蟹24 h后称重。直至所有的三疣梭子蟹完成蜕皮后停止试验,全程记录蜕皮后蟹的体质量、全甲宽、全甲长和体高。
在摄食试验期间,每天17:00投喂过量的花蛤肉或杂鱼,2 h后捞出残饵,计算摄食量(精确到0.01 g)。
1.2.3 螯足断肢后三疣梭子蟹摄食能力和摄食选择性的测定 从暂养的120只三疣梭子蟹中挑选健康有活力、四肢健全和规格均匀的蟹24只,分成3组,分别记为对照组(无断螯组)、断一螯组和断两螯组,每组8只蟹。饥饿24 h后开始试验,每个循环水槽里投喂一只大小均匀、质量相近的寻氏肌蛤(体质量为2.22 g±0.18 g),用摄像机记录2 h内每只三疣梭子蟹打开寻氏肌蛤的总时间(即每只三疣梭子蟹在成功打开寻氏肌蛤之前处理寻氏肌蛤所用的时间)[17]。
在上述试验结束后,将蟹饥饿24 h后开始摄食选择性试验。每组分别投喂过量的寻氏肌蛤、杂鱼及饲料(宁波天邦饲料科技有限公司),质量分别为(2.0±0.2)、(6.0±0.1)、(1.0±0.1)g,2 h后统计残饵的情况,用摄食量作为摄食选择性的评价标准,摄食量体现摄食概率。
1.2.4 螯足断肢后三疣梭子蟹攻击行为的测定 从暂养的120只三疣梭子蟹中挑选健康有活力、四肢健全和规格均匀的蟹30只,分成3组,即对照组(无断螯组)、断一螯组和断两螯组。5只无断螯蟹和5只无断螯蟹配对(记为组0),5只无断螯蟹和5只断一螯蟹配对(记为组1),5只无断螯蟹和5只断两螯蟹配对(记为组2)。饥饿24 h后开始试验,试验前先用马克笔在蟹甲壳上进行标记,后将蟹置于水深5~10 cm的水槽中,并被不透明的隔板隔开使之相互不能接触,适应 15 min 后抽开隔板,然后放入花蛤肉均质液诱发争斗。用行为仪EthoVision XT记录30 min内蟹的争斗情况。相关指标定义如下:
1)争斗延迟时间。从倒完均质液到争斗双方中的一方第一次接近另一方的时间。
2)争斗持续时间。开始于一方接近另一方,结束于一方持续逃跑、后退和离开。记录30 min内总的争斗持续时间。
3)争斗强度。根据李叶森等[22]的方法,定义三疣梭子蟹的5种争斗强度:①强度0级(很弱),两方未移动,或者移动了未表现出攻击行为;②强度Ⅰ级(弱),一方靠近另一方且表现出攻击行为,另一方体现出顺从且无身体碰触;③强度Ⅱ级(中),两方个体均表现出攻击行为,肢体接触发生,直到获胜者成功爬上对方或失败者出现持续撤退;④强度Ⅲ级(强),两方的争斗升级到夹击和推搡,失败者出现撤退但展开螯足不断示威;⑤强度Ⅳ级(很强),失败方虽出现撤退但不断重新开始争斗过程。本研究中,定义了上述攻击行为的名词如表1所示。
表1 攻击行为的要素分类及描述
Tab.1 Classification and description of the elements of aggressive behaviour
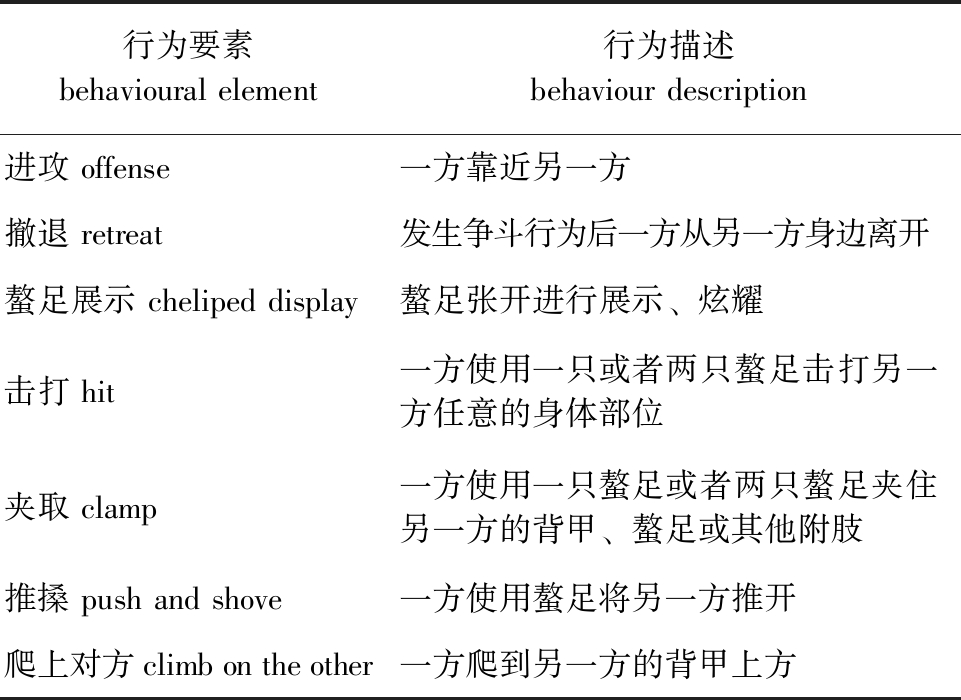
行为要素behavioural element行为描述 behaviour description进攻 offense一方靠近另一方撤退 retreat发生争斗行为后一方从另一方身边离开螯足展示 cheliped display螯足张开进行展示、炫耀击打 hit一方使用一只或者两只螯足击打另一方任意的身体部位夹取 clamp一方使用一只螯足或者两只螯足夹住另一方的背甲、螯足或其他附肢 推搡 push and shove一方使用螯足将另一方推开爬上对方 climb on the other一方爬到另一方的背甲上方
4)移动速度和移动距离。一场争斗中双方平均移动的速度(cm/s)和移动距离(cm)。
1.2.5 螯足再生后三疣梭子蟹摄食率、摄食能力和摄食选择性的测定 在“1.2.2节”试验基础上进行。取暂养的三疣梭子蟹对其进行螯足断肢处理后,养殖在循环水系统中,直到蜕壳后长出新的附肢,开始螯足再生摄食试验。采用“1.2.2节”方法测定摄食率,采用“1.2.3节”方法测定摄食能力,采用“1.2.4节”方法测定摄食选择性。
1.2.6 生长性能指标的计算 蟹摄食量(C)、摄食率(RF)、增重率(RWG)[23]和形态指标增长率(F,包括全甲宽、全甲长和体高)计算公式为
C=C0-Ct,
(1)
RF=(C0-Ct)I/W×100%,
(2)
RWG=(Wt-W0)/W0×100%,
(3)
F=(Ft-F0)/F0。
(4)
式中:C0为擦干表面水分后投喂饵料的质量(g);Ct为擦干表面水分后捞出饵料的质量(g);I为干重率(%),其中,I=It/I0×100%,It为烘干后饵料的质量(g),I0为擦干表面水分后饵料的质量(g);W为三疣梭子蟹断肢后或再生后的质量(g);Wt、W0分别为三疣梭子蟹蜕皮后和蜕皮前的质量(g);Ft、F0分别为三疣梭子蟹蜕皮后和蜕皮前的形体指标(cm)。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。试验数据采用单因素方差分析和Fisher 精确测试,对达到显著性的平均值进行Duncan多重比较。若方差不齐,则采用Kruskal-Wallis检验。采用SPSS 26.0软件进行数据分析,显著性水平设为0.05。
2 结果与分析
2.1 螯足断肢对三疣梭子蟹生长的影响
从表2可见:螯足断肢对三疣梭子蟹的体质量增长率无显著性影响(P>0.05);断两螯组蟹的全甲宽、全甲长及体高增长率均显著低于对照组(P<0.05),而于断一螯组则较对照组略有降低(P>0.05),且增长率与螯足断肢数目呈负相关,即断肢数目越多,体质量、全甲长、全甲宽和体高的增长率越低。
表2 三疣梭子蟹螯足断肢后的体质量增长率及形体增长率
Tab.2 Body weight growth rate and morphological growth rate of Portunus trituberculatus after chelicerae autotomy %

注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
组别group体质量增长率weight gain rate全甲宽增长率total carapace width growth rate全甲长增长率total carapace length growth rate体高增长率body height growth rate对照组 control group89.86±10.1325.21±3.64b26.04±2.22b25.49±4.53b断一螯组 one cheliped autotomy group89.65±15.0624.15±3.18ab25.52±3.09ab24.05±4.31ab断两螯组 two chelipeds autotomy group88.08±15.3620.54±2.35a21.29±3.20a19.29±3.03a
2.2 螯足断肢及再生对三疣梭子蟹摄食率的影响
试验开始后的几天,螯足断肢的三疣梭子蟹在断肢的位置逐渐长出新的肉芽,并慢慢变大,等到下次蜕皮后舒展开来,形成一个比原螯略小的新螯。此外,对肢芽再生的三疣梭子蟹在解剖镜下观察发现,其肢芽再生部分大致分为4个阶段,分别为断肢截面形成期、肢芽出膜期、肢芽变大期和肢芽分化期(图2)。
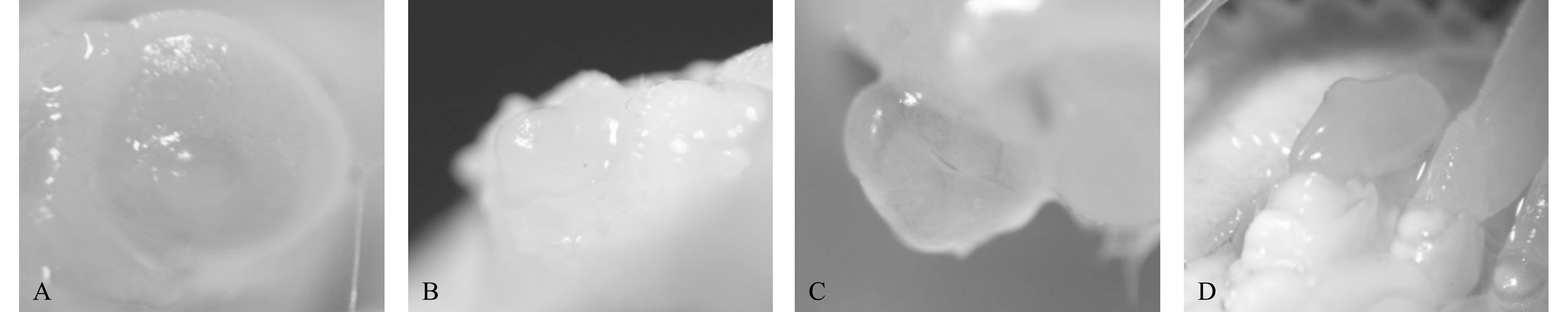
A—断肢截面形成;B—肢芽出膜;C—肢芽变大;D—肢芽分化。
A—formation of autotomy section;B—limb buds emerge from membrane;C—limb buds become larger;D—limb buds differentiate.
图2 三疣梭子蟹螯足再生的发育过程
Fig.2 Developmental process in the regeneration of the chelicerae of Portunus trituberculatus
螯足断肢及再生后的三疣梭子蟹仍能正常摄食。从表3可见:螯足断肢后,三疣梭子蟹对花蛤肉和杂鱼的摄食率较对照组均有降低,但无显著性差异(P>0.05);螯足再生后,对照组和再生螯组蟹对花蛤肉及杂鱼的摄食率相近(P>0.05),对照组和再生螯组蟹对花蛤肉摄食率平均值约为2.4%,对杂鱼摄食率平均值约为1.0%。
表3 三疣梭子蟹螯足断肢和再生后的摄食率
Tab.3 Feeding rate of Portunus trituberculatus after chelicerae autotomy and regeneration %
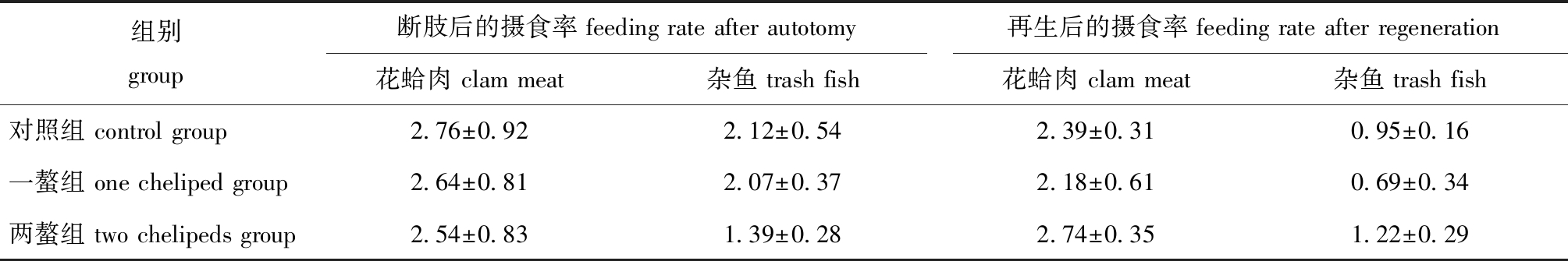
组别group断肢后的摄食率 feeding rate after autotomy再生后的摄食率 feeding rate after regeneration花蛤肉 clam meat杂鱼 trash fish花蛤肉 clam meat杂鱼 trash fish对照组 control group2.76±0.922.12±0.542.39±0.310.95±0.16一螯组 one cheliped group2.64±0.812.07±0.372.18±0.610.69±0.34两螯组 two chelipeds group2.54±0.831.39±0.282.74±0.351.22±0.29
2.3 螯足断肢及再生对三疣梭子蟹摄食能力的影响
从表4可见:螯足断肢后,对照组和断一螯组打开寻氏肌蛤的成功率均为100%,但断两螯组的成功率为0,对照组蟹打开寻氏肌蛤的时间为(1.29±0.44)min,而断一螯组用时为(2.01±1.05)min,二者间无显著性差异(P>0.05);螯足再生后,对照组和再生一螯组蟹打开寻氏肌蛤的成功率分别为100%和77.73%±19.28%,但再生两螯组蟹的成功率为0,对照组蟹打开寻氏肌蛤的时间为(4.87±1.77)min,而再生一螯组蟹用时为(5.30±2.35)min,二者间无显著性差异(P>0.05)。
表4 三疣梭子蟹螯足断肢和再生后打开寻氏肌蛤的成功率及所用时间
Tab.4 Success rate and time required of opening Musculus senhousei by Portunus trituberculatus after autotomy and regeneration

组别group断肢指标 autotomy indicator再生指标 regeneration indicator成功率/%success rate所用时间/mintime spent in regeneration成功率/%success rate所用时间/mintime spent in regeneration对照组 control group100±0b1.29±0.44100±0b4.87±1.77一螯组 one cheliped group100±0b2.01±1.0577.73±19.28b5.30±2.35两螯组 two chelipeds group0±0a—0±0a—
2.4 螯足断肢及再生对三疣梭子蟹摄食选择性的影响
从表5可见:螯足断肢后,断一螯组和断两螯组蟹摄食杂鱼的概率显著高于对照组(P<0.05);断一螯组摄食杂鱼的概率为90.8%±3.2%,断两螯组摄食杂鱼的概率为92.9%±2.1%,组间存在极显著性差异(P<0.01),对照组、断一螯组和断两螯组蟹摄食饲料的概率显著高于其他两组(P<0.05);而断一螯组蟹摄食寻氏肌蛤的概率显著高于其他两组(P<0.05)。由此可见,随着螯足断肢数目的增多,三疣梭子蟹对寻氏肌蛤的摄食量减少,对杂鱼和饲料的摄食量增加。
表5 三疣梭子蟹螯足断肢和再生后对杂鱼、饲料及寻氏肌蛤的摄食选择性
Tab.5 Feeding selectivity of Portunus trituberculatus on trash fish,forage and Musculus senhousei after chelicerae autotomy and regeneration %
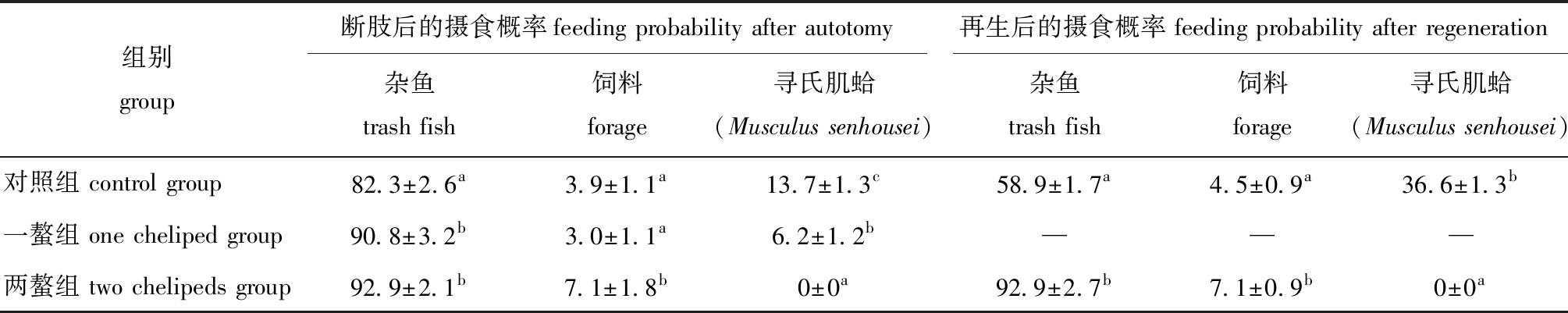
组别group断肢后的摄食概率feeding probability after autotomy再生后的摄食概率 feeding probability after regeneration杂鱼trash fish饲料forage寻氏肌蛤(Musculus senhousei)杂鱼trash fish饲料forage寻氏肌蛤(Musculus senhousei)对照组 control group82.3±2.6a3.9±1.1a13.7±1.3c58.9±1.7a4.5±0.9a36.6±1.3b一螯组 one cheliped group90.8±3.2b3.0±1.1a6.2±1.2b———两螯组 two chelipeds group92.9±2.1b7.1±1.8b0±0a92.9±2.7b7.1±0.9b0±0a
螯足再生后,再生两螯组蟹摄食杂鱼和饲料的概率显著高于对照组(P<0.05);再生两螯组蟹摄食寻氏肌蛤的概率为0。由此可见,随着再生螯足数目的增多,三疣梭子蟹对寻氏肌蛤的摄食量减少,对杂鱼和饲料的摄食量增加(表5)。
2.5 螯足断肢对三疣梭子蟹攻击行为的影响
在攻击行为试验中,用EthoVision XT行为仪记录了三疣梭子蟹在30 min内的争斗情况。从表6可见:争斗延迟时间随螯足断肢数目增加呈下降趋势,但各组间无显著性差异(P>0.05);而争斗持续时间则呈现出截然相反的趋势,呈升高的趋势,但2个断螯组争斗持续时间均显著低于对照组(P<0.05);争斗过程中,断螯组蟹的移动速度和移动距离均低于对照组,但各组间均无显著性差异(P>0.05)。
表6 三疣梭子蟹螯足断肢后的争斗指标
Tab.6 Fight indicators of Portunustri tuberculatus after chelicerae autotomy
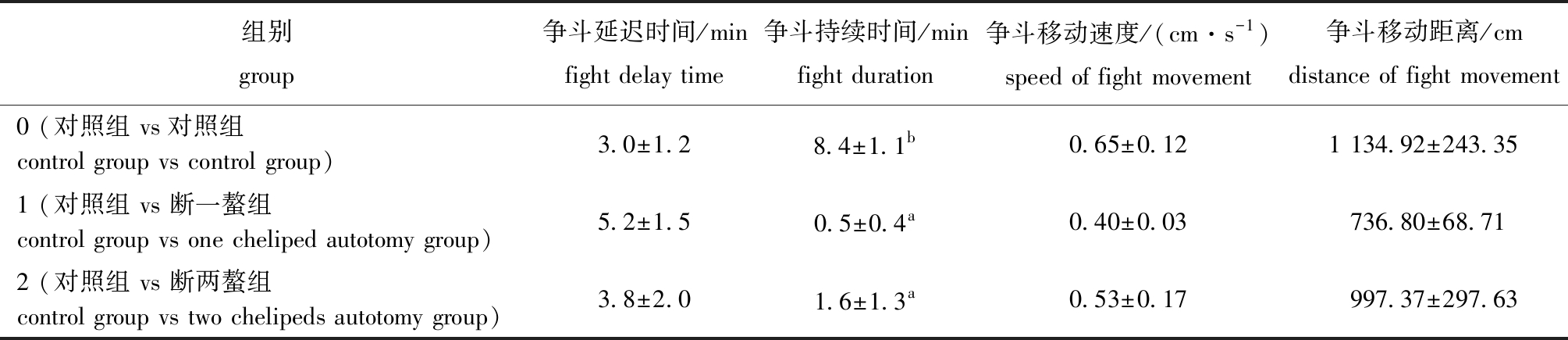
组别group争斗延迟时间/minfight delay time争斗持续时间/minfight duration争斗移动速度/(cm·s-1)speed of fight movement争斗移动距离/cmdistance of fight movement0 (对照组 vs对照组 control group vs control group)3.0±1.28.4±1.1b0.65±0.121 134.92±243.351 (对照组 vs 断一螯组 control group vs one cheliped autotomy group)5.2±1.50.5±0.4a0.40±0.03736.80±68.712 (对照组 vs 断两螯组 control group vs two chelipeds autotomy group)3.8±2.01.6±1.3a0.53±0.17997.37±297.63
从图3可见:组0中蟹的争斗等级均为Ⅳ级,表明争斗程度很激烈;组1中蟹出现4种争斗强度,分别为0、Ⅰ、Ⅱ和Ⅲ级,占比分别为40%、20%、20%和20%;组2中蟹出现3种争斗强度,分别为0、Ⅱ和Ⅲ,占比分别为40%、40%和20%;组0中蟹的争斗强度与组1、组2中蟹的争斗强度存在显著性差异(P<0.05)。表明组0中蟹的争斗强度最高,而组1中蟹的争斗强度最低。
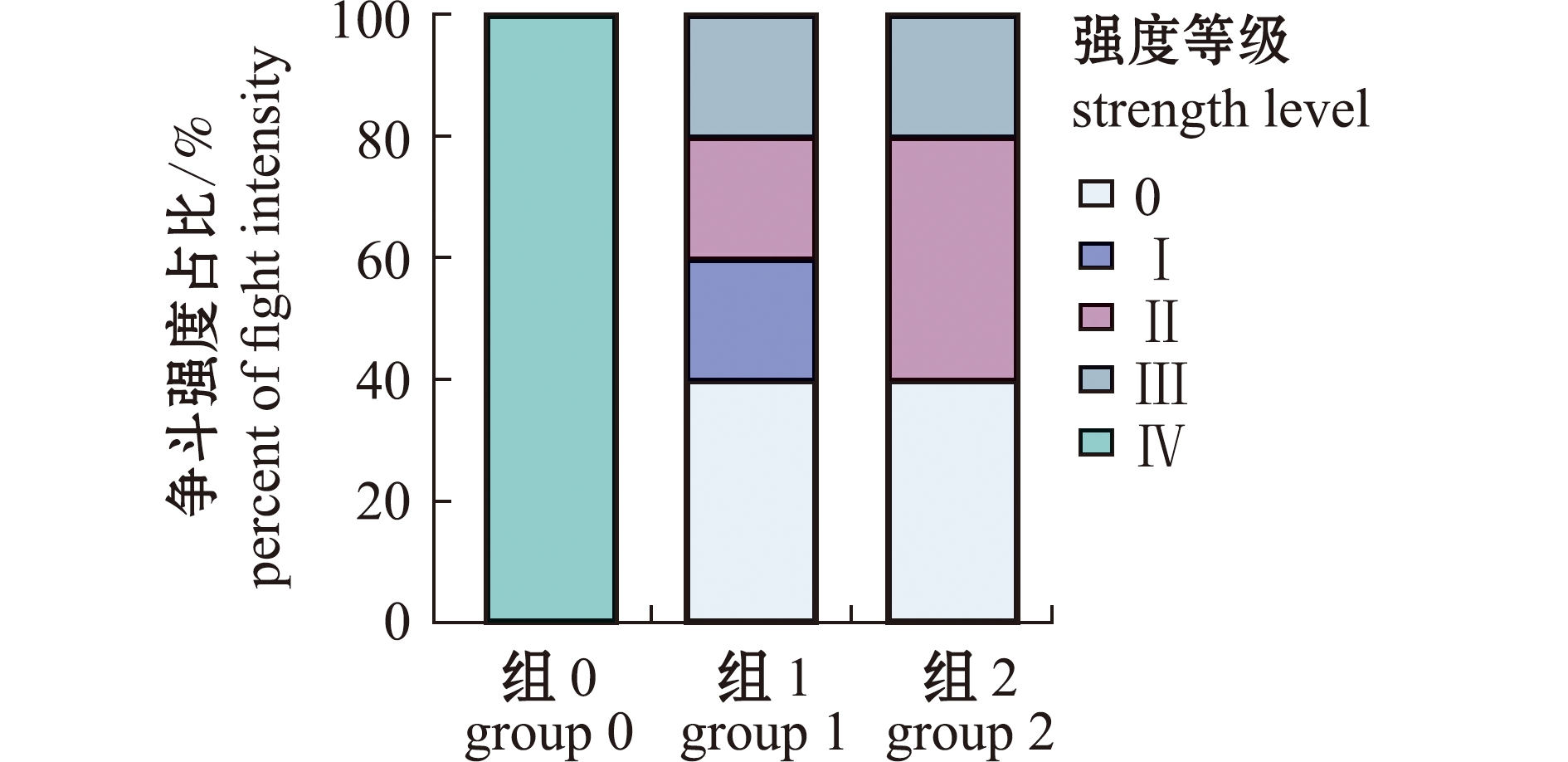
图3 三疣梭子蟹螯足断肢后的争斗强度
Fig.3 Fight intensity of Portunus trituberculatus after chelicerae autotomy
3 讨论
3.1 高温胁迫螯足断肢法
三疣梭子蟹在种间和种内竞争有限的资源(如食物、住所和配偶)时,断肢是避免被捕食和限制伤口的有利策略[9],这也是一种反射性的自我保护机制[24]。在蟹的5对附肢中,螯足是多功能进攻和防御的武器,这也使得其最容易发生断肢[19]。本研究中,运用高温胁迫断肢的方法进行模拟断肢,较捏长节断肢法(人工压力断肢)[24-25]和剪断长节断肢法[26]效率高且效果好。与暴力拉扯断肢法相比,采用高温胁迫断肢法使其自动断肢能缩小伤口尺寸并降低血淋巴的流失,该方法为人工断肢技术提供了新的思路。
3.2 螯足断肢对三疣梭子蟹生长的影响
断肢是三疣梭子蟹普遍采用的行为机制,对逃避危险及提高自身的生存概率具有重要意义。本研究表明,三疣梭子蟹幼蟹螯足断肢后的体质量、全甲宽、全甲长及体高的增长率随螯足断肢数目的增加而减少,仅断两螯组的全甲宽、全甲长及体高的增长率与对照组相比有显著性差异。再生是一个需要投入能量的过程,断肢后摄食率减少,且机体大部分能量投入再生过程中,从而影响了体质量的增加及体型的生长。Paula等[27]研究表明,断螯岸蟹(Carcinus maenas)肌肉生长抑制素基因的表达量显著低于正常蟹,断螯蟹的肌肉生长迅速。有研究发现,断肢减少了三疣梭子蟹的蜕皮时间[1],与未断螯蟹相比,断螯蟹的营养积累不够,导致各项生长指标增长缓慢,这种现象在克氏原螯虾(Procambarus clarkii)、远海梭子蟹(Portunus pelagicus)及瓷蟹(Porcelain crab)中也有发现,去螯虾的体型小于未去螯虾[26],去螯蟹的全甲宽增量小于未去螯蟹[11]。上述研究结果为实际养殖过程中蟹的产量评估提供了理论依据。
3.3 螯足断肢及再生对三疣梭子蟹摄食行为的影响
本研究中,三疣梭子蟹螯足断肢和再生后均能正常摄食,但断肢后摄食率会下降。有研究表明,三疣梭子蟹断肢后的食物转化率明显提高[1]。究其原因,可能一方面是断肢后的蟹活动能力变弱,能量代谢水平下降,摄食率也随之下降;另一方面断肢后的蟹为了尽快摆脱损伤的状态,将自身的大部分能量用于螯足的再生,提高了饲料的转化效率。此外,Dorrance等[28]研究表明,有完整螯足的北黄道蟹(Cancer borealis)明显比螯足断肢的蟹更活跃。He等[24]发现,中华绒螯蟹(Eriocheir sinensis)的蜕皮时间随螯足断肢数目的增加而减少,这些均表明,断肢后的三疣梭子蟹活动能力下降,再生过程加快。有研究表明,在断肢的螯足中存在摄食抑制因子(FIF),即一种由X器官-窦腺复合体产生的蛋白质类激素[29],FIF会对摄食产生影响,从而降低摄食率。Zhang等[30]发现,中华绒螯蟹在再生附肢过程中蜕皮激素受体的水平显著上调,这都与笔者的猜想相一致。三疣梭子蟹螯足再生后,对照组和断螯组的摄食率相似,表明再生螯足具备正常摄食花蛤肉及杂鱼的能力。He等[24]研究表明,中华绒螯蟹再生螯足后的摄食率与未断螯组相似,与本研究结果一致。
本研究中提出了一种量化三疣梭子蟹幼蟹螯足力量的方式,即通过摄像头记录三疣梭子蟹打开寻氏肌蛤的成功率及时间来量化,相比于通过摄食率、摄食强度、滤水率和滤取效率来量化摄食能力具有一定的直观和简便性[31]。断两螯组和再生两螯组的三疣梭子蟹均不能打开寻氏肌蛤,并且对摄食的选择性显著改变,表明三疣梭子蟹断螯及再生后摄食蛤类的能力降低,断两螯组及再生两螯组不能摄食蛤类。相关研究表明,螯足断肢的蟹存在觅食障碍,特别是主螯的缺失,主螯的丧失使牡蛎(猎物)的死亡率降低了93%~100%[12,25,28]。蟹类一次再生螯比原螯小且细长,需经过2~3次蜕皮才能长出与原螯大小相似的螯足[25]。两次蜕皮后的红岩黄道蟹(Cancer productus)的再生螯力量明显低于对侧正常螯(未断肢螯)[32],这些研究均表明,一次再生的螯足力量变小,摄食能力减弱,摄食蛤类能力降低。然而,De Oliveira等[10]发现,断肢厚纹蟹(Pachygrapsus transversus)的摄食具有可塑性,依然可以通过口器去撬开蛤类,这与本研究结果相反,这可能是物种差异造成的。因此,在养殖过程中,幼蟹螯足断肢及再生蟹的投喂应以杂鱼、花蛤肉为主,饲料为辅,而体质量为(2.22±0.18)g的寻氏肌蛤不适合投喂,这为养殖过程中的实际投喂提供了理论参考。
3.4 螯足断肢对三疣梭子蟹攻击行为的影响
争斗残杀已成为制约甲壳动物集约化养殖提质增效的瓶颈之一。争斗行为是种内竞争的一个重要方面,可以让获胜者获得更多的资源,以提高生存率和获得福利[20]。为了进一步明确三疣梭子蟹螯足断肢对群体养殖中攻击行为的影响,本研究中通过EthoVision XT行为仪模拟实际养殖环境去观察分析,初步证明随着螯足断肢数量的增加,攻击行为延迟时间呈现缩短的情况,而争斗持续时间、移动速度、移动距离及争斗强度则呈现增加的情况。这表明,对照组蟹的争斗激烈程度高于断螯组,断两螯组蟹的激烈程度高于断一螯组。有研究表明,失去螯足会降低存活率,这种生存的差异反映了断螯蟹有较低的竞争和争斗能力[25]。在紫色食草蟹(Hemigrapsus nudus)的争斗行为中发现,断螯蟹的攻击性行为减少,退缩行为增加[6]。本研究中,在断两螯蟹和对照蟹的争斗过程中,四肢健全的三疣梭子蟹看到双螯尽断的对手,相较于断一螯的对手比较“好欺负”,争斗胜利的可能性较大,所以攻击行为强度升高。此外,有研究发现,在寄居蟹(Pagurus minutus)的争斗过程中,没有主螯的竞争者因资源持有潜力评估的准确性差依然会开始争斗,但从对手手中夺取雌性的成功率显著降低,这表明失去双螯的蟹依旧会发起争斗,但取得争斗胜利的可能性不大[33]。此外,三疣梭子蟹是异质甲壳动物[34],存在主螯和副螯,主螯比副螯大且能产生更多的力量[9]。本研究中,断一螯组蟹是随机断肢的,如果断的主螯较多,攻击能力会极大降低[12]。研究显示,通过去除榄绿青蟹(Scylla olivacea)螯足或步足,可减少争斗行为,提高生产性能,且去除双螯和所有步足可以使现有单室养殖的饲养密度增加一倍,使产量提高约三倍[35]。这些都与本研究结果类似,表明螯足是三疣梭子蟹决定争斗成败最重要的武器,失去主螯的蟹在争斗过程中处于极大的劣势,螯足断肢减少了幼蟹的攻击行为,有助于提高养殖过程中的养殖密度。
4 结论
1)螯足断肢降低了三疣梭子蟹体质量和形体指标的增长率。
2)三疣梭子蟹螯足断肢后对花蛤肉和杂鱼的摄食率减少,螯足再生后对花蛤肉和杂鱼摄食率无影响。
3)螯足断肢及再生改变了三疣梭子蟹的摄食能力及摄食选择性。
4)螯足断肢后的三疣梭子蟹攻击能力减弱。
[1] 何杰,王绪杰,余方平,等.自切附肢对三疣梭子蟹(Portunus trituberculatus)幼蟹存活、生长和能量收支的影响[J].海洋与湖沼,2018,49(1):207-213.
HE J,WANG X J,YU F P,et al.Effects of limb autotomy on survival,growth and energy budget of juvenile swimming crab Portunus trituberculatus[J].Oceanologia et Limnologia Sinica,2018,49(1):207-213.(in Chinese)
[2] WOLFF A,HINMAN V.The use of larval sea stars and sea urchins in the discovery of shared mechanisms of metazoan whole-body regeneration[J].Genes,2021,12(7):1063.
[3] REDDIEN P W,ALVARADO A S.Fundamentals of planarian regeneration[J].Annual Review of Cell and Developmental Biology,2004,20:725-757.
[4] JOHNSTON C A,SMITH R S.Vegetation structure mediates a shift in predator avoidance behavior in a range-edge population[J].Behavioral Ecology,2018,29(5):1124-1131.
[5] EMBERTS Z,MILLER C W,KIEHL D,et al.Cut your losses:self-amputation of injured limbs increases survival[J].Behavioral Ecology,2017,28(4):1047-1054.
[6] MAGINNIS T L,ISIKBAY M,DEGERSTEDT S G,et al.The effects of cheliped autotomy and regeneration on aggression in purple shore crabs (Hemigrapsus nudus)[J].Marine and Freshwater Behaviour and Physiology,2015,48(4):241-251.
[7] FLEMING P A,MULLER D,BATEMAN P W.Leave it all behind:a taxonomic perspective of autotomy in invertebrates[J].Biological Reviews,2007,82(3):481-510.
[8] FELEKE M,BENNETT S,CHEN J Z,et al.Biological insights into the rapid tissue regeneration of freshwater crayfish and crustaceans[J].Cell Biochemistry and Function,2021,39(6):740-753.
[9] MARIAPPAN P,BALASUNDARAM C,SCHMITZ B.Decapod crustacean chelipeds:an overview[J].Journal of Biosciences,2000,25(3):301-313.
[10] DE OLIVEIRA D N,CHRISTOFOLETTI R A,BARRETO R E.Feeding behavior of a crab according to cheliped number[J].PLoS One,2015,10(12):e0145121.
[11] BARR A E,GONZ
A E,GONZ LEZ M.Effect of autotomy and regeneration of the chelipeds on growth and development in Petrolisthes laevigatus (Guérin,1835) (Decapoda,Anomura,Porcellanidae)[J].Crustaceana,2008,81(6):641-652.
LEZ M.Effect of autotomy and regeneration of the chelipeds on growth and development in Petrolisthes laevigatus (Guérin,1835) (Decapoda,Anomura,Porcellanidae)[J].Crustaceana,2008,81(6):641-652.
[12] TUMMON FLYNN P S,MELLISH C L,PICKERING T R,et al.Effects of claw autotomy on green crab (Carcinus maenas) feeding rates[J].Journal of Sea Research,2015,103:113-119.
[13] PFEIFFENBERGER J A,HSIEH S T.Autotomy-induced effects on the locomotor performance of the ghost crab Ocypode quadrata[J].Journal of Experimental Biology,2021,224(10):jeb233536.
[14] SMITH L D.The impact of limb autotomy on mate competition in blue crabs Callinectes sapidus Rathbun[J].Oecologia,1992,89(4):494-501.
[15] WANG X J,PENG Y Y,YU H H,et al.Short term effects of limb autotomy on immune function and disease resistance of Portunus trituberculatus (Brachyura,Portunidae)[J].Crustaceana,2020,93(2):181-197.
[16] MCCARTHY J F,SKINNER D M.Proecdysial changes in serum ecdysone titers,gastrolith formation,and limb regeneration following molt induction by limb autotomy and/or eyestalk removal in the land crab,Gecarcinus lateralis[J].General and Comparative Endocrinology,1977,33(2):278-292.
[17] SHINJI J,MIYANISHI H,GOTOH H,et al.Appendage regeneration after autotomy is mediated by baboon in the crayfish Procambarus fallax F.virginalis Martin,Dorn,Kawai,Heiden and Scholtz,2010 (Decapoda:Astacoidea:Cambaridae)[J].Journal of Crustacean Biology,2016,36(5):649-657.
[18] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2022年中国渔业统计年鉴[M].北京:中国农业出版社,2022.
Fisheries and Fisheries Administration Bureau of Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.China fisheries statistical yearbook 2021[M].Beijing:China Agriculture Press,2022.(in Chinese)
[19] 王绪杰.三疣梭子蟹应对附肢自切的生理生态响应策略研究[D].舟山:浙江海洋大学,2019.
WANG X J.Study on physiological and ecological response strategies of swimming crab (Portunus trituberculatus) to autotomy[D].Zhoushan:Zhejiang Ocean University,2019.(in Chinese)
[20] HE J,GAO Y,WANG W,et al.Limb autotomy patterns in the juvenile swimming crab (Portunus trituberculatus) in earth ponds[J].Aquaculture,2016,463:189-192.
[21] 沈洁,朱冬发,胡则辉,等.三疣梭子蟹蜕皮周期的分期[J].水产学报,2011,35(10):1481-1487.
SHEN J,ZHU D F,HU Z H,et al.Molt staging in the swimming crab Portunus trituberculatus[J].Journal of Fisheries of China,2011,35(10):1481-1487.(in Chinese)
[22] 李叶森,刘晶晶,宿宪朋,等.溶解氧对三疣梭子蟹争斗行为和能量代谢的影响[J].中国水产科学,2021,28(10):1311-1318.
LI Y S,LIU J J,SU X P,et al.Effect of dissolved oxygen on agonistic behavior and energy metabolism of the swimming crab (Portunus trituberculatus)[J].Journal of Fishery Sciences of China,2021,28(10):1311-1318.(in Chinese)
[23] 王吉桥,庞璞敏,于静,等.中华绒螯蟹对食物的选择性、摄食量及摄食节律的研究[J].水利渔业,2000,20(4):6-7.
WANG J Q,PANG P M,YU J,et al.Studies on the food selectivity,consumption and feeding rhythm of the Chinese crab Eriocheir sinensis[J].Reservoir Fisheries,2000,20(4):6-7.(in Chinese)
[24] HE J,WU X,CHENG Y.Effects of limb autotomy on growth,feeding and regeneration in the juvenile Eriocheir sinensis[J].Aquaculture,2016,457:79-84.
[25] WEIS J S.Effects of environmental factors on regeneration and molting in fiddler crabs[J].The Biological Bulletin,1976,150(1):152-162.
[26] FIGIEL C R,MILLER G L.The frequency of chela autotomy and its influence on the growth and survival of the crayfish Procambarus clarkii (Girard,1852) (Decapoda,Cambaridae)[J].Crustaceana,1995,68(4):472-483.
[27] TUMMON FLYFNN P S,MELLISH C L,PICKERING T R,et al.Effects of claw autotomy on green crab (Carcinus maenas) feeding rates[J].Journal of Sea Research,2015,103:113-119.
[28] DORRANCE A N,GOLDSTEIN J S,CARLONI J T,et al.Sublethal behavioral and physiological effects of claw removal on Jonah crabs (Cancer borealis)[J].Journal of Experimental Marine Biology and Ecology,2021,545:151642.
[29] DARNELL M Z,RITTSCHOF C C,RITTSCHOF J,et al.Autotomy of the major claw stimulates molting and suppresses feeding in fiddler crabs[J].Journal of Experimental Marine Biology and Ecology,2018,509:66-70.
[30] ZHANG C,SONG X Z,ZHANG Q,et al.Changes in bud morphology,growth-related genes and nutritional status during cheliped regeneration in the Chinese mitten crab,Eriocheir sinensis[J].PLoS One,2018,13(12):e0209617.
[31] 董双林,李德尚.鲢、鳙摄食能力的比较研究[J].海洋与湖沼,1995,26(1):53-57.
DONG S L,LI D S.Comparative studies on the feeding capacity of silver carp (Hypophthalmichthys molitrix) and bighead carp (Aristichthys nobilis)[J].Oceanologia et Limnologia Sinica,1995,26(1):53-57.(in Chinese)
[32] SMITH L D,HINES A H.Autotomy in blue crab (Callinectes sapidus rathbun) populations:geographic,temporal,and ontogenetic variation[J].The Biological Bulletin,1991,180(3):416-431.
[33] YASUDA C I,KOGA T.Do weaponless males of the hermit crab Pagurus minutus give up contests without escalation?Behavior of intruders that lack their major cheliped in male-male contests[J].Journal of Ethology,2016,34(3):249-254.
[34] MASUNARI N,SEKIN K,KANG B J,et al.Ontogeny of cheliped laterality and mechanisms of reversal of handedness in the durophagous gazami crab,Portunus trituberculatus[J].The Biological Bulletin,2020,238(1):25-40.
K,KANG B J,et al.Ontogeny of cheliped laterality and mechanisms of reversal of handedness in the durophagous gazami crab,Portunus trituberculatus[J].The Biological Bulletin,2020,238(1):25-40.
[35] RAHMAN M R,ASADUZZAMAN M,ZAHANGIR M M,et al.Evaluation of limb autotomy as a promising strategy to improve production performances of mud crab (Scylla olivacea) in the soft-shell farming system[J].Aquaculture Research,2020,51(6):2555-2572.