光照(光色、光照度和光周期)是影响水生生物生长发育的重要环境因子之一,鱼类的摄食、生长、发育及存活等都直接或者间接受到光照的影响[1-2]。研究表明,光照与鱼类的摄食和生长之间存在着密切关系[3-4]。国外关于鱼类光照调控策略的研究较多,并应用到促进鱼类生长或调控性腺发育中[5-6]。然而,国内关于综合光照因素对鱼类生长和摄食方面的研究较少。
目前,国内外关于光照与幼鱼摄食和生长间关系的研究大部分都集中在仔稚鱼方面[2,7-9],在某些研究中,也有利用某种颜色的光来增加食物的可见性,进而通过增加食物的摄入量来促进鱼类的生长[10]。如黑线鳕(Melanogrammus aeglefinus)仔稚鱼在蓝光和绿光光照环境中成活率较高[11],鲤(Cyprinus carpio)[12]在绿光照射下生长速度较快。石斑鱼(Epinephelus coioides)最适生长光照度为320~1 150 lx[13],花鲈(Lateolabrax japonicus)幼鱼在光照度为400 lx左右时摄食强度最大且光照度和花鲈幼鱼的摄食呈一定的关系[14]。有研究表明,长光周期能促进幼鱼的生长,如大西洋庸鲽(Hippoglossus hippoglossus)[15]等,但也有研究表明,光周期对鱼类的生长无影响,如光周期对褐牙鲆(Paralichthys olivaceus)幼鱼的生长无显著影响[16]。
大菱鲆(Scophthalmus maximus)肉质鲜美、营养丰富、生长速度快,1992年由雷霁霖院士引进中国,经过科研人员的努力已发展为中国北方沿海主要的工厂化养殖经济鱼类。虽然大菱鲆在自然海区营底栖生活,但在工厂化养殖过程中,有效水深一般较浅(30~50 cm),光照是否对大菱鲆的生长和摄食产生影响有待深入研究。LED光源作为节能环保的新能源,在水产中的应用较少。本研究中,采用光谱窄和光照度可控的LED灯作为照明装置,分析了不同光色、光照度和光周期对大菱鲆幼鱼生长、摄食的影响,并测定了其血清中与生长和摄食相关的激素含量,并借助分子生物学手段研究了不同光照条件下幼鱼神经肽Y基因的变化,以期为LED照明系统在水产中的应用提供一定的理论依据和数据支持。
1 材料与方法
1.1 材料
试验用大菱鲆由山东省东方海洋股份有限公司莱州分厂提供,从养殖池中选择体质量为(3.17±0.07)g的健康幼鱼进行试验。试验系统为自行搭建的小型流水系统,养殖水槽为85 cm×75 cm×60 cm,有效水深为30 cm,水流速度为(45.45±8.53)mL/s。养殖用水为深井过滤海水,水温为(18.3±0.5)℃,盐度为27~29,溶解氧为(12.34±3.20)mg/L。将试验鱼由养殖池转到水槽中暂养7 d进行驯化,灯光打开后再驯化7 d。每天7:00、12:00、17:00按体质量的3%定量投喂3次。
1.2 方法
1.2.1 灯光设置 LED光源由博瑞光电照明有限公司根据试验要求开发,有冷白光、暖白光、红光、蓝光和绿光共5种光源。光照度可通过数控电路进行精密控制以保证光照度为试验要求的强度。每盏LED灯悬挂在离水面75 cm处,光照度以水面中心位置的测定值为准,使用TES-1339专业级照度计测定。每个灯都配有一个数码定时器精确控制光周期。每个水槽由黑色塑料布遮挡,以避免环境光照对试验的影响。
1.2.2 试验设计 试验饲料为常熟泉兴营养添加剂有限公司生产的多宝鱼(大菱鲆)慢沉颗粒配合饲料,主要营养成分为粗蛋白质≥52%、粗纤维≤4%、粗灰分≤16%、赖氨酸≥1.8%、水分≤12%、食盐≤3.8%、钙≤5%和磷≥0.5%。在东方海洋科技股份有限公司莱州分公司进行大菱鲆光照试验,正式养殖时间为65 d。光色、光照度及光周期的设置见表1。
表1 光照试验水平及因素
Tab.1 Factors and levels of illumination experiment
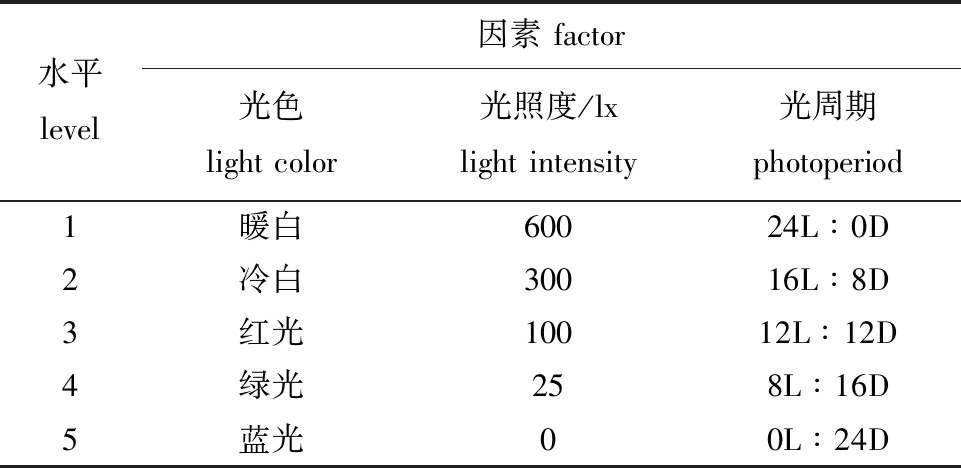
水平level因素 factor光色 light color光照度/lx light intensity光周期 photoperiod1暖白60024L∶0D2冷白30016L∶8D3红光10012L∶12D4绿光258L∶16D5蓝光00L∶24D
1)光色试验。采用完全随机化试验设计,使用红、绿和蓝三原色的LED灯,并设置暖白和冷白LED灯作为白光对照,每个光照条件设置3个重复。将试验鱼随机分配到每个处理组,每组80尾鱼,其他光照条件保持一致(光周期为12L∶12D,光照度为300 lx)。
2)光照度试验。在冷白光源下设置600、300、100、25 lx及黑暗对照(0 lx)5个光照度,每个光照条件设置3个重复。将试验鱼随机分配到每个处理组,每组80尾鱼,光周期为12L∶12D。
3)光周期试验。在冷白光源下设置24L∶0D、16L∶8D、12L∶12D、8L∶16D及黑暗对照(0L∶24D,L为光照,D为黑暗)5个光周期,每个光照条件设置3个重复。将试验鱼随机分配到每个处理组,每组80尾鱼,光照度为300 lx。
1.2.3 样品采集与分析 试验开始时停食1 d,从每组取20尾鱼测定体质量,计算每个处理组鱼的初始平均体质量。每天测量一次温度,每周测定一次水质指标,保证水质适宜大菱鲆生长,每天记录鱼的死亡数。每天定时、定量投喂,黑暗对照组仅在投喂时开启微弱灯光。试验结束时停食1 d,将每个处理组所有80尾鱼的体质量进行测定,计算每个处理组的最终平均体质量。停食1 d后,在微弱灯光下从每组随机取样3尾,使用MS-222麻醉,用预冷的无菌注射器从尾柄静脉采集血液,4 ℃冰箱静置过夜,于4 ℃下离心(8 000 r/min)15 min,取上层血清保存于-80 ℃超低温冰箱中,用于测定生长和摄食相关激素的含量。采血后的鱼在冰上解剖,取其下丘脑用预冷的RNAstore液保存,在4 ℃冰箱保存12 h后,置入-80 ℃超低温冰箱中长期保存,用于神经肽Y基因的定量分析。
1.2.4 生长性能指标的计算 存活率(survival rate, RS)、特定生长率(specific growth rate, RSG)和饵料系数(feed conversion ratio,RFC)计算公式为
RS=Nt/N0×100%,
(1)
RSG=(lnWt-lnW0)/t×100%,
(2)
RFC=F/(Wt-W0)。
(3)
式中:Nt、N0分别为试验末和初始幼鱼数量(ind.);Wt、W0分别为试验末和初始幼鱼平均体质量(g);t为养殖时间(d);F为摄食饲料总量(g)。
1.2.5 生长和摄食相关激素水平的测定 使用鱼生长激素ELISA检测试剂盒、鱼IGF-1 ELISA检测试剂盒和鱼神经肽Y ELISA检测试剂盒(江苏奇一科技有限公司)进行生长激素(growth hormone,GH)、胰岛素样生长因子-1(IGF-1)和神经肽Y(neuropeptide,NPY)含量的测定。
1.2.6 神经肽Y基因的定量 使用MiniBEST Universal RNA Extraction Kit(TaKaRa)提取总RNA,使用反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)(TaKaRa)反转录合成cDNA,稀释25倍后参照SYBR® Premix Ex TaqTMII (Tli RNaseH Plus)(TaKaRa)说明书,以β-action作为内参基因进行实时定量PCR (quantitative real-time PCR,qRT-PCR)。反应程序:95 ℃下预变性30 s;95 ℃下变性5 s,62 ℃下退火26 s,共进行40个循环。每个样品设置3个平行,NPY和内参β-action基因的引物序列(表2)参照课题组前期对NPY基因的研究设计[17],由铂尚生物技术(上海)有限公司合成。所得的Ct值通过2-ΔΔCt法计算NPY基因的相对表达量。
表2 实时定量PCR引物序列
Tab.2 Nucleotide sequences of the primers for real-time PCR

引物 primer 序列 sequence(5′-3′)NPYF:CAGCCCTGAGACACTACATCAACCTR:CTCAGAGACCAGTGTGTCCAGAATCβ-actionF:TGAACCCCAAAGCCAACAGGR:CAGAGGCATACAGGGACAGCAC
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 18.0软件进行单因素方差分析(one-way ANOVA),采用LSR法进行多重比较,检验显著性水平为0.05。
2 结果分析
2.1 不同光照环境下大菱鲆幼鱼存活率的变化
从表3可见,大菱鲆幼鱼的存活率由低至高依次为红色光源处理组<蓝色光源处理组<黑暗对照组<其他光照组(包括剩余光色、光照度和光周期处理组),且各处理组间无显著性差异(P>0.05)。这表明,光色、光照度和光周期对大菱鲆幼鱼的存活率未产生显著影响。
表3 不同光照条件下大菱鲆幼鱼的存活率
Tab.3 Survival rate of juvenile turbot reared at different light conditions

光照条件 light condition存活率 survival rate/%红色光源处理组 red light source89.58±5.05蓝色光源处理组 blue light source96.67±1.44黑暗对照组 dark control97.08±1.91其他光照组 other lighting groups100
2.2 不同光色下大菱鲆幼鱼生长和摄食的变化
2.2.1 不同光色下大菱鲆幼鱼的特定生长率和饵料系数 从表4可见:养殖65 d后,冷白光源处理组大菱鲆幼鱼的特定生长率最大(3.356 %/d),不同光色处理组幼鱼的特定生长率由高至低依此为冷白>绿色>暖白>蓝色>红色光源,仅红色光源处理组幼鱼的特定生长率显著低于冷白和绿色光源处理组(P<0.05),其他处理组间均无显著性差异(P>0.05);冷白光源处理组幼鱼的饵料系数最低,各处理组饵料系数由小到大依次为冷白<绿色<暖白<蓝色<红色光源,红色光源处理组饵料系数显著高于冷白和绿色光源处理组(P<0.05)。
表4 不同光色下大菱鲆幼鱼的特定生长率和饵料系数
Tab.4 Specific growth rate and feed conversion ratio of juvenile turbot reared at different light colors
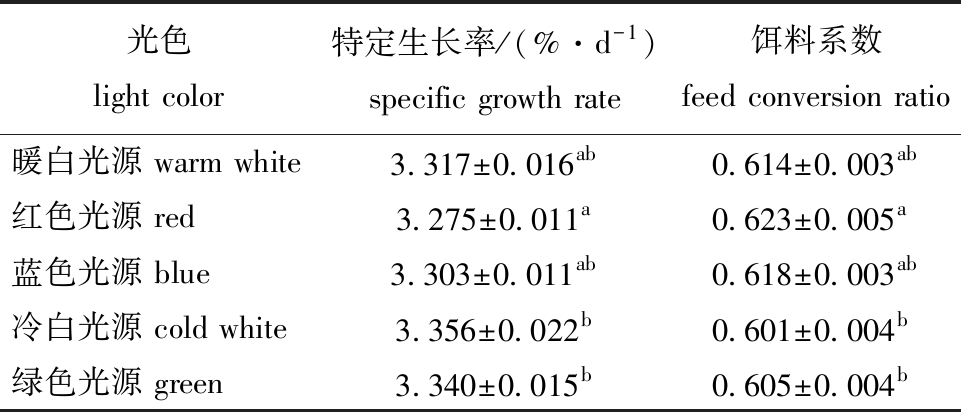
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
光色light color特定生长率/(%·d-1)specific growth rate饵料系数feed conversion ratio暖白光源 warm white3.317±0.016ab0.614±0.003ab红色光源 red3.275±0.011a0.623±0.005a蓝色光源 blue3.303±0.011ab0.618±0.003ab冷白光源 cold white3.356±0.022b0.601±0.004b绿色光源 green3.340±0.015b0.605±0.004b
2.2.2 不同光色下大菱鲆幼鱼血清生长相关激素水平 养殖65 d后,不同光色养殖环境下,大菱鲆幼鱼血清中GH含量为70.068~98.221 μg/L,各组GH含量由高至低依次为绿色>冷白>暖白>蓝色>红色光源,冷白、绿色光源处理组GH含量较高且显著高于红色光源处理组(P<0.05)(表5);大菱鲆幼鱼血清GH含量与特定生长率呈正相关,回归方程为y=347.31x-1 068.3(R2=0.874 6)。
表5 不同光色下大菱鲆幼鱼的生长和摄食相关激素水平
Tab.5 The levels of hormone related to growth and feeding in juvenile turbot reared at different light colors

光色light color生长相关激素水平 level of hormones associated with growth摄食相关激素水平 level of hormones associated with feeding血清中生长激素/(μg·L-1)GH in serum血清中IGF-1/(μg·L-1)IGF-1 in serum血清中神经肽Y/(ng·L-1)NPY in serum下丘脑中神经肽Y基因NPY gene in hypothalamus暖白光源 warm white79.541±4.682ab12.705±1.123ab393.185±33.391ab1.021±0.128ab红色光源 red70.068±3.298a9.804±0.906a359.487±16.742a0.741±0.141a蓝色光源 blue78.654±2.951ab12.001±1.735ab378.457±38.232ab0.942±0.153ab冷白光源 cold white94.362±7.493b14.360±1.065b446.532±18.994b1.917±0.285b绿色光源 green98.221±3.548b13.398±0.720b443.890±18.378b1.486±0.435ab
不同光色养殖环境下,大菱鲆幼鱼血清中IGF-1含量为9.804~14.360 μg/L,冷白、绿色光源处理组IGF-1含量较高且显著高于红色光源处理组(P<0.05)(表5);大菱鲆幼鱼血清IGF-1含量与特定生长率呈正相关,回归方程为y=53.386x-164.69(R2=0.865 5)。
2.2.3 不同光色下大菱鲆幼鱼摄食相关激素水平 养殖65 d后,不同光色养殖环境下,大菱鲆幼鱼血清中NPY含量为359.487~446.532 ng/L,其中,冷白、绿色光源处理组NPY含量较高且显著高于红色光源处理组(P<0.05),其他处理组间均无显著性差异(P>0.05)(表5);大菱鲆幼鱼血清NPY水平与饵料系数呈负相关,回归方程为y=-4 268.2x+3 017.3(R2=0.879 8)。
不同光色养殖环境下,冷白光源处理组大菱鲆幼鱼下丘脑NPY基因mRNA的相对表达量最高且显著高于红色光源处理组(P<0.05),其他处理组间均无显著性差异(P>0.05)(表5);大菱鲆幼鱼下丘脑NPY基因mRNA相对表达量与饵料系数呈负相关,回归方程为y=-51.098x+32.499(R2=0.947 5)。
2.3 不同光照度下大菱鲆幼鱼生长和摄食的变化
2.3.1 不同光照度下大菱鲆幼鱼的特定生长率和饵料系数 从表6可见,养殖65 d后,不同光照度下,大菱鲆幼鱼的特定生长率为3.297~3.356 %/d,光照度300、100 lx处理组大菱鲆幼鱼的特定生长率较高且显著高于600 lx处理组(P<0.05),其他处理组间均无显著性差异(P>0.05);大菱鲆的饵料系数为0.601~0.616,300、100 lx处理组大菱鲆幼鱼的饵料系数较低且显著低于600 lx组(P<0.05)。
表6 不同光照度下大菱鲆幼鱼的特定生长率和饵料系数
Tab.6 Specific growth rate and feed conversion ratio of juvenile turbot reared at different light intensities
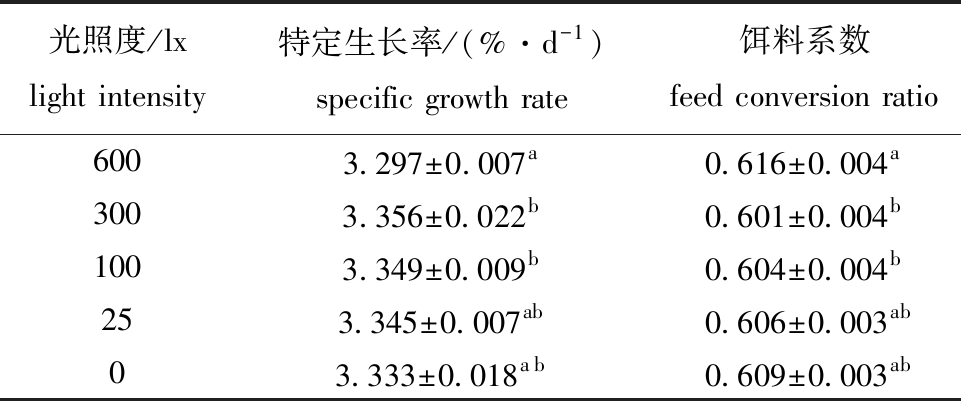
光照度/lxlight intensity特定生长率/(%·d-1)specific growth rate饵料系数feed conversion ratio6003.297±0.007a0.616±0.004a3003.356±0.022b0.601±0.004b1003.349±0.009b0.604±0.004b253.345±0.007ab0.606±0.003ab03.333±0.018ab0.609±0.003ab
2.3.2 不同光照度下大菱鲆幼鱼血清生长相关激素水平 饲养65 d后,不同光照度养殖环境下,大菱鲆幼鱼血清中GH含量为76.577~94.362 μg/L,300 lx处理组的GH含量最高且显著高于600 lx处理组(P<0.05)(表7);大菱鲆幼鱼血清GH水平与特定生长率呈正相关,回归方程为y=241.37x-720.57(R2=0.697 1)。
表7 不同光照度下大菱鲆幼鱼的生长和摄食相关激素水平
Tab.7 The levels of hormone related to growth and feeding in juvenile turbot reared at different light intensities

光照度/lxlight intensity生长相关激素水平 level of hormones associated with growth摄食相关激素水平 level of hormones associated with feeding血清中生长激素/(μg·L-1)GH in serum血清中IGF-1/(μg·L-1)IGF-1 in serum血清中神经肽Y/(ng·L-1)NPY in serum下丘脑中神经肽Y基因NPY gene in hypothalamus60076.577±4.960a10.851±0.687a397.333±24.568a0.783±0.106a30094.362±7.493b14.360±1.065b446.532±18.994b1.156±0.078b10082.880±5.039ab13.866±0.916b423.698±24.887ab1.021±0.140ab2587.358±7.991ab13.177±0.859ab412.705±17.657ab0.969±0.069ab081.258±3.927ab12.852±1.046ab421.948±15.934ab1.016±0.059ab
不同光照度养殖环境下,大菱鲆幼鱼血清IGF-1含量为10.851~14.360 μg/L,光照度300、100 lx处理组IGF-1含量较高且显著高于600 lx处理组(P<0.05)(表7);大菱鲆幼鱼血清IGF-1水平与特定生长率呈正相关,回归方程为y=57.172x-177.67(R2=0.875 3)。
2.3.3 不同光照度下大菱鲆幼鱼摄食相关激素水平 不同光照度养殖环境下,大菱鲆幼鱼血清NPY含量为397.333~446.532 ng/L,光照度300 lx处理组NPY含量最高且显著高于600 lx处理组(P<
0.05),其次为100、0、25 lx处理组(表7);大菱鲆幼鱼血清NPY含量与饵料系数呈负相关,回归方程为y=-2 779.3x+2 108.1(R2=0.784 8)。
不同光照度养殖环境下,300 lx处理组大菱鲆幼鱼下丘脑NPY基因mRNA的相对表达量最高,其次为100、0、25 lx处理组,仅300 lx处理组显著高于600 lx处理组(P<0.05)(表7);大菱鲆幼鱼NPY基因mRNA的相对表达量与饵料系数呈负相关,回归方程为y=-22.235x+14.487(R2=0.900 6)。
2.4 不同光周期下大菱鲆幼鱼生长和摄食的变化
2.4.1 不同光周期下大菱鲆幼鱼的特定生长率和饵料系数 从表8可见:不同光周期下,大菱鲆幼鱼的特定生长率为3.224~3.375 %/d,持续光照组(24L∶0D)大菱鲆幼鱼的特定生长率最小且显著低于12L∶12D、8L∶16D处理组和黑暗对照组(0L∶24D)(P<0.05),各光周期组幼鱼的特定生长率由高至低依次为8L∶16D>12L∶12D>黑暗对照组(0L∶24D)>16L∶8D>24L∶0D,大菱鲆幼鱼的饵料系数为0.601~0.624,持续光照组(24L∶0D)幼鱼的饵料系数最大且显著大于12L∶12D、8L∶16D和黑暗对照组(0L∶24D)(P<0.05),各光周期组幼鱼的饵料系数由大到小依次为24L∶0D>16L∶8D>黑暗对照组(0L∶24D)>12L∶12D>8L∶16D。
表8 不同光周期下大菱鲆幼鱼的特定生长率和饵料系数
Tab.8 Specific growth rate and feed conversion ratio of juvenile turbot reared at different photoperiods
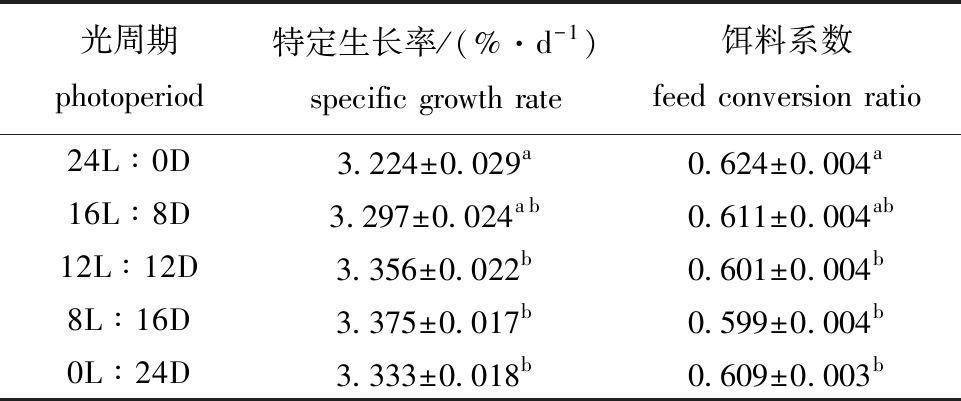
光周期photoperiod特定生长率/(%·d-1)specific growth rate饵料系数feed conversion ratio24L∶0D3.224±0.029a0.624±0.004a16L∶8D3.297±0.024ab0.611±0.004ab12L∶12D3.356±0.022b0.601±0.004b8L∶16D3.375±0.017b0.599±0.004b0L∶24D3.333±0.018b0.609±0.003b
2.4.2 不同光周期下大菱鲆幼鱼血清生长相关激素水平 不同光周期养殖环境下,大菱鲆幼鱼血清GH含量为71.044~94.744 μg/L,光周期24L∶0D处理组的GH水平最低且显著低于12L∶12D、8L∶16D及黑暗对照组(0L∶24D)(P<0.05);各光周期组幼鱼GH水平由高到低依次为8L∶16D>12L∶12D>黑暗对照组(0L∶24D)>16L∶8D>24L∶0D(表9);大菱鲆幼鱼血清GH水平与特定生长率呈正相关,回归方程为y=160.92x-449.64(R2=0.873 4)。
表9 不同光周期下大菱鲆幼鱼的生长和摄食相关激素水平
Tab.9 The levels of hormone related to growth and feeding in juvenile turbot reared at different photoperiods

光周期photoperiod生长相关激素水平 level of hormones associated with growth摄食相关激素水平 level of hormones associated with feeding血清生长激素/(μg·L-1)GH in serum血清IGF-1/(μg·L-1)IGF-1 in serum血清神经肽Y/(ng·L-1)NPY in serum下丘脑神经肽Y基因NPY gene in hypothalamus24L∶0D71.044±5.217a10.225±0.684a367.285±12.233a0.645±0.109a16L∶8D79.244±4.545ab11.821±1.445ab412.705±26.874ab0.968±0.186ab12L∶12D94.362±7.493b14.360±1.065b446.532±18.994b1.156±0.078ab8L∶16D94.744±6.182b14.525±1.385b465.078±22.344b1.451±0.089b0L∶24D81.258±3.927b12.852±1.046b421.948±15.934b1.016±0.059ab
不同光周期养殖环境下,大菱鲆幼鱼血清IGF-1含量为10.225~14.525 μg/L,光周期24L∶0D处理组幼鱼血清IGF-1含量最低且显著低于12L∶12D、8L∶16D对照组及黑暗对照组(0L∶24D)(P<0.05);各光周期组幼鱼血清IGF-1含量由高到低依次为8L∶16D>12L∶12D>黑暗对照组(0L∶24D)>16L∶8D>24L∶0D(表9);大菱鲆幼鱼血清IGF-1水平与特定生长率呈正相关,回归方程为y=29.655x-85.608(R2=0.860 4)。
2.4.3 不同光周期下大菱鲆幼鱼摄食相关激素水平 不同光周期养殖环境下,大菱鲆幼鱼血清NPY含量为367.285~465.078 ng/L,光周期24L∶0D处理组幼鱼血清NPY含量最低且显著低于12L∶12D、8L∶16D及黑暗对照组(0L∶24D)(P<0.05);各光周期组幼鱼NPY含量由高到低依次为8L∶16D>12L∶12D>黑暗对照组(0L∶24D)>16L∶8D>24L∶0D(表9);大菱鲆幼鱼血清NPY水平与饵料系数呈负相关,回归方程为y=-3 737.6x+2 697.8(R2=0.886 3)。
不同光周期养殖环境下,光周期8L∶16D处理组大菱鲆幼鱼下丘脑NPY基因mRNA的相对表达量最高且显著高于24L∶0D处理组(P<0.05);各光周期组幼鱼NPY基因mRNA的相对表达量由高到低依次为8L∶16D>12L∶12D>黑暗对照组(0L∶24D)>16L∶8D>24L∶0D(表9);大菱鲆幼鱼下丘脑NPY基因mRNA的相对表达量与饵料系数呈负相关,回归方程为y=-28.314x+18.279(R2=0.907 5)。
3 讨论
3.1 光色对大菱鲆幼鱼生长和摄食的影响
光照是影响鱼类生长、摄食和生理生化指标的重要因子之一。创造适宜的养殖环境,减少鱼类应激反应,促进鱼类生长和提高鱼类营养价值,是工厂化养殖生产中必须考虑的重要问题[18]。研究表明,光色与鱼类的生长和摄食密切相关[19-20]。本研究发现,LED光源发出的冷白光和绿光对大菱鲆幼鱼的生长和摄食有一定的促进作用,但冷白光、绿光、暖白光及蓝光处理组间无显著性差异,而红光对大菱鲆幼鱼生长和摄食的影响相比冷白光和绿光具有明显的抑制作用,且出现鱼死亡较多的现象。这可能与野生大菱鲆的栖息环境有关,原产自欧洲(大西洋东侧欧洲沿岸)的大菱鲆,属于底栖性鱼类,活跃于水深20~70 m处,此深度下,短波长的蓝绿光分布较多,长波长的红光分布较少甚至消失[21]。鱼类的视网膜内有可感光的视杆细胞和对特定波长反应灵敏的视锥细胞,这两种细胞里的视色素会把光线转化为可供解读的信号[22]。鱼类视网膜所具有的视色素与特定种群所在栖息水域光谱的光波峰是一致的[23],深水活动的鱼类光谱敏感曲线在短波长范围内,即对蓝绿光敏感[24],蓝绿光对其生长和摄食可能产生促进作用,如条斑星鲽(Verasper moseri)[20],绿光可提高其生长性能,而红光则能降低其生长性能;活动在近岸海水与淡水中的鱼类吸收的光则偏重于长波长(红光)范围内[24],如镜鲤[25]等,红光会促进其生长。可见,不同鱼类适宜生长的光色有所不同。
3.2 光照度对大菱鲆幼鱼生长和摄食的影响
鱼类的适宜光照度随种类的不同而产生明显的差异,往往与鱼类所处的自然环境有关。本研究中,强光照处理组(600 lx)的大菱鲆幼鱼生长和摄食情况较差,可能是因为强光照会抑制鱼类的采食行为,并且会使鱼类的游动频率增加[26],导致更多的能量用于鱼类游动而不是自身的生长[27]。大菱鲆幼鱼在25~300 lx光照度范围内的生长和摄食较好,并且在完全黑暗情况下,仅于摄食时给予光照照射,生长和摄食情况同样较好,说明大菱鲆幼鱼适宜在弱光条件下生长,这与其营底栖生活有关,在一定光照度范围内,其生长和摄食不会受到影响。本研究结果与对同样营底栖生活的漠斑牙鲆(Paralichthys lethostigma)[28]的研究结果一致。
3.3 光周期对大菱鲆幼鱼生长和摄食的影响
鱼类的适宜光周期随种类的不同也会产生一定的差异。本研究中,大菱鲆幼鱼养殖在短光周期(0~12 h光照)下相对于长光周期下生长和摄食较好,且全天持续光照对生长和摄食有明显的抑制作用。持续光照对生长和摄食的抑制与长时间光照引起的胁迫有关,鱼类将花费更多时间在寻找掩体和互相竞争上;在短光照和黑暗中,鱼类将更多能量用于生长,而将较少的能量用于与新陈代谢相关的活动[29]。在不增加投饵频次的情况下,大菱鲆在持续光照下的新陈代谢活动消耗可能更大,导致其生长减缓。本研究结果与对鲆鲽类的狭鳞庸鲽(Hippoglossus stenolepis)[30]仔稚鱼的研究结果一致。
3.4 光照对大菱鲆幼鱼生长和摄食相关激素水平的影响
鱼类生长激素具有促进生长、提高摄食效率、参与蛋白质合成、促进脂肪代谢和调节渗透压等作用。生长激素对生长的调节主要通过胰岛素样生长因子IGF家族(insulin-like growth factor,IGF)的配合来实现,其中,起主要作用的因子是胰岛素样生长因子-1[31]。已有研究表明,光照通过刺激垂体中生长激素的分泌影响鱼类的生长[2]。本研究中,大菱鲆幼鱼生长相关激素(GH和IGF-1)水平在不同光照环境下表现出一定的差异,且与特定生长率呈正相关,这也佐证了此结论。鱼类神经肽Y主要参与摄食行为的调节,起到促进摄食的作用[32],作者前期研究也已证明,大菱鲆的NPY基因参与了摄食调控,且起到了促进摄食的作用[17]。本研究中,大菱鲆幼鱼血清中NPY含量和下丘脑中NPY基因的mRNA表达量在不同光照环境下表现出一定的差异,且与饵料系数间呈负相关,大菱鲆NPY表达水平可以作为衡量大菱鲆幼鱼摄食情况的一个分子指标。由此可见,光照会影响大菱鲆幼鱼生长和摄食相关激素水平,激素水平的改变进而影响了其生长和摄食,但其具体影响机制还需进一步研究。
4 结论
1)红光对大菱鲆生长和摄食的影响相对于冷白光源等其他光源具有抑制作用,并出现鱼死亡相对较多的现象。因此,在生产上要尽量避免红光,相应照明装置的光照波长也要避开红光。
2)大菱鲆幼鱼适宜在较弱(25~300 lx)的光照环境中生长,这与其所栖息的自然环境有关,强光照会抑制大菱鲆幼鱼的生长和摄食。
3)持续光照会抑制大菱鲆的生长和摄食,短光周期(0~12 h光照)相对于长光周期更利于大菱鲆幼鱼的生长和摄食。
[1] 许国晶,段登选,张金路,等.几个环境因子对鱼类生长发育影响的研究进展[J].山东师范大学学报(自然科学版),2014,29(1):147-150.
XU G J,DUAN D X,ZHANG J L,et al.Effects of environmental factors on the growth and development in fish[J].Journal of Shandong Normal University (Natural Science Edition),2014,29(1):147-150.(in Chinese)
[2] RUCHIN A B.Effect of illumination on fish and amphibian:development,growth,physiological and biochemical processes[J].Reviews in Aquaculture,2021,13(1):567-600.
[3] MORET K J.Effects of photoperiod and light intensity on the survival,growth and feeding behaviour of larval striped wolffish (Anarhichas lupus) [J].Reproductive Biology,2013,13(1):42-42.
[4] 赵年桦,赵贺,强壮,等.水温、光周期和光照强度对塔里木裂腹鱼幼鱼存活、摄食和生长的影响及其盐碱耐受能力研究[J].南方水产科学,2021,17(5):54-63.
ZHAO N H,ZHAO H,QIANG Z,et al.Effects of water temperature,photoperiod and light intensity on survival,feeding and growth of Schizothorax biddulphi juveniles and their tolerance of salinity and alkalinity[J].South China Fisheries Science,2021,17(5):54-63.(in Chinese)
[5] KORSØEN Ø,DEMPSTER T,FOSSEIDENGEN J E,et al.Towards cod without spawning:artificial continuous light in submerged sea-cages maintains growth and delays sexual maturation for farmed Atlantic cod Gadus morhua[J].Aquaculture Environment Interactions,2013,3(3):245-255.
[6] LASSE TARANGER G,CARRILLO M,SCHULZ R W,et al.Control of puberty in farmed fish[J].General and Comparative Endocrinology,2010,165(3):483-515.
[7] TIAN H Y,ZHANG D D,XU C,et al.Effects of light intensity on growth,immune responses,antioxidant capability and disease resistance of juvenile blunt snout bream Megalobrama amblycephala[J].Fish &Shellfish Immunology,2015,47(2):674-680.
[8] VILLAMIZAR N,BLANCO-VIVES B,MIGAUD H,et al.Effects of light during early larval development of some aquacultured teleosts:a review[J].Aquaculture,2011,315(1/2):86-94.
[9] SIERRA-FLORES R,DAVIE A,GRANT B,et al.Effects of light spectrum and tank background colour on Atlantic cod (Gadus morhua) and turbot (Scophthalmus maximus) larvae performances[J].Aquaculture,2016,450:6-13.
[10] ULLMANN J F,GALLAGHER T,HART N S,et al.Tank color increases growth,and alters color preference and spectral sensitivity,in barramundi(Lates calcarifer)[J].Aquaculture,2011,322,323:235-240.
[11] DOWNING G.Impact of spectral composition on larval haddock,Melanogrammus aeglefinus L.,growth and survival[J].Aquaculture Research,2002,33(4):251-259.
[12] RUCHIN A.Growth and feeding intensity of young carp Cyprinus carpio under different constant and variable monochromatic illuminations[J].Journal of Ichthyol,2002,42:191-199.
[13] WANG T,CHENG Y,LIU Z,et al.Effects of light intensity on growth,immune response,plasma cortisol and fatty acid composition of juvenile Epinephelus coioides reared in artificial seawater[J].Aquaculture,2013,414/415:135-139.
[14] 姜志强,谭淑荣.不同光照强度对花鲈幼鱼摄食的影响[J].水产科学,2002,21(3):4-5.
JIANG Z Q,TAN S R.Effect of light intensity on feeding intensity of Lateolabrax japonicus juvenile[J].Fisheries Science,2002,21(3):4-5.(in Chinese)
[15] SIMENSEN L M,JONASSEN T M,IMSLAND A K,et al.Photoperiod regulation of growth of juvenile Atlantic halibut (Hippoglossus hippoglossus L.)[J].Aquaculture,2000,190(1/2):119-128.
[16] 黄国强,李洁,唐夏,等.光照周期对褐牙鲆幼鱼生长、能量分配及生化指标的影响[J].水产学报,2014,38(1):109-118.
HUANG G Q,LI J,TANG X,et al.Effects of photoperiod on the growth,energy allocation,and biochemical parameters in juvenile brown flounder(Paralichthys olivaceus)[J].Journal of Fisheries of China,2014,38(1):109-118.(in Chinese)
[17] 韩建,刘滨,姜志强,等.大菱鲆神经肽Y基因克隆及其在工厂化养殖饥饿-投喂策略中的表达特征分析[J].中国工程科学,2014,16(9):42-49.
HAN J,LIU B,JIANG Z Q,et al.cDNA cloning of neuropeptide Y gene of turbot and its expression analysis for the strategy of starvation and feeding in industrial culture[J].Engineering Sciences,2014,16(9):42-49.(in Chinese)
[18] 周显青,牛翠娟,李庆芬.光照对鱼类生理活动影响的研究进展[J].生态学杂志,1999,18(6):59-61,74.
ZHOU X Q,NIU C J,LI Q F.A review of the effect of light on physiological activities of fishes[J].Chinese Journal of Ecology,1999,18(6):59-61,74.(in Chinese)
[19] 仇登高,徐世宏,刘鹰,等.光环境因子对循环水养殖系统中大西洋鲑生长和摄食的影响[J].中国水产科学,2015,22(1):68-78.
QIU D G,XU S H,LIU Y,et al.Effects of different types of environment light on the growth performance and feeding of Atlantic salmon(Salmo salar) in recirculating aquaculture systems[J].Journal of Fishery Sciences of China,2015,22(1):68-78.(in Chinese)
[20] YAMANOME T,MIZUSAWA K,HASEGAWA E I,et al.Green light stimulates somatic growth in the barfin flounder Verasper moseri[J].Journal of Experimental Zoology Part A:Ecological Genetics and Physiology,2009,311A(2):73-79.
[21] 刘莲珍,李武.海中不同波长光衰减特性的研究[J].黄渤海海洋,1986,1:30-35.
LIU L Z,LI W.A study of the attenuation properties of the light with various wavelength in the sea[J].Journal of Oceanography of Huanghai &Bohai seas,1986,1:30-35.(in Chinese)
[22] KUSMIC C.Morphology and spectral sensitivities of retinal and extraretinal photoreceptors in freshwater teleosts[J].Micron,2000,31(2):183-200.
[23] 宋昌斌,刘立莉,卢鹏志,等.水产养殖车间LED光环境设计研究[J].大连海洋大学学报,2018,33(2):145-150.
SONG C B,LIU L L,LU P Z,et al.Design of artificial LED lighting in aquaculture workshop[J].Journal of Dalian Ocean University,2018,33(2):145-150.(in Chinese)
[24] ARIMOTO T,GLASS C W,ZHANG X M.Fish vision and its role in fish capture[M]//Behavior of marine fishes:capture processes and conservation challenges.Ames,Iowa,USA:Blackwell Publishing,2010:25-44.
[25] KARAKATSOULI N,PAPOUTSOGLOU E S,SOTIROPOULOS N,et al.Effects of light spectrum,rearing density and light intensity on growth performance of scaled and mirror common carp Cyprinus carpio reared under recirculating system conditions[J].Aquacultural Engineering,2010,42(3):121-127.
[26] STAFFAN F.Food competition and its relation to aquaculture in juvenile Perca fluviatilis[D].Ultuna,Sweden:Swedish University of Agricultural Sciences,2004.
[27] TRIPPEL E A,NEIL S R.Effects of photoperiod and light intensity on growth and activity of juvenile haddock (Melanogrammus aeglefinus)[J].Aquaculture,2003,217(1/2/3/4):633-645.
[28] HENNE J P,WATANABE W O.Effects of light intensity and salinity on growth,survival,and whole-body osmolality of larval southern flounder Paralichthys lethostigma[J].Journal of the World Aquaculture Society,2010,34(4):450-465.
[29] APPELBAUM S,KAMLER E.Survival,growth,metabolism and behaviour of Clarias gariepinus (Burchell 1822) early stages under different light conditions[J].Aquacultural Engineering,2000,22(4):269-287.
[30] LIU HAN W U,STICKNEY R R,DICKHOFF W W,et al.Effects of environmental factors on egg development and hatching of Pacific halibut Hippoglossus stenolepis[J].Journal of the World Aquaculture Society,1994,25(2):317-321.
[31] REINECKE M,BJÖRNSSON B T,DICKHOFF W W,et al.Growth hormone and insulin-like growth factors in fish:where we are and where to go[J].General and Comparative Endocrinology,2005,142(1/2):20-24.
[32] ASSAN D,MUSTAPHA U F,CHEN H P,et al.The roles of neuropeptide Y (npy) and peptide YY (pyy) in teleost food intake:a mini review[J].Life,2021,11(6):547.