海洋聚球藻(Synechococcus)是一类重要的单细胞蓝藻,与单细胞藻类原绿球藻(Prochlorococcus)比较,海洋聚球藻的分布范围更为广泛,从近岸到外海、从热带到极地海域均有分布[1-2]。海洋聚球藻贡献了全球海洋净初级生产力的16.7%[3-4],是构成全球碳循环的重要组成部分[5]。因此,研究海洋聚球藻在全球海域的分布模式,对于提高海洋生态系统碳汇能力、实现碳达峰、碳中和意义重大。
基于16S rRNA(subunit of RNA polymerase)基因、rpoC1基因和ITS序列等基因标记分析,海洋聚球藻被分为3个亚类约20个分型,即亚类5.1、5.2和5.3[3,6-10]。其中,亚类5.1 可进一步分为5.1A (包括分型Ⅱ、Ⅲ、Ⅳ、ⅩⅤ和CRD2)和5.1 B(包括分型Ⅰ、Ⅴ、Ⅵ、Ⅶ、Ⅷ、Ⅸ、ⅩⅥ和CRD1)[2,11]。分型CB4和CB5属于5.2亚类,而分型Ⅹ被归为分支5.3-Ⅰ[1-2,12]。已有研究发现,不同类型的海洋聚球藻在纬度[1-2,11,13-17]、水平分布[2,11-12,15]及垂直分布[11,14,16]上呈现出不同的分布规律。影响聚球藻各类群生物地理学分布的主要环境因子为温度[15-18]、盐度[2,18]、营养盐类型和可利用性[19-20],以及微量金属如铁(Fe2+)和钴(Co2+)[16]等。
尽管已有一些海洋聚球藻生态类群在全球海域分布的研究,但对海洋动力学背景下聚球藻生态类群分布的研究较少。聚球藻具有较高的营养需求,其在近岸[21]和上升流区[22]具有较高丰度的分布,已有研究对上升流区聚球藻类群的生物地理学分布和生态学机制进行了调查及探讨[15-17,23]。研究认为,CRD1和CRD2型是CRD上升流区聚球藻属的优势分型[16-17,23]。另外,在海洋上升流水体中也检测到Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅹ、ⅩⅤ及ⅩⅥ型等聚球藻的分布,温度、盐度、混合层深度和痕量金属是影响上升流区聚球藻各分型分布的重要因素[15-17]。尽管这些研究对上升流区聚球藻分型的生物地理学分布及其影响因素进行了调查,但研究海域主要集中于大洋上升流区,而对近岸上升流区缺乏相关研究;另外,研究的空间范围也主要针对上升流断面,而对聚球藻各类群在上升流区精密空间尺度的共存关系及影响机制尚缺乏报道。
本研究中,采用16S~23S rDNA ITS qPCR技术,对南海西北部琼东上升流海域水体中10个聚球藻主要分型的水平和垂直分布特征进行了调查,探讨了海洋聚球藻各类群在近岸上升流区的分布特征、共存关系及其影响机制,该研究结果有助于认识海洋上升流动力过程下聚球藻分型的生态位分化,可为深入研究聚球藻生态类群功能的发挥及在碳达峰、碳中和中的贡献提供科学参考。
1 材料与方法
1.1 调查区域及站位设置
琼东上升流位于南海西北部,是海南岛东岸典型的季节性近岸上升流[24]。上升流发生在18°30′~20°30′N和110°00′~111°30′E之间。强上升流在空间上主要发生在离岸130 km以内、水深小于100 m的海域[25],其中心位于离岸10 km以内、水深30 m以浅的近岸水体[26]。受西南季风影响,上升流发生的时间为每年的4—9月,其中6—8月最强[26]。地形是影响上升流空间分布的重要因素,在上升流期间,陆架上的等温线和等盐线均向近岸抬升[26],琼东上升流表层和次表层水体呈现出明显的低温、低溶解氧(DO)及高盐度等特征,这些特征对浮游藻类的丰度和分布均具有重要影响[26]。除此之外,来自海南岛中部万泉河的径流输入也会影响到水体理化特征的变化。综上,琼东海域受到上升流动力过程、近岸地形及河流输入的影响,是探讨近岸上升流区聚球藻各生态类群分布特征及影响因素的理想场所。
本次调查开展于2018年8月22—25日琼东上升流期间[26],共设置3个断面5个水层(2、25、50、100 m和底层),每条断面由从近海向外海延伸的4个站位组成,断面和水层的设置覆盖了琼东强上升流中心,采样期间在第2断面的30# 站位附近有来自万泉河的淡水输入(图1)。
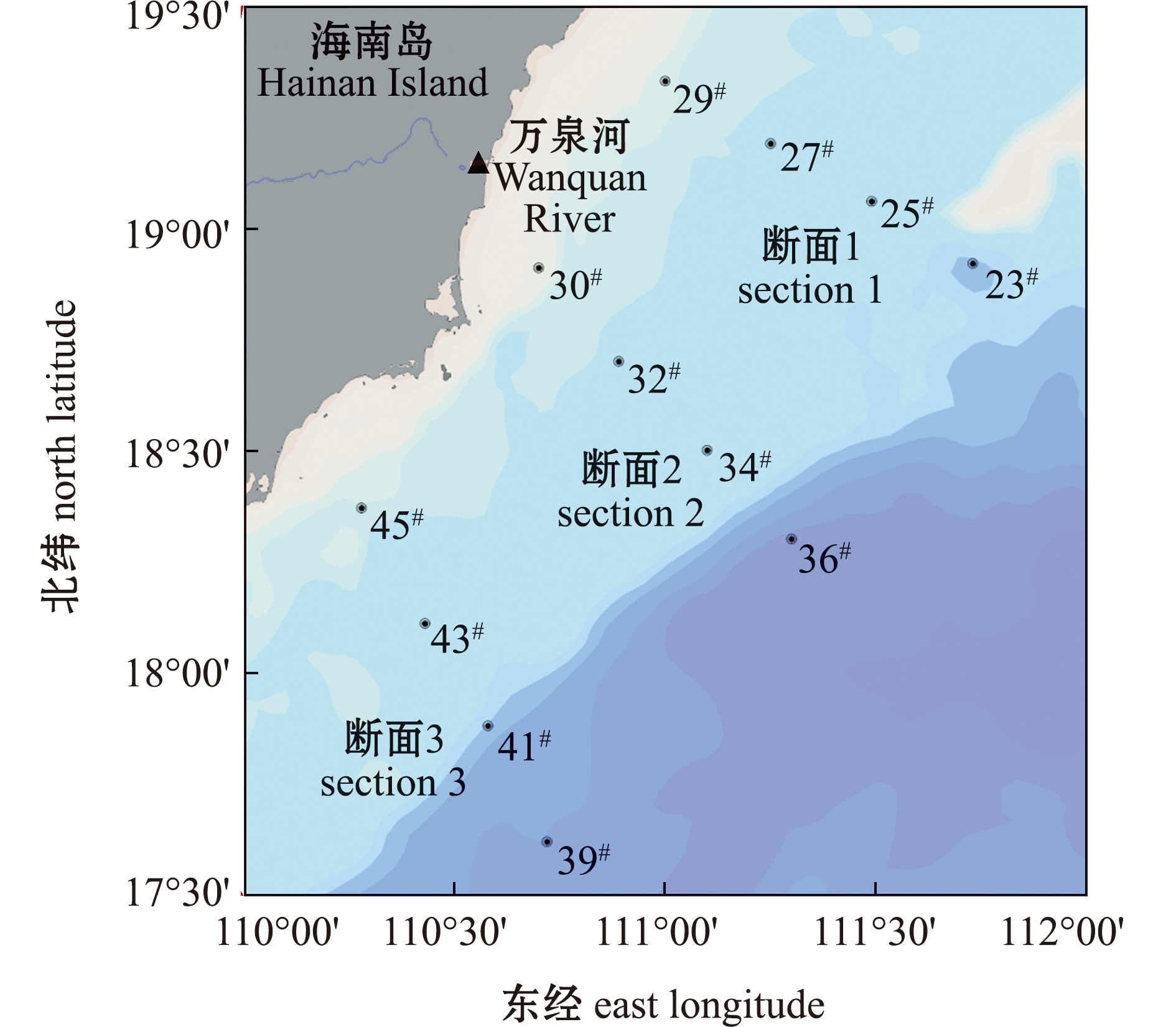
本图基于自然资源部标准地图服务网站GS(2019)4346号标准地图为底图,底图边界无修改。
The figure is based on the standard map GS(2019)4346 in the standard map service website of Ministry of Natural Resources of the People’s Republic of China,with no modifications of the boundaries in the standard map.
图1 琼东上升流的地理位置和采样点位置
Fig.1 Geographical position and sampling sites in the Qiongdong upwelling
1.2 方法
1.2.1 上升流水环境参数及海水样品采集 通过温盐深测量仪CTD(Seabird SBE 911 Plus,USA)现场检测水环境参数(温度、盐度、DO和叶绿素)。同时通过挂在CTD上的南森瓶采集海水样品,每个站位采集1 L海水并用0.22 μm聚碳酸酯膜蠕动过滤,将过滤后的滤膜立即冻存于-80 ℃冰箱中,用于后续聚球藻类群丰度的分析。
1.2.2 DNA提取及qPCR检测 将冷冻的滤膜在实验室解冻后,使用环境DNA提取试剂盒PowerSoil® DNA Isolation Kit(MoBio Laboratories,Carlsbad,CA,USA)从滤膜中提取环境总DNA。用超微量分光光度计Nano VueTM Plus(GE Healthcare Life Sciences,UK)测定总DNA浓度,然后保存在-80 ℃超低温冰箱直至qPCR检测。针对16S~23S rDNA ITS序列,参考Ahlgren等[1]的方法,设计qPCR引物(表1)。在荧光定量PCR仪(Bio-Rad,USA)中采用qPCR方法测定10个聚球藻分型(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅷ、Ⅹ、ⅩⅤ、ⅩⅥ、CRD1、CRD2)的丰度。部分聚球藻分型(Ⅴ、Ⅵ、Ⅶ和Ⅸ)因缺乏足够的序列用于设计有效的引物,故在本研究中未检测。qPCR反应体系(20 μL):模板DNA 1 μL,上、下游引物各0.4 μL,SYBR® Green Master Mix 10 μL,无菌蒸馏水8.2 μL。qPCR扩增循环条件见表1。质粒标准曲线覆盖101 ~ 108个基因拷贝数。所有定量反应均设置3次重复,每次试验均包括无模板空白对照。通过PCR产物的熔解曲线(65.0~95.0 ℃),每增长0.5 ℃保持5 s)验证反应的特异性,并通过琼脂糖凝胶电泳验证扩增片段的预期大小。每个样品的基因丰度标准化为过滤后的每升海水,根据Ahlgren等[1]的校正方法将基因拷贝数转化为细胞密度。
表1 用于qPCR分析的引物和循环条件[1]
Tab.1 Primers and cycling conditions used for qPCR assays[1]
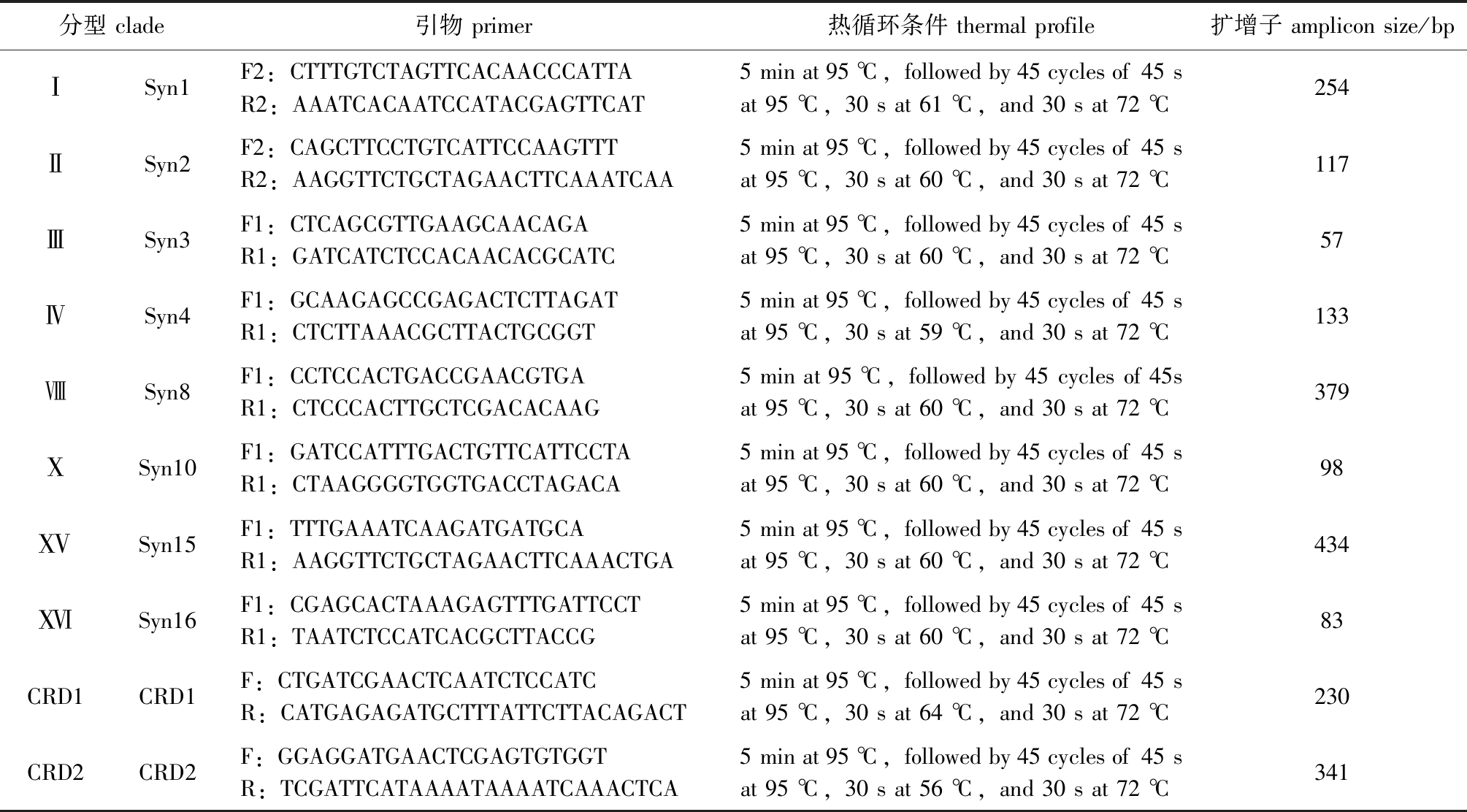
分型 clade引物 primer热循环条件 thermal profile扩增子 amplicon size/bp ⅠSyn1F2:CTTTGTCTAGTTCACAACCCATTAR2:AAATCACAATCCATACGAGTTCAT5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 61 ℃,and 30 s at 72 ℃254ⅡSyn2F2:CAGCTTCCTGTCATTCCAAGTTTR2:AAGGTTCTGCTAGAACTTCAAATCAA5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 60 ℃,and 30 s at 72 ℃117ⅢSyn3F1:CTCAGCGTTGAAGCAACAGAR1:GATCATCTCCACAACACGCATC5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 60 ℃,and 30 s at 72 ℃57ⅣSyn4F1:GCAAGAGCCGAGACTCTTAGATR1:CTCTTAAACGCTTACTGCGGT5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 59 ℃,and 30 s at 72 ℃133ⅧSyn8F1:CCTCCACTGACCGAACGTGAR1:CTCCCACTTGCTCGACACAAG5 min at 95 ℃,followed by 45 cycles of 45s at 95 ℃,30 s at 60 ℃,and 30 s at 72 ℃379ⅩSyn10F1:GATCCATTTGACTGTTCATTCCTAR1:CTAAGGGGTGGTGACCTAGACA5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 60 ℃,and 30 s at 72 ℃98ⅩⅤSyn15F1:TTTGAAATCAAGATGATGCAR1:AAGGTTCTGCTAGAACTTCAAACTGA5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 60 ℃,and 30 s at 72 ℃434ⅩⅥSyn16F1:CGAGCACTAAAGAGTTTGATTCCTR1:TAATCTCCATCACGCTTACCG5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 60 ℃,and 30 s at 72 ℃83CRD1CRD1F:CTGATCGAACTCAATCTCCATCR:CATGAGAGATGCTTTATTCTTACAGACT5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 64 ℃,and 30 s at 72 ℃230CRD2CRD2F:GGAGGATGAACTCGAGTGTGGTR:TCGATTCATAAAATAAAATCAAACTCA5 min at 95 ℃,followed by 45 cycles of 45 s at 95 ℃,30 s at 56 ℃,and 30 s at 72 ℃341
1.2.3 聚球藻各分型的分布特征及其相关分析 Sohm等[11]和Ahlgren等[16]通过将qPCR测得的聚球藻10个主要分型的丰度之和与显微镜计数或流式细胞仪计数获得的聚球藻总丰度进行比较,发现聚球藻主要分型在CRD上升流区的丰度之和与流式细胞仪测得的聚球藻总密度高度相关[16],在大西洋和太平洋4个主要海区的研究进一步证实了这一点[11]。基于上述研究结果,本研究中将qPCR试验得到的10个聚球藻分型丰度之和作为聚球藻的总丰度,以描述琼东上升流区聚球藻总量的分布特征。
利用Ocean Data View软件对琼东上升流区水环境参数和聚球藻丰度进行作图,分析其在琼东上升流区的水平和垂直分布特征。通过IBM SPSS Statistics软件计算聚球藻各分型丰度对数值之间的Spearman相关系数(R)和统计学差异(P),以探讨各型聚球藻在琼东上升流区可能存在的共现性关系。同样的方法也用于各型聚球藻丰度和水环境参数之间的相关关系分析,以探讨琼东上升流动力过程对聚球藻各类群分布的潜在影响。
2 结果与分析
2.1 琼东上升流区水环境参数
通过测定温度、DO及盐度,观测其在琼东上升流区的水平和垂直空间分布特征,依据这些指标判断采样期间是否存在上升流现象。从水平断面来看,琼东上升流近岸表层海水中并未观测到低温、低DO及高盐度的典型上升流特征,但在25 m水层观测到较表层水体的低温、低DO及高盐度现象,在50 m水层也观测到低温、低DO和高盐度锋面(图2(a))。从垂直断面来看,温度、DO和盐度的等值线呈现出明显的向近岸次表层水体的抬升(图2(b))。温度和DO在25、50、100 m水层表现出近岸站位低、离岸站位高的现象,而盐度则呈现相反的趋势,即盐度在25、50和100 m水层呈现出近岸高、离岸低的现象,在45# 站位盐度最高(图2(a))。在万泉河入海口处,盐度呈现出在表层水体(2 m)中较低且随深度增加的现象(图2(a)),表明采样期间存在径流输入的现象;另外,表层盐度在远岸存在一个低值中心的现象。综合以上结果,采样期间琼东上升流区次表层水体呈现出较表层水体低温、低DO和高盐度的现象,温度、DO及盐度的等值线向近岸方向明显抬升,近岸水体较离岸水体整体上呈现出低温、低DO及高盐度现象。这些现象表明,虽然采样期间琼东上升流并未抬升到表层海水,但在次表层海水仍然存在上升流现象,只是与最强盛期相比其抬升程度略有下降。表层盐度在远岸存在低值中心的现象,可能是由于在采样之前(7月)上升流比较强,近岸低盐度海水在风应力作用下被海流带离近岸,采样期间上升流减弱,琼东上升流区中间表层水体盐度变高,而带到琼东上升流区远岸端的表层海水就保持了低盐度现象。另外,采样期间万泉河径流输入也导致了表层水体的低盐度。
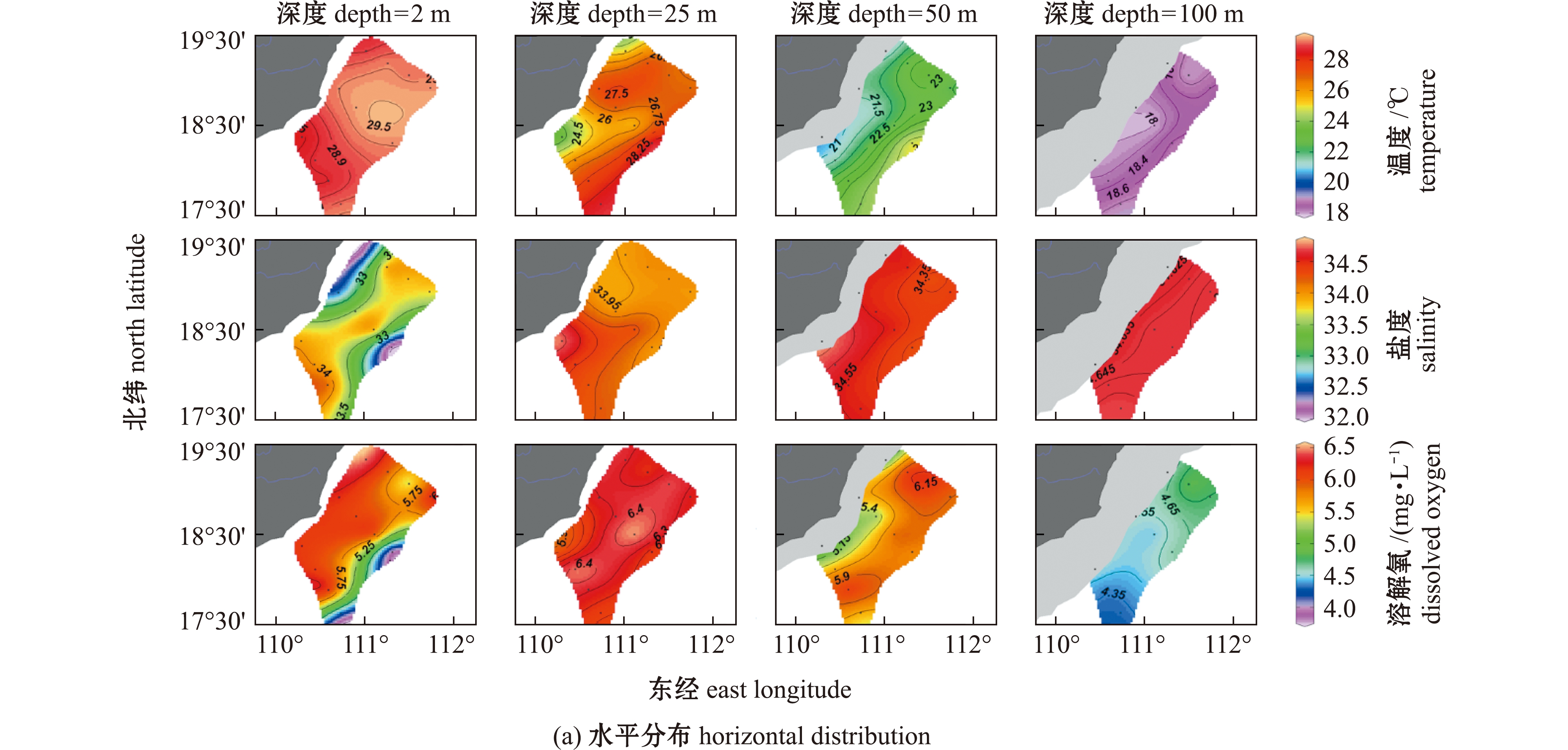
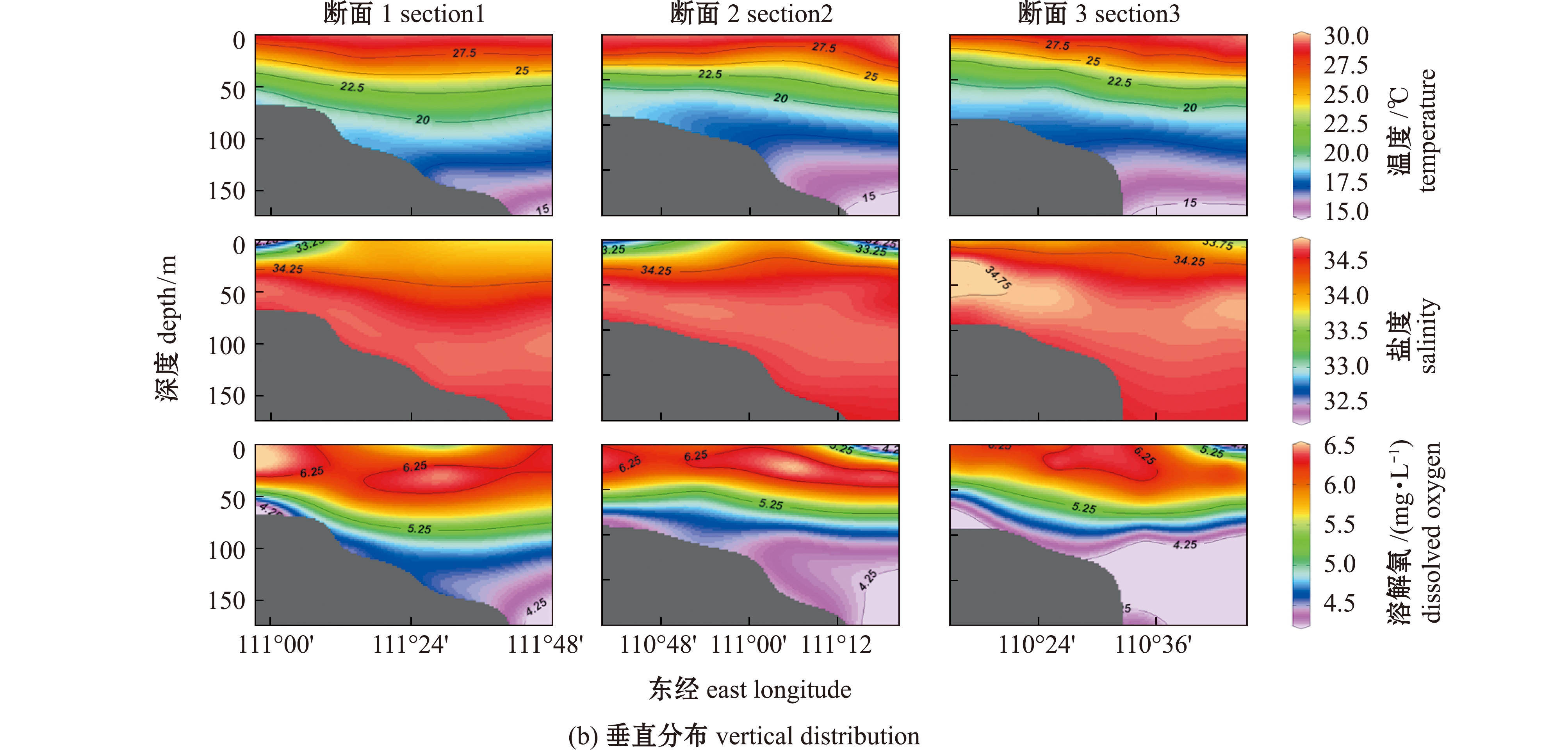
图2 琼东上升流水环境参数(盐度、温度和溶解氧)的空间分布
Fig.2 Spatial distributions of hydrological parameters (salinity,temperature and DO)in the Qiongdong upwelling
2.2 聚球藻生态类群在琼东上升流区的分布及生态位分化
2.2.1 聚球藻生态类群在琼东上升流区的分布 经qPCR分析发现,聚球藻10个分型在琼东上升流区均广泛分布,聚球藻各类群在表层水体(2 m)中的平均丰度为4.20×105 cells/mL,与热带太平洋东部CRD上升流区的报道相似[16]。比较不同样品中聚球藻各类群的总丰度发现,在万泉河河口附近的30#站位表层水体中聚球藻总丰度达到最大值(1.00×106 cells/mL)。在所有分型中,Ⅱ、Ⅲ、Ⅹ和CRD1型聚球藻在琼东海域所有调查样品中平均丰度均较高(8.43×103、2.82×103、2.79×103、2.60×103 cells/mL),其中,Ⅱ型聚球藻平均丰度最高;分型Ⅰ、Ⅳ、Ⅷ、ⅩⅤ、ⅩⅥ和CRD2聚球藻在琼东海域所有调查样品中平均丰度均较低,在这6个分型中,Ⅰ型聚球藻平均丰度最高(图3)。
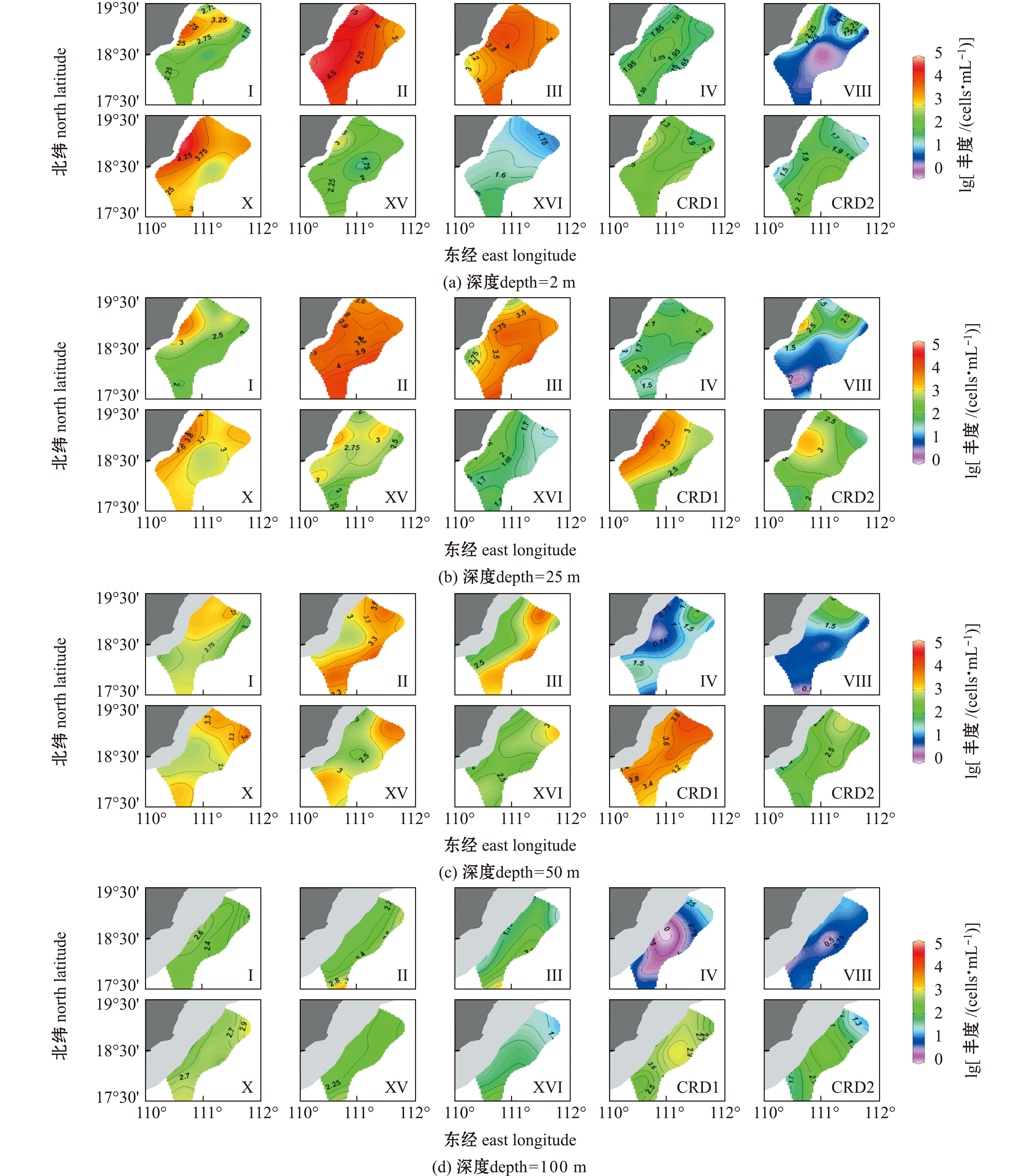
图3 通过qPCR确定的琼东上升流区聚球藻各分型丰度的水平分布
Fig.3 Horizontal distribution of Synechococcus clade abundances in the Qiongdong upwelling determined by qPCR
聚球藻Ⅱ、Ⅲ和Ⅳ型丰度的等值线在次表层水体中均呈现出向近岸明显抬升的现象(图4),与温度、DO和盐度向近岸次表层水体的抬升现象相似。另外,在这3 个分型中,Ⅳ型聚球藻平均丰度最低(44.28 cells/mL),比Ⅱ、Ⅲ型均低两个数量级。从垂向分布来看,Ⅱ、Ⅲ型聚球藻主要在表层水体中高丰度分布,其丰度在近岸表层水体中达最大值,分别为5.76×104、1.17×104 cells/mL(图4)。
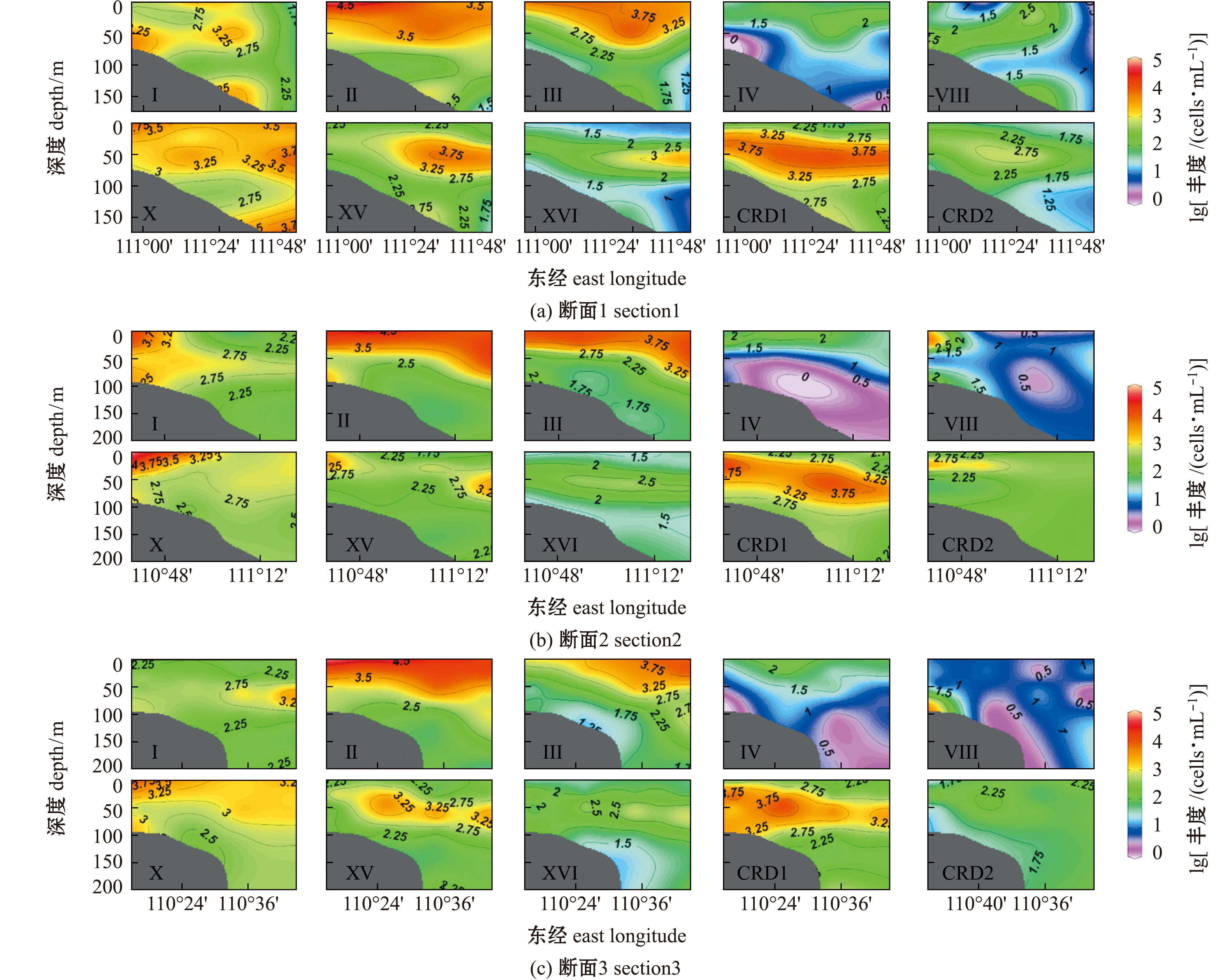
图4 通过qPCR确定的琼东上升流区聚球藻各分型丰度的垂直分布
Fig.4 Vertical distributions of Synechococcus clade abundances in the Qiongdong upwelling determined by qPCR
从空间分布特征看,Ⅰ、Ⅷ和Ⅹ型聚球藻在琼东上升流区未表现出明显的垂向分布特征,三者在万泉河河口表层水体所有样品中丰度值均较高(图3),分别为1.1×104、6.77×102、5.14×104 cells/mL。值得注意的是,Ⅰ型聚球藻除在万泉河河口表层水体中有分布外,在琼东上升流次表层水体约50 m水层也广泛分布(图4)。Ⅰ、Ⅷ和Ⅹ型聚球藻在琼东上升流区的平均丰度呈现出Ⅹ型最高(2.80×103 cells/mL)、Ⅰ型次之(9.66×102 cells/mL)、Ⅷ型最低(1.00×102 cells/mL)的现象。
从垂向分布来看,CRD1和CRD2型聚球藻主要分布在次表层(-25~50 m)水体中(图4)。CRD1的最大丰度值为1.52×104 cells/mL,而CRD2最高可达1.99×103 cells/mL,CRD2的平均丰度比CRD1低一个数量级。分型ⅩⅤ和ⅩⅥ均在约50 m深度水层分布最为丰富(图4)。
2.2.2 聚球藻分型的共现现象及其与水环境参数的相关关系 琼东上升流区各型聚球藻丰度之间的Spearman相关性分析显示:Ⅱ、Ⅲ、Ⅳ和Ⅹ型聚球藻彼此之间呈现出极显著的正相关关系(P<0.01),ⅩⅤ、ⅩⅥ、CRD1和CRD2型彼此之间也呈极显著正相关(P<0.01),这两组相关关系均首次在上升流水体中检测到;除上述相关关系外,琼东上升流海域水体中还存在其他显著正相关关系的聚球藻分型组合,如Ⅰ型分别与Ⅷ、ⅩⅤ、ⅩⅥ、CRD1型聚球藻呈现出显著或极显著正相关关系(P<0.05或P<0.01),Ⅲ型与CRD2型呈显著正相关(P<0.05),Ⅷ型与Ⅹ、ⅩⅤ、CRD1型呈显著或极显著正相关(P<0.05或P<0.01)(表2)。
表2 聚球藻各分型丰度与环境参数之间的Spearman相关性分析(相关系数R)
Tab.2 Spearman correlation analysis between Synechococcus clade abundances and environmental parameters
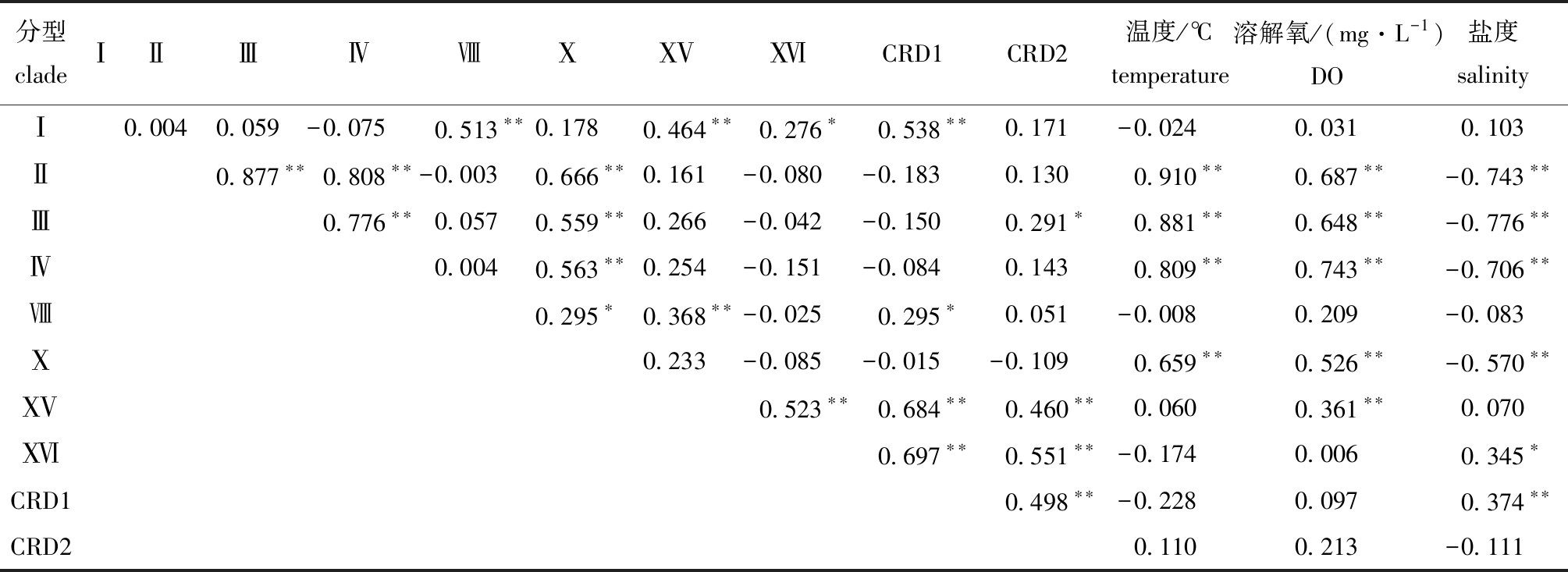
注:*表示有显著性影响(P<0.05),**表示有极显著性影响(P<0.01)。
Note:*means significant effect(P<0.05),** means very significant effect(P<0.01).
分型cladeⅠⅡⅢⅣⅧⅩ ⅩⅤ ⅩⅥ CRD1 CRD2 温度/℃temperature 溶解氧/(mg·L-1)DO盐度salinityⅠ0.0040.059-0.075 0.513∗∗0.178 0.464∗∗0.276∗0.538∗∗0.171 -0.024 0.0310.103Ⅱ0.877∗∗0.808∗∗-0.0030.666∗∗0.161-0.080-0.1830.1300.910∗∗0.687∗∗-0.743∗∗Ⅲ0.776∗∗0.0570.559∗∗0.266-0.042-0.1500.291∗0.881∗∗0.648∗∗-0.776∗∗Ⅳ0.0040.563∗∗0.254-0.151-0.0840.1430.809∗∗0.743∗∗-0.706∗∗Ⅷ0.295∗0.368∗∗-0.0250.295∗0.051-0.0080.209-0.083Ⅹ0.233-0.085-0.015-0.1090.659∗∗0.526∗∗-0.570∗∗ⅩⅤ0.523∗∗0.684∗∗0.460∗∗0.0600.361∗∗0.070ⅩⅥ0.697∗∗0.551∗∗-0.1740.0060.345∗CRD10.498∗∗-0.2280.0970.374∗∗CRD20.1100.213-0.111
聚球藻各分型丰度与环境因子的Spearman相关性分析显示:Ⅱ、Ⅲ、Ⅳ和Ⅹ型聚球藻均呈现出与环境因子相一致的相关关系,即这4个分型聚球藻丰度均与温度和DO呈极显著正相关、与盐度呈极显著负相关(P<0.01);除此之外,ⅩⅤ型聚球藻与DO呈极显著正相关(P<0.01),ⅩⅥ和CRD1型均与盐度呈显著正相关(P<0.05)(表2)。
3 讨论
3.1 琼东上升流区聚球藻各类群的整体分布及影响因素
本研究中,对琼东上升流区聚球藻的优势类群与其他海域进行了比较,发现琼东上升流区平均丰度最高的聚球藻类群是Ⅱ、Ⅲ、Ⅹ和CRD1分型。已有研究认为,分型Ⅱ、CRD1和CRD2是温暖的CRD上升流区聚球藻的优势类群[15-17,23],Ⅱ、Ⅲ和Ⅹ型偏好分布于热带和亚热带地区的温暖水体中[1,14-15]。因此,除CRD2分型丰度相对较低外,琼东上升流中聚球藻的优势分型与温暖上升流区及温暖大洋区的研究报道相似。尤其值得注意的是,不管是在温暖的上升流区[15-17,23]还是在温暖的大洋区[1,14-15],Ⅱ型聚球藻均是优势类群之一,且在本研究中,Ⅱ型聚球藻是琼东上升流水体中最丰富和最广泛分布的分型,并进一步验证了温暖水体中Ⅱ型聚球藻较其他分型的优势地位。从垂直分布来看,Ⅱ型聚球藻在琼东海域主要分布在温暖的表层水体中,其丰度随着深度的增加而显著降低。Spearman相关性分析显示,Ⅱ型聚球藻与温度呈正相关,这与Ⅱ型聚球藻在温暖的CRD上升流区[16-17]及西北太平洋[14]海域的研究结果相似。以上研究表明,Ⅱ型聚球藻是温暖海洋水体(含上升流区)中的优势分型,温度是驱动Ⅱ型聚球藻在温暖海洋水体中高丰度分布的重要因素。
聚球藻Ⅰ型和Ⅳ分型通常被认为在寒冷、营养丰富和高纬度水体中占主导地位[1,27-28],且通常彼此共存[11,29]。本研究中,检测到Ⅰ型和Ⅳ型聚球藻在琼东上升流水体中的分布,该结果与Ⅰ型和Ⅳ型聚球藻在热带CRD上升流区分布的现象相似[16],而与此二型在高纬度寒冷水体中高丰度分布的现象不同。经比较发现,尽管在CRD上升流和琼东上升流水体中有Ⅰ型和Ⅳ型聚球藻分布,但它们在两个热带上升流区的丰度均相对较低,这证实了Gibbons等[30]的“种子库(seed bank)”模型理论,即聚球藻分型在其最适应的生境中达到最高丰度,但在次优生境中可能以极低的丰度持续存在。这个理论模型现在又可以被Ⅰ型和Ⅳ型聚球藻各自具有不同的亚分支所解释,即Ⅰ型聚球藻具有7个亚分支,部分亚分支分布于高纬度表层海水,而另外部分亚分支分布于热带或亚热带次表层水体中,Ⅰ型聚球藻不同的亚分支在次表层海水中又具有不同的生态位分化[10,15]。因此,Ⅰ型聚球藻通过其不同温度偏好的子分支组成扩大其在海洋环境中的分布[10,18]。Ahlgren等[31]发现,Ⅳ型聚球藻也具有不同的亚分支Ⅳa和Ⅳb,二者在美国Los Angeles近岸的亚热带表层水体中呈现出不同的季节性变化规律。综上,尽管Ⅰ型和Ⅳ型聚球藻在琼东上升流区以低丰度分布,但是此现象区别于传统观念中Ⅰ型和Ⅳ型聚球藻主要在高纬度寒冷海水中分布的认识,其原因可能是由于二者又分别具有不同的亚分支以扩大其在不同海洋环境中的分布。因此,需要更多的研究调查Ⅰ型和Ⅳ型聚球藻亚分支在全球海域的时空变化规律及其生态学机制。
3.2 琼东上升流区聚球藻各类群的生态位分化及影响机制
3.2.1 聚球藻Ⅱ、Ⅲ、Ⅳ和Ⅹ分型在琼东上升流表层水体中高丰度分布 本研究表明,聚球藻Ⅱ、Ⅲ、Ⅳ和Ⅹ分型在琼东上升流海域彼此呈正相关关系,目前尚未见在全球其他海域(含上升流区)有关这4个聚球藻分型相关关系的报道,只有Sohm等[11]报道了Ⅱ、Ⅲ和Ⅹ型聚球藻在热带和亚热带温暖开阔大洋中存在共存关系,表明Ⅱ、Ⅲ和Ⅹ型聚球藻在热带和亚热带海域的共存现象不仅存在于开阔大洋,而且也存在于近岸上升流水体中。本研究中相关性分析表明,琼东上升流水体中Ⅱ、Ⅲ、Ⅳ和Ⅹ型聚球藻的丰度与温度和DO呈正相关,而与盐度呈负相关,说明温度、DO和盐度是影响Ⅱ、Ⅲ、Ⅳ和Ⅹ型聚球藻在琼东海域分布的重要因素。这与热带和亚热带温暖开阔大洋中Ⅱ型聚球藻与温度呈正相关的结果相吻合[11]。通过比较垂向分布特征发现,虽然琼东上升流区Ⅱ、Ⅲ、Ⅳ和Ⅹ型聚球藻与温度、DO和盐度呈现出相同的相关关系,但只有Ⅱ、Ⅲ、Ⅳ型聚球藻与温度、DO和盐度的等值线呈现出相似的垂向分布规律,即明显地向近岸次表层水体抬升,而Ⅹ型聚球藻并未呈现出明显的抬升现象。另外,虽然Ⅱ、Ⅲ、Ⅳ和Ⅹ型聚球藻均与盐度呈负相关,但是Ⅱ、Ⅲ和Ⅳ型聚球藻偏好分布于琼东上升流表层低盐度海水,而Ⅹ型主要分布在万泉河河口表层低盐度水体中。综上所述,Ⅱ、Ⅲ和Ⅳ型聚球藻受到了琼东上升流动力过程的影响,而Ⅹ型聚球藻则主要受万泉河径流输入的影响。
3.2.2 聚球藻CRD1、CRD2、ⅩⅤ和ⅩⅥ分型在琼东上升流次表层水体中高丰度分布 本研究表明,聚球藻CRD1、CRD2、ⅩⅤ和ⅩⅥ分型主要在琼东上升流次表层水体中高丰度分布且彼此呈显著正相关,目前尚未在其他上升流区次表层水体中见到这4个分型共存的报道。相关性分析显示,琼东上升流区ⅩⅥ和CRD1共存且均与盐度呈正相关,而温度和DO并不是影响CRD1、CRD2、ⅩⅤ和ⅩⅥ型聚球藻彼此共存的因素。由此可见,琼东上升流动力过程并未直接影响CRD1、CRD2、ⅩⅤ和ⅩⅥ 型聚球藻在次表层水体中的分布及共存。而其他海域关于CRD1、CRD2、ⅩⅤ和ⅩⅥ型聚球藻之间共存关系的研究主要集中在CRD1/CRD2[11,16-17,23]或ⅩⅤ/ⅩⅥ[10-11,16-17]两个分型之间的组合。
已有研究认为,CRD1和/或CRD2型聚球藻主要分布在低铁(Fe2+)上升流区[11,16-17,23]及高营养盐低叶绿素海域[15,32]。本研究中发现,CRD1和CRD2型聚球藻在次表层(-25~50 m)水体中呈现较高丰度分布,这也正是琼东上升流强中心所在的位置[26]。虽然本研究中未检测铁离子(Fe2+)浓度,但Jing等[25]认为,琼东上升流动力过程将陆架深水区营养盐丰富的海水向上涌升,形成了表层和次表层水体高营养盐的特征。同时,本调查中检测的多个样品的叶绿素值均低于检测限(故未在结果部分列出),表明琼东上升流区存在高营养盐低叶绿素的状态,与低铁(Fe2+)的上升流和开阔大洋的环境相似。综上所述,CRD1和CRD2型聚球藻在全球海域倾向分布于低铁、高营养盐低叶绿素的水体中。
本研究中,从垂向分布来看,ⅩⅤ和ⅩⅥ型聚球藻在琼东上升流区丰度最高的水层是约50 m深度水体,与ⅩⅤ和ⅩⅥ型在CRD上升流区[16-17]和外海[10-11]次表层水体中分布的研究结果相似。结合琼东上升流区温度、盐度及DO的断面分布(图2)来看,ⅩⅤ和ⅩⅥ型在次表层水体的分布(图4)与上升流产生的温度、盐度及DO锋面相吻合,而Sohm等[11]和Xia等[10]研究认为,ⅩⅤ和 ⅩⅥ型主要存在于高营养盐过渡水体环境。由此可见,琼东上升流涌升过程导致了次表层水体中温度、盐度及DO锋面的产生,形成了过渡水体及高营养盐在此处聚集,最终导致ⅩⅤ和ⅩⅥ型在琼东海域次表层水体中的高丰度分布。
3.2.3 聚球藻Ⅰ、Ⅷ分型在河口表层水体中高丰度分布 聚球藻Ⅰ和Ⅷ分型彼此间呈正相关关系,二者丰度均在万泉河河口表层水体中达到峰值,未出现类似于温度、DO和盐度等值线向近岸次表层水体的抬升。从相关性分析来看,Ⅰ、Ⅷ型聚球藻与温度、盐度及DO均无相关性,说明琼东上升流动力过程不是影响Ⅰ型和Ⅷ型聚球藻分布的主要因素,二者在万泉河河口表层水体的分布可能与河口局部水体环境有关。Harrison等[19]研究认为,河口表层水体是淡水和海水的混合体,具有低盐度和高营养盐的特征,能够吸引高营养需求的广盐菌株[10]。另有研究证实了Ⅷ型聚球藻对环境具有较强的调节适应能力以适应多变的海洋环境,其广泛分布于广盐或河口水体中[2,12]。Ahlgren等[16]对CRD上升流区聚球藻类群的调查结果显示,该海域未检测到聚球藻Ⅷ分型。本研究中比较发现,CRD上升流属于大洋上升流而不是近岸上升流,未受到陆地径流输入的影响,进一步验证了Ⅷ型聚球藻在琼东海域的分布主要是受到万泉河径流输入的影响,而与上升流动力过程无关。综上所述,上升流动力过程不是影响Ⅰ型和Ⅷ型聚球藻在琼东海域整体分布的主要因素,其在万泉河口表层水体中的高丰度分布可能与径流输入有关。
4 结论
1)从整体分布来看,聚球藻10个主要分型广泛分布于琼东上升流水体中。Ⅱ、Ⅲ、Ⅹ和CRD1型聚球藻在琼东上升流海域占主导地位,其中Ⅱ型聚球藻最为丰富。
2)Ⅱ、Ⅲ、Ⅳ和Ⅹ型聚球藻在琼东海域表层水体中高丰度分布且具有共存关系,其中,Ⅱ、Ⅲ和Ⅳ型聚球藻丰度的等值线呈现出向近岸的抬升现象,三者均与温度和DO呈正相关,与盐度呈负相关,说明这3个分型受到了上升流动力过程的影响。
3)CRD1、CRD2、ⅩⅤ和ⅩⅥ型聚球藻在琼东上升流次表层水体中共存且彼此呈显著正相关,其中,CRD/CRD2型聚球藻的分布主要与高营养盐低叶绿素水体有关,而ⅩⅤ/ⅩⅥ型聚球藻主要分布于过渡水体中,主要与琼东上升流涌升产生的温度、盐度及DO锋面有关。
4)Ⅰ、Ⅷ和Ⅹ型聚球藻主要在万泉河河口表层水体中高丰度分布,三者均未出现等值线向近岸的抬升现象,三者主要受到了万泉河径流输入的影响,而上升流动力过程并不是影响其在琼东海域分布的主要因素。
[1] AHLGREN N A,ROCAP G.Diversity and distribution of marine Synechococcus:multiple gene phylogenies for consensus classification and development of qPCR assays for sensitive measurement of clades in the ocean[J].Frontiers in Microbiology,2012,3:213.
[2] HUANG S J,WILHELM S W,HARVEY H R,et al.Novel lineages of Prochlorococcus and Synechococcus in the global oceans[J].The ISME Journal,2012,6(2):285-297.
[3] FARRANT G K,DOR H,CORNEJO-CASTILLO F M,et al.Delineating ecologically significant taxonomic units from global patterns of marine picocyanobacteria[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(24):E3365-E3374.
H,CORNEJO-CASTILLO F M,et al.Delineating ecologically significant taxonomic units from global patterns of marine picocyanobacteria[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(24):E3365-E3374.
[4] VISINTINI N,MARTINY A C,FLOMBAUM P.Prochlorococcus,Synechococcus,and picoeukaryotic phytoplankton abundances in the global ocean[J].Limnology and Oceanography Letters,2021,6(4):207-215.
[5] JARDILLIER L,ZUBKOV M V,PEARMAN J,et al.Significant CO2 fixation by small prymnesiophytes in the subtropical and tropical northeast Atlantic Ocean[J].The ISME Journal,2010,4(9):1180-1192.
[6] TOLEDO G,PALENIK B.Synechococcus diversity in the California current as seen by RNA polymerase (rpoC1) gene sequences of isolated strains[J].Applied and Environmental Microbiology,1997,63(11):4298-4303.
[7] ROCAP G,DISTEL D L,WATERBURY J B,et al.Resolution of Prochlorococcus and Synechococcus ecotypes by using 16S-23S ribosomal DNA internal transcribed spacer sequences[J].Applied and Environmental Microbiology,2002,68(3):1180-1191.
[8] PENNO S,LINDELL D,POST A F.Diversity of Synechococcus and Prochlorococcus populations determined from DNA sequences of the N-regulatory gene ntcA[J].Environmental Microbiology,2006,8(7):1200-1211.
[9] MAZARD S,OSTROWSKI M,PARTENSKY F,et al.Multi-locus sequence analysis,taxonomic resolution and biogeography of marine Synechococcus[J].Environmental Microbiology,2012,14(2):372-386.
[10] XIA X M,PARTENSKY F,GARCZAREK L,et al.Phylogeography and pigment type diversity of Synechococcus cyanobacteria in surface waters of the northwestern Pacific Ocean[J].Environmental Microbiology,2017,19(1):142-158.
[11] SOHM J A,AHLGREN N A,THOMSON Z J,et al.Co-occurring Synechococcus ecotypes occupy four major oceanic regimes defined by temperature,macronutrients and iron[J].The ISME Journal,2016,10(2):333-345.
[12] DUFRESNE A,OSTROWSKI M,SCANLAN D J,et al.Unraveling the genomic mosaic of a ubiquitous genus of marine cyanobacteria[J].Genome Biology,2008,9(5):R90.
[13] ZWIRGLMAIER K,HEYWOOD J L,CHAMBERLAIN K,et al.Basin-scale distribution patterns of picocyanobacterial lineages in the Atlantic Ocean[J].Environmental Microbiology,2007,9(5):1278-1290.
[14] CHOI D H,SELPH K E,NOH J H.Niche partitioning of picocyanobacterial lineages in the oligotrophic northwestern Pacific Ocean[J].Algae,2015,30(3):223-232.
[15] XIA X M,CHEUNG S Y,ENDO H S,et al.Latitudinal and vertical variation of Synechococcus assemblage composition along 170° W transect from the south Pacific to the Arctic Ocean[J].Microbial Ecology,2019,77(2):333-342.
[16] AHLGREN N A,NOBLE A,PATTON A P,et al.The unique trace metal and mixed layer conditions of the Costa Rica upwelling dome support a distinct and dense community of Synechococcus[J].Limnology and Oceanography,2014,59(6):2166-2184.
[17] GUTI RREZ-RODR
RREZ-RODR GUEZ A,SLACK G,DANIELS E F,et al.Fine spatial structure of genetically distinct picocyanobacterial populations across environmental gradients in the Costa Rica Dome[J].Limnology and Oceanography,2014,59(3):705-723.
GUEZ A,SLACK G,DANIELS E F,et al.Fine spatial structure of genetically distinct picocyanobacterial populations across environmental gradients in the Costa Rica Dome[J].Limnology and Oceanography,2014,59(3):705-723.
[18] XIA X M,VIDYARATHNA N K,PALENIK B,et al.Comparison of the seasonal variations of Synechococcus assemblage structures in estuarine waters and coastal waters of Hong Kong[J].Applied and Environmental Microbiology,2015,81(21):7644-7655.
[19] HARRISON P J,YIN K D,LEE J H W,et al.Physical-biological coupling in the Pearl River Estuary[J].Continental Shelf Research,2008,28(12):1405-1415.
[20] XIA X M,GUO W,TAN S J,et al.Synechococcus assemblages across the salinity gradient in a salt wedge estuary[J].Frontiers in Microbiology,2017,8:1254.
[21] NAGARKAR M,WANG M,VALENCIA B,et al.Spatial and temporal variations in Synechococcus microdiversity in the Southern California coastal ecosystem[J].Environmental Microbiology,2021,23(1):252-266.
[22] ZHONG Y P,HU J,LAWS E A,et al.Plankton community responses to pulsed upwelling events in the southern Taiwan Strait[J].ICES Journal of Marine Science,2019,76(7):2374-2388.
[23] SAITO M A,ROCAP G,MOFFETT J W.Production of cobalt binding ligands in a Synechococcus feature at the Costa Rica upwelling dome[J].Limnology and Oceanography,2005,50(1):279-290.
[24] SU J,POHLMANN T.Wind and topography influence on an upwelling system at the eastern Hainan coast[J].Journal of Geophysical Research,2009,114:C06017.
[25] JING Z Y,QI Y Q,HUA Z L,et al.Numerical study on the summer upwelling system in the northern continental shelf of the South China Sea[J].Continental Shelf Research,2009,29(2):467-478.
[26] LI K Z,YIN J Q,HUANG L M,et al.Distribution and abundance of thaliaceans in the northwest continental shelf of South China Sea,with response to environmental factors driven by monsoon[J].Continental Shelf Research,2011,31(9):979-989.
[27] ZWIRGLMAIER K,JARDILLIER L,OSTROWSKIM,et al.Global phylogeography of marine Synechococcus and Prochlorococcus reveals a distinct partitioning of lineages among oceanic biomes[J].Environmental Microbiology,2008,10(1):147-161.
[28] TAI V,PALENIK B.Temporal variation of Synechococcus clades at a coastal Pacific Ocean monitoring site[J].The ISME Journal,2009,3(8):903-915.
[29] MACKEY K R M,HUNTER-CEVERA K,BRITTEN G L,et al.Seasonal succession and spatial patterns of Synechococcus microdiversity in a salt marsh estuary revealed through 16S rRNA gene oligotyping[J].Frontiers in Microbiology,2017,8:1496.
[30] GIBBONS S M,CAPORASO J G,PIRRUNGM,et al.Evidence for a persistent microbial seed bank throughout the global ocean[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(12):4651-4655.
[31] AHLGREN N A,PERELMAN J N,YEH Y C,et al.Multi-year dynamics of fine-scale marine cyanobacterial populations are more strongly explained by phage interactions than abiotic,bottom-up factors[J].Environmental Microbiology,2019,21(8):2948-2963.
[32] COALE K H,JOHNSON K S,FITZWATER S E,et al.A massive phytoplankton bloom induced by an ecosystem-scale iron fertilization experiment in the equatorial Pacific Ocean[J].Nature,1996,383:495-501.