浮游植物是水生态系统中的初级生产者,其物种变化、群落演替及其与水环境因子间的关系可以直观地反映水生态系统的动态变化[1]。相对于其他方法,Reynolds等[2]和Padisák等[3]提出并完善了浮游藻类功能群理论,共划分和描述了39 组浮游植物功能群。这种方法能够更加准确地描述浮游植物的生境特征,表现浮游植物群落同水环境因子的相关性,预测特定生境下浮游植物的群落分布状况。
河流生态系统是地球上最为复杂的生态系统之一,是陆生生态系统和水生生态系统之间物质循环、能量流动和信息传递的重要媒介,人类活动通过直接或间接的方式影响着河流生态系统的健康[4]。近年来,基于浮游植物功能群理论对中国热带[5]、亚热带[6-12]、温带[13-15]和北方寒区河流[16-19]不同类型的水体研究逐渐增多。作为北方寒区呼伦湖主要入湖河流之一的海拉尔河,与其相关的研究主要集中在流域水质评价[20]和水文学[21]等方面,而利用生物指标[22]进行的相关研究较少。李星醇等[23]首次将浮游植物功能群理论应用于海拉尔河,但其缺少在时间尺度上完整的浮游植物功能群变化研究。海拉尔河流域是呼伦贝尔市人口及经济产业集中带,所面临的人口、经济与环境发展问题更加复杂且严峻。因此,作为额尔古纳河重要上源及呼伦湖主要入湖河流之一的海拉尔河,其水生态环境的优良程度对其下游及呼伦湖乃至整个呼伦贝尔市水生态安全具有重要意义。本研究中,对海拉尔河水域浮游植物群落进行了功能群划分,并分析了功能群与水环境因子间的关系,以期为海拉尔河未来的浮游植物功能群研究提供一定的数据参考,同时尝试从浮游植物功能群角度分析海拉尔河的主要污染原因,进而维护整个呼伦湖流域的生态安全。
1 材料与方法
1.1 调查区域及采样站位的设置
海拉尔河流域(117° 48′30″ E~122° 28′ 05″ E,47°32′30″N~50°16′02″N)位于内蒙古自治区呼伦贝尔市西南部,发源于大兴安岭雷勒奇克山西麓,自东向西流向,至扎赛诺尔区北部阿巴该图山附近右转向北,是额尔古纳河上源之一,流域面积为5.48万km2。海拉尔河干流全长1 430 km,由东向西依次流经牙克石市、海拉尔区、陈巴尔虎旗和新巴尔虎左旗,汇入额尔古纳河;其主要支流有免渡河和伊敏河等[20]。流域属中温带半湿润半干旱大陆性季风气候,多年年均气温和降水量分别为5.34 ℃和348 mm,冬季漫长,冬雪期从每年10月末—11月上中旬开始,次年4—5月初结束[20]。2007年实施的呼伦湖水资源配置工程(引河济湖工程),引入海拉尔河河水,使呼伦湖恢复了与海拉尔河的水文联系。
根据海拉尔河的水体和水域范围的实际情况,以上、中、下游为依据,共设置了14个采样点。上游点位分别为S1(海拉尔河上游)、S2(牙克石),并包括上游支流免渡河点位S3(免渡河上游)、S4(免渡河下游),中游点位为S5(海拉尔河中游)、S6(海拉尔桥)、S7(北山口)和S8(呼和诺尔),并包括中游支流伊敏河点位S9(伊敏河上游)、S10(伊敏河中游)和S11(伊敏河下游),下游点位为S12(东乌珠尔)、S13(嵯岗)和S14(海拉尔河引河)。具体采样点设置见图1。

图1 海拉尔河流域采样点分布
Fig.1 Sampling sites in Hailaer River
1.2 方法
1.2.1 样品采集与鉴定 浮游植物采集使用5 L采水器采集上、中、下层混合水样1 L,加入15 mL鲁哥氏液进行固定。带回实验室的水样静置沉淀72 h后,用虹吸管吸去上清液至沉淀物体积约50 mL,放入标本瓶中继续静置沉淀48 h后,定容至30 mL。在光学显微镜下进行物种鉴定、细胞计数等分析操作。浮游植物种类鉴定参考《中国淡水藻类:系统、分类及生态》[24]等相关文献。
依照文献[25],计算获得各采样点浮游植物的生物量。
1.2.2 水环境因子的测定 水环境因子的测定采用现场测定与实验室测定相结合的方式。现场使用表面水温计对水温(WT)进行测定,使用YSI-6600多功能水质分析仪对pH、溶解氧(DO)、电导率(Cond)进行测定。各采样点采集2 L水样,低温条件下48 h内送至实验室,按照《水和废水监测分析方法》中的方法测定总氮(TN)、总磷(TP)、化学需氧量(CODCr)和高锰酸盐指数(CODMn)。
1.2.3 除趋势对应分析和冗余分析 对浮游植物重要功能群生物量数据和水环境因子数据(除pH)进行量纲化处理[lg(x+1)]后,采用Canoco 4.5软件对生物量和水环境因子数据进行除趋势对应分析(detrended correspondence analysis,DCA)。处理后4个排序轴梯度长度最大为1.319,小于3.0,再通过蒙特卡洛置换检验(Monte carlo cermutation test,MCPT),采用冗余分析(redundancy analysis,RDA)获得功能群与环境因子相关性的数据[26]。
1.2.4 浮游植物功能群划分 浮游植物功能群的分类方法参照Reynolds[2]和Padis k等[3]提出的方法,将相对生物量大于10%的功能群定义为重要功能群。
k等[3]提出的方法,将相对生物量大于10%的功能群定义为重要功能群。
1.3 数据处理
浮游植物数据的统计和分析采用Excel 2010软件进行初步整理。采用SPSS 19.0软件进行单因素方差分析,采用Waller-Duncan法进行多重比较,分析水环境因子和生物量的时空差异显著性,显著性水平设为0.05;使用重要浮游植物功能群,通过Pearson相关分析研究浮游植物重要功能群与水环境因子间的相关性。
2 结果与分析
2.1 海拉尔河水环境因子的分布特征
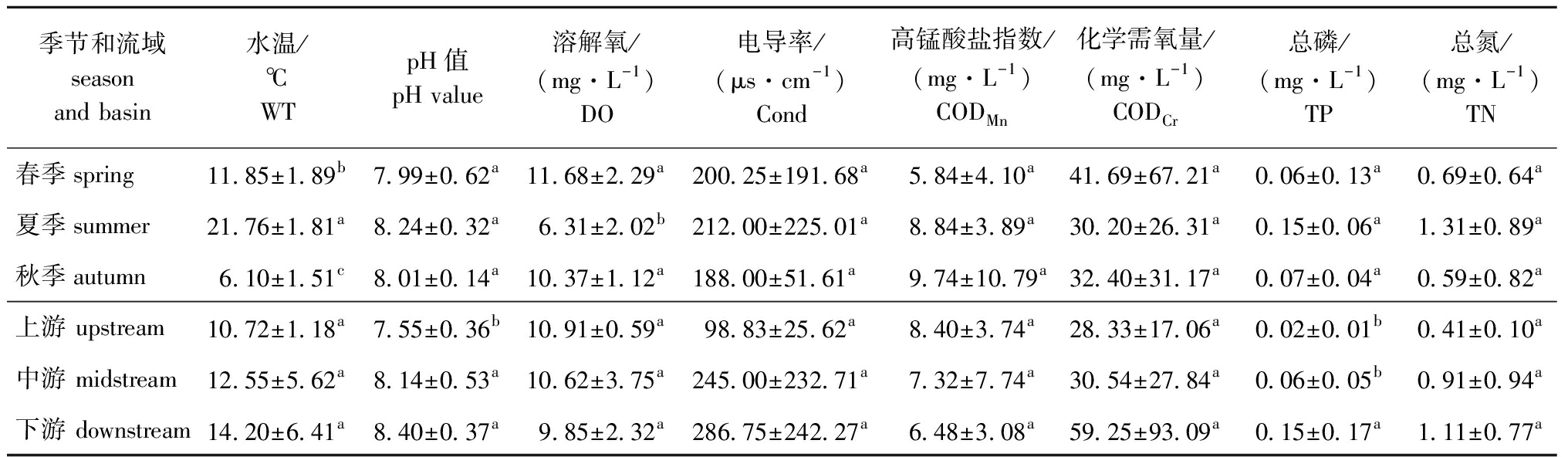
海拉尔河水环境因子的时空变化见表1。从季节分布看:海拉尔河春、夏、秋3个季节WT及DO有显著性差异(P<0.05),其他水环境因子均无显著性差异(P>0.05);春季DO、CODCr平均值明显高于其他季节,且CODCr值达到了国家Ⅴ类水标准(40 mg/L);夏季WT、TP、TN平均值明显高于其他季节;秋季CODMn平均值明显高于其他季节,且超过国家Ⅲ类水标准(6 mg/L),接近国家Ⅳ类水标准(10 mg/L)(表1)。
表1 海拉尔河环境因子的时空变化
Tab.1 Temporal and spatial variation in environmental factors in the Hailaer River
季节和流域season and basin水温/℃WTpH值pH value溶解氧/(mg·L-1)DO电导率/(μs·cm-1)Cond高锰酸盐指数/(mg·L-1)CODMn化学需氧量/(mg·L-1)CODCr总磷/(mg·L-1) TP总氮/(mg·L-1)TN春季spring11.85±1.89b7.99±0.62a11.68±2.29a200.25±191.68a5.84±4.10a41.69±67.21a0.06±0.13a0.69±0.64a夏季summer21.76±1.81a8.24±0.32a6.31±2.02b212.00±225.01a8.84±3.89a30.20±26.31a0.15±0.06a1.31±0.89a秋季autumn6.10±1.51c8.01±0.14a10.37±1.12a188.00±51.61a9.74±10.79a32.40±31.17a0.07±0.04a0.59±0.82a上游 upstream10.72±1.18a7.55±0.36b10.91±0.59a98.83±25.62a8.40±3.74a28.33±17.06a0.02±0.01b0.41±0.10a中游 midstream12.55±5.62a8.14±0.53a10.62±3.75a245.00±232.71a7.32±7.74a30.54±27.84a0.06±0.05b0.91±0.94a下游 downstream14.20±6.41a8.40±0.37a9.85±2.32a286.75±242.27a6.48±3.08a59.25±93.09a0.15±0.17a1.11±0.77a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
从空间分布看:海拉尔河上、中、下游水环境因子pH及TP有显著性差异(P<0.05),其他水环境因子均无显著性差异(P>0.05);WT、pH、Cond、CODCr、TP、TN均呈现下游>中游>上游的趋势,下游水域氮磷含量明显增加;DO、CODMn均呈现上游>中游>下游的趋势,海拉尔河流域CODMn平均值较高,超过国家Ⅲ类水标准(6 mg/L),CODCr平均值超过国家Ⅲ类水标准(20 mg/L),下游CODCr达到国家Ⅴ类水标准(40 mg/L)。
2.2 海拉尔河浮游植物功能群分布
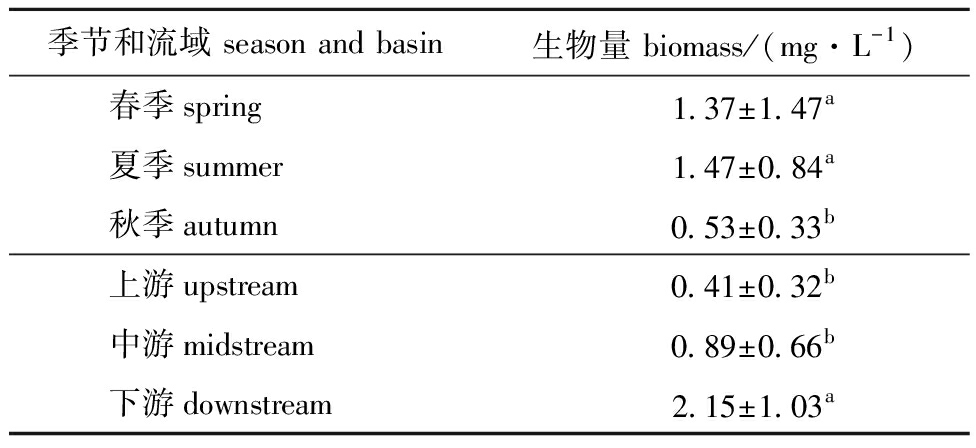
海拉尔河浮游植物生物量时空分布结果如表2所示,时间尺度上生物量呈现夏季>春季>秋季的趋势,且春夏两季生物量显著高于秋季;空间尺度上,平均生物量呈现下游>中游>上游的趋势(P<0.05),且下游平均生物量显著高于上游和中游(P<0.05)。
表2 海拉尔河浮游植物平均生物量的时空变化
Tab.2 Temporal and spatial variation of phytoplankton biomass in the Hailaer River
季节和流域 season and basin生物量 biomass/(mg·L-1)春季spring1.37±1.47a夏季summer1.47±0.84a秋季autumn0.53±0.33b上游upstream0.41±0.32b中游midstream0.89±0.66b下游downstream2.15±1.03a
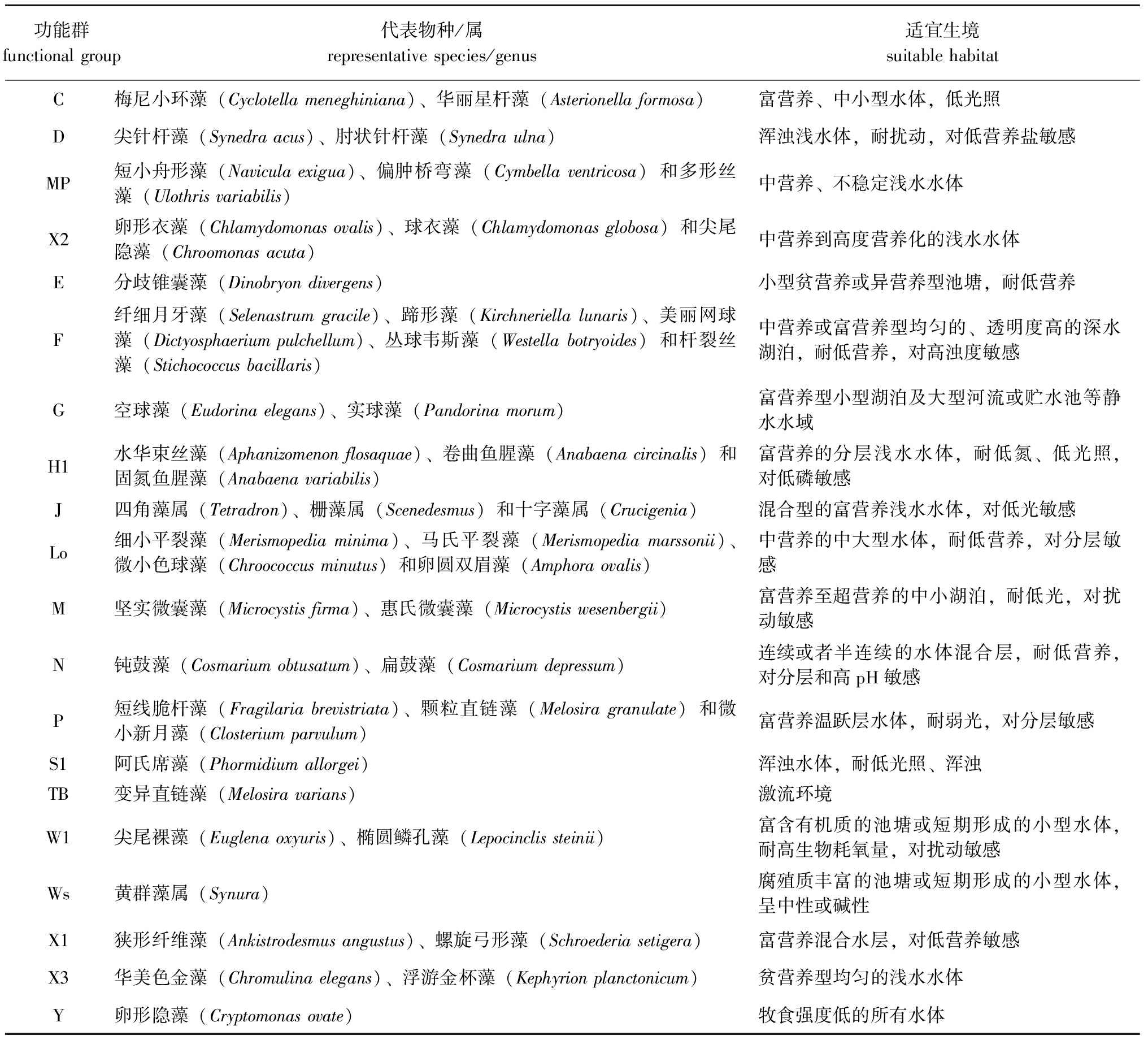
海拉尔河水域春、夏、秋3个季节共鉴定出6门80种浮游植物,可划分为20个功能群,功能群组成见表3。对整体功能群生物量进行筛选,将每个季节采样点中相对生物量>10%的功能群定义为重要功能群,则海拉尔河春、夏、秋3个季节共筛选出重要功能群4个,分别为功能群C、D、MP、X2,重要浮游植物功能群春、夏、秋3个季节相对生物量时空分布见图2。其中,海拉尔河重要功能群季节组成变化不明显,时间变化呈现C+X2+D(春季)→X2+MP+D+C(夏季)→D+C+MP(秋季)。夏季浮游植物生物量高于春季,主要是由于春季到夏季功能群C生物量极显著减少(7.69 mg/L→2.42 mg/L)(P<0.01),功能群X2生物量显著增加(4.20 mg/L→7.48 mg/L),而其余功能群生物量变化不明显;秋季浮游植物生物量最少,主要是由于温度的显著降低导致整体生物量显著减少。
表3 海拉尔河浮游植物功能群组成
Tab.3 Composition of phytoplankton functional groups in the Hailaer River
功能群functional group代表物种/属representative species/genus适宜生境suitable habitatC梅尼小环藻(Cyclotella meneghiniana)、华丽星杆藻(Asterionella formosa)富营养、中小型水体,低光照D尖针杆藻(Synedra acus)、肘状针杆藻(Synedra ulna)浑浊浅水体,耐扰动,对低营养盐敏感MP短小舟形藻(Navicula exigua)、偏肿桥弯藻(Cymbella ventricosa)和多形丝藻(Ulothris variabilis)中营养、不稳定浅水水体X2卵形衣藻(Chlamydomonas ovalis)、球衣藻(Chlamydomonas globosa)和尖尾隐藻(Chroomonas acuta)中营养到高度营养化的浅水水体E分歧锥囊藻(Dinobryon divergens)小型贫营养或异营养型池塘,耐低营养F纤细月牙藻(Selenastrum gracile)、蹄形藻(Kirchneriella lunaris)、美丽网球藻(Dictyosphaerium pulchellum)、丛球韦斯藻(Westella botryoides)和杆裂丝藻(Stichococcus bacillaris)中营养或富营养型均匀的、透明度高的深水湖泊,耐低营养,对高浊度敏感G空球藻(Eudorina elegans)、实球藻(Pandorina morum)富营养型小型湖泊及大型河流或贮水池等静水水域H1水华束丝藻(Aphanizomenon flosaquae)、卷曲鱼腥藻(Anabaena circinalis)和固氮鱼腥藻(Anabaena variabilis)富营养的分层浅水水体,耐低氮、低光照,对低磷敏感J四角藻属(Tetradron)、栅藻属(Scenedesmus)和十字藻属(Crucigenia)混合型的富营养浅水水体,对低光敏感Lo细小平裂藻(Merismopedia minima)、马氏平裂藻(Merismopedia marssonii)、微小色球藻(Chroococcus minutus)和卵圆双眉藻(Amphora ovalis)中营养的中大型水体,耐低营养,对分层敏感M坚实微囊藻(Microcystis firma)、惠氏微囊藻(Microcystis wesenbergii)富营养至超营养的中小湖泊,耐低光,对扰动敏感N钝鼓藻(Cosmarium obtusatum)、扁鼓藻(Cosmarium depressum)连续或者半连续的水体混合层,耐低营养,对分层和高pH敏感P短线脆杆藻(Fragilaria brevistriata)、颗粒直链藻(Melosira granulate)和微小新月藻(Closterium parvulum)富营养温跃层水体,耐弱光,对分层敏感S1阿氏席藻(Phormidium allorgei)浑浊水体,耐低光照、浑浊TB变异直链藻(Melosira varians)激流环境W1尖尾裸藻(Euglena oxyuris)、椭圆鳞孔藻(Lepocinclis steinii)富含有机质的池塘或短期形成的小型水体,耐高生物耗氧量,对扰动敏感Ws黄群藻属(Synura)腐殖质丰富的池塘或短期形成的小型水体,呈中性或碱性X1狭形纤维藻(Ankistrodesmus angustus)、螺旋弓形藻(Schroederia setigera)富营养混合水层,对低营养敏感X3华美色金藻(Chromulina elegans)、浮游金杯藻(Kephyrion planctonicum)贫营养型均匀的浅水水体Y卵形隐藻(Cryptomonas ovate)牧食强度低的所有水体
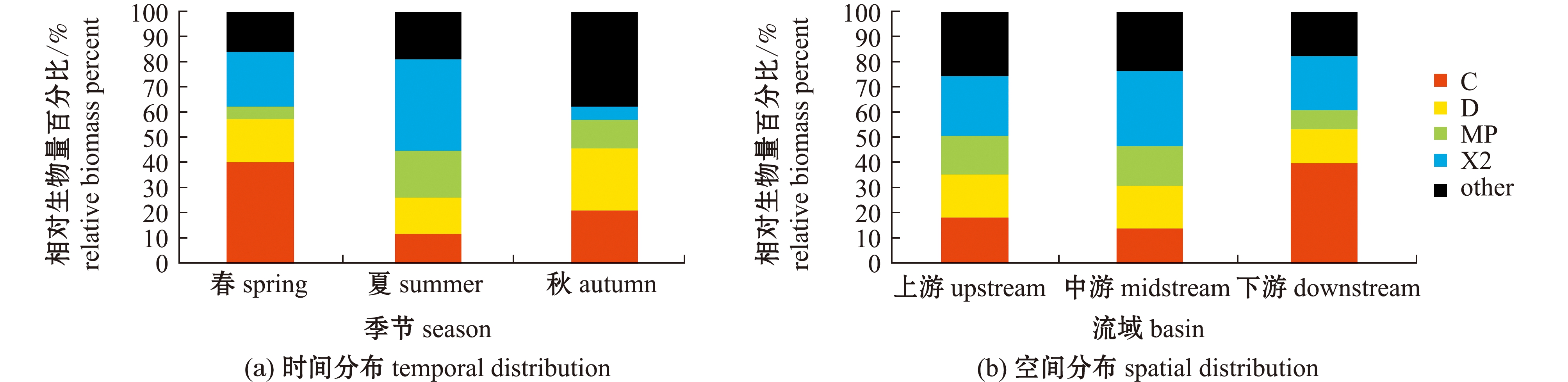
图2 海拉尔河浮游植物功能群相对生物量的时空分布
Fig.2 Temporal and spatial distribution of relative biomass of phytoplankton functional groups in the Hailaer River
2.3 海拉尔河重要浮游植物功能群与水环境因子的相关关系
2.3.1 Pearson相关性分析 从表4可见,重要功能群主要与WT、pH、Cond、CODCr、TP和TN相关;功能群C与pH呈显著正相关(P<0.05);功能群D与WT和pH呈极显著正相关(P<0.01);功能群MP与WT呈极显著正相关(P<0.01);功能群X2与WT和TN呈显著正相关(P<0.05),与pH、Cond、CODCr和TP呈极显著正相关(P<0.01);其他功能群则与CODCr呈显著正相关(P<0.05),与pH和TP呈极显著正相关(P<0.01)。
表4 浮游植物重要功能群生物量与水环境因子的Pearson相关性分析
Tab.4 Pearson correlation between the biomass of the main phytoplankton functional groups and environment factors
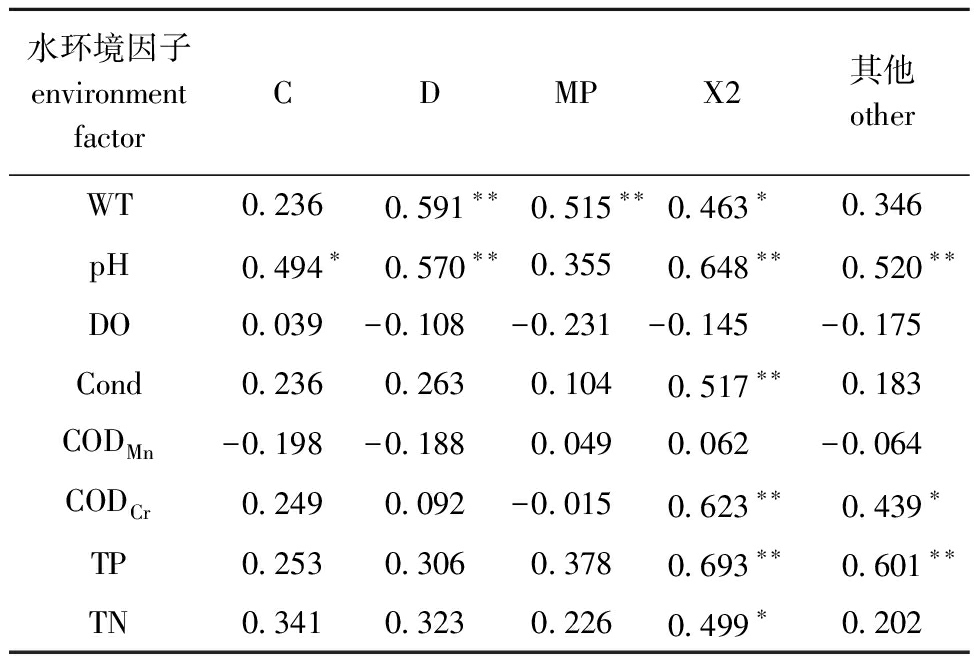
水环境因子environmentfactorCDMPX2其他otherWT0.236 0.591∗∗ 0.515∗∗0.463∗0.346pH0.494∗0.570∗∗0.3550.648∗∗0.520∗∗DO0.039-0.108-0.231-0.145-0.175Cond0.2360.2630.1040.517∗∗0.183CODMn-0.198-0.1880.0490.062-0.064CODCr0.2490.092-0.0150.623∗∗0.439∗TP0.2530.3060.3780.693∗∗0.601∗∗TN0.3410.3230.2260.499∗0.202
注:*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。
Note:* means significant correlations(P<0.05),**means very significant correlations(P<0.01).
2.3.2 RDA分析 从表5可见,特征值轴1大于轴2,前两轴物种数据累计变化率为66.4%,相关性累计变化率达到95.8%,表明浮游植物重要功能群与环境变量之间存在显著相关性。从图3可见,轴1最主要的正相关因子为pH(相关性系数为0.768 4),其余主要的相关性因子分别为TP(相关性系数为0.581 0)、TN(相关性系数为0.576 8)、Cond(相关性系数为0.564 3)及WT(相关性系数为0.501 2);轴2最主要的正相关因子为CODMn(相关性系数为0.492 4),最主要的负相关因子为DO(相关性系数为-0.467 9)。
表5 排序轴特征值、浮游植物与水环境因子的相关性
Tab.5 Eigenvalues and correlation of phytoplankton and water environment factors
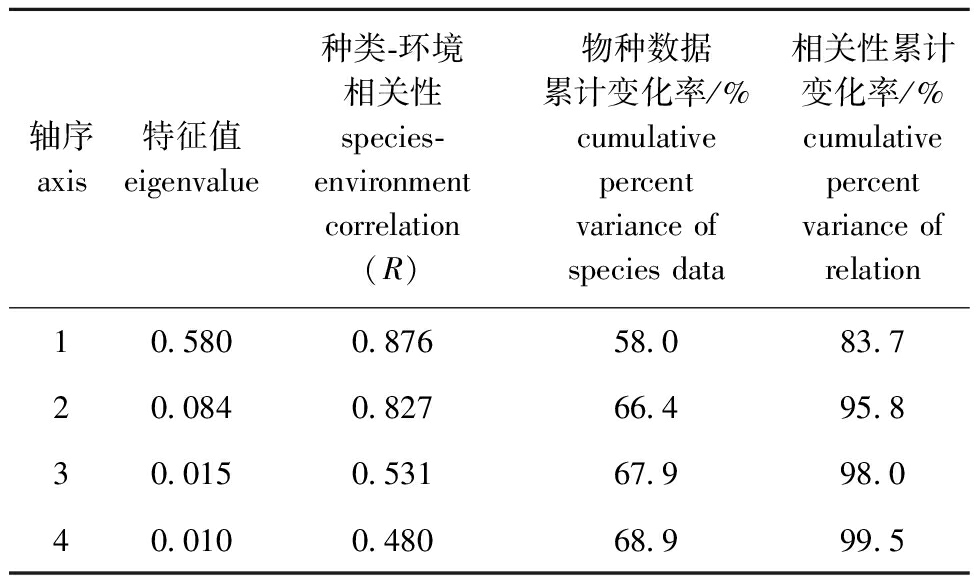
轴序axis特征值eigenvalue种类-环境相关性species-environment correlation (R)物种数据累计变化率/%cumulative percent variance of species data相关性累计变化率/%cumulative percent variance of relation10.5800.87658.083.720.0840.82766.495.830.0150.53167.998.040.0100.48068.999.5
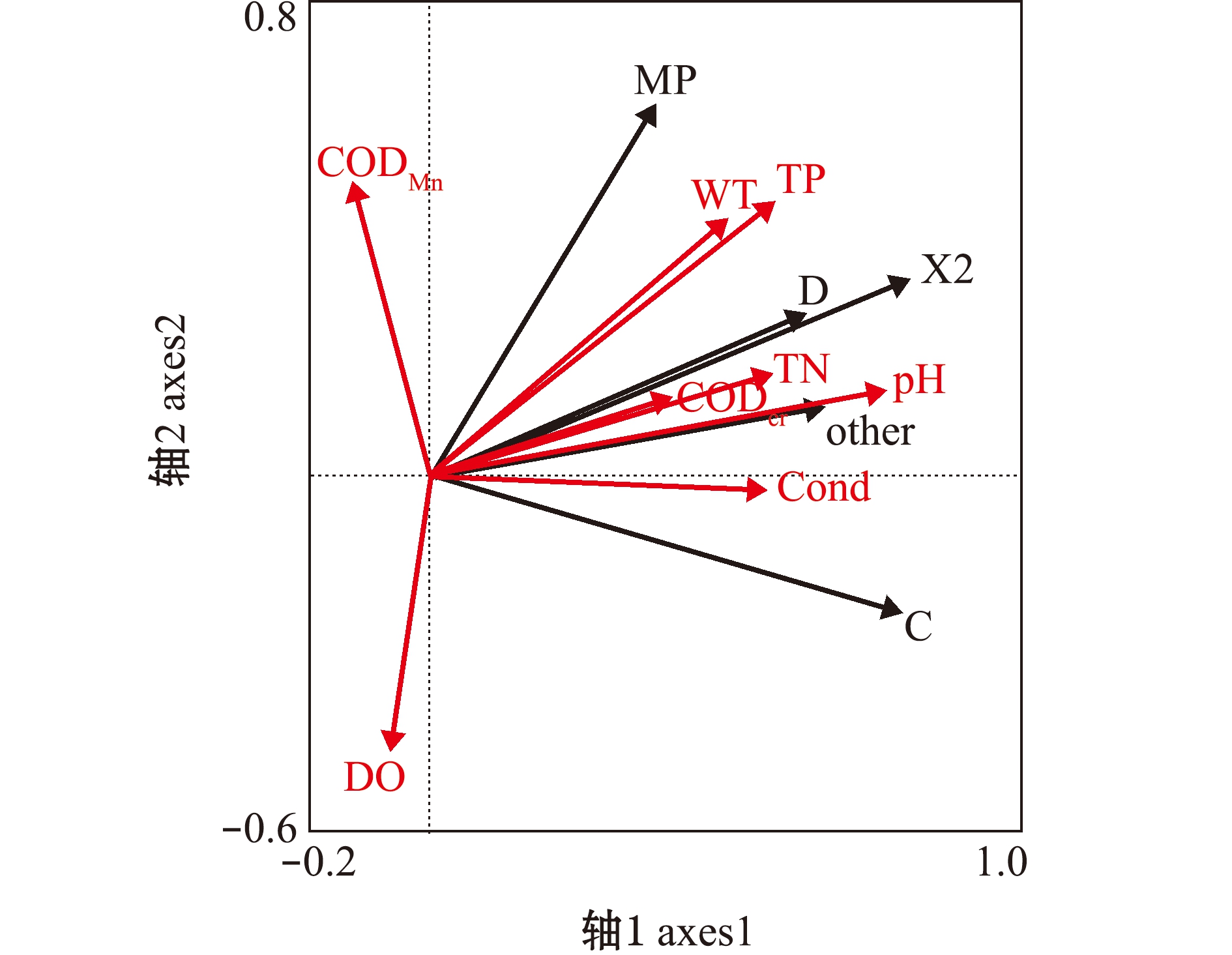
图3 重要功能群与环境因子的RDA分析
Fig.3 Redundancy analysis between the main functional groups and environment factors
重要功能群C、D、MP、X2与pH、TP、TN、Cond和WT均呈正相关关系;CODMn与除功能群C以外的其他功能群呈正相关关系,DO则相反,与除功能群C以外的功能群呈负相关关系(图3)。
3 讨论
3.1 海拉尔河浮游植物功能群特征
相较于湖泊,河流生态系统浮游植物的组成受温度和营养盐等因素影响相对较小,不同纬度、不同营养水平条件下优势种类均以硅藻为主,差异并不十分显著。洪松等 [27]对20世纪70年代末至80年代前期的黑龙江、松花江、黄河、长江和珠江等中国南北方主要河流的相关研究显示,浮游植物组成以硅藻门和绿藻门为主,而优势种基本以硅藻门种类为主,主要为功能群C中的小环藻属,功能群D中的针杆藻属、菱形藻属,功能群MP中的舟形藻属、双菱藻属,以及功能群P中的直链藻属、脆杆藻属。从近年研究也可看出,不同纬度富营养化河流和贫营养河流重要功能群的差异均较小。亚热带地区富营养化河流[6]全年以功能群P、D占优,贫营养河流[17]全年则以C、MP、D占优;温带地区富营养河流[13]春、秋季节以功能群MP、D、L0、J占优;北方寒区富营养河流[16]全年以功能群C、D、MP占优,贫营养河流[17]春季以L0、MP、P、C占优。从本研究结果来看,北方寒区富营养化偏碱性河流海拉尔河浮游植物重要功能群为C、D、MP、X2,且呈现C+X2+D(春季)→X2+MP+D+C(夏季)→D+C+MP(秋季)的季节变化特征,功能群C、D和MP同样占重要地位。表明海拉尔河浮游植物功能群生物量季节变化较小。
河流系统浮游植物功能群生物量时空差异较大,通常下游水域浮游植物功能群生物量高于中、上游水域。杜红春等[6]对汉江中、下游水域浮游植物功能群生物量研究表明,下游水域生物量明显高于中游,下游功能群C和P显著增加。白海峰等[14]研究也表明,渭河流域浮游植物功能群生物量呈现下游>中游>上游的趋势。从本研究结果来看,海拉尔河水域浮游植物功能群生物量也呈现下游>中游>上游的趋势,下游功能群C也显著增加。
功能群C、X2是海拉尔河最具有代表性的功能群。功能群C代表中营养到富营养的中小型水体,海拉尔河春季进入融雪期,冰雪融化冲刷泥沙携带腐殖质入河,水体营养程度逐渐增大的同时,水体浑浊程度也增大,同时也验证了功能群C耐低光照的特性。这是由于海拉尔河发源于大兴安岭山间溪流,上游无人为污染干扰,而中游经过牙克石、海拉尔等人类活动密集区域,城市生活污水和工业废水等导致水体污染加剧[20-21],下游浮游植物大量生长,致使在下游区域的功能群C占据显著优势。功能群X2代表中营养到富营养化的浅水水体,且功能群X2以喜高温的绿藻门种类为主,使其在高温和高营养盐的夏季占据优势。功能群D和MP适宜生活在频繁扰动的浑浊水体中,夏季雨水增多,雨水带来的扰动使更适应此类环境的功能群D、MP占据优势,同时由于功能群D具有喜光的特性,使其在水质更好、更清澈的上游区域占据优势。
3.2 海拉尔河浮游植物功能群与水环境因子的关系
浮游植物功能群的演替同水温、营养盐、光照强度、水动力学,以及水生生物之间的相互作用联系十分紧密,在不同环境条件及不同水环境因子下,耐受特定环境的浮游植物群体会在其适宜条件下生存下来并占据主导位置[25]。pH对海拉尔河浮游植物功能群产生着重要的影响。海拉尔河pH为7.5~8.5,属于弱碱性水体。有研究显示,水体的酸碱性会影响浮游植物的生长,当水体处于弱碱性时,会加快浮游植物吸收二氧化碳,促进浮游植物的生长[28]。本研究中,海拉尔河重要功能群C、D、MP、X2均与pH呈正相关关系,说明在适宜范围内,pH会促进这些功能群浮游植物的生长。这与于洪贤等[18]对春季牡丹江浮游植物研究的结果相似。
富营养化水体中,营养盐也是影响浮游植物功能群的主要因子[5],营养盐的浓度与占比均会影响浮游植物的生长与活动。安睿等[29]对小兴凯湖浮游植物功能群研究表明,TP是影响浮游植物功能群的最主要影响因子之一;李晓钰等[19]对松花江哈尔滨段浮游植物功能群研究表明,CODCr、WT和TP是影响浮游植物功能群的最主要影响因子。对不同区域、不同类型的富营养化水体研究均表明,TN、TP是影响浮游植物功能群的主要因素,尤其是对淡水生态系统,相较于TN,TP对浮游植物功能群的影响更大[30]。于孝坤等[15]对芜湖河道浮游植物研究表明,功能群C与TN、TP均呈正相关关系,相较于TP,功能群C与TN相关性较大;陈楠等[31]对泰湖浮游植物的研究也证明了功能群X2与TN、TP呈显著正相关关系;对长寿湖[8]和新丰江水库[9]的研究均表明,功能群D和MP与TN、TP也呈正相关关系。与上述研究结果一致,本研究表明,TN、TP均是影响海拉尔河流域浮游植物重要功能群的主要相关因子,其中,TP对浮游植物功能群的影响更大。海拉尔河浮游植物重要功能群C、X2、D和MP均与TN、TP呈正相关,其中,功能群X2和D相比其余功能群与TN、TP的相关性较大,功能群MP与TP相关性较大,而功能群C则与TN相关性较大。由此可见,TN、TP明显能促进重要功能群浮游植物的生长。
WT同样是影响海拉尔河浮游植物功能群的重要因子之一。WT是通过控制光合作用的酶促反应或呼吸作用的强度来直接影响藻类的生长[32],并通过影响藻类酶的活性间接影响其对光能和营养盐的获取、利用,进而影响藻类的生长[33]。相对于热带、亚热带区域,WT通常是受温度变化影响较为明显的寒区浮游植物功能群的主要因素之一。林岿璇等[34]对镜泊湖浮游植物研究表明,WT是影响寒区浮游植物功能群的主要影响因子。张俊芳等[10]对汤浦水库研究表明,WT与功能群X2呈显著正相关;韩丽彬等[11]对贵州百花水库浮游植物研究表明,功能群D与WT呈显著正相关;杨雅兰等[12]对云南大理洱源西湖浮游植物研究表明,功能群MP与WT呈正相关关系,但不是主要正相关因子。可以看出,WT对不同浮游植物功能群的影响程度也不同,功能群X2和D通常与WT呈显著正相关,功能群MP和C虽然也与WT呈正相关,但相关性不显著。与此结果相似,本研究表明,功能群X2、D、MP和C均与WT呈正相关,尤其是功能群X2、D、MP与WT呈显著正相关。这是由于功能群X2主要以绿藻门的衣藻属种类为主,衣藻属种类适宜生长温度为25 ℃[35],其在WT较高的夏季占比较高,而在WT较低的春、秋季节占比显著下降。而以硅藻门为主的功能群更适宜低温环境,且最适生长温度很少超过25 ℃[36]。针杆藻属既能在冬、春等低温季节生长[37],同时也能在夏季快速生长,说明针杆藻属是对水温适应较广的种类。由此可见,以针杆藻属为主的功能群D与WT会呈现显著的正相关关系。
4 结论
1)海拉尔河浮游植物重要功能群组成季节变化呈现C+X2+D(春季)→X2+MP+D+C(夏季)→D+C+MP(秋季),浮游植物生物量空间变化呈现下游>中游>上游的趋势。说明海拉尔河浮游植物功能群组成较稳定,受时间变化影响较小,浮游植物生物量在人类活动强度的影响下,空间变化较大。
2)浮游植物功能群C在下游比例显著升高,说明海拉尔河下游污染相较上游及中游较重。
3)影响海拉尔河流域浮游植物功能群的主要水环境因子为pH、TP、TN和WT,均与功能群C、D、MP、X2呈正相关,尤其是功能群X2与pH、TP、TN和WT呈显著正相关,D与WT、pH呈显著正相关,功能群MP相较于TN,与TP相关性更大,功能群 C则与TN相关性更大。说明控制海拉尔河污染应着重于N、P的点源及面源污染,改善下游工业、生活及牧业的废水污水排放处理体系,逐步减轻对海拉尔河水域的危害,进而维护整个呼伦湖流域的生态安全。
[1] REYNOLDS C S.Ecology of phytoplankton[M].Cambridge,UK:Cambridge University Press,2006.
[2] REYNOLDS C S,HUSZAR V,KRUK C,et al.Towards a functional classification of the freshwater phytoplankton[J].Journal of Plankton Research,2002,24(5):417-428.
[3] PADIS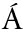 K J,CROSSETTI L O,NASELLI-FLORES L.Use and misuse in the application of the phytoplankton functional classification:a critical review with updates[J].Hydrobiologia,2009,621(1):1-19.
K J,CROSSETTI L O,NASELLI-FLORES L.Use and misuse in the application of the phytoplankton functional classification:a critical review with updates[J].Hydrobiologia,2009,621(1):1-19.
[4] NAIMAN R J.River ecology and management[J].Ambio A Journal of the Human Environment,2008,37(7-8):15-15.
[5] 高国敬,肖利娟,林秋奇,等.海南省典型水库浮游植物功能类群的结构特征与水质评价[J].生态科学,2013,32(2):144-150.
GAO G J,XIAO L J,LIN Q Q,et al.Structure of phytoplankton functional groups and water quality assessment of main reservoirs in Hainan Province[J].Ecological Science,2013,32(2):144-150.(in Chinese)
[6] 杜红春,王晓宁,吴虎,等.汉江中下游浮游植物群落结构、功能群特征及水质评价[J].长江流域资源与环境,2021,30(8):1839-1847.
DU H C,WANG X N,WU H,et al.Community structure and functional groups of phytoplankton and water quality evaluation in the middle and lower Hanjiang River[J].Resources and Environment in the Yangtze Basin,2021,30(8):1839-1847.(in Chinese)
[7] 文威,孙婷婷,李红涛,等.贵州印江河浮游植物群落特征及其与环境因子的关系[J].生物资源,2022,44(3):247-256.
WEN W,SUN T T,LI H T,et al.Phytoplankton community structure and its relationship with environmental factors in Yinjiang River,Guizhou[J].Biotic Resources,2022,44(3):247-256.(in Chinese)
[8] 闫苏苏,雷波,刘朔孺,等.长寿湖浮游植物功能群季节变化及影响因子[J].水生态学杂志,2018,39(3):52-60.
YAN S S,LEI B,LIU S R,et al.Seasonal variation of phytoplankton functional groups in Changshou Lake and relevant environmental factors[J].Journal of Hydroecology,2018,39(3):52-60.(in Chinese)
[9] 张辉,彭宇琼,邹贤妮,等.新丰江水库浮游植物功能分组特征及其与环境因子的关系[J].中国环境科学,2022,42(1):380-392.
ZHANG H,PENG Y Q,ZOU X N,et al.Characteristics of phytoplankton functional groups and their relationships with environmental factors in Xinfengjiang Reservoir[J].China Environmental Science,2022,42(1):380-392.(in Chinese)
[10] 张俊芳,胡晓红,马沛明,等.汤浦水库浮游植物功能群季节演替及关键驱动因子[J].水生态学杂志,2021,42(3):55-62.
ZHANG J F,HU X H,MA P M,et al.Seasonal succession of phytoplankton functional groups and key driving factors in Tangpu Reservoir[J].Journal of Hydroecology,2021,42(3):55-62.(in Chinese)
[11] 韩丽彬,王星,李秋华,等.贵州高原百花水库浮游植物功能群的动态变化及驱动因子[J].湖泊科学,2022,34(4):1102-1114.
HAN L B,WANG X,LI Q H,et al.Dynamic changes and driving factors of phytoplankton functional groups in Baihua Reservoir,Guizhou Plateau[J].Journal of Lake Sciences,2022,34(4):1102-1114.(in Chinese)
[12] 杨雅兰,过龙根,尹成杰,等.云南大理洱源西湖浮游植物功能群季节演替研究[J].环境工程技术学报,2023,13(2):625-631.
YANG Y L,GUO L G,YIN C J,et al.Study on the seasonal succession of phytoplankton functional groups in the West Lake of Eryuan,Dali,Yunnan Province[J].Journal of Environmental Engineering Technology,2023,13(2):625-631.(in Chinese)
[13] 闵文武,王培培,李丽娟,等.渭河流域浮游植物功能群与环境因子的关系[J].环境科学研究,2015,28(9):1397-1406.
MIN W W,WANG P P,LI L J,et al.Relationship between phytoplankton functional groups and environmental factors in the Wei- he River Basin[J].Research of Environmental Sciences,2015,28(9):1397-1406.(in Chinese)
[14] 白海锋,王怡睿,宋进喜,等.渭河浮游生物群落结构特征及其与环境因子的关系[J].生态环境学报,2022,31(1):117-130.
BAI H F,WANG Y R,SONG J X,et al.Characteristics of plankton community structure and its relation to environmental factors in Weihe River,China[J].Ecology and Environmental Sciences,2022,31(1):117-130.(in Chinese)
[15] 于孝坤,范廷玉,王兴明,等.芜湖河道浮游植物功能群分布及其与环境因子的关系[J].科学技术与工程,2022,22(19):8546-8553.
YU X K,FAN T Y,WANG X M,et al.Distribution of phytoplankton functional groups in Wuhu River and their relationship with environmental factors[J].Science Technology and Engineering,2022,22(19):8546-8553.(in Chinese)
[16] 冯凯,刘莹,张柠.松花江哈尔滨段浮游植物分布研究[J].黑龙江水利科技,2021,49(7):1-4,194.
FENG K,LIU Y,ZHANG N.Phytoplankton distribution in Harbin section of Songhua River[J].Heilongjiang Hydraulic Science and Technology,2021,49(7):1-4,194.(in Chinese)
[17] 赵晨,孙佳伟,尹增强,等.大罗圈沟河水生生物多样性及水质评价[J].大连海洋大学学报,2023,38(3):504-514.
ZHAO C,SUN J W,YIN Z Q,et al. Aquatic biodiversity and water quality evaluation in Daluoquangou River[J].Journal of Dalian Ocean University,2023,38(3):504-514.(in Chinese)
[18] 于洪贤,曲翠,马成学.牡丹江浮游植物丰度与环境因子的相关性分析[J].湿地科学,2008,6(2):293-297.
YU H X,QU C,MA C X.Correlation between phytoplankton abundance and its environmental factors in Mudan River[J].Wetland Science,2008,6(2):293-297.(in Chinese)
[19] 李晓钰,于洪贤,马成学.松花江哈尔滨段浮游植物群落典范对应分析及多样性分析[J].东北林业大学学报,2013,41(10):103-107.
LI X Y,YU H X,MA C X.Structure of phytoplankton community based on canonical correspondence analysis and biodiversity analysis in Harbin section of Songhua River[J].Journal of Northeast Forestry University,2013,41(10):103-107.(in Chinese)
[20] 庞燕,项颂,杨天学,等.内蒙古海拉尔河水质污染时空变化特征[J].环境工程技术学报,2019,9(4):414-420.
PANG Y,XIANG S,YANG T X,et al.Spatial and temporal variation characteristics of water pollution in Hailaer River,Inner Mongolia[J].Journal of Environmental Engineering Technology,2019,9(4):414-420.(in Chinese)
[21] 董熙,陈志泊,胡春明,等.气候、径流及河漫滩湿地淹没状态耦合关系研究:以海拉尔河下游段为例[J].生态学报,2022,42(22):9297-9308.
DONG X,CHEN Z B,HU C M,et al.Coupling relationship between climate,runoff and inundation state of river floodplain wetlands in the lower section of the Hailar River[J].Acta Ecologica Sinica,2022,42(22):9297-9308.(in Chinese)
[22] 霍堂斌,崔晓文,姜作发,等.应用大型底栖动物完整性指数评价海拉尔河健康[J].生态学杂志,2013,32(9):2510-2516.
HUO T B,CUI X W,JIANG Z F,et al.Health assessment of Hailaer River in Northeast China based on the benthic index of biotic integrity on stream macrozoobenthos[J].Chinese Journal of Ecology,2013,32(9):2510-2516.(in Chinese)
[23] 李星醇,于洪贤,窦华山,等.呼伦湖及其周围水域春季浮游植物功能群及其影响因子[J].水产学杂志,2020,33(3):31-41.
LI X C,YU H X,DOU H S,et al.Phytoplankton functional groups and related influencing factors in Hulun Lake and adjacent waters in spring[J].Chinese Journal of Fisheries,2020,33(3):31-41.(in Chinese)
[24] 胡鸿钧,魏印心.中国淡水藻类:系统、分类及生态[M].北京:科学出版社,2006.
HU H J,WEI Y X.The freshwater algae of China Systematics, taxonomy and ecology[M].Beijing:Science Press,2006.(in Chinese)
[25] MA C X,YU H X.Phytoplankton community structure in reservoirs of different trophic status,Northeast China[J].Chinese Journal of Oceanology and Limnology,2013,31(3):471-481.
[26] MA C X,ZHAO C,MWAGONA P C,et al.Bottom-up and top-down effects on phytoplankton functional groups in Hulun Lake,China[J].Annales De Limnologie-International Journal of Limnology,2021,57:3.
[27] 洪松,陈静生.中国河流水生生物群落结构特征探讨[J].水生生物学报,2002,26(3):295-305.
HONG S,CHEN J S.Structure characteristics of aquatic community from the main rivers in China[J].Acta Hydrobiologica Sinica,2002,26(3):295-305.(in Chinese)
[28] JAKOBSEN H H,BLANDA E,STAEHR P A,et al.Development of phytoplankton communities:implications of nutrient injections on phytoplankton composition,pH and ecosystem production[J].Journal of Experimental Marine Biology and Ecology,2015,473:81-89.
[29] 安睿,王凤友,于洪贤,等.小兴凯湖浮游植物功能群特征及其影响因子[J].环境科学研究,2016,29(7):985-994.
AN R,WANG F Y,YU H X,et al.Characteristics and physical factors of phytoplankton functional groups in small Xingkai Lake[J].Research of Environmental Sciences,2016,29(7):985-994.(in Chinese)
[30] SCHINDLER D W,HECKY R E,FINDLAY D L,et al.Eutrophication of lakes cannot be controlled by reducing nitrogen input:results of a 37-year whole-ecosystem experiment[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(32):11254-11258.
[31] 陈楠,王莹,杨天雄,等.泰湖夏季浮游植物功能群特征及水质状况[J].东北林业大学学报,2018,46(3):69-73.
CHEN N,WANG Y,YANG T X,et al.Characteristics of functional group and evaluation of water quality of summer phytoplankton in the Tai Lake[J].Journal of Northeast Forestry University,2018,46(3):69-73.(in Chinese)
[32] BLINN D W.Diatom community structure along physicochemical gradients in saline lakes[J].Ecology,1993,74(4):1246-1263.
[33] BUTTERWICK C,HEANEY S I,TALLING J F.Diversity in the influence of temperature on the growth rates of freshwater algae,and its ecological relevance[J].Freshwater Biology,2004,50(2):291-300.
[34] 林岿璇,汪星,王瑜,等.镜泊湖浮游藻类功能群的演替特征及其影响因素[J].环境科学研究,2017,30(4):520-528.
LIN K X,WANG X,WANG Y,et al.Composition and influencing factors of algal functional groups in Jingpo Lake[J].Research of Environmental Sciences,2017,30(4):520-528.(in Chinese)
[35] 郑凌凌.衣藻FACHB-1741.中国科学院淡水藻种库[DB/OL].(2011-05-17)[2022-11-14]. http://algae.ihb.ac.cn/Products/ProductDetail.aspx?product=1171.
ZHENG L L.Chlamydomonas FACHB-1741.Freshwater Algae Culture Collection at the Institute of Hydrobiology[DB/OL].(2011-05-17) [2022-11-14].http://algae.ihb.ac.cn/Products/ProductDetail.aspx?product=1171.(in Chinese)
[36] COLES J F,JONES R C.Effect of temperature on photosynthesis-light response and growth of four phytoplankton species isolated from a tidal freshwater river[J].Journal of Phycology,2000,36(1):7-16.
[37] 薛迪,解军,周建仁,等.南水北调东线湖泊针杆藻属分布特征及其与环境因子的关系[J].环境科学研究,2016,29(11):1600-1607.
XUE D,XIE J,ZHOU J R,et al.Distribution characteristics of Synedra and its relationship with environmental variables in storage lakes on the eastern route of the south-to-north water diversion project[J].Research of Environmental Sciences,2016,29(11):1600-1607.(in Chinese)