菲律宾蛤仔(Ruditapes philippinarum)隶属于软体动物门(Mollusca)双壳纲(Lamellibranchia)帘蛤目(Veneroida)帘蛤科(Veneridae)蛤仔属(Ruditapes),是中国主要的海水养殖经济贝类之一[1]。盐度是影响菲律宾蛤仔存活和生长的重要环境因子之一[2]。研究发现,在低盐度海水中,菲律宾蛤仔会表现出明显的应激反应[3],其摄食率和清滤率均有所下降[4],当盐度低于15时,菲律宾蛤仔无法维持其正常的代谢活动[5]。盐度骤降对菲律宾蛤仔的鳃和肝胰腺影响较明显[6],且高温时海水盐度波动更容易引起菲律宾蛤仔渗透压的改变[7]。
亚硝酸盐氮是养殖水体中常见的污染物之一,水中较高浓度的亚硝酸盐氮会影响水产养殖动物血液对氧气的输送,降低其抵抗环境胁迫的能力,从而抑制其生长发育。研究表明:亚硝酸盐氮质量浓度增加会引起凡纳滨对虾(Litopenaeus vannamei)能量代谢进程加快[8],急性胁迫时凡纳滨对虾死亡率随亚硝酸盐氮浓度的增加而升高[9];亚硝酸盐氮对管角螺(Hemifusus tuba)稚贝的毒害作用随pH和盐度的降低而增大[10];亚硝酸盐氮胁迫也会造成菲律宾蛤仔免疫功能下降和组织再生障碍[11],且对菲律宾蛤仔浮游幼虫生长发育的影响大于幼贝[12]。然而,有关低盐度和亚硝酸盐氮协同作用对水生生物呼吸代谢的影响研究鲜见报道,尤其对贝类呼吸代谢的协同作用未见报道。
菲律宾蛤仔养殖过程中,天然降水可能导致养殖区海水盐度下降,而含氮有机物的硝化过程受到抑制,可能会导致水中亚硝酸盐氮积累,海水盐度下降和亚硝酸盐氮积累均会影响菲律宾蛤仔的代谢和生长。但是,低盐度和亚硝酸盐氮协同胁迫对菲律宾蛤仔呼吸和代谢的影响尚未见报道。本研究中,选取菲律宾蛤仔“斑马蛤2号”和莆田群体为试验对象,研究了低盐度和亚硝酸盐氮单因子胁迫及二者协同胁迫对菲律宾蛤仔呼吸代谢的影响,并观察了协同胁迫后菲律宾蛤仔鳃丝的组织结构变化,以期为探讨外界环境胁迫对菲律宾蛤仔代谢的影响提供科学参考。
1 材料与方法
1.1 材料
试验用菲律宾蛤仔(以下简称“蛤仔”)“斑马蛤2号”和莆田群体,均采自辽宁省大连市獐子岛贝类育苗基地,“斑马蛤2号”壳长为(27.5±1.2)mm,莆田群体壳长为(31.2±1.8)mm。正式试验前将蛤仔暂养7 d,每天全量换水一次,早晚各投喂适量小球藻藻膏(盘锦光合蟹业有限公司生产)一次,正式试验开始前1 d停止投喂。
试验用海水取自大连市黑石礁近岸海域,经沉淀、沙滤和紫外消毒后备用,海水盐度为29.6±0.5,pH为8.0±0.1。试验在辽宁省贝类良种繁育工程技术研究中心进行。
1.2 方法
蛤仔的耗氧率和排氨率试验采用密闭静水方法,试验水温为20 ℃,以盐度30的海水为对照,调整试验海水盐度分别为25、20、15,亚硝酸盐氮质量浓度分别为0、0.15、0.30、0.60 mg/L,分别进行低盐度、亚硝酸盐氮单因子胁迫试验及二者的协同胁迫试验。每个试验用海水2 L,放入试验蛤仔5枚,每个试验设置3个平行,试验时间为4 h。试验前后采用碘量法和次溴酸盐氧化法(GB 17378.4—2007)分别测定水中溶解氧和总氨氮含量,取蛤仔体软体部于70 ℃烘箱中干燥24 h后称重。呼吸代谢过程中的耗氧率、排氨率和氧氮比(O∶N)计算公式分别为
RO=(CD0-CDt)×V/(m×t)。
(1)
RN=(CNt-CN0)×V/(m×t)。
(2)
RO∶N=(RO/16)/(RN/14)。
(3)
式中:RO为耗氧率[mg/(g·h)];RN为排氨率[mg/(g·h)];RO∶N为氧氮比;CD0和CDt分别为试验前和试验t时水中的溶解氧含量(mg/L);CN0和CNt分别为试验前和试验t时水中的总氨氮质量浓度(mg/L);V为试验用海水体积(L);m为菲律宾蛤仔质量(g);t为试验时间(h)。
试验结束后,从每个试验组分别取3枚蛤仔,解剖取其鳃,用多聚甲醛固定液固定24 h,用体积分数为70%的乙醇洗涤3次,再进行梯度脱水处理,然后透蜡、包埋、修蜡、切片(切片厚度为5 μm)、展片、脱蜡、染色(苏木精-伊红染色法)和脱水,用中性树胶进行封片,最后在显微镜(LEICA DM 4000B LED)下观察并拍照。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 26.0软件进行单因素和双因素方差分析(ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 低盐度对菲律宾蛤仔耗氧率和排氨率的影响
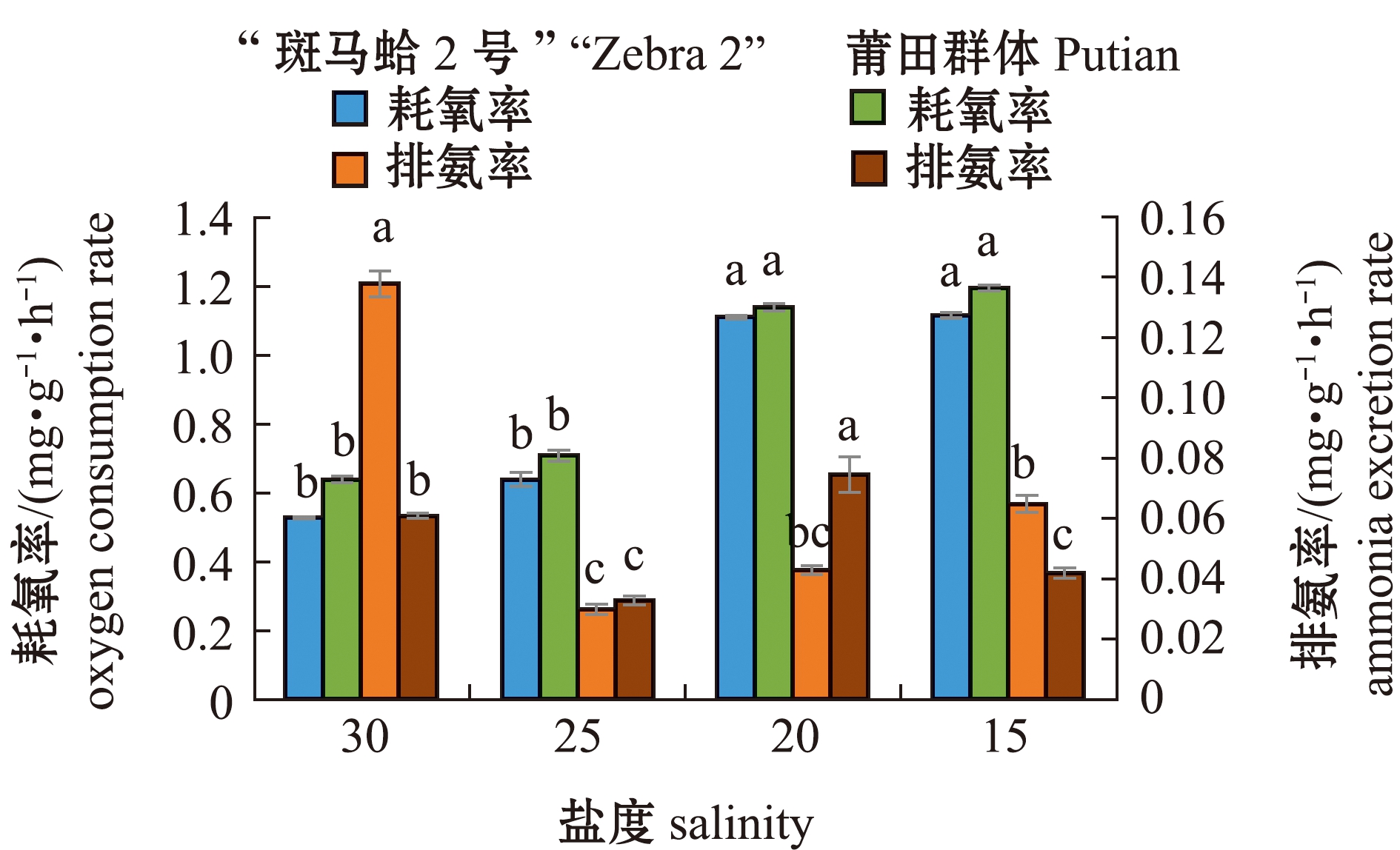
从图1可见:在盐度30、25、20、15范围内,“斑马蛤2号”和莆田群体的耗氧率均随盐度的降低而升高,当盐度降至20、15时,两种蛤仔的耗氧率均显著高于对照组(盐度30)(P<0.05);“斑马蛤2号”和莆田群体的排氨率均随盐度的降低呈先降低后升高的变化趋势,与对照组相比,“斑马蛤2号”的排氨率在低盐度(25~15)时均显著降低(P<0.05),莆田群体的排氨率在盐度为25、15时显著降低(P<0.05),在盐度为20时又升高且显著高于其他盐度组(P<0.05)。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Different letter means significant difference (P<0.05),and same letter means no significant difference (P>0.05),et sequentia.
图1 盐度对“斑马蛤2号”和莆田群体耗氧率和排氨率的影响
Fig.1 Effects of salinity on the oxygen consumption rate and ammonia excretion rate of “Zebra 2” and Putian population
从表1可见:“斑马蛤2号”的O∶N值随盐度的降低呈先升高后降低的趋势,在低盐度(25~15)时,其O∶N值均显著高于对照组(P<0.05),且在盐度20时最高;莆田群体在低盐度(25~15)时,其O∶N值均高于对照组,仅盐度为15时显著高于对照组(P<0.05)。
表1 盐度对“斑马蛤2号”和莆田群体O∶N值的影响
Tab.1 Effects of salinity on O∶N value of “Zebra 2” and Putian population
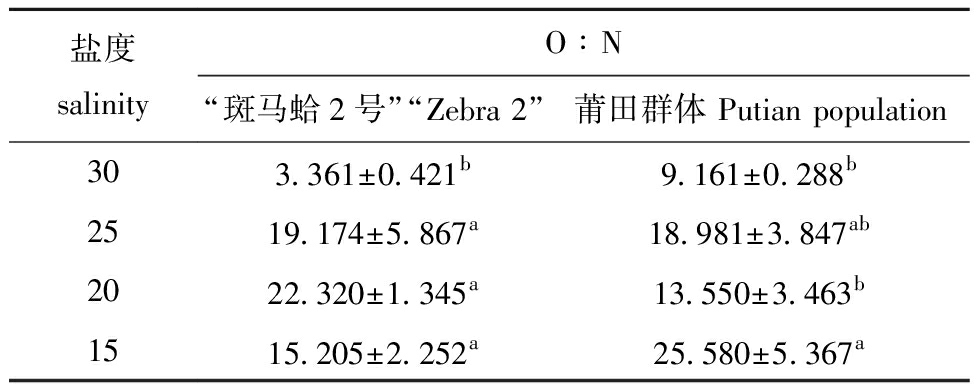
盐度salinityO∶N“斑马蛤2号”“Zebra 2”莆田群体 Putian population303.361±0.421b9.161±0.288b2519.174±5.867a18.981±3.847ab2022.320±1.345a13.550±3.463b1515.205±2.252a25.580±5.367a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
2.2 亚硝酸盐氮对菲律宾蛤仔耗氧率和排氨率的影响
从图2可见:在亚硝酸盐氮质量浓度为0.15~0.60 mg/L范围内,“斑马蛤2号”和莆田群体的耗氧率随亚硝酸盐氮质量浓度的增加而升高,均较对照组显著升高(P<0.05),二者的耗氧率均在亚硝酸盐氮质量浓度为0.60 mg/L时最高,分别为(2.225±0.007)、(2.442±0.005)mg/(g·h);“斑马蛤2号”的排氨率呈先降低后升高的趋势,且在亚硝酸盐氮质量浓度为0.15~0.60 mg/L时其排氨率均显著低于对照组(P<0.05),亚硝酸盐氮质量浓度为0.15 mg/L时排氨率降至最低,为(0.052±0.006)mg/(g·h),而莆田群体的排氨率则随亚硝酸盐氮质量浓度的增加呈先升高后降低的趋势,在亚硝酸盐氮质量浓度为0.30 mg/L时达到最高,为(0.077±0.003)mg/(g·h)。
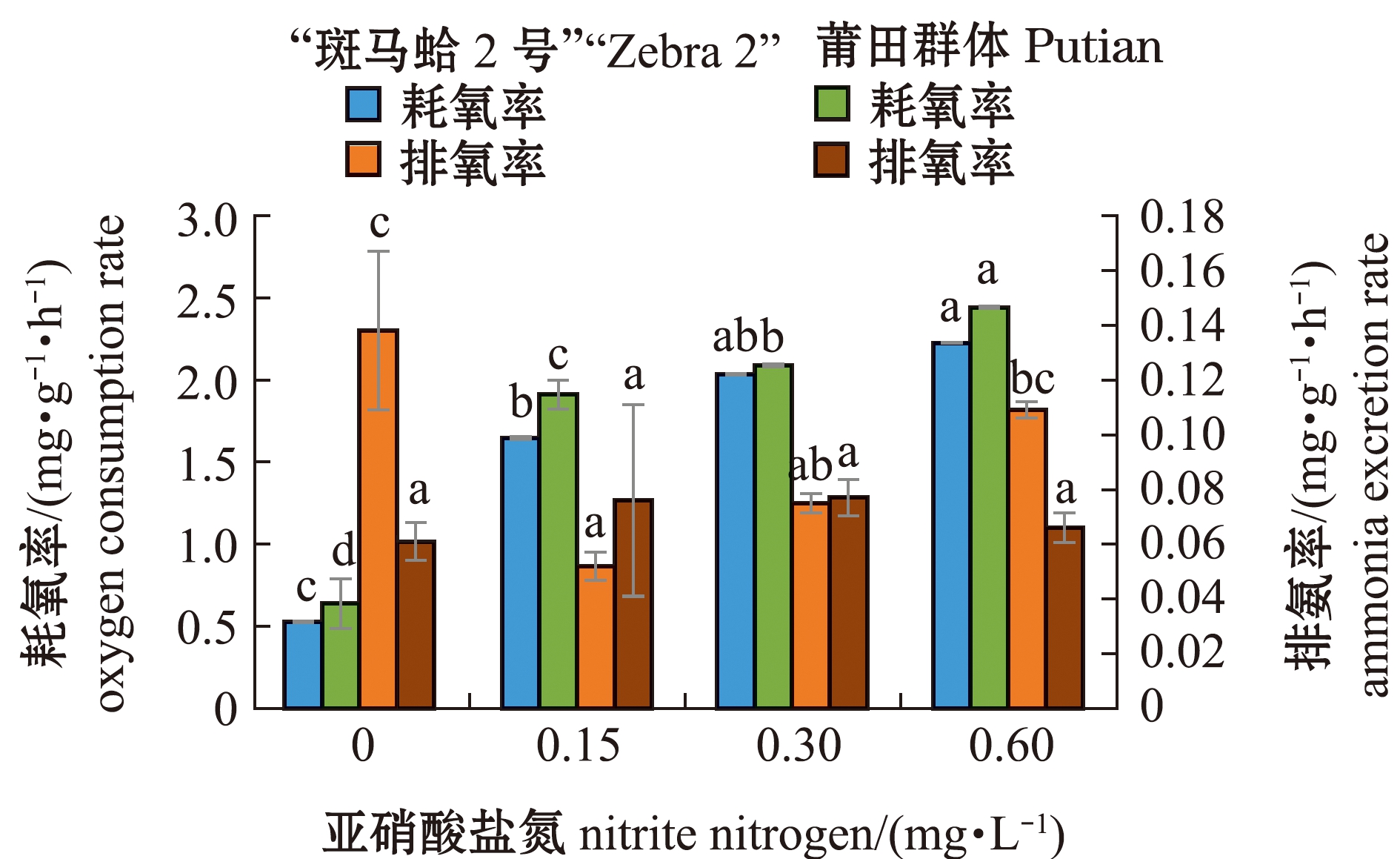
图2 亚硝酸盐氮对“斑马蛤2号”和莆田群体耗氧率和排氨率的影响
Fig.2 Effects of nitrite nitrogen concentration on the oxygen consumption rate and ammonia excretion rate of “Zebra 2” and Putian population
从表2可见:随亚硝酸盐氮质量浓度的增加,“斑马蛤2号”的O∶N值呈先升高后降低的趋势,而莆田群体O∶N值则呈升高的趋势;在亚硝酸盐氮质量浓度为0.15~0.60 mg/L时,两种蛤仔的O∶N值均显著高于对照组(P<0.05)。
表2 亚硝酸盐氮对“斑马蛤2号”和莆田群体O∶N值的影响
Tab.2 Effects of nitrite nitrogen concentration on O∶N value of “Zebra 2”and Putian population
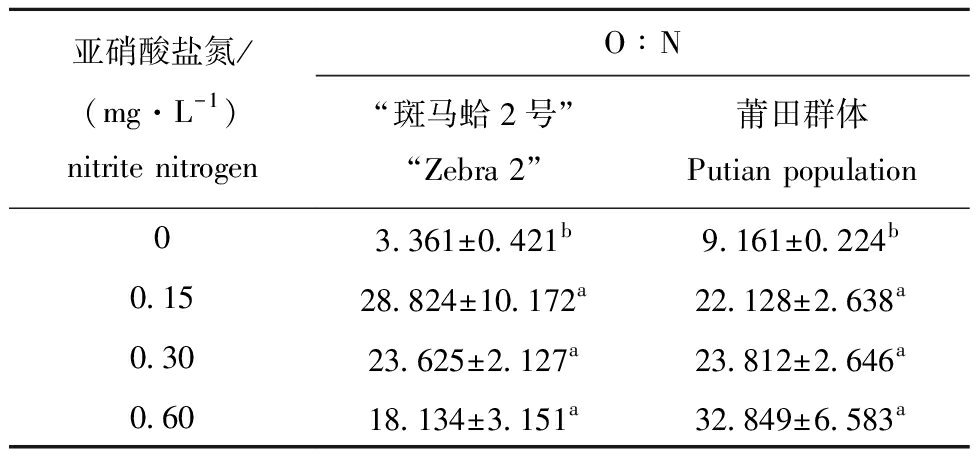
亚硝酸盐氮/(mg·L-1)nitrite nitrogenO∶N“斑马蛤2号”“Zebra 2”莆田群体Putian population03.361±0.421b9.161±0.224b0.1528.824±10.172a22.128±2.638a0.3023.625±2.127a23.812±2.646a0.6018.134±3.151a32.849±6.583a
2.3 低盐度和亚硝酸盐氮协同对菲律宾蛤仔耗氧率和排氨率的影响
通过双因素方差分析显示,低盐度和亚硝酸盐氮协同作用对菲律宾蛤仔的耗氧率和排氨率有显著性影响(P=0.04)。
从图3可见,总体上,“斑马蛤2号”和莆田群体的耗氧率在同一盐度下均随亚硝酸盐氮质量浓度的增加而升高,均在盐度15和亚硝酸盐氮质量浓度0.60 mg/L协同胁迫下最高,分别为(2.458±0.033)、(2.583±0.012)mg/(g·h),表明低盐度和高质量浓度亚硝酸盐氮协同胁迫对蛤仔耗氧率的影响更显著。从图4可见,“斑马蛤2号”排氨率在盐度15和亚硝酸盐氮质量浓度0.30 mg/L协同胁迫下最高,为(0.162±0.007)mg/(g·h),莆田群体排氨率在盐度为15和亚硝酸盐氮质量浓度为0.60 mg/L协同胁迫时最高,为(0.161±0.007)mg/(g·h)。
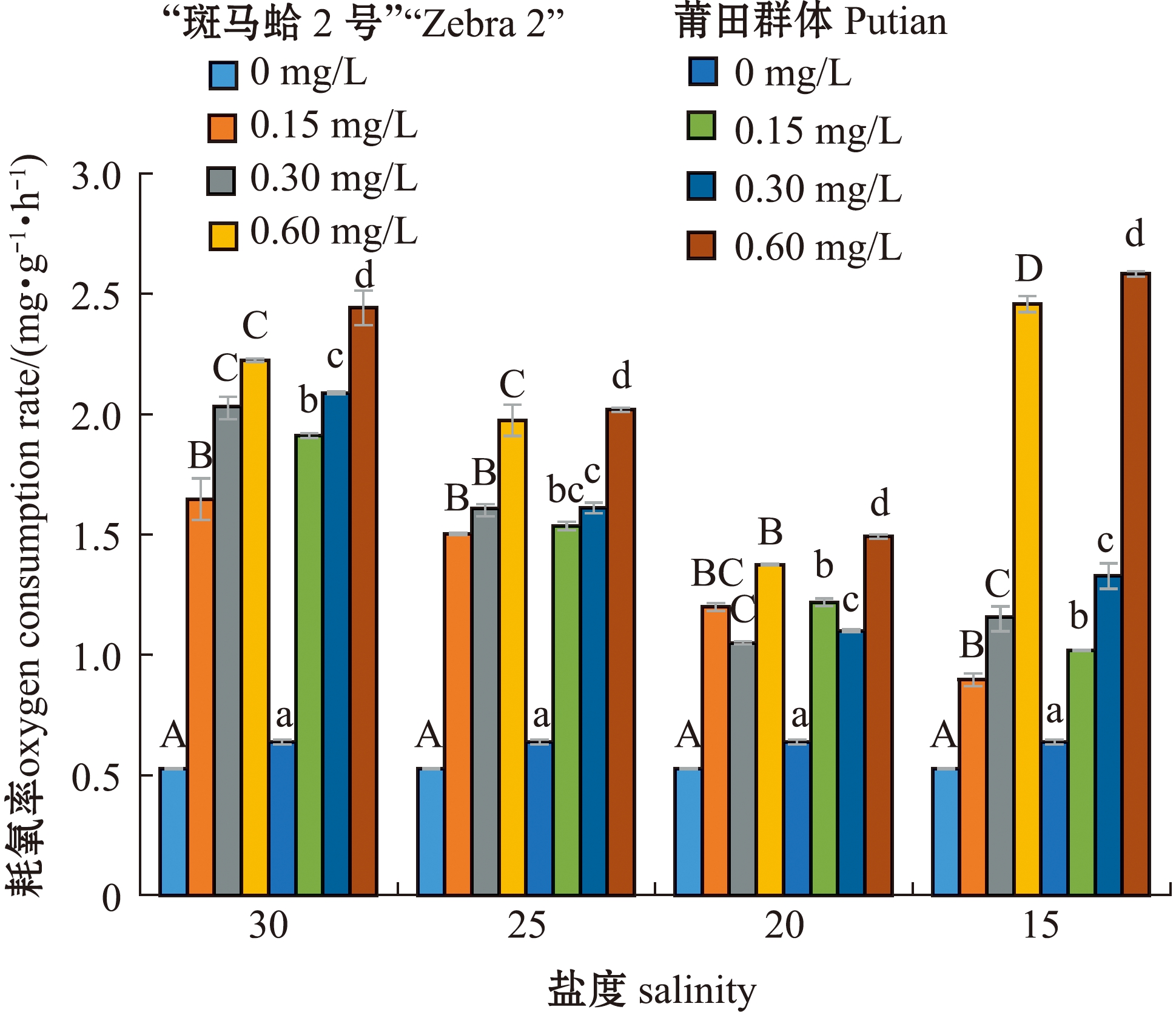
标有不同大写字母表示“斑马蛤2号”在同一盐度下不同亚硝酸盐氮质量浓度组间有显著性差异(P<0.05),标有不同小写字母表示莆田群体在同一盐度下不同亚硝酸盐氮质量浓度组间有显著性差异(P<0.05),标有相同字母表示组间无显著性差异(P>0.05),下同。
Different capital letters indicate that “Zebra 2” has significant differences among groups with different nitrite nitrogen concentrations under the same salinity (P<0.05);different letters indicate that Putian population has significant differences among groups with different nitrite nitrogen concentrations under the same salinity (P<0.05);and the means with the same letters are not significant differences(P>0.05),et sequentia.
图3 低盐度和亚硝酸盐氮协同对菲律宾蛤仔耗氧率的影响
Fig.3 Synergistic effect of low salinity and nitrite nitrogen on the oxygen consumption of Ruditapes philippinrum
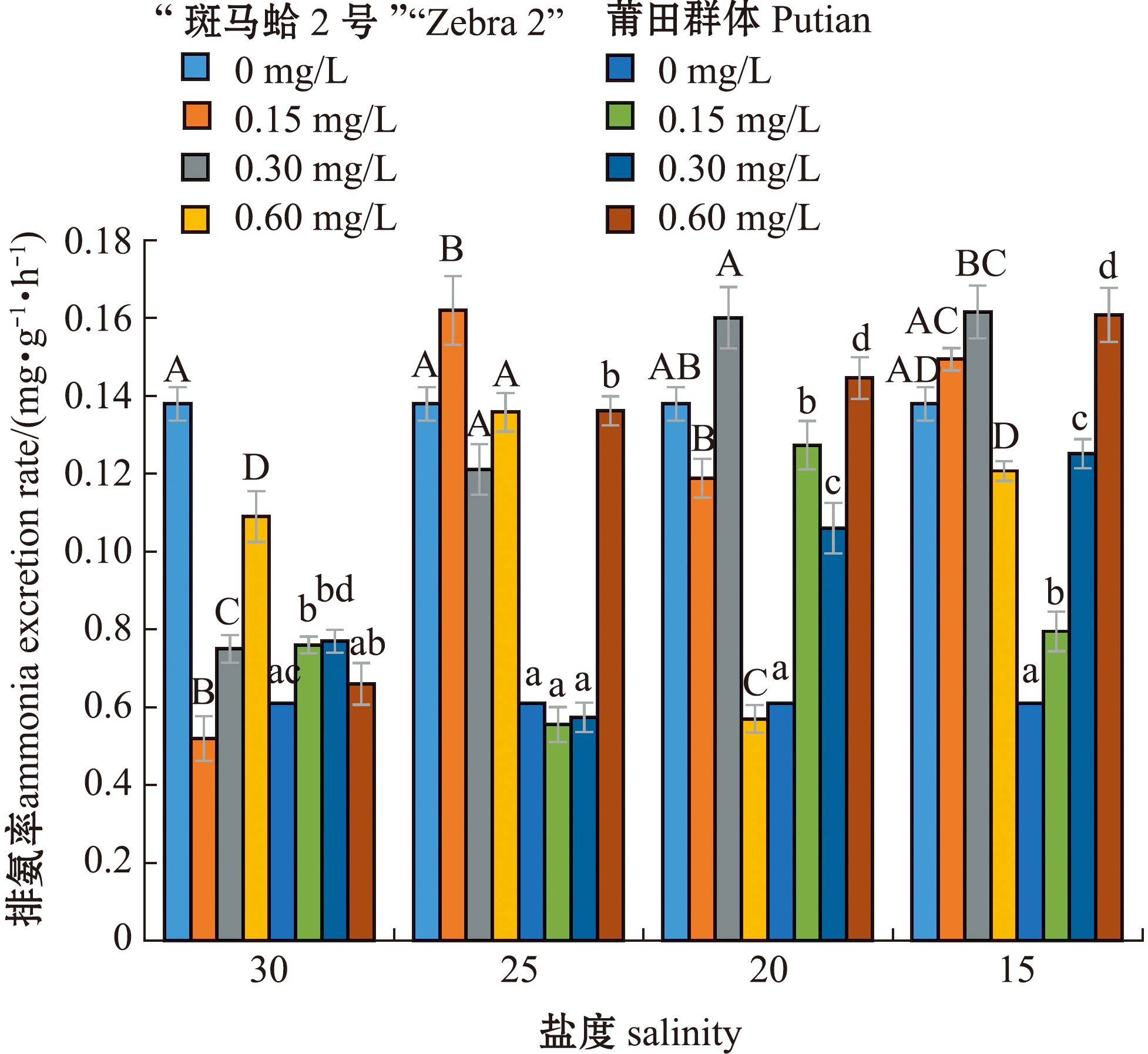
图4 低盐度和亚硝酸盐氮协同对菲律宾蛤仔排氨率的影响
Fig.4 Synergistic effect of low salinity and nitrite nitrogen on the ammonia excretion rate of Ruditapes philippinarum
从表3可见:“斑马蛤2号”和莆田群体的O∶N值总体上随盐度的降低和亚硝酸盐氮质量浓度的增加呈升高趋势,对照组O∶N值均较低;“斑马蛤2号”O∶N值在盐度为30和亚硝酸盐氮质量浓度为0.15 mg/L协同胁迫时最高,莆田群体O∶N值在盐度为30和亚硝酸盐氮质量浓度为0.60 mg/L协同胁迫时最高。
表3 盐度和亚硝酸盐氮协同对菲律宾蛤仔O∶N值的影响
Tab.3 Synergistic effect of salinity and nitrite nitrogen on O∶N value of Ruditapes philippinrum
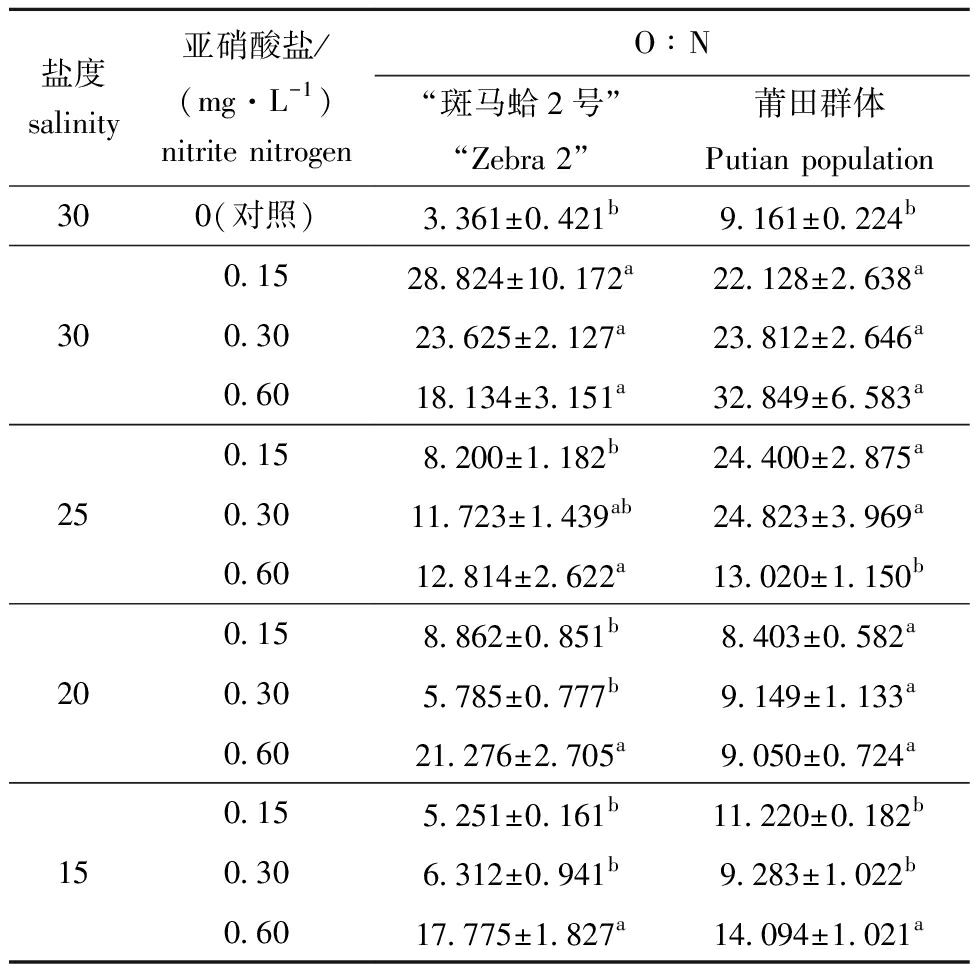
盐度salinity亚硝酸盐/(mg·L-1)nitrite nitrogenO∶N“斑马蛤2号”“Zebra 2”莆田群体Putian population300(对照)3.361±0.421b9.161±0.224b0.1528.824±10.172a22.128±2.638a300.3023.625±2.127a23.812±2.646a0.6018.134±3.151a32.849±6.583a0.158.200±1.182b24.400±2.875a250.3011.723±1.439ab24.823±3.969a0.6012.814±2.622a13.020±1.150b0.158.862±0.851b8.403±0.582a200.305.785±0.777b9.149±1.133a0.6021.276±2.705a9.050±0.724a0.155.251±0.161b11.220±0.182b150.306.312±0.941b9.283±1.022b0.6017.775±1.827a14.094±1.021a
2.4 低盐度和亚硝酸盐氮协同对菲律宾蛤仔鳃组织结构的影响
经低盐度和亚硝酸盐氮协同胁迫4 h后,对蛤仔的鳃组织结构观察发现:蛤仔对照组的鳃组织结构完整、呼吸上皮细胞排列整齐、细胞结构形态结构正常(图5A);在盐度15和亚硝酸盐氮质量浓度为0.60 mg/L协同胁迫下,“斑马蛤2号”的鳃丝出现呼吸上皮细胞脱落、鳃小片上皮细胞排列发生紊乱和鳃小片轻微肿胀(图5B),莆田群体鳃丝出现了皱缩、呼吸上皮细胞脱落和鳃间距增大(图5C)。
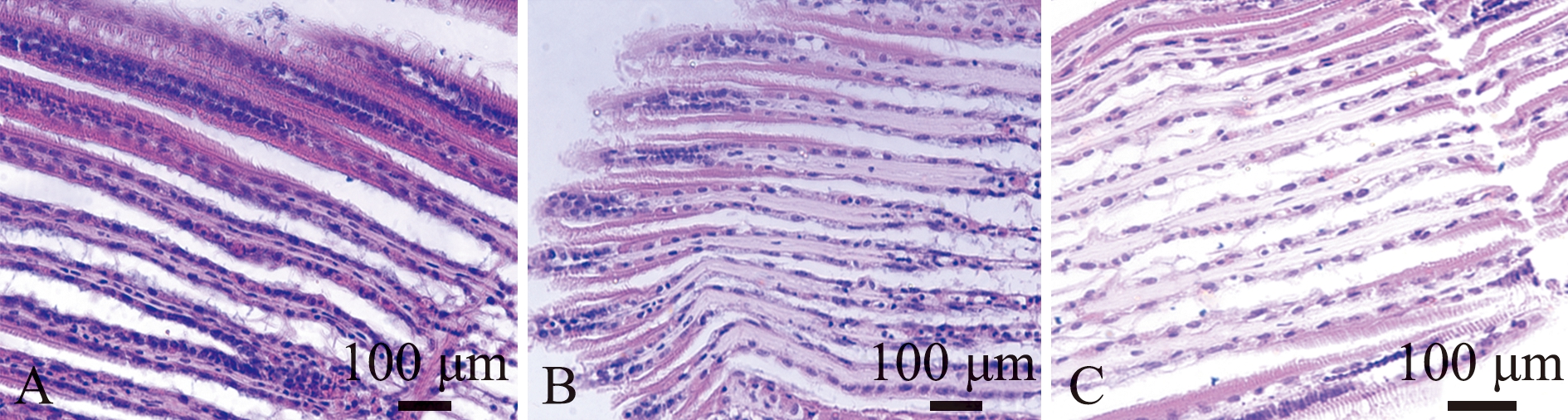
A—对照组;B—“斑马蛤2号”;C—莆田群体。
A—control group;B—“Zebra 2”;C—Putian population.
图5 低盐度(盐度15)和亚硝酸盐氮(0.60 mg/L)协同对菲律宾蛤仔鳃组织结构的影响
Fig.5 Synergistic effect of low salinity(salinity 15)and nitrite nitrogen(0.60 mg/L)on the gill tissue structure of Ruditapes philippinarum
3 讨论
3.1 低盐度对菲律宾蛤仔呼吸代谢的影响
盐度对贝类的呼吸和代谢作用具有重要影响,也是决定海洋贝类生态分布的重要因子之一。河流入海口附近或沿岸海域,因降雨、蒸发和河流流量等因素会影响该区域的盐度。盐度变化不仅影响贝类的摄食能力,还会影响其呼吸作用。盐度过高或过低均会使贝类关闭进出水管,紧闭双壳,形成组织隔离和外部环境隔离,导致呼吸作用和代谢过程减慢[13]。盐度变化会影响贝类的耗氧率和排氨率,王刚等[14]研究发现,近江牡蛎(Crassostrea hongkongensis)在低盐度时耗氧率增加,而Navarro等[15]却发现,壳菜蛤(Choromytilus chorus)的耗氧率随盐度的降低而降低。丁天扬等[16]研究发现,文蛤(Meretrix meretrix)的耗氧率随盐度的降低而升高,本研究结果与此相似,菲律宾蛤仔“斑马蛤2号”和莆田群体的耗氧率均随盐度的降低而升高,这可能与菲律宾蛤仔通过消耗自身能量来调节渗透压有关,菲律宾蛤仔生存在等渗点海水环境中时,用于维持自身生理活动的能量消耗较少,反之则需要较多的能量来适应盐度的变化。上述研究表明,低盐度胁迫对不同海水养殖动物的呼吸代谢影响不同。
O∶N是动物利用能源物质的一个重要指标之一,代表动物体内蛋白质与脂肪、糖类分解代谢的比率[17]。动物体内当蛋白质代谢占主导地位时,O∶N值通常较低。如果机体消耗的能量完全由蛋白质提供,O∶N值约为7;当7
3.2 亚硝酸盐氮对菲律宾蛤仔耗氧率的影响
亚硝酸盐氮是水产养殖中的常见污染物,在养殖环境中积累过量会降低养殖生物血液输送氧气的能力[21]。本研究中,菲律宾蛤仔“斑马蛤2号”和莆田群体的耗氧率随水中亚硝酸盐质量浓度的增加而升高,这可能是因为亚硝酸盐氮对菲律宾蛤仔产生胁迫作用,菲律宾蛤仔需要更多的能量来响应亚硝酸盐氮的胁迫,导致菲律宾蛤仔耗氧率增加。这说明水中高浓度的亚硝酸盐氮会对养殖生物的呼吸代谢造成严重影响。
3.3 低盐度和亚硝酸盐氮协同胁迫对菲律宾蛤仔呼吸代谢的影响
水环境因子变化影响贝类的呼吸代谢,亚硝酸盐氮和盐度是养殖水体中重要的环境因子,会影响生物的呼吸代谢功能。本研究中,首次进行了低盐度和亚硝酸盐氮协同对贝类呼吸代谢的影响试验,菲律宾蛤仔“斑马蛤2号”和莆田群体在低盐度(盐度15)和高亚硝酸盐氮(质量浓度0.60 mg/L)单因子及二者协同胁迫下均未出现死亡现象,但其耗氧率和排氨率出现明显变化,且二者协同胁迫下蛤仔的耗氧率明显大于单因子胁迫下的耗氧率。出现这种情况的原因,可能是双因子协同胁迫下,菲律宾蛤仔出现了更加明显的应激反应,需要消耗更多的溶解氧维持自身代谢需求。此外,通过分析低盐度和亚硝酸盐氮协同胁迫下菲律宾蛤仔的O∶N值可以看出,菲律宾蛤仔主要由脂肪或碳水化合物提供能量,表明低盐度和高亚硝酸盐氮质量浓度对菲律宾蛤仔呼吸代谢的影响更大。
菲律宾蛤仔的呼吸器官是鳃,在低盐度环境中会造成菲律宾蛤仔鳃丝连接松散、褶皱无法形成、纤毛运动停止和呼吸滤食受阻等[6]。本研究中,在低盐度和亚硝酸盐氮的协同作用下,菲律宾蛤仔“斑马蛤2号”和莆田群体出现了鳃丝呼吸上皮细胞脱落、鳃小片轻微肿胀、鳃小片上皮细胞排列发生紊乱和部分鳃丝出现皱缩等,说明低盐度和亚硝酸盐氮协同胁迫会对菲律宾蛤仔的呼吸器官产生不利影响。Galat等[22]研究发现,低盐度胁迫会使鲑(Salmo clarki)鳃上皮裂解、泌氯细胞增生。Stewart Fielder等[23]研究发现盐度胁迫会影响金头鲷(Pagrus auratus)鳃丝上泌氯细胞的数目和形态变化。宫春光等[24]发现,亚硝酸盐氮急性胁迫会造成斑尾复虾虎鱼(Synechogobius hasta)组织结构损伤,使其鳃丝充血,鳃小片上皮细胞增生等。上述研究均表明,盐度和亚硝酸盐氮会对水产动物的呼吸器官产生影响。
4 结论
1)低盐度和亚硝酸盐氮单因子均会对菲律宾蛤仔产生胁迫作用,两者协同对菲律宾蛤仔的胁迫作用大于单因子胁迫,且低盐度和高浓度亚硝酸盐氮协同胁迫对菲律宾蛤仔“斑马蛤2号”和莆田群体的耗氧率和排氨率的影响较大。
2)低盐度和亚硝酸盐氮协同造成菲律宾蛤仔鳃丝连接松散,说明低盐度和亚硝酸盐氮协同作用会对菲律宾蛤仔的呼吸器官产生不利影响。
[1] 桑士田,闫喜武,杨鹏,等.菲律宾蛤仔稚贝最适生长环境条件的响应面法分析[J].水产学报,2012,36(9):1410-1417.
SANG S T,YAN X W,YANG P,et al.Response surface methodology for optimization of growth condition in juvenile Ruditapes philippinarum[J].Journal of Fisheries of China,2012,36(9):1410-1417.(in Chinese)
[2] 范超,温子川,霍忠明,等.盐度胁迫对不同发育时期菲律宾蛤仔生长和存活的影响[J].大连海洋大学学报,2016,31(5):497-504.
FAN C,WEN Z C,HUO Z M,et al.Influence of salinity stress on growth and survival of Manila clam Ruditapes philippinarum at various developmental stages[J].Journal of Dalian Ocean University,2016,31(5):497-504.(in Chinese)
[3] VELEZ C,FIGUEIRA E,SOARES A M,et al.Combined effects of seawater acidification and salinity changes in Ruditapes philippinarum[J].Aquatic Toxicology,2016,176:141-150.
[4] 王贵宁,姜令绪,王韶华,等.盐度对菲律宾蛤仔摄食率和清滤率的影响[J].海洋科学,2010,34(6):6-8.
WANG G N,JIANG L X,WANG S H,et al.Influence of salinity on the ingestion rate and clearance rate of Ruditapes philippinarum[J].Marine Sciences,2010,34(6):6-8.(in Chinese)
[5] KIM W S,HUH H T,HUH S H,et al.Effects of salinity on endogenous rhythm of the Manila clam,Ruditapes philippinarum (Bivalvia:Veneridae)[J].Marine Biology,2001,138(1):157-162.
[6] 宋晓楠,马峻峰,秦艳杰,等.盐度骤降对菲律宾蛤仔抗氧化酶活力及组织结构的影响[J].农学学报,2013,3(1):50-56,70.
SONG X N,MA J F,QIN Y J,et al.Effects of abrupt decline in salinity on the antioxidant enzyme activities and histological structure in Ruditapes philippenarum[J].Journal of Agriculture,2013,3(1):50-56,70.(in Chinese)
[7] 杨东敏,张艳丽,丁鉴锋,等.高温、低盐对菲律宾蛤仔免疫能力的影响[J].大连海洋大学学报,2017,32(3):302-309.
YANG D M,ZHANG Y L,DING J F,et al.Synergistic effects of high temperature and low salinity on immunity of Manila clam Ruditapes philippinarum[J].Journal of Dalian Ocean University,2017,32(3):302-309.(in Chinese)
[8] 李忠帅,马甡,单洪伟,等.亚硝态氮胁迫下凡纳滨对虾体内亚硝态氮的积累与能量代谢响应[J].水产学报,2021,45(11):1825-1834.
LI Z S,MA S,SHAN H W,et al.Accumulation of nitrite and responses of energy metabolism exposed to nitrite stress in Litopenaeus vannamei[J].Journal of Fisheries of China,2021,45(11):1825-1834.(in Chinese)
[9] 方成,黎兰诗,梁震宇,等.不同浓度亚硝酸盐亚急性胁迫对凡纳滨对虾生长与免疫功能的影响[J].渔业科学进展,2022,43(4):180-189.
FANG C,LI L S,LIANG Z Y,et al.Changes in immune system and growth performance of Litopenaeus vannamei after 40-day challenge with different concentrations of nitrite[J].Progress in Fishery Sciences,2022,43(4):180-189.(in Chinese)
[10] 罗杰,陈加辉,刘楚吾.管角螺稚贝对亚硝酸盐耐受力研究[J].南方水产科学,2011,7(2):42-48.
LUO J,CHEN J H,LIU C W.Study on tolerance of Hemifusus tuba juvenile at to nitrite[J].South China Fisheries Science,2011,7(2):42-48.(in Chinese)
[11] LV J,CAO T,JI C,et al.Digital gene expression analysis in the gills of Ruditapes philippinarum after nitrite exposure[J].Ecotoxicology and Environmental Safety,2019,184:109661.
[12] 陈震楠,刘念,张跃环,等.亚硝酸态氮对菲律宾蛤仔浮游幼虫及幼贝的急性毒性[J].大连海洋大学学报,2019,34(3):399-404.
CHEN Z N,LIU N,ZHANG Y H,et al.Acute toxicity of nitrite nitrogen to planktonic larvae and juveiles of Manila clam Ruditapes philippinarum[J].Journal of Dalian Ocean University,2019,34(3):399-404.(in Chinese)
[13] 蔡星媛,张秀梅,田璐,等.盐度胁迫对魁蚶稚贝血淋巴渗透压及鳃Na+/K+-ATP酶活力的影响[J].南方水产科学,2015,11(2):12-19.
CAI X Y,ZHANG X M,TIAN L,et al.Effect of salinity stress on hemolymph osmolality and gill Na+/K+-ATPase activity of juvenile ark shell(Anadara broughtonii)[J].South China Fisheries Science,2015,11(2):12-19.(in Chinese)
[14] 王刚,张其中,喻子牛,等.盐度对近江牡蛎耗氧率、排氨率、O∶N和吸收率的影响[J].海洋科学,2013,37(2):101-106.
WANG G,ZHANG Q Z,YU Z N,et al.Effects of sanility on oxygen consumption,ammonia-N excretion rate,O∶N and absorption efficiency of Crassostrea hongkongensis[J].Marine Sciences,2013,37(2):101-106.(in Chinese)
[15] NAVARRO J M.The effects of salinity on the physiological ecology of Choromytilus chorus (Molina,1782) (Bivalvia:Mytilidae)[J].Journal of Experimental Marine Biology and Ecology,1988,122(1):19-33.
[16] 丁天扬,白奕天,聂鸿涛,等.低温和低盐胁迫对文蛤呼吸和排泄的影响[J].水产学杂志,2019,32(1):28-32.
DING T Y,BAI Y T,NIE H T,et al.Effects of low temperature and low salinity on oxygen consumption rate and ammonia excretion rate of Venus clam Meretrix meretrix[J].Chinese Journal of Fisheries,2019,32(1):28-32.(in Chinese)
[17] 郝振林,丁君,贲月,等.高温对虾夷扇贝存活率、耗氧率和排氨率的影响[J].大连海洋大学学报,2013,28(2):138-142.
HAO Z L,DING J,BEN Y,et al.Effect of high temperature on survival,oxygen consumption and ammonia-N excretion in yesso scallop Mizuhopecten yessoensis[J].Journal of Dalian Ocean University,2013,28(2):138-142.(in Chinese)
[18] BOUGRIER S,GEAIRON P,DESLOUS-PAOLI J M,et al.Allometric relationships and effects of temperature on clearance and oxygen consumption rates of Crassostrea gigas (Thunberg)[J].Aquaculture,1995,134(1/2):143-154.
[19] 吴文广,张继红,方建光等.盐度对不同规格泥螺耗氧率和排氨率的影响[J].生态学杂志,2013,32(9):2457-2461。
WU W G,ZHANG J H,FANG J G,et al.Effects of salinity on oxygen consumption and ammonia excretion rate of different sizes of Bullacta exarata[J].Chinese Journal of Ecology,2013,32(9):2457-2461.(in Chinese)
[20] 王冲,孙同秋,王玉清,等.温度和盐度对毛蚶耗氧率和排氨率的影响[J].海洋湖沼通报,2018(1):110-115.
WANG C,SUN T Q,WANG Y Q,et al.Influences of temperature and salinity on oxygen consumption and ammonia excretion rates of Scapharca subcrenata[J].Transactions of Oceanology and Limnology,2018(1):110-115.(in Chinese)
[21] 宋萍.养殖水体中亚硝酸盐的形成原因及解决方法[J].科学养鱼,2012(9):91.
SONG P.Causes and solutions of nitrite formation in aquaculture water[J].Scientific Fish Farming,2012(9):91.(in Chinese)
[22] GALAT D L,POST G,KEEFE T J,et al.Histological changes in the gill,kidney and liver of Lahontan cutthroat trout,Salmo clarki henshawi,living in lakes of different salinity-alkalinity[J].Journal of Fish Biology,1985,27(5):533-552.
[23] STEWART FIELDER D,ALLAN G L,PEPPERALL D,et al.The effects of changes in salinity on osmoregulation and chloride cell morphology of juvenile Australian snapper,Pagrus auratus[J].Aquaculture,2007,272(1/2/3/4):656-666.
[24] 宫春光,张薇,张建业,等.亚硝酸盐氮急性胁迫对斑尾复鰕虎鱼组织结构的影响[J].河北渔业,2018(8):11-13.
GONG C G,ZHANG W,ZHANG J Y,et al.Effect of acute nitrite nitrogen stress on the tissue structure of spotted-tailed tiger fish[J].Hebei Fisheries,2018(8):11-13.(in Chinese)