大口黑鲈(Micropterus salmoides)自20世纪80年代引入中国以后,养殖规模逐渐扩大,现已成为中国第十大淡水养殖鱼类[1]。然而,在养殖过程中一些疾病也陆续出现,其中,大口黑鲈蛙虹彩病毒(Largemouth bass ranavirus,LMBV)是影响较大的病毒性病害之一。该病毒于1996年被Plumb等[2]分离和鉴定,并被归为虹彩病毒科,后来经过遗传分析证实该毒株为LMBV[3]。2009年邓国成等[4]首次报道了由虹彩病毒引起的大口黑鲈溃疡病,经电镜观察和序列分析确定为LMBV。虽然LMBV已出现多年,但至今尚无有效的预防和治疗药物。
疫苗免疫是进行病毒性疾病预防最具性价比的手段之一。LMBV相关疫苗,如灭活疫苗[5]、核酸疫苗[6]和亚单位疫苗[7]等已开展研究,并表现出了一定的免疫保护率。Yi等[6]构建的基于MCP基因的大口黑鲈DNA疫苗免疫保护率为63%,Jia等[7]研制的甘露糖修饰MCP亚单位疫苗免疫保护率达到78.94%。然而,针对LMBV的弱毒疫苗目前尚未见报道。LMBV的致弱通常以传代致弱或者毒力基因的敲除为主要手段。通过在培养细胞中连续传代致弱,是进行病毒减毒最常见的方法,病毒在培养细胞的多次传代过程中,常导致病毒基因中一个或多个突变的积累,从而导致减毒[8]。
病毒传代致弱已在水产和畜禽弱毒疫苗研究中被广泛应用。通过查阅文献发现4个LMBV潜在的毒力基因,即E3、TNFR[9]、ICP18[10]和ICP46[11],根据NCBI已公布的蛙虹彩病毒全基因组中毒力基因序列,LMBV ORF046与预测的E3泛素连接酶(predicted E3 ubiquitin ligase domai,E3)结构域的同源性较高,LMBV ORF057与肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)结构域的同源性较高,LMBV ORF018与蛙虹彩病毒的感染细胞多肽ICP18(infected cell polypeptides 18)的同源性较高,LMBV ORF087与预测的感染细胞多肽ICP46的同源性较高。本研究中,通过对LMBV分离株LMBV-ZJDSS进行连续传代培养,对不同代次的毒株进行致病性比较、体外生长特性及组织分布研究,以期为LMBV弱毒疫苗研究提供科学参考。
1 材料与方法
1.1 材料
健康大口黑鲈体质量为(14±2)g,取自浙江省淡水水产研究所八里店基地。暂养两周,水温为28 ℃,pH为7.65,每日投喂两次商品鲈饲料,且摄食良好。试验前随机抽取10尾鱼检测其LMBV、传染性脾肾坏死病毒和弹状病毒,确保均为阴性。EPC细胞、大口黑鲈LMBV-ZJDSS毒株由浙江省淡水水产研究所鱼病室保存。
新生牛血清购自内蒙古金源康生物工程有限公司,M199 培养基购自美国 Gibco 公司,青霉素、链霉素和 PBS 均购自北京索莱宝科技有限公司,2×Flash Hot Start MasterMix(Dye)购自康为世纪生物科技股份有限公司,2×SuperReal PreMix(Probe)购自天根生化科技(北京)有限公司,磁珠法核酸提取试剂盒(AS214)购自洛阳爱森生物科技有限公司。
1.2 方法
1.2.1 引物设计与合成 根据NCBI登录的LMBV Alleghany 12-343株(GenBank:MK681855.1)的全基因组,设计扩增E3、TNFR、ICP18和ICP46基因的引物(表1),并由浙江尚亚生物技术公司合成。
表1 LMBV引物探针序列信息
Tab.1 LMBV primers and primer sequence for gene amplification

引物 primer序列 sequence(5′-3′)用途 useLMBV-E3-1426F:CTTTCACAAACTATTGGACACGR:TCTGATGAAGGGTTCTCAAGTC扩增E3LMBV-TNFR-1157F:CCAAGTTGTCTAAGACCATGCR:CTGTAATCTGCGTCCACCA扩增TNFRLMBV-ICP18-704F:GCACGCTTATCAGAAACAGACR:CCTCGGCTAAAATGGACTAC扩增ICP18LMBV-ICP46-1493F:GGCCATCAACCACAACATTR:CGCTCCTACGCCAACTAAA扩增ICP146LMBV-Tq102F:ACTGGCCACCACCTCTACTCR:AGACACGTTGATGCTTGCGTTqMAN:FAM-ACGCCCTGAGCCTC- AACGATCC-BHQ1qPCR
1.2.2 LMBV-ZJDSS传代 EPC细胞采用含10%血清和1%双抗(均为体积分数,下同)的M199培养基于24 ℃培养箱中培养。铺满单层后,弃培养液,接入病毒液1 mL,24 ℃培养箱孵育1 h后,吸出病毒液,加入细胞维持液(含2%血清和1%双抗的M199培养基),于24 ℃培养,每日观察细胞病变效应 (cytopathic effect,CPE)情况,待CPE达到80%时,收集病毒液,于-80 ℃超低温冰箱中保存。
进行病毒传代时,将上一代次的病毒液冻融两次后,4 ℃下以8 000 r/min离心10 min,取上清液用0.45 μm滤器过滤,接种EPC细胞进行病毒培养和传代,每隔5代保存在液氮中备用,对F5、F35和F65代毒株进行特性与毒力测定。
1.2.3 不同代次毒株的生长动力学曲线 取浓度为108.5 TCID50/mL LMBV-ZJDSS的F5、F35和F65代毒株,分别接种于12孔板铺满单层的EPC细胞中,150 μL/孔,24 ℃培养箱孵育1 h,吸出病毒液,接入细胞维持液(2 mL/孔)。定时用显微镜观察细胞病变形态并拍照记录,分别在1、6、12、24、36、48、72、96、120、144、168 h取病毒培养上清液,每个时间点取3个平行样,按照Reed-Muench法计算TCID50,并绘制生长动力学曲线。
1.2.4 不同代次毒株致病力的测定 取140尾健康大口黑鲈分为7组,包括6个试验组和1个对照组,每组20尾。6个试验组分别用3个代次毒株的两种浓度进行攻毒,两种攻毒浓度分别为108.5 、109.5 TCID50/mL,攻毒剂量为0.1 mL/尾,对照组注射等量EPC细胞液,攻毒方式为腹腔注射。攻毒后每日早、晚观察,共观察15 d,并记录大口黑鲈死亡率。
1.2.5 不同代次毒株在大口黑鲈器官组织中的分布 取50尾健康大口黑鲈分为两组,分别用F5和F65代毒株进行攻毒,浓度均为108.5 TCID50/mL,攻毒剂量为0.1 mL/尾,且在攻毒后的4、8、12、24、48、72、96、120 h分别取两个攻毒组鱼的肝、脾、肾、鳃、肠、脑和心组织,每个组织大约取50 mg,每次随机选取3尾鱼,将各个组织加入无菌PBS中进行研磨,采用磁珠法核酸提取试剂盒(AS214)提取DNA,测量DNA浓度,并将提取的DNA作为模板,用qPCR方法检测病毒载量。
1.2.6 LMBV-ZJDSS不同代次全基因组测序 将LMBV-ZJDSS第5代和第65代毒株进行扩大培养,收集病毒液,冻融3次,以12 000 r/min离心45 min,取上清液,再将病毒液加入50 mL离心管中,离心管中提前加入配制好的质量分数为30%的蔗糖溶液5 mL,配平后放入超速冷冻离心机中,4 ℃下以50 000 r/min离心3 h。离心完成后立即取出离心管,弃上清液,用150 μL无菌PBS冲洗管壁,悬浮病毒液,提取病毒DNA,送浙江尚亚生物技术公司进行二代测序,并分析不同代次毒株基因组的差异性。
1.2.7 不同地区毒力基因序列分析 筛选4个蛙虹彩病毒毒力相关基因(E3、TNFR、ICP18和ICP46),其中,ly20912-14、ly20918-23、ly20918-25和ly20918-15为本实验室分离并保存,Pine 14-204(登录号:MK681856)、Alleghany 12-343(登录号:MK681856)和NH-1609(登录号:MG941005)序列参考NCBI数据库(表2),通过设计引物(表1),对来自不同地区的临床LMBV阳性样品进行4个基因的扩增。反应程序:95 ℃下预变性5 min;94 ℃下变性30 s,52 ℃下退火30 s,72 ℃下延伸100 s,共进行35个循环;最后在72 ℃下再延伸5 min。 PCR产物送浙江尚亚生物技术有限公司进行测序,并对4个毒力基因编码蛋白采用MAGA 11软件进行比对分析。
表2 不同代次基因组差异
Tab.2 Genomic differences among different generations
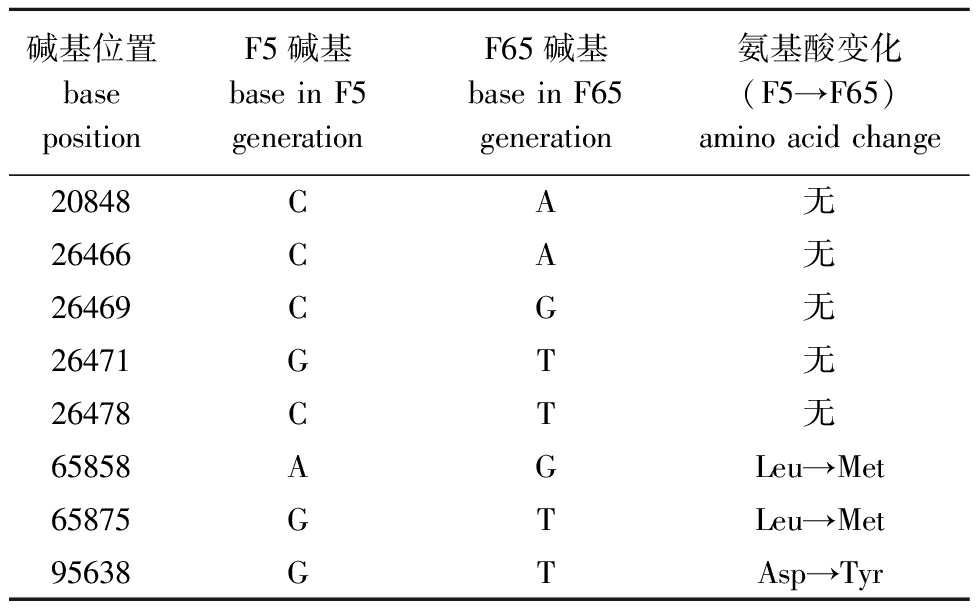
碱基位置base positionF5碱基 base in F5 generation F65碱基 base in F65generation 氨基酸变化(F5→F65)amino acid change20848CA无26466CA无26469CG无26471GT无26478CT无65858AGLeu→Met65875GTLeu→Met95638GTAsp→Tyr
表2 蛙虹彩病毒毒株样品编号及来源
Tab.2 Sample numbering and origin of LMBV
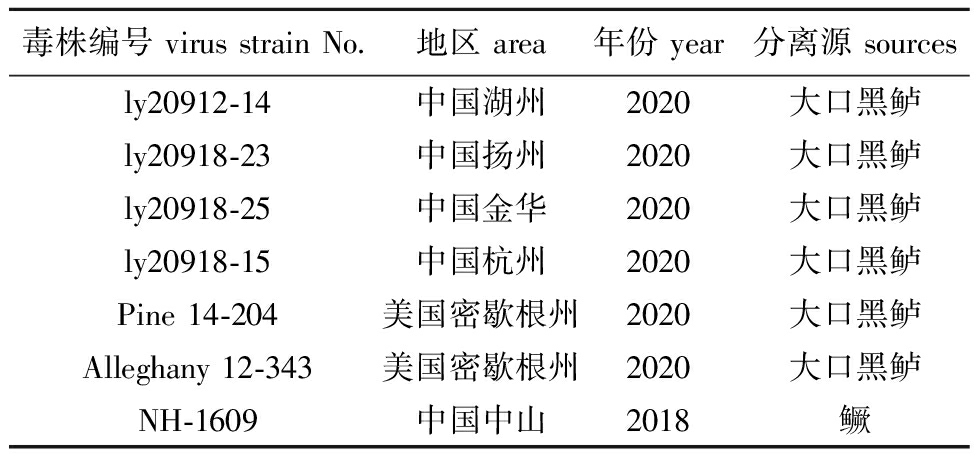
毒株编号 virus strain No.地区 area年份 year分离源 sources ly20912-14中国湖州2020大口黑鲈ly20918-23中国扬州2020大口黑鲈ly20918-25中国金华2020大口黑鲈ly20918-15中国杭州2020大口黑鲈Pine 14-204美国密歇根州2020大口黑鲈Alleghany 12-343美国密歇根州2020大口黑鲈NH-1609中国中山2018鳜
2 结果与分析
2.1 不同代次毒株致细胞病变能力比较
将LMBV-ZJDSS毒株在EPC细胞中进行传代,图1为F5、F35和F65代毒株接种EPC细胞后在48 h产生的CPE特征,随着传代次数的增加,出现CPE的时间变短。这表明,LMBV-ZJDSS毒株在相同病毒滴度下,F65和F35代毒株比F5代毒株表现出更强的致细胞病变能力。
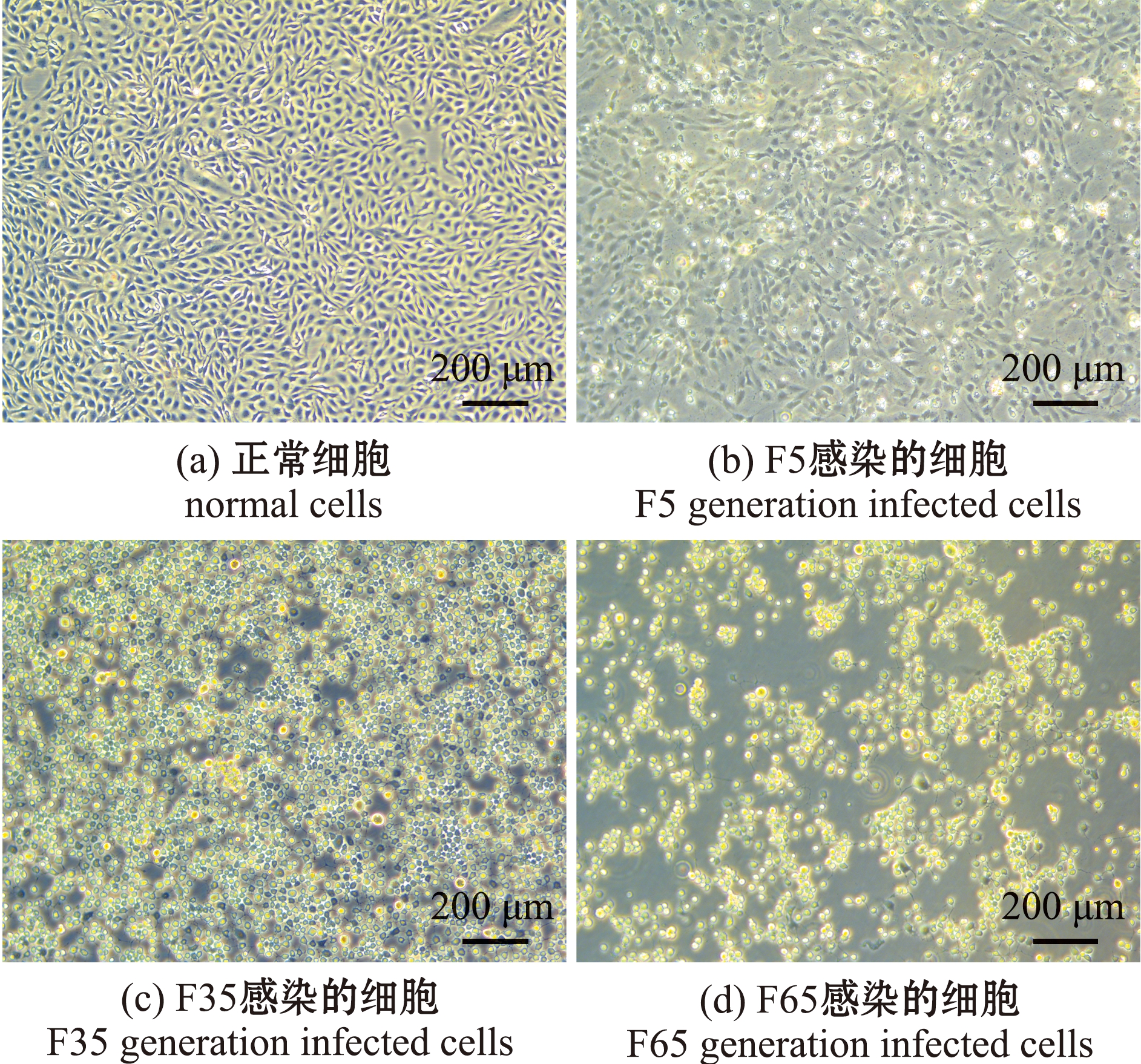
图1 不同代次毒株感染48 h后细胞的病变差异
Fig.1 Difference in cytopathic effect caused by different generations of virus strains for 48 h infection in vitro
2.2 不同代次毒株的生长动力学曲线
通过病毒的复制动力学曲线来比较不同代次LMBV的增值特性。从图2可见:3个代次毒株的复制趋势基本一致;3个代次毒株均在48~72 h时达到病毒最高滴度,其中,F5代毒株在72 h时达到最高滴度,为109.5 TCID50 /mL,F35代和F65代均在36~72 h时达到最高滴度(分别为109.6 、109.8 TCID50/mL);在病毒培养过程中,F5代在24 h时病毒滴度超过了F35和F65代,但在48 h时病毒滴度却低于F35和F65代。
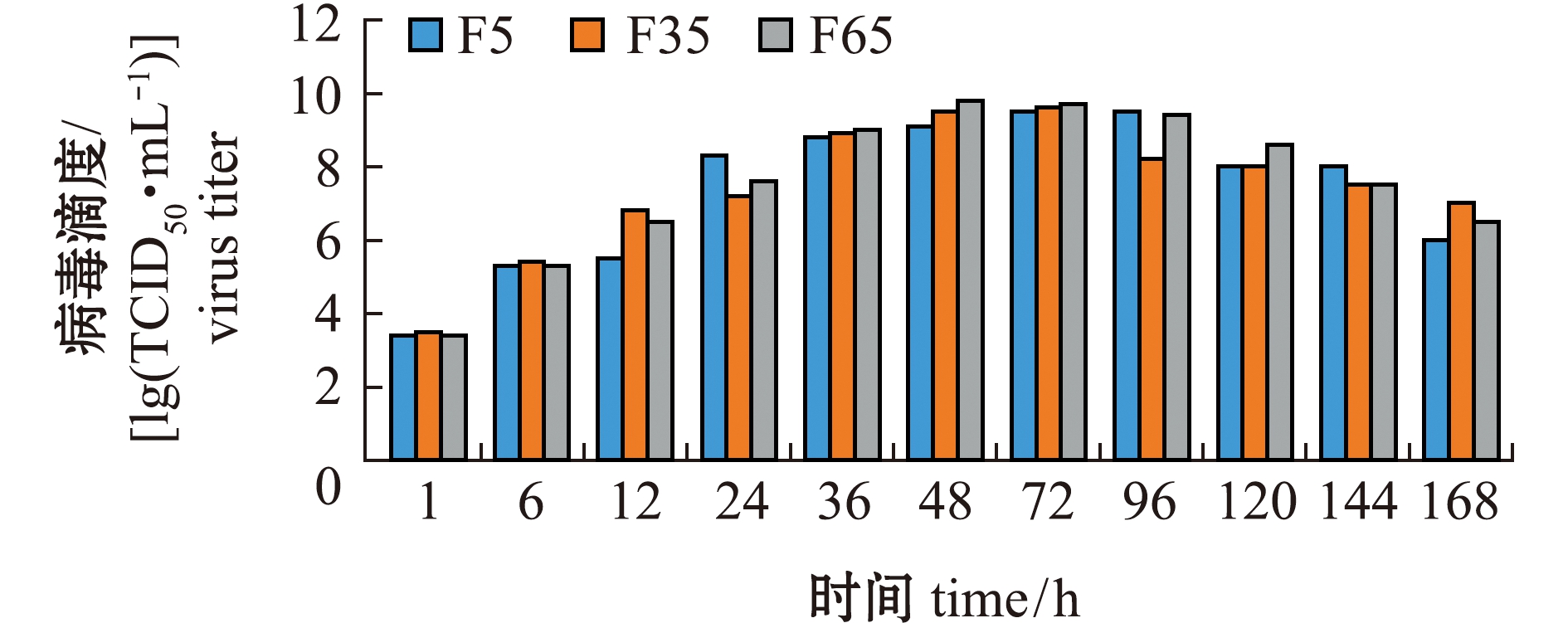
图2 不同代次毒株的体外生长特性
Fig.2 Growth curves of different generations of virus strains in vitro
2.3 不同代次毒株对大口黑鲈的致病力比较
从图3可见:在相同攻毒浓度下,高代次毒株表现出更低的毒力;当F5、F35和F65代毒株攻毒浓度为108.5 TCID50/mL时,攻毒后15 d内,大口黑鲈死亡率分别为60%、25%和5%,而当F5、F35和F65攻毒浓度为109.5 TCID50/mL时,大口黑鲈死亡率分别为90%、70%和10%。这表明,LMBV病毒传代可引起病毒对宿主致病力的减弱。
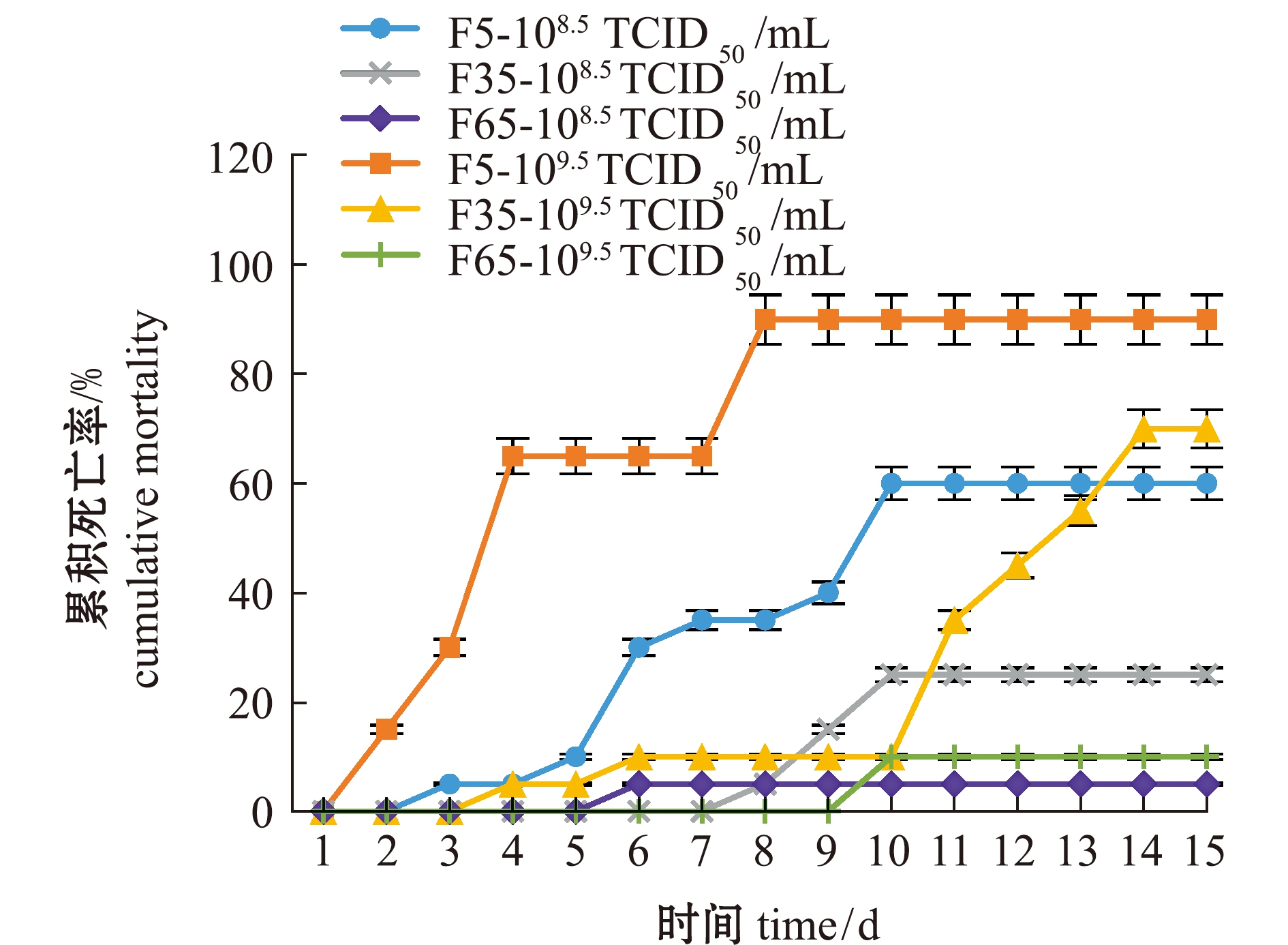
图3 不同代次毒株的致病性比较
Fig.3 Comparison of pathogenicity among different generations of virus strains
2.4 不同代次毒株在大口黑鲈器官组织中的分布
F5和F65代毒株均以108.5 TCID50/mL浓度感染大口黑鲈后,对不同感染时间不同组织中的病毒含量进行测定(图4(a)~(g)),结果显示,F5代毒株在感染大口黑鲈后4 h时就可在各脏器中被检出,而F65代毒株在感染后8 h时才被检出,表明F5代毒株在体内复制更为迅速。
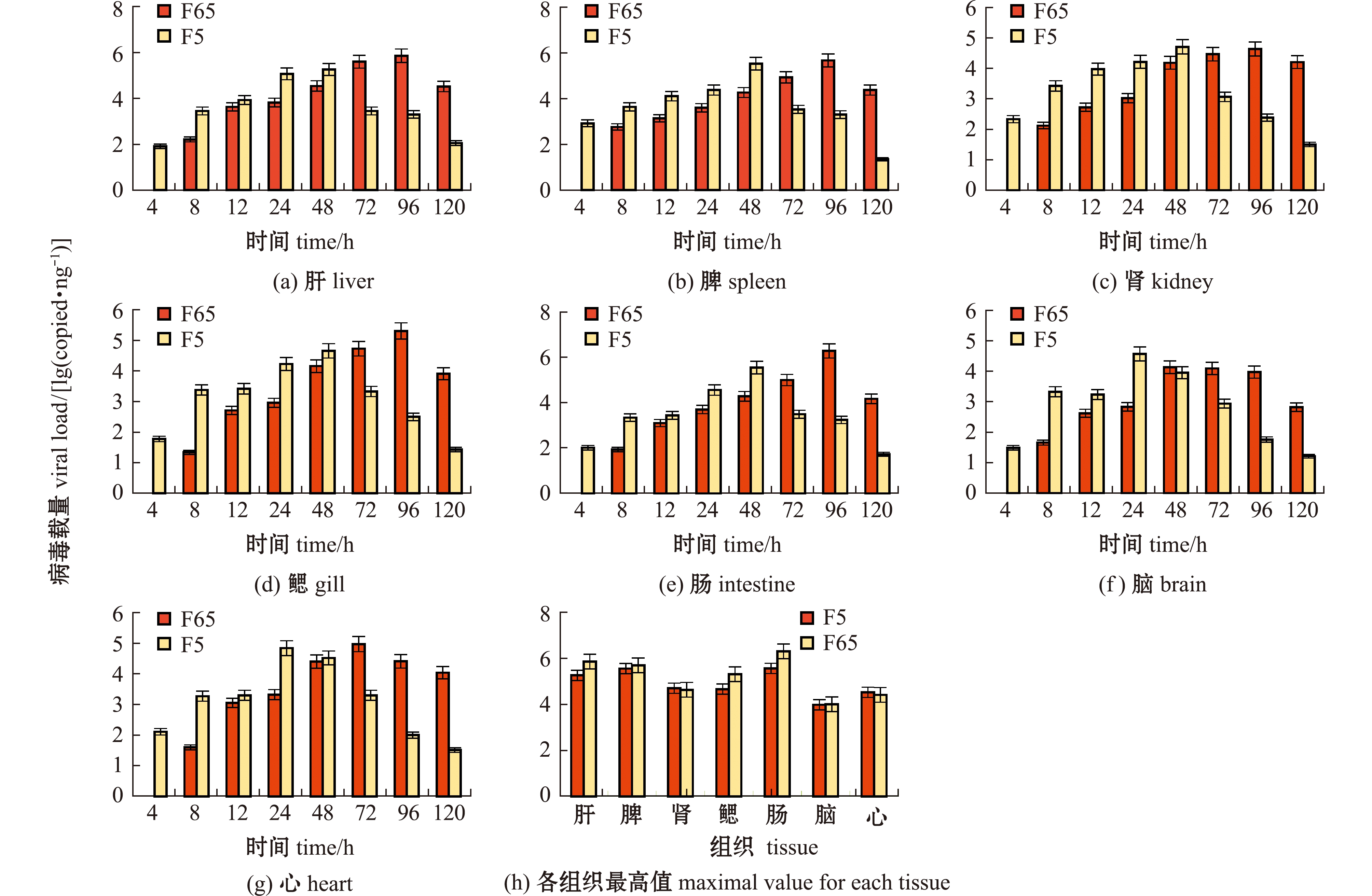
图4 不同代次毒株感染大口黑鲈后各组织中病毒载量的变化
Fig.4 Changes in viral load in tissues and organs of Micropterus salmoides after infection with different generations of virus strains
大口黑鲈被感染后不同组织中,F5代毒株在24~48 h时达到最高病毒载量,而F65代毒株在72~96 h时出现病毒载量峰值,F5代和F65代病毒载量最高的组织均为肠道组织,病毒载量分别达到105.6 copies/ng和106.3 copies/ng;两个代次毒株载量在达到最高值后均开始下降(图4(h))。
2.5 LMBV-ZJDSS不同代次基因组差异分析
采用二代测序技术进行病毒文库序列测定,通过ORF预测与筛选,共获得85个编码框。F65相对于F5代毒株,变异点有8处,其中有3处可以引起氨基酸的改变,2处在ORF 069R区域,氨基酸由亮氨酸变为甲硫氨酸,其编码的蛋白为神经丝三联体h1样蛋白(neurofilament triplet h1-like protein);1处在ORF 102L区域,第37位氨基酸由天冬氨酸变为酪氨酸,其编码的蛋白为感染细胞多肽ICP46(表2)。
2.6 不同地区毒力基因的序列分析
通过对不同地区的7个LMBV阳性组织样品进行4个毒力基因的扩增与测序,结果表明,E3基因编码区在所有临床毒株中序列完全相同(图5(a)),与LMBV中国鳜分离株NH-1609(MG941005)完全一致,与LMBV美国分离株Pine 14-204(MK681856)和Alleghany 12-343(MK681856)仅相差一个碱基。
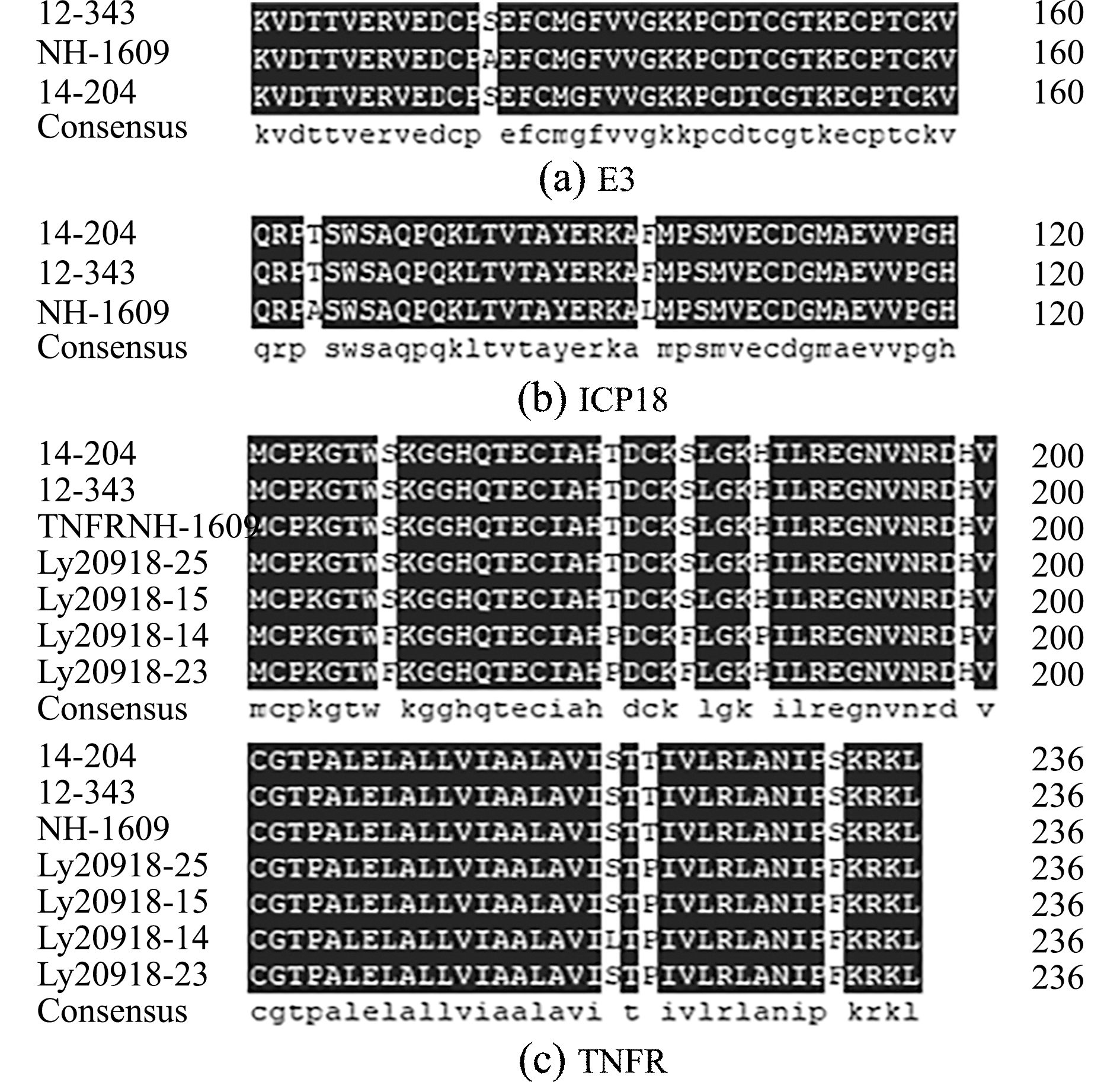
图5 E3、TNFR和ICP18氨基酸序列的比对
Fig.5 Amino acid sequence alignment of E3,TNFR and ICP18
ICP18基因编码区序列比较发现,国内的毒株序列完全一致(图5(b)),与美国株Pine 14-204株和Alleghany 12-343株相比,有7个位点的差异,其中2个位点是非同义变异,出现在第84位和103位,国内流行株分别为丙氨酸和亮氨酸,美国株为苏氨酸和苯丙氨酸。而ICP46基因编码区国内外的毒株序列完全相同(氨基酸序列图略)。
TNFR基因编码区表现出了较多的变异位点(图5(c)),共有13个变异位点,13处变异位点均出现在不同的中国分离株中,其中,5处为同义变异,8处变异可引起氨基酸的改变,NH-1609株第168、180、184、188、199、220、222和232位氨基酸分别为丝氨酸、苏氨酸、苏氨酸、组氨酸、组氨酸、丝氨酸、丝氨酸和苏氨酸,ly20912-14株第178、180、184、188、199、220、222和232位氨基酸分别为苯丙氨酸、脯氨酸、苯丙氨酸、脯氨酸、脯氨酸、亮氨酸、脯氨酸和苯丙氨酸,ly20918-23株第168、180、184、222和232位氨基酸分别为苯丙氨酸、脯氨酸、苯丙氨酸、脯氨酸和苯丙氨酸,ly20918-15株和ly20918-25株第222和232位氨基酸分别为脯氨酸和苯丙氨酸。
3 讨论
3.1 病毒在体外的连续传代
蛙病毒是属于虹彩病毒科的一种DNA病毒,虹彩病毒科包括7个属,分别为蛙病毒属(Ranavirus)、细胞肿大病毒属(Megalocytivirus)、淋巴囊肿病毒属 (Lymphocystivirus)、水蚤虹彩病毒属(Daphniairidovirus)、虹彩病毒属(Iridovirus)和绿虹彩病毒属(Chloriridovirus),以及近年发现的十足目虹彩病毒属(Decapodiridovirus)[12]。蛙虹彩病毒的感染范围非常广泛,可以感染鱼类,如鲈和褐篮子鱼[13],还可以感染两栖类,如蝾螈和牛蛙。其中,LMBV自2009年在国内首次出现之后,在国内各地均有发现,对养殖户造成了较大的经济损失。本实验室分离了一株LMBV,将该毒株在EPC细胞上进行连续传代致弱,目前已经传到第65代,并将其与第5代和第35代毒株进行体外生长特性比较,结果表明,在连续传代的过程中,增加了病毒的细胞适应性,导致细胞病变的速度变快,当病毒培养液达到最高病毒滴度时,被感染细胞释放到上清液中的病毒粒子与上清液中失活的病毒粒子数量达到平衡,上清液中具有感染性病毒的数量达到最高值,此刻为最佳收获病毒时间,而不同代次病毒的最高滴度并不会出现较大差异。本试验中,通过腹腔注射的方式用3个代次的毒株感染大口黑鲈,每个代次分为两个攻毒浓度,对其感染的大口黑鲈进行为期15 d的观察,发现F65代毒株感染的大口黑鲈死亡率要低于F5和F35代,这说明在连续传代过程中,病毒的毒力有所减弱,也为病毒的减毒活疫苗开发提供了有益参考。
3.2 LMBV在大口黑鲈各器官组织中的分布
为比较LMBV不同代次毒株的感染性,笔者在对大口黑鲈攻毒试验过程中,通过荧光定量检测出LMBV在大口黑鲈各个器官组织中均存在,其中,肠的病毒载量最高,肝脏和脾脏的病毒载量也较高。F5代毒株攻毒后,在48 h内各组织中病毒载量达到高峰期,之后病毒载量逐渐降低,而F65代毒株攻毒后,在96 h内各组织中病毒载量达到高峰期。杨展展等[14]对LMBV在大口黑鲈体内的动态分布研究表明,心脏在攻毒后4 h检测出病毒,而肠、脑和鳃在攻毒24 h后才检测出病毒,心脏的病毒载量最高。此结果与本试验结果存在一定的差异,可能与攻毒时鱼体大小、病毒的浓度及攻毒剂量有关。刘丹等[15]对大鲵蛙病毒(CGSRV)在体内组织分布的研究表明,在各个组织中均能检测到病毒,其中,肝脏中的病毒载量最高。彭超等[16]运用原位杂交和荧光定量方法,对人工感染蛙病毒(FV3)后鞍带石斑鱼体内不同组织中的分布进行分析,原位杂交结果表明,脾脏和肝脏都有信号,而脑组织中无信号;荧光定量结果表明,脾脏、肾脏和心脏的病毒载量最多。Cunningham等[17]研究表明,林蛙感染FV3后,肝脏和肾脏中的病毒载量较高。综上所述,蛙病毒的感染性较强,可以侵染到宿主的各个器官组织且感染范围广,对很多物种都具有感染性。同时,通过病毒的连续传代,病毒侵染大口黑鲈的速度逐渐变慢。
3.3 不同代次毒力基因差异比较
为比较不同地区LMBV毒力基因的差异及其遗传稳定性,本研究中,对不同地区毒力基因序列进行比对,结果表明,E3与NCBI上的中国株序列一致,与美国株仅有一个碱基差异;ICP18与美国株相比,仅有2处变异;TNFR与美国株相比,有1处变异点,但在国内株之间出现了8个变异点;ICP46与国内外毒株则无任何变异点。TNFR变异点较多的原因,可能是病毒宿主所处的地域不同所致,E3与ICP18出现的变异点可能是国内外毒株的差异[18]。至于变异点突变前后的氨基酸,表达出的蛋白质功能是否相同,还有待进一步研究。TNFR样病毒因子在淋巴囊肿病毒中被认为是一种病毒感受器,其可以与鱼类细胞因子TNF结合,并中和其作用[19]。ICP18与ICP46是虹彩病毒科蛙病毒属的核心基因之一,都属于立即早期基因(immediate early gene,IE),IE基因转录后产生的病毒蛋白对病毒复制和细胞周期进程具有重要影响[20]。本研究中,对不同代次毒株全基因组序列分析结果表明,F65代毒株与F35代毒株相比,编码ICP46的一个氨基酸发生突变,此突变可能导致ICP46的功能发生改变,使毒株毒力减弱。夏立群等[21]对SGIV ICP46中一段富含亮氨酸的潜在核输出信号进行研究,发现NES对ICP46输出细胞核具有决定性作用。随着对LMBV的不断研究,也发现了一些新的问题,毒力减弱后的毒株是否还保留免疫原性,是否可以作为减毒活疫苗候选毒株,本研究中选择的4个毒力基因是否为LMBV的必需毒力基因,这些问题将在后续试验中进行验证。
4 结论
1)通过对LMBV的连续传代,并将不同代次毒株进行体外生长特性、致病性、感染大口黑鲈后病毒在组织内的载量变化及全基因组测序分析,表明随着病毒代次的增高,病毒的毒力下降,致病性降低,病毒载量在组织内达到峰值的时间变慢。
2)通过对LMBV传代致弱进行研究,表明高代次基因组氨基酸的改变可能是毒株毒力下降的原因,而不同地区毒株毒力基因的差异主要集中在TNFR基因上。
[1] COYLE S D,TIDWELL J H,WEBSTER C D.Response of largemouth bass Micropterus salmoides to dietary supplementation of lysine,methionine,and highly unsaturated fatty acids[J].Journal of the World Aquaculture Society,2000,31(1):89-95.
[2] PLUMB J A,GRIZZLE J M,YOUNG H E,et al.An Iridovirus isolated from wild largemouth bass[J].Journal of Aquatic Animal Health,1996,8(4):265-270.
[3] PIASKOSKI T O,PLUMB J A,ROBERTS S R.Characterization of the largemouth bass virus in cell culture[J].Journal of Aquatic Animal Health,1999,11(1):45-51.
[4] 邓国成,谢骏,李胜杰,等.大口黑鲈病毒性溃疡病病原的分离和鉴定[J].水产学报,2009,33(5):871-877.
DENG G C,XIE J,LI S J,et al.Isolation and preliminary identification of the pathogen from largemouth bass ulcerative syndrome[J].Journal of Fisheries of China,2009,33(5):871-877.(in Chinese)
[5] 吕顺友.大口黑鲈虹彩病毒LMBV灭活疫苗制备及石斑鱼干扰素刺激基因EcfinTRIM82的功能分析[D].广州:华南农业大学,2019.
LÜ S Y.Preparation of largemouth bass virus inactivated vaccine and functional analysis of interferon-stimulating gene EcfinTRIM82 in grouper,Epinephelus coioides[D].Guangzhou:South China Agricultural University,2019.(in Chinese)
[6] YI W Y,ZHANG X,ZENG K,et al.Construction of a DNA vaccine and its protective effect on largemouth bass (Micropterus salmoides) challenged with largemouth bass virus (LMBV)[J].Fish &Shellfish Immunology,2020,106:103-109.
[7] JIA Y J,XIA J Y,JIANG F Y,et al.Antigenic epitope screening and functional modification of mannose enhance the efficacy of largemouth bass virus subunit vaccines[J].Journal of Fish Diseases,2022,45(11):1635-1643.
[8] LIU F X,WU X D,LI L,et al.Evolutionary characteristics of morbilliviruses during serial passages in vitro:gradual attenuation of virus virulence[J].Comparative Immunology,Microbiology and Infectious Diseases,2016,47:7-18.
[9] TSAI C T,TING J W,WU M H,et al.Complete genome sequence of the grouper iridovirus and comparison of genomic organization with those of other iridoviruses[J].Journal of Virology,2005,79(4):2010-2023.
[10] XIA L Q,CAO J H,HUANG X H,et al.Characterization of Singapore grouper iridovirus (SGIV) ORF086R,a putative homolog of ICP18 involved in cell growth control and virus replication[J].Archives of Virology,2009,154(9):1409-1416.
[11] EATON H E,METCALF J,PENNY E,et al.Comparative genomic analysis of the family Iridoviridae:re-annotating and defining the core set of iridovirus genes[J].Virology Journal,2007,4:11.
[12] 董寒旭,曾伟伟.大口黑鲈蛙虹彩病毒病研究进展[J].病毒学报,2022,38(3):746-756.
DONG H X,ZENG W W.Research progress on largemouth bass Ranavirus disease[J].Chinese Journal of Virology,2022,38(3):746-756.(in Chinese)
[13] 雷燕,戚瑞荣,唐绍林,等.褐篮子鱼虹彩病毒病的诊断[J].大连海洋大学学报,2014,29(3):236-240.
LEI Y,QI R R,TANG S L,et al.Diagnosis of iridovirus disease in spinefoot Siganus fuscescens[J].Journal of Dalian Ocean University,2014,29(3):236-240.(in Chinese)
[14] 杨展展,林强,付小哲,等.大口黑鲈蛙病毒分子流行病学及组织病理分析[J].水产学报,2022,46(6):1063-1073.
YANG Z Z,LIN Q,FU X Z,et al.Molecular epidemiology and histopathological analysis of largemouth bass ranavirus[J].Journal of Fisheries of China,2022,46(6):1063-1073.(in Chinese)
[15] 刘丹,耿毅,汪开毓,等.大鲵蛙病毒感染大鲵的动态病理损伤及病原的组织分布[J].中国水产科学,2017,24(1):146-155.
LIU D,GENG Y,WANG K Y,et al.Dynamic pathological lesions and tissue distribution of Chinese giant salamanders infected with CGSRV[J].Journal of Fishery Sciences of China,2017,24(1):146-155.(in Chinese)
[16] 彭超,马红玲,郭志勋,等.石斑鱼蛙病毒在鞍带石斑鱼中的组织分布[J].南方水产科学,2015,11(3):88-94.
PENG C,MA H L,GUO Z X,et al.Tissue distribution of grouper iridovirus genus Ranavirus in infected farmed juvenile giant grouper (Epinephelus lanceolatus)[J].South China Fisheries Science,2015,11(3):88-94.(in Chinese)
[17] CUNNINGHAM A A,TEMS C A,RUSSELL P H.Immunohistochemical demonstration of Ranavirus antigen in the tissues of infected frogs (Rana temporaria) with systemic haemorrhagic or cutaneous ulcerative disease[J].Journal of Comparative Pathology,2008,138(1):3-11.
[18] 黄友华,孙伟,张奇亚.淋巴囊肿病毒中国株TNFR类似物的原核表达与结构分析[J].中国病毒学,2005,20(6):652-655.
HUANG Y H,SUN W,ZHANG Q Y.Analysis and expression of tumor necrosis factor receptor homolog from LCDV-C[J].Virologica Sinica,2005,20(6):652-655.(in Chinese)
[19] ESSBAUER S,FISCHER U,BERGMANN S,et al.Investigations on the ORF 167L of lymphocystis disease virus (Iridoviridae)[J].Virus Genes,2004,28(1):19-39.
[20] BERNARD M,SHISLER J L.Immunology 101 at poxvirus U:immune evasion genes[J].Seminars in Immunology,2001,13(1):59-66.
[21] 夏立群,张红莲,秦启伟.新加坡石斑鱼虹彩病毒ICP46核输出信号序列的定位与功能鉴定[J].水产学报,2012,36(11):1763-1769.
XIA L Q,ZHANG H L,QIN Q W.Definition and function identification of nucleus export signal of SGIV ICP46[J].Journal of Fisheries of China,2012,36(11):1763-1769.(in Chinese)