短颌鲚(Coilia brachygnathus)俗称毛花鱼[1],体型似长颌鲚(Coilia macrognathos),二者形态上的主要区别:长颌鲚上颌骨较长,可向后延长至鳃盖后缘,体侧纵列鳞数目较多,为75~83个;而短颌鲚上颌骨不超过鳃盖后缘,体侧纵列鳞数目为68~77个。早期研究认为,短颌鲚生长、发育和繁殖均在江河湖泊内,且多在中上水层生活,并在深水层越冬,生殖期在每年4—5月,能在静水和缓水中产卵,属于中小型经济鱼类[2-3]。近年来研究发现,短颌鲚也存在江海洄游的个体[4]。短颌鲚在不同的生长阶段食性会发生变化,幼鱼主要以水中浮游动物为食,小型成体主要摄食昆虫幼虫、桡足类和枝角类,而大型成体主要以鱼虾为食[5-6]。
鱼类肠道微生物是由宿主自身的特性和各种外界环境因素共同作用形成的,最有优势的微生物类群一般是细菌[7],主要由兼性厌氧菌和好氧菌组成,通常存在变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)3门核心微生物,它们能够有效调控肠道菌群结构组成,参与鱼的生长和免疫,促使鱼类健康生长[8]。
鄱阳湖是中国第一大淡水湖[9],位于江西省北部,是长江中下游地区主要支流之一;而青草沙水库位于咸、淡水交界处的长江口,短颌鲚均是鄱阳湖和青草沙水库鱼类的优势种[10-12],在两种不同水域中都具有很强的适应性。鱼类肠道菌群与水域环境密切相关,因此,探究不同水域短颌鲚肠道菌群差异及影响因素具有重要意义。本研究通过比较鄱阳湖和青草沙水库中大、小两种规格的短颌鲚肠道菌群结构差异并预测菌群功能,以期为探究短颌鲚水环境适应性机制及短颌鲚肠道菌群与宿主之间的调控关系提供数据支持。
1 材料与方法
1.1 调查站位
分别于2021年11月23、24、25日对江西省九江市鄱阳湖湖口,以及2021年12月30日对上海市长江口青草沙水库进行实地采样。调查当日下午将网具放置在指定位置,次日上午收取。调查网具为三层刺网:单条网长100 m,高2 m,网目2a=4 cm,每个调查站位放置2条,每次放置时间约12 h。采样点具体信息见图1、表1。
表1 鄱阳湖和青草沙水库短颌鲚样本采集信息
Tab.1 Coordinate information of sample collection in Poyang Lake and Qingcaosha Reservoir
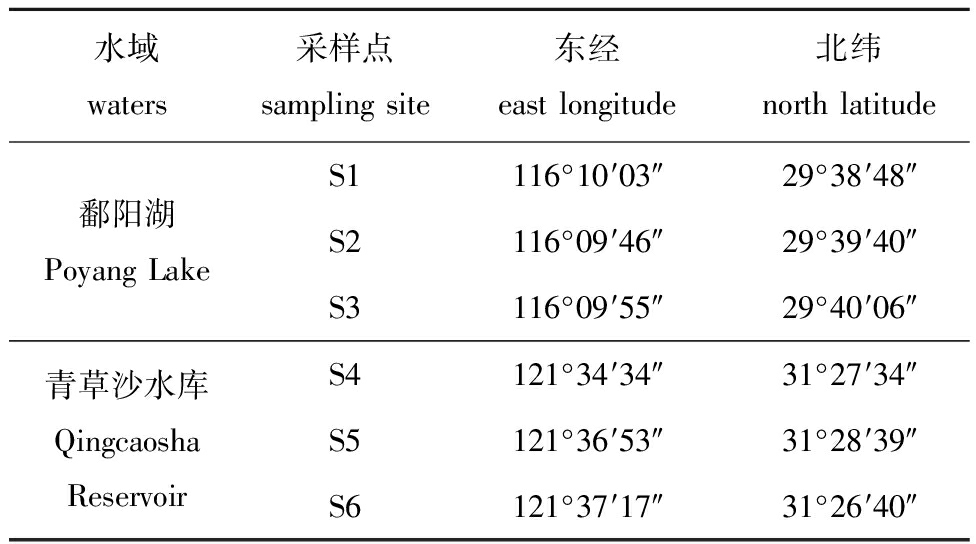
水域waters采样点sampling site东经east longitude北纬north latitudeS1116°10′03″29°38′48″鄱阳湖Poyang LakeS2116°09′46″29°39′40″S3116°09′55″29°40′06″S4121°34′34″31°27′34″青草沙水库Qingcaosha ReservoirS5121°36′53″31°28′39″S6121°37′17″31°26′40″
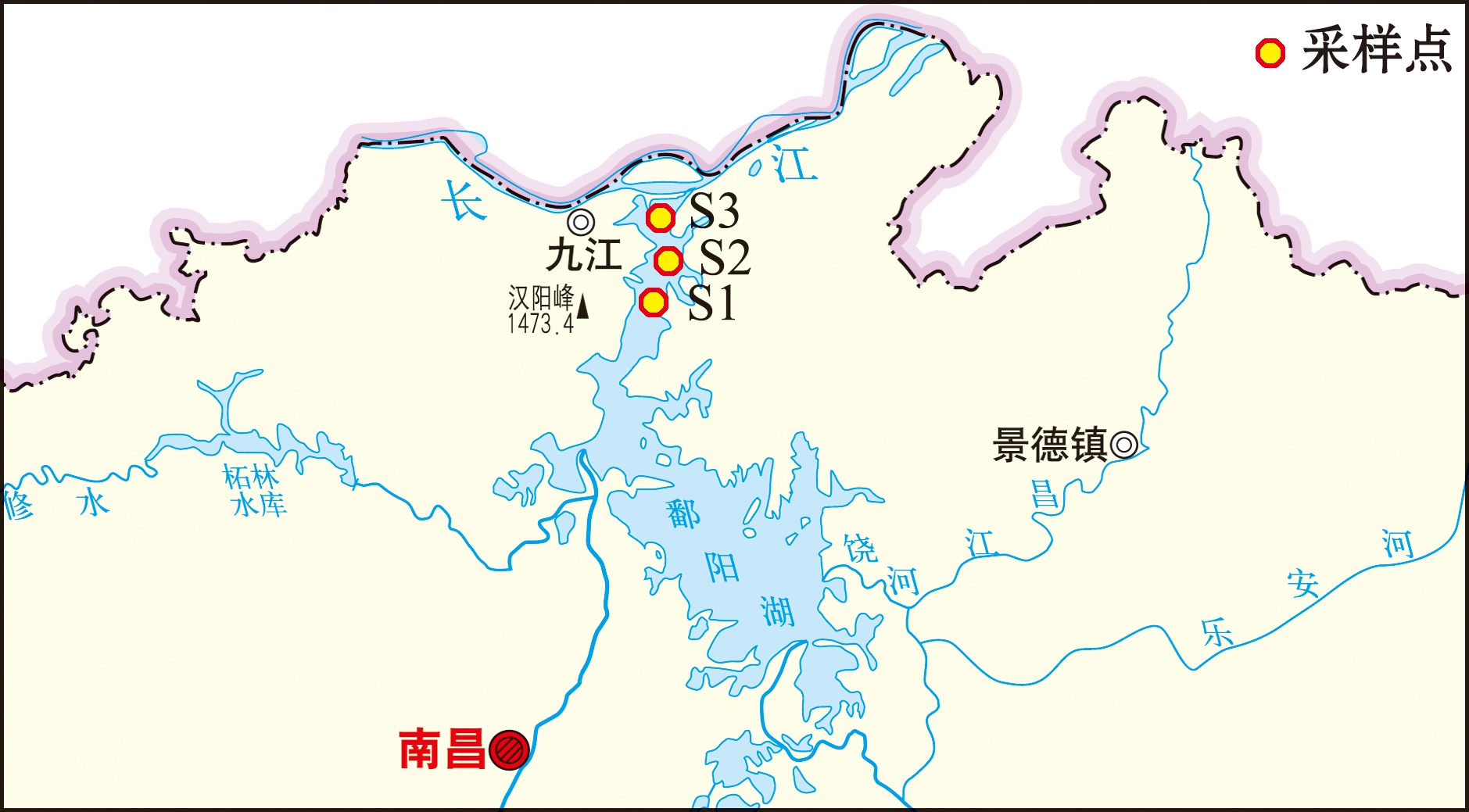
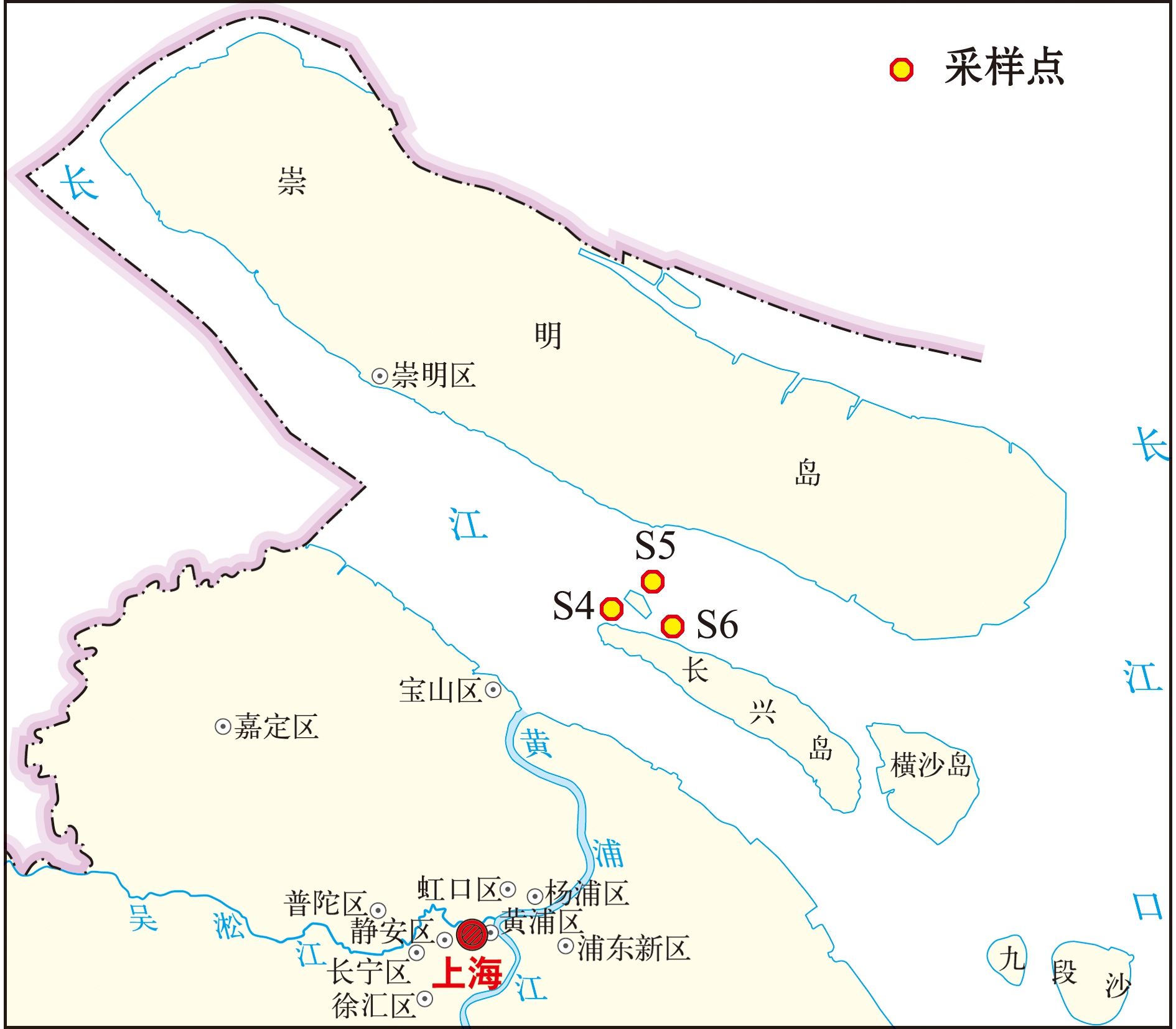
本图基于自然资源部标准地图服务网站GS(2019)3333号标准地图为底图,底图边界无修改。
The figure is based on the standard map GS(2019)3333 in the Standard Map Service website of Ministry of Natural Resources of the People’s Republic of China,with no modifications of the boundaries in the standard map.
图1 短颌鲚样品采集站位
Fig.1 Sample collection sites of Coilia brachygnathus
1.2 方法
1.2.1 样品采集 在鄱阳湖湖口共采集到短颌鲚60尾,在青草沙水库共采集到74尾。测量样本全长和体质量,并按全长、体质量区间值划分为大、小规格两类,共4组。其中,青草沙水库大、小规格短颌鲚分别记为QCS-L、QCS-S,鄱阳湖大、小规格短颌鲚分别记为PYH-L、PYH-S。大规格全长为30~35 cm,平均值为(31.58±0.74)cm,体质量为100~130 g,平均值为(120.43±5.85)g;小规格全长为15~20 cm,平均值为(17.72±1.30)cm,体质量为10~30 g,平均值为(16.85±4.53)g。
从每组随机选取3尾短颌鲚,共12个样本。无菌条件下,用乙醇棉球擦拭鱼体表后,再用剪刀从短颌鲚肛门处将腹部剪开,分离出完整肠道。将肠道放入培养皿中,去除肠道内容物,并使用缓冲液冲洗掉肠壁上的血液、脂肪。肠道样品用液氮速冻后置于2 mL冻存管,并于-80 ℃超低温冰箱中保存。
1.2.2 细菌总DNA提取和测序 根据E.Z.N.A.® soil DNA kit 抽提肠道菌群群落总DNA,采用10 g/L琼脂糖凝胶电泳检测DNA质量,并利用NanoDrop 2000测定DNA浓度和纯度。设计上游引物(5′GTGCCAGCMGCCGCGGTAA 3′)和下游引物(5′CCGTCAATTCMTTTRAGTTT 3′)对16S rRNA V4~V5(a)可变区进行PCR扩增。扩增程序:95 ℃下预变性3 min;95 ℃下变性30 s,56 ℃下退火30 s,72 ℃下延伸30 s,共进行27个循环;最后在72 ℃下再延伸10 min,4 ℃下保存(PCR 仪:ABI GeneAmp® 9700型)。PCR 反应体系:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上、下游引物(5 μmol/L)各0.8 μL,TransStart FastPfu DNA 聚合酶0.4 μL,DNA模板 10 ng,用灭菌双蒸水补足至20 μL。PCR产物在Illumina MiSeq平台(Illumina,San Diego,USA)上进行测序。
1.2.3 样品OTU、菌群多样性及群落组成分析 对测序数据进行初步筛查,对存在问题的样品进行重测、补测。原始序列按照index和barcode信息进行文库和样品划分,去除低质量序列及barcode和接头信息。
按照QIIME 2 dada 2和Vsearch软件的分析流程进行序列OTU聚类。依据OTU在不同样品中的分布,评估每个样品的Alpha多样性水平。
在物种分类学组成层面,利用QIIME 2软件进行分析,并结合统计学检验方法,进一步衡量不同样品间的物种丰度组成差异。
2 结果与分析
2.1 肠道菌群的测序质量及OTU数量
从图2可见,随着测序数据量的增加,各组样品OTU数量也随之增大,最终曲线趋于平缓,表明测序结果已足够反映样品所包含的多样性,能反映不同水域短颌鲚肠道菌群组成和种类。
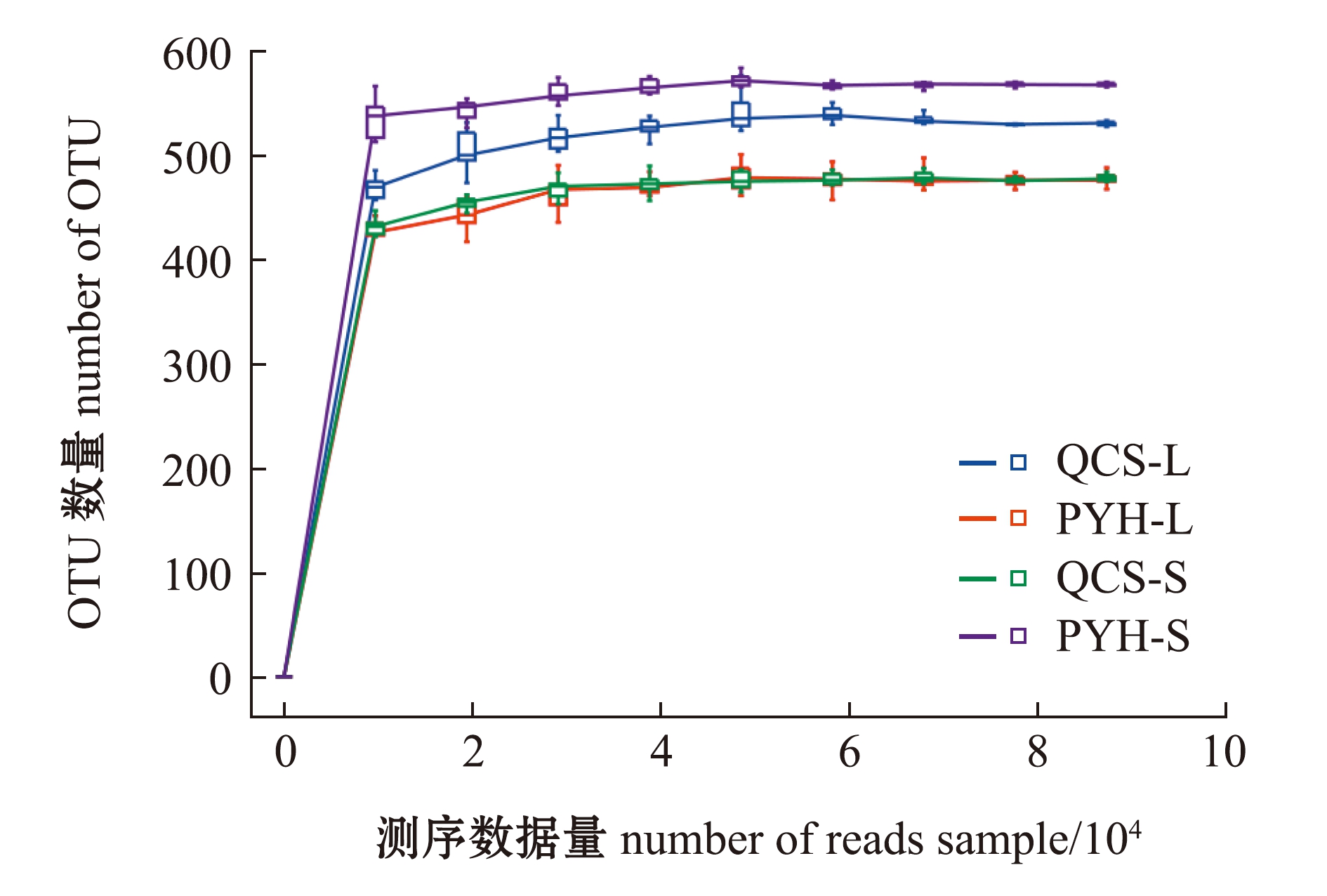
图2 样品稀释曲线
Fig.2 Sample dilution curves
从图3可见,QCS-L、QCS-S、PYH-L、PYH-S肠道菌群的平均OTU分别为524、472、466和567个,4组特有的OTU分别为 215、171、189、280个,表明QCS-L肠道菌群的多样性比PYH-L的更高,而QCS-S肠道菌群的多样性则比PYH-S的要低。

图3 鄱阳湖、青草沙水库不同规格短颌鲚肠道菌群的OTU数量
Fig.3 OTU number of intestinal bacterial communities of Coilia brachygnathus with different sizes in Poyang Lake and Qingcaosha Reservoir
2.2 肠道菌群Alpha多样性
从表2可见,鄱阳湖、青草沙水库不同规格短颌鲚肠道菌群样品覆盖率均接近1.0,且无显著性差异(P>0.05),表明样品中未被测序的菌群概率非常低。在Alpha多样性分析中,Chao1指数值越大,OTU数目越多,说明该样品肠道菌群物种数较多。QCS-L的Chao1指数值比PYH-L的高,而QCS-S的Chao1指数则比PYH-S的低。表明大规格短颌鲚的肠道菌群在青草沙水库的物种数比鄱阳湖多,而小规格则相反。
表2 鄱阳湖、青草沙水库不同规格短颌鲚肠道菌群 Alpha 多样性
Tab.2 Alpha diversity index of intestinal bacterial communities of Coilia brachygnathus with different sizes in Poyang Lake and Qingcaosha Reservoir
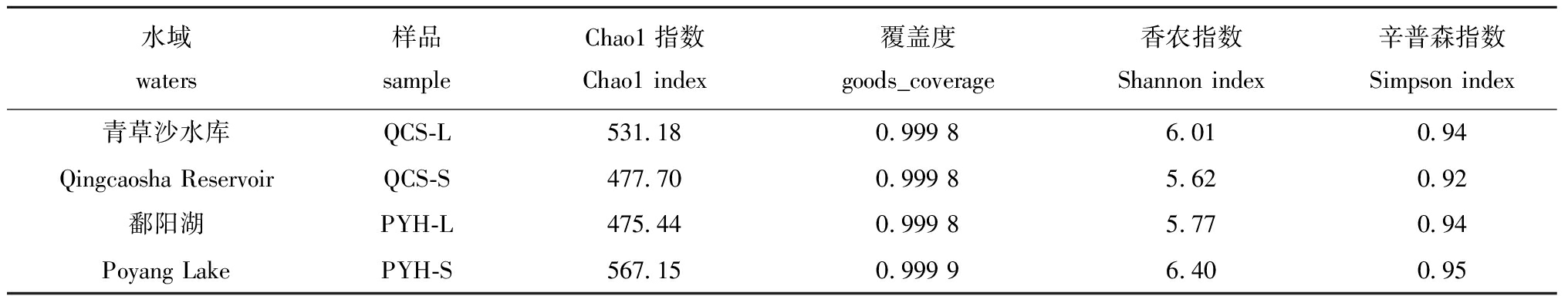
水域waters样品sampleChao1指数Chao1 index覆盖度goods_coverage香农指数Shannon index辛普森指数Simpson index青草沙水库QCS-L531.180.999 86.010.94Qingcaosha ReservoirQCS-S477.700.999 85.620.92鄱阳湖PYH-L475.440.999 85.770.94Poyang LakePYH-S567.150.999 96.400.95
Shannon和Simpson指数表征物种多样性,数值越大,表示群落多样性越高。QCS-L肠道菌群的Shannon和Simpson值比PYH-L的高,而QCS-S肠道菌群的Shannon和Simpson值则比PYH-S的低。表明大规格短颌鲚肠道菌群在青草沙水库的群落多样性比鄱阳湖的高,而小规格则相反。
2.3 肠道菌群Beta多样性
PCoA分析显示:QCS-L肠道菌群样品主要沿PCo1坐标轴形成一个簇,与PYH-L明显分离;沿PCo2坐标轴,QCS-S肠道菌群样品也与PYH-S明显分离(图4)。Permanova分析表明,青草沙水库与鄱阳湖大、小规格短颌鲚肠道菌群存在显著性差异(P=0.003<0.05)。
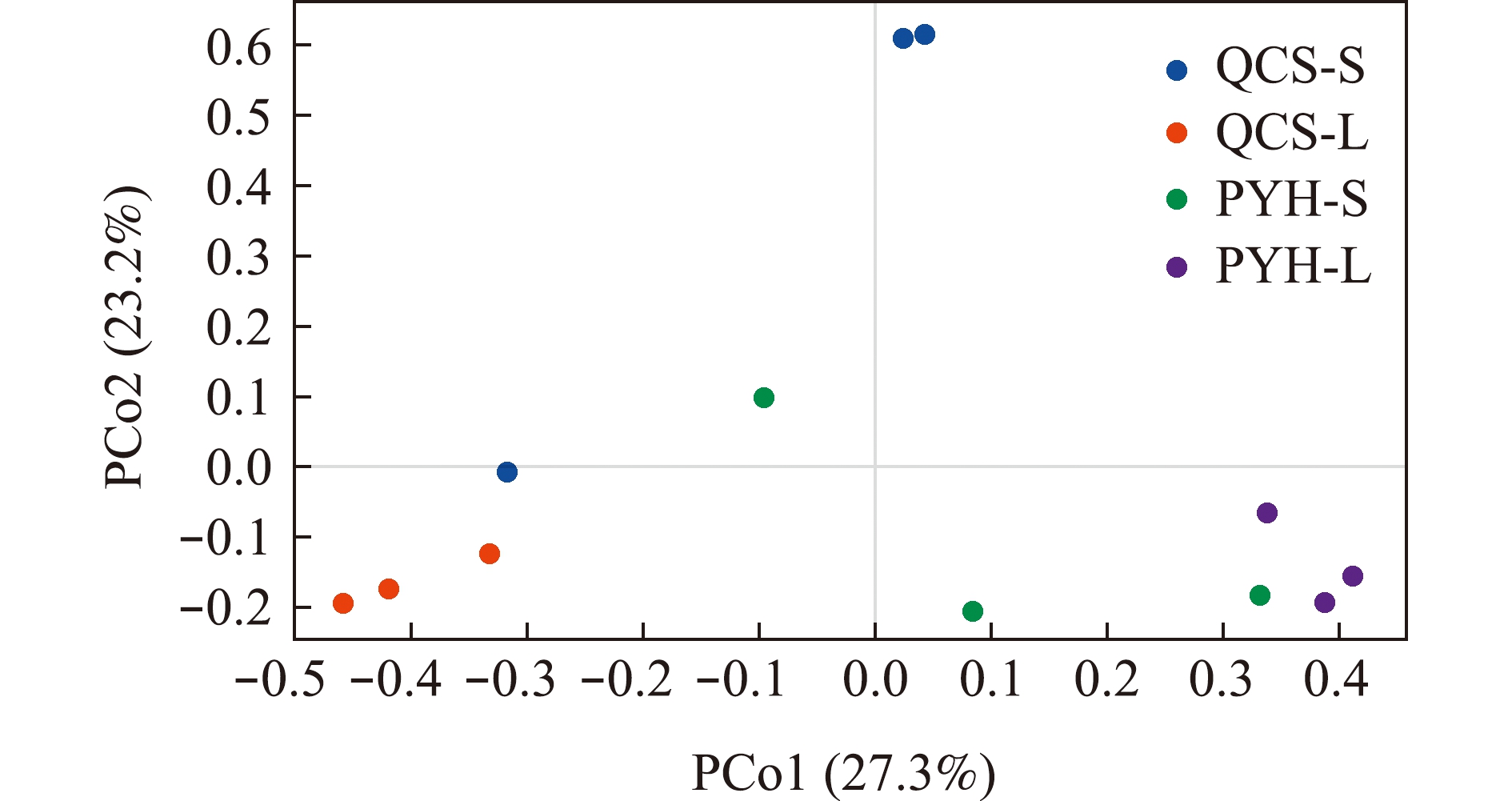
图4 鄱阳湖、青草沙水库不同规格短颌鲚肠道菌群差异主成分分析
Fig.4 Principal co-ordinates analysis showing the differences in intestinal bacterial communities of Coilia brachygnathus with different sizes in Poyang Lake and Qingcaosha Reservoir
2.4 肠道菌群组成
从门分类水平将丰度大于1%的细菌类群进行统计,而将丰度小于1%的细菌类群进行合并,并命名为“others”。从图5可见,不同水域短颌鲚肠道菌群主要分为8个门,分别是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、OD1菌门(OD1)、浮霉菌门(Planctomycetes)、衣原体门(Chlamydiae)和酸杆菌门(Acidobacteria)。每个门类细菌在不同水域短颌鲚肠道中的丰度差异较大,在大规格短颌鲚中,变形菌门和拟杆菌门在鄱阳湖中的丰度大于青草沙水库,厚壁菌门在鄱阳湖中的丰度则小于青草沙水库;在小规格短颌鲚中,拟杆菌门、厚壁菌门在鄱阳湖中的丰度大于青草沙水库,变形菌门在鄱阳湖中的丰度则小于青草沙水库。
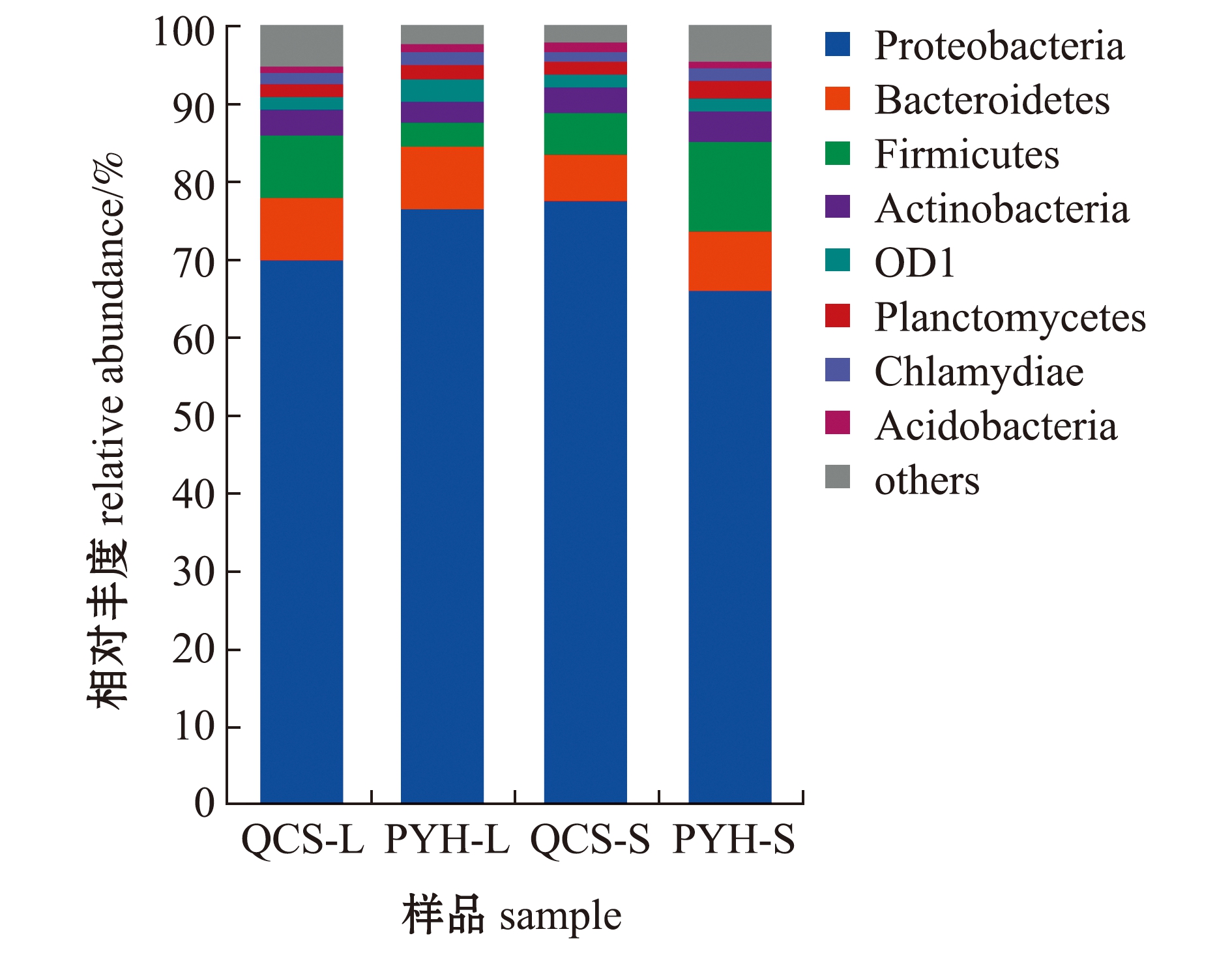
图5 门水平上鄱阳湖、青草沙水库不同规格短颌鲚肠道菌群丰度
Fig.5 Intestinal bacterial community abundance in Coilia brachygnathus with different sizes at phylum level in Poyang Lake and Qingcaosha Reservoir
从图6可见,鄱阳湖、青草沙水库不同规格短颌鲚肠道菌群主要分为9个属,分别是苍白杆菌属(Ochrobactrum)、伯克霍尔德菌属(Burkholderia)、鲑色沉积物杆状菌属(Sediminibacterium)、红游动菌属(Rhodoplanes)、不动杆菌属(Acinetobacter)、德沃斯氏菌属(Devosia)、念珠菌属(Candidatus_Rhabdochlamydia)、鞘氨醇单胞菌属(Sphingomonas)和慢生根瘤菌属(Bradyrhizobium)。在各组对比中,伯克霍尔德菌属为差异性最大的菌群,其在QCS-L、PYH-L中分别占18.69%、9.28%,在QCS-S、PYH-S中分别占25.53%、12.68%。
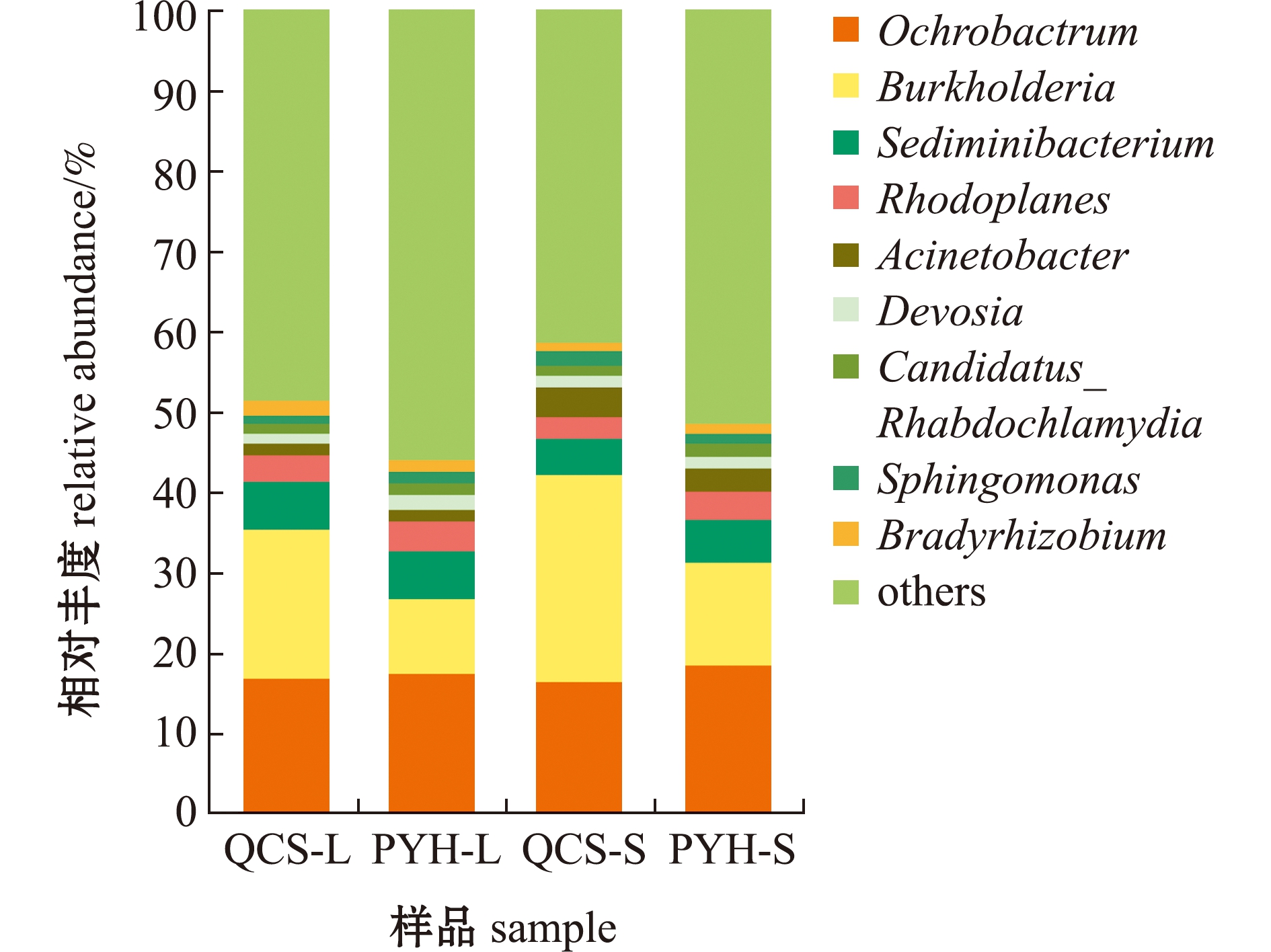
图6 属水平上鄱阳湖、青草沙水库不同规格短颌鲚肠道菌群丰度
Fig.6 Intestinal bacterial community abundance in Coilia brachygnathus with different sizes at genus level in Poyang Lake and Qingcaosha Reservoir
2.5 肠道菌群功能预测
从图7可见,参与生物合成(biosynthesis)的代谢途径丰度最高,其中,参与氨基酸生物合成(amino acid biosynthesis)、核苷与核苷酸生物合成(nucleoside and nucleotide biosynthesis)、脂肪酸与脂质生物合成(fatty acid and lipid biosynthesis)及辅因子(cofactor,prosthetic group,electron carrier and vitamin biosynthesis)等通路丰度较高。
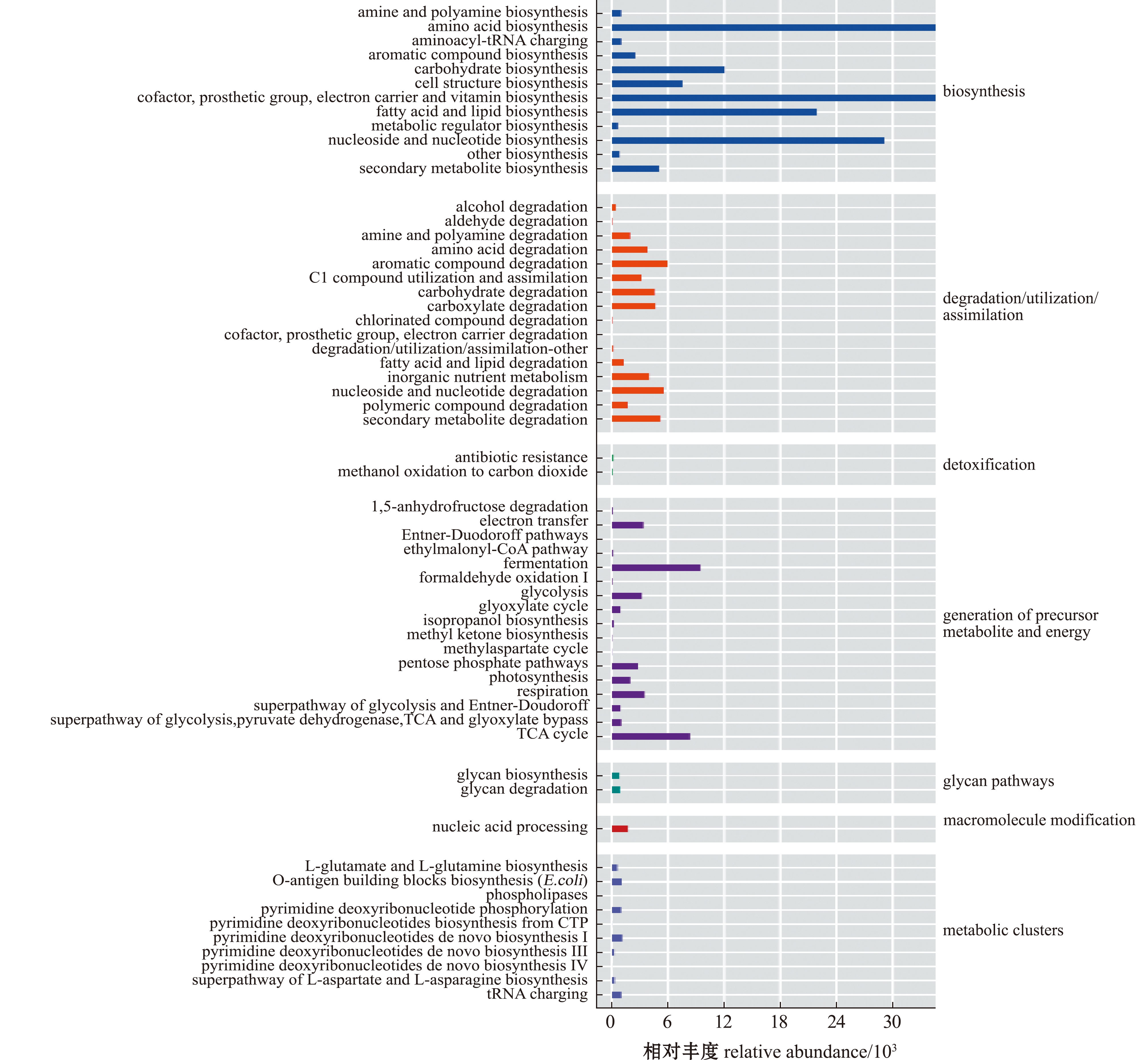
图7 鄱阳湖和青草沙水库不同规格短颌鲚肠道菌群代谢通路丰度
Fig.7 Metabolic pathway abundance of intestinal bacterial community in Coilia brachygnathus with different sizes in Poyang Lake and Qingcaosha Reservoir
3 讨论
鱼类肠道微生物是水环境和饵料中的微生物随着鳃和口腔进入体内,并与鱼类发生适应性生理生化作用,最终定植在鱼类肠道中的菌群,因此,鱼类肠道菌群的结构与其遗传、食性和水环境密切相关[13]。Fietz等[14]在鳞柄玉筋鱼(Ammodytes tobianus)和尖头富筋鱼(Hyperoplus lanceolatus)这两种海洋鱼类中发现,遗传因素可能在种间和种内水平上对肠道菌群组起调节作用。鄱阳湖和青草沙水库两个水域小规格短颌鲚可能均为定居性群体,且在不同水域发生了遗传分化[15],这可能是它们肠道菌群组成差异的原因之一;由于本研究中短颌鲚样品均为性成熟的样品[16],因此,肠道菌群与发育阶段无关,导致其肠道菌群差异的因素还可能有食性和水环境。
3.1 肠道菌群与食性的关系
李可俊等[17]在对长江口8种野生鱼类肠道菌群的比较中发现,鱼类肠道结构多样性的差异与鱼类食性密切相关,食性差异越大的鱼类之间肠道菌群差异也越显著。同一种鱼摄食不同种类的食物后,其消化道菌群结构也会发生改变[18-19]。本研究发现,鄱阳湖小规格短颌鲚相比大规格的肠道菌群多样性和丰富度更高。唐渝[20]在研究太湖湖鲚种群数量变动及合理利用时发现,湖鲚胃容物包括原生动物、虾蟹贝幼体、鱼卵、水蚤、轮虫、低等藻类及湖鲚幼鱼等,高达30多种。一般体长小于13 cm的湖鲚饵料以枝角类、桡足类等浮游动物为主,当其体长超过13 cm时,饵料中会出现一些经济鱼虾,当其体长增长至17 cm以上时,饵料中经济鱼虾相对密度急剧上升[21]。Zhang等[22]研究证实,鄱阳湖短颌鲚食性介于滤食性与肉食性之间。本研究中,小规格短颌鲚还能以浮游动物为食,相比大规格的个体在食性上更为丰富,这很可能是导致鄱阳湖小规格短颌鲚肠道菌群多样性和丰富度比大规格短颌鲚高的重要原因。而青草沙水库短颌鲚则与之相反,这可能是由于采集分析的大规格短颌鲚样本存在江海洄游的个体。徐刚春等[4]在研究长江短颌鲚耳石Sr/Ca值变化特征时发现,长江中存在参与江海洄游的短颌鲚个体。江海洄游需经历咸、淡水复杂的水环境,导致洄游型短颌鲚肠道菌群多样性和丰富度更高。
3.2 肠道菌群与水环境的关系
董博等[23]研究发现,河口生活的弹涂鱼(Periophthalmus cantonensis)肠道微生物群落中同时具有陆生动物、淡水与海水鱼类及两栖动物的典型细菌家族,这与其在水陆过渡咸淡水交界处的生活特征相吻合,其依靠多样的肠道微生物来应对不同环境。本研究中发现,鄱阳湖小规格短颌鲚的肠道菌群多样性和丰富度最高,因其样品采集于鄱阳湖湖口,此处属鄱阳湖与长江交汇处,来水及水体环境复杂,相较湖区水体微生物群落更为丰富[24-25]。而青草沙水库采用“避咸取淡”(避东海咸潮取长江淡水)管理模式,经过十多年的运行,青草沙水库库内与库外的水质发生了明显差异,库内为较优质的、稳定的饮用水源[26],库内藻类较来水有所增殖,导致库内微生物多样性比来水低,即长江水进入水库后,微生物群落出现了生态演替,菌群多样性降低[27],进而影响到栖息于此的鱼类肠道菌群多样性和组成。
3.3 肠道菌群组成及其功能预测
本研究中,从不同水域短颌鲚肠道菌群组成分析可以看出,青草沙水库和鄱阳湖短颌鲚的肠道菌群中,变形菌门、拟杆菌门和厚壁菌门均占绝对优势。这与鄱阳湖水体环境优势菌群组成相一致[24-25],进一步证实水环境是影响短颌鲚肠道菌群多样性和组成的重要因素。同时也有研究发现,变形菌门、拟杆菌门和厚壁菌门这3类细菌在很多鱼类肠道中出现且占肠道菌群的90%以上[28],变形菌门和拟杆菌门的有些成员可以改善宿主的代谢和免疫功能障碍,诱导其免疫应答,很可能与鱼的生长和免疫有关[29-30],这与本研究发现的短颌鲚肠道菌群中,参与生物合成的代谢途径丰度相较其他代谢通路丰度较高的结果相一致。而厚壁菌门中的某些细菌在鱼类的消化吸收过程中提供多种酶[31],可能在促进短颌鲚营养物质的吸收中发挥重要作用。
4 结论
1)青草沙水库大规格短颌鲚的肠道菌群多样性比鄱阳湖同规格短颌鲚的高,而鄱阳湖小规格短颌鲚的肠道菌群多样性比青草沙水库同规格的高。
2)不同水域短颌鲚肠道中,每个门类的细菌丰度差异较大;在属水平上,伯克霍尔德菌属为丰度差异性最大的菌群。
3)不同水域短颌鲚肠道菌群多样性和丰度的差异,极有可能是短颌鲚生活史、食性转变及水环境差异造成的。
[1] 湖北省水生生物研究所鱼类研究室编.长江鱼类[M].北京:科学出版社,1976:21-30.
Department of Ichthyology,Institute of Hydrobiology,Hubei Province.Fishes of the Yangtze River[M].Beijing:Science Press,1976:21-30.(in Chinese)
[2] 张世义.中国动物志硬骨鱼纲:鲟形目 海鲢目 鲱形目 鼠鱼吉目[M].北京:科学出版社,2011:155-156.
ZHANG S Y.Fauna Sinica Osteichthyes:Acipenseriformes;Elopiformes;Clupeiforme;Gonorhynchiformes[M].Beijing:Science Press,2001:155-156.(in Chinese)
[3] 中国水产科学研究院东海水产研究所,上海市水产研究所.上海鱼类志 [M].上海:上海科学技术出版社,1990:114.
East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,and Shanghai Fisheries Research Institute.The fishes of Shanghai area [M].Shanghai:Shanghai Scientific &Technical Publishers,1990:114.(in Chinese)
[4] 徐钢春,顾若波,刘洪波,等.长江短颌鲚耳石Sr/Ca值变化特征及其江海洄游履历[J].水产学报,2014,38(7):939-945.
XU G C,GU R B,LIU H B,et al.Fluctuation of Sr/Ca in otoliths of Coilia nasus in the Yangtze River and the validation for the anadromous migratory history[J].Journal of Fisheries of China,2014,38(7):939-945.(in Chinese)
[5] 王旭歌,何勇凤,李昊成,等.长湖短颌鲚的年龄与生长特性[J].淡水渔业,2016,46(3):29-33.
WANG X G,HE Y F,LI H C,et al.Study on the age and growth characteristics of Coilia brachygnathus in Lake Changhu[J].Freshwater Fisheries,2016,46(3):29-33.(in Chinese)
[6] LIU Y L,WU Z Q,HU M L.Advances on tapertail anchovy Coilia ectenes in China [J].Fisheries Science,2008,27(4):205-209.
[7] GAJARDO K,RODILES A,KORTNER T M,et al.A high-resolution map of the gut microbiota in Atlantic salmon (Salmo salar):a basis for comparative gut microbial research[J].Scientific Reports,2016,6:30893.
[8] GATESOUPE F J.Live yeasts in the gut:natural occurrence,dietary introduction,and their effects on fish health and development[J].Aquaculture,2007,267(1/2/3/4):20-30.
[9] 王晓鸿,鄢帮有,吴国琛.山江湖工程[M].北京:科学出版社,2006.
WANG X H,YAN B Y,WU G C.Program of mountain-river-lake[M].Beijing:Science Press,2006.(in Chinese)
[10] 李丽,杜蓉,刘其根,等.长江口青草沙水库刀鲚食性转变[J].中国水产科学,2019,26(4):765-773.
LI L,DU R,LIU Q G,et al.The ontogenetic dietary shift of Japanese grenadier anchovy (Coilia nasus) in the Qingcaosha Reservoir near the Yangtze River Estuary[J].Journal of Fishery Sciences of China,2019,26(4):765-773.(in Chinese)
[11] 田思泉,高春霞,王绍祥,等.青草沙水库刀鲚生物学特性初步研究[J].上海海洋大学学报,2013,22(6):835-840.
TIAN S Q,GAO C X,WANG S X,et al.Biological characteristics of Coilia ectenes in Qingcaosha Reservoir[J].Journal of Shanghai Ocean University,2013,22(6):835-840.(in Chinese)
[12] 阳敏,盛漂,张燕萍,等.禁捕初期鄱阳湖鱼类群落的结构特征[J].水生生物学报,2022,46(10):1569-1579.
YANG M,SHENG P,ZHANG Y P,et al.Characteristics of fish assemblages of Poyang Lake at the initial stage of the fishing ban[J].Acta Hydrobiologica Sinica,2022,46(10):1569-1579.(in Chinese)
[13] 向佳丽,李渊,宋普庆,等.鱼类肠道微生物多样性及其与环境因子关系的研究进展[J].渔业研究,2022,44(2):187-195.
XIANG J L,LI Y,SONG P Q,et al.Research progress on gut microbial diversity of fish and its relationship with environmental factors[J].Journal of Fisheries Research,2022,44(2):187-195.(in Chinese)
[14] FIETZ K,RYE HINTZE C O,SKOVRIND M,et al.Mind the gut:genomic insights to population divergence and gut microbial composition of two marine keystone species[J].Microbiome,2018,6(1):82.
[15] 王玮欣,李宇,朱洪赓,等.基于形态和Cytb序列的短颌鲚种群遗传分化研究[J].水产科学,2022,41(6):949-958.
WANG W X,LI Y,ZHU H G,et al.Genetic differentiation of shortjaw tapertail anchovy Coilia brachygnathus population based on Cytb and morphology[J].Fisheries Science,2022,41(6):949-958.(in Chinese)
[16] 杨丽亚,吕红健,付梅,等.三峡库区短颌鲚年龄和生长特性的研究[J].水生生物学报,2022,46(1):17-28.
YANG L Y,LÜ H J,FU M,et al.Age and growth characteristics of Coilia nasus in the Three Gorges Reservoir region[J].Acta Hydrobiologica Sinica,2022,46(1):17-28.(in Chinese)
[17] 李可俊,管卫兵,徐晋麟,等.PCR-DGGE对长江河口八种野生鱼类肠道菌群多样性的比较研究[J].中国微生态学杂志,2007,19(3):268-269,272.
LI K J,GUAN W B,XU J L,et al.PCR-DGGE analysis of bacterial diversity of the intestinal system in eight kinds of wild fishes from the Changjiang River Estuary[J].Chinese Journal of Microecology,2007,19(3):268-269,272.(in Chinese)
[18] REID H I,TREASURER J W,ADAM B,et al.Analysis of bacterial populations in the gut of developing cod larvae and identification of Vibrio logei,Vibrio anguillarum and Vibrio splendidus as pathogens of cod larvae[J].Aquaculture,2009,288(1/2):36-43.
[19] APPER E,WEISSMAN D,RESPONDEK F,et al.Hydrolysed wheat gluten as part of a diet based on animal and plant proteins supports good growth performance of Asian seabass (Lates calcarifer),without impairing intestinal morphology or microbiota[J].Aquaculture,2016,453:40-48.
[20] 唐渝.太湖湖鲚种群数量变动及合理利用的研究[J].水产学报,1987,11(1):61-73.
TANG Y.On the population dynamics of lake anchovy in Taihu Lake and its rational exploitation[J].Journal of Fisheries of China,1987,11(1):61-73.(in Chinese)
[21] 刘引兰,吴志强,胡茂林.我国刀鲚研究进展[J].水产科学,2008,27(4):205-209.
LIU Y L,WU Z Q,HU M L.Advances on tapertail anchovy Coilia ectenes in China[J].Fisheries Science,2008,27(4):205-209.(in Chinese)
[22] ZHANG H,WU G G,ZHANG H,et al.Role of body size and temporal hydrology in the dietary shifts of shortjaw tapertail anchovy Coilia brachygnathus (Actinopterygii,Engraulidae) in a large floodplain lake[J].Hydrobiologia,2013,703(1):247-256.
[23] 董博,邓涵逸,孙艺秋,等.基于肠道宏基因组对弹涂鱼两栖适应性的研究[J].广东农业科学,2022,49(11):32-42.
DONG B,DENG H Y,SUN Y Q,et al.Study on the amphibious adaptability of mudskippers based on intestinal metagenome[J].Guangdong Agricultural Sciences,2022,49(11):32-42.(in Chinese)
[24] 黄小兰,简正军,叶长盛,等.鄱阳湖河湖交错带枯水期水体细菌群落空间分布[J].微生物学通报,2021,48(6):1862-1873.
HUANG X L,JIAN Z J,YE C S,et al.Spatial distribution of bacterial community in river-lake ecotone of Poyang Lake during dry season[J].Microbiology China,2021,48(6):1862-1873.(in Chinese)
[25] 褚奇奇,徐广昌,黄晶,等.鄱阳湖流域河湖口微生物多样性研究[J].江西农业学报,2022,34(11):138-142,148.
CHU Q Q,XU G C,HUANG J,et al.Study on microbial diversity in estuary of Poyang Lake basin[J].Acta Agriculturae Jiangxi,2022,34(11):138-142,148.(in Chinese)
[26] 朱宜平.近十年来青草沙水库取水口水质变化趋势分析[J].华东师范大学学报(自然科学版),2022(3):50-60.
ZHU Y P.Analysis of changes in water quality at the Qingcaosha Reservoir water intake over a period of 10 years[J].Journal of East China Normal University (Natural Science Edition),2022(3):50-60.(in Chinese)
[27] GUO J,ZHENG Y,TENG J, et al.The seasonal variation of microbial communities in drinking water sources in Shanghai[J/OL].Journal of Cleaner Production,2020.DOI:10.1016/j.jclepro.2020.121604.
[28] 翟万营,郭安宁.鱼类肠道微生物研究进展[J].河南水产,2016(4):18-21,40.
ZHAI W Y,GUO A N.Research progress on the fish intestinal microbiota[J].Henan Fisheries,2016(4):18-21,40.(in Chinese)
[29] RAWLS J F,MAHOWALD M A,LEY R E,et al.Reciprocal gut microbiota transplants from zebrafish and mice to germ-free recipients reveal host habitat selection[J].Cell,2006,127(2):423-433.
[30] GAUFFIN CANO P,SANTACRUZ A,MOYA  ,et al.Bacteroides uniformis CECT 7771 ameliorates metabolic and immunological dysfunction in mice with high-fat-diet induced obesity[J].PLoS One,2012,7(7):e41079.
,et al.Bacteroides uniformis CECT 7771 ameliorates metabolic and immunological dysfunction in mice with high-fat-diet induced obesity[J].PLoS One,2012,7(7):e41079.
[31] SMRIGA S,SANDIN S A,AZAM F.Abundance,diversity,and activity of microbial assemblages associated with coral reef fish guts and feces[J].FEMS Microbiology Ecology,2010,73(1):31-42.