嗜水气单胞菌(Aeromonas hydrophila)隶属于弧菌科(Vibrionaceae)气单胞菌属(Aeromonas),在水体、人类粪便、空气和土壤环境中广泛存在,该菌可引起人类出血病、介水传染病、腹泻、继发感染和食物中毒等疾病,在公共卫生中占有举足轻重的地位[1]。嗜水气单胞菌作为一种重要的人-畜-鱼共患病病原,在鱼类中除感染鲤科外,还可感染大鲵、乌鳢等,是水产养殖中危害最大、最普遍的一类病原菌[2]。研究证实,嗜水气单胞菌的致病力与其携带的毒力因子密切相关,其含有的相应毒力基因的数量和类型可作为预测分离株致病性及判定其毒力强弱的重要依据。这些编码毒力因子的基因已被广泛应用于从环境、食品、鱼类和人类临床样本中分离的气单胞菌潜在致病性检测[3]。因此,研究嗜水气单胞菌的流行性、致病性和耐药性,探寻对该菌有效的治疗方法对于嗜水气单胞菌感染的防控和公共卫生安全十分必要。
青鱼(Mylopharyngodon piceus)隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)雅罗鱼亚科(Leuciscinae)青鱼属(Mylopharyngodon),是中国传统的四大淡水养殖鱼类之一,主要分布在长江以南的滨江区域,是湖泊和池塘中的主要养殖对象和重要水产品资源,也是中国淡水养殖的重要经济种类。随着养殖规模的扩大和集约化程度的增加,青鱼受大量病原微生物的影响,除病毒性病原外,嗜水气单胞菌[4]、类志贺邻单胞菌[5]、非霍乱弧菌[6]和荧光假单胞菌[7]等细菌性病害也在一定程度上严重危害青鱼养殖,尤其是嗜水气单胞菌会引起肠道出血和细菌性败血症,其危害大、波及范围广且致病性强,对青鱼养殖业造成了严重的经济损失。
2021年8月,湖北省荆州市某养殖场的青鱼在高温条件下出现连续死亡情况,患病青鱼主要的临床症状表现为反应迟钝、摄食减退、鳃丝有淤血、腹下体表弥漫性出血和肛门红肿;解剖发现,患病鱼腹腔有积液,脏器弥漫性出血,肝脏和脾脏肿大,肠道有出血现象,初步诊断为细菌性出血病。本研究中,以自然发病的青鱼为试验材料,通过采集患病青鱼病变组织进行病原的分离和鉴定,分离纯化得到一株优势菌QAB5,综合其形态特征、生理生化特性和16S rRNA测序,鉴定其为气单胞菌属的嗜水气单胞菌,并通过对分离菌株进行多序列位点分型、胞外酶活性和毒力基因检测、人工感染试验、生物被膜形成能力测定和药敏试验等,研究了该菌的致病机制,以期为嗜水气单胞菌引起的出血病的有效预防和精准治疗提供参考。
1 材料与方法
1.1 材料
自然患病青鱼样品由湖北省荆州市某养殖场提供,病鱼体质量为1.0~1.5 kg。健康青鱼体质量10 g左右,经7 d暂养观察,对其进行特定病原体检测,选取不携带特定病毒和致病菌的健康青鱼用于人工感染试验。
革兰氏染色剂、琼脂均购自北京索莱宝生物科技有限公司;药敏纸片、细菌微量生化管购自杭州微生物试剂有限公司;2×PCR Mix酶、DL2000 DNA Marker购自北京聚合美生物科技有限公司;细菌基因组提取试剂盒、病毒DNA/RNA基因组提取试剂盒购自北京天根生化科技有限公司;反转录试剂盒购自南京诺唯赞生物科技股份有限公司;引物合成及测序委托生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 病原菌的分离与纯化 检查记录患病青鱼的外观症状,用体积分数为75%的乙醇擦拭病鱼体表后,无菌条件下解剖,取其病变组织肾、肠、肝、鳃和脾。经无菌水冲洗、研磨后,在LB琼脂培养基上划线,28 ℃下倒置培养18 h;挑取单个优势菌落进行纯化培养,观察并记录菌落形态特征,保存备用。
1.2.2 病原检测 取患病青鱼病变的肾、肠、肝、鳃和脾组织(约200 mg),置入无酶的1.5 mL EP管中进行研磨,使用病毒DNA/RNA基因组提取试剂盒提取基因组,使用反转录试剂盒进行反转录,以反转录产物作为病毒检测的模板,以恒温培养18 h后长出的单菌落作为PCR检测细菌的模板。基于嗜水气单胞菌(登录号:NZ.CP050851.1)的OmpA基因设计合成特异性引物,迟缓爱德华氏菌、类志贺邻单胞菌和草鱼呼肠孤病毒等病原的引物序列参考文献[8-14]合成(表1),使用相应的体系和程序进行扩增,PCR产物使用10 g/L琼脂糖凝胶进行电泳检测。
表 1 病原检测引物信息
Tab.1 Primer information for pathogen detection

病原(简称)pathogen (abbreviation)引物序列(5′- 3′)primer sequence (5′- 3′)目的产物/bpproduct size嗜水气单胞菌(Aeromonas hydrophila, Ah)F:CCTGTTCAGCCAGATAGTGR:GGTGATCGGAGAGGACTT202类志贺邻单胞菌(Plesiomonas shigelloides, PS)F:CTCCGAATACCGTAGAGTGCTATCCR:CTCCCCTAGCCCAATAACACCTAAA284[8]迟缓爱德华氏菌(Edwardsiella tarda, Et)F:CATCGTCACCATTCACAGTR:CCTTAATCCCACCCTCATAG494[9]副溶血性弧菌(Vibrio parahemo-lyticus, VP)F:AAAGCGGATTATGCAGAAGCACTGR:GCTACTTTCTAGCATTTTCTCTGC450[10]无乳链球菌(Streptococcus agalactiae, GBS)F:ATGGAAATGAATAAAAAGGTACR:TTAGTTAAAGGATACGTGAACGTGG1 320[11]鮰爱德华氏菌(Edwardsiella ictaluri, Ei)F:TCATCACATCATCTAGCGATTR:CTTTACACAGATAGGCGATAC276[12]鲤疱疹病毒(Koi herpesvirus,CyHV)Ⅰ-F:TCGATGAGAGTCTGGGCGTGⅠ-R:CGGGACCACACCTGGCATAAⅡ-F:CTACCCATCATCCGAGCCGTⅡ-R:AGCTCGGTCGTGTTGAAACC900[13]600[13]草鱼呼肠孤病毒(Grass carp reovirus, GCRV)F:CTTTACACAGATAGGCGATACR:TAA TTG CCT GCT GCG CTG ACT196[14]
1.2.3 分离菌株QAB5的鉴定 从划线的平板上分离到一株优势菌,命名为QAB5,对分离菌株进行革兰氏染色后镜检;使用细菌微量生理生化鉴定管,参照生理生化试剂盒说明书分析分离菌株的生理生化特性;以提取的菌株QAB5基因组作为模板,采用通用引物27F:AGAGTTTGATCMTGGCTCAG和1 492R:GGTTACCTTGTTACGACTT扩增其16S rRNA片段。PCR反应体系(25 μL):模板1 μL,2×PCR mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL、ddH2O 9.5 μL。PCR扩增条件:94 ℃下预变性5 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸1 min,共进行33个循环;最后在 72 ℃下再延伸10 min。PCR产物使用10 g/L琼脂糖凝胶进行电泳。将PCR产物进行测序,测序结果在GenBank数据库上进行序列同源性比对分析;选取弧菌科同源性较高的不同种属,利用MEGA 11软件进行多序列比对,用Neighbor-Joining法构建系统进化树。综合菌落特征、生理生化特性和分子进化关系判定分离菌株QAB5的种属关系。
1.2.4 多位点序列分型(multilocus sequence typing,MLST) 应用PCR方法扩增A.hydrophila的6个管家基因gltA(MH697729)、groL(MH697730)、gyrB(MH697731)、metG(MH697732)、ppsA(MH697733)和recA(MH697734),并对PCR产物进行测序[15]。将所得序列上传至PubMLST(https://pubmlst.org/aeromonas/)进行比对,从而得到每个管家基因的等位基因型,按顺序获得相应的ST型。
1.2.5 菌株QAB5致病性分析
1)溶血活性、蛋白酶活性和脂肪酶活性检测。制备浓度为1.5×108 CFU/mL的菌液作为试验菌液,分别取1 μL试验菌液点种在含5%绵羊血平板、含1%脱脂牛奶的TSA平板和含1%(均为体积分数)吐温-80的TSA平板,并设置3个平行,28 ℃下静置培养36 h后,测定溶血圈、蛋白质和脂肪水解圈的直径[16]。
2)毒力基因检测。选取嗜水气单胞菌6个毒力基因,即溶血素(hemolysin,hly)、气溶素(aerolysin,aer)、细胞兴奋性肠毒素(heat-labile enterotoxin,alt)、热稳定性肠毒素(heat-stable enterotoxin,ast)、细胞毒性肠毒素(cytotoxic enterotoxin,act)和丝氨酸蛋白酶(serine protease,ahp)合成特异性引物[17](表2),通过PCR检测分离菌株的毒力基因。
表2 嗜水气单胞菌毒力基因引物序列
Tab.2 Primer sequence of virulence gene of Aeromonas hydrophila

基因gene引物序列(5′-3′)primer sequence (5′-3′)目的产物/bpproduct sizeaerF:CAAGAACAAGTTCAAGTGGCCAR:ACGAAGGTGTGGTTCCAGT309actF:GAGAAGGTGACCACCAAGAACAR:AACTGACATCGGCCTTGAACTC232astF:TGACCCAGTCCTGGCACGGCR:GGTGATCGATCACCACCAGC444hlyF:TGACAGGCAAGTAGAATAACGCR:TGTCCGCTTTCCACTCCC1 815ahpF:GTTAGCGTTGGCAATCTCGR:CGCTGGAGTAGGAGGAACG874altF:ATCGTCAGCGACAGCTTCTTR:CTCATCCCTTGGCTTGTTGT504
3)人工感染试验。活化菌株,挑取单菌落接种到LB液体培养基中,28 ℃、180 r/min摇床培养5 h,以4 000 g离心5 min后收集菌体,用无菌PBS洗涤3次,再用PBS重悬菌体。试验用健康青鱼经特定病原检测为阴性后,随机分为6组,其中包括3.5×104、3.5×105、3.5×106、3.5×107、3.5×108 CFU/mL 5个试验组,每组20尾,每尾注射0.1 mL菌悬液,以接种无菌PBS的青鱼作为对照组。连续观察7 d,记录试验青鱼感染后的发病症状与死亡情况;根据改良的寇氏法计算其半致死浓度(LD50),并对发病死亡的试验青鱼进行病原菌的再次分离和鉴定。
1.2.6 生物被膜形成能力测定 取菌株QAB5处于生长稳定期的菌液,在96孔微量滴定板上加入100 μL的LB肉汤和1 μL的菌液,以未接种菌液的空白培养基孔作为对照,各设置3个重复。28 ℃下孵育8~10 h,移除细菌后加入200 μL的甲醇分析纯固定25 min;用无菌PBS洗净晾干后,加入125 μL体积分数为0.1%的结晶紫染色10 min,再用PBS洗净晾干后,加入150 μL冰醋酸作用10 min;550 nm下测定OD值,判定其生物被膜形成能力。判定标准[18]:若OD≤OD空白时,表明测试菌株无生物被膜形成能力;若OD空白
1.2.7 药敏试验
1)抗菌药物敏感性试验。用无菌棉签蘸取菌液,均匀涂布在LB琼脂培养基上,采用Kirb-Bauer(K-B)纸片扩散法,将19种抗生素纸片贴在培养基上,28 ℃下恒温培养18 h后,测量药敏片的抑菌圈直径(mm),参照药敏试验判断标准判定菌株QAB5的耐药性。
2)中药敏感性试验。依据前人有关中药单方对嗜水单胞菌的抑制试验,选取黄芩、苏子、独活、款冬花、桑皮、川贝母、天竹黄、大黄、荆芥、半夏、黄连、白僵蚕、白附子、茯苓、羌活、桔梗、雄黄、朱砂、枳壳、连翘、板蓝根、鱼腥草、全蝎、野菊花、薄荷、五味子、金银花、五倍子、秦皮、首乌藤、丁香、蒲公英、桑白皮、地榆、槟榔、大青叶、罗汉果、三七和乌梅39种中药材,分别取1 g药材,加入100 mL蒸馏水煎煮,过滤后取上清液浓缩至1 mL。将药液高压灭菌后,置于4 ℃下保存。使用无菌棉签蘸取菌液均匀涂布在LB平板上,培养基上放置4个牛津杯,其中1个孔加入100 μL的无菌水作为空白对照,其余3个孔加入100 μL制备好的中药药液,于28 ℃下培养16 h,测量每种中药的抑菌圈直径。
2 结果与分析
2.1 自然发病青鱼临床症状
自然发病青鱼表现为反应迟钝,摄食减少,腹下体表弥漫性出血,伴有腹水等症状,尾部肌肉溃疡(图1A),鳃盖充血(图1B),眼球突出、充血(图1C),肛门红肿(图1D)。解剖可见,脏器弥漫性出血(图2A),鳃丝有淤血(图2B),肝脏肿大、出血(图2C),肠道有出血现象(图2D)。
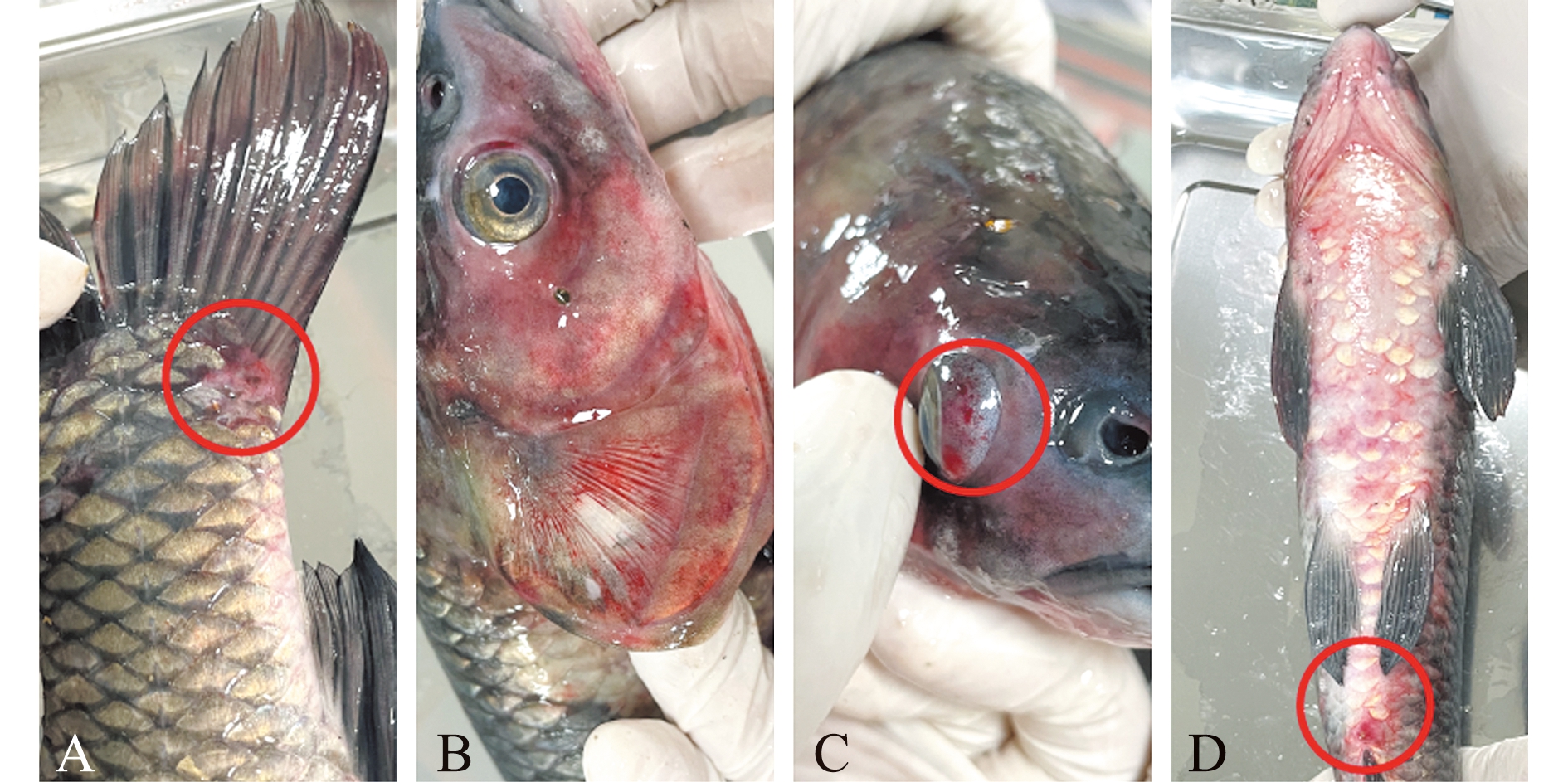
A—尾部溃疡;B—鳃盖充血;C—眼球出血;D—腹部充血、肛门红肿。
A—tail ulcer;B—congestion in operculum;C—hemophchalmos;D—abdominal congestion and anal redness.
图1 自然发病青鱼的临床病症
Fig.1 Clinical symptoms of naturally diseased Mylopharyngodon piceus
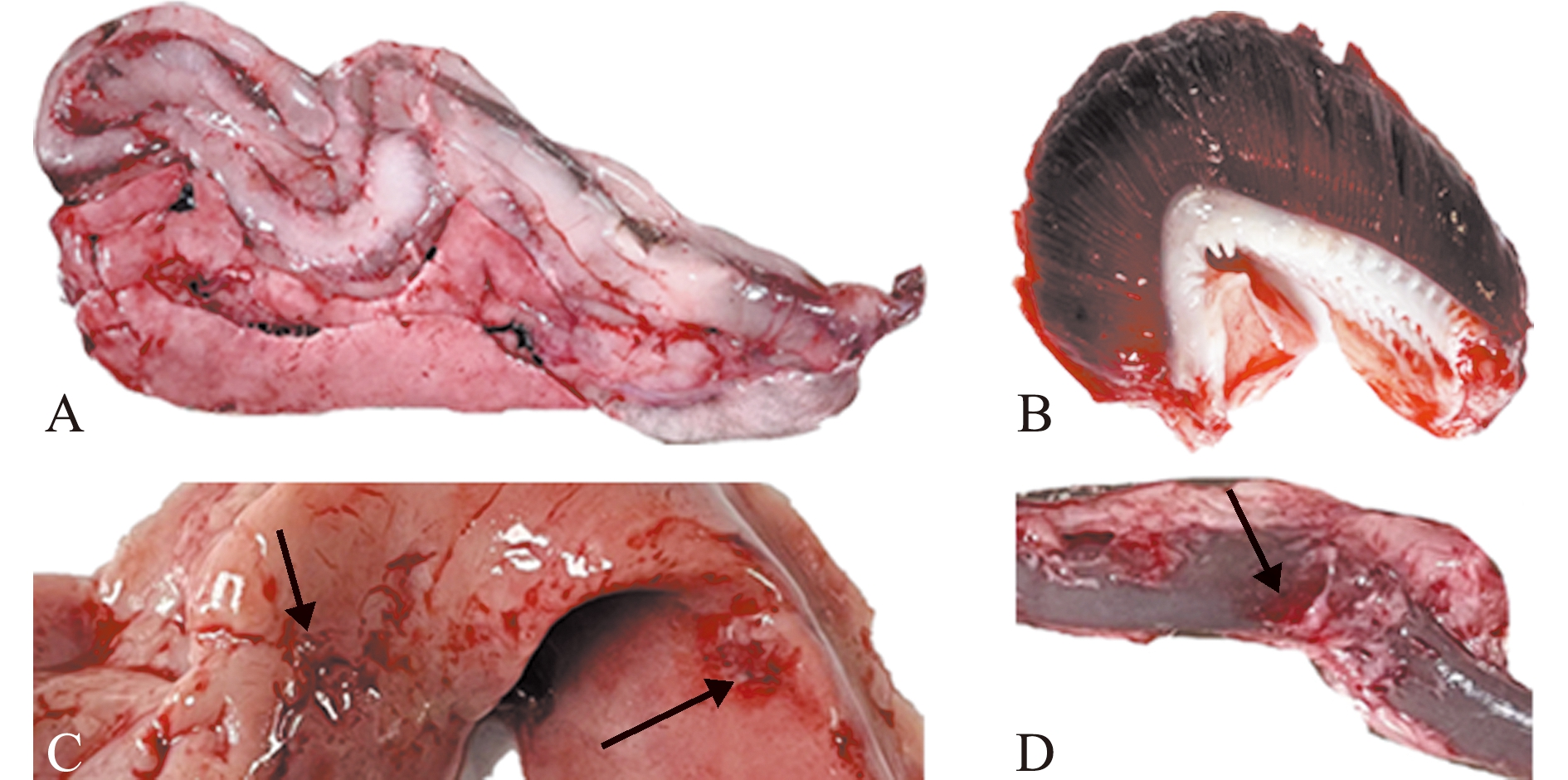
A—腹部脏器出血;B—鳃丝淤血;C—肝脏出血;D—肠道出血。
A—abdominal visceral hemorrhage;B—gill filament congestion;C—liver bleeding;D—intestinal bleeding.
图2 自然发病青鱼解剖图
Fig.2 Necropsy lesions of naturally diseased Mylopharyngodon piceus
2.2 特定病原检测
从图3可见,用嗜水气单胞菌的引物扩增出与预期片段大小相符合的特异性条带,大小为202 bp,其余细菌和病毒引物均未扩增出特异性条带,初步表明患病青鱼疑似为嗜水气单胞菌感染。
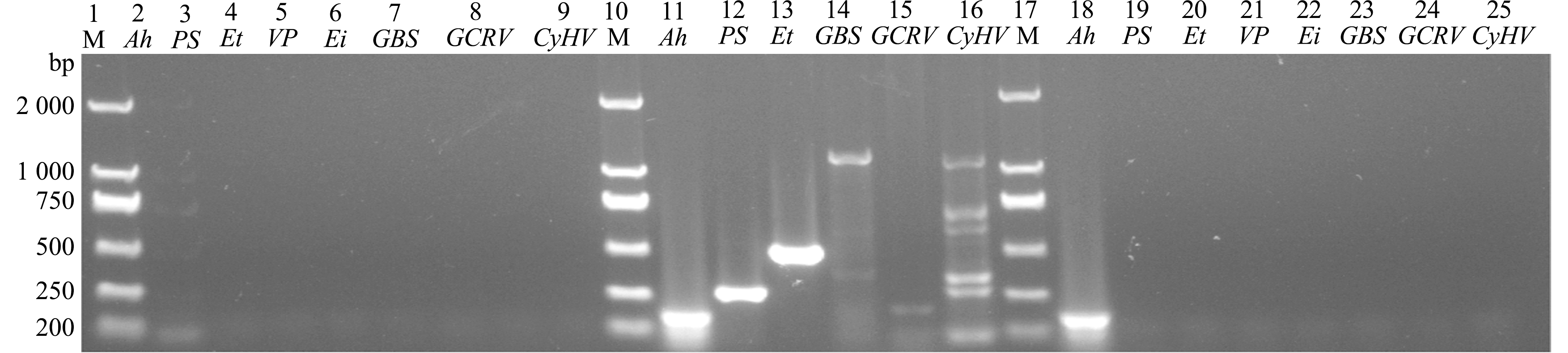
M—DNA分子质量标准;2~9—阴性对照;11~16—阳性对照;18~25—样品;2、11、18—Ah;3、12、19—PS;4、13、20—Et;5、21—VP;6、22—Ei;7、14、23—GBS;8、15、24—GCRV;9、16、25—CyHV。
M—DNA marker;2-9—negative controls;11-16—positive controls;18-25—test samples.2,11 and 18—Ah;3,12 and 19—PS;4,13 and 20—Et;5 and 21—VP;6 and 22—Ei;7,14 and 23—GBS;8,15 and 24—GCRV;9,16 and 25—CyHV.
图3 病原的PCR鉴定
Fig.3 Identification of the pathogens by PCR
2.3 嗜水气单胞菌的分离鉴定
2.3.1 嗜水气单胞菌在器官组织中的分布 从图4(a)可见,在患病鱼的肠、鳃和肝中均能扩增出嗜水气单胞菌的特异性条带,肾和脾组织中未检出,表明嗜水气单胞菌存在于患病青鱼的肠道、鳃和肝脏组织中,具有一定的嗜性。
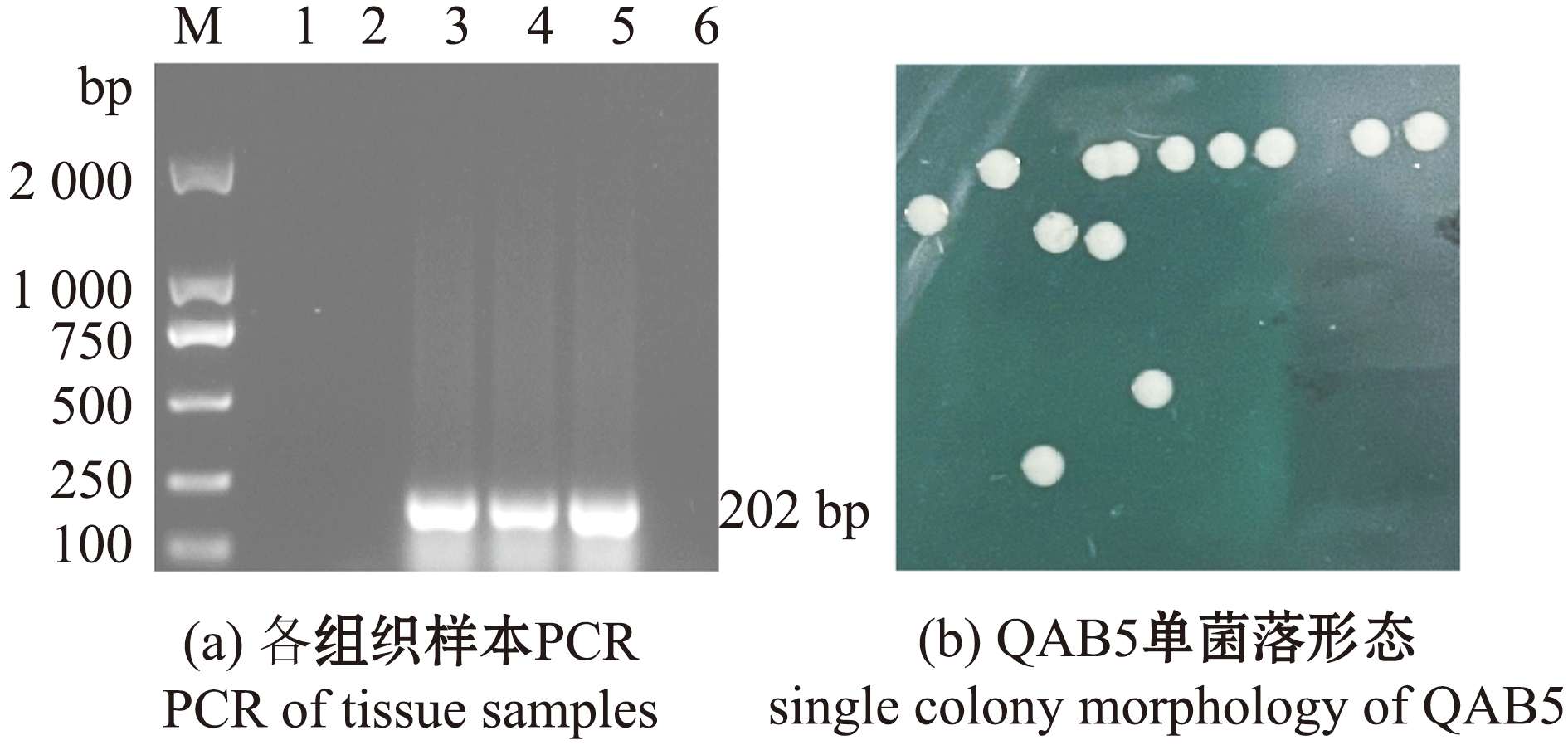
M—DNA分子质量标准;1—阴性对照;2—肾;3—肠;4—鳃;5—肝;6—脾:7—阴性对照;8—通用引物扩增嗜水气单胞菌。
M—DNA marker;1—negative control;2—kidney;3—intestine;4—gill;5—liver;6—spleen;7—negative control;8—universal primer used to amplify A.hydrophila.
图4 分离株QAB5的分子鉴定结果和形态特征
Fig.4 Molecular identification results and morphological characteristics of strain QAB5
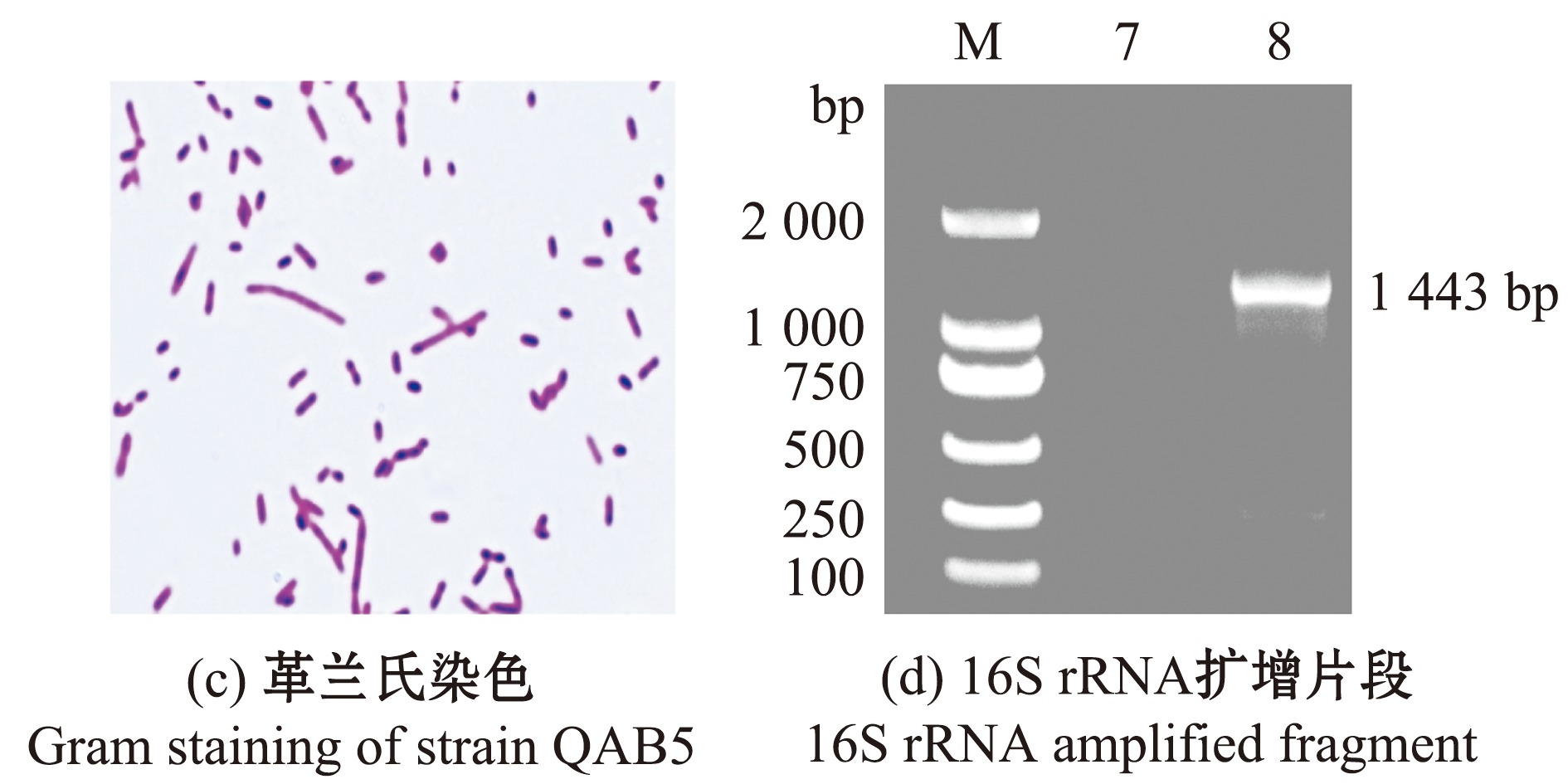
2.3.2 形态观察及生理生化鉴定 菌株QAB5在LB琼脂平板上可形成边缘光滑、中央凸起和肉色有光泽的圆形菌落(图4(b));革兰氏染色显示,其为阴性杆菌,两端钝圆,有的聚集成链状,符合嗜水气单胞菌的形态特征(图4(c))。
生理生化鉴定结果显示,菌株QAB5氧化酶反应呈阳性,能发酵葡萄糖、阿拉伯糖、七叶苷和蔗糖等,硝酸盐还原试验为阳性,不发酵肌醇,能够使明胶液化(表3),与《伯杰氏系统细菌学手册》中嗜水气单胞菌的生化特性一致。
表3 分离株QAB5的生理生化特征
Tab.3 Physiological and biochemical characteristics of strain QAB5

鉴定项目characteristic item嗜水气单胞菌Aeromonas hydrophila菌株QAB5QAB5 strain葡萄糖 glucose++甘露醇 mannitol++阿拉伯糖 arabinose++七叶苷水解 esculin hydrolysis++蔗糖 sucrose++明胶水解 gelatin hydrolysis++肌醇 inositol——鸟氨酸脱羧酶 ornithine decarboxylase——赖氨酸脱羧酶 lysine decarboxylase——精氨酸双水解酶 arginine dihydrolase++硫化氢 H2S——硝酸盐还原 nitrate reduction++葡萄糖产气 glucose gas production++M.R试验M.R test++VP试验V-P test——蕈糖 D-trehalose anhydrous++木糖 xylose——蜜二糖 melibiose——半乳糖 galactose++棉子糖 raffinose——乳糖 lactose——山梨醇 sorbitol——靛基质 indole ——氧化酶 oxidase++麦芽糖 maltose++鼠李糖 L-rhamnose monohydrate——果糖 fructose++
注:+,阳性;—,阴性。
Note:+,positive reaction;—,negative reaction.
2.3.3 16S rRNA序列鉴定 利用通用引物扩增分离菌株QAB5的16S rRNA片段,大小约为1 443 bp(图4(d))。将该菌株的16S RNA测序结果与GenBank中细菌的16S rRNA进行同源序列比对,结果显示,菌株QAB5与嗜水气单胞菌 (GenBank登录号:JN400042.1)基因序列的一致性为99.71%。
选择同源性较高的不同种属构建系统进化树,结果显示,菌株QAB5与嗜水气单胞菌的亲缘关系最近,与气单胞菌属的亲缘关系较近,与邻单胞菌属、发光杆菌属和弧菌属亲缘关系较远(图5)。综合生理生化特性和分子鉴定结果,确定分离菌株QAB5为嗜水气单胞菌。

图5 基于16S rRNA序列构建的系统进化树
Fig.5 Phylogenetic tree analysis based on 16S rRNA sequences
2.4 MLST分析结果
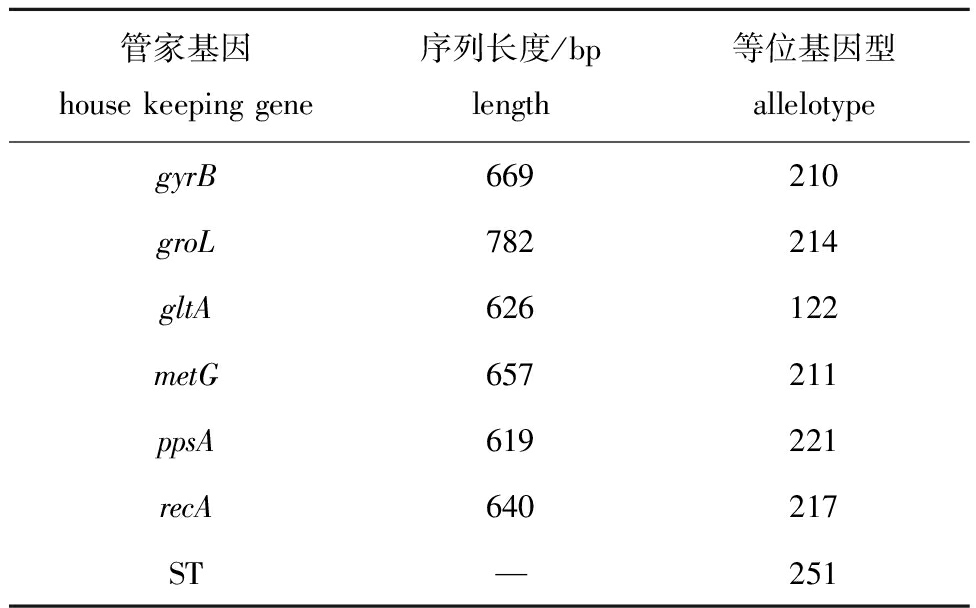
扩增分离菌株QAB5的管家基因(gyrB、groL、gltA、metG、ppsA和recA),并将序列上传至PubMLST,与数据库现有数据进行比对。结果显示,菌株QAB5为嗜水气单胞菌ST251型菌株(表4),与中国流行强毒株J-1和NJ-35同属一种等位基因型菌株。
表4 分离株QAB5的MLST分型
Tab.4 MLST typing of strain QAB5
管家基因house keeping gene序列长度/bplength等位基因型allelotypegyrB669210groL782214gltA626122metG657211ppsA619221recA640217ST—251
2.5 菌株QAB5致病性分析结果
2.5.1 溶血活性、蛋白酶活性和脂肪酶活性 菌株QAB5在3种平板上28 ℃下培养36 h后,分别出现明显的溶血圈、蛋白圈和脂肪水解圈(图6),直径分别为0.75、2.30、1.30 cm,表明分离菌株QAB5具有溶血活性、蛋白酶活性和脂肪酶活性。
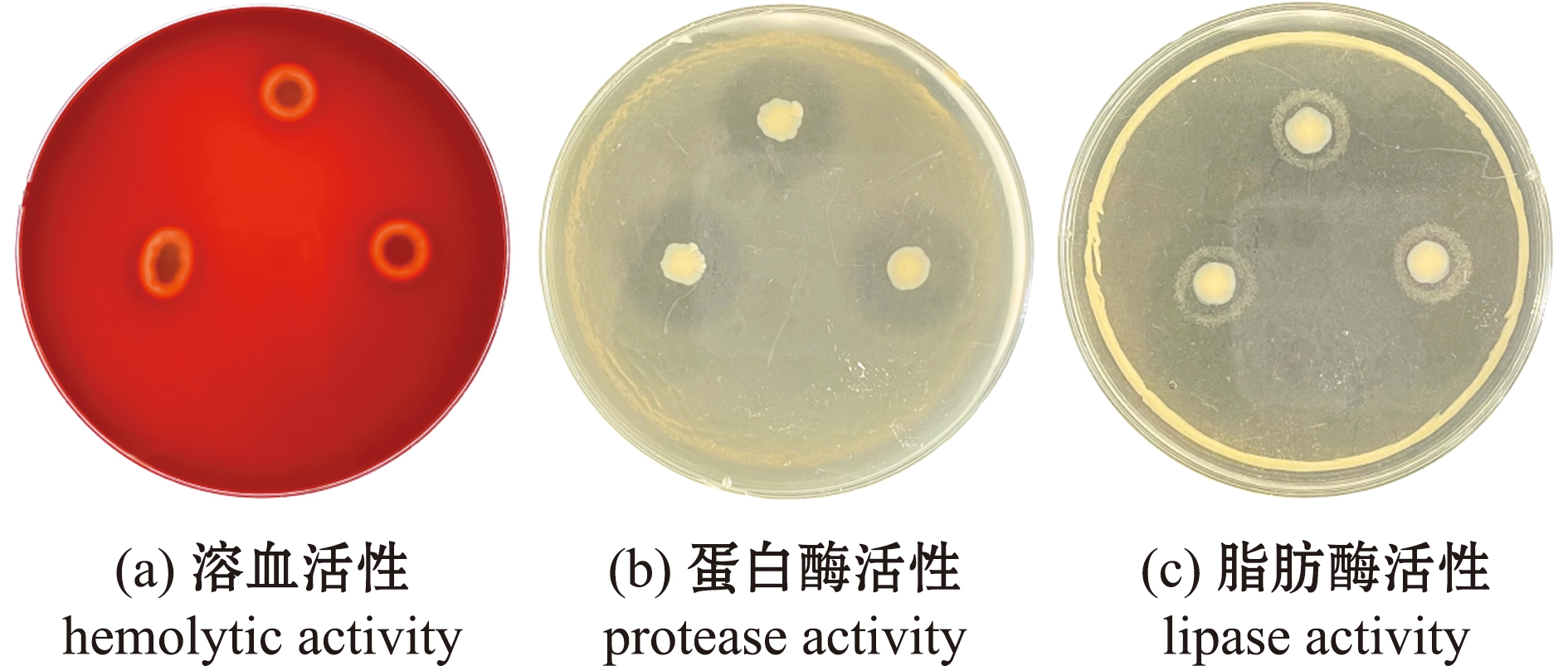
图6 分离株QAB5毒力因子表型特征
Fig.6 Phenotypic characteristics of virulence factors for strain QAB5
2.5.2 毒力基因检测 PCR检测结果显示,菌株QAB5携带aer、ahp、hly、ast、alt和act 6种毒力基因(图7),其毒力基因型为aer+hly+ahp+ast+alt+act+。
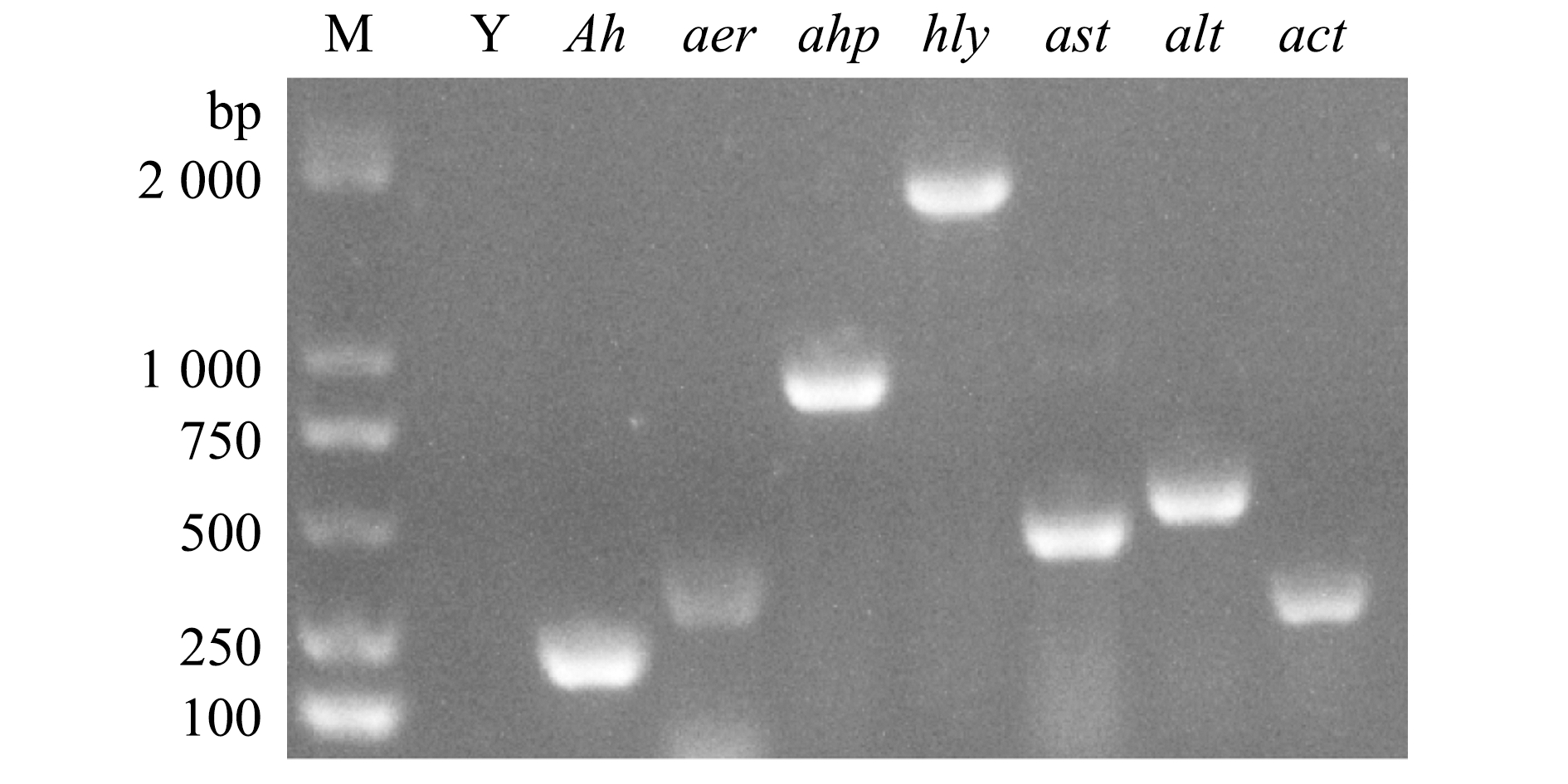
Y—阴性对照;Ah—嗜水气单胞菌特异性引物。
Y—negative control;Ah—specific primer of Aeromonas hydrophila.
图7 毒力基因检测结果
Fig.7 Results of virulence gene testing
2.5.3 人工感染试验 用分离菌株QAB5人工感染健康青鱼,最高菌液浓度组(3.5×108 CFU/mL)的青鱼在腹腔注射后4 h开始出现反应迟钝、摄食减少的现象,在感染后8 h出现暴发性死亡现象,并在2 d内全部死亡;最低菌液浓度组(3.5×104 CFU/mL)和PBS对照组青鱼在整个试验期间均未出现死亡现象;随着攻毒菌液浓度的增加,试验青鱼的死亡率逐渐上升(图8)。
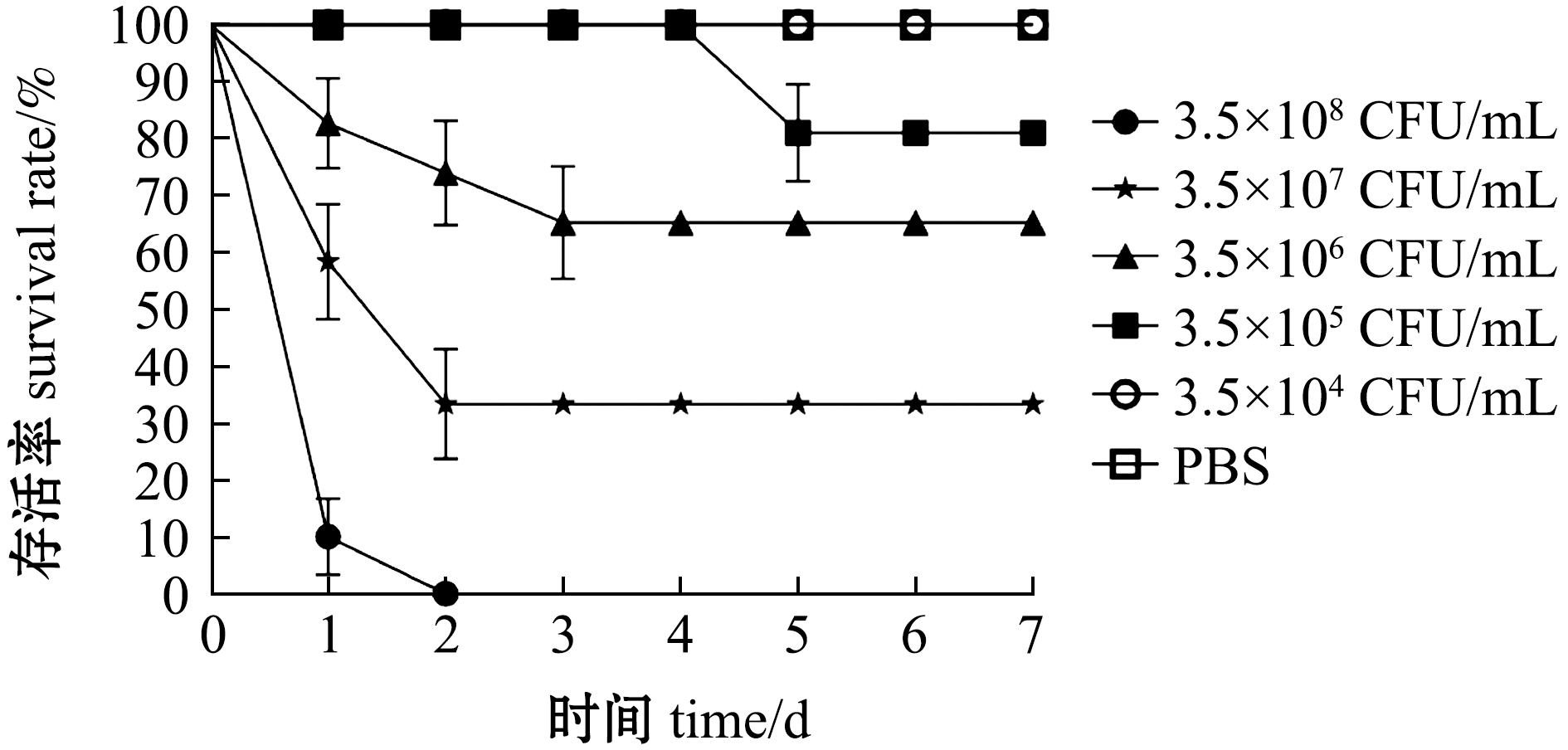
图8 青鱼感染菌株QAB5后生存曲线
Fig.8 Survival curve of Mylopharyngdon piceus challenged with strain QAB5 infection
分离菌株QAB5感染的患病青鱼出现体表和肠道出血等与自然发病青鱼类似的临床症状,试验组死亡青鱼脏器中均能检测和分离到嗜水气单胞菌,分离菌株的形态、生理生化特征和测序结果与菌株QAB5一致。计算得到QAB5的LD50为4.4×106 CFU/mL,具有高致病性。这表明,嗜水气单胞菌QAB5为高致病性的强毒株,确定其为此次青鱼出血病的致病病原。
2.6 生物被膜形成能力的测定
从图9可见,分离菌株QAB5的OD550 nm值为0.300 7,空白对照组OD550 nm值为0.075,且二者间有极显著性差异(P<0.001),参照标准判定菌株QAB5具有较强的产生物膜能力。
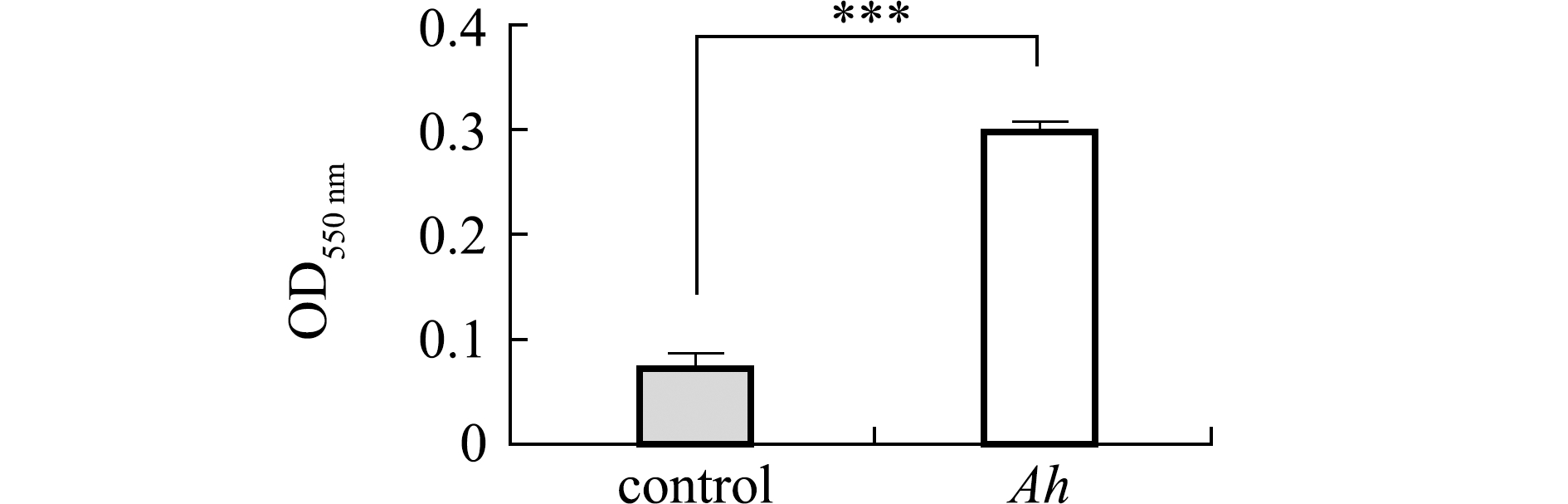
***表示与对照组有极显著性差异(P<0.01)。
***means very significant difference compared with the control
(P<0.01).
图9 菌株QAB5生物被膜形成能力
Fig.9 Biofilm forming ability of strain QAB5
2.7 药敏试验
2.7.1 抗菌药物筛选 药物敏感性试验显示,嗜水气单胞菌QAB5对阿莫西林、氨苄西林、头孢氨苄、利福平耐药,对卡那霉素、丁胺卡那、头孢哌酮、氯霉素、红霉素、庆大霉素、新霉素、多西环素、诺氟沙星、氧氟沙星、头孢曲松、米诺环素、环丙沙星和四环素敏感,对青霉素中度敏感(表5)。
表5 分离菌株QAB5药敏试验结果
Tab.5 Drug susceptibility tast results of the isolated strain QAB5
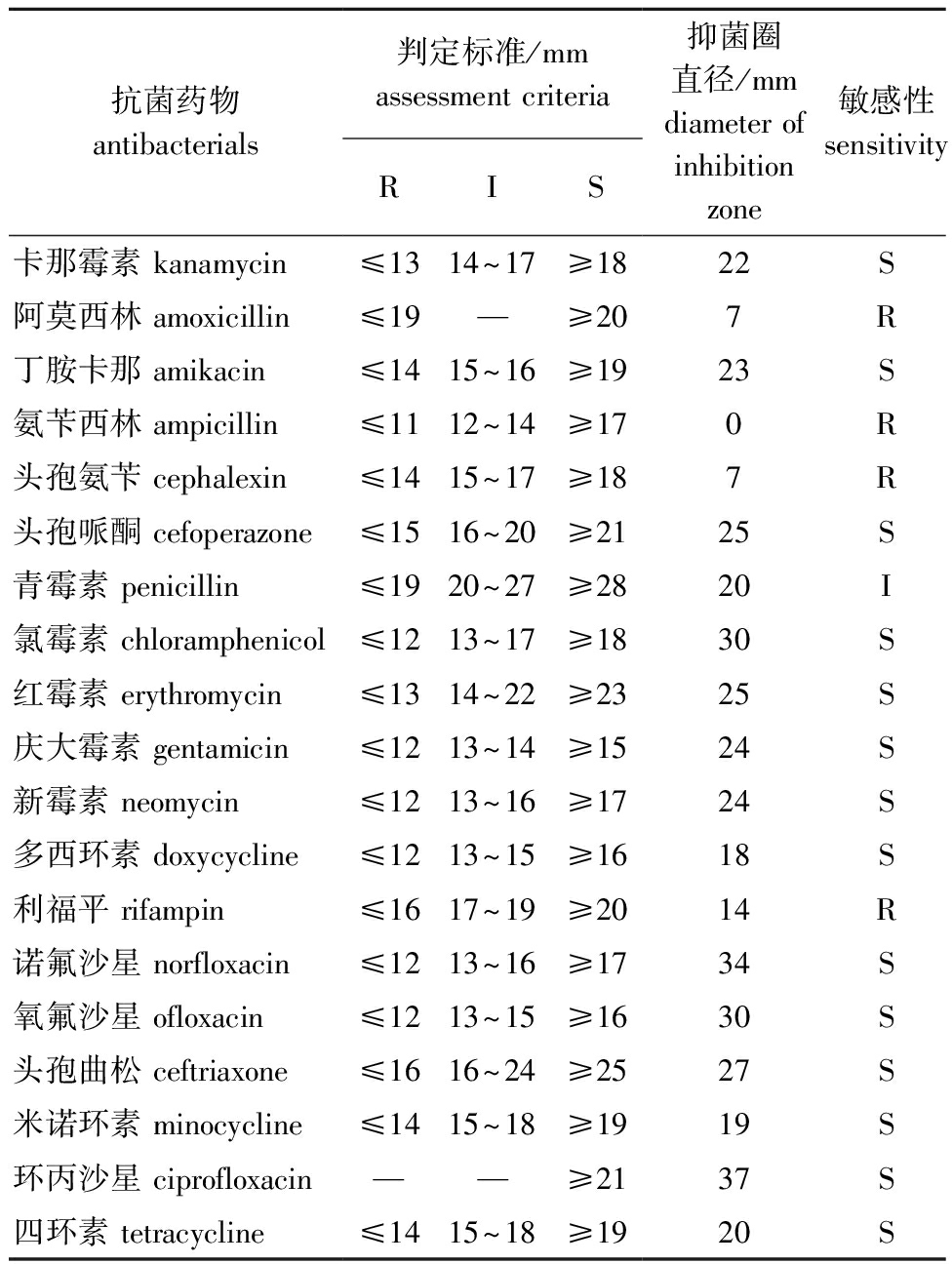
抗菌药物antibacterials判定标准/mmassessment criteriaRIS抑菌圈直径/mmdiameter of inhibition zone敏感性sensitivity卡那霉素 kanamycin≤1314~17≥1822S阿莫西林 amoxicillin≤19—≥207R丁胺卡那 amikacin≤1415~16≥1923S氨苄西林 ampicillin≤1112~14≥170R头孢氨苄 cephalexin≤1415~17≥187R头孢哌酮 cefoperazone≤1516~20≥2125S青霉素 penicillin≤1920~27≥2820I氯霉素 chloramphenicol≤1213~17≥1830S红霉素 erythromycin≤1314~22≥2325S庆大霉素 gentamicin≤1213~14≥1524S新霉素 neomycin≤1213~16≥1724S多西环素 doxycycline≤1213~15≥1618S利福平 rifampin≤1617~19≥2014R诺氟沙星 norfloxacin≤1213~16≥1734S氧氟沙星 ofloxacin≤1213~15≥1630S头孢曲松 ceftriaxone≤1616~24≥2527S米诺环素 minocycline≤1415~18≥1919S环丙沙星 ciprofloxacin——≥2137S四环素 tetracycline≤1415~18≥1920S
注:S—高度敏感;I—中度敏感;R—耐药。
Note:S—highly sensitive;I—moderately sensitive;R—resistant.
2.7.2 中药筛选 采用药敏纸片琼脂平板扩散法对菌株QAB5进行中药药敏试验,结果显示,全蝎、乌梅和丁香对菌株QAB5有明显的体外抑制效果,黄芩和荆芥有一定的抑菌效果,黄连、大黄对菌株QAB5的体外抑制效果较弱,其余32种中药对菌株QAB5无抑制作用(表6)。
表6 中药药敏试验
Tab.6 Susceptibility test of traditional Chinese medicines

中药traditional Chinese medicine抑菌圈直径/mmdiameter of inhibition zone敏感性sensitivity黄芩 (Scutellaria baicalensis)11.5+乌梅( Fructus mume)13.0+丁香 (Syzygium aromaticum)12.0+黄连 (Coptis chinensis)9.0—荆芥( Schizonepeta)11.5+大黄 (Rheum officinale)9.0—全蝎 (whole Scorpio)13.0+苏子 (Perilla)0—独活( Heracleum hemsleyanum)0—款冬花 (Tussilago farfara)0—桑皮 (Mulberry bark)0—川贝母 (Fritillaria cirrhosa)0—天竹黄 (Tabasheer)0—半夏 (Pinellia ternata)0—白僵蚕 (white Muscardine silkworm)0—白附子 (Typhonium giganteum) 0—茯苓 (Wolfiporia cocos)0—羌活 (Notopterygium incisum)0—桔梗 (Platycodon grandiflorus)0—雄黄 (Realgar)0—朱砂 (Cinnabaris)0—枳壳 (Fructus aurantii)0—连翘 (Forsythia suspensa)0—板蓝根 (Isatis tinctoria)0—鱼腥草 (Houttuynia cordata)0—野菊花 (Chrysanthemum indicum)0—薄荷 (Mentha haplocalyx)0—五味子 (Schisandra chinensis)0—金银花 (Lonicera japonica)0—五倍子 (Rhus chinensis )0—秦皮 (Cortex fraxini)0—首乌藤 (Caulis polygoni multiflori)0—蒲公英 (Taraxacum mongolicum)0—桑白皮 (Morus alba)0—地榆 (Sanguisorba officinalis)0—槟榔 (Areca catechu )0—大青叶 (Folium isatidis)0—罗汉果 (Siraitia grosvenorii)0—三七 (Panax notoginseng)0—
注:+++—极敏,抑菌直径(d)≥20 mm;++—高敏,20>d≥15 mm;+—中敏,15>d≥10 mm;— —低敏,d<10 mm。
Note:+++—extremely sensitive,diameter of inhibition zoen (d)≥20 mm;++—high sensitivity,20>d≥15 mm;+—medium sensitive,15>d≥10 mm;— —low sensitivity,d<10 mm.
3 讨论
3.1 致病性嗜水气单胞菌的鉴定
嗜水气单胞菌属于弧菌科气单胞菌属,是气单胞菌的模式种。气单胞菌属根据有无运动力可分为两类:一类是嗜冷性、非运动性的气单胞菌,另一类为嗜温性、运动性的气单胞菌,嗜水气单胞菌属于第二类[19]。根据中华人民共和国国家标准《致病性嗜水气单胞菌检验方法》可知,嗜水气单胞菌在普通琼脂平板上生长出的菌落为光滑、微凸、圆整、无色或淡黄色,有特殊芳香气味;氧化酶反应为阳性;可发酵葡萄糖、蔗糖、阿拉伯糖和七叶苷;脱脂奶平板试验菌落周围会出现清晰、透明的溶蛋白圈,符合以上特征可判定菌株为致病性嗜水气单胞菌。本研究中,从青鱼分离的菌株QAB5同时符合上述特征。分子生物学鉴定可以在核酸水平上快速、准确地对细菌种属进行鉴定,而高度保守的16S rRNA序列是鉴定细菌的理想靶基因。本研究中,通过对16S rRNA序列鉴定发现,分离菌株QAB5与嗜水气单胞菌亲缘关系最近。综合生理生化特性和分子鉴定结果,确定分离菌株QAB5为气单胞菌属的嗜水气单胞菌。
3.2 嗜水气单胞菌的毒力基因与致病力
嗜水气单胞菌由于血清型众多,又含有多种毒力因子,这些因子单个作用或多个共同作用,所以该菌的致病机制复杂,而胞外酶的分泌是气单胞菌致病过程中的一个重要特征。罗志飞等[20]研究证实,嗜水气单胞菌强毒株具有溶血活性和蛋白酶活性,而弱毒株没有。与此研究结果一致,本研究中,分离菌株QAB5具有溶血活性、蛋白酶活性和脂肪酶活性,表现出强毒株特征。
此外,嗜水气单胞菌的毒力强弱与其所携带的毒力基因型和数量密切相关。刘杰等[21]研究证实,可将携带hly和act基因并同时携带aer、alt、ahal、ahp中的2种或2种以上毒力基因作为强毒株的鉴定标准;朱大玲等[22]研究证实,ahpA阴性菌株为无毒株,强毒株呈aerA+hlyA+ahpA+基因型。本研究中,菌株QAB5同时携带aer、ahp、hly、ast、alt、act 6个毒力基因,判定其为强毒株。对菌株QAB5进行MLST分析,鉴定其为ST251型菌株,为中国和美国流行菌株,主要分布在中国的江苏、河南、湖北、湖南、广东及浙江等省份,感染的鱼类有中国的草鱼、岩原鲤、团头鲂,以及美国的斑点叉尾鮰等。庞茂达[23]分析了ST251型菌株的致病特性,发现其含有某些代谢途径,可能会帮助细菌在宿主体内获得营养物质,增强其生存增殖能力,从而使该型菌株能够成为强毒力菌株并广泛流行,提示同为ST251型的青鱼源嗜水气单胞菌分离株QAB5也具有较强的毒力。本研究中,通过人工感染健康青鱼,发现高浓度组在短时间内可使试验鱼出现暴发性死亡,其LD50为4.4×106 CFU/mL,与团头鲂源嗜水气单胞菌的LD50为1.55×105 CFU/mL[24]、岩原鲤源LD50约为7.308×105 CFU/mL[25]较为接近,表明ST251型嗜水气单胞菌有较强的致病力。综上,可判定此次青鱼出血病所分离的ST251型嗜水气单胞菌QAB5为高致病性的强毒株,也进一步证实了溶血活性、蛋白酶活性和脂肪酶活性在嗜水气单胞菌的致病机制中发挥着重要作用,为后续深入研究嗜水气单胞菌的致病机制奠定了基础。
3.3 嗜水气单胞菌的药物敏感性与病害防控
针对嗜水气单胞菌的主要治疗方式以抗生素药物为主,因此,高效、精准地使用抗生素及应用中药可以有效控制疾病传播,减少细菌耐药性的产生。孙浩然等[26]对黄颡鱼源嗜水气单胞菌HSY202005的药敏试验显示,其对四环素药物敏感,对新霉素中度敏感;对卡那霉素、氨苄西林、庆大霉素和米诺环素等7种药物耐药。王艺等[27]对草鱼源嗜水气单胞菌菌株的药敏试验显示,分离菌株对青霉素、氨苄西林和头孢氨苄等7种药物耐受,对卡那霉素、庆大霉素、丁胺卡那和头孢曲松等5种药物敏感。本研究中药敏试验显示,分离菌株QAB5与其他来源嗜水气单胞菌的药物敏感性有一定差异,但分别对β-内酰胺类药物和氨基糖苷类药物均有不同程度的耐药和敏感,这可能是由于时间、地区间用药习惯及抗生素使用史有关。细菌的生物被膜具有抗吞噬、趋化和抗菌作用,以抵抗外界环境条件的改变和逃避机体的免疫系统清除[28]。本研究中证实,分离菌株QAB5具有较强的形成生物被膜的能力,易产生致病力增强和耐药性传播的风险,提示其在临床治疗中可能面临一定困难和考验,表明要正确合理地选用敏感药物和生物被膜清除剂进行治疗。
张浩然等[29]研究发现,中药对鲫源嗜水气单胞菌的抑菌能力依次为五倍子>五味子>大黄>乌梅>诃子>山茱萸,6种中药均可抑制嗜水气单胞菌;夏与晴等[30]分析了25种中药对嗜水气单胞菌的抑制效果,发现其中20种中药能够抑制嗜水气单胞菌,石榴皮、乌梅和黄连效果最佳;苏振霞等[31]研究证实,五倍子、黄连、诃子和大黄对嗜水气单胞菌具有较好的抑菌效果,抑菌能力为大黄>诃子>黄连>五倍子;彭金菊等[32]使用32种中药对嗜水气单胞菌进行抑制试验,结果发现,五倍子、栀子、诃子、五味子、黄芩、石榴皮、乌梅、川黄连、青蒿、鱼腥草、甘草、大黄、白头翁和虎杖对其有较好的抑菌效果。本研究中发现,全蝎、乌梅、丁香、黄芩、荆芥、黄连和大黄7种中药对青鱼源嗜水气单胞菌分离菌株均有抑菌效果,且抑菌能力依次为全蝎=乌梅>丁香>黄芩=荆芥>黄连=大黄。以上试验结果存在差异可能与试验方法、所试菌株毒力的强弱,以及药物的采集区、采集季节和贮藏炮制方法等不一致有关。因此,在青鱼等淡水鱼养殖过程中要选择嗜水气单胞菌的高敏感药物,并遵循使用小剂量原则进行联合用药和精准防控,确保治疗效果,预防和减少耐药菌株的产生。
4 结论
1)本研究中从患病青鱼中分离到一株优势菌QAB5,经形态学观察、生理生化分析和16S rRNA基因序列分析鉴定为嗜水气单胞菌,其LD50为4.4×106 CFU/mL,MLST分型为ST251型,具有较强致病性。
2)青鱼源嗜水气单胞菌分离菌株QAB5携带aer、ahp、hly、ast、alt和act 6个毒力基因,具有溶血活性、蛋白酶活性和脂肪酶活性,属于强毒株。
3)分离菌株QAB5具有较强生物被膜形成能力,含多重耐药特征,在临床用药中,推荐使用环丙沙星、四环素等高敏感抗菌药物,并结合生物被膜清除剂进行小剂量精准施治。
4)全蝎、乌梅和丁香等中药对嗜水气单胞菌QAB5具有良好的体外抑制效果,可为后续研发低抗无毒的水产类中药制品提供科学参考。
[1] 杨守明,王民生.嗜水气单胞菌及其对人的致病性[J].疾病控制杂志,2006,10(5):511-514.
YANG S M,WANG M S.Aeromonas hydrophila and its pathogensis to humans[J].Chinese Journal of Disease Control &Prevention,2006,10(5):511-514.(in Chinese)
[2] 冯帅升.鲤鱼感染嗜水气单孢菌后脾脏转录组的比较分析及免疫相关基因SCARA的系统研究[D].上海:上海海洋大学,2016.
FENG S S.Comparative transcriptomic analysis of common carp spleen in response to Aeromonas hydrophila infection &genome wide characterization of scavenger receptors class a in common carp[D].Shanghai:Shanghai Ocean University,2016.(in Chinese)
[3] 李绍戊,卢彤岩.嗜水气单胞菌毒力因子研究进展[J].水产学杂志,2013,26(5):61-64.
LI S W,LU T Y.Research advances of virulence factors in bacterium Aeromonas hydrophila[J].Chinese Journal of Fisheries,2013,26(5):61-64.(in Chinese)
[4] 张波,曾令兵,罗晓松,等.青鱼肠道出血症病原菌的分离与鉴定[J].华中农业大学学报,2010,29(5):607-612.
ZHANG B,ZENG L B,LUO X S,et al.Isolation and identification of pathogen from enteric septicemia of black carp (Mylopharyngodon piceus)[J].Journal of Huazhong Agricultural University,2010,29(5):607-612.(in Chinese)
[5] 叶键,刘晓宁,王晓,等.青鱼(Mylopharyngodon piceus)新发病病原类志贺邻单胞菌(Plesiomonas shigelloides)的分离鉴定[J].海洋与湖沼,2016,47(3):633-639.
YE J,LIU X N,WANG X,et al.Isolation and identification of pathogenic Plesiomonas shigelloides from diseased black carp (Mylopharyngodon piceus)[J].Oceanologia et Limnologia Sinica,2016,47(3):633-639.(in Chinese)
[6] 梁睿.青鱼细菌性败血症的病态特征与防治[J].畜牧兽医科技信息,2007(10):92.
LIANG R.Pathological characteristics and control of bacterial septicemia of herring[J].Chinese Journal of Animal Husbandry and Veterinary Medicine,2007(10):92.(in Chinese)
[7] WANG H R,HU Y H,ZHANG W W,et al.Construction of an attenuated Pseudomonas fluorescens strain and evaluation of its potential as a cross-protective vaccine[J].Vaccine,2009,27(30):4047-4055.
[8] 曹恒源.养殖鲈鲤致病性类志贺邻单胞菌的分离与鉴定[D].贵阳:贵州大学,2017.
CAO H Y.Isolation and characterization of pathogens Plesiomonas shigelloides isolated from farm-cultured Percocypris pingi (Tchang)[D].Guiyang:Guizhou University,2017.(in Chinese)
[9] 中华人民共和国海关总署.迟缓爱德华氏菌病检疫技术规范:SN/T 5188—2020[S].北京:中国海关出版社,2021.
General Administration of Customs of the People’s Republic of China.Technical specifications for quarantine of Edwards tarda disease:SN/T 5188—2020[S].Beijing: China Customs Press.(in Chinese)
[10] 胡元庆,黄玉萍,李凤霞,等.水产品中副溶血性弧菌LAMP检测方法的优化[J].现代食品科技,2017,33(6):313-320,247.
HU Y Q,HUANG Y P,LI F X,et al.Optimization of loop-mediated isothermal amplification methods for the detection of Vibrio parahaemolyticus in aquatic products[J].Modern Food Science and Technology,2017,33(6):313-320,247.(in Chinese)
[11] 刘贝贝.无乳链球菌、海豚链球菌及荧光假单胞菌多重PCR检测方法的建立和应用[D].雅安:四川农业大学,2013.
LIU B B.Establishment and application of triple PCR assay for identification of Streptococcus agalactiae,Streptococcus iniae and Pseudomonas fluoroscens[D].Yaan:Sichuan Agricultural University,2013.(in Chinese)
[12] 郭欣.南方鲇爱德华氏菌的分离鉴定及双重PCR诊断方法的建立[D].雅安:四川农业大学,2014.
GUO X.Isolation and identification of Edwardsiella in south catfish and establishment of the duplex PCR for detection of Edwardsiella[D].Yaan:Sichuan Agricultural University,2014.(in Chinese)
[13] 彭军辉,安伟,张明辉.鲤疱疹病毒2型和3型三重PCR检测方法的建立与应用[J].渔业科学进展,2021,42(6):158-164.
PENG J H,AN W,ZHANG M H.Establishment and application of the triplex PCR method for simultaneous detection of cyprinid herpesvirus 2 and cyprinid herpesvirus 3[J].Progress in Fishery Sciences,2021,42(6):158-164.(in Chinese)
[14] 曾伟伟,王庆,王英英,等.草鱼呼肠孤病毒三重PCR检测方法的建立及其应用[J].中国水产科学,2013,20(2):419-426.
ZENG W W,WANG Q,WANG Y Y,et al.Establishment of multiplex PCR for detection of grass carp reovirus and its application[J].Journal of Fishery Sciences of China,2013,20(2):419-426.(in Chinese)
[15] 刘俊琦.蛇源ST516型嗜水气单胞菌鉴定及其对粘菌素耐药机制研究[D].长沙:湖南农业大学,2020.
LIU J Q.Identification of snake-original ST516 Aeromonas hydrophila and its mechanisms of colistin resistance[D].Changsha:Hunan Agricultural University,2020.(in Chinese)
[16] 谭爱萍,赵飞,郭忠宝,等.大口黑鲈白皮病病原菌的分离鉴定及药物敏感性试验[J].微生物学通报,2022,49(5):1741-1758.
TAN A P,ZHAO F,GUO Z B,et al.Isolation,identification,and antimicrobial susceptibility test of the pathogen from largemouth bass(Micropterus salmoides)with white skin disease[J].Microbiology China,2022,49(5):1741-1758.(in Chinese)
[17] 薛明洋,周勇,梁宏伟,等.一株中华鳖源嗜水气单胞菌的分离鉴定及毒力基因分析[J].中国农学通报,2021,37(20):152-159.
XUE M Y,ZHOU Y,LIANG H W,et al.Isolation,identification and virulence gene analysis of an Aeromonas hydrophila from diseased Pelodiscus sinensis[J].Chinese Agricultural Science Bulletin,2021,37(20):152-159.(in Chinese)
[18] 韩坤.貂源肺炎克雷伯菌的生物学特性及致病性研究[D].北京:中国农业科学院,2019.
HAN K.Biological characterisitcs and pathogenicity analysis of Klebsiella pneumoniae from mink[D].Beijing:Chinese Academy of Agricultural Sciences,2019.(in Chinese)
[19] 姚伦.团头鲂暴发性败血症病原和免疫防治研究[D].南昌:南昌大学,2008.
YAO L.Studies on the pathogen and immune intervention of fulminant septicaemia Megalobrama amblycephala[D].Nanchang:Nanchang University,2008.(in Chinese)
[20] 罗志飞,胡萌,陆承平,等.3株嗜水气单胞菌弱毒株的毒力相关特性分析[J].中国兽医学报,2012,32(1):48-51,57.
LUO Z F,HU M,LU C P,et al.Virulence-associated characterization analysis of three strains of Aeromonas hydrophila[J].Chinese Journal of Veterinary Science,2012,32(1):48-51,57.(in Chinese)
[21] 刘杰,黄艳华,黄钧,等.黄沙鳖源嗜水气单胞菌的致病力与毒力基因型相关性[J].中国水产科学,2015,22(4):698-706.
LIU J,HUANG Y H,HUANG J,et al.Studies on the correlation with pathogenicity and virulence genes of Aeromonas hydrophila by Truogx sinensis[J].Journal of Fishery Sciences of China,2015,22(4):698-706.(in Chinese)
[22] 朱大玲.嗜水气单胞菌毒力基因及基因工程疫苗[D].武汉:中国科学院研究生院(水生生物研究所),2006.
ZHU D L.The virulence genes and genetic engineering vaccines of Aeromonas hydrophila[D].Wuhan:Institute of Hydrobiology,Chinese Academy of Sciences,2006.(in Chinese)
[23] 庞茂达.嗜水气单胞菌流行株基因组特征及毒力相关基因研究[D].南京:南京农业大学,2015.
PANG M D.Genomic characteristics and virulence-associated genes analysis of Aeromonas hydrophila[D].Nanjing:Nanjing Agricultural University,2015.(in Chinese)
[24] 王超杰,王至诚,康兴宇,等.一株分离自团头鲂的嗜水气单胞菌病原学及其与ST251型菌株的全基因组比较[J].中国水产科学,2021,28(4):503-516.
WANG C J,WANG Z C,KANG X Y,et al.Aetiology characteristics of a pathogenic Aeromonas hydrophila strain isolated from Megalobrama amblycephala and genomic characterization with the epidemic ST251 clones[J].Journal of Fishery Sciences of China,2021,28(4):503-516.(in Chinese)
[25] 陈梦竹,康振亚,郭向辉,等.一株岩原鲤源致病性ST-251型嗜水气单胞菌的分离与生物学特性研究[J].浙江农业学报,2021,33(12):2286-2294.
CHEN M Z,KANG Z Y,GUO X H,et al.Isolation and biological characteristics of a pathogenic ST-251 Aeromonas hydrophila from rock carp (Procypris rabaudi)[J].Acta Agriculturae Zhejiangensis,2021,33(12):2286-2294.(in Chinese)
[26] 孙浩然,王丽,杨洋,等.患腹水病黄颡鱼嗜水气单胞菌的分离、鉴定及特性分析[J].武汉轻工大学学报,2021,40(5):1-8,39.
SUN H R,WANG L,YANG Y,et al.Isolation,identification and characteristics of Aeromonas hydrophila from Pelteobagrus fulvidraco with ascites[J].Journal of Wuhan Polytechnic University,2021,40(5):1-8,39.(in Chinese)
[27] 王艺,刘文珍,傅松哲,等.一株从草鱼中分离的嗜水气单胞菌的病原学及基因组特征[J].水产学报,2019,43(4):1181-1191.
WANG Y,LIU W Z,FU S Z,et al.Etiology and genomic characteristics of an Aeromonas hydrophila strain isolated from Ctenopharyngodon idella[J].Journal of Fisheries of China,2019,43(4):1181-1191.(in Chinese)
[28] 陈朝喜.细菌生物被膜定性和定量研究方法[J].湖北农业科学,2016,55(9):2177-2180.
CHEN C X.Qualitative and quantitative research methods of bacterial biofilm[J].Hubei Agricultural Sciences,2016,55(9):2177-2180.(in Chinese)
[29] 张浩然,刘琴琴,徐杭忠,等.不同单味中草药与其复配组方对鲫鱼源嗜水气单胞菌的抑菌效果[J].贵州农业科学,2022,50(3):74-82.
ZHANG H R,LIU Q Q,XU H Z,et al.Bacteriostatic effect of six Chinese herbal medicines and their compounds on Aeromonas hydrophila from Carassius auratus[J].Guizhou Agricultural Sciences,2022,50(3):74-82.(in Chinese)
[30] 夏与晴,刘文珍,傅松哲,等.25种中草药及其联合用药配伍对5种水产养殖常见致病菌的抑菌作用[J].大连海洋大学学报,2019,34(1):7-14.
XIA Y Q,LIU W Z,FU S Z,et al.Antimicrobial effects of 25 kinds of Chinese herbal medicines and their combinations on five routine pathogenic bacteria in aquaculture[J].Journal of Dalian Ocean University,2019,34(1):7-14.(in Chinese)
[31] 苏振霞,肖辉,陈列欢,等.中药单味药及复方对嗜水气单胞菌的体外抑菌作用[J].中国兽医杂志,2011,47(11):52-54.
SU Z X,XIAO H,CHEN L H,et al.In vitro antibacterial effect of Chinese herbal medicine against Aeromonas hydrophila[J].Chinese Journal of Veterinary Medicine,2011,47(11):52-54.(in Chinese)
[32] 彭金菊,马驿,罗伟英,等.32种中药及其复方对嗜水气单胞菌体外抑菌效果[J].中兽医医药杂志,2009,28(6):5-7.
PENG J J,MA Y,LUO W Y,et al.Antibacterial effects of 32 kinds of Chinese herbs and compounds against Ameromnas hydrophila in vitro[J].Journal of Traditional Chinese Veterinary Medicine,2009,28(6):5-7.(in Chinese)