病害是影响水产养殖产业发展的主要原因之一。据《2022年中国水生动物卫生状况报告》报道,2021年中国水产养殖产业因病害造成的经济损失约为539亿元。其中,弧菌病是影响多种水产养殖动物尤其是海水养殖鱼类、贝类和甲壳类最常见的细菌性疾病之一[1]。Chong等[2]研究发现,石斑鱼(Epinephelus spp.)约66.7%的疾病属于弧菌病,且影响石斑鱼生长的各个阶段,并会导致高达50%的死亡率。由副溶血弧菌(Vibrio parahaemolyticus)引起的对虾急性肝胰腺坏死综合征(acute hepatopancreatic necrosis disease,AHPND)导致2010—2016年中国、马来西亚、墨西哥、泰国和越南共计440亿美元的经济损失;患AHPND的虾苗在投苗后10~35 d内,可达100%的死亡率[3]。因此,开展弧菌病防控技术研究对水产养殖业的可持续发展意义重大。
目前,控制水产动物弧菌病的主要手段是以抗生素为代表的药物防治、以疫苗为代表的免疫防治及以益生菌为代表的生物防治。抗生素是早期养殖生产中防治弧菌病的主要手段,在弧菌病防控中也发挥着巨大的作用[4]。然而,随着抗生素广泛使用产生的选择性压力导致耐药性细菌的发生、留存和传播[5],降低了药物防控的效果,也对环境和食品安全造成了巨大的隐患。目前,水产养殖中可用的抗生素药剂仅包括甲砜霉素粉、 氟苯尼考粉、 氟苯尼考注射液、 氟甲喹粉、 恩诺沙星粉、 盐酸多西环素粉、 维生素 C 磷酸酯镁盐酸环丙沙星预混剂、盐酸环丙沙星盐酸小檗碱预混剂、硫酸新霉素粉、 磺胺间甲氧嘧啶钠粉、 复方磺胺嘧啶粉、 复方磺胺二甲嘧啶粉和复方磺胺甲噁唑粉 13种药物(水产养殖用药明白纸2022年2号),而随着耐药性的增加,原本可用于治疗AHPND的四环素和土霉素已经被限制使用[6]。疫苗接种是弧菌病的另一种有效控制策略,其是基于养殖动物免疫系统开发的用于预防感染性病害发生的一类生物制品。然而,弧菌疫苗具有一定的局限性:一是由于区域性菌种的差异导致有效性不理想;二是只能覆盖部分养殖品种,对缺乏适应性免疫反应的虾蟹贝等不能进行疫苗接种;三是疫苗再次免疫困难,免疫保护时间有限。因此,具有水产养殖市场授权的弧菌疫苗数量有限,国际上预防鱼类弧菌病的商品化疫苗仅5种,主要针对溶藻弧菌(V.alginolyticus)、副溶血弧菌、创伤弧菌(V.vulnificus)和鳗弧菌(V.anguillaris)感染引起的弧菌病[7],国内获得中国新兽药证书且用于预防弧菌病的疫苗仅2种,即牙鲆溶藻弧菌、鳗弧菌和迟缓爱德菌病多联抗独特型抗体疫苗,以及大菱鲆鳗弧菌基因工程活疫苗 (MVAV6203 株)[8],不能完全覆盖现有的弧菌种类和养殖品种。生物防治在水产养殖全过程进行疾病的广谱预防和控制上具有优势,且对环境和食品安全影响小,是具有巨大潜力的病害防控技术。
本文在总结弧菌病病原学、流行病学、发病机制和诊断方法的基础上,重点从作用机制方面综述了弧菌病最新的生物防治技术,并阐述了生物防治技术在不同水产动物中的应用,以期为水产养殖动物弧菌病的生物防治研究提供科学参考。
1 水产动物弧菌病概况
1.1 病原学
弧菌病通常指由弧菌科(Vibrionaceae)细菌引起的系统性细菌感染,进而引起的败血症、肠胃炎和溃疡等[9](表1)。目前,被详细描述和鉴定的弧菌科细菌有143种,隶属于6个属,即不利弧菌属(Aliivibrio)、肠弧菌属(Enterovibrio)、格里蒙特氏菌属(Grimontia)、发光细菌属(Photobacterium)、盐弧菌属(Salinivibrio)和弧菌属(Vibrio)[7]。引起弧菌病最主要的是某些种类的弧菌,其次是发光杆菌。仅弧菌属就有123个物种(http://www.bacterio.net/)被鉴定,其中危害水产动物最主要的是哈维弧菌(V.harveyi)、副溶血弧菌、溶藻弧菌和鳗弧菌[10]。此外,拟态弧菌(V.mimicus)是一种非嗜盐弧菌,在淡水养殖鱼类中也会造成严重危害。而引起弧菌病的发光杆菌主要是美人鱼发光杆菌(P.damselae),包括美人鱼亚种[P.damselae subsp.damselae,之前被称为美人鱼弧菌(V.damsela)]和杀鱼亚种[P.damselae subsp.psicicida,之前被称为杀鱼巴斯德氏菌(Pasteurella piscicida)]2个亚种。
表1 主要的水产动物弧菌病
Tab.1 Main vibriosis of animals in aquatulture

宿主 host疾病 disease病原 pathogen参考文献 reference鱼类 fish鳗鱼红虫/红熬病鳗弧菌红斑病鳗弧菌溃疡综合征鳗弧菌冬季溃疡病黏弧菌、沃达尼斯弧菌冷水弧菌病(Hitra病)杀鲑弧菌鳞片脱落和肌肉坏死病哈维弧菌血管炎哈维弧菌感染性坏死性肠炎哈维弧菌板鳃类疾病美人鱼发光杆菌美人鱼亚种、哈维弧菌眼部病变哈维弧菌水疖病鳗弧菌尾腐病副溶血弧菌温水弧菌病创伤弧菌Mohamad等[12]虾、蟹类 shrimp and crab对虾急性肝胰腺坏死病副溶血弧菌对虾发光弧菌病哈维弧菌对虾幼体弧菌病鳗弧菌、海弧菌、溶藻弧菌和副溶血弧菌等对虾红腿病副溶血弧菌、鳗弧菌和溶藻弧菌等对虾烂鳃病哈维弧菌等 养成期烂眼病非 01 群霍乱弧菌甲壳溃疡病杀对虾弧菌等蟹弧菌病鳗弧菌、溶藻弧菌和副溶血弧菌等舒琥等[13]贝类 shellfish鲍肌肉萎缩症哈维弧菌和副溶血弧菌杂色鲍幼苗急性脱板症溶藻弧菌和溶珊瑚弧菌皱纹盘鲍脓疱病哈维弧菌方斑东风螺肿吻症哈维弧菌舒琥等[13]
1.2 流行病学
弧菌病最初在鳗鱼中被描绘和命名,现在在全球范围内各种野生和养殖的海洋鱼类、甲壳类、软体动物和珊瑚等中流行(表1)。Noga[11]指出,所有海洋鱼类可能至少对一种弧菌敏感。因此,弧菌病已成为许多水产动物常见的一种疾病。
温暖的海水最有利于弧菌的生存和繁殖,病原体在鱼类之间迅速传播,使弧菌病成为一种“夏季”疾病。因此,弧菌病尤其对热带国家的水产养殖业构成威胁。如在马来西亚及其邻国,全年平均28 ℃的热带气候,使得许多水产养殖场弧菌病频发。其中,从养殖鲈、石斑鱼和鲷等鱼类中最常分离出的病原菌是哈维弧菌,其次是副溶血弧菌、溶藻弧菌和鳗弧菌[10]。Noorlis等[14]报道了在马来西亚两种常见淡水鱼——罗非鱼(Oreochromis sp.)和鲇鱼(Pangasius hypophthalmus)中副溶血弧菌的感染情况。另一项调查显示,从泥蟹(Scylla serrata)、花蟹(Portunus pelagicus)、地毯蛤(Paphia textile)、硬壳蛤(Meretrix meretrix)和泥海蜷(Cerithidea obtusa)中也分离出了副溶血弧菌,且这些弧菌对水产养殖中常用抗生素显示出高耐药性[15]。自2009年在中国发现AHPND以来,由副溶血弧菌引起的AHPND一直是全球虾养殖业的重大威胁[3],同时,中国象山湾大黄鱼(Larimichthys crocea)也受到溶藻弧菌、哈维弧菌和副溶血弧菌等的频繁感染[16]。此外,近年来,随着气候变暖,许多温带和寒冷地区的软体动物也暴发了弧菌病[17]。如在爱尔兰海及周边地区,弧菌病引起大范围双壳类软体动物幼虫和一些甲壳类动物大量死亡[18]。
美人鱼发光杆菌是引起弧菌病样症状的另一种主要病原体,这种疾病也称为光细菌病[19]。自美人鱼光杆菌首次从斑鳍光鳃鱼(Chromis punctipinnis)的皮肤溃疡中分离出以来[20],其感染已传播到各种宿主,如大菱鲆、虹鳟、卵形鲳鲹、鳗、鲈、鰤和鲷[21]。美人鱼光杆菌包括美人鱼亚种和杀鱼亚种2个亚种。美人鱼亚种已被广泛认为是鱼类和哺乳动物(包括人类)的机会致病菌,而杀鱼亚种在多种海洋鱼类中引起严重的败血症(称为假结核)。与其他弧菌一样,杀鱼亚种因其无处不在,而且具有广泛的抗生素耐药性,使得其感染宿主广泛,且缺乏有效的疫苗,对海水养殖业影响较大。
1.3 发病机制
疾病的发生是病原、环境和宿主 “三元”系统作用的结果(图1)。从病原角度分析,弧菌病发病过程一般包括病原弧菌黏附与体表定植、侵袭、体内定植与增殖扩散、产生毒素及宿主死亡等过程[7,22]。
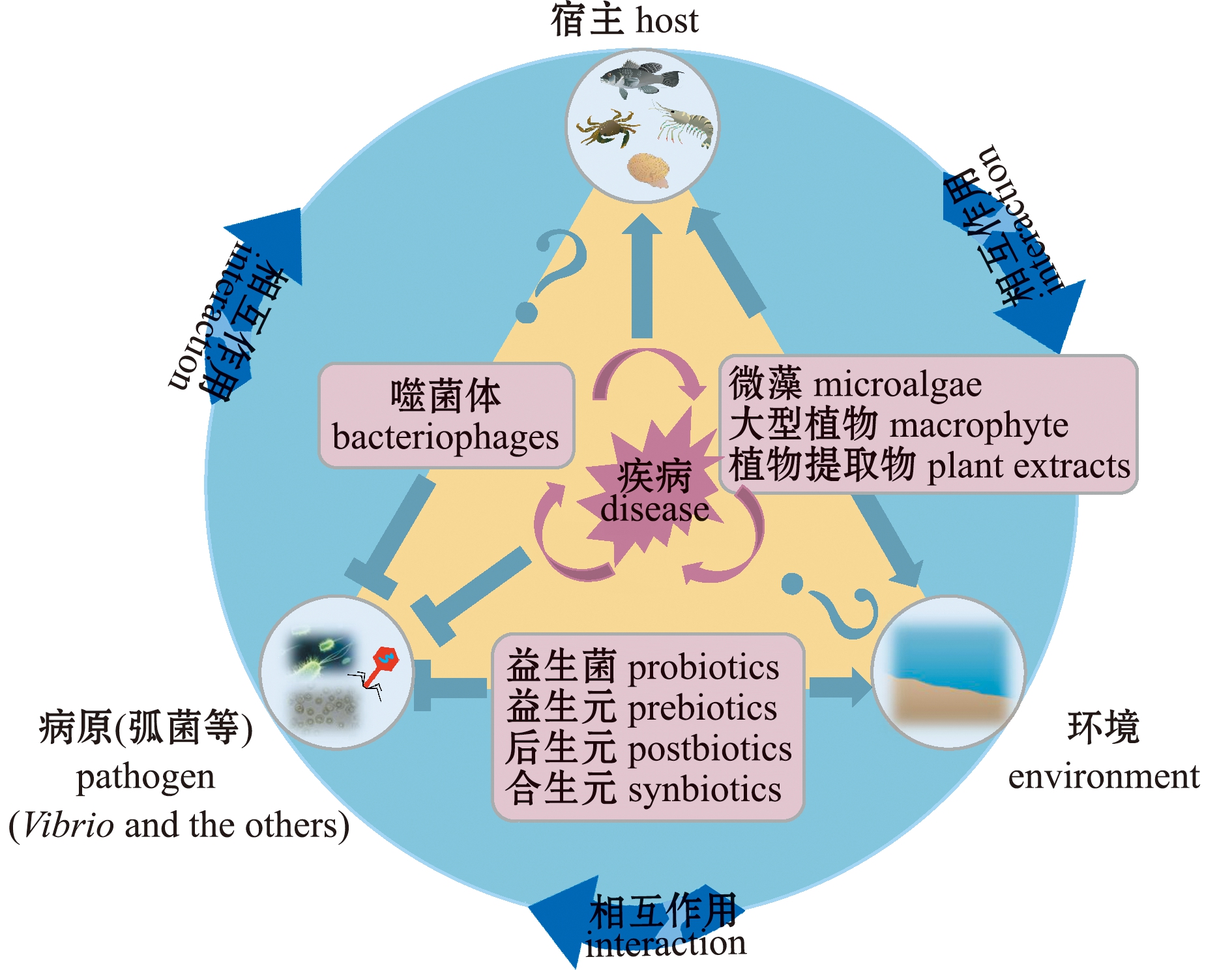
图1 水产动物疾病的发生及其生物防治(改编自参考文献[23]的图1)
Fig.1 Occurrence and biological control of animal diseases(adapted from Fig.1 of reference [23])
发病的第一个关键步骤是病原菌黏附并定植在宿主的黏膜表面。成功的黏附是后续定植和建立感染的先决条件,微生物细胞表面的疏水性决定了弧菌成功黏附到宿主组织。菌毛黏附素及鞭毛、外膜蛋白等非菌毛黏附素,在弧菌与宿主细胞的初始附着中也起着至关重要的作用。而生物膜是许多细菌在环境中生存和传播的关键因素,且生物膜的形成是致病性弧菌定植的一个重要毒力因素。
病原菌定植只意味着微生物在宿主体表或体内繁殖位点的建立,并不表示会导致对组织的入侵和损伤。病原体需要抵御宿主防御,从而侵入宿主组织,在宿主体内定植并增殖扩散,进而对宿主组织造成损害。最常见的弧菌感染途径是通过口腔、鳃和皮肤。在细菌感染后,宿主免疫系统触发先天和/或适应性免疫反应来中和入侵的细菌。弧菌分泌的细胞外产物(ECPs),如蛋白酶、溶血素、磷脂酶、铁载体和细胞毒素,有助于其在引起宿主疾病前逃避宿主防御。炎症反应在细菌黏附和定植后的宿主防御机制中也至关重要。弧菌通过各种炎症诱导因子,如脂多糖、肽聚糖、脂肽、脂质A、鞭毛蛋白、菌毛蛋白、DNA和外毒素,诱导炎症反应,导致宿主过度产生炎症介质,造成宿主严重的组织损伤甚至死亡,即败血症。此外,分泌系统,如Ⅲ型分泌系统(Type Ⅲ secretion systems,T3SSs),是高度专门化的弧菌等革兰氏阴性菌注射装置,通过细胞膜将细菌蛋白(效应器)直接注射到宿主细胞的细胞质中,并参与细胞毒性,并能诱导细胞自噬、变圆和裂解等。
需要特别注意的是,尽管高毒力弧菌菌株可引起原发疾病,特别是在无脊椎动物和几种养殖鱼中,如患AHPND的凡纳滨对虾(Litopenaeus vannamei)及1990—1996年西班牙西南部养殖场感染弧菌的金头鲷(Sparus aurata L.),弧菌常与其他已知的细菌病原体[如海水屈挠杆菌(Tenacibaculum maritimum)和假单胞菌(Pseudomonas spp.)]及病毒性病原体[如感染性胰腺坏死病毒(IPNV)和海洋双RNA病毒(MABV-F)]等实现共感染。因此,弧菌经常被称为继发性或机会性病原体。
1.4 诊断方法
弧菌病的诊断通常使用标准的微生物学方法,基于病原体分离和培养,获得纯培养的细菌后进行后续的鉴定和人工感染试验等[21-22]。
1)病原体的分离和培养。病原体的分离和培养需要选定具有临床症状的目标组织。分离全身弧菌感染的首选器官是肾脏、肝脏和脾脏,当存在溃疡时,可选择从病变皮肤中分离。此外,胃肠道和眼等也可以进行弧菌的分离。合适的培养条件是获得病原菌的基础,主要考虑培养基、温度和时长等因素。如硫代硫酸盐-柠檬酸盐-胆汁盐-蔗糖(TCBS)是分离弧菌最常用的选择性培养基。选择性培养基的利用也被证明在针对特定物种的弧菌方面更有效。例如,CHROMagarTM Vibrio(CaV)用于分离副溶血弧菌和创伤弧菌,而X-Gal(VVX)、纤维二糖多黏菌素(CPC)和纤维二糖黏菌素(CC)琼脂则专门用于分离创伤弧菌。
2)细菌生理生化、免疫学和分子生物学等方法的鉴定。传统的试管培养法分析细菌生理生化指标,工作量大且对技术熟练度要求较高。近年来,国内外推出了多种类型的成套鉴定系统即编码鉴定方法。如法国生物-梅里埃集团的API/ATB、瑞士公司的Enterotube(肠管系统)和美国的Biolog全自动和手动细菌鉴定系统等,使得细菌鉴定逐步简易化、微量化和快速化。其中,API20E系统可用于鉴定副溶血弧菌和美人鱼发光杆菌杀鱼亚种等。免疫学检测技术是基于免疫学中抗原同抗体能特异性结合,通过抗原检测抗体或通过抗体检测抗原的技术。如免疫层析法被用于鉴定产生tdh的副溶血弧菌。然而生理生化和免疫学鉴定方法往往操作复杂、检测耗时,甚至试剂价格昂贵等,因此,快捷、灵敏的分子生物学检测技术迅速发展,并被广泛运用。最常用的是基于16S rRNA的聚合酶链式反应(polymerase Chain Reaction,PCR)技术。16S rRNA是弧菌科所有物种中唯一可用的基因,是避免假阳性检测的最佳基因。然而,在某些情况下,由于16S rRNA的鉴别能力较低,不能鉴定到种,因此,针对蛋白质编码基因的PCR技术常用于鉴定弧菌,并发展出实时PCR技术(real-time PCR,RT-PCR)、多位点序列分析(multilocus sequence analysis,MLSA)技术、环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)和重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)等。如中国水产科学研究院南海水产研究所开发了一套三重PCR检测方法,用于同时检测副溶血弧菌、美人鱼发光杆菌和鰤诺卡氏菌[24],并建立了一种多位点序列分析方法鉴定哈维弧菌[25]。
3)人工感染试验验证。对细菌进行鉴定之后,并不能确定其为疾病的原发病原。通常情况下必须对鉴定的潜在病原菌进行致病性试验,即人工感染试验,依据科赫法则确证该物种的致病性。
2 水产动物弧菌病的生物防治
生物防治是利用物种间的相互关系,以一种或一类生物或其衍生物抑制另一种或另一类生物的方法。目前,开展的弧菌病生物防治技术(图1,表2)主要有分别基于细菌、植物和病毒的益生菌及其相关产品、药用植物及噬菌体,它们主要通过直接杀灭弧菌、抑制弧菌生长、控制弧菌毒力(调控)基因表达与传播、刺激宿主免疫反应及改善养殖环境等方式防治弧菌病。
表2 水产动物弧菌病生物防治技术
Tab.2 Biological control of vibriosis in animals in aquaculture
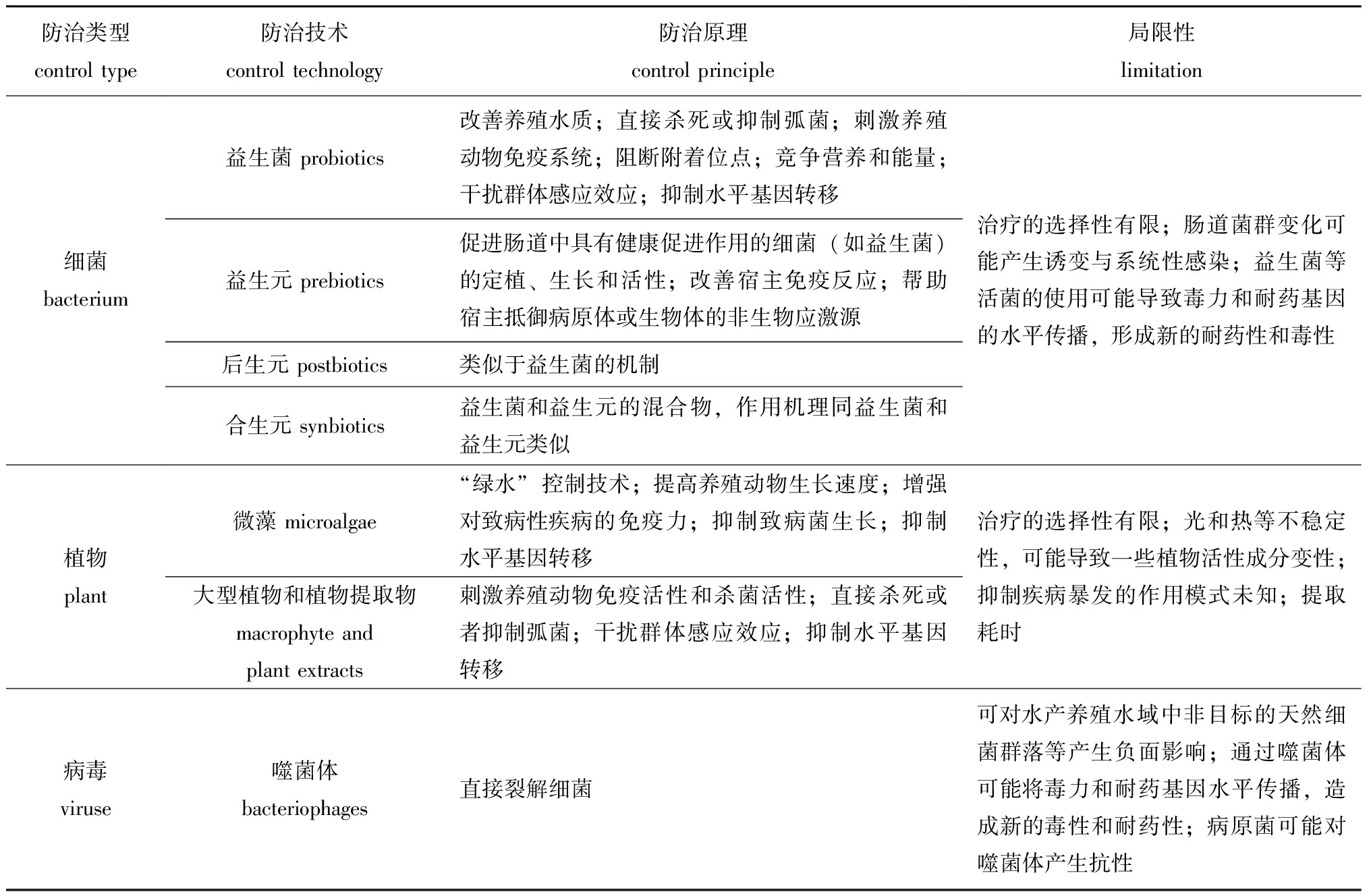
防治类型 control type防治技术 control technology防治原理 control principle局限性 limitation细菌 bacterium益生菌 probiotics改善养殖水质;直接杀死或抑制弧菌;刺激养殖动物免疫系统;阻断附着位点;竞争营养和能量;干扰群体感应效应;抑制水平基因转移益生元 prebiotics促进肠道中具有健康促进作用的细菌(如益生菌)的定植、生长和活性;改善宿主免疫反应;帮助宿主抵御病原体或生物体的非生物应激源后生元 postbiotics类似于益生菌的机制合生元 synbiotics益生菌和益生元的混合物,作用机理同益生菌和益生元类似治疗的选择性有限;肠道菌群变化可能产生诱变与系统性感染;益生菌等活菌的使用可能导致毒力和耐药基因的水平传播,形成新的耐药性和毒性植物 plant微藻 microalgae“绿水”控制技术;提高养殖动物生长速度;增强对致病性疾病的免疫力;抑制致病菌生长;抑制水平基因转移大型植物和植物提取物 macrophyte and plant extracts刺激养殖动物免疫活性和杀菌活性;直接杀死或者抑制弧菌;干扰群体感应效应;抑制水平基因转移治疗的选择性有限;光和热等不稳定性,可能导致一些植物活性成分变性;抑制疾病暴发的作用模式未知;提取耗时病毒 viruse噬菌体bacteriophages直接裂解细菌可对水产养殖水域中非目标的天然细菌群落等产生负面影响;通过噬菌体可能将毒力和耐药基因水平传播,造成新的毒性和耐药性;病原菌可能对噬菌体产生抗性
2.1 生物防治技术
2.1.1 益生菌及其相关产品 用于生物防治的益生菌及其相关产品主要包括益生菌(probiotics)、益生元(prebiotics)、后生元(postbiotics)和合生元(synbiotics)(表2)。1986年,Kozasa首次将益生菌应用到水产养殖中,1999年Gatesoupe首次将益生菌定义引申到水产动物上[26]。益生菌是一类活的微生物,当摄入数量足够时有益于宿主健康[27]。益生菌可单独使用或者混合使用[28]。目前,用于水产养殖中的益生菌主要有乳酸杆菌(Lactobacillus)、芽孢杆菌(Bacillus)、肠球菌(Enterococcus)、肉杆菌(Carnobacterium)和酵母菌(Yeast)[29-31]。益生元是指一些不被宿主消化吸收,却能够有选择性地促进体内有益菌的代谢和增殖,改善宿主免疫反应,帮助宿主抵御病原体或生物体的非生物应激源,进而改善宿主健康的有机物质[32]。益生元主要是各种寡糖或低聚糖,其中,水产养殖中常用的益生元包括甘露寡糖(MOS)、低聚果糖(FOS)、低聚半乳糖(GOS)、阿拉伯木聚糖寡糖(AXOS)和菊粉。
尽管益生菌对防控弧菌病具有良好的效果,但在水产养殖系统中添加大量活细菌的安全性受到质疑,因为这些细菌也可能通过水平基因转移等获得高水平的抗生素耐药性基因和毒力因子[33]。为此,研究者又开发出了后生元和合生元作为治疗和预防弧菌病的可行策略。后生元是来自益生菌微生物的非活性细菌产物或代谢副产物,在宿主中具有生物活性,这些物质直接或间接地对宿主产生有益影响[34]。尽管后生元不含活微生物,但它们通过类似于益生菌的机制显示出有益宿主健康的效果,同时最大限度地降低了与摄入相关的风险[34]。目前,可用的后生元包括有益微生物的无细胞上清液、胞外多糖、抗氧化酶与过氧化物酶等酶类、细菌脂磷壁酸等细胞壁成分、短链脂肪酸、细菌裂解物,以及维生素、酚类代谢产物和芳香氨基酸等肠道微生物群产生的代谢产物等。合生元是益生菌和益生元的混合物,两者之间可通过协同和/或互补作用增强宿主生长性能[35]。其作用机理主要是合生元中的益生元通过选择性刺激一种或有限数量的益生菌的生长和/或激活其代谢,来提高其中的益生菌在胃肠道中的存活和植入,最终改善宿主健康,如益生菌可以利用益生元作为碳源,在发酵过程中实现高生长率和细胞产量。此外,合生元中的益生元也可能直接作用于宿主免疫系统。目前,具有益生元特性的化合物,如甘露寡糖、低聚果糖、短链低聚果糖(SC)、菊粉、壳聚糖寡糖(COS)、低聚半乳糖、阿拉伯低聚木糖和异麦芽寡糖(IMO),可与益生菌组合成水产养殖合生元。
2.1.2 药用植物(medicinal plants) 药用植物即基于植物的治疗产品,主要包括微藻(microalgae)、大型植物及其提取物(macro plants and plant extracts)[36]。药用植物因其成本低廉,对环境无毒害,不仅能安全有效地提高宿主免疫、代谢和生长,帮助宿主抵抗疾病(抗细菌、病毒、真菌和寄生虫),甚至具有改善水质、抗应激等特性,被广泛应用于水产养殖[36]。微藻是单细胞植物,其中许多微藻富含蛋白质、脂质和生物活性成分;因此,它们构成了天然水生食物链的重要组成部分[37]。微藻防治技术也是水产疾病中最常用的生物控制技术,通常被称为“绿水”控制技术,其作用原理可能是微藻和微藻共生细菌构成“绿水”系统,创造了一个限制系统中弧菌生长的环境。此外,微藻也可通过提高养殖动物生长速度、增强养殖动物免疫力、抑制致病菌生长甚至控制致病菌毒力基因水平传播等,有效地预防和控制水产养殖疾病,包括弧菌病[22]。植物提取物,即植物生物素(phytobiotics),是添加到饮食中的植物衍生的天然生物活性化合物,具有抗应激、促生长、刺激食欲、增强免疫力、促亲鱼成熟、促繁殖和抗致病性(包括弧菌病)等多种特性,可改善养殖动物和人类的营养和健康。
2.1.3 噬菌体(bacteriophages) 噬菌体是感染和杀死细菌的病毒,广泛分布在细菌宿主聚集的地方,如土壤或动物的肠道,其自然来源之一是海水,作为抗生素的替代品已经使用了90多年,可对抗多种细菌[38]。与化学治疗相比,噬菌体治疗具有有机、经济、安全、高特异性及无副作用等特点。噬菌体有裂解性噬菌体和溶原性噬菌体两种类型。裂解性噬菌体侵入宿主细胞后,随即关闭其防御机制,自身复制并引起宿主细胞裂解。溶原性噬菌体侵入宿主细胞后,其核酸附着并整合在宿主染色体上,与宿主核酸同步复制,宿主细胞不裂解而继续生长。因此,水产养殖疾病控制中所选噬菌体应具有溶解性,以避免有毒基因水平转移到宿主,从而使养殖动物具有毒性。
2.2 生物防治机制
2.2.1 改善养殖水质 不适当的水质会损害养殖动物的健康,削弱养殖动物的免疫系统,使得弧菌有条件感染宿主,从而导致养殖动物大量死亡。益生菌尤其是光合细菌、硝化细菌和芽孢杆菌,能够通过氧化、硝化、反硝化、硫化、氨化、解硫和固氮等作用,迅速降低水体中的氨氮、亚硝氮和硫化氢等有害物质含量,以及降解水产动物排泄物、残余饵料和动植物残骸等大分子有机物,从而改善养殖水质,降低弧菌感染率,促进养殖动物健康生长[39]。如芽孢杆菌,包括枯草芽孢杆菌(B.subtilis)、蜡状芽孢杆菌(B.cereus)和地衣芽孢杆菌(B.licheniformis),可以帮助氨氮和亚硝氮的矿化,通过硝化和/或好氧反硝化防止含氮废物的积累[40],故此类益生菌制剂也被称为微生态水质调节剂。与此类似,绿藻和硅藻等微藻,可吸收水体中各种营养盐,减少水中氨氮和亚硝氮等有害物质,有效降低动物被弧菌感染的风险[41]。
2.2.2 直接杀死或抑制弧菌 益生菌通过产生抗生素、细菌素、过氧化氢、水解酶及乳酸等抑制其他微生物的生长,如益生菌产生的细菌素是由细菌核糖体合成的抗菌肽,通常对同种近缘菌株具有杀菌或抑菌作用[42],其主要通过直接溶解目标细菌细胞壁、抑制目标细菌细胞壁合成及在细胞膜上打孔3种作用方式发挥抑菌作用[40]。微藻和微藻共生细菌构成“绿水”系统,通过产生对弧菌有害的抗菌物质(如游离脂肪酸和原二硫辛酸),从而竞争性排斥限制弧菌可获得的营养量,创造一个限制系统中弧菌生长的环境。微藻产生的胞内外代谢产物,也可能抑制致病菌生长,有效地预防和控制水产养殖疾病,包括弧菌病[43]。如微藻产生的长链饱和及不饱和脂肪酸通过诱导原生质体裂解,成为对抗多种致病菌的杀菌剂[44];微藻也可释放萜烯、糖苷、多不饱和醛及叶绿素a衍生物等化合物破坏病原菌,抑制病原菌生长[45]。此外,植物提取物如邻苯三酚也具有较强的杀菌效果,通过破坏弧菌细胞壁结构等降解弧菌细胞[46]。而噬菌体则主要通过感染和裂解细菌达到防控弧菌病的目的。
2.2.3 刺激养殖动物免疫系统 益生菌进入肠道后,可以与免疫系统之间相互作用,提高淋巴细胞和吞噬细胞的活性,刺激宿主特异性和非特异性免疫,增强水产动物的免疫力和对传染病的抵抗力,达到抗病效果[47]。与其相关的益生元、合生元和后生元也都可改善宿主免疫。
药用植物也可安全有效地提高宿主免疫、代谢和生长能力,帮助宿主抵抗疾病[36]。如微藻产生的β-胡萝卜素等可改善养殖动物生长,增强其免疫反应和对抗副溶血弧菌感染的能力等。植物提取物生物碱、萜类、鞣质、皂甙、糖苷类、黄酮类、酚类、甾体和精油等植物生物活性物质也具有增强动物免疫力的特性。
2.2.4 阻断附着位点 病原菌侵染宿主的第一步是黏附,而益生菌一个重要的益生作用机制就是对黏附位点的竞争,也称为“竞争性排斥”。当摄入益生菌时,它们会竞争结合位点,留下较少的结合位点供病原体使用。病原体通过肠道,在无结合位点的情况下能更快地离开宿主,降低感染概率。
2.2.5 竞争营养和能量 任何微生物种群的生存都取决于其在同一环境中与其他微生物争夺营养和可用能量的能力。益生菌可利用更多可用营养来战胜病原体,导致病原菌受饥饿而无法在肠道中生存。如铁载体是一种低分子量的铁螯合剂,可以溶解沉淀的铁或从铁络合物中提取铁,从而使其用于细菌生长。产铁载体的益生菌,可以在低铁环境中螯合三价铁,故不利于病原菌的生长[48]。
2.2.6 干扰群体感应效应 群体感应(quorum sensing,QS)是一种细胞间的通信系统,在该系统中,细菌通过产生、检测和响应自身诱导物(细胞外小信号分子)来控制某些基因的表达,以协调其行为。在弧菌中发现了三通道QS系统,即LuxM/LuxN、LuxS/LuxPQ和CqsA/CqsS通道。3个自身诱导剂信号分子Harveyi,即自身诱导剂1(HAI-1)、自身诱导物2(AI-2)和Cholerae自身诱导剂1(CAI-1)是分别由LuxM、LuxS和CqsA蛋白产生的N-酰基高丝氨酸内酯(AHL)N-(3-羟基丁酰基)-L-高丝氨酸内酯、呋喃基硼酸二酯和(Z)-3-氨基十一碳-2-烯-4-酮,并分别由LuxN、LuxPQ和CqsS蛋白感应[49]。QS系统被证明可以调节弧菌的多种生理活性,包括毒力、共生、感受态、接合转移、抗生素产生、运动性和生物膜形成。一些益生菌,如抑黄杆菌(Phaeobacter inhibens),可通过分泌AHL信号分子等调节弧菌的QS途径,最终调节弧菌的生长和毒力等[50]。“绿水”系统中的许多微藻或细菌可以分泌QS抑制剂(即N-酰基-丝氨酸内酯类似物),干扰弧菌中毒力基因的表达,并抑制其致病性。植物提取物,如十一酸(UDA)和生长素(IAA和IBA)等,也可通过下调弧菌QS相关主调控基因(luxO、luxQ、luxR和luxS),干扰弧菌QS,从而抑制弧菌毒力基因表达。
2.2.7 抑制水平基因转移 水平基因转移(horizontal gene transfer,HGT)不同于垂直基因转移,其是种内或种间不同个体之间遗传物质的交流方式,包括转化、转导和接合转移3种方式[51]。接合转移是功能基因传播和扩散效率最高的水平基因转移方式,其影响原核生物的致病性、耐药性和代谢等各个方面[50]。哈维弧菌、溶藻弧菌和副溶血弧菌等常见弧菌病原均被发现,可通过接合转移获取外源毒力和耐药基因[52-55]。乳杆菌和乳酸菌等益生菌发酵产生的不饱和脂肪酸(如油酸和亚油酸),被发现可抑制细菌接合转移[56]。因此,益生菌产生的不饱和脂肪酸通过抑制接合转移可阻碍弧菌毒力和耐药基因的获得,最终控制弧菌病害的发生[57-58]。而油酸、亚油酸、脱氢戊烯酸也是微藻和植物提取物,说明微藻和植物提取物也可抑制细菌接合转移[59],最终控制弧菌感染。
3 水产动物弧菌病生物防治技术的应用
3.1 益生菌和植物(提取物)的单一使用
益生菌和植物(提取物)的生物防治技术已被广泛研究并应用于水产动物弧菌病防控(鱼、虾、蟹和贝类中弧菌病的生物防治见电子版附表A)中。使用最多的是益生菌和植物提取物,通常以拌料投喂形式进行疾病的预防和治疗。在鱼类养殖中,主要用于抵抗哈维弧菌、鳗弧菌、创伤弧菌和溶藻弧菌。如从健康石斑鱼肠道中分离到的芽孢杆菌K2拌料投喂石斑鱼后,可显著提高其生长性能、免疫力和对哈维弧菌感染的保护力;经芽孢杆菌K2拌料投喂28 d后,用哈维弧菌攻毒,拌料投喂组石斑鱼存活率(55%)显著高于对照组(25%)[60]。用创伤弧菌感染石斑鱼后,用植物提取物油酸拌料投喂石斑鱼,可显著提高石斑鱼免疫反应水平和存活率(从对照组的43.3%提高至63.3%)[61]。在虾类养殖中,由副溶血弧菌VPAHPND感染引起的急性肝胰腺坏死病及哈维弧菌感染引起的发光弧菌病是最主要的弧菌病,且虾类生物防治技术研究主要集中于全球养殖产量第一的凡纳滨对虾。如球形红杆菌SS15可产生抗弧菌肽,伴饲投喂可将感染VPAHPND的凡纳滨对虾的存活率提高27%[62]。而日本纳豆浸提液能够抑制细菌生物膜的形成,其拌料投喂后可将感染哈维弧菌的凡纳滨对虾的成活率从对照组的29%提高到76%[63]。在贝类养殖中,贝类弧菌病生物防治技术主要针对感染副溶血弧菌的鲍鱼和牡蛎。如解淀粉芽孢杆菌可促进皱纹盘鲍(Haliotis discus nannai)的摄食和生长,且有效地提高了鲍鱼的非特异性免疫和对副溶血弧菌感染的抵抗力。其中,105 CFU/g解淀粉芽孢杆菌拌料组投喂效果最佳,感染副溶血弧菌后鲍鱼死亡率从100%降低至约50%[64]。在12.5 ℃条件下,用1.5%葡萄籽提取物净化人工海水2 d,可将太平洋牡蛎(Crassostrea gigas)中副溶血弧菌数的对数(lg)减少3.52[65]。
3.2 益生菌和植物(提取物)的复合和联用
相同的防控方式不仅可单一使用,还可复合使用,且复合可能会取得更好的效果。如用添加市售复合益生菌(含有枯草芽孢杆菌7.0×109 CFU/g、地衣芽孢杆菌3.0×109 CFU/g、乳杆菌5.0×108 CFU/g和节杆菌1.0×108 CFU/g)的饲料投喂军曹鱼(Rachycentron canadum),可显著提高其生长和免疫力,并显著降低哈维弧菌感染后的死亡率,且最佳复合益生菌添加剂量为3.3 g/kg[66]。用益生元AXOS和菊粉单独或复合拌料投喂凡纳滨对虾后发现,与单一益生元处理相比,饲料中同时添加4 mg/g的AXOS和菊粉显著提高了饲养8周后对虾的生长参数及免疫相关基因的表达,还显著提高了溶藻弧菌感染对虾的存活率(约从10%提高至50%)[67]。用同温层芽孢杆菌A3440和/或海洋褐色杆菌AP1220拌料投喂杂色鲍(Haliotis diversicolor)180 d后,进行哈维弧菌感染试验发现,单独或者复合益生菌均可提高稚鲍的壳长和湿质量,其中,A3440拌料投喂后稚鲍壳长和湿质量增加最多,其次是复合益生菌和AP1220,而AP1220拌料投喂后稚鲍存活率提高最多,从对照组的61.33%±8.33%提高至89.33%±10.07%,其次是复合益生菌(84.00%±6.93%)和A3440(70.67%±28.37%)[68]。
不同防控方式也可以联用,如益生菌和益生元组合成合生元使用,往往比单用益生菌或者益生元的防控效率更高。如枯草芽孢杆菌和低聚果糖联合使用,对卵形鲳鲹(Trachinotus ovatus)幼鱼免疫应答和抗病性具有显著的促进作用,且在饲料中添加5.62×107 CFU/g枯草芽孢杆菌后,再分别添加0、0.2%和0.4% FOS,创伤弧菌感染后10 d,幼鱼的累积死亡率分别为62.96%±1.85%、57.41%±1.85%和29.63%±1.85%[69]。
3.3 噬菌体的应用
近年来,噬菌体生物防治技术逐渐成为研究热点,其主要通过直接投入养殖水体达到裂解病原菌和净化水体的目的,并且也有单一和复合使用的方式。如从智利圣地亚哥中心市场购买的双壳类样品中分离出来的噬菌体,在鳗弧菌感染复数(MOA)为1和20时,将噬菌体直接加入养殖水体,可使大西洋鲑(Salmo salar)的存活率提高到100%,而在无噬菌体的情况下,存活率不到10%[70]。从牡蛎中分离出的噬菌体Viha 10和从斑节对虾(Penaeus monodon)孵化场分离出的噬菌体Viha 8分别裂解了70%和68%所测试的100株哈维弧菌菌株,而两者的混合物可裂解94%的哈维弧菌菌株;养殖水中投入2×106 PFU/mL(plaque forming units,PFU)的噬菌体处理,使斑节对虾幼虾的存活率超过85%[71]。从夏威夷海水中分离到抗珊瑚弧菌和抗管状弧菌的5个噬菌体,其中,单个噬菌体处理可以保护牡蛎幼体免受珊瑚弧菌和管状弧菌的感染,有效降低了幼虫的死亡率,并呈剂量依赖性;用致死剂量的珊瑚弧菌攻毒6 d后,5个噬菌体的混合物可将美洲牡蛎(Crassostrea virginica)和太平洋牡蛎的幼体死亡率降低91%[72]。
总体来说,生物防治技术在各种水产动物弧菌病防治中被广泛研究,体内外试验均证明,其可通过杀死或抑制弧菌并刺激宿主免疫反应等显著提高养殖动物的存活率。此外,同一防控类型的不同防控技术,如不同的益生菌、植物(提取物)及噬菌体之间可以复合使用,且不同的防控类型,如益生菌与益生元、益生菌与植物提取物等之间可以联合使用,同一防控技术可能呈现剂量依赖性,但目前主要停留在理论基础研究上,有效的成果转化和商业化效率较低。
4 存在问题及展望
弧菌病危及全球水产业,由于多种因素影响(如弧菌的异质性、适应能力及在海洋环境中普遍存在的特性),弧菌病防治已成为水产养殖产业持续面临的问题。基于抗生素治疗弧菌病的环境不友好性及疫苗使用的局限性等,良好的管理措施和潜在的生物防治方法是降低水产养殖业经济损失和确保本行业可持续发展的最佳途径。目前,正在探索的生物防治方法,主要包括使用益生菌(益生元、后生元、合生元)、药用植物和噬菌体,然而,选择使用的方法将取决于养殖方式、养殖规模、感染水平、有效性和经济成本等因素。尽管每种方法都有显而易见的优势,但仍然存在一些缺陷和知识空白,包括作用机制、作用模式,对水产动物和环境可能产生的毒性,以及它们在实际养殖系统中应用的可行性。这些知识是生物防治方法被推广和商业化所必需考量的,因此,未来可从以下方面重点开展研究。
4.1 加强生物防治技术作用机制的基础研究
疾病的发生是病原、环境和宿主相互作用的结果。生物防治方法不仅可改善养殖环境,还可刺激宿主免疫系统。针对病原方面,主要集中在对病原菌的抑制和消杀方面,但具体的抑制机制如阻断附着位点及竞争营养和能量的研究较少。同时,病原菌毒力基因的存在与表达决定其毒力作用的发挥。因此,深入研究生物防治技术的作用机制,尤其是该技术对群体感应和水平基因转移等的作用机制,是建立毒力控制技术的基础,可为生物防治技术的建立提供重要理论支持。
4.2 建立生物防治技术标准和技术体系
未来水产养殖业的方向是精准化、标准化和集成化作业。目前的研究更多是针对单一生物防治技术的防治原理和防治效果的解析。不同防治方法间的协同、拮抗作用,以及剂量依赖性和时间依赖性等都不甚清楚。因此,在明晰生物防治作用机制和作用效率的基础上,需要进一步探究不同生物防治技术间的复合、混合作用效果,并确定最佳作用剂量、作用时机和作用时间等动力学参数,建立一套生物防治的标准和体系,以扩展生物防治技术的使用范围,增强生物防治技术的作用效果。
4.3 加快推进生物防治技术体系的商业化
生物防治具有使用广谱性和安全性的特点,是最具应用前景的水产疾病防治手段。目前,生物防治多集中于基础研究和小范围的应用示范层面,为促进生物防治的应用,以增效降本、环境友好为原则,亟待加快推进生物防治商业化体系的探索,进一步实现生态化的水产疾病防控,为实现中国水产养殖业绿色可持续高质量发展提供重要技术支撑。
[1] AMARO C,FOUZ B,SANJU N E,et al.Vibriosis[M]//Climate change and infectious fish diseases.UK:CABI,2020:182-210.
N E,et al.Vibriosis[M]//Climate change and infectious fish diseases.UK:CABI,2020:182-210.
[2] CHONG R, BOUSFIELD B, BROWN R.Fish disease management[J].Veterinary Bulletin-Agriculture, Fisheries and Conservation Department Newsletter,2011,1: 1-12.
[3] TANG K F J,BONDAD-REANTASO M G.Impacts of acute hepatopancreatic necrosis disease on commercial shrimp aquaculture[J].Revue Scientifique et Technique De L’OIE,2019,38(2):477-490.
[4] WONG K C,BROWN A M,LUSCOMBE G M,et al.Antibiotic use for Vibrio infections:important insights from surveillance data[J].BMC Infectious Diseases,2015,15:226.
[5] JOAKIM LARSSON D G J,FLACH C F.Antibiotic resistance in the environment[J].Nature Reviews Microbiology,2022,20(5):257-269.
[6] JUN J W,HAN J E,TANG K F J,et al.Potential application of bacteriophage pVp-1:agent combating Vibrio parahaemolyticus strains associated with acute hepatopancreatic necrosis disease (AHPND) in shrimp[J].Aquaculture,2016,457:100-103.
[7] INA-SALWANY M Y,AL-SAARI N,MOHAMAD A,et al.Vibriosis in fish:a review on disease development and prevention[J].Journal of Aquatic Animal Health,2019,31(1):3-22.
[8] 王启要.中国鱼类疫苗技术研发及应用研究进展[J].大连海洋大学学报,2022,37(1):1-9.
WANG Q Y.Fish vaccine technology development and application in China:a review[J].Journal of Dalian OceanUniversity,2022,37(1):1-9.(in Chinese)
[9] FARMER III J J,MICHAEL JANDA J,BRENNER F W,et al.Vibrio[M]//Bergey’s Manual of Systematics of Archaea and Bacteria.New York,USA:John Wiley &Sons,Inc., in Association with Bergey’s Manual Trust,2015:1-79.
[10] ALBERT V, RANSANGAN J.Effect of water temperature on susceptibility of culture marine fish species to vibriosis[J].International Journal of Research in Pure and Applied Microbiology,2013,3(3):48-52.
[11] NOGA E J.Fish disease: diagnosis and treatment[M].New York,USA:John Wiley &Sons,Inc.,2010.
[12] MOHAMAD N,AMAL M N A,YASIN I S M,et al.Vibriosis in cultured marine fishes:a review[J].Aquaculture,2019,512:734289.
[13] 舒琥,冯娟.水产病原微生物与免疫[M].北京:海洋出版社,2022.
SHU H,FENG J.Aquatic pathogenic microorganisms and immunity[M].Beijing:Ocean Press,2022.(in Chinese)
[14] NOORLIS A,GHAZALI F M,CHEAH Y K,et al.Prevalence and quantification of Vibrio species and Vibrio parahaemolyticus in freshwater fish at hypermarket level[J].International Food Research Journal,2011,18(2):689-695.
[15] LETCHUMANAN V,YIN W F,LEE L H,et al.Prevalence and antimicrobial susceptibility of Vibrio parahaemolyticus isolated from retail shrimps in Malaysia[J].Frontiers in Microbiology,2015,6:33.
[16] LIU L,GE M F,ZHENG X Y,et al.Investigation of Vibrio alginolyticus,V.harveyi,and V.parahaemolyticus in large yellow croaker,Pseudosciaena crocea (Richardson) reared in Xiangshan Bay,China[J].Aquaculture Reports,2016,3:220-224.
[17] YE Y M,GUTIERREZ N L.Ending fishery overexploitation by expanding from local successes to globalized solutions[J].Nature Ecology &Evolution,2017,1(7):179.
[18] ROWLEY A F,CROSS M E,CULLOTY S C,et al.The potential impact of climate change on the infectious diseases of commercially important shellfish populations in the Irish Sea—a review[J].ICES Journal of Marine Science,2014,71(4):741-759.
[19] ESSAM H M,ABDELLRAZEQ G S,TAYEL S I,et al.Pathogenesis of Photobacterium damselae subspecies infections in sea bass and sea bream[J].Microbial Pathogenesis,2016,99:41-50.
[20] LOVE M,TEEBKEN-FISHER D,HOSE J E,et al.Vibrio damsela,a marine bacterium,causes skin ulcers on the damselfish Chromis punctipinnis[J].Science,1981,214(4525):1139-1140.
[21] ANDREONI F,MAGNANI M.Photobacteriosis:prevention and diagnosis[J].Journal of Immunology Research,2014,2014:793817.
[22] MANCHANAYAKE T,SALLEH A,AMAL M N A,et al.Pathology and pathogenesis of Vibrio infection in fish:a review[J].Aquaculture Reports,2023,28:101459.
[23] P REZ-S
REZ-S NCHEZ T,MORA-S
NCHEZ T,MORA-S NCHEZ B,BALC
NCHEZ B,BALC ZAR J L.Biological approaches for disease control in aquaculture:advantages,limitations and challenges[J].Trends in Microbiology,2018,26(11):896-903.
ZAR J L.Biological approaches for disease control in aquaculture:advantages,limitations and challenges[J].Trends in Microbiology,2018,26(11):896-903.
[24] 许海东,郭志勋,陈日和,等.一种副溶血弧菌、美人鱼发光杆菌和鰤诺卡氏菌的检测引物组、检测试剂盒和检测方法:CN105176997A[P].2015-12-23.
XU H D,GUO Z X,CHEN R H,et al.Detection primer set,detection kit and detection method for Vibrio parahaemolyticus,Photobacterium damsela and Nocardia seriolea:CN105176997A[P].2015-12-23.(in Chinese)
[25] DENG Y Q,XU L W,LIU S L,et al.What drives changes in the virulence and antibiotic resistance of Vibrio harveyi in the South China Sea?[J].Journal of Fish Diseases,2020,43(8):853-862.
[26] 田启文,郭振,嵇乐乐,等.水产养殖中益生菌研究进展[J].工业微生物,2019,49(4):50-55.
TIAN Q W,GUO Z,JI L L,et al.Research progress of probiotics in aquaculture[J].Industrial Microbiology,2019,49(4):50-55.(in Chinese)
[27] HILL C,GUARNER F,REID G,et al.Expert consensus document.The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic[J].Nature Reviews Gastroenterology &Hepatology,2014,11(8):506-514.
[28] HAI N V.The use of probiotics in aquaculture[J].Journal of Applied Microbiology,2015,119(4):917-935.
[29] ZHENG X T,DUAN Y F,DONG H B,et al.Effects of dietary Lactobacillus plantarum on growth performance,digestive enzymes and gut morphology of Litopenaeus vannamei[J].Probiotics and Antimicrobial Proteins,2018,10(3):504-510.
[30] VAN NGUYEN N,ONODA S,VAN KHANH T,et al.Evaluation of dietary heat-killed Lactobacillus plantarum strain L-137 supplementation on growth performance,immunity and stress resistance of Nile tilapia (Oreochromis niloticus)[J].Aquaculture,2019,498:371-379.
[31] VAN DOAN H,HOSEINIFAR S H,RINGØ E,et al.Host-associated probiotics:a key factor in sustainable aquaculture[J].Reviews in Fisheries Science &Aquaculture,2020,28(1):16-42.
[32] DAVANI-DAVARI D,NEGAHDARIPOUR M,KARIMZADEH I,et al.Prebiotics:definition,types,sources,mechanisms,and clinical applications[J].Foods,2019,8(3):92.
[33] LI T,TENG D,MAO R Y,et al.A critical review of antibiotic resistance in probiotic bacteria[J].Food Research International,2020,136:109571.
![]() J,MARZEC A,RUSZCZY
J,MARZEC A,RUSZCZY SKI M,et al.Postbiotics—a step beyond pre- and probiotics[J].Nutrients,2020,12(8):2189.
SKI M,et al.Postbiotics—a step beyond pre- and probiotics[J].Nutrients,2020,12(8):2189.
[35] HUYNH T G,SHIU Y L,NGUYEN T P,et al.Current applications,selection,and possible mechanisms of actions of synbiotics in improving the growth and health status in aquaculture:a review[J].Fish &Shellfish Immunology,2017,64:367-382.
[36] ELIAS N A,ABU HASSAN M S,YUSOFF N A H,et al.Potential and limitation of biocontrol methods against vibriosis:a review[J].Aquaculture International,2023,31(4):2355-2398.
[37] YARNOLD J,KARAN H,OEY M,et al.Microalgal aquafeeds as part of a circular bioeconomy[J].Trends in Plant Science,2019,24(10):959-970.
[38] KEEN E C.Phage therapy:concept to cure[J].Frontiers in Microbiology,2012,3:238.
[39] HLORDZI V,KUEBUTORNYE F K A,AFRIYIE G,et al.The use of Bacillus species in maintenance of water quality in aquaculture:a review[J].Aquaculture Reports,2020,18:100503.
[40] NIMRAT S,KHAOPONG W,SANGSONG J,et al.Improvement of growth performance,water quality and disease resistance against Vibrio harveyi of postlarval whiteleg shrimp (Litopenaeus vannamei) by administration of mixed microencapsulated Bacillus probiotics[J].Aquaculture Nutrition,2020,26(5):1407-1418.
[41] 曹煜成,李卓佳,杨莺莺,等.浮游微藻生态调控技术在对虾养殖应用中的研究进展[J].南方水产,2007,3(4):70-73.
CAO Y C,LI Z J,YANG Y Y,et al.Research progress on technology of microalgae ecological management in shrimp culture[J].South China Fisheries Science,2007,3(4):70-73.(in Chinese)
[42] SOLTANI S,HAMMAMI R,COTTER P D,et al.Bacteriocins as a new generation of antimicrobials:toxicity aspects and regulations[J].FEMS Microbiology Reviews,2021,45(1):fuaa039.
[43] ANAYA-ROSAS R E,RIVAS-VEGA M E,MIRANDA-BAEZA A,et al.Effects of a co-culture of marine algae and shrimp (Litopenaeus vannamei) on the growth,survival and immune response of shrimp infected with Vibrio parahaemolyticus and white spot virus (WSSV)[J].Fish &Shellfish Immunology,2019,87:136-143.
[44] DASH P,AVUNJE S,TANDEL R S,et al.Biocontrol of luminous vibriosis in shrimp aquaculture:a review of current approaches and future perspectives[J].Reviews in Fisheries Science &Aquaculture,2017,25(3):245-255.
[45] RIBALET F,INTERTAGLIA L,LEBARON P,et al.Differential effect of three polyunsaturated aldehydes on marine bacterial isolates[J].Aquatic Toxicology,2008,86(2):249-255.
[46] TINH T H,ELAYARAJA S,MABROK M,et al.Antibacterial spectrum of synthetic herbal-based polyphenols against Vibrio parahaemolyticus isolated from diseased Pacific whiteleg shrimp (Penaeus vannamei) in Thailand[J].Aquaculture,2021,533:736070.
[47] KUMAR BAJAJ B,CLAES I J J,LEBEER S.Functional mechanisms of probiotics[J].Journal of Microbiology,Biotechnology and Food Sciences,2015,4(4):321-327.
[48] GRAM L,MELCHIORSEN J,SPANGGAARD B,et al.Inhibition of Vibrio anguillarum by Pseudomonas fluorescens AH2,a possible probiotic treatment of fish[J].Applied and Environmental Microbiology,1999,65(3):969-973.
[49] ZHANG S S,YANG Q A,EGGERMONT M,et al.Quorum-sensing interference in vibrios[J].Reviews in Aquaculture,2023:1-15.
[50] ZHAO W J,YUAN T,PIVA C,et al.The probiotic bacterium Phaeobacter inhibens downregulates virulence factor transcription in the shellfish pathogen Vibrio coralliilyticus by N-acyl homoserine lactone production[J].Applied and Environmental Microbiology,2019,85(2):e01545-e01518.
[51] THOMAS C M,NIELSEN K M.Mechanisms of,and barriers to,horizontal gene transfer between bacteria[J].Nature Reviews Microbiology,2005,3(9):711-721.
[52] ROUX F L,BLOKESCH M.Eco-evolutionary dynamics linked to horizontal gene transfer in vibrios[J].Annual Review of Microbiology,2018,72:89-110.
[53] MUTHUKRISHNAN S,DEFOIRDT T,SHARIFF M,et al.Horizontal gene transfer of the pirAB genes responsible for Acute Hepatopancreatic Necrosis Disease (AHPND) turns a non-Vibrio strain into an AHPND-positive pathogen[J].BioRxiv, 2019.doi: https://doi.org/10.1101/2019.12.20.884320.
[54] DENG Y Q,LIU S L,FENG J,et al.What drives putative bacterial pathogens removal within seagrass meadows?[J].Marine Pollution Bulletin,2021,166:112229.
[55] DENG Y Q,XU H D,SU Y L,et al.Horizontal gene transfer contributes to virulence and antibiotic resistance of Vibrio harveyi 345 based on complete genome sequence analysis[J].BMC Genomics,2019,20(1):761.
[56] 刘艺云,邓利敏,岳慧颖,等.质粒接合转移及其抑制剂的研究进展[J].生物技术通报,2022,38(9):35-46.
LIU Y Y,DENG L M,YUE H Y,et al.Research progress in plasmid conjugation and its inhibitors[J].Biotechnology Bulletin,2022,38(9):35-46.(in Chinese)
[57] CABEZ N E,RIPOLL-ROZADA J,PE
N E,RIPOLL-ROZADA J,PE A A,et al.Towards an integrated model of bacterial conjugation[J].FEMS Microbiology Reviews,2015,39(1):81-95.
A A,et al.Towards an integrated model of bacterial conjugation[J].FEMS Microbiology Reviews,2015,39(1):81-95.
[58] GRAF F E,PALM M,WARRINGER J,et al.Inhibiting conjugation as a tool in the fight against antibiotic resistance[J].Drug Development Research,2019,80(1):19-23.
[59] RAMESH KUMAR B,DEVIRAM G,MATHIMANI T,et al.Microalgae as rich source of polyunsaturated fatty acids[J].Biocatalysis and Agricultural Biotechnology,2019,17:583-588.
[60] LI J,WU Z B,ZHANG Z,et al.Effects of potential probiotic Bacillus velezensis K2 on growth,immunity and resistance to Vibrio harveyi infection of hybrid grouper (Epinephelus lanceolatus♂×E.fuscoguttatus♀)[J].Fish &Shellfish Immunology,2019,93:1047-1055.
[61] NATNAN M E,LOW C F,CHONG C M,et al.Comparison of different dietary fatty acids supplement on the immune response of hybrid grouper (Epinephelus fuscoguttatus×E.lanceolatus) challenged with Vibrio vulnificus[J].Biology,2022,11(9):1288.
[62] CHUMPOL S,KANTACHOTE D,RATTANACHUAY P,et al.Optimization of culture conditions for production of antivibrio compounds from probiotic purple nonsulfur bacteria against acute hepatopancreatic necrosis disease-causing Vibrio parahaemolyticus and Vibrio spp.[J].Aquaculture,2019,505:72-83.
[63] YATIP P,NITIN CHANDRA TEJA D,FLEGEL T W,et al.Extract from the fermented soybean product Natto inhibits Vibrio biofilm formation and reduces shrimp mortality from Vibrio harveyi infection[J].Fish &Shellfish Immunology,2018,72:348-355.
[64] GAO X L,KE C H,ZHANG M,et al.Effects of the probiotic Bacillus amyloliquefaciens on the growth,immunity,and disease resistance of Haliotis discus Hannai[J].Fish &Shellfish Immunology,2019,94:617-627.
[65] SHEN X Y,SU Y C.Application of grape seed extract in depuration for decontaminating Vibrio parahaemolyticus in Pacific oysters (Crassostrea gigas)[J].Food Control,2017,73:601-605.
[66] GENG X,DONG X H,TAN B P,et al.Effects of dietary probiotic on the growth performance,non-specific immunity and disease resistance of cobia,Rachycentron canadum[J].Aquaculture Nutrition,2012,18(1):46-55.
[67] LI Y,YUAN W,ZHANG Y,et al.Single or combined effects of dietary arabinoxylan-oligosaccharide and inulin on growth performance,gut microbiota,and immune response in Pacific white shrimp Litopenaeus vannamei[J].Journal of Oceanology and Limnology,2021,39(2):741-754.
[68] ZHAO J,LING Y H,ZHANG R Z,et al.Effects of dietary supplementation of probiotics on growth,immune responses,and gut microbiome of the abalone Haliotis diversicolor[J].Aquaculture,2018,493:289-295.
[69] ZHANG Q,YU H R,TONG T,et al.Dietary supplementation of Bacillus subtilis and fructooligosaccharide enhance the growth,non-specific immunity of juvenile ovate pompano,Trachinotus ovatus and its disease resistance against Vibrio vulnificus[J].Fish &Shellfish Immunology,2014,38(1):7-14.
[70] HIGUERA G,BAST AS R,TSERTSVADZE G,et al.Recently discovered Vibrio anguillarum phages can protect against experimentally induced vibriosis in Atlantic salmon,Salmo salar[J].Aquaculture,2013,392/393/394/395:128-133.
AS R,TSERTSVADZE G,et al.Recently discovered Vibrio anguillarum phages can protect against experimentally induced vibriosis in Atlantic salmon,Salmo salar[J].Aquaculture,2013,392/393/394/395:128-133.
[71] KARUNASAGAR I,SHIVU M M,GIRISHA S K,et al.Biocontrol of pathogens in shrimp hatcheries using bacteriophages[J].Aquaculture,2007,268(1/2/3/4):288-292.
[72] RICHARDS G P,WATSON M A,MADISON D,et al.Bacteriophages against Vibrio coralliilyticus and Vibrio tubiashii:isolation,characterization,and remediation of larval oyster mortalities[J].Applied and Environmental Microbiology,2021,87(10):e00008-e00021.