富山武装乌贼(Enoploteuthis chunii)和相拟钩腕乌贼(Abralia similis)均为外海小型头足类,隶属于鞘亚纲(Coleoidea)枪形目(Teuthoidea)武装乌贼科(Enoploteuthidae)。富山武装乌贼主要分布于日本大陆架及临近水域,包括中国东海及黑潮-亲潮过渡区域直至夏威夷海域,其最大胴长约为100 mm。相拟钩腕乌贼分布于热带西太平洋、太平洋赤道至亚热带海域,包括巴布亚新几内亚、汤加南部海域,最大胴长约为35 mm [1-2]。国内外对富山武装乌贼和相拟钩腕乌贼的相关研究较少,仅限于对两个物种的空间分布和生物学特征方面的研究[3]。Watanabe等[4]指出,与多数头足类相似,大部分海域的富山武装乌贼存在昼夜垂直洄游运动,而在海洋暖涡(warm core ring,WCR)附近的富山武装乌贼始终栖息于400 m水深以下。此外,两种头足类作为饵料生物,多被海洋哺乳动物及鱼类所摄食,包括侏儒抹香鲸(Kogia sima)[5]和太平洋蓝鳍金枪鱼(Thunnus orientalis)[6]等。
营养生态位对于研究物种的种间关系、资源相互利用,以及了解生态系统中的群落结构和功能发挥着重要作用,其主要反映物种自身的营养需求及其在生态系统中的营养功能[7]。目前,稳定同位素技术已经广泛运用于水生生物的营养生态位分析,相较于胃含物分析的短期性及偶然性,稳定同位素作为天然示踪剂提供了生态系统中物质来源和输送过程等重要信息,并用于研究生物的能量来源、食性变化及营养关系的时空变化[8]。其中,生物个体组织中的碳氮稳定同位素(δ13C、δ15N)可以反映生物个体摄食及栖息地的长期变化情况[9]。由于δ13C值在各营养级富集较低,仅为0~1‰,因此,δ15C可用于指示初级生产力的来源,并用于区分生物个体摄食区域的水平和垂直变化,如近岸与离岸、中上层与底栖及较低纬度与较高纬度之间的浮游生物量变化[10]。而δ15N在各营养级间的富集程度较高(2‰~3.5‰),并沿着食物链逐步富集,将营养传递至更高营养级,因此,δ15N多用于确定研究对象的营养位置,也可用于指示个体在其生命周期内的摄食营养差异变化[11]。
生物个体不同组织的不同周转速率及分馏系数,也反映了个体在不同时间尺度上的摄食情况变化。硬组织(如眼睛晶体、角质颚及内壳等)因其具有周期性的生长增量,故可用于分析头足类生活史过程[12]。Liu等[13]采用眼睛晶体稳定同位素,对秘鲁外海的茎柔鱼不同生长期的摄食策略和地理迁移运动研究发现,茎柔鱼在生活史早期阶段摄食区域范围较大,而进入成鱼期后其主要在同一栖息地摄食,并存在摄食选择偏向性,同时在胚胎期与成鱼期之间茎柔鱼也具有不同的营养分布和空间生态。与硬组织相比,肌肉的稳定同位素值可以反映生物体一段时间内的摄食信息,一般为几个月至一年左右;肝脏的稳定同位素值等可以提供几周内的摄食信息;性腺和消化腺的稳定同位素周转率则更快,通常可以反映几天内的摄食信息[14]。操亮亮等[15]通过肌肉组织稳定同位素值,对东南太平洋厄瓜多尔和秘鲁公海茎柔鱼的生长过程中摄食生态及地理差异变化研究发现,厄瓜多尔和秘鲁公海的茎柔鱼生态位间存在差异,其中,秘鲁公海的茎柔鱼δ13C和δ15N值变化主要受到摄食变化的影响,而厄瓜多尔的茎柔鱼则受到同位素基线值变化及摄食变化的共同影响。目前,有关富山武装乌贼和相拟钩腕乌贼的营养生态位研究国内外均处于空白,而两种乌贼作为饵料生物被西北太平洋众多捕食者所摄食,在生态系统中也发挥着重要作用。本研究中,通过肌肉碳氮稳定同位素分析,研究了西北太平洋两种小型头足类——富山武装乌贼和相拟钩腕乌贼个体发育期及种间营养生态位变化,以期为深入了解大洋性小型头足类摄食生态及种间生态关系提供基础资料。
1 材料与方法
1.1 样本来源
渔业生物样品及浮游动物样品均由上海海洋大学渔业资源调查船“淞航”号于2019年3月21—23日和9月5—8日在西北太平洋黑潮-亲潮区域调查期间采集(146°30′~150°13′ E,31°00′ ~39°00′ N)。调查共采集富山武装乌贼51尾,相拟钩腕乌贼30尾,分类清洗后置于-20 ℃下冻存。各站点附近使用大型浮游生物网(网长为2.8 m,网口内径为80 cm,筛绢孔径约为0.505 mm)由200 m水深垂直拖至表层,拖速为0.5~0.8 m/s。网采样品使用海水冲洗并经149 μm筛绢过滤后于-20 ℃下冻存(图1、表1)。
表1 渔业生物采样站点信息
Tab.1 Sampling sites information of fishery organisms
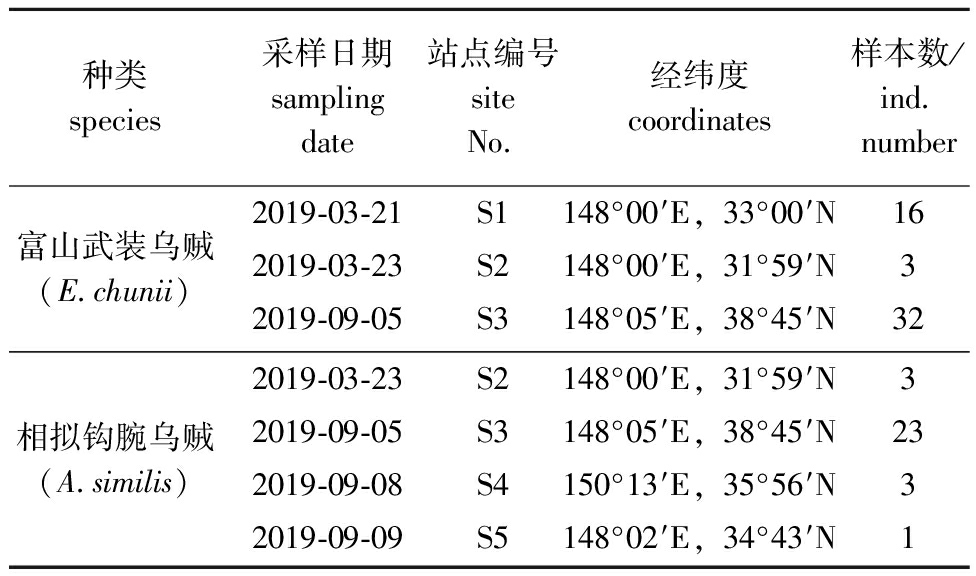
种类species采样日期sampling date站点编号site No.经纬度coordinates样本数/ind.number富山武装乌贼(E.chunii)2019-03-21S1148°00′E,33°00′N162019-03-23S2148°00′E,31°59′N32019-09-05S3148°05′E,38°45′N32相拟钩腕乌贼(A.similis)2019-03-23S2148°00′E,31°59′N32019-09-05S3148°05′E,38°45′N232019-09-08S4150°13′E,35°56′N32019-09-09S5148°02′E,34°43′N1
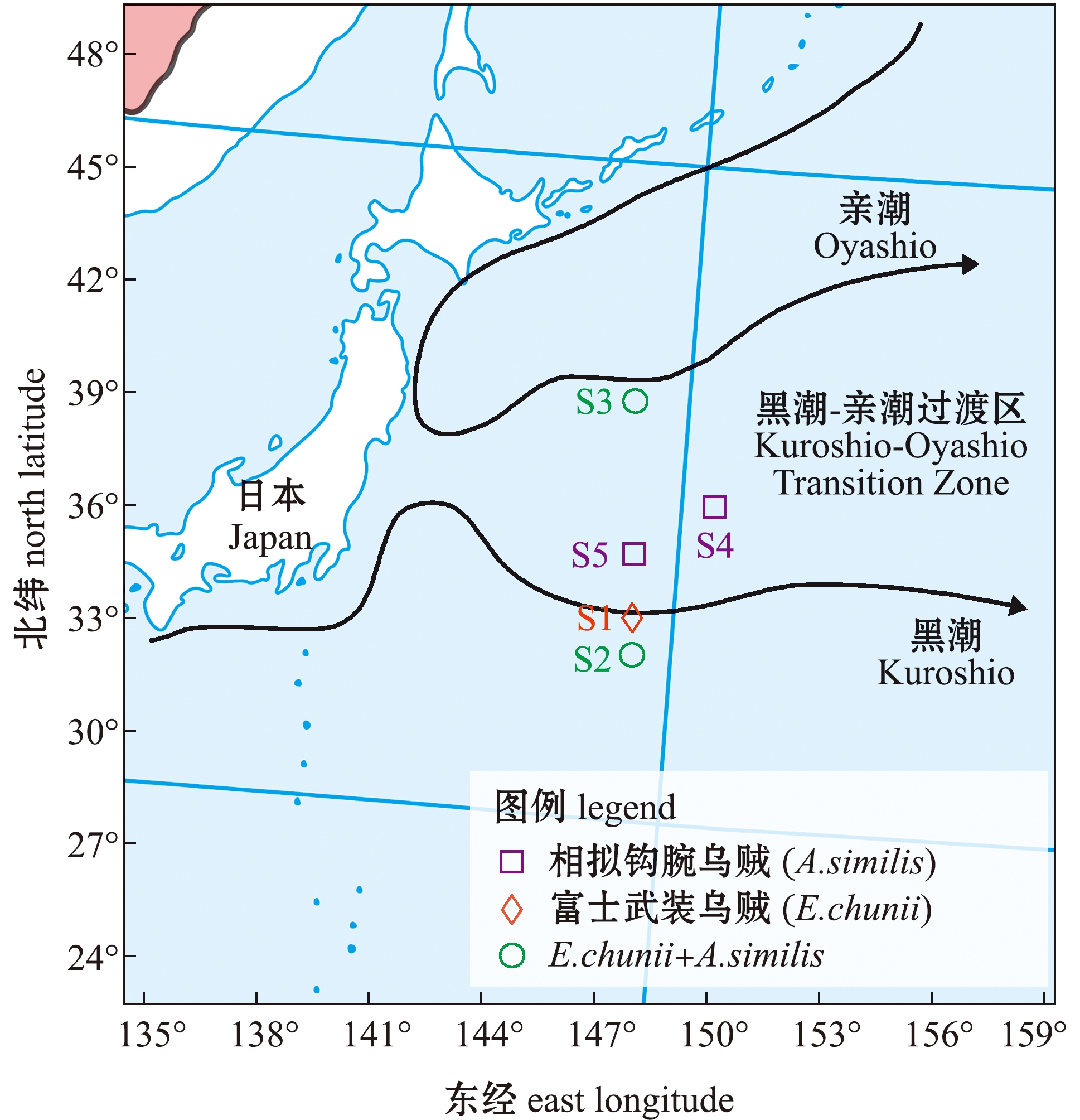
本图基于自然资源部标准地图服务网站GS(2020)4392号标准地图为底图,底图边界无修改。
The figure is based on the standard map GS(2020)4392 in the Standard Map Service website of Ministry of Natural Resources of the People’s Republic of China,with no modifications of the boundaries in the standard map.
图1 西北太平洋富山武装乌贼、相拟钩腕乌贼采集站点及黑潮-亲潮过渡区[19]分布
Fig.1 Sampling sites of Enoploteuthis chunii and Abralia similis and the distribution Kuroshio-Oyashio Transition Zone[19] in the Northwest Pacific Ocean
1.2 方法
1.2.1 样本预处理 在显微镜下挑出桡足类样品并置于15 mL离心管中,使用Milli-Q超纯水进行反复冲洗和离心(6 000 r/min,离心3 min),将最终沉积的桡足类置于1.5 mL离心管中,在烘箱(60 ℃)中烘干至恒质量,并使用MM400混合型球磨仪研磨成均匀粉末,称取1.5 mg粉末置于锡舟中包样待测。
头足类样品在实验室常温静置解冻后,清洗并测定生物学数据,包括胴长(mm)、体质量(g)等,其中,长度测量精确到1 mm,质量测量精确到0.01 g。在各样品的胴体腹部剪取适量肌肉,所有肌肉样品去除表皮后,使用Milli-Q超纯水冲洗5 min,以去除可能的污染物质,在冷冻干燥机内进行冷冻干燥(-50 ℃,干燥30 h)。与桡足类相同,干燥后使用球磨仪研磨成均匀粉末,称取1.5 mg粉末放入锡舟中包样待测。
1.2.2 稳定同位素分析 使用ISOPRIME 100稳定同位素质谱仪(Isoprime Corporation,Cheadle,UK)及VarioISOTOPE Cube元素分析仪(Elementar Analysensysteme GmbH,Hanau,Germany)进行碳氮稳定同位素测定。计算公式为
δX=(Rsample-Rstandard)/Rstandard×103。
式中:δ值为国际通用的稳定同位素比值;X为13C或15N;Rsample和Rstandard分别为样品和标准物中的13C/12C或15N/14N值。在测定过程中,采用美洲拟箭石(PDB)和纯化大气氮(N2)作为碳氮稳定同位素的标准物质。同时,为保证测样结果的稳定性,每10个测试样品后插入3个标准同位素样品,分析精度为±0.06‰。由于头足类肌肉中含有丰富的脂类,在测定过程中会导致δ13C值存在偏差[16]。在进行碳氮稳定同位素分析时,当C∶N<3.5时,则不需要进行脂类去除处理[17];当C∶N>3.5时,本研究中选用已有的北太平洋柔鱼脂类校正模型样品的δ13C值进行修正[18]。
1.2.3 δ15N基线值调整 为了准确比较种间的摄食营养水平差异变化,根据各站点附近所采集的桡足类δ15N值作为基线值,通过减去基线值来调整所有样本的δ15N值,调整后的δ15N值称为δ15Nb值。
1.2.4 生态位宽度和重叠率的计算 根据卜心宇等[19]和Guerra-Marrero等[20]的研究,富山武装乌贼胴长小于31 mm为稚鱼期,胴长大于32 mm为成鱼期;相拟钩腕乌贼胴长小于20 mm为稚鱼期,胴长大于21 mm为成鱼期。
基于样本的δ13C和δ15N值在R 4.2.0软件中使用SIBER包绘制富山武装乌贼和相拟钩腕乌贼不同生长时期营养生态位,计算贝叶斯标准椭圆面积(SEAc),采用SIAR包计算营养生态位重叠率,并根据Layman等[21]的判定方法判断富山武装乌贼和相拟钩腕乌贼个体发育期内及种间不同时期营养生态位的重叠率。采用非参数估计的局部加权回归散点平滑法(LOESS)对富山武装乌贼和相拟钩腕乌贼的δ13C、δ15N和δ15Nb与胴长的关系分别进行拟合。此外,考虑到S5站点仅获取1尾相拟钩腕乌贼,因此,S5站点样本数据未用作有关碳氮稳定同位素值的地理差异分析。
1.3 数据处理
本研究中,试验数据均以平均值±标准差(mean±S.D.)表示,并采用单因素方差分析法(one-ANOVA)对两个物种间、种内不同站点间的δ13C和δ15N差异进行显著性分析,采用SPSS 26.0软件进行统计检验,显著性水平α=0.05。
2 结果与分析
2.1 胴长组成
从图2可见:富山武装乌贼胴长为11~62 mm,优势胴长为26~35 mm;相拟钩腕乌贼胴长为13~36 mm,优势胴长为16~25 mm。两个物种的胴长具有显著性差异(F=73.915,P<0.05)。不同采样站点间,富山武装乌贼的胴长有显著性差异(F=40.273,P<0.05),而相拟钩腕乌贼的胴长无显著性差异(F=1.648,P>0.05)。
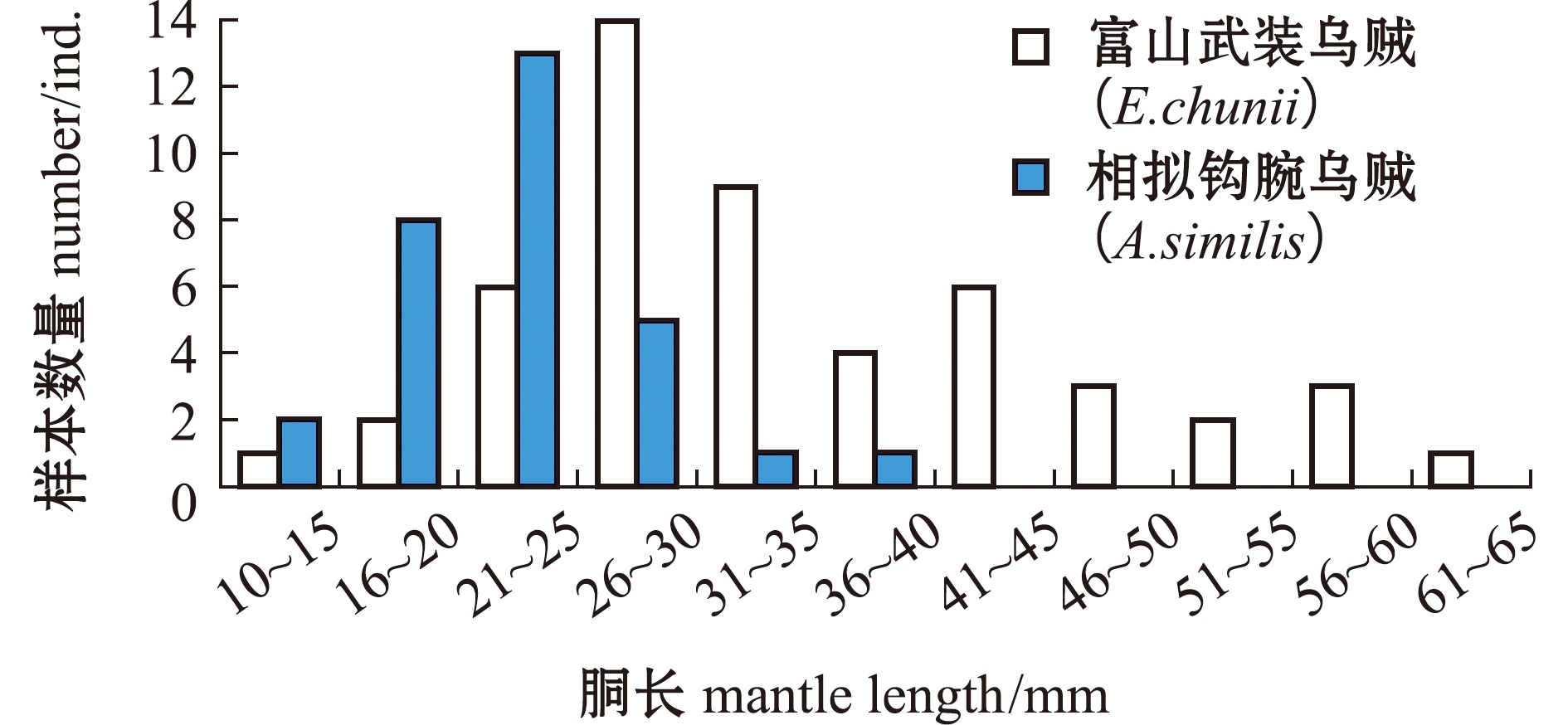
图2 富山武装乌贼和相拟钩腕乌贼胴长分布
Fig.2 Mantle length distribution of Enoploteuthis chunii and Abralia similis
2.2 稳定同位素值
富山武装乌贼δ13C值为-20.53‰~-18.27‰,δ15N值为8.67‰~12.17‰;相拟钩腕乌贼δ13C值为-19.60‰~-18.73‰,δ15N值为8.21‰~11.12‰。两个物种的δ13C值无显著性差异(F=1.104,P>0.05),δ15N值有显著性差异(F=73.090,P<0.05)。基线调整后的富山武装乌贼和相拟钩腕乌贼δ15Nb值分别为2.82‰~7.26‰和1.62‰~8.21‰,且两个物种的δ15Nb值有显著性差异(F=13.461, P<0.05)。
S2站点中,两个物种的δ13C、δ15N和δ15Nb值均无显著性差异(FC=0.574,PC>0.05;FN=0.000,PN>0.05;FNb=0.001,PNb>0.05);S3站点中,两个物种的δ15N和δ15Nb值均有显著性差异(FN=13.813,PN<0.05;FNb=13.800,PNb<0.05),而δ13C值无显著性差异(F=3.643,P>0.05);富山武装乌贼在S3站点具有较大的δ13C、δ15N值,而相拟钩腕乌贼在S3站点具有较大的δ15N值,在S4站点具有较大的δ13C值(表2)。
表2 渔业生物样本信息
Tab.2 Specimen information of fishery organisms
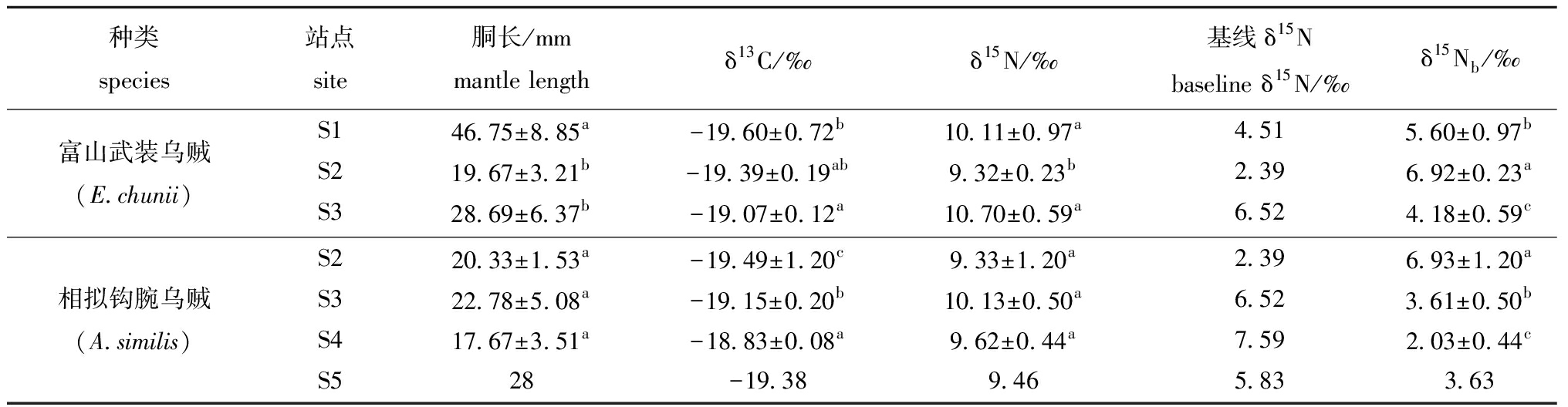
种类species站点site胴长/mmmantle lengthδ13C/‰δ15N/‰基线δ15Nbaseline δ15N/‰δ15Nb/‰富山武装乌贼(E.chunii)S146.75±8.85a-19.60±0.72b10.11±0.97a4.515.60±0.97bS219.67±3.21b-19.39±0.19ab9.32±0.23b2.396.92±0.23aS328.69±6.37b-19.07±0.12a10.70±0.59a6.524.18±0.59c相拟钩腕乌贼(A.similis)S220.33±1.53a-19.49±1.20c9.33±1.20a2.396.93±1.20aS322.78±5.08a-19.15±0.20b10.13±0.50a6.523.61±0.50bS417.67±3.51a-18.83±0.08a9.62±0.44a7.592.03±0.44cS528-19.389.465.833.63
注:同列中标有不同字母者表示同一物种不同站点间有显著性差异(P<0.05),标有相同字母者表示站点间无显著性差异(P>0.05)。
Note:means with different letters within the same column in same species are significantly different in different site at the 0.05 probability level,and the means with the same letter within the same column are not significant differences.
从整体上看,站点对富山武装乌贼δ13C、δ15N和δ15Nb值均有显著性影响(FC=5.021,PC<0.05;FN=9.868,PN<0.05;FNb=9.715,PNb<0.05),除了δ13C值中S1与S2站点及S2与S3站点,δ15N值中S1与S3站点外,其余各站点间δ13C、δ15Nb和δ15Nb值均存在显著性差异(P<0.05)。站点对相拟钩腕乌贼δ13C和δ15Nb值有显著性影响(FC=6.988,PC<0.05;FNb=39.490,PNb<0.05),而对δ15N值无显著性影响(F=2.473,PN>0.05)(表2)。
2.3 稳定同位素值与胴长的关系
在个体生长发育过程中,富山武装乌贼的δ13C、δ15N值与胴长无显著相关性(FC=1.283,PC>0.05;FN=0.243,PN>0.05),δ15Nb值随胴长的增大而显著增大(F=11.218,P<0.05);相拟钩腕乌贼的δ13C、δ15N和δ15Nb值随胴长的变化均无显著相关性(FC=1.442,PC>0.05;FN=0.179,PN>0.05;FNb=0.005,PNb>0.05)。此外,按图2所划分的胴长组,并计算各胴长组平均胴长,分析富山武装乌贼和相拟钩腕乌贼各胴长组内δ13C、δ15N值变化,结果显示,富山武装乌贼和相拟钩腕乌贼的δ13C、δ15N和δ15Nb值在同一胴长组内均出现较大的波动(图3)。
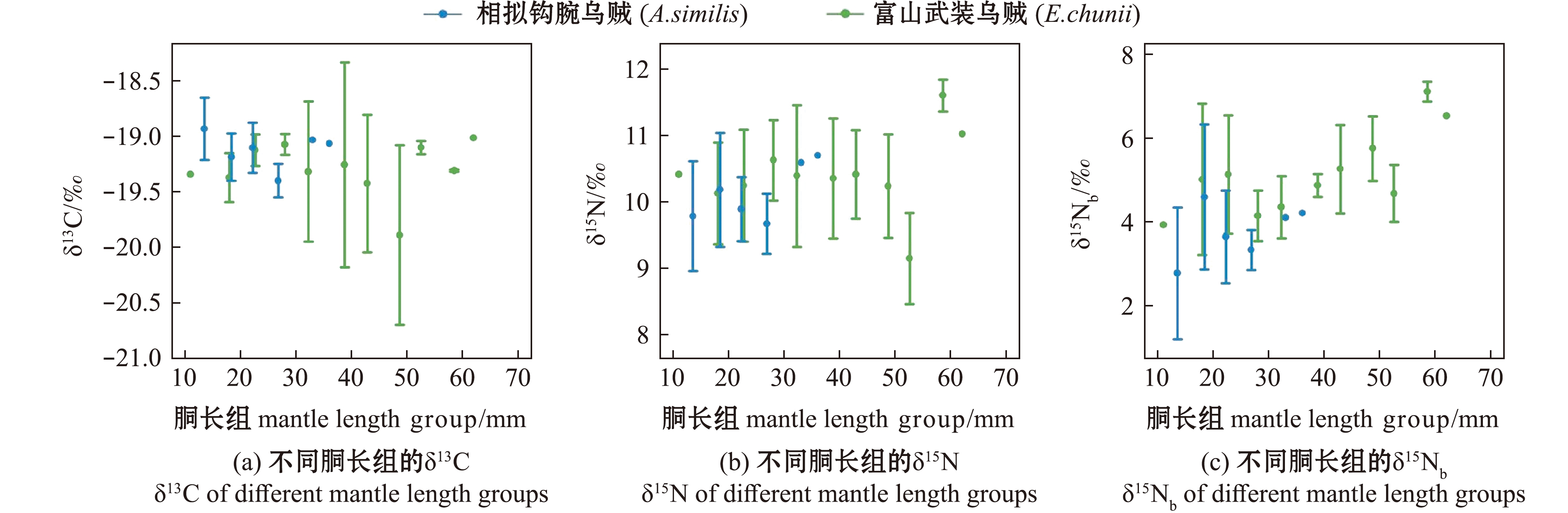
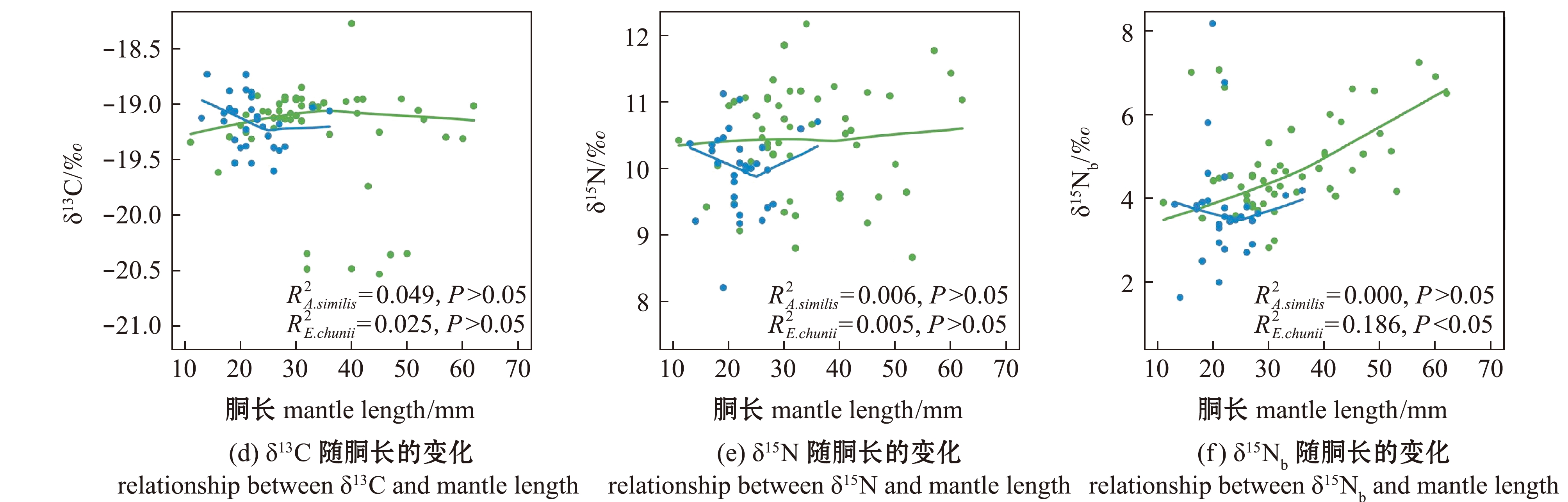
图3 富山武装乌贼和相拟钩腕乌贼各胴长组的δ13C、δ15N、δ15Nb值及其与胴长的平滑拟合
Fig.3 Relationship between δ13C,δ15N and δ15Nb values with each mantle length group and smooth fitting with mantle length of Enoploteuthis chunii and Abralia similis
2.4 个体发育期营养生态位对比
从表3可见:稚鱼期,富山武装乌贼与相拟钩腕乌贼的胴长有显著性差异(F=33.688,P<0.05),而δ13C、δ15N和δ15Nb值均无显著性差异(FC=0.108,PC>0.05;FN=1.736,PN>0.05;FNb=0.134,PNb>0.05);成鱼期,两个物种的胴长、δ15N和δ15Nb值均有显著性差异(FML=32.049,P<0.05; FN=34.352,PN<0.05;FNb=33.443,PNb<0.05),而δ13C值无显著性差异(F=2.846,P>0.05)。
表3 两种头足类不同发育时期的生物信息
Tab.3 Biological information at the different ontogenies of two cephalopods
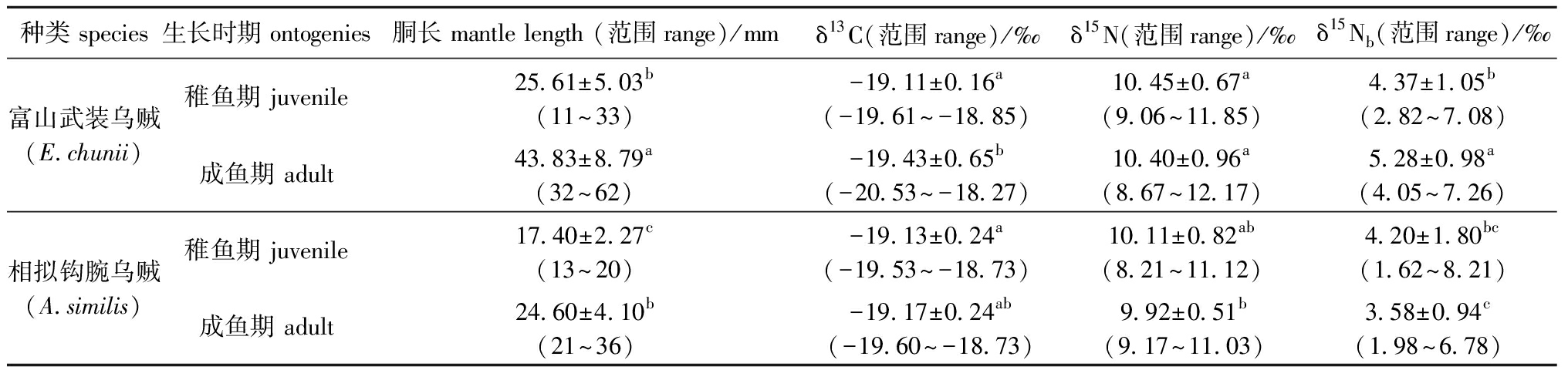
种类 species生长时期 ontogenies胴长 mantle length (范围range)/mmδ13C(范围range)/‰δ15N(范围range)/‰δ15Nb(范围range)/‰富山武装乌贼(E.chunii)稚鱼期 juvenile25.61±5.03b(11~33)-19.11±0.16a(-19.61~-18.85)10.45±0.67a(9.06~11.85)4.37±1.05b(2.82~7.08)成鱼期 adult43.83±8.79a(32~62)-19.43±0.65b(-20.53~-18.27)10.40±0.96a(8.67~12.17)5.28±0.98a(4.05~7.26)相拟钩腕乌贼(A.similis)稚鱼期 juvenile17.40±2.27c(13~20)-19.13±0.24a(-19.53~-18.73)10.11±0.82ab(8.21~11.12)4.20±1.80bc(1.62~8.21)成鱼期 adult24.60±4.10b(21~36)-19.17±0.24ab(-19.60~-18.73)9.92±0.51b(9.17~11.03)3.58±0.94c(1.98~6.78)
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences.
不同生长时期营养生态位分析显示:富山武装乌贼成鱼期营养生态位宽度(SEAc=1.78‰2)大于稚鱼期(SEAc=0.32‰2),两者间重叠率较低(0.19);相拟钩腕乌贼成鱼期的营养生态位宽度(SEAc=0.39‰2)小于稚鱼期(SEAc=0.68‰2),两者间重叠率中等(0.37)(图4)。种间分析显示,富山武装乌贼与相拟钩腕乌贼稚鱼期的重叠率中等(0.33),成鱼期重叠率较低(0.20)(图5)。
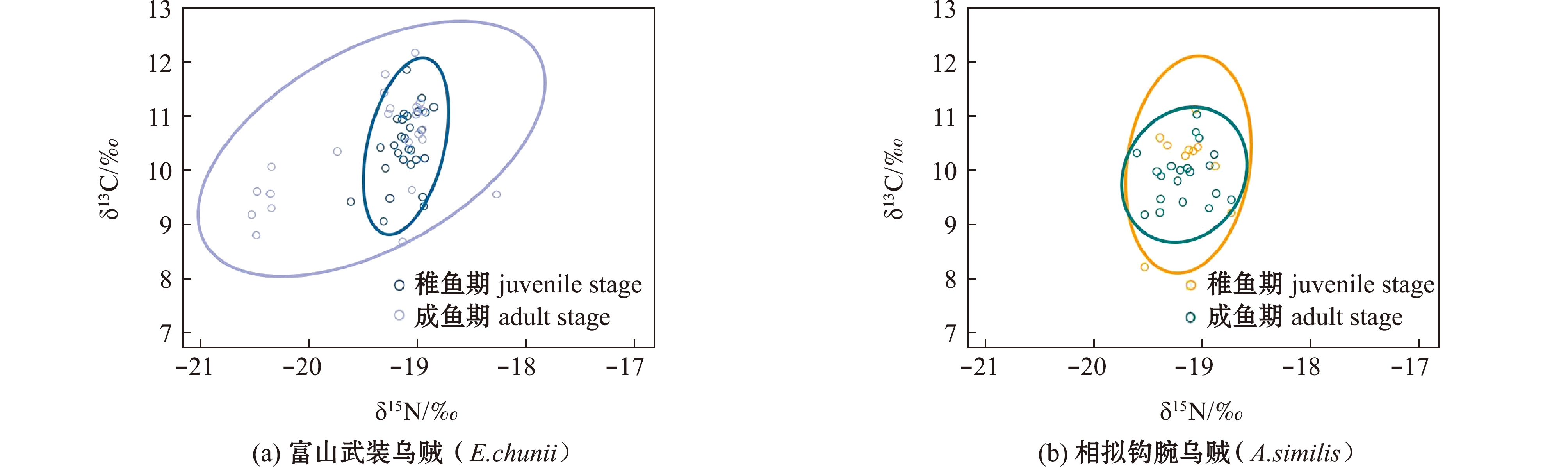
图4 富山武装乌贼和相拟钩腕乌贼不同生长时期营养生态位
Fig.4 Trophic niche of Enoploteuthis chunii and Abralia similis at different stages
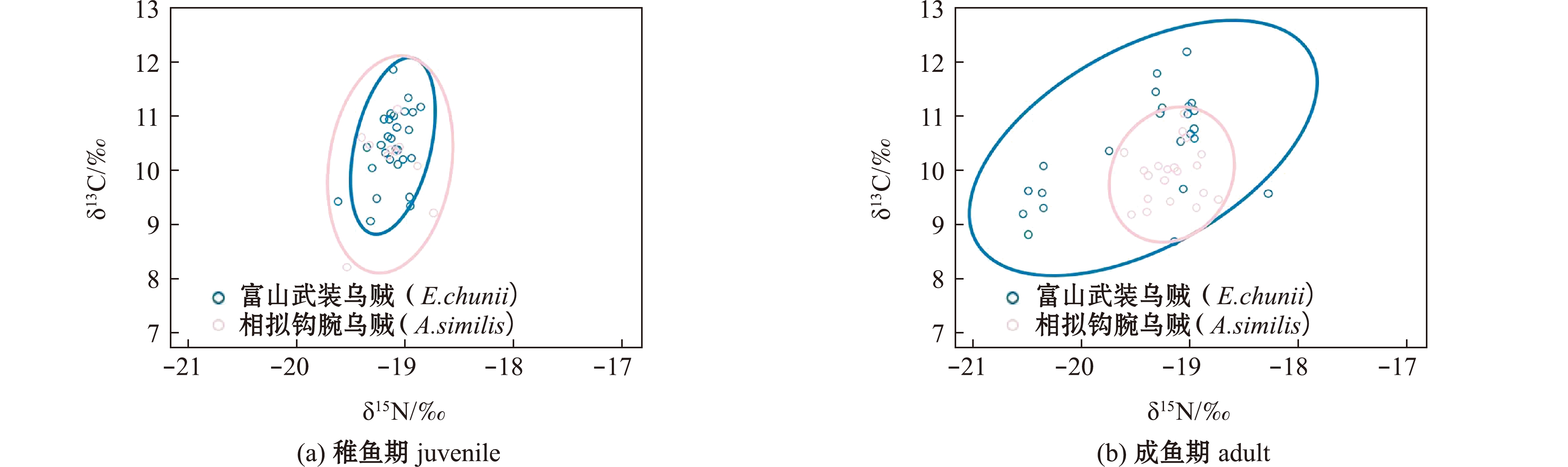
图5 不同生长时期富山武装乌贼和相拟钩腕乌贼营养生态位对比
Fig.5 Comparison of the trophic niche between Enoploteuthis chunii and Abralia similis at ontogenetic stages
3 讨论
3.1 碳氮稳定同位素值的地理差异
生物组织中的δ13C值反映了初级生产力的来源,并随纬度和海岸水平距离产生变化。本研究中,富山武装乌贼和相拟钩腕乌贼不同站点δ13C值的显著变化差异可能与地理变化差异有关。位于黑潮以北及黑潮-亲潮过渡区的S3和S4站点中,富山武装乌贼和相拟钩腕乌贼均有较高的δ13C值。Nishikawa等[22]研究发现,黑潮、亲潮交汇带来了丰富的营养物质,为小型中上层鱼类提供了重要的索饵育肥场。Rau等[23]指出,随着海表面温度(SST)的升高,浮游植物的δ13C值随之增大。此外,水中的CO2浓度及浮游植物的生长速度也会影响其碳同位素的分馏作用[24]。这些影响因素会对浮游植物的δ13C值产生影响,并最终反映在鱿鱼的δ13C值中[25]。本研究中,S3和S4采样站点的SST(分别为25.20、28.70 ℃)高于S1和S2站点(分别为18.04、17.91 ℃)(https://resources. marine.copernicus.eu/products),因此,SST较高的站点有丰富的营养物质,使得营养盐、浮游植物等较大的初级生产力随着食物网中物质、能量流动,最终反映在富山武装乌贼和相拟钩腕乌贼的肌肉δ13C值中。
与不同采样站点的δ13C值存在显著性差异的原因不同,富山武装乌贼不同采样站点的δ15N值的显著性差异可能受基线值的空间变化和营养效应两方面影响[26]。本研究中,使用采样站点附近的浮游动物桡足类δ15N值作为基线,对δ15N值进行基线调整后,各采样站点的δ15Nb值也具有显著性差异,同时,富山武装乌贼各采样站点的胴长也存在显著性差异。因此,笔者认为,各站点物种胴长差异所带来的摄食结构变化,会造成各站点乌贼肌肉中δ15N值的空间差异。同时大多数头足类均会出现明显的洄游行为,在其生命周期中将跨越多个不同的栖息地环境[27]。Young等[28]指出,如果研究对象是在被捕捞前的短时间内迁移至采样站点,使用采样站点基线对组织δ15N值进行调整会产生一定的空间偏差,同时肌肉组织中也整合了生物个体一段时间内的摄食信息。因此,富山武装乌贼的洄游迁移运动对各采样站点的δ15N值的空间差异也产生一定程度的影响。而相拟钩腕乌贼各采样站点的δ13C、δ15Nb值差异显著及胴长差异不显著,表明各站点间的同位素值差异更多的来自基线值的空间变化。
3.2 个体发育对稳定同位素值变化的影响
头足类的个体发育往往会带来其摄食习性及摄食范围等的变化,并反映在其稳定同位素值的变化中。本研究中,与富山武装乌贼胴长小于31 mm组相比,胴长为31~48 mm时,胴长组内δ13C值变化较大,同时,δ15Nb值随胴长的增大而显著增加(图3)。出现这种情况的原因可能有两个方面:一是,随着富山武装乌贼的个体的生长,其游泳能力逐渐增强,可以在更大的区域范围内进行摄食;二是,角质颚的不断生长及个体体型的增大,也使其在摄食猎物的选择上,从最初仔鱼期的小型浮游动物这类营养水平较低的生物开始向大型浮游动物、甲壳类和小型鱼类等营养水平较高及体型更大的生物进行转变[19],这种摄食变化现象也在头足类个体发育过程中被广泛观察到,如茎柔鱼[29]。此外,头足类是贪婪的机会主义摄食者[30],同一个胴长组内由于摄食区域的差异,有着不同营养水平的食物资源,从而使同一胴长组内δ15Nb值产生较大的变化。本研究中,所采集的富山武装乌贼中胴长较大(ML>48 mm)的个体主要集中于S1站点,摄食范围集中;随着个体发育逐渐趋于成熟,富山武装乌贼的摄食习性逐渐倾向于更高营养水平的生物,其摄食种类也更趋向于稳定,因此,在富山武装乌贼生命后期,同一胴长组的δ13C和δ15Nb值变化范围逐渐降低。
本研究中,相拟钩腕乌贼个体发育过程中,δ15N和δ15Nb值随胴长的变化较小,这可能是由于在相拟钩腕乌贼整个生长过程中,摄食的主要对象为浮游动物,这种摄食习性也在其他小型头足类如魏氏钩腕乌贼和小钩腕乌贼的摄食中被观察到[20]。当胴长小于25 mm时,相拟钩腕乌贼δ13C值变化范围较大,同时随着个体发育,δ15N和δ15Nb值呈现下降趋势(图3)。Somes等[31]研究认为,如果排除个体发育过程中营养变化的影响,在鱿鱼生长过程中,δ15N值会出现系统性下降,这一过程往往与迁移运动中的栖息地变化所带来的基线生物δ15N值的降低有关。而Takai等[27]研究则发现,与δ13C值变化相似,浮游植物的δ15N值具有纬度方向上的变化,随纬度的增加而降低。本研究中,相拟钩腕乌贼各站点间同位素值的微小差异更多来自基线值的差异,且胴长小于25 mm的相拟钩腕乌贼在S2、S3和S4站点均有分布,而胴长大于25 mm的乌贼则主要分布在S3站点。由此可见,当相拟钩腕乌贼处于仔稚鱼期及未成熟的幼鱼期时,会逐渐向黑潮-亲潮过渡区洄游,然后随着个体的发育生长及黑潮-亲潮过渡区所提供的丰富的饵料生物,相拟钩腕乌贼也会开始摄食体型更大、能量更高的猎物以满足性腺发育的营养需求[32],因此,当胴长大于25 mm后,其δ15N和δ15Nb值均出现连续增长趋势,而δ13C值变化则较小。
3.3 不同生长时期生态位的变化
营养生态位宽度主要反映了生物摄食资源的多样性和均匀度[33],而生态位的重叠反映了物种间资源利用的相似度和竞争关系[34]。本研究中,富山武装乌贼在个体发育过程中,稚鱼期时体型较小,游泳能力较弱,主要摄食浮游动物,摄食资源较为单一,活动范围较小,因此,生态位宽度较小;成鱼期的富山武装乌贼随着胴长的增大,游泳能力加强,具有明显的昼夜垂直洄游习性,且昼夜分离明显,对生态系统中的能量物质输送起着重要作用[35],同时富山武装乌贼垂直和水平活动范围增大,摄食营养水平增加,从而有着更大的生态位宽度。此外,富山武装乌贼稚鱼期和成鱼期营养生态位间较低的重叠率,也反映了物种个体发育过程中存在较为明显的摄食习性变化及栖息地利用范围的增大。相拟钩腕乌贼在个体发育过程中,稚鱼期营养生态位宽度略大于成鱼期,且重叠率中等。相拟钩腕乌贼在整个生命周期中主要摄食浮游动物,成鱼期主要集中在黑潮-亲潮过渡区进行索饵,并随着胴长的增大及个体发育中能量的需求,其摄食开始出现一定偏向性,并开始摄食一些体型较大、能量更高的猎物,从而会出现稚鱼期和成鱼期营养生态位宽度较小的变化及中等程度的重叠率。
两个物种间对比发现,稚鱼期富山武装乌贼与相拟钩腕乌贼营养生态位宽度相比差异较小,且δ13C和δ15N值均无显著性差异,由于在该时期两个物种胴长较小,主要摄食浮游动物,笔者认为造成营养生态位的微小差异可能与采样站点的分布有关。本研究中,所采集的稚鱼期富山武装乌贼站点为 S2、S3,稚鱼期相拟钩腕乌贼站点为S2、S3 和 S4。因此,稚鱼期相拟钩腕乌贼站点分布较广可能是造成其营养生态位较宽的主要原因,同时中等程度的重叠率也进一步证明了两个物种在稚鱼期栖息地存在一定的差异。而成鱼期,两个物种的δ15N和δ15Nb值具有显著性差异,这是因为富山武装乌贼有着较大的胴长、较强的游泳能力及明显的摄食习性的改变,因此,有着更大的生态位宽度,且两者之间的重叠率较低。
4 结论
1)富山武装乌贼δ13C、δ15N值主要受到同位素基线值空间变化及摄食作用的影响,而相拟钩腕乌贼δ13C、δ15N值主要受到同位素基线值空间变化的影响。
2)整个生命周期中,富山武装乌贼和相拟钩腕乌贼主要以黑潮-亲潮过渡区作为索饵育肥场所。
3)个体发育过程中,富山武装乌贼随胴长的增大出现摄食习性变化,成鱼期营养生态位宽度较大,有着更大的运动范围及摄食资源多样性;相拟钩腕乌贼主要摄食浮游动物,其稚鱼期与成鱼期之间营养生态位宽度变化较小,随胴长的增大及个体发育能量的需求,该乌贼在成鱼期摄食也会出现一定的偏向性,开始摄食一些营养水平更高的猎物。
[1] OKUTANI T K.Abralia similis,a new enoploteuthid squid from the northwest Pacific (Cephalopoda,Oegopsida)[J].Bulletin of the National Science Museum Series A,Zoology,1987,13(4):141-150.
[2] SON M H,HONG S Y.A short note on Enoploteuthis (Paraenoploteuthis chunii) (Cepphlopoda:Enopoteuthidae) from the Korean water[J].Animal Systematics,Evolution and Diversity,1992,8(2):331-335.
[3] 连晋欣,臧娜,陈新军,等.西北太平洋富山武装乌贼和相拟钩腕乌贼的空间分布及生物学特征[J].广东海洋大学学报,2021,41(5):53-60.
LIAN J X,ZANG N,CHEN X J,et al.Spatial distribution and biological characteristics of Enoploteuthis chunii and Abralia similis in the northwest Pacific[J].Journal of Guangdong Ocean University,2021,41(5):53-60.(in Chinese)
[4] WATANABE H,KUBODERA T,MOKU M,et al.Diel vertical migration of squid in the warm core ring and cold water masses in the transition region of the western North Pacific[J].Marine Ecology Progress Series,2006,315:187-197.
[5] WANG M C,WALKER W A,SHAO K T,et al.Comparative analysis of the diets of pygmy sperm whales and dwarf sperm whales in Taiwanese waters[J].Acta Zoologica Taiwanica,2002,13(2):53-62.
[6] SHIMOSE T,WATANABE H,TANABE T,et al.Ontogenetic diet shift of age-0 year Pacific bluefin tuna Thunnus orientalis[J].Journal of Fish Biology,2013,82(1):263-276.
[7] 李云凯,陈子昂,贡艺,等.海洋动物营养生态位研究方法及其应用[J].热带海洋学报,2021,40(4):143-156.
LI Y K,CHEN Z A,GONG Y,et al.A review on the methods used in trophic niche studies of marine animals and their applications[J].Journal of Tropical Oceanography,2021,40(4):143-156.(in Chinese)
[8] 李云凯,贡艺,陈新军.稳定同位素技术在头足类摄食生态学研究中的应用[J].应用生态学报,2014,25(5):1541-1546.
LI Y K,GONG Y,CHEN X J.Applications of stable isotope analysis in the trophic ecology studies of cephalopods[J].Chinese Journal of Applied Ecology,2014,25(5):1541-1546.(in Chinese)
[9] YOKOYAMA H,TAMAKI A,HARADA K,et al.Variability of diet-tissue isotopic fractionation in estuarine macrobenthos[J].Marine Ecology Progress Series,2005,296:115-128.
[10] CHEREL Y,HOBSON K A.Geographical variation in carbon stable isotope signatures of marine predators:a tool to investigate their foraging areas in the Southern Ocean[J].Marine Ecology Progress Series,2007,329:281-287.
[11] TANAKA Y,MINAMI H,ISHIHI Y,et al.Relationship between prey utilization and growth variation in hatchery-reared Pacific bluefin tuna,Thunnus orientalis(Temminck et Schlegel),larvae estimated using nitrogen stable isotope analysis[J].Aquaculture Research,2014,45(3):537-545.
[12] JIN Y,LIN F L,CHEN X J,et al.Microstructure comparison of hard tissues (statoliths,beaks,and eye lenses) of Uroteuthis chinensis in the South China Sea[J].Bulletin of Marine Science,2019,95(1):13-26.
[13] LIU B L,XU W,CHEN X J,et al.Ontogenetic shifts in trophic geography of jumbo squid,Dosidicus gigas,inferred from stable isotopes in eye lens[J].Fisheries Research,2020,226:105507.
[14] MALPICA-CRUZ L,HERZKA S Z,SOSA-NISHIZAKI O,et al.Tissue-specific isotope trophic discrimination factors and turnover rates in a marine elasmobranch:empirical and modeling results[J].Canadian Journal of Fisheries and Aquatic Sciences,2012,69(3):551-564.
[15] 操亮亮,刘必林,李建华.基于稳定同位素技术的东南太平洋公海茎柔鱼摄食生态分析[J].大连海洋大学学报,2022,37(1):120-128.
CAO L L,LIU B L,LI J H.Analysis of feeding ecology of jumbo squid Dosidicus gigas in the high seas of southeast Pacific Ocean based on stable isotope technology[J].Journal of Dalian Ocean University,2022,37(1):120-128.(in Chinese)
[16] DENIRO M J,EPSTEIN S.Mechanism of carbon isotope fractionation associated with lipid synthesis[J].Bioorganic &Medicinal Chemistry,1977,197(4300):261-263.
[17] POST D M,LAYMAN C A,ARRINGTON D A,et al.Getting to the fat of the matter:models,methods and assumptions for dealing with lipids in stable isotope analyses[J].Oecologia,2007,152(1):179-189.
[18] 贡艺,陈新军,高春霞,等.脂类抽提对北太平洋柔鱼肌肉碳、氮稳定同位素测定结果的影响[J].应用生态学报,2014,25(11):3349-3356.
GONG Y,CHEN X J,GAO C X,et al.Effects of lipid extraction on stable carbon and nitrogen isotope analyses of Ommastrephes bartramii muscle[J].Chinese Journal of Applied Ecology,2014,25(11):3349-3356.(in Chinese)
[19] 卜心宇,刘必林,欧利国,等.富山武装乌贼个体发育期角质颚表型变化分析[J].南方水产科学,2022,18(1):144-152.
BU X Y,LIU B L,OU L G,et al.Analysis of ontogenetic phenotype changes of Enoploteuthis chunii beak[J].South China Fisheries Science,2022,18(1):144-152.(in Chinese)
[20] GUERRA-MARRERO A,HERN NDEZ-GARC
NDEZ-GARC A V,SARMIENTO-LEZCANO A,et al.Migratory patterns,vertical distributions and diets of Abralia veranyi and Abraliopsis morisii (Cephalopoda:Enoploteuthidae) in the eastern North Atlantic[J].Journal of Molluscan Studies,2019,86(1):27-34.
A V,SARMIENTO-LEZCANO A,et al.Migratory patterns,vertical distributions and diets of Abralia veranyi and Abraliopsis morisii (Cephalopoda:Enoploteuthidae) in the eastern North Atlantic[J].Journal of Molluscan Studies,2019,86(1):27-34.
[21] LAYMAN C A,ARRINGTON D A,MONTA A C G,et al.Can stable isotope ratios provide for community-wide measures of trophic structure?[J].Ecology,2007,88(1):42-48.
A C G,et al.Can stable isotope ratios provide for community-wide measures of trophic structure?[J].Ecology,2007,88(1):42-48.
[22] NISHIKAWA H,NISHIKAWA S,ISHIZAKI H,et al.Detection of the Oyashio and Kuroshio fronts under the projected climate change in the 21st century[J].Progress in Earth and Planetary Science,2020,7:29.
[23] RAU G H,TAKAHASHI T,DES MARAIS D J.Latitudinal variations in plankton delta 13C:implications for CO2 and productivity in past oceans[J].Nature,1989,341(6242):516-518.
[24] RUIZ-COOLEY R I,GERRODETTE T.Tracking large-scale latitudinal patterns of δ13C and δ15N along the E Pacific using epi-mesopelagic squid as indicators[J].Ecosphere,2012,3(7):1-17.
[25] CLARKE M R.The role of cephalopods in the world’s oceans:general conclusions and the future[J].Philosophical Transactions of the Royal Society of London Series B:Biological Sciences,1996,351(1343):1105-1112.
[26] LAWS E,POPP B,BIDIGARE J R R,et al.Dependence of phytoplankton carbon isotopic composition on growth rate and (CO2)aq:theoretical considerations and experimental results[J].Geochimica et Cosmochimica Acta,1995,59(6):1131-1138.
[27] TAKAI N,ONAKA S,IKEDA Y,et al.Geographical variations in carbon and nitrogen stable isotope ratios in squid[J].Journal of the Marine Biological Association of the United Kingdom,2000,80(4):675-684.
[28] YOUNG J W,OLSON R J,M NARD F,et al.Setting the stage for a global-scale trophic analysis of marine top predators:a multi-workshop review[J].Reviews in Fish Biology and Fisheries,2015,25(1):261-272.
NARD F,et al.Setting the stage for a global-scale trophic analysis of marine top predators:a multi-workshop review[J].Reviews in Fish Biology and Fisheries,2015,25(1):261-272.
[29] 操亮亮,力清影,刘必林.东太平洋公海茎柔鱼饵料中鱼类和头足类组成初步分析[J].应用生态学报,2021,32(12):4515-4522.
CAO L L,LI Q Y,LIU B L.Preliminary analysis on the composition of fish and cephalopod in diet of Dosidicus gigas in the high sea of Eastern Pacific Ocean[J].Chinese Journal of Applied Ecology,2021,32(12):4515-4522.(in Chinese)
[30] WATANABE H,KUBODERA T,ICHII T,et al.Feeding habits of Neon flying squid Ommastrephes bartramii in the transitional region of the central North Pacific[J].Marine Ecology Progress Series,2004,266:173-184.
[31] SOMES C J,SCHMITTNER A,GALBRAITH E D,et al.Simulating the global distribution of nitrogen isotopes in the ocean[J].Global Biogeochemical Cycles,2010,24(4).https://doi.org/10.1029/2009GB003767.
[32] 陈新军,马金,刘必林,等.基于耳石微结构的西北太平洋柔鱼群体结构、年龄与生长的研究[J].水产学报,2011,35(8):1191-1198.
CHEN X J,MA J,LIU B L,et al.Population structure,age and growth of neon flying squid(Ommastrephes bartramii)in the northwest Pacific Ocean based on statolith microstructure[J].Journal of Fisheries of China,2011,35(8):1191-1198.(in Chinese)
[33] BEARHOP S,ADAMS C E,WALDRON S,et al.Determining trophic niche width:a novel approach using stable isotope analysis[J].Journal of Animal Ecology,2004,73(5):1007-1012.
[34] HURLBERT S H.The measurement of niche overlap and some relatives[J].Ecology,1978,59(1):67-77.
[35] HIDAKA K,KAWAGUCHI K,MURAKAMI M,et al.Downward transport of organic carbon by diel migratory micronekton in the western equatorial Pacific:its quantitative and qualitative importance[J].Deep Sea Research Part I:Oceanographic Research Papers,2001,48(8):1923-1939.