糖尿病是一种以高血糖为特征的代谢性疾病,可诱发心肌梗死、中风和心血管疾病等各种慢性并发症。近年来,糖尿病发病率在全世界迅速增加,已成为继心脑血管疾病、癌症后的第三大危害人类生命健康的疾病[1]。据统计,2021年中国的糖尿病患者数量为1.4亿,10年间增幅达56%,预计2030年中国糖尿病患者人数将超过1.6亿[2]。Ⅱ型糖尿病是糖尿病患者的主要发病类型,现有研究表明,α-葡萄糖苷酶、α-淀粉酶和二肽基肽酶Ⅳ(DPP-Ⅳ)是治疗Ⅱ型糖尿病的重要靶点[3]。α-葡萄糖苷酶可直接参与多糖代谢,通过水解葡萄糖苷键在小肠释放葡萄糖;α-淀粉酶通过水解淀粉内部α-1,4-糖苷键生成葡萄糖,促进血糖快速升高。因此,抑制α-葡萄糖苷酶及α-淀粉酶的活性可延缓多糖向单糖的转化,维持血糖正常水平,并有效改善餐后高血糖症状。胰高血糖素样肽-1(GLP-1)是一种能刺激胰岛素分泌的激素,可系统调控血糖水平,但体内GLP-1极易被DPP-IV降解失活,而DPP-IV抑制剂可延长GLP-1的作用时间,达到降低血糖的目的。因此,α-淀粉酶、α-葡萄糖苷酶和DPP-Ⅳ酶天然抑制剂具有调控血糖的良好潜力。
牡蛎,俗称“蚝”,是世界第一大养殖贝类,是中国卫生部门批准的第一批药食同源的海产品之一[4]。牡蛎富含优质蛋白质,有“海洋牛奶”之美誉,是制备活性肽的良好来源。研究表明,牡蛎肽(oyster peptide)具有调节免疫力、降血压及降血糖等多种生理活性[5-6]。牡蛎肽因具备特殊海洋环境赋予的独特氨基酸序列结构,在降糖应用方面具有天然优势[7-8]。但其消化稳定性差的问题,极大地限制了活性肽的活性发挥[9]。花色苷是一类广泛存在于果蔬中的天然色素,具有显著的降血糖功能[10-11],且本课题组前期研究发现,花色苷与牡蛎肽的复合物具有提高二者消化稳定性和降糖活性的潜力。目前,关于牡蛎降糖肽的结构特征、消化稳定性及活性增效研究鲜有报道。本研究中,以香港牡蛎(Grassostrea hongkongensis)为原料制备牡蛎降糖肽,对其相对分子质量分布、氨基酸组成和肽谱序列等结构特征进行表征;通过体外降糖模型(α-葡萄糖苷酶、α-淀粉酶和DPP-Ⅳ抑制模型)及模拟胃肠消化模型考察牡蛎肽的降糖活性及消化稳定性,并探究了利用花色苷协同提高牡蛎肽消化稳定性和降糖活性,以期为新型牡蛎降糖肽及其活性增效研究提供科学参考。
1 材料与方法
1.1 材料
试验用新鲜牡蛎肉购于广东省湛江市水产品批发市场;黑豆皮花色苷购于西安维珍生物科技有限公司。
试剂:动物蛋白水解复合酶(10 万U/g)购于广西南宁庞博生物工程有限公司;α-葡萄糖苷酶(70 万U/mL)、α-淀粉酶(猪胰腺,5 U/mg)、可溶性淀粉、对硝基苯基吡喃葡萄糖苷(p-NPG)、胃蛋白酶、胰蛋白酶和磷酸缓冲液(PBS)均购于上海源叶生物科技有限公司;甲醛(色谱级)购于北京索莱宝科技有限公司;氮-甘氨酰脯氨酰-对硝基苯胺盐酸盐(328.75 mol/g)、二肽基肽酶Ⅳ(4 000 U/μg)购于美国Sigma公司。
仪器与设备:Varioskan Flash全自动酶标仪(美国Thermo公司);5810R高速台式冷冻离心机(美国Eppendorf公司);半制备液相色谱仪(美国安捷伦公司);FD-551大型立式冷冻干燥机(东京理化器械公司);旋蒸浓缩系统N-4000(东京理化器械公司);全自动凯氏定氮仪VAPODEST 450(德国格哈特分析仪器有限公司)。
1.2 方法
1.2.1 牡蛎肽的制备 参考柏昌旺等[12]方法优化牡蛎肽制备条件。将香港牡蛎肉经流水解冻后按料液比1∶3.9(g∶mL)加水匀浆,加入动物蛋白酶(每g牡蛎全肉加酶量为3 300 U)酶解3 h(pH 6~7,47 ℃),酶解结束后沸水浴灭酶10 min,迅速冷却至室温,4 ℃下以8 000 r/min离心15 min后,用4层脱脂棉纱布过滤,取上清液冷冻干燥48 h备用。
1.2.2 牡蛎肽相对分子质量分布 参考Li等[13]的方法,分析牡蛎肽的相对分子质量分布。
样品制备:称取样品100 mg于10 mL容量瓶中,用流动相稀释至刻度,超声5 min后离心,采用孔径为0.22 μm的有机系滤膜过滤后进样,同时配制质量浓度为1 mg/mL的多肽标准溶液。
色谱条件:色谱柱,TSKgel2000SWXL300 mm×7.8 mm;流动相为乙腈+水+三氟乙酸,三者的体积比为40∶60∶0.1;流速为0.5 mL/min,柱温为 30 ℃,进样体积为20 μL,检测波长为220 nm。对多肽标准品的保留时间及相对分子质量的对数进行线性拟合,制作标准曲线,并采用面积归一化法进行相对分子质量分布的计算。
1.2.3 牡蛎肽氨基酸组成分析 按照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》中的方法,采用全自动氨基酸分析仪进行氨基酸组成分析。
1.2.4 牡蛎肽肽谱序列测定 参考Xu等[14]的方法并稍作改进。采用UPLC-Q-TOF技术对牡蛎肽进行肽谱序列鉴定。选取C18色谱柱(150 mm × 2.0 mm),检测波长为220 nm,柱温为40 ℃,流速为0.3 mL/min,进样量为10 μL。流动相:A液为纯乙腈和0.1%甲酸;B液为超纯水和0.1%甲酸。采取梯度洗脱方式:0 min时A液为96%(均为体积分数,下同),在55 min内B液由4%增加至40%;56 min时B液为95%,并保持至66 min,结束后用95%的B液冲洗柱子。
1.2.5 牡蛎肽体外降糖活性测定
1)α-葡萄糖苷酶抑制率。参照De Matos等[15]的方法并稍作调整,采用pNPG法测定牡蛎肽的α-葡萄糖苷酶抑制活性。移取110 μL磷酸盐缓冲液(pH 6.8)于96孔板微孔,分别加入20 μL样品溶液和20 μL 1 U/mL的α-葡萄糖苷酶溶液,混匀后于37 ℃下孵育10 min后,加入20 μL 1.25 mmol/L的底物pNPG,体系于37 ℃下反应20 min后,加入80 μL 0.1 mol/L的碳酸钠终止反应,以阿卡波糖作为阳性对照组,重复以上试验操作。用酶标仪在405 nm处测定其吸光值,并计算α-葡萄糖苷酶抑制率(RⅠ),即
(1)
式中:A1、A2、A3和A4分别为样品组、样品空白组、对照组和空白组的吸光值。
2)α-淀粉酶抑制率。参照De Matos等[15]的方法并稍作调整,采用DNS比色法测定牡蛎肽的α-淀粉酶抑制活性。在玻璃试管中加入300 μL样液和300 μL淀粉酶溶液(0.1 U/mL),37 ℃下水浴15 min后,加入300 μL可溶性淀粉(体积分数为1%),37 ℃下反应30 min后,加入500 μL DNS在沸水浴中继续反应10 min,冰浴冷却后加入8 600 μL蒸馏水,漩涡混匀。以阿卡波糖作为阳性对照组,重复以上试验操作,取200 μL反应液置于96孔板,检测其在540 nm处的吸光值,并根据式(1)计算α-淀粉酶抑制率。
3)DPP-Ⅳ抑制率。参考Lourdes等[16]的方法,采用Gly-Pro法测定牡蛎肽的DPP-Ⅳ抑制活性。在96孔板微孔中,分别加入25 μL样品溶液和25 μL底物(甘氨酸对硝基苯胺溶液),混匀后于37 ℃下孵育10 min后,加入50 μL 0.01 U/mL的DPP-Ⅳ,体系于37 ℃下反应60 min后,加入100 μL 1 mol/L的醋酸钠缓冲液(pH 4)终止反应。以西格列汀作为阳性对照组,重复以上试验操作。采用酶标仪在405 nm处测定其吸光值,并计算DPP-Ⅳ抑制率,即
(2)
式中:A1和A2分别为对照组和样品组的吸光值。
1.2.6 牡蛎肽-花色苷复合物的体外模拟胃肠消化特性分析 参照Guo等[17]的方法并稍作调整。称取1.0 g牡蛎肽放入100 mL烧杯中,并加入0.2 g NaCl和50 mL去离子水,用浓度为1.0 mol/L的HCl溶液调节pH至2.0,加入0.05 g胃蛋白酶后于37 ℃水浴反应2 h,消化结束后用100 ℃沸水灭酶,冷却至室温后补水至100 mL。移取50 mL胃消化液用水定容至100 mL,牡蛎肽在反应体系的质量浓度为5 mg/mL,将稀释后的胃消化液于4 ℃下以8 000 r/min离心15 min,取上清液进行α-葡萄糖苷酶、α-淀粉酶和DPP-Ⅳ抑制活性测定。
按上述方法进行胃肠消化试验,在上述剩余的50 mL胃消化液中继续加入2 mL胰蛋白酶溶液,改用1.0 mol/L NaOH溶液调节pH至7.0,其他操作不变,测定胃肠消化液对3种酶的抑制活性。
重复上述试验步骤,测定经胃消化及胃肠消化后牡蛎肽-花色苷复合物的体外降糖活性,考察牡蛎肽-花色苷复合物的消化稳定性。
1.2.7 牡蛎肽-花色苷复合物的降糖活性增效作用试验 参考Aleksandr等[18]的方法,设计牡蛎肽与花色苷的样品剂量协同矩阵,根据矩阵对应的不同样品组合浓度进行α-葡萄糖苷酶、α-淀粉酶和DPP-Ⅳ抑制活性测定,利用多药物联用效应计算软件SynergyFinder(https://synergyfinder.org/)对所得的试验数据进行分析。该软件中的HSA模型在评价协同效果试验中运用广泛,采用HSA模型计算得到Synergy score(δ),当 δ=0、δ>0和δ<0时,分别对应于样品组合间的零交互、协同和拮抗作用[19]。
1.3 数据处理
试验数据均采用平均值±标准差(mean±S.D.)表示,每组试验均设置3个平行。采用SPSS 22.0软件对试验数据进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 牡蛎肽的相对分子质量分布
由中性复合蛋白酶酶解得到的牡蛎肽经色谱柱洗脱后,出现4个明显的吸收峰。结合峰面积归一化法分析显示,牡蛎肽主要是由相对分子质量为1 000以下的小分子多肽组成,占比高达84.01%,其中,相对分子质量为180~500的短肽占比达46.70%(图1),说明制备的牡蛎肽为低聚肽,且主要是二肽到五肽之间的小分子肽。
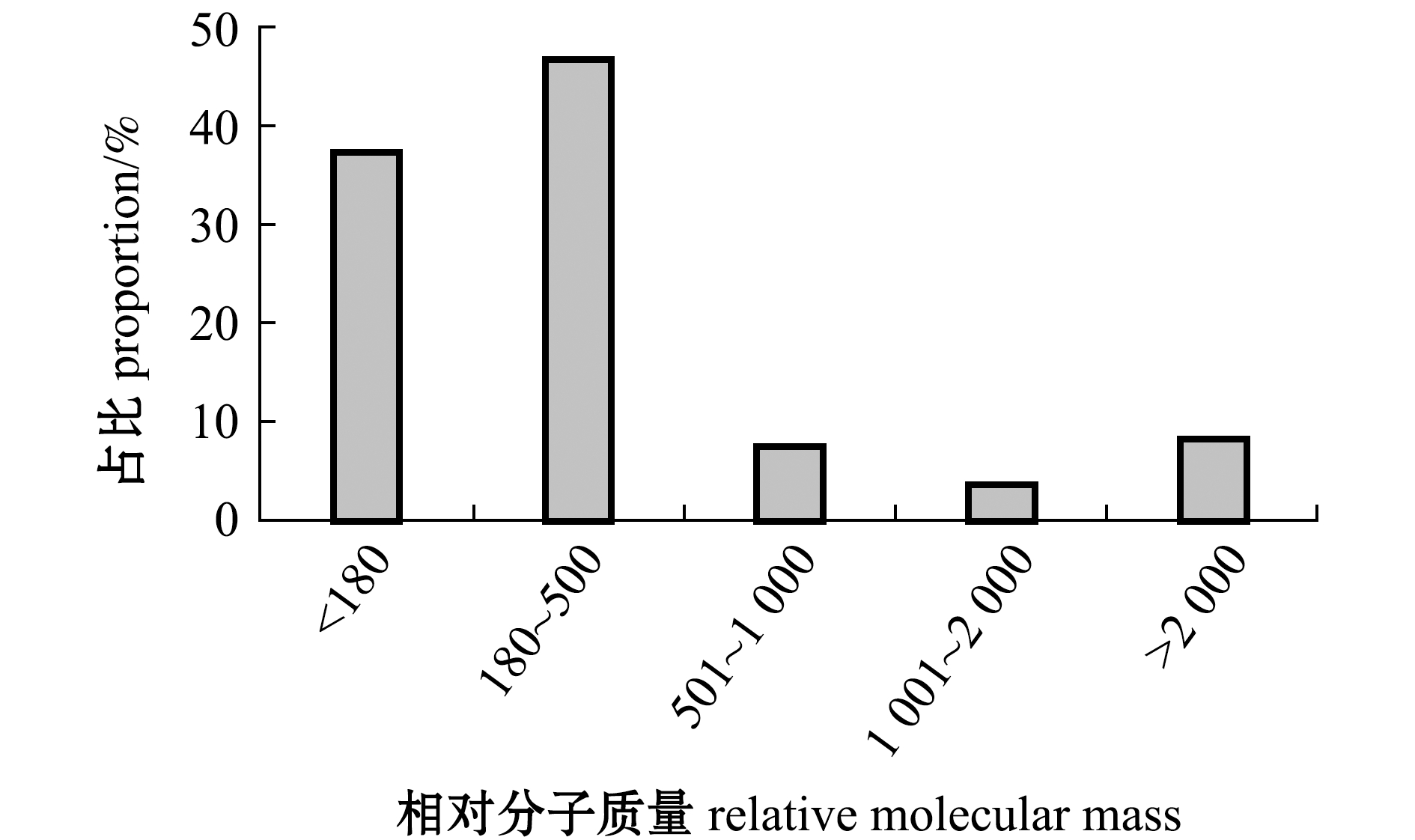
图1 牡蛎肽的相对分子质量分布
Fig.1 Relative molecular mass distribution of oyster peptides
2.2 牡蛎肽的氨基酸组成
从表1可见:牡蛎肽游离氨基酸主要由谷氨酸、丙氨酸、亮氨酸、赖氨酸和精氨酸等组成,占游离氨基酸总量的44.39%,且牡蛎肽富含必需氨基酸(占氨基酸总量的45.82%)和疏水性氨基酸(占比44.53%);牡蛎肽疏水性氨基酸中脯氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸和苯丙氨酸占比较高,占游离氨基酸总量的41.49%,其中,支链氨基酸(异亮氨酸、亮氨酸和缬氨酸)含量较高(占游离氨基酸总量的21.29%),表明牡蛎肽的疏水性氨基酸和支链氨基酸含量丰富。
表1 牡蛎肽的氨基酸组成
Tab.1 Amino acid components of oyster peptides g/100 g peptide
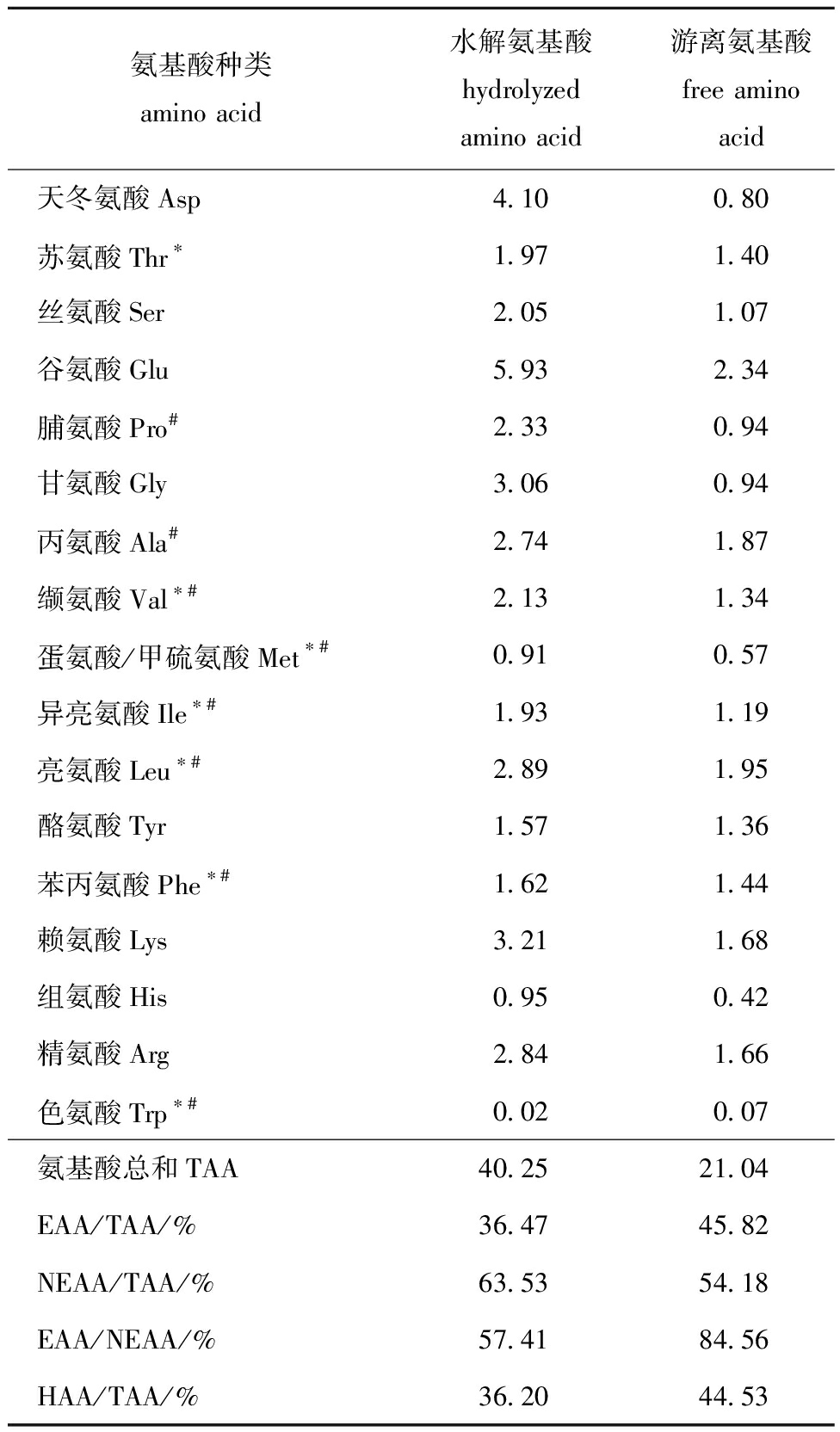
氨基酸种类amino acid水解氨基酸hydrolyzed amino acid游离氨基酸free amino acid天冬氨酸Asp4.100.80苏氨酸Thr∗1.971.40丝氨酸Ser2.051.07谷氨酸Glu5.932.34脯氨酸Pro#2.330.94甘氨酸Gly3.060.94丙氨酸Ala#2.741.87缬氨酸Val∗#2.131.34蛋氨酸/甲硫氨酸Met∗#0.910.57异亮氨酸Ile∗#1.931.19亮氨酸Leu∗#2.891.95酪氨酸Tyr1.571.36苯丙氨酸Phe∗#1.621.44赖氨酸Lys3.211.68组氨酸His0.950.42精氨酸Arg2.841.66色氨酸Trp∗#0.020.07氨基酸总和TAA40.2521.04EAA/TAA/%36.4745.82NEAA/TAA/%63.5354.18EAA/NEAA/%57.4184.56HAA/TAA/%36.2044.53
注:EAA—必需氨基酸;NEAA—非必需氨基酸;HAA—疏水性氨基酸;*为必需氨基酸;#为疏水性氨基酸。
Note:EAA—essential amino acids;NEAA—non-essential amino acids;HAA—hydrophobic amino acids;*—essential amino acids;#—hydrophobic amino acids.
2.3 牡蛎肽的肽谱序列
从表2可见,经肽谱序列鉴定分析制备的牡蛎肽含有LYF、TLFLK、IRAGYD、TLHHRVH、ARNEANVNIY、CVIGR等15条肽段序列。相对分子质量集中在400~1 500,且肽段序列中均含有丰富的疏水性氨基酸,这与牡蛎肽的相对分子质量分布及氨基酸组成分析结果相符。
表2 牡蛎肽中鉴定的肽谱及序列信息
Tab.2 Peptide sequence information in oyster peptides
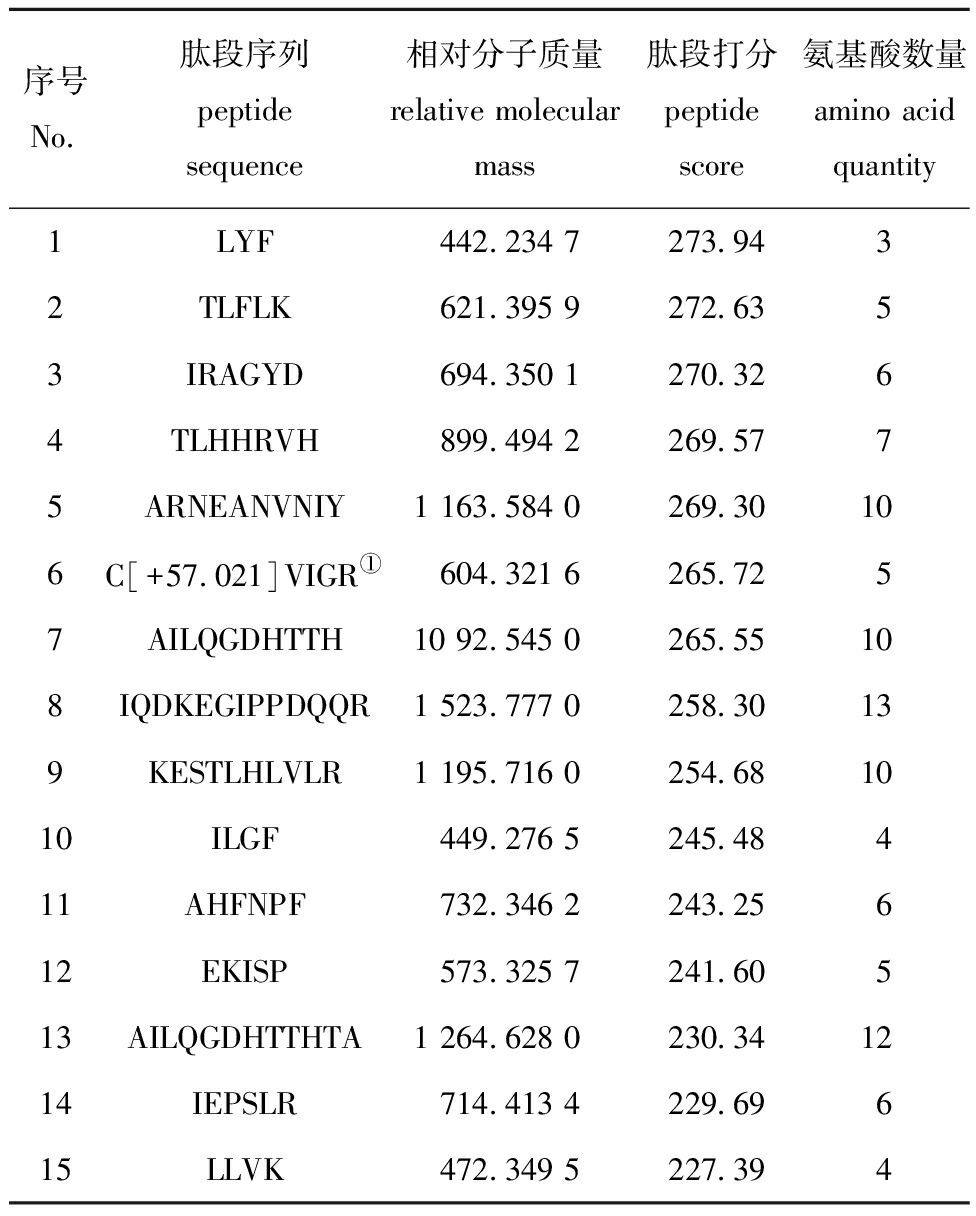
序号No.肽段序列peptide sequence相对分子质量relative molecular mass肽段打分peptide score氨基酸数量amino acid quantity1LYF442.234 7273.9432TLFLK621.395 9272.6353IRAGYD694.350 1270.3264TLHHRVH899.494 2269.5775ARNEANVNIY1 163.584 0269.30106C[+57.021]VIGR①604.321 6265.7257AILQGDHTTH10 92.545 0265.55108IQDKEGIPPDQQR1 523.777 0258.30139KESTLHLVLR1 195.716 0254.681010ILGF449.276 5245.48411AHFNPF732.346 2243.25612EKISP573.325 7241.60513AILQGDHTTHTA1 264.628 0230.341214IEPSLR714.413 4229.69615LLVK472.349 5227.394
注:①C[+57.021]表示Carbamidomethylation(C)烷基化修饰,发生在半胱氨酸上,相对分子质量变化为+57.021。
Note:①C[+57.021],Carbamidomethylation(C)alkylation modification occurred on cysteine and the relative molecular weight changed to +57.021.
2.4 牡蛎肽的体外降糖活性
经计算,牡蛎肽对DPP-Ⅳ、α-葡萄糖苷酶及α-淀粉酶的半抑制浓度(IC50)分别为(2.60±0.46)、(8.62±0.66)、(3.66±0.47)mg/mL,尤其对DPP-Ⅳ抑制效果更好,表明牡蛎肽是良好的DPP-Ⅳ抑制剂,具有显著的降糖活性。
2.5 牡蛎肽及牡蛎肽-花色苷复合物的体外胃肠模拟消化特性
从图2(a)可见:经过胃肠模拟消化后,牡蛎肽的降糖活性均显著降低;与消化前相比,经过胃消化后,牡蛎肽对DPP-Ⅳ酶、α-葡萄糖苷酶和α-淀粉酶的抑制率分别降低了25.09%、6.23%、15.16%,再经过胃肠消化后,牡蛎肽对3种酶的抑制率分别降低了32.48%、11.57%、24.70%。说明经过胃肠消化后,牡蛎肽的降糖活性大幅度降低。
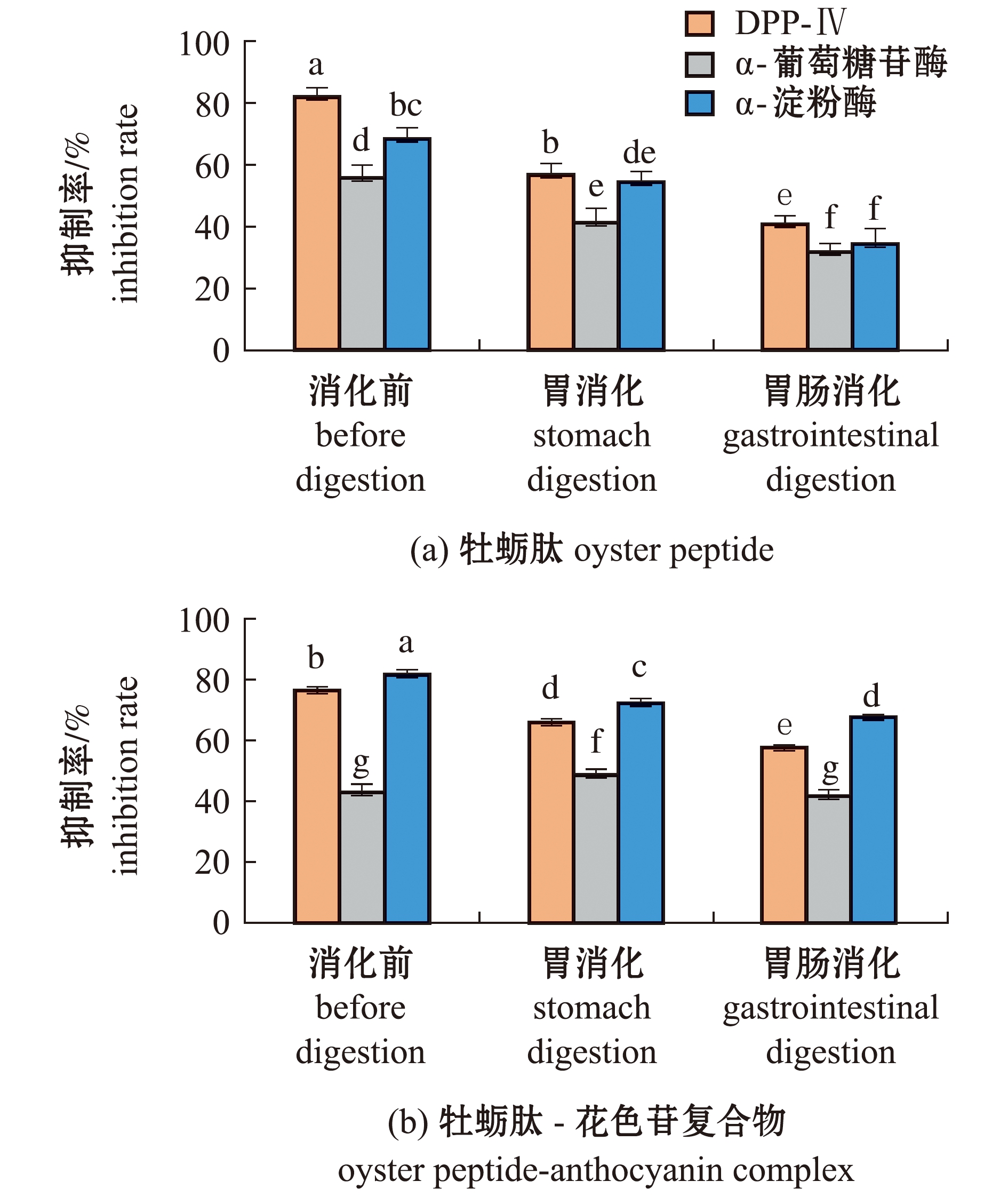
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences.
图2 牡蛎肽和牡蛎肽-花色苷复合物胃肠消化前后的酶抑制率
Fig.2 Inhibition rate of oyster peptides and oyster peptide-anthocyanin complexagainst DPP-Ⅳ,α-glucosidase and α-amylase before and after gastrointestinal digestion
从图2(b)可见:与消化前相比,经胃消化后,牡蛎肽-花色苷复合物对α-葡萄糖苷酶的抑制率升高了5.74%(P<0.05),经过胃肠消化后,对α-葡萄糖苷酶的抑制率无显著性变化(P>0.05);经胃消化和胃肠消化阶段后,牡蛎肽-花色苷复合物对DPP-Ⅳ酶抑制率和α-淀粉酶抑制率均显著降低(P<0.05),相比于单独使用牡蛎肽进行的胃肠消化试验结果(图2(a)),组合花色苷后的牡蛎肽对DPP-Ⅳ酶、α-淀粉酶的抑制率分别提升了16.83%和33.32%,且消化过程中抑制率的波动范围变小。说明牡蛎肽协同花色苷后,降糖活性得到了提高。
2.6 牡蛎肽-花色苷复合物的降糖活性增效作用
从图3可见:在α-淀粉酶抑制试验中,牡蛎肽与花色苷组合的HSA模型得分(δ)为3.632,表明具有协同作用(δ>0);当牡蛎肽质量浓度低于0.92 mg/mL,花色苷质量浓度高于2.7 mg/mL时,两种物质间的协同作用不明显,说明低浓度的牡蛎肽和高浓度的花色苷组合对α-淀粉酶抑制效果较弱;当牡蛎肽和花色苷质量浓度分别为1.83~7.32、0.34~1.35 mg/mL时,存在δ得分较高区域,此时牡蛎肽与花色苷间的协同作用较强。
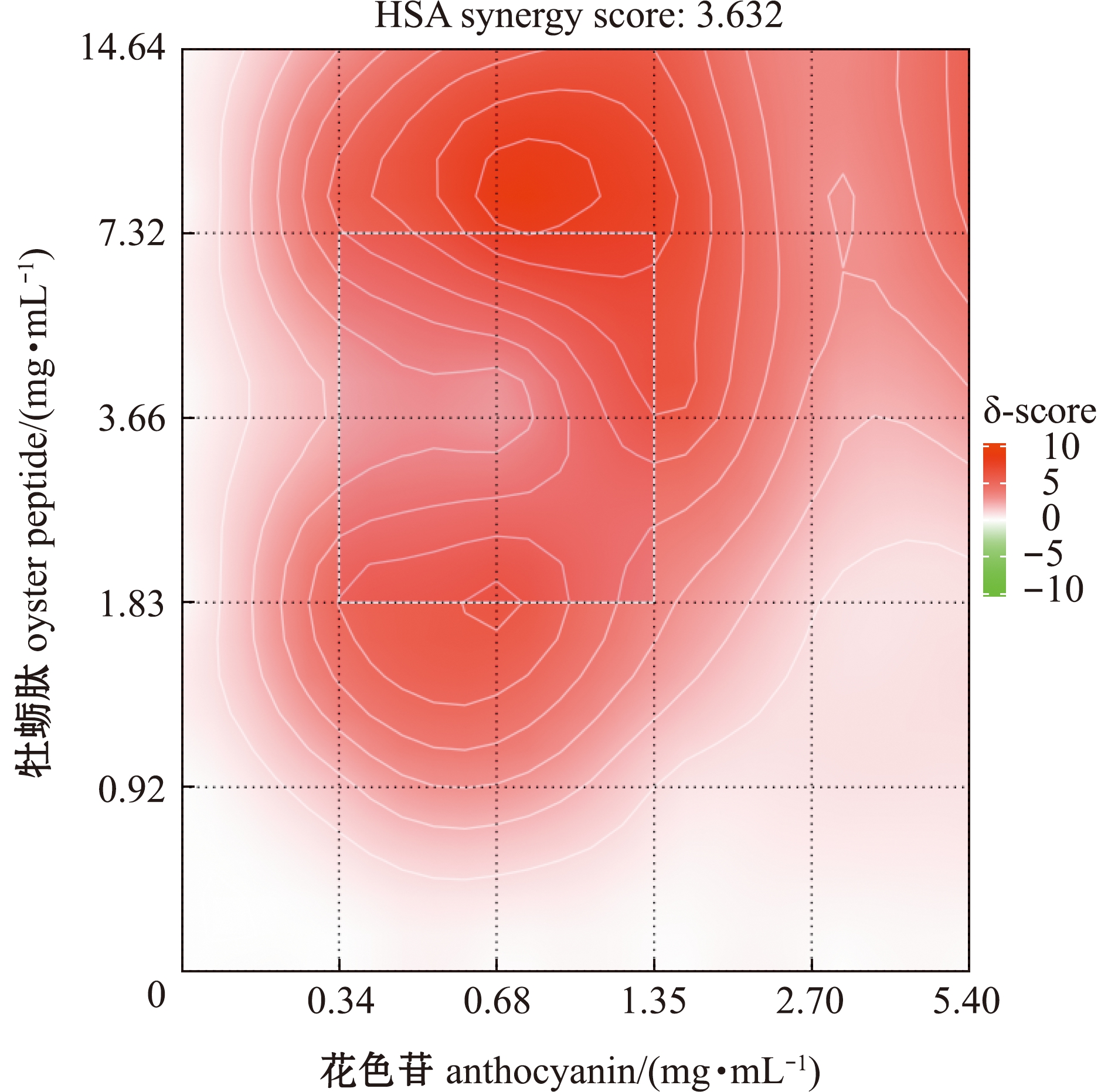
图3 牡蛎肽和花色苷对α-淀粉酶的协同抑制作用
Fig.3 Synergistic inhibition of oyster peptides and anthocyanins against α-amylase
从图4可见:在α-葡萄糖苷酶抑制试验中,牡蛎肽与花色苷组合的HSA模型得分(δ)为3.503,表明两种物质间存在协同作用(δ>0);当牡蛎肽和花色苷的质量浓度分别低于2.13、1.63 mg/mL时,两种物质的δ得分均较低,说明低浓度牡蛎肽和花色苷组合对α-葡萄糖苷酶的协同抑制作用不明显;当牡蛎肽和花色苷的质量浓度分别为4.25~17.00、3.25~13.00 mg/mL时,存在δ得分较高区域,且高分区域较为集中,此时二者的协同作用较强。
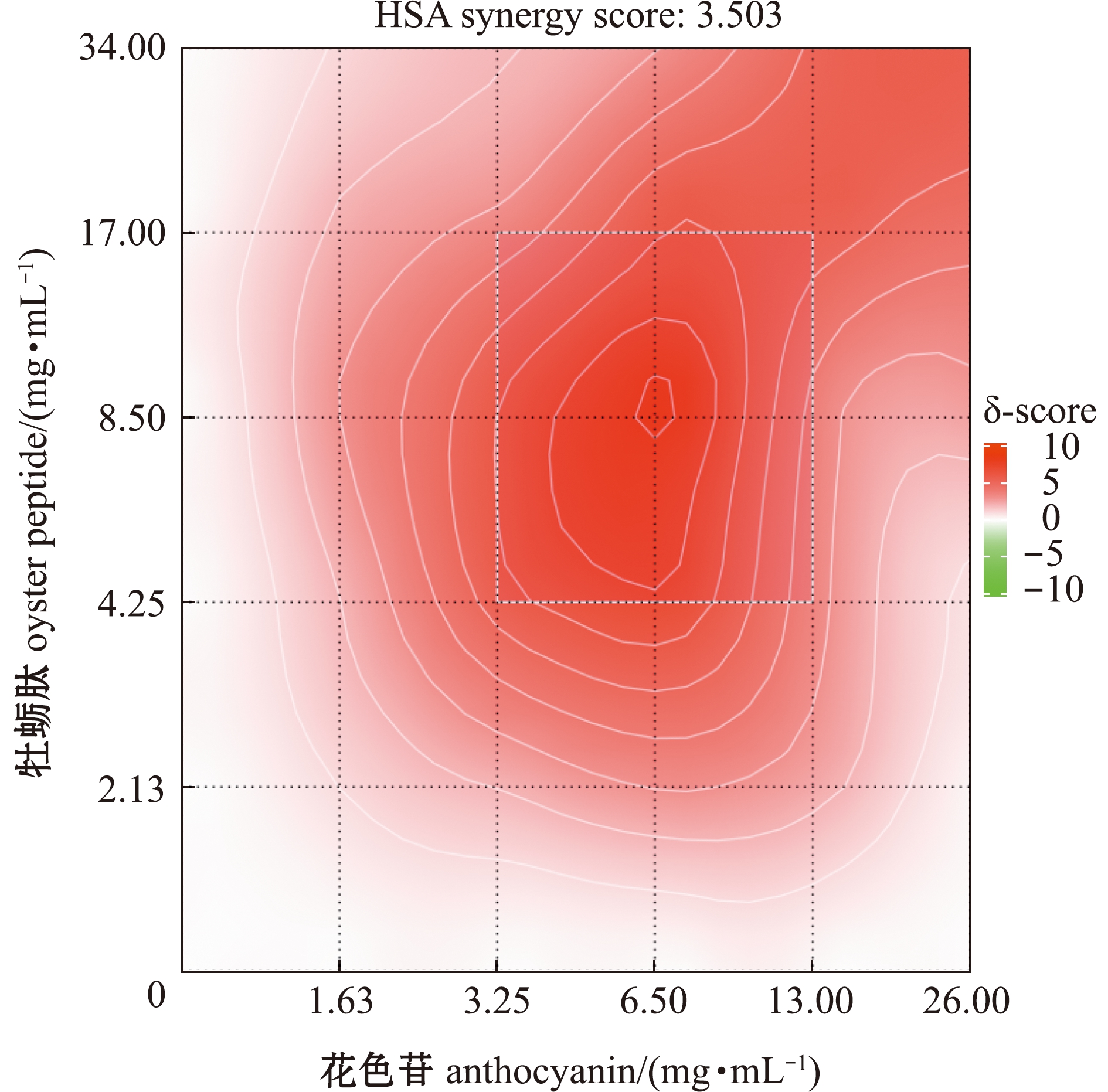
图4 牡蛎肽和花色苷对α-葡萄糖苷酶的协同抑制作用
Fig.4 Synergistic inhibition of oyster peptides and anthocyanins against α-glucosidase
从图5可见:在DPP-Ⅳ酶抑制试验中,牡蛎肽与花色苷组合的HSA模型得分(δ)为3.156,表明两种物质间存在协同作用(δ>0);当牡蛎肽和花色苷的质量浓度分别低于0.65、3.24 mg/mL时,两种物质的δ得分均较低,说明低浓度花色苷和牡蛎肽组合对DPP-Ⅳ酶协同抑制作用不明显;当牡蛎肽和花色苷的质量浓度分别为1.30~5.20、3.24~12.96 mg/mL时,存在δ得分较高区域,此时协同作用最强。
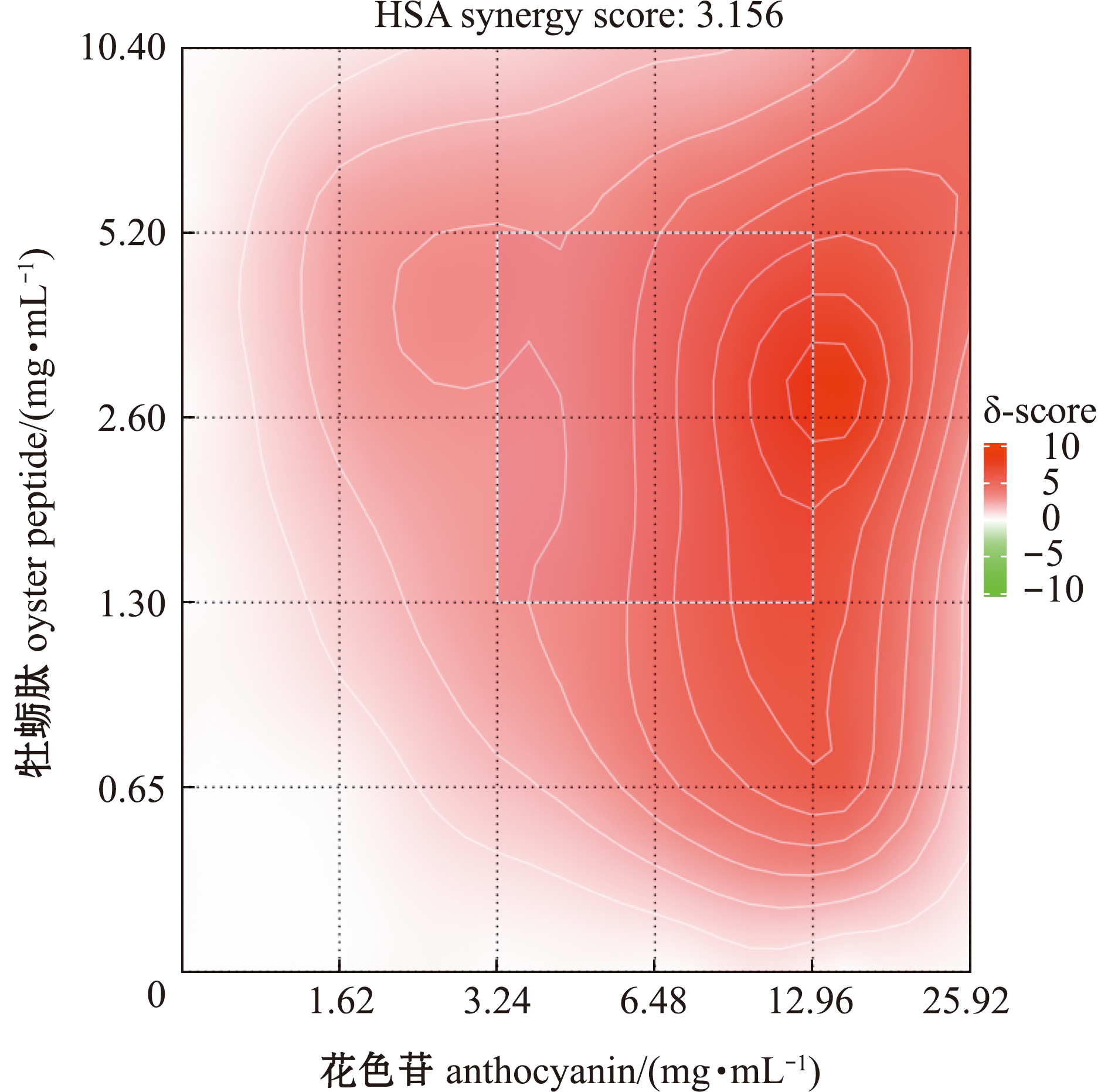
图5 牡蛎肽和花色苷对DPP-Ⅳ的协同抑制作用
Fig.5 Synergistic inhibition of oyster peptides and anthocyanins against DPP-Ⅳ
3 讨论
3.1 牡蛎降糖肽的特征结构表征
天然降糖肽经过胃肠消化后的活性变化趋势是判断其进入人体内活性作用强度的重要依据,消化稳定性强的天然活性肽更具有替代治疗药物的潜力[20]。二肽到五肽等短肽渗透压低,其在人体胃肠道中具有较高的移动速率,有利于提高短肽的利用率及发挥降糖活性[6]。本试验中制备的牡蛎肽含LYF、TLFLK、ILGF、EKISP、LLVK、CVIGR 6条此类短肽,占牡蛎肽段总数40%,因此,牡蛎肽具有潜在的降糖活性,即为牡蛎降糖肽。从本试验结果可知,牡蛎肽中含有丰富的疏水性氨基酸和支链氨基酸。众多研究表明,肽的生物活性与其化学结构密切相关,如肽链段长度、氨基酸组成与序列及疏水性氨基酸比例等,而降糖活性肽通常含有较高比例的疏水性氨基酸及支链氨基酸,多肽中的脯氨酸残基是DPP-Ⅳ酶抑制肽的重要组成成分[21]。Zong等[22]发现,由疏水性氨基酸组成的β-酪啡肽7可以抑制小肠对葡萄糖的吸收,具有良好的降糖活性。因此,本研究中制备的牡蛎肽具有降糖活性肽典型的氨基酸组成结构特征。
有研究报道,结构序列中富含支链氨基酸BCAAs(含Leu、Ile和Val)或BCAAs位于序列中特定位置的活性肽是有效的DPP-Ⅳ抑制剂,如肽链N端为BCAAs,处于N端的第1、2位或1~2位均有的肽,其DPP-Ⅳ抑制活性更为显著[23-24]。本研究中,11条肽符合此特征(LYF、TLFLK、IRAGYD、TLHHRVH、C[+57.021]VIGR、AILQGDHTTH、KESTLHLVLR、ILGF、AILQGDHTTHTA、IEPSLR和LLVK)。此外,芳香族氨基酸AAAs(含Phe、Trp和Tyr)和脯氨酸(Pro)对肽的降糖活性也具有重要贡献,如牡蛎肽结构中含有AAAs或Pro位于肽链N端第1~4位时,这种肽对DPP-Ⅳ的抑制肽活性更佳[25-26]。Xie等[27]研究报道,中性复合蛋白酶作用于C-末端和N-末端的疏水性氨基酸,酶切范围广,水解后疏水性基团暴露,与本研究中制备的牡蛎肽序列中含有较多的亮氨酸和异亮氨酸结果相符。综上,牡蛎肽具有降糖活性肽的特征结构。
3.2 体外模拟胃肠消化对牡蛎肽降糖活性的影响
DPP-Ⅳ抑制剂可以减缓GLP-1过快降解,达到促进胰岛素分泌、降低血糖的目的;α-葡萄糖苷酶及α-淀粉酶抑制剂可以抑制糖原和淀粉在小肠内水解成葡萄糖,可阻止餐后血糖水平快速升高[16]。抑制DPP-Ⅳ发挥降糖作用的天然活性肽原料多以海洋生物源为主,Jin等[28]研究发现,大西洋鲑皮蛋白酶解物(<3 kU)具有显著的DPP-Ⅳ抑制活性。而抑制α-葡萄糖苷酶及α-淀粉酶发挥降糖作用的天然活性肽原料多以植物源为主。李艳敏等[29]研究发现,裙带菜酶解物对α-葡萄糖苷酶的IC50值为46.08 mg/mL。袁娟等[30]研究发现,白豆提取物对α-淀粉酶的IC50值为4.20 mg/mL。本研究中,牡蛎肽对DPP-Ⅳ、α-葡萄糖苷酶和α-淀粉酶的IC50值均小于10 mg/mL,因此,牡蛎肽对以上3种酶均具有良好的抑制作用,在作为天然降糖活性物质上具有良好的应用潜力,且作为低分子量的天然活性肽,牡蛎肽具备吸收快、活性强的特点,符合未来食品行业天然降糖制剂的发展趋势。
本研究中,通过测定胃肠消化前后牡蛎肽对DPP-Ⅳ、α-葡萄糖苷酶和α-淀粉酶的抑制率,以评价降糖活性变化。结果表明,经过胃肠模拟消化后牡蛎肽对3种酶的抑制率降低幅度较大(最高达32.48%),可能是由于胃液中的强酸性条件、胃肠间的pH急剧变化,以及胃肠液中的消化酶破坏了牡蛎降糖肽的结构,即牡蛎降糖肽的消化稳定性较差,但消化后其仍具有一定的降糖活性,因此,有必要采取一定手段提升牡蛎肽的消化稳定性,保留其降糖活性。
3.3 协同花色苷对牡蛎肽降糖活性的影响
牡蛎肽的消化稳定性较差,经过胃肠消化后的降糖活性损失较大,因此,考虑通过牡蛎肽协同花色苷来提高牡蛎肽的消化稳定性,提高其降糖活性。本研究中,牡蛎肽-花色苷复合物在体外胃肠模拟消化过程中,对DPP-Ⅳ、α-葡萄糖苷酶和α-淀粉酶的抑制率变化范围较小,与牡蛎肽相比,模拟消化后对DPP-Ⅳ酶、α-淀粉酶的抑制率有显著提高,这可能是复合物间形成了较稳定的体系,可对抗复杂的模拟消化环境,保护了具有降糖活性的物质。而对α-葡萄糖苷酶的抑制率呈先上升后降低的趋势,这可能是花色苷在酸性环境的胃消化阶段较稳定,发挥了最大的活性作用,在回到中性环境的肠消化阶段后,对α-葡萄糖苷酶的抑制作用又回到消化前水平。因此,牡蛎肽协同花色苷后可提高消化稳定性和降糖活性。
为进一步研究牡蛎肽-花色苷复合物的降糖活性增效作用,采用协同作用研究软件Synergyfinder中的HSA模型算法,评价牡蛎肽与花色苷对α-淀粉酶、α-葡萄糖酶及DPP-Ⅳ的协同抑制作用。结果表明,牡蛎肽-花色苷复合物对α-淀粉酶、α-葡萄糖酶及DPP-Ⅳ抑制试验的HSA模型得分(δ)均大于0,说明牡蛎肽与花色苷对这3种酶具有协同抑制作用。这可能是复合物中花色苷的羟基与牡蛎肽的氨基酸残基发生了相互作用,对二者的降糖活性结构产生了保护作用,提高了复合物对这3种酶的抑制率,使复合物具有协同降糖作用。
4 结论
1)制备的牡蛎肽相对分子质量主要集中在1 000以下,其必需氨基酸和疏水性氨基酸含量丰富。肽谱序列鉴定发现,牡蛎降糖肽富含支链氨基酸和脯氨酸,且位于肽链N端1~4位的特定位置,说明牡蛎肽具备典型的降糖肽特征结构。
2)牡蛎肽对α-葡萄糖苷酶、α-淀粉酶和DPP-Ⅳ具有显著的抑制效果,是良好的降糖肽。
3)牡蛎肽经过体外模拟胃肠消化后,其降糖活性显著降低,说明牡蛎肽消化稳定性差。通过组合花色苷设计协同矩阵试验(以HSA为计算模型)发现,牡蛎肽-花色苷对上述3种酶具有一定的协同抑制效果,并用复合物再次进行体外模拟胃肠消化试验,确定了花色苷具有协同提高牡蛎肽消化稳定性的作用。本研究结果为进一步开展牡蛎降糖肽的稳态化及活性增效研究提供科学依据。
[1] 董宇婷,王荣春.降糖肽的发展现状及研究进展[J].生物信息学,2018,16(2):83-89.
DONG Y T,WANG R C.The status quo and research progress of hypoglycemic peptide[J].Chinese Journal of Bioinformatics,2018,16(2):83-89.(in Chinese)
[2] 尤莉莉,赵金红,陈新月,等.国家基本公共卫生服务项目十年评价(2009—2019年)系列报告(二):国家基本公共卫生服务项目实施十年的进展与成效[J].中国全科医学,2022(26):3209-3220.
YOU L L,ZHAO J H,CHEN X Y,et al.National essential public health services programs over the past decade research report two:progress and achievements of the implementation of national essential public health services programs over the past decade[J].Chinese General Practice,2022(26):3209-3220.(in Chinese)
[3] ADEFEGHA S A,MOLEHIN O R.Inhibitory activities of brimstone (Morinda lucida) Roots extract on α-amylase and α-glucosidase-In vitro[J].Vegetos:An International Journal of Plant Research,2017,30(4):105.
[4] 蔡水淋,陈晓婷,刘淑集,等.牡蛎肉的综合开发研究进展[J].渔业研究,2020,42(5):527-532.
CAI S L,CHEN X T,LIU S J,et al.Research progress in the comprehensive development of oysters meat[J].Journal of Fisheries Research,2020,42(5):527-532.(in Chinese)
[5] 蔡亚伟,王海燕,孟辰,等.牡蛎肉提取物对小鼠抗疲劳和耐缺氧能力的影响[J].山东中医药大学学报,2019,43(5):503-507.
CAI Y W,WANG H Y,MENG C,et al.Effects of oyster meat extract on anti-fatigue ability and hypoxia tolerance in mice[J].Journal of Shandong University of Traditional Chinese Medicine,2019,43(5):503-507.(in Chinese)
[6] 张可佳,张胜男,祁艳霞,等.牡蛎ACE抑制肽对原发性高血压大鼠的降压效果及其性质研究[J].大连海洋大学学报,2018,33(6):788-794.
ZHANG K J,ZHANG S N,QI Y X,et al.Properties and antihypertensive effect of ACE inhibitory peptides from oyster on spontaneously hypertensive rats[J].Journal of Dalian Ocean University,2018,33(6):788-794.(in Chinese)
[7] XIA E Q,ZHU S S,HE M J,et al.Marine peptides as potential agents for the management of type 2 diabetes mellitus-A prospect[J].Marine Drugs,2017,15(4):88-103.
[8] HAO L L,WANG X C,CAO Y R,et al.A comprehensive review of oyster peptides:preparation,characterisation and bioactivities[J].Reviews in Aquaculture,2022,14(1):120-138.
[9] BECHAUX J,GATELLIER P,LE PAGE J F,et al.A comprehensive review of bioactive peptides obtained from animal byproducts and their applications[J].Food &Function,2019,10(10):6244-6266.
[10] MOJICA L,BERHOW M,DE MEJIA E G.Black bean anthocyanin-rich extracts as food colorants:physicochemical stability and antidiabetes potential[J].Food Chemistry,2017,229:628-639.
[11] CHEN Z,WANG C,PAN Y,et al.Hypoglycemic and hypolipidemic effects of anthocyanins extract from black soybean seed coat in high fat diet and streptozotocin-induced diabetic mice[J].Food Funct,2018,9(1):426-439.
[12] 柏昌旺,章超桦,林海生,等.响应面法优化制备牡蛎短肽工艺[J].广东海洋大学学报,2019,39(6):85-92.
BAI C W,ZHANG C H,LIN H S,et al.Optimization of preparation process of oyster oligopeptides by response surface methodology[J].Journal of Guangdong Ocean University,2019,39(6):85-92.(in Chinese)
[13] LI W,XU C,ZHANG C,et al.The purification and identification of immunoregulatory peptides from oyster (Crassostrea hongkongensis) enzymatic hydrolysate[J].RSC Advances,2019,9(56):32854-32863.
[14] XU L L,HU P P,KONG X L,et al.3-hydroxypyridinone-l-phenylalanine conjugates with antimicrobial and tyrosinase inhibitory activities as potential shrimp preservatives[J].International Journal of Food Science &Technology,2014,49(3):797-803.
[15] DE MATOS F M,GOMES D L J T J,GIOVANNA Z,et al.Production of black cricket protein hydrolysates with α-amylase,α-glucosidase and angiotensin I-converting enzyme inhibitory activities using a mixture of proteases[J].Biocatalysis and Agricultural Biotechnology,2022,39:102276.
[16] LOURDES R F, CAROLINE R, CHEN L.Sequential alcalase and flavourzyme treatment for preparation of α-amylase,α-glucosidase,and dipeptidyl peptidase (DPP)-Ⅳ inhibitory peptides from oat protein[J].Journal of Functional Foods,2021,87:104829.
[17] GUO Y X, CHEN X F, GONG P, et al.Effects of simulated saliva-gastrointestinal digestion on the physicochemical properties and bioactivities of Siraitia grosvenorii polysaccharides[J].International Journal of Food Science &Technology,2022, 57(7):4495-4506.
[18] ALEKSANDR I,LIYE H,TERO A,et al.SynergyFinder:a web application for analyzing drug combination dose-response matrix data[J].Bioinformatics,2017,33(15):2413-2415.
[19] DUARTE D,FALC O S I,EL MEHDI I,et al.Honeybee venom synergistically enhances the cytotoxic effect of CNS drugs in HT-29 colon and MCF-7 breast cancer cell lines[J].Pharmaceutics,2022,14(3):511.
O S I,EL MEHDI I,et al.Honeybee venom synergistically enhances the cytotoxic effect of CNS drugs in HT-29 colon and MCF-7 breast cancer cell lines[J].Pharmaceutics,2022,14(3):511.
[20] GALLEGO M,GROOTAERT C,MORA L,et al.Transepithelial transport of dry-cured ham peptides with ACE inhibitory activity through a Caco-2 cell monolayer[J].Journal of Functional Foods,2016,21:388-395.
[21] YE X Y,XIONG L,FU Q Fet al.Chemical characterization and DPP-Ⅳ inhibitory activity evaluation of tripeptides from Gynura divaricata (L.) DC[J].Journal of Ethnopharmacology,2022,292:115203.
[22] ZONG Y F,CHEN W H,ZHANG Y S,et al.Effects of intra-gastric beta-casomorphin-7 on somatostatin and gastrin gene expression in rat gastric mucosa[J].World Journal of Gastroenterology,2007,13(14):2094-2099.
[23] NONGONIERMA A B,PAOLELLA S MUDGIL P,et al.Identification of novel dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory peptides in camel milk protein hydrolysates[J].Food Chemistry,2018,244:340-348.
[24] WANG Y C,SONG X, FENG Y,et al.Changes in peptidomes and Fischer ratios of corn-derived oligopeptides depending on enzyme hydrolysis approaches[J].Food Chemistry,2019,297:124931.
[25] GONZ LEZ-MONTOYA M,HERN
LEZ-MONTOYA M,HERN NDEZ-LEDESMA B,MORA-ESCOBEDO R,et al.Bioactive peptides from germinated soybean with anti-diabetic potential by inhibition of dipeptidyl peptidase-Ⅳ,α-amylase,and α-glucosidase enzymes[J].International Journal of Molecular Sciences,2018,19(10):E2883.
NDEZ-LEDESMA B,MORA-ESCOBEDO R,et al.Bioactive peptides from germinated soybean with anti-diabetic potential by inhibition of dipeptidyl peptidase-Ⅳ,α-amylase,and α-glucosidase enzymes[J].International Journal of Molecular Sciences,2018,19(10):E2883.
[26] 赵嘉妮,陈宏,翁凌,等.食源性DPP-Ⅳ抑制肽降血糖作用机制研究进展[J].食品工业科技,2021,42(23):447-454.
ZHAO J N,CHEN H,WENG L,et al.Research progress on the mechanism of food-derived DPP-Ⅳ inhibitory peptides for hypoglycemic effect[J].Science and Technology of Food Industry,2021,42(23):447-454.(in Chinese)
[27] XIE Y Z,LIU C H,CHENG L X,et al.Single molecular insight into steric effect on C-terminal amino acids with various hydrogen bonding sites[J].Chinese Chemical Letters,2022,33(10):4649-4654.
[28] JIN R T,TENG X Y,SHANG J Q, et al. Identification of novel DPP-Ⅳ inhibitory peptides from Atlantic salmon (Salmo salar) skin[J].Food Research International,2020,133:109-161.
[29] 李艳敏,郁书怀,仝艳军,等.裙带菜α-葡萄糖苷酶抑制活性肽的制备[J].食品工业科技,2020,41(20):127-134.
LI Y M,YU S H,TONG Y J,et al.Preparation of α-glucosidase inhibitory peptides derived from sea mustard[J].Science and Technology of Food Industry,2020,41(20):127-134.(in Chinese)
[30] 袁娟,卫娜,徐勇,等.白豆提取物对α-淀粉酶和α-葡萄糖苷酶活性研究[J].食品与发酵科技,2014,50(3):12-15.
YUAN J,WEI N,XU Y,et al.Research on α-amylase and α-glucosidase inhibitory activities of white beans natural extracts[J].Food and Fermentation Technology,2014,50(3):12-15.(in Chinese)