中华绒螯蟹(Eriocheir sinensis)具有独特的芳香味和鲜味,是中国乃至东亚地区最受欢迎的水产品之一[1]。大量研究表明,中华绒螯蟹味道鲜美主要与其肌肉中游离氨基酸和核苷酸含量较高有关[2]。大部分的游离氨基酸都具有独特的味道,如谷氨酸和天冬氨酸与鲜味的形成有关[3]。5′-肌苷酸钠、5′-鸟苷酸钠和5′-腺苷酸钠都能产生甜味[2],且机体中核苷酸和游离氨基酸还能相互影响,共同促成鲜味[3-4]。但不同来源的中华绒螯蟹风味差别较大。Wang等[5]通过顶空固相微萃取与高效液相色谱联用技术分离并比较了不同来源的中华绒螯蟹在挥发性风味物质上的差异,发现其风味存在差异的主要原因是醛类物质含量不同。Wu等[6]比较了中华绒螯蟹不同可食部位的呈味后也发现,醛类是导致其风味差异的主要因素。实际上,醛类有较强的挥发性和较低的阈值[5],无论是对哺乳动物还是水生动物,其风味的形成较大程度上取决于醛类的丰度[6]。醛类主要由多不饱和脂肪酸氧化分解产生,脂氧合酶(LOX)是一种含铁的氧化还原酶,可以使脂质中的多不饱和脂肪酸催化加氧[7]。大量研究发现,由LOX介导的脂肪酸氧化途径会影响水生动物挥发性化合物的形成[8]。除味道鲜美外,中华绒螯蟹还富含多不饱和脂肪酸[9]。通常多不饱和脂肪酸含量高、饱和脂肪酸含量低的食物具有较高的营养价值,也符合现代人的营养需求[10]。而中华绒螯蟹中多不饱和脂肪酸的含量高达30%,因此,其营养价值较高。
目前,中华绒螯蟹养殖是中国最大的商业性甲壳类水产养殖产业之一,其主要分布在中国东部地区,特别是长江和瓯江流域[11]。2020年,中国中华绒螯蟹养殖产量达775 887 t[12]。值得注意的是,在中华绒螯蟹的传统养殖中大量使用冰鱼,造成了严重的环境污染。随着中国环境污染治理工作的不断推进,阳澄湖等少部分地区已明令禁止在中华绒螯蟹养殖过程中投喂冰鱼,由此也推动了人工配合饲料的使用,然而人工配合饲料对中华绒螯蟹肌肉风味品质的影响尚未知晓。本研究中,比较了投喂冰鱼和人工配合饲料对中华绒螯蟹肌肉风味品质的影响,并探究导致其发生改变的主要因素,以期为中华绒螯蟹健康、科学养殖提供科学参考。
1 材料与方法
1.1 材料
试验用中华绒螯蟹由华海种业科技有限公司提供,初始体质量为(5.33±0.79)g。
试验试剂:氢氧化钠(优级纯,上海阿拉丁生化科技股份有限公司);高氯酸(分析纯,上海华谊集团化工有限公司);50 mmol/L磷酸盐缓冲液(pH 7.0,上海源叶生物科技有限公司);吐温(纯度≥99%,生物技术级,上海麦恪林生化科技有限公司);其他试剂均为国产分析纯。试验用水为超纯水。
试验仪器:L-8800全自动氨基酸分析仪(日本Hitachi公司产品);气相色谱仪(Agilents Technologies Inc.,Santa Clara,CA)、Agilent1100高效液相色谱仪(HPLC)和6890型质谱仪(均为美国Agilent公司产品)。
1.2 方法
1.2.1 试验设计 选取雌、雄性别比为1∶1的中华绒螯蟹,以2 只/m2的密度平均分养到8个大型试验池塘(长、宽、深分别为130、80、1.5 m)中。试验分为两组(每4个池塘为一组),一组投喂冰鱼(记为TFG),另一组投喂人工配合饲料(记为FDG),并检测两组饲料的一般营养成分和氨基酸含量(表1)。每天17:00投喂一次,投喂量为总蟹质量的0.5%~4.0%(根据残留饲料进行调整)。每天检测养殖环境,水温为(27±2)℃,pH为8.0~8.6,溶解氧为5 mg/L以上。经过8个月(3—10月)的养殖,试验蟹的平均体质量为(150.07±0.51)g。
表1 冰鱼和配合饲料的主要营养成分及部分氨基酸含量
Tab.1 Main biochemical composition and contents of partial amino acid in different feedsw/%
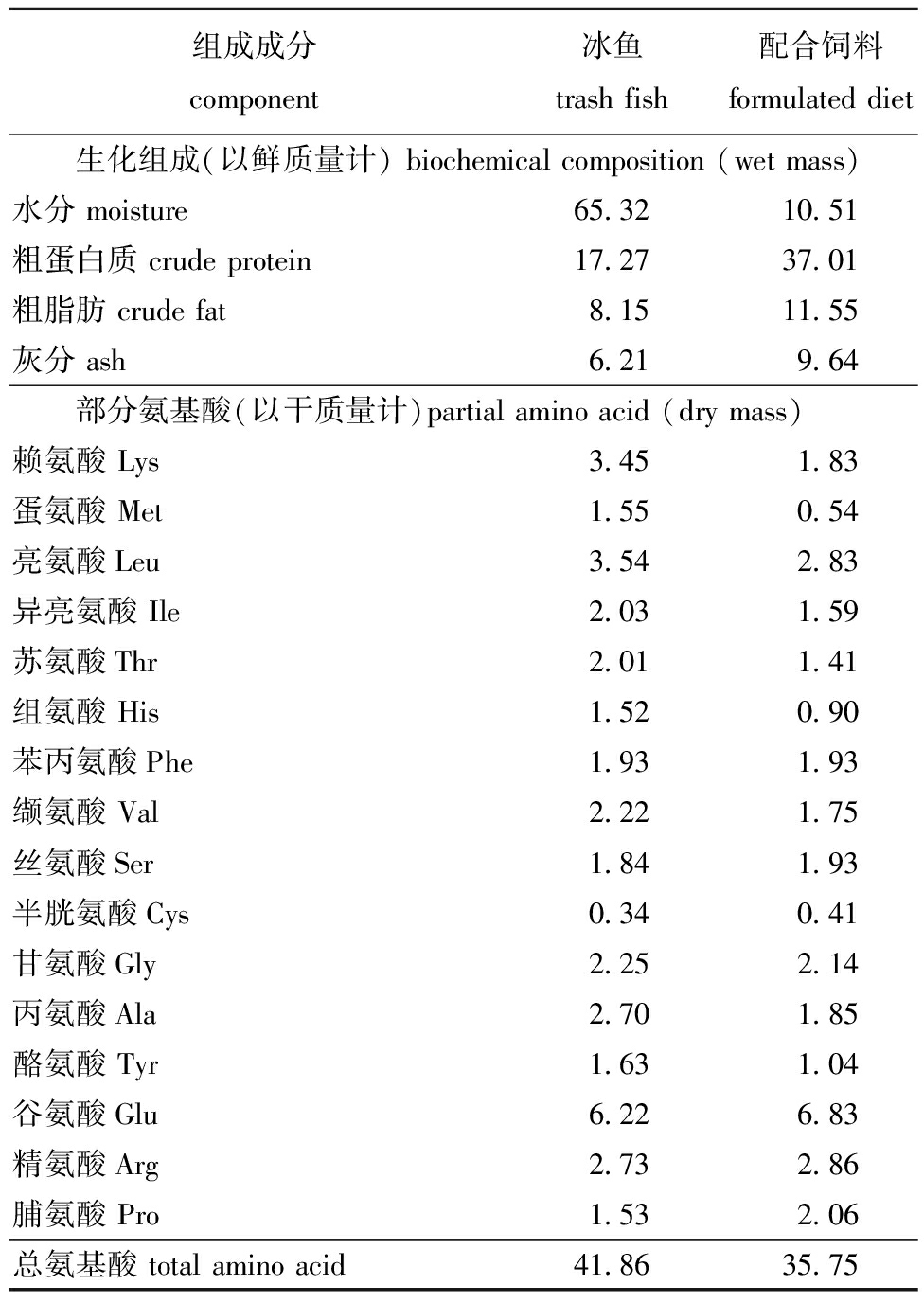
组成成分component冰鱼trash fish配合饲料formulated diet 生化组成(以鲜质量计) biochemical composition (wet mass)水分 moisture65.3210.51粗蛋白质 crude protein17.2737.01粗脂肪 crude fat8.1511.55灰分 ash6.219.64 部分氨基酸(以干质量计)partial amino acid (dry mass)赖氨酸 Lys3.451.83蛋氨酸 Met1.550.54亮氨酸Leu3.542.83异亮氨酸 Ile2.031.59苏氨酸Thr2.011.41组氨酸 His1.520.90苯丙氨酸Phe1.931.93缬氨酸 Val2.221.75丝氨酸Ser1.841.93半胱氨酸Cys0.340.41甘氨酸Gly2.252.14丙氨酸Ala2.701.85酪氨酸 Tyr1.631.04谷氨酸Glu6.226.83精氨酸Arg2.732.86脯氨酸 Pro1.532.06总氨基酸 total amino acid41.8635.75
1.2.2 样品采集 试验结束时,从每组收集100只大小相似、健康状况良好且雌、雄性别比为1∶1的中华绒螯蟹(25 只/塘),用于感官评价;从每组收集40只(10 只/塘),置于冰上麻醉10 min,待中华绒螯蟹运动状态明显减弱,在冰上解剖,用4 ℃预冷的生理盐水(质量浓度为0.89 g/L的NaCl)彻底清洗,随即置于液氮中速冻后于-80 ℃超低温冰箱中保存,以备后续分析。
1.2.3 感官评价分析 根据Kong等[13]的方法,采用配对比较试验对中华绒螯蟹进行感官评价。将洗净的中华绒螯蟹用高压锅蒸煮20 min,不添加任何调味剂和香料。由15位充分了解蟹组织结构的研究人员在3 min内将其壳与肉快速分离,避免蟹壳颜色和其他组织影响评估,以及保证食用时其温度不会影响评价员的打分。此外,还需选择30名未经训练的人员进行测评。在测评前1 h内,评价员不可进食、吸烟、饮酒或咀嚼口香糖。评价员在品蟹后,参考Wu等[14]提供的表格,按照咸味、苦味、甜味、鲜味、腥味、肉香味、脂肪味和青草味对样品进行评估,每项分0~9十个等级。
1.2.4 肌肉核苷酸和游离氨基酸(FAA)组成分析 参照Chen等[15]的方法分析核苷酸组成。取中华绒螯蟹肌肉5.0 g匀浆,用孔径为0.45 μm的过滤器过滤,取10 μL滤液注入HPLC中。通过与标准品中每种核苷酸保留时间和峰面积的比较,评估核苷酸的类型和含量。
根据Tanaka等[16]的方法分析游离氨基酸组成。取0.5 g肌肉于体积分数为5%的高氯酸溶液中匀浆,提取游离氨基酸,采用自动氨基酸分析仪分析提取液。
1.2.5 脂肪酸组成分析 参照Shantha等[17]的方法,利用三氟化硼-甲醇溶液将样品甲酯化。根据王潇等[18]和Gao等[19]的方法,采用气相色谱仪测定饲料和肌肉样品中的脂肪酸组成。
1.2.6 鲜味当量(EUC) 本研究中用味精当量(EUC)表示鲜味当量,味精当量计算公式[20]为
CEU=∑(aibi)+1 218∑(aibi)∑(ajbj)。
(1)
式中:CEU为味精(MSG)当量(g/100 g);ai为鲜味FAA(Glu、Asp)的质量分数(g/100 g);bi为鲜味FAA的相对呈鲜系数(RUC,Glu的RUC为1,Asp的RUC为0.077);aj为鲜味核苷酸(IMP、GMP、AMP)的质量分数(g/100 g);bj为鲜味核苷酸的相对呈鲜系数(5′-IMP的RUC为1,5′-GMP的RUC为2,3′-AMP和5′-AMP的RUC均为0.18);1 218为协同作用系数。
1.2.7 挥发性化合物分析 参照Gu等[21]的方法测定挥发性化合物。准确称取6.00 g肌肉样品,置于20 mL顶空瓶中,并加入2 μL的内标物2,4,6-三甲基吡啶(TMP),使其终浓度为1 000 mg/L,将顶空瓶置于45 ℃水浴预热,再将75 μm CAR/PDMS萃取头插入气相色谱仪进样口,设置萃取时间为40 min,于250 ℃进行解析。使用装配DB-5MS色谱柱的Agilent 6890型质谱仪进行测定。高纯氦气为载气,流速为 1 mL/min,通过NIST检索(NIST 2008)和保留指数(IR)鉴定挥发性化合物,并使用内标物进行定量。计算公式为
IR=[(tx-tn)/(tn+1-tn)+n]×100,
(2)
wx=(RxmTMP)/mS。
(3)
式中:tx为挥发性化合物x的保留时间(min);tn和tn+1分别为化合物x在相同色谱条件下直接洗脱前、后正烷烃的保留时间(min);wx为挥发性化合物x的含量(ng/g);Rx为混合物与TMP的峰面积比;mTMP为TMP质量,取为2 μg;mS为样品质量,取为6 g。
1.2.8 脂氧合酶(LOX)分析 LOX酶活性的测定参照Hsieh等[22]方法并略作修改。精准称取5.00 g肌肉,加入5 mL预冷的50 mmol/L磷酸盐缓冲液(pH 7.0,含1 mmol/L β-巯基乙醇、0.5 mmol/L苯甲烷磺酰氟和2 mmol/L乙二胺四乙酸)匀浆,用孔径为154 μm的双层滤布过滤,4 ℃下以10 000 r/min 离心30 min,上清液即为粗酶液;取200 μL粗酶液与1.8 mL 10 mmol/L的亚油酸溶液(pH 9,含50 mmol/L柠檬酸盐和20 mmol/L吐温)混合;每10 s 测定一次其在234 nm下的吸光度(A 234 nm),并计算酶活性。
参照Dai等[23]的方法,采用实时荧光定量PCR检测LOX表达。采用Primer 5软件设计目标基因LOX5的引物序列(F:5′GGGGAGGATACCGAGG 3′,R:3′CCGCTGTAACAAAGGC 5′)和内参基因β-atin引物序列(F:5′GCATCCACGAGACCACTTACA 3′,R:3′CTCCTGCTTGCTGATCCACATC 5′)。采用2-ΔΔCt法计算靶基因的相对表达量。
参照Cao等[24]的方法,用蛋白免疫印迹法(WB)检测LOX5蛋白和β-actin的表达,并计算蛋白的相对表达量(LOX5/β-actin)。目的蛋白LOX5的抗体购自Abcam公司(型号为169755),β-actin购自Proteintech公司(型号为66009)。采用Image J 1.44p软件对目标条带的强度进行定量。
1.3 数据处理
试验数据均以平均值±标准误(mean±S.E.)表示,采用SPSS 20.0软件进行统计分析。试验数据进行独立样本T检验,显著性水平设为0.05。
2 结果与分析
2.1 两种饲料投喂下中华绒螯蟹的感官评价
从味觉指标得分看,TFG和FDG组中华绒螯蟹肌肉的苦味和咸味无差异,而与TFG组相比,FDG组中华绒螯蟹肌肉的甜味和鲜味评分较高;从嗅觉指标得分看,TFG和FDG组蟹的脂肪味和肉香味相似,与TFG组相比,FDG组中华绒螯蟹肌肉的青草味较高,而腥味则较低(图1)。
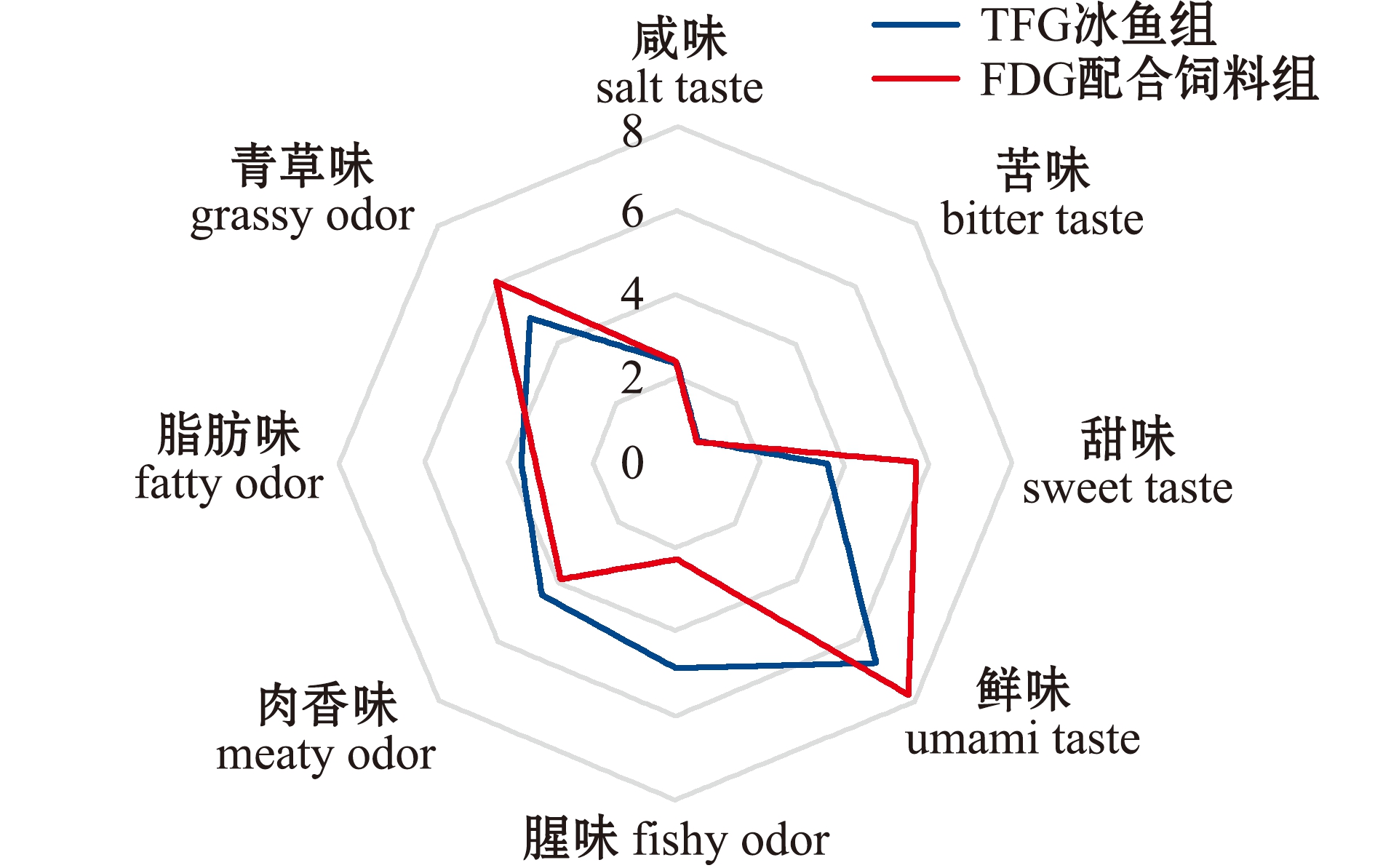
图1 冰鱼和配合饲料投喂组中华绒螯蟹的感官评价
Fig.1 Sensory evaluation in Eriocheir sinensis fed with trash fish and formulated diet
2.2 两种饲料投喂下中华绒螯蟹肌肉中的游离氨基酸及核苷酸含量
从表2可见,冰鱼和配合饲料投喂下,中华绒螯蟹肌肉中17种游离氨基酸均无显著性差异(P>0.05)。
表2 中华绒螯蟹肌肉中部分游离氨基酸含量
Tab.2 Partial free amino acid content in Eriocheir sinensis muscle mg/100 mg muscle
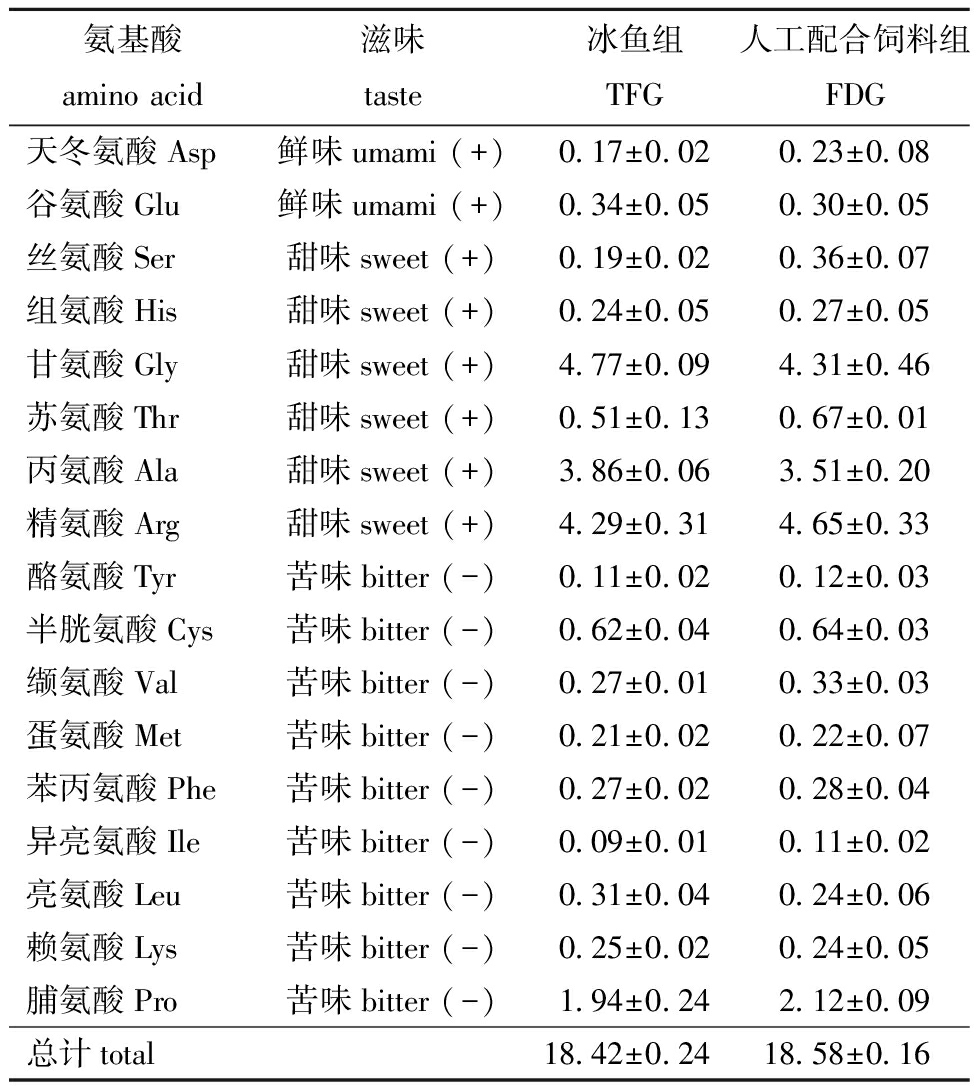
氨基酸amino acid滋味taste冰鱼组TFG人工配合饲料组FDG天冬氨酸Asp鲜味umami (+)0.17±0.020.23±0.08谷氨酸Glu鲜味umami (+)0.34±0.050.30±0.05丝氨酸Ser甜味sweet (+)0.19±0.020.36±0.07组氨酸His甜味sweet (+)0.24±0.050.27±0.05甘氨酸Gly甜味sweet (+)4.77±0.094.31±0.46苏氨酸Thr甜味sweet (+)0.51±0.130.67±0.01丙氨酸Ala甜味sweet (+)3.86±0.063.51±0.20精氨酸Arg甜味sweet (+)4.29±0.314.65±0.33酪氨酸Tyr苦味bitter (-)0.11±0.020.12±0.03半胱氨酸Cys苦味bitter (-)0.62±0.040.64±0.03缬氨酸Val苦味bitter (-)0.27±0.010.33±0.03蛋氨酸Met苦味bitter (-)0.21±0.020.22±0.07苯丙氨酸Phe苦味bitter (-)0.27±0.020.28±0.04异亮氨酸Ile苦味bitter (-)0.09±0.010.11±0.02亮氨酸Leu苦味bitter (-)0.31±0.040.24±0.06赖氨酸Lys苦味bitter (-)0.25±0.020.24±0.05脯氨酸Pro苦味bitter (-)1.94±0.242.12±0.09总计total18.42±0.2418.58±0.16
注:+,积极的滋味;-,消极的滋味。
Note:+,positive taste;-,negative taste.
从表3可见,两组中华绒螯蟹肌肉中的 5′-肌苷酸钠和5′-鸟苷酸钠无显著性差异(P>0.05),但FDG组蟹的5′-腺苷酸钠和鲜味当量均显著高于TFG组(P<0.05)。
表3 中华绒螯蟹肌肉中的呈味核苷酸含量
Tab.3 Flavor nucleotide content in Eriocheir sinensis muscle

组别group5′-鸟苷酸钠/(mg·100 g-1)GMP5 ′-肌苷酸钠/(mg·100 g-1)IMP5 ′-腺苷酸钠/(mg·100 g-1)AMP鲜味当量/(g·100 g-1)EUCTFG41.62±2.05394.95±46.69253.56±61.282.23±0.11FDG36.98±1.65530.19±62.55617.84±111.41∗2.77±0.13∗
注:*,TFG与FDG组间有显著性差异(P<0.05),下同。
Note:*,significant difference between TFG and FDG groups(P<0.05),et sequentia.
2.3 两种饲料投喂下中华绒螯蟹肌肉脂肪酸组成
从表4可见:与TFG组相比,FDG组中华绒螯蟹肌肉中有8种脂肪酸(C14:0、C15:0、C16:0、C17:0、C20:0、C20:1、C22:1和C22:6)含量显著减少(P<0.05),有3种脂肪酸(C18:2、C20:2和C22:5)含量显著增加(P<0.05);FDG组中的饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)含量显著低于TFG组(P<0.05),但多不饱和脂肪酸(PUFA)含量显著高于TFG组(P<0.05)。
表4 中华绒螯蟹肌肉中部分脂肪酸含量
Tab.4 Partial fatty acid content in Eriocheir sinensis muscle %
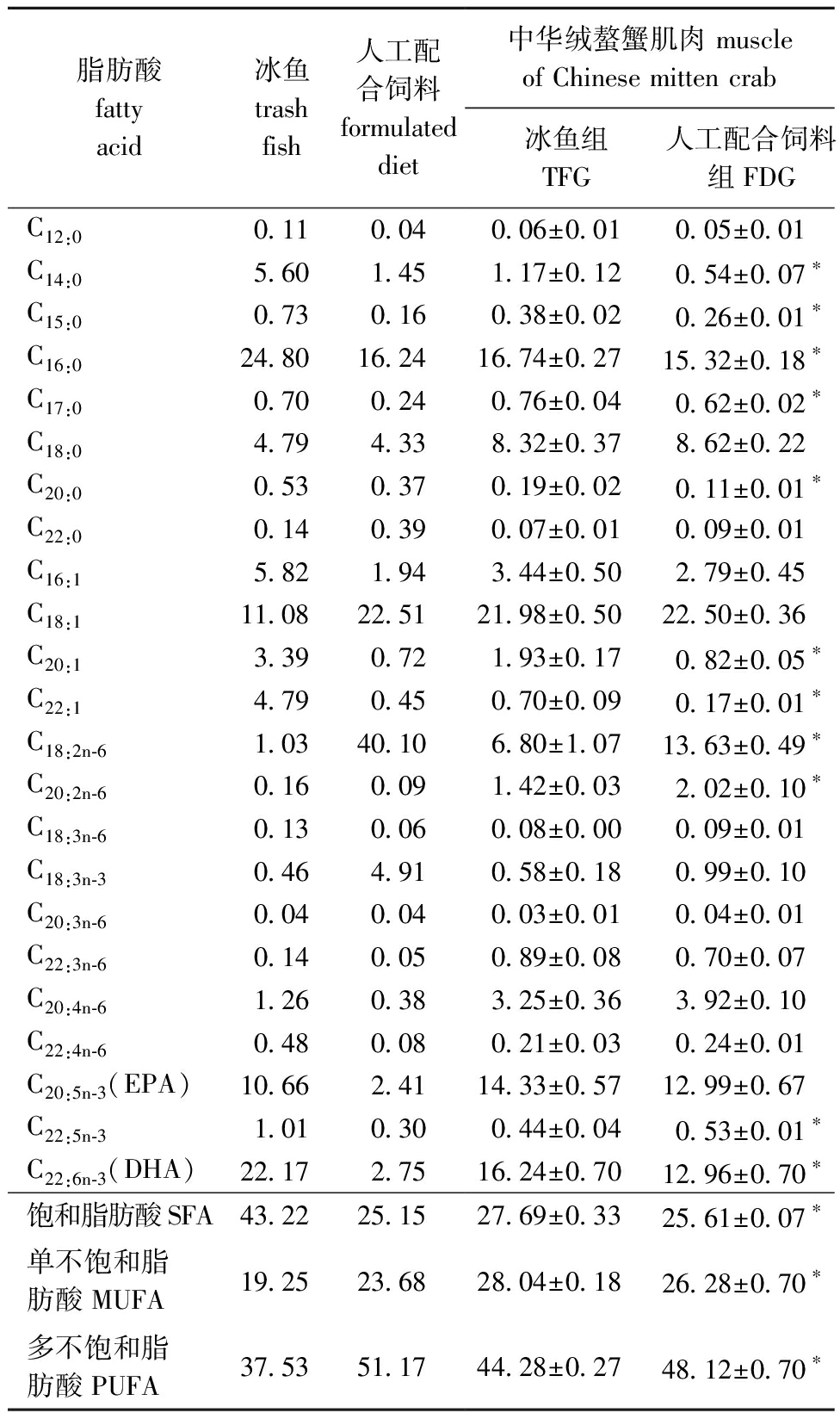
脂肪酸fatty acid冰鱼trashfish人工配合饲料formulated diet 中华绒螯蟹肌肉 muscle of Chinese mitten crab冰鱼组TFG人工配合饲料组FDGC12:00.110.040.06±0.010.05±0.01C14:05.601.451.17±0.120.54±0.07∗C15:00.730.160.38±0.020.26±0.01∗C16:024.8016.2416.74±0.2715.32±0.18∗C17:00.700.240.76±0.040.62±0.02∗C18:04.794.338.32±0.378.62±0.22C20:00.530.370.19±0.020.11±0.01∗C22:00.140.390.07±0.010.09±0.01C16:15.821.943.44±0.502.79±0.45C18:111.0822.5121.98±0.5022.50±0.36C20:13.390.721.93±0.170.82±0.05∗C22:14.790.450.70±0.090.17±0.01∗C18:2n-61.0340.106.80±1.0713.63±0.49∗C20:2n-60.160.091.42±0.032.02±0.10∗C18:3n-60.130.060.08±0.000.09±0.01C18:3n-30.464.910.58±0.180.99±0.10C20:3n-60.040.040.03±0.010.04±0.01C22:3n-60.140.050.89±0.080.70±0.07C20:4n-61.260.383.25±0.363.92±0.10C22:4n-60.480.080.21±0.030.24±0.01C20:5n-3(EPA)10.662.4114.33±0.5712.99±0.67C22:5n-31.010.300.44±0.040.53±0.01∗C22:6n-3(DHA)22.172.7516.24±0.7012.96±0.70∗饱和脂肪酸SFA43.2225.1527.69±0.3325.61±0.07∗单不饱和脂肪酸MUFA19.2523.6828.04±0.1826.28±0.70∗多不饱和脂肪酸PUFA37.5351.1744.28±0.2748.12±0.70∗
2.4 两种饲料投喂下中华绒螯蟹的挥发性化合物
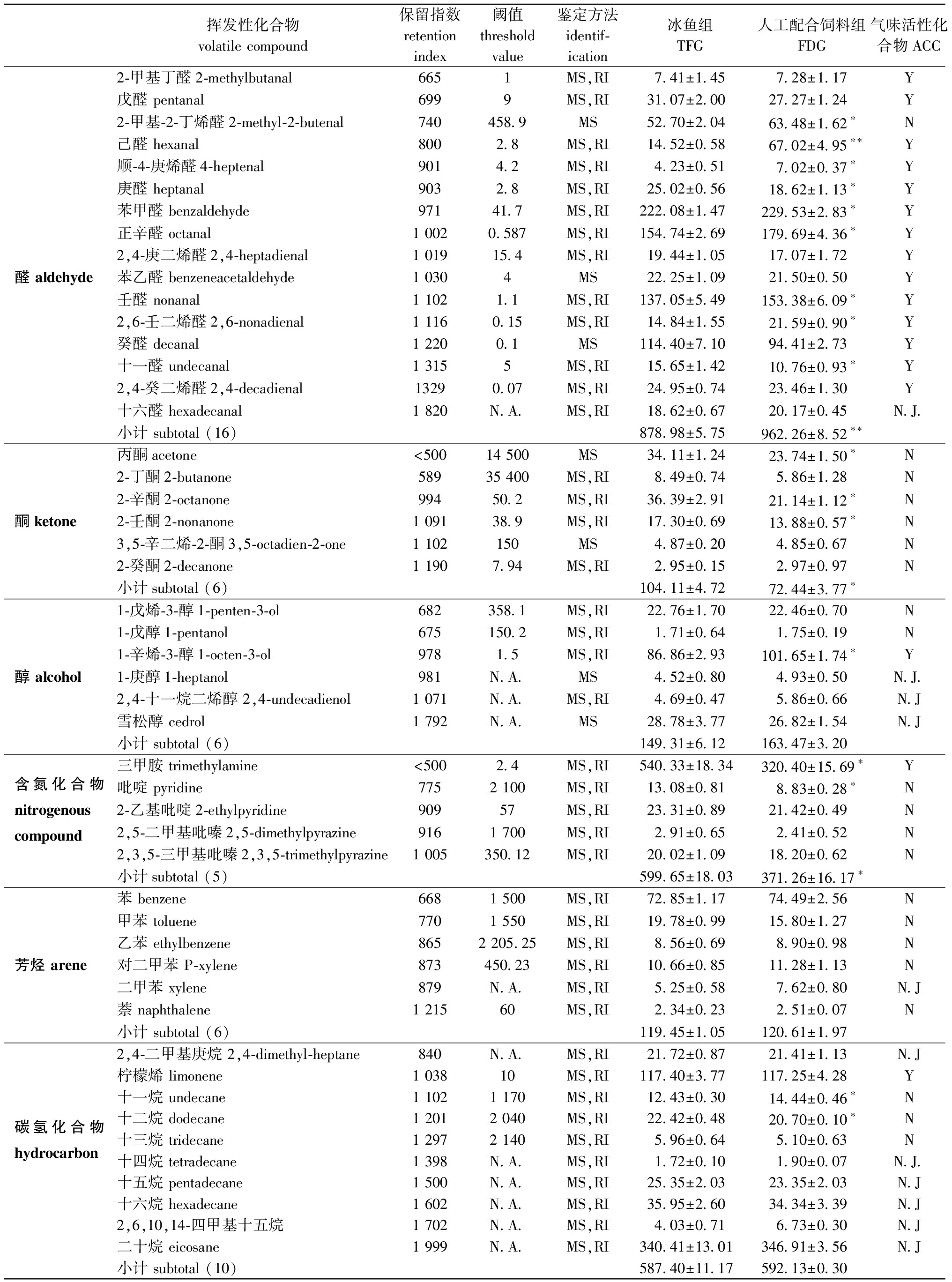
从表5可见:两组中华绒螯蟹肌肉中共检测到55种挥发性化合物,包括16种醛、6种酮、6种醇类、6种芳族化合物、5种含氮化合物、10种碳氢化合物和6种其他化合物;与TFG组相比,FDG组中华绒螯蟹肌肉中的醛含量显著增加(P<0.05),而酮和含氮化合物含量显著下降(P<0.05);两组中的醇类、芳香族和碳氢类化合物无显著性差异(P>0.05)。气味活度值(OAV)是用来评判呈味物质味感强度的重要指标,可通过化合物的浓度除以其感觉阈值来计算。当OAV值大于1时,该物质则被定义为气味活性化合物(AAC)。经计算,两组中华绒螯蟹中有19种挥发性化合物定义为ACC,其中包括14种醛类、1种醇类、1种含氮化合物、1种烃类和2种其他化合物。
表5 冰鱼和配合饲料组中华绒螯蟹肌肉中挥发性化合物含量的比较
Tab.5 Comparison of identified volatile compounds content in muscle of Eriocheir sinensis fed with trash fish and formulated diet ng/g muscle
挥发性化合物volatile compound保留指数retention index阈值threshold value鉴定方法identif-ication冰鱼组TFG人工配合饲料组FDG气味活性化合物ACC2-甲基丁醛2-methylbutanal6651MS,RI7.41±1.457.28±1.17Y戊醛 pentanal6999MS,RI31.07±2.0027.27±1.24Y2-甲基-2-丁烯醛2-methyl-2-butenal740458.9MS52.70±2.0463.48±1.62∗N己醛 hexanal8002.8MS,RI14.52±0.5867.02±4.95∗∗Y顺-4-庚烯醛4-heptenal9014.2MS,RI4.23±0.517.02±0.37∗Y庚醛 heptanal9032.8MS,RI25.02±0.5618.62±1.13∗Y苯甲醛 benzaldehyde97141.7MS,RI222.08±1.47229.53±2.83∗Y正辛醛 octanal1 0020.587MS,RI154.74±2.69179.69±4.36∗Y2,4-庚二烯醛2,4-heptadienal1 01915.4MS,RI19.44±1.0517.07±1.72Y醛 aldehyde苯乙醛 benzeneacetaldehyde1 0304MS22.25±1.0921.50±0.50Y壬醛 nonanal1 1021.1MS,RI137.05±5.49153.38±6.09∗Y2,6-壬二烯醛2,6-nonadienal1 1160.15MS,RI14.84±1.5521.59±0.90∗Y癸醛 decanal1 2200.1MS114.40±7.1094.41±2.73Y十一醛 undecanal1 3155MS,RI15.65±1.4210.76±0.93∗Y2,4-癸二烯醛2,4-decadienal13290.07MS,RI24.95±0.7423.46±1.30Y十六醛 hexadecanal1 820N.A.MS,RI18.62±0.6720.17±0.45N.J.小计 subtotal (16)878.98±5.75962.26±8.52∗∗丙酮acetone<50014 500MS34.11±1.2423.74±1.50∗N2-丁酮2-butanone58935 400MS,RI8.49±0.745.86±1.28N2-辛酮2-octanone99450.2MS,RI36.39±2.9121.14±1.12∗N酮ketone2-壬酮2-nonanone1 09138.9MS,RI17.30±0.6913.88±0.57∗N3,5-辛二烯-2-酮3,5-octadien-2-one1 102150MS4.87±0.204.85±0.67N2-癸酮2-decanone1 1907.94MS,RI2.95±0.152.97±0.97N小计subtotal (6)104.11±4.7272.44±3.77∗1-戊烯-3-醇1-penten-3-ol682358.1MS,RI22.76±1.7022.46±0.70N1-戊醇1-pentanol675150.2MS,RI1.71±0.641.75±0.19N1-辛烯-3-醇1-octen-3-ol9781.5MS,RI86.86±2.93101.65±1.74∗Y醇 alcohol1-庚醇1-heptanol981N.A.MS4.52±0.804.93±0.50N.J.2,4-十一烷二烯醇 2,4-undecadienol1 071N.A.MS,RI4.69±0.475.86±0.66N.J雪松醇 cedrol1 792N.A.MS28.78±3.7726.82±1.54N.J小计 subtotal (6)149.31±6.12163.47±3.20三甲胺 trimethylamine<5002.4MS,RI540.33±18.34320.40±15.69∗Y吡啶 pyridine7752 100MS,RI13.08±0.818.83±0.28∗N含氮化合物 nitrogenous compound2-乙基吡啶2-ethylpyridine90957MS,RI23.31±0.8921.42±0.49N2,5-二甲基吡嗪2,5-dimethylpyrazine9161 700MS,RI2.91±0.652.41±0.52N2,3,5-三甲基吡嗪2,3,5-trimethylpyrazine1 005350.12MS,RI20.02±1.0918.20±0.62N小计subtotal (5)599.65±18.03371.26±16.17∗苯 benzene6681 500MS,RI72.85±1.1774.49±2.56N甲苯 toluene7701 550MS,RI19.78±0.9915.80±1.27N乙苯 ethylbenzene8652 205.25MS,RI8.56±0.698.90±0.98N芳烃 arene对二甲苯 P-xylene873450.23MS,RI10.66±0.8511.28±1.13N二甲苯 xylene879N.A.MS,RI5.25±0.587.62±0.80N.J萘 naphthalene1 21560MS,RI2.34±0.232.51±0.07N小计 subtotal (6)119.45±1.05120.61±1.972,4-二甲基庚烷 2,4-dimethyl-heptane840N.A.MS,RI21.72±0.8721.41±1.13N.J柠檬烯 limonene1 03810MS,RI117.40±3.77117.25±4.28Y十一烷 undecane1 1021 170MS,RI12.43±0.3014.44±0.46∗N十二烷 dodecane1 2012 040MS,RI22.42±0.4820.70±0.10∗N碳氢化合物 hydrocarbon十三烷 tridecane1 2972 140MS,RI5.96±0.645.10±0.63N十四烷 tetradecane1 398N.A.MS,RI1.72±0.101.90±0.07N.J.十五烷 pentadecane1 500N.A.MS,RI25.35±2.0323.35±2.03N.J十六烷 hexadecane1 602N.A.MS,RI35.95±2.6034.34±3.39N.J2,6,10,14-四甲基十五烷1 702N.A.MS,RI4.03±0.716.73±0.30N.J二十烷 eicosane1 999N.A.MS,RI340.41±13.01346.91±3.56N.J小计 subtotal (10)587.40±11.17592.13±0.30
表5(续) 冰鱼和配合饲料组中华绒螯蟹肌肉中挥发性化合物含量的比较
Tab.5(continued) Comparison of identified volatile compounds content in muscle of Eriocheir sinensis fed with trash fish and formulated diet ng/g muscle
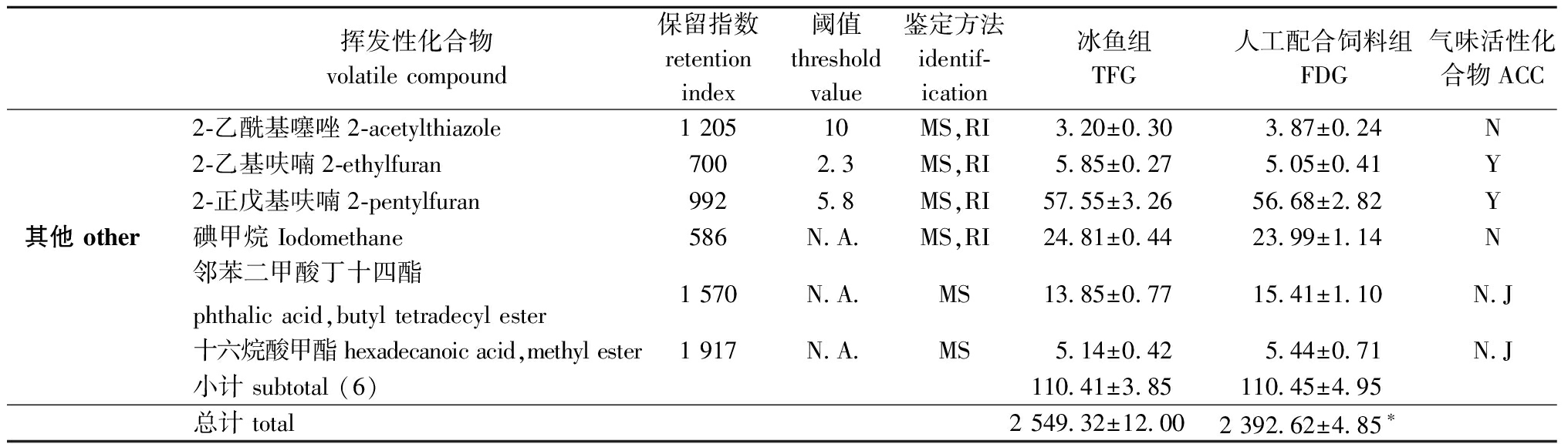
挥发性化合物volatile compound保留指数retention index阈值threshold value鉴定方法identif-ication冰鱼组TFG人工配合饲料组FDG气味活性化合物ACC2-乙酰基噻唑2-acetylthiazole1 20510MS,RI3.20±0.303.87±0.24N2-乙基呋喃2-ethylfuran7002.3MS,RI5.85±0.275.05±0.41Y2-正戊基呋喃2-pentylfuran9925.8MS,RI57.55±3.2656.68±2.82Y其他 other碘甲烷 Iodomethane586N.A.MS,RI24.81±0.4423.99±1.14N邻苯二甲酸丁十四酯 phthalic acid,butyl tetradecyl ester1 570N.A.MS13.85±0.7715.41±1.10N.J十六烷酸甲酯 hexadecanoic acid,methyl ester1 917N.A.MS5.14±0.425.44±0.71N.J小计 subtotal (6)110.41±3.85110.45±4.95总计 total2 549.32±12.002 392.62±4.85∗
注:N.A.—不可用;Y—属于ACCs;N—不属于ACCs;N.J.—不能判断是否属于ACCs;MS—质谱(通过数据库质谱鉴定);RI—保留指数(与文献中的RI进行比较)。*和**分别表示TFG和FDG组间有显著性差异(P<0.05)和极显著性差异(P<0.01)。
Note:N.A.—not available;Y—belong to ACCs;N—not belong to ACCs;N.J.— cannot be judged whether belongs to ACCs;MS—mass spectrum (identified thanks to the mass spectra of database);RI—retention index (compared with the RI in the literature). *and ** respectively indicated that there were significant differences (P<0.05)and extremely significant differences (P<0.01)between TFG and FDG groups.
2.5 两种饲料投喂下中华绒螯蟹的脂氧合酶比较
从图2、图3可见:与TFG组相比,FDG组中华绒螯蟹肌肉中LOX酶活性显著增加(P<0.05);LOX5 mRNA水平显著升高1.76倍(P<0.05),LOX5蛋白水平也显著升高(P<0.05)。
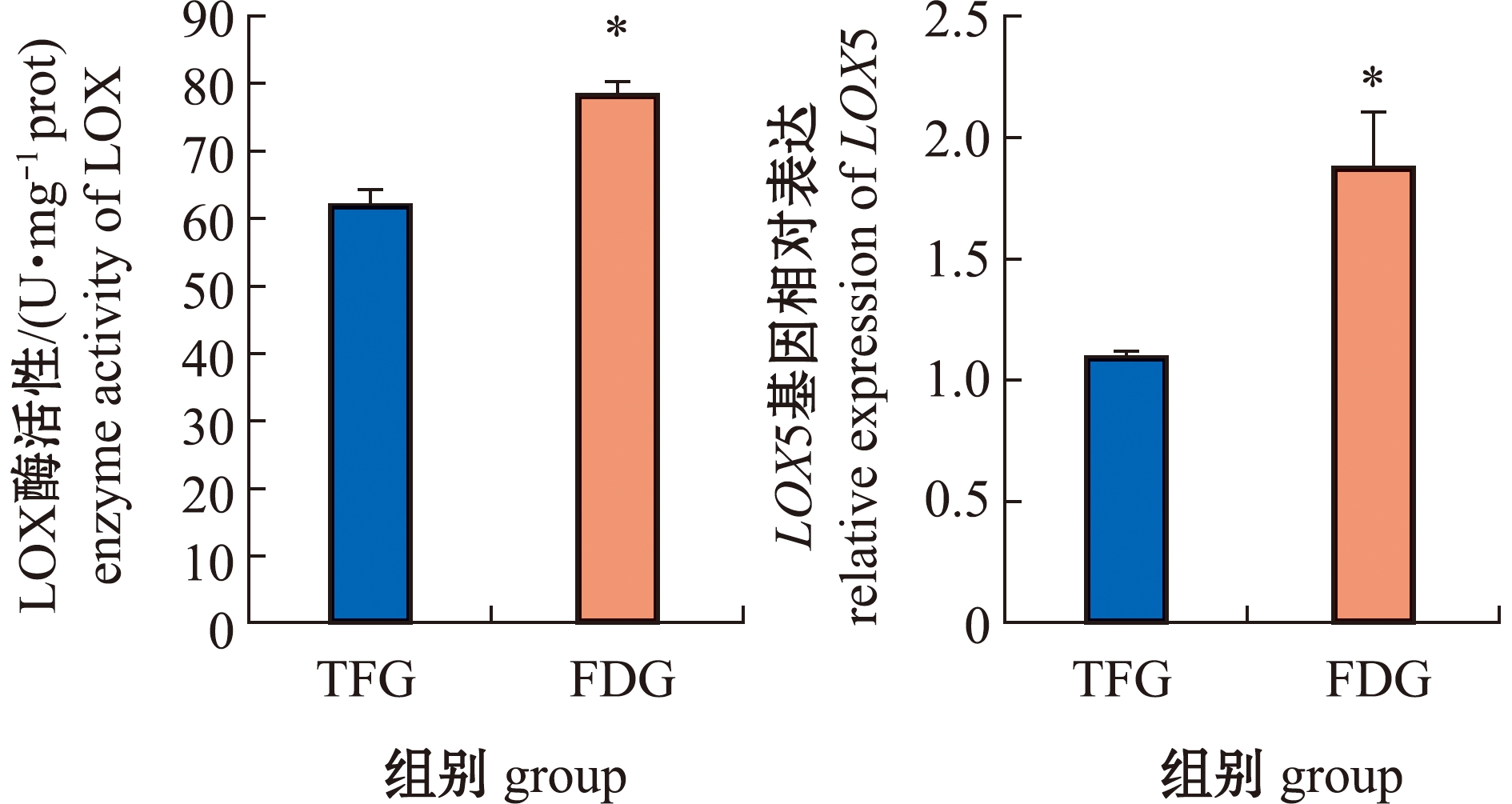
*表示组间有显著性差异(P<0.05),下同。
*means significant differences between groups(P<0.05),et sequentia.
图2 中华绒螯蟹肌肉中的脂氧合酶活性与基因表达
Fig.2 Enzyme activity and relative gene expression of LOX in Eriocheir sinensis muscle
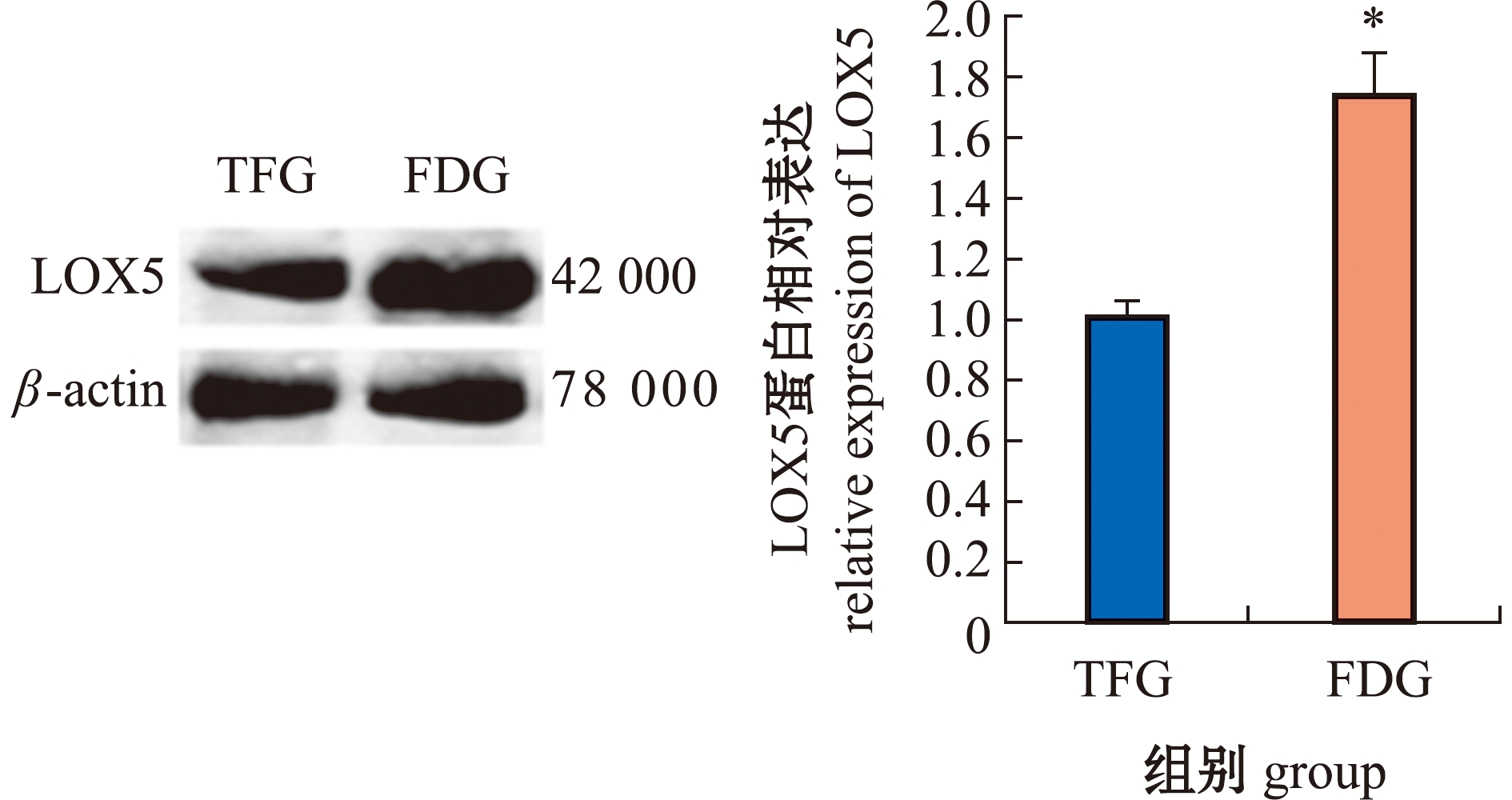
图3 中华绒螯蟹肌肉中LOX5蛋白表达
Fig.3 Relative expression of LOX5 protein in Eriocheir sinensis muscle
3 讨论
3.1 冰鱼和配合饲料组中华绒螯蟹的感官评价
投喂冰鱼的中华绒螯蟹风味独特,鲜味和甜味突出,然而转喂人工配合饲料后,其风味如何尚未知晓,为此,本试验中比较了不同养殖模式下中华绒螯蟹的风味差异。感官评价是描述中华绒螯蟹蟹肉滋味的常用方法,本研究中发现,两组中华绒螯蟹肌肉品质的主要差异在于腥味、鲜味、甜味和青草味,而在苦味和咸味方面无明显差异,FDG组中华绒螯蟹肌肉的甜味和鲜味高于TFG组。Zhuang等[25]也发现了相似的结果,与投喂冰鱼相比,投喂人工配合饲料的中华绒螯蟹肌肉具有较高的甜味和鲜味。气味评价中,本研究中,两组中华绒螯蟹肌肉的脂肪味较相似且均无明显的腐烂味,然而与TFG组相比,FDG组蟹的腥味较少,而青草味较多。前期相关研究表明,食物中的腥味物质可以被水生动物直接吸收,并残留在机体内[26]。因此,本研究中TFG组蟹中较高的腥味可能是因为冰鱼中原有的腥味物质被中华绒螯蟹吸收继而储存在肌肉中,而FDG组中较高的青草味可能与饲料中含有较高的多不饱和脂肪酸有关。有研究表明,多不饱和脂肪酸可以通过激活LOX酶的代谢途径加速脂肪酸氧化分解,产生具有果味和青草味的烯醛,从而改变肉的风味[27]。
3.2 两组中华绒螯蟹游离氨基酸和核苷酸的比较
众所周知,游离氨基酸的含量与食品的味道有较强的相关性,如呈味氨基酸(谷氨酸、天冬氨酸、甘氨酸、丝氨酸、丙氨酸和脯氨酸)对中华绒螯蟹的甜味和鲜味有较大影响[15]。本试验中检测两组中华绒螯蟹肌肉中17种游离氨基酸含量发现,冰鱼和配合饲料投喂组的游离氨基酸之间无显著性差异。Chen等[15]也得出相似的结论,在比较投喂人工配合饲料和野杂鱼下中华绒螯蟹的呈味氨基酸含量时发现,肌肉中17种游离氨基酸的含量无显著性差异。水生动物肌肉中游离氨基酸的组成主要与摄入的蛋白源有关[28]。目前,人工配合饲料中主要蛋白源仍以鱼粉为主[29],鱼粉主要由野生鱼类加工而成,因此,其游氨基酸成分与野生鱼类相似。本研究中,TFG和FDG组蟹的游离氨基酸分布相似,可能是因为配方饲料选择了鱼粉作为蛋白质的主要来源,故两组中华绒螯蟹中的游离氨基酸含量无显著性差异。
除氨基酸外,3种核苷酸(5′-肌苷酸钠、5′-鸟苷酸钠和5′-腺苷酸钠)具有甜味,对中华绒螯蟹的味道具有重要的影响[15-16]。本研究中,通过检测两组中华绒螯蟹肌肉中的3种核苷酸含量发现,IMP和GMP并无显著性差异,然而与TFG组相比,FDG组中华绒螯蟹肌肉中AMP含量显著升高。Wang等[5]也发现,AMP在中华绒螯蟹肌肉中的含量远高于其他两种核苷酸。Zhuang等[25]也报道了相似的结果,投喂人工配合饲料的中华绒螯蟹肝脏组织中AMP含量升高。因AMP在中华绒螯蟹的所有组织中含量均较高,故被认为是在3种核苷酸中产生甜味的主要物质[5]。AMP含量的显著增加可能与配合饲料中富含PUFAs有关。大量研究证实,PUFAs可激活腺苷酸活化蛋白激酶通路(AMPK),使得AMP含量增加。核苷酸在游离氨基酸之间具有独特的协同作用,可导致鲜味增加,这种协同表现鲜味的能力被量化为鲜味当量[15]。本试验中,FDG组中华绒螯蟹肌肉中的鲜味当量值显著高于TFG组。综上所述,投喂配合饲料的中华绒螯蟹具有较高的甜味可能与肌肉中AMP含量升高有关,而较高的鲜味可能是核苷酸和游离氨基酸协同作用的结果。
3.3 两组中华绒螯蟹肌肉中脂肪酸的比较
中华绒螯蟹中多不饱和脂肪酸含量较高,而饱和脂肪酸含量较低,这完全符合人类的健康需要[30]。本研究中发现,与TFG组相比,FDG组中华绒螯蟹肌肉中饱和脂肪酸含量显著降低。Wen等[31]研究了不同脂肪源对中华绒螯蟹脂肪酸组成的影响,发现饲料和机体中的饱和脂肪酸含量有较强的正相关性,表明中华绒螯蟹可能会把饲料中的饱和脂肪酸直接吸收继而沉积在肌肉中。基于此推测,本试验中FDG组较低的饱和脂肪酸含量可能与人工配合饲料的脂肪酸组成有关,因此,对冰鱼及配合饲料的脂肪酸组成进行了检测,结果发现,人工配合饲料中的饱和脂肪酸含量远低于冰鱼中的含量。近年的研究表明,食用富含饱和脂肪酸的食物会增加心脑血管疾病的风险,且极有可能进一步诱发慢性炎症,最终导致代谢综合征和Ⅱ型糖尿病[10]。因此,FDG组中低饱和脂肪酸的中华绒螯蟹或许具有更高的营养价值。
本试验发现,FDG组中华绒螯蟹肌肉中单不饱和脂肪酸(MUFA)含量低于TFG组,但配合饲料中的MUFA比例却高于冰鱼中。这可能是因为人工配合饲料中油酸(C18:1)的比例(22.51%)是冰鱼(11.08%)的2倍。油酸是含有一个双键的18碳脂肪酸,可以在去饱和酶的催化作用下加一个双键生成亚油酸(LA,C18:2n-6)[32]。本研究中,FDG组中华绒螯蟹肌肉中LA(13.63%)是TFG组(6.80%)的2倍,这也印证了中华绒螯蟹能够把饲料中高含量的OA转化为LA,导致FDG组中华绒螯蟹具有较低的MUFA和较高的LA。目前,MUFA对人体健康的影响仍无统一定论。有报道显示,富含MUFA的高脂日粮会诱发大鼠的代谢紊乱,且与投喂富含饱和脂肪酸(SFA)的高脂日粮试验组比较发现,两组间无显著性差异,这说明SFA和MUFA对机体代谢方面均会产生负面的影响。此外,2006年,美国营养协会建议人体以MUFA形式消耗的能量应少于20%[8]。这些研究表明,MUFA可能对人体健康产生负面影响。
多不饱和脂肪酸对人体健康有诸多好处,可预防慢性疾病和促进大脑发育等。本研究中,FDG组中华绒螯蟹肌肉中PUFAs含量较TFG组显著增加。可能是因为人工配合饲料的PUFAs含量较高(占脂肪酸组成的51.17%,比冰鱼中高出14%)。ɑ-亚麻酸(ALA,C18:3n-3)是二十碳五烯酸(EPA,C20:5n-3)和二十二碳六烯酸(DHA,C22:6n-3)的前体,而亚油酸是花生四烯酸(AA,C20:4n-6)的前体[31]。AA和DHA是细胞膜磷脂的主要成分,是中枢神经系统中主要的长链PUFAs。在各种PUFAs中,AA、EPA、ALA和DHA对人类健康至关重要,它们具有维持细胞形态和预防慢性疾病的功能[32]。本研究中,与TFG组相比,FDG组蟹的EPA和AA含量无显著性差异,但亚油酸(LA,C18:2)含量较显著升高,DHA含量显著降低。综上就脂肪酸而言,FDG组含有较低的SFAs、MUFAs及较高的PUFAs,这更符合消费者对健康的需求。
3.4 两组中华绒螯蟹肌肉中挥发性化合物的比较
醛类物质具有较强的挥发性和较低的阈值,对肉品的气味形成具有重要影响,相较哺乳动物而言,水生动物中的醛类含量更高,对气味的影响更显著[13]。本试验中,FDG组中华绒螯蟹肌肉中醛类总含量显著高于TFG;FDG组中7种醛(2-甲基-2-丁烯醛、己醛、顺-4-庚烯醛、苯甲醛、壬醛、正辛醛和2,6-壬二烯醛)的含量显著高于TFG组。多不饱和脂肪酸的氧化分解是产生醛类物质的重要来源。而人工配合饲料中的PUFAs(51.17%)远高于冰鱼中的含量(37.53%),因此,导致中华绒螯蟹肌肉中PUFAs含量(48.12%)增加。此外,FDG组肌肉中有2种醛(庚醛和十一醛)的含量显著低于TFG组。Zhuang等[25]也得出了相似的结果,投喂人工配合饲料的中华绒螯蟹肌肉中的庚醛和十一醛含量低于传统养殖模式下的含量,研究者认为这可能与氨基酸Strecker反应有关。
除醛类以外,气味活性化合物还包括2-乙基呋喃、2-正戊基呋喃、柠檬烯、1-辛烯-3-醇和三甲胺。两组中华绒螯蟹肌肉中的2-乙基呋喃、2-戊基呋喃和柠檬烯含量均无显著性差异。三甲胺是一种含氮化合物,其水溶液具有浓郁的腥味,Brand等[34]认为其是导致鱼类具有腥味的主要物质。本试验中,TFG组中华绒螯蟹肌肉中三甲胺含量显著高于FDG组,这与感官评价中TFG组鱼腥味评分较高相对应。此外,本试验中,FDG组中华绒螯蟹肌肉中1-辛烯-3-醇含量显著高于TFG组,1-辛烯-3-醇的具体来源尚不清楚,但研究发现,机体中的醛类在脱氢酶的作用下可以转化为相应的醇类物质[35],FDG组中1-辛烯-3-醇含量的升高可能与高含量的醛有关。
综上推测,中华绒螯蟹肌肉中醛的差异是TFG和FDG组蟹肉风味变化的主要原因。此前的研究已经证实,脂氧合酶催化PUFAs生成的醛类化合物在水果和蔬菜独特香气形成中发挥了重要作用。感官评价中FDG组鲜味得分高,可能与蟹肉中的醛类物质含量高有关。
3.5 两组中华绒螯蟹肌肉中脂氧合酶的比较
脂氧合酶(LOX)是非血红素双加氧酶,可催化PUFAs氧化分解产生醛类物质[36]。研究表明,由LOX介导的PUFAs代谢途径参与了多种香味的形成[37]。本研究中,FDG组中华绒螯蟹肌肉中LOX酶活性显著高于TFG组。Wang等[38]研究发现,日粮中高含量的亚油酸提高了大黄鱼(Larmichthys crocea)LOX的转录水平。本研究中,配合饲料中的亚油酸含量约为野生鱼中的40倍,这表明FDG组中LOX活性升高可能与LOX转录的加强有关。荧光定量PCR和蛋白免疫印迹的检测结果显示,FDG组中华绒螯蟹肌肉中LOX基因和蛋白表达均显著增加。LOX活性的升高意味着醛类的合成增强,这与对挥发性化合物进行检测时发现醛类含量升高的结果相一致。由此推测,中华绒螯蟹较高的清香味可能与LOX介导的PUFAs氧化分解途径的增强有关。
4 结论
1)人工配合饲料组的蟹肉在甜味、鲜味和青草味方面较为突出,而鱼腥味则低于冰鱼组。
2)采用人工配合饲料投喂中华绒螯蟹虽不影响其肌肉脂肪酸组成,但显著提高了多不饱和脂肪酸的含量,显著降低了饱和脂肪酸和单不饱和脂肪酸的含量。
3)人工配合饲料组蟹肌肉中的5′-腺苷酸钠和鲜味当量显著升高。
4)醛类物质是产生独特香味的主要因素,人工配合饲料组蟹肌肉中的醛类物质含量显著升高,这可能与LOX酶活性的增加有关。
总体而言,人工配合饲料可以提升蟹肉风味,提高多不饱和脂肪酸、腺嘌呤核糖核苷酸和鲜味当量含量,更符合消费者对健康饮食的需求。
[1] 李晨虹,李思发.中国大陆沿海六水系绒螯蟹(中华绒螯蟹和日本绒螯蟹)群体亲缘关系:形态判别分析[J].水产学报,1999,23(4):337-342.
LI C H,LI S F.Phylogenesis of populations of mitten crabs (Eriocheir sinensis,Eriocheir japonicus) in six river systems of China’s mainland:morphology discriminant analysis[J].Journal of Fisheries of China,1999,23(4):337-342.(in Chinese)
[2] SHAO L C,WANG C,HE J,et al.Meat quality of Chinese mitten crabs fattened with natural and formulated diets[J].Journal of Aquatic Food Product Technology,2014,23(1):59-72.
[3] TANAKA T,SAITO N,OKUHARA A,et al.Studies on the taste of α-amino acids part III[J].Journal of the Agricultural Chemical Society of Japan,1969,43(4):263-268.
[4] 郇思琪,刘登勇,王笑丹,等.食品中呈鲜味物质研究进展[J].食品工业科技,2020,41(21):333-339.
HUAN S Q,LIU D Y,WANG X D,et al.Research advances on umami substances in food[J].Science and Technology of Food Industry,2020,41(21):333-339.(in Chinese)
[5] WANG S,HE Y,WANG Y Y,et al.Comparison of flavour qualities of three sourced Eriocheir sinensis[J].Food Chemistry,2016,200:24-31.
[6] WU N,GU S Q,TAO N P,et al.Characterization of important odorants in steamed male Chinese mitten crab (Eriocheir sinensis) using gas chromatography-mass spectrometry-olfactometry[J].Journal of Food Science,2014,79(7):C1250-C1259.
[7] 吕静.膳食脂肪酸摄入、体内脂质代谢水平及其与乳腺癌发生的相关性研究[D].重庆:第三军医大学,2010.
LÜ J.Study of the dietary intake levels,fatty acid lipid metabolic gene expressions and their relationships with breast cancer risk[D].Chongqing:Third Military Medical University,2010.(in Chinese)
[8] DELGADO G E,KR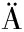 MER B K,LORKOWSKI S,et al.Individual omega-9 monounsaturated fatty acids and mortality—the Ludwigshafen risk and cardiovascular health study[J].Journal of Clinical Lipidology,2017,11(1):126-135.e5.
MER B K,LORKOWSKI S,et al.Individual omega-9 monounsaturated fatty acids and mortality—the Ludwigshafen risk and cardiovascular health study[J].Journal of Clinical Lipidology,2017,11(1):126-135.e5.
[9] 肖起珍.中华绒螯蟹DNA分子标记开发及其应用[D].上海:上海海洋大学,2018.
XIAO Q Z.DNA molecular markers discovery of Chinese mitten crab Eriocheir sinensis and its application[D].Shanghai:Shanghai Ocean University,2018.(in Chinese)
[10] RUIZ-N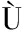
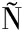 EZ B,DIJCK-BROUWER D A J,MUSKIET F A J.The relation of saturated fatty acids with low-grade inflammation and cardiovascular disease[J].The Journal of Nutritional Biochemistry,2016,36:1-20.
EZ B,DIJCK-BROUWER D A J,MUSKIET F A J.The relation of saturated fatty acids with low-grade inflammation and cardiovascular disease[J].The Journal of Nutritional Biochemistry,2016,36:1-20.
[11] WANG M Y,GE J C,YU J H,et al.Molecular insights into information processing and developmental and immune regulation of Eriocheir sinensis megalopa under hyposaline stress[J].Genomics,2020,112(6):4647-4656.
[12] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2021中国渔业统计年鉴[M].北京:中国农业出版社,2021.
Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2021 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2021.(in Chinese)
[13] KONG L,CAI C F,YE Y T,et al.Comparison of non-volatile compounds and sensory characteristics of Chinese mitten crabs (Eriocheir sinensis) reared in lakes and ponds:potential environmental factors[J].Aquaculture,2012,364/365:96-102.
[14] WU M C.Food analysis and sensory evaluation[M].Beijing:China Agriculture Press,2002:314-318.
[15] CHEN D W,ZHANG M.Non-volatile taste active compounds in the meat of Chinese mitten crab (Eriocheir sinensis)[J].Food Chemistry,2007,104(3):1200-1205.
[16] TANAKA R,MIYAMOTO H,INOUE S I,et al.Thermophile-fermented compost as a fish feed additive modulates lipid peroxidation and free amino acid contents in the muscle of the carp,Cyprinus carpio[J].Journal of Bioscience and Bioengineering,2016,121(5):530-535.
[17] SHANTHA N C,ACKMAN R G.Nervonic acid versus tricosanoic acid as internal standards in quantitative gas chromatographic analyses of fish oil longer-chain n-3 polyunsaturated fatty acid methyl esters[J].Journal of Chromatography B:Biomedical Sciences and Applications,1990,533:1-10.
[18] 王潇,韩刚,张小军,等.不同水域中华绒螯蟹雄体营养成分及风味成分差异性研究[J].大连海洋大学学报,2019,34(5):688-696.
WANG X,HAN G,ZHANG X J,et al.Nutritional composition and flavor components of male Chinese mitten handed crab Eriocheir sinensis from different waters[J].Journal of Dalian Ocean University,2019,34(5):688-696.(in Chinese)
[19] GAO Z X,LUO W,LIU H,et al.Transcriptome analysis and SSR/SNP markers information of the blunt snout bream (Megalobrama amblycephala)[J].PLoS One,2012,7(8):e42637.
[20] YAMAGUCHI S,YOSHIKAWA T,IKEDA S,et al.Measurement of the relative taste intensity of some l-α-amino acids and 5′-nucleotides[J].Journal of Food Science,1971,36(6):846-849.
[21] GU S Q,WANG X C,TAO N P,et al.Characterization of volatile compounds in different edible parts of steamed Chinese mitten crab (Eriocheir sinensis)[J].Food Research International,2013,54(1):81-92.
[22] HSIEH R J,KINSELLA J E.Lipoxygenase-catalyzed oxidation of n-6 and n-3 polyunsaturated fatty acids:relevance to and activity in fish tissue[J].Journal of Food Science,1986,51(4):940-945.
[23] DAI Y J,JIANG G Z,YUAN X Y,et al.High-fat-diet-induced inflammation depresses the appetite of blunt snout bream (Megalobrama amblycephala) through the transcriptional regulation of leptin/mammalian target of rapamycin[J].The British Journal of nutrition,2018,120(12):1-10.
[24] CAO X F,DAI Y J,LIU M Y,et al.High-fat diet induces aberrant hepatic lipid secretion in blunt snout bream by activating endoplasmic reticulum stress-associated IRE1/XBP1 pathway[J].Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids,2019,1864(3):213-223.
[25] ZHUANG K J,WU N,WANG X C,et al.Effects of 3 feeding modes on the volatile and nonvolatile compounds in the edible tissues of female Chinese mitten crab (Eriocheir sinensis)[J].Journal of Food Science,2016,81(4):S968-S981.
[26] SAGEHASHI M,SHIRAISHI K,FUJITA H,et al.Adsorptive ozonation of 2-methylisoborneol in natural water with preventing bromate formation[J].Water Research,2005,39(16):3900-3908.
[27] BAYSAL T,DEMIRDÖVEN A.Lipoxygenase in fruits and vegetables:a review[J].Enzyme and Microbial Technology,2007,40(4):491-496.
[28] SUN C X,ZHANG D D,LIU W B,et al.Growth performance,digestion and metabolism to fish meal replacement by rice protein concentrate in Chinese soft-shelled turtle Pelodiscus sinensis[J].Aquaculture,2018,492:321-326.
[29] JIA E T,ZHENG X C,CHENG H H,et al.Dietary fructooligosaccharide can mitigate the negative effects of immunity on Chinese mitten crab fed a high level of plant protein diet[J].Fish &Shellfish Immunology,2019,84:100-107.
[30] 彭静文,张艳霞,从娇娇,等.不同囤养阶段雌性中华绒螯蟹体肉脂含量和脂肪酸组成的比较[J].现代食品科技,2018,34(12):96-103.
PENG J W,ZHANG Y X,CONG J J,et al.Effects of different hoarding stages on lipid content and fatty acids of female Chinese mitten crab body meat[J].Modern Food Science and Technology,2018,34(12):96-103.(in Chinese)
[31] WEN X B,CHEN L Q,ZHOU Z L,et al.Reproduction response of Chinese mitten-handed crab (Eriocheir sinensis) fed different sources of dietary lipid[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2002,131(3):675-681.
[32] 卜俊芝,徐迅,严利强.三疣梭子蟹脂肪提取工艺及其组成分析[J].食品工业科技,2020,41(13):72-78,84.
BU J Z,XU X,YAN L Q.Extraction process and composition profiles of fat from Portunus trituberculatus[J].Science and Technology of Food Industry,2020,41(13):72-78,84.(in Chinese)
[33] GORJ O R,AZEVEDO-MARTINS A K,RODRIGUES H G,et al.Comparative effects of DHA and EPA on cell function[J].Pharmacology &Therapeutics,2009,122(1):56-64.
O R,AZEVEDO-MARTINS A K,RODRIGUES H G,et al.Comparative effects of DHA and EPA on cell function[J].Pharmacology &Therapeutics,2009,122(1):56-64.
[34] BRAND J M,GALASK R P.Trimethylamine:the substance mainly responsible for the fishy odor often associated with bacterial vaginosis[J].Obstetrics and Gynecology,1986,68(5):682-685.
[35] EDENBERG H J.The genetics of alcohol metabolism:role of alcohol dehydrogenase and aldehyde dehydrogenase variants[J].Alcohol Research &Health,2007,30(1):5-13.
[36] LE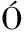 N J,ROYO J,VANCANNEYT G,et al.Lipoxygenase H1 gene silencing reveals a specific role in supplying fatty acid hydroperoxides for aliphatic aldehyde production[J].Journal of Biological Chemistry,2002,277(1):416-423.
N J,ROYO J,VANCANNEYT G,et al.Lipoxygenase H1 gene silencing reveals a specific role in supplying fatty acid hydroperoxides for aliphatic aldehyde production[J].Journal of Biological Chemistry,2002,277(1):416-423.
[37] SHEN J Y,WU L,LIU H R,et al.Bagging treatment influences production of C6 aldehydes and biosynthesis-related gene expression in peach fruit skin[J].Molecules,2014,19(9):13461-13472.
[38] WANG T J,ZUO R T,MAI K S,et al.Molecular cloning and functional characterization of arachidonate 5-lipoxygenase (Alox5),and its expression in response to the ratio of linolenic acid to linoleic acid in diets of large yellow croaker (Larmichthys crocea)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2016,201:21-28.