琼枝(Betaphycus gelatinus)广泛分布于中国、日本、菲律宾和其他东南亚国家[1],在中国主要分布于海南省及台湾地区。琼枝隶属于红藻门(Rhodophyta)红翎菜科(Solieriaceae)琼枝藻属(Betaphycus),是中国主要栽培的大型经济红藻。琼枝藻体颜色为紫红色或黄绿色,直径为11~21 cm,腹面有圆锥状突起,枝条为扁平或圆柱状,平卧生长,有圆盘状固着器,附着于大潮低潮线下1~3 m的死珊瑚或礁石上。琼枝含有卡拉胶、多种微量元素及丰富的生物活性物质,具有抗病毒[2]、抗氧化[3]、抗菌[4]、调节免疫[5]和抗高脂血症[6]等功效,在功能食品和药品的研发等方面具有较大潜力。随着卡拉胶在世界范围的广泛应用,琼枝需求量不断增加[7],而过度采捞导致琼枝自然生存环境遭到破坏,野生资源急剧降低[8],因此,人工栽培琼枝成为主要来源[9]。为便于琼枝栽培期间的采收与管理,生产中常将琼枝从深水区迁移至水位较浅的潮下带,并绑于水泥网框的网片上[10]。与自然生长的环境相比,栽培琼枝易受到光照胁迫,表现出明显的光抑制或不可逆的光损伤,导致藻体有明显的背腹之分,背部藻体老化严重,枝条粗大且质地较硬,表面分布有白斑,生长速率降低,严重影响了琼枝品质和产量,因此,亟待选育一种能快速生长且耐高光强的琼枝新品系。
近年来,国内外学者对琼枝生物学特性[11-12]、遗传多样性[13]和营养成分[14]等方面的研究较多,但在筛选抗逆琼枝突变体方面尚未见报道。本研究中,通过自然突变与高光筛选相结合的方法,获得一株耐高光琼枝突变体并进行生产性能评价,以期为琼枝的优良品系选育提供一条新途径,为耐高光琼枝新种质资源开发提供科学参考。
1 材料与方法
1.1 材料
试验用琼枝野生型品系(WT)、潜在耐高光藻株均采自海南省昌江黎族自治县海尾镇琼枝栽培区(19°59′N,108°47′E)的养殖网框(图1)。
本图以自然资源部标准地图服务网站GS(2017)1268号标准地图为底图,底图边界无修改。
The figure is based on the standard map GS(2017)1268 in the Standard Map Service website of Ministry of Natural Resources of the People’s Republic of China,with no modifications of the boundaries in the standard map.
图1 采样海域
Fig.1 Sampling sea area
1.2 方法
1.2.1 样品采集 潜在的耐高光藻株的采集标准:向光面的藻体表面老化不严重、无明显背腹之分,藻枝饱满多汁、舒展并向四周延伸,藻体生长旺盛健康。其中,采集到一株琼枝藻体颜色为红色与绿色相间的嵌合体,切除红色组织后于海区内扩培,用于后续耐高光筛选试验。
1.2.2 耐高光藻株选育 试验在中国热带农业科学院热带生物技术研究所进行。取5 g潜在的耐高光藻株并以琼枝WT为对照,培养液由新鲜海水加入PES培养基(上海生工生物工程股份有限公司)制成。培养条件:光量子通量密度为280 μmol/(m2·s),温度为26 ℃,盐度为32,pH 为8.20,光周期12 L∶12 D。经28 d培养筛选出增重最高的藻体作为耐高光藻株,经6次继代培养验证其遗传性状稳定,并检测其生理生化指标及生产性能。
1.2.3 主要光合色素含量测定 将琼枝突变体与WT暂养于光量子通量密度为60 μmol/(m2·s)的光照条件下,每组设3个重复,其余条件同“1.2.2节”。暂养7 d后,从每个重复取0.1 g新鲜藻体测定脂溶性色素叶绿素a、类胡萝卜素及水溶性色素藻胆蛋白含量,具体方法参照文献[15-16]。
1.2.4 光系统Ⅱ(PSⅡ)最大光化学转换效率测定 将琼枝突变体和WT切段,分别置于光量子通量密度为55、110、180、250、280、370 μmol/(m2·s)条件下培养,每个试验设置3个重复,其余培养条件同“1.2.2节”。培养28 d后,使用MINI-PAM(Walz,Effeltrich,Germany)测定最大光量子产量。暗适应30 min后,首先在0.3 μmol/(m2·s)光量子通量密度下,测得最小荧光值(F0),然后在4 000 μmol/(m2·s)的饱和脉冲下,测得最大荧光值(Fm)。PSⅡ最大光化学转换效率(Fv/Fm)计算公式[17]为
Fv/Fm=(Fm-F0)/Fm。
(1)
1.2.5 不同光照条件下琼枝突变体生长性能的测定 将琼枝突变体和WT切段,初始质量均为(1.00±0.01)g,分别设置55、110、180、250、280、370 μmol/(m2·s)6个光量子通量密度,每个试验设置6个重复,其余培养条件同“1.2.2节”。每3 d更换一次海水,培养28 d后,测量藻体的湿质量。增重率(GBW,%)、特定生长率(RSG,%/d)计算公式分别为
GBW=(Wt-W0)/W0×100%,
(2)
RSG=(lnWt-lnW0)/t×100%。
(3)
式中:W0为藻体初始鲜质量(g);Wt为试验结束时藻体鲜质量(g);t为试验时间(d),称量前用吸水纸快速吸干藻体表面的水分。
1.2.6 琼枝突变体海区养殖试验 2021年12月—2022年6月中旬于海区进行生长性能试验。将琼枝突变体栽于水泥网框中,水泥网框上有两层尼龙网,底层网目数小,上层网目数大。使用轧带将质量为1 g的琼枝突变体系于底网,苗间距约为10 cm,共计45株,并将水泥网框迁移至水位较浅的养殖海域。以WT为对照组,分别于2022年2、4、5、6月每月退潮时各选取6株琼枝称重,计算其特定生长率,10月时观察藻体长势并拍照。
1.2.7 卡拉胶含量的测定 将海区养殖6个月的琼枝突变体与WT置于60 ℃烘箱中烘干至恒重,每组设置3个重复,分别取(1.00±0.01)g烘干后的藻体,参照文献[18]中的方法测定胶含量。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,采用SPSS 20.0软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 耐高光琼枝突变体XY-01的选育
经过28 d实验室培养筛选出一株生长速率最快的耐高光突变体,藻体呈绿色,偏肉质,背腹面区分不明显,向光面稍老化,藻枝舒展且饱满,藻株高光胁迫表型不明显,其余形态特征与WT相似。WT在高光培养期间生长速度缓慢,枝段培养初期颜色呈紫红色,培养15 d时颜色变淡,枝段出现白化腐烂现象,培养28 d后枝段颜色变为黄绿色,分枝较小且数量增多;而琼枝突变体在培养期间藻体颜色稳定为绿色,高光条件下生长明显比WT迅速,枝段未出现腐烂,枝条延伸生长(图2)。

图2 琼枝WT与XY-01形态对比
Fig.2 Morphological comparison between Betaphycus gelatinus WT and XY-01
由于该耐高光琼枝突变体是通过对嵌合体简单分离获得的,培养期间随着藻株生长偶见红色组织块。将该突变体分成若干4 cm的藻段,置于110 μmol/(m2·s)光量子通量密度下进行复筛,并及时切除红色组织块。培养60~90 d期间均未发现红色组织块的出现。随后将该绿色突变株置于低光照[55 μmol/(m2·s)]下培养,28 d后的藻株性状稳定,初步获得性状稳定的耐高光突变株。
将颜色稳定的琼枝突变体送至养殖海区继代培养6次,藻体颜色均为绿色,无红色组织块出现,琼枝突变体生长旺盛且生长速率高于WT,故获得的突变株为遗传稳定的耐高光琼枝,编号为XY-01。
2.2 XY-01的光合色素含量
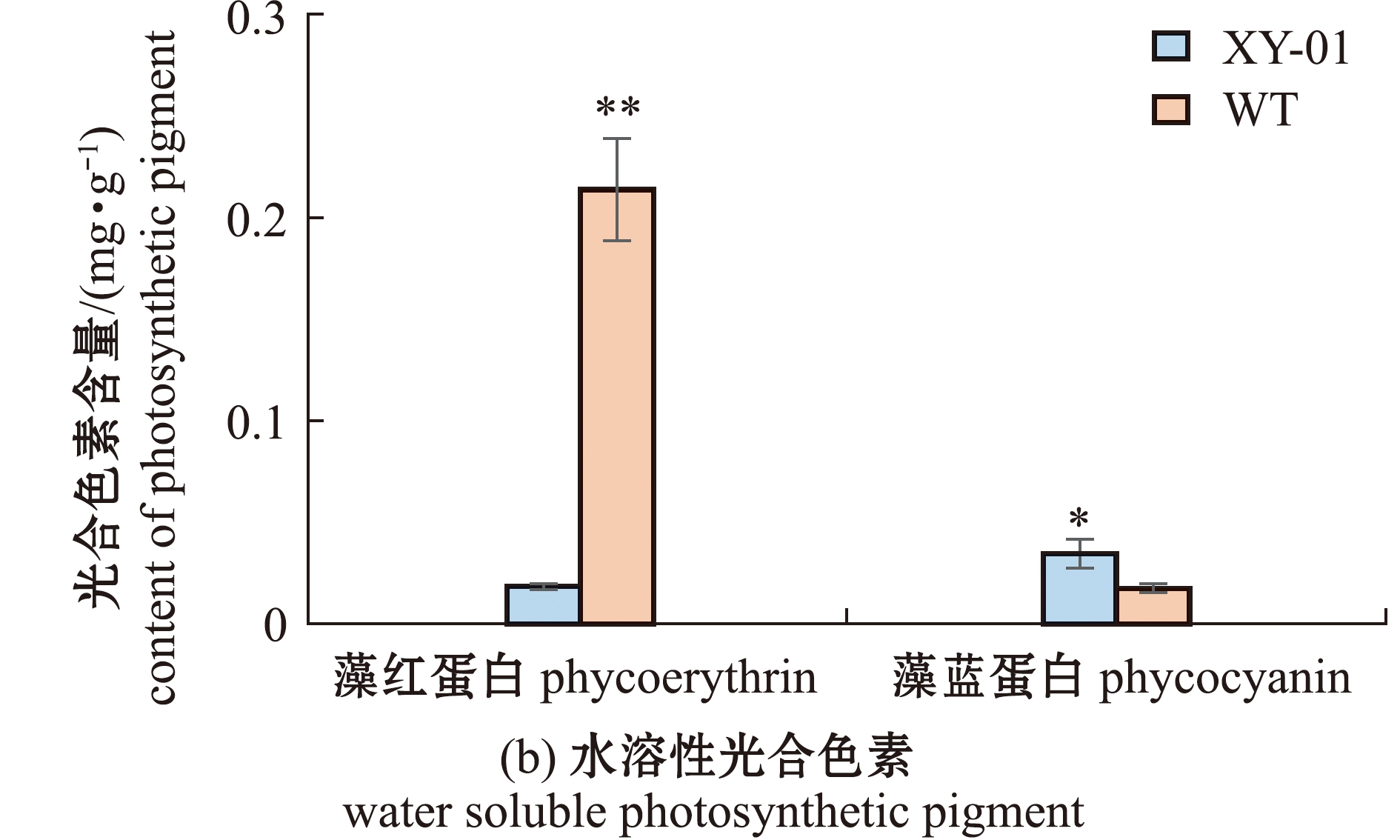
从图3可见:在光量子通量密度为60 μmol/(m2·s)下培养7 d后,XY-01的叶绿素a和类胡萝卜素含量稍高于WT,但组间无显著性差异(P>0.05);XY-01的藻红蛋白(PE)含量为(0.018±0.001)mg/g,极显著低于WT[(0.210±0.025)mg/g](P<0.01),而藻蓝蛋白(PC)含量则显著高于WT(P<0.05)。

*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01),下同。
* means significant difference compared with the control(P<0.05);** means very significant difference compared with the control(P<0.01),et sequemtia.
图3 琼枝XY-01和WT的光合色素含量
Fig.3 Photosynthetic pigment contents of Betaphycus gelatinus XY-01 and WT
2.3 XY-01的PSⅡ最大光化学转换效率
从图4可见:经过28 d培养后,XY-01的Fv/Fm在光量子通量密度250 μmol/(m2·s)下最大,为(0.635±0.019),WT的Fv/Fm在光量子通量密度180 μmol/(m2·s)下最大,为(0.512±0.037);在光量子通量密度55~370 μmol/(m2·s)范围内,WT的Fv/Fm均显著低于XY-01。这表明,WT光化学转换效率较低,而XY-01有更高效的光合作用能力。
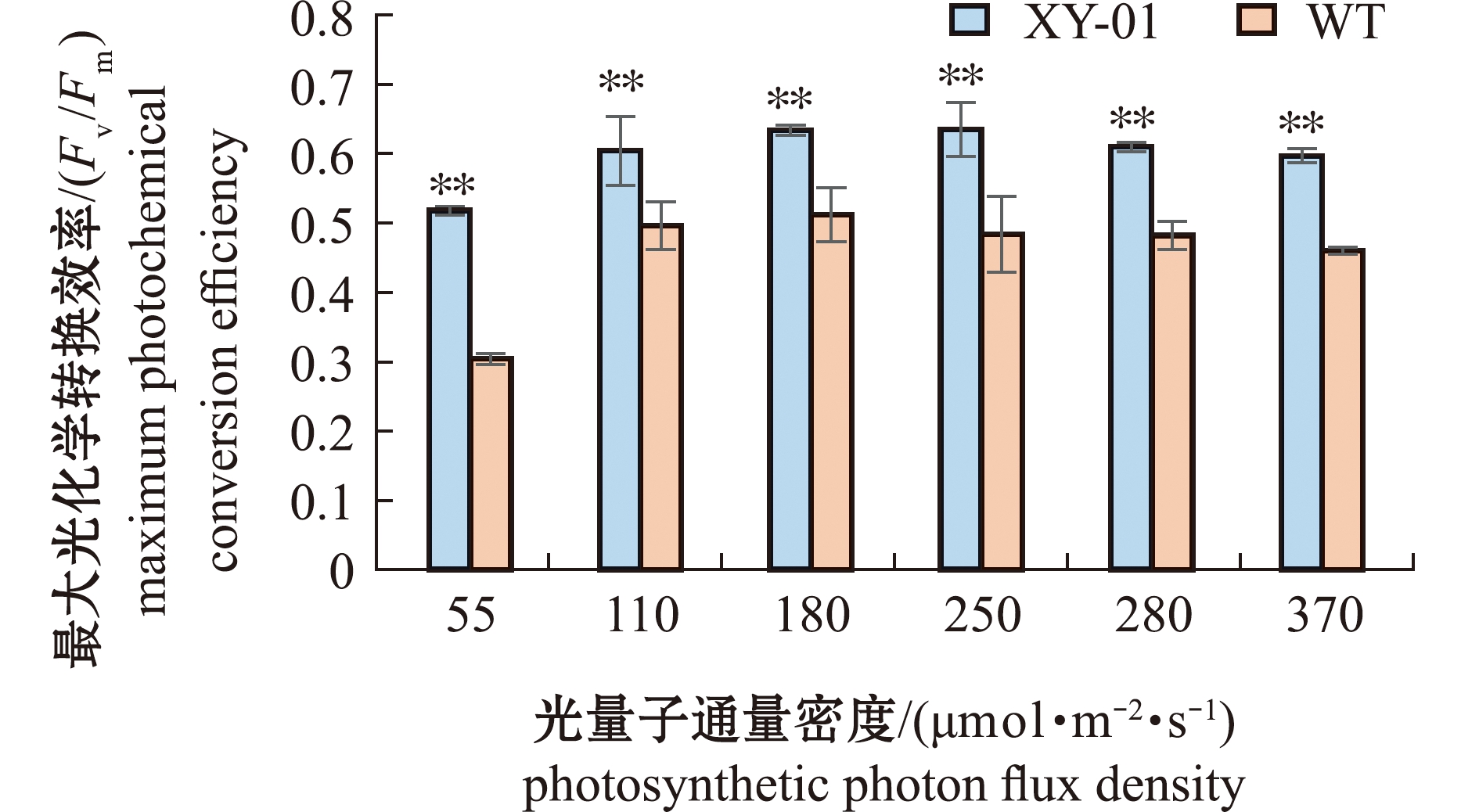
图4 琼枝XY-01和WT的最大光化学转换效率
Fig.4 Maximum photochemical conversion efficiency of Betaphycus gelatinus XY-01 and WT
2.4 XY-01在不同光量子通量密度下的生长性能
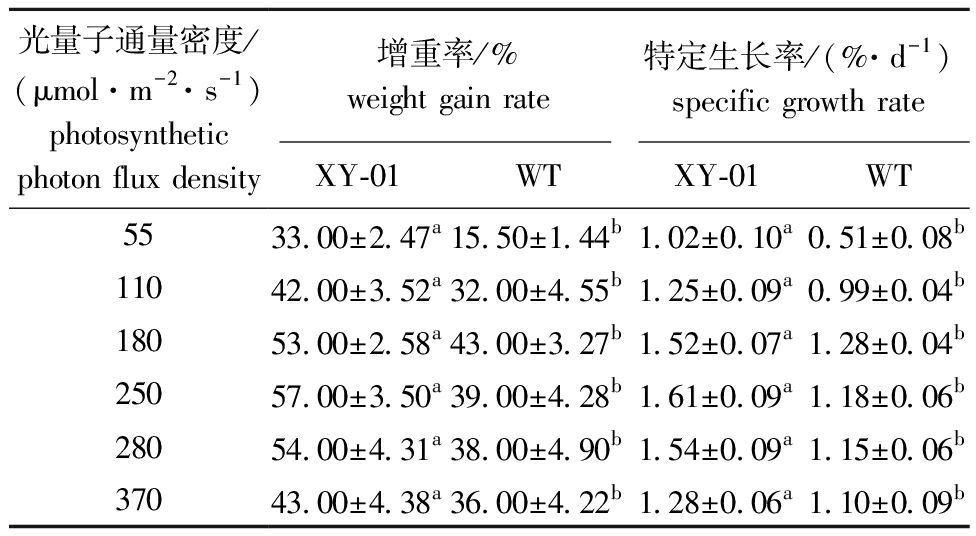
从表1可见:在55~370 μmol/(m2·s)光量子通量密度下,经过28 d培养后,XY-01和WT的增重率和特定生长率均有显著性差异(P<0.05);XY-01于250 μmol/(m2·s)光量子通量密度下,具有最大的增重率和特定生长率,WT于180 μmol/(m2·s)光量子通量密度下,具有最大的增重率和特定生长率,二者均在55 μmol/(m2·s)条件下具有最小的生长性能。这表明,XY-01比WT具有更好的高光适应性。
表1 琼枝XY-01和WT的生长性能
Tab.1 Growth performance of Betaphycus gelatinus XY-01 and WT
光量子通量密度/(μmol·m-2·s-1)photosynthetic photon flux density增重率/%weight gain rate特定生长率/(%·d-1) specific growth rateXY-01WTXY-01WT55 33.00±2.47a15.50±1.44b1.02±0.10a0.51±0.08b11042.00±3.52a32.00±4.55b1.25±0.09a0.99±0.04b18053.00±2.58a43.00±3.27b1.52±0.07a1.28±0.04b25057.00±3.50a39.00±4.28b1.61±0.09a1.18±0.06b28054.00±4.31a38.00±4.90b1.54±0.09a1.15±0.06b37043.00±4.38a36.00±4.22b1.28±0.06a1.10±0.09b
注:同行中标有不同字母者表示同一指标下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters at same index within the same line are significantly different in different groups at the 0.05 probability level,and the means with the same letter within the same line are not significant differences.
2.5 XY-01在海区养殖期间的特定生长率
从2021年12月初—2022年6月中旬,栽培在海区的XY-01生长旺盛,藻体颜色为绿色,无胁迫表型,同期栽培的WT生长较为缓慢(图5)。从图6可见:2021年12月初—2022年2月下旬时,XY-01组和WT组均生长较慢,特定生长率分别为(1.61±0.10)、(1.68±0.14)%/d,且组间无显著性差异(P>0.05);WT组最高特定生长率出现在2月下旬—4月下旬,为(2.82±0.14)%/d,此时期XY-01组为(3.18±0.19)%/d,优于WT组,但组间仍无显著性差异(P>0.05);XY-01组于4月下旬—5月下旬期间生长最为迅速,特定生长率达(3.63±0.07)%/d,此时期WT组的特定生长率仅为(2.63±0.36)%/d,且组间有极显著性差异(P<0.01)。这表明,XY-01较WT有更优良的海区生长率,表现出明显的耐高光特性。

A、C、E—琼枝XY-01;B、D、F—琼枝WT;A~D—栽培初期;E~F—栽培后期。
A,C and E—Betaphycus gelatinus XY-01;B,D and F—Betaphycus gelatinus WT;A-D—early stage of cultivation;E-F—later stages of cultivation.
图5 水泥网框法栽培
Fig.5 Cultivation with cement mesh frame method
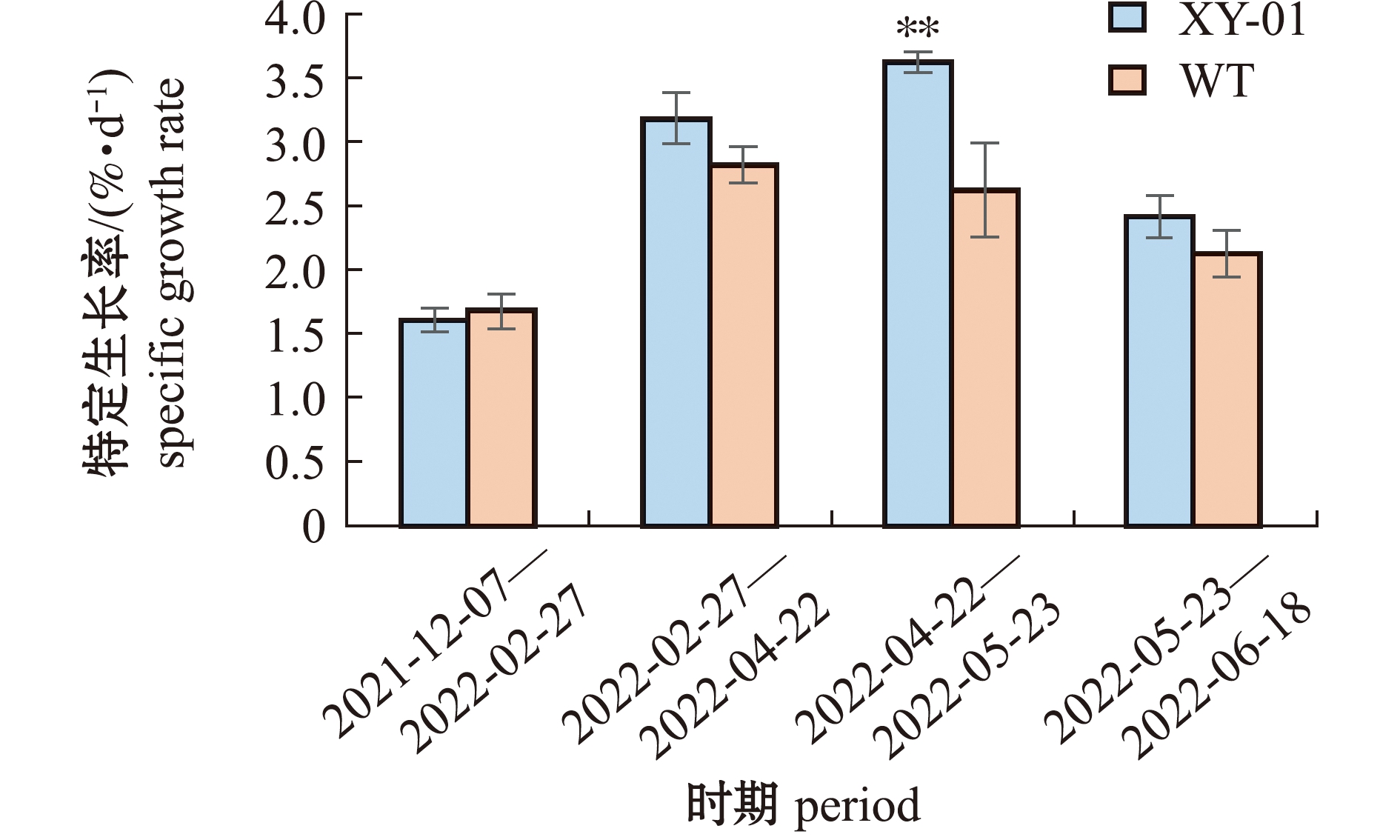
图6 不同时期琼枝XY-01与WT的特定生长率
Fig.6 Specific growth rate of Betaphycus gelatinus XY-01 and WT at different periods
2.6 XY-01的卡拉胶含量
经测定,琼枝在海区培养6个月后,XY-01的卡拉胶含量为38.91%±1.54%,WT为36.87%±2.80%,两者间无显著性差异(P>0.05)。
3 讨论
3.1 高光突变体琼枝的选育
目前,已有多种物理及化学诱变技术应用到藻类的育种中,如严兴洪等[19]利用60Co-γ射线诱变条斑紫菜(Porphyra yezoensis)壳孢子萌发体获得色素突变体;孟琳等[20]利用MNNG化学诱变剂诱变龙须菜(Gracilaria lemaneiformis)茎尖,获得耐高温龙须菜突变体。由于诱导琼枝产生四分孢子的技术还不成熟,琼枝的人工有性生殖繁育尚未实现;此外,诱导愈伤组织技术不成熟,通过茎尖切段的琼枝营养繁殖技术也不完善,切断后的藻株生长速率缓慢,导致通过人工杂交或物理、化学诱变等技术进行琼枝育种的工作难以开展。然而,自然突变是生物进化的强大推手,其为研究人员提供了一批具备优良性状的突变体,因此,选择育种也成为育种方法中的一种重要手段。
世界各地的多项研究表明,红藻中存在大量自然突变体,如在日本发现的红藻(Pyropia kinositae)绿色自然突变体[21],在巴西发现的红藻(Gracilaria caudata)褐绿色自然突变体[22],在印度发现的红藻(Gracilaria debilis、Gracilaria edulis)自然绿色突变体[23]等。优良性状自然突变体的产生与积累需要一定的种群规模与特定的选择压力。海南省昌江黎族自治县海尾镇自1998年开始栽培琼枝,至2012年栽培面积达到320.2 hm2。琼枝栽培一直采取营养繁殖的方式,在长达14年的水泥网框式琼枝栽培过程中,为自然突变体的积累提供了条件。本研究中采用选择育种的方法,对耐高光琼枝进行了选育,通过对海区内的自然突变体进行初筛,进而在实验室高光强培养条件下进行定向筛选与鉴定,获得了耐高光琼枝突变体XY-01。 但由于目前尚未了解环境因子对琼枝生长的影响,人工培养条件下琼枝的生长速率低于海区,因而本研究中采用了室内定向筛选与海区培养相结合的方法以加快选育的进程,在较短的时间内获得了耐高光性状稳定的琼枝突变体 XY-01。
3.2 琼枝XY-01的生长特性
叶绿素a、类胡萝卜素和藻胆蛋白是海洋红藻主要的光合色素,光合色素含量影响海藻的光合速率。其中,红藻中影响藻体颜色的色素主要是叶绿素和藻胆蛋白,藻体表现为绿色或红色,可能与叶绿素与藻胆蛋白含量的变化有关。Veeragurunathan等[23]对红藻(Gracilaria debilis)的研究表明,绿色突变体藻体的颜色稳定,且红色野生型藻红蛋白含量高于绿色突变体。本研究中,XY-01和WT也有类似表现,在相同的实验室培养条件下,XY-01的藻红蛋白含量极显著低于WT,同时叶绿素a含量高于WT,因此,XY-01藻体表现为绿色,可能与其叶绿素与藻胆蛋白含量差异有关。
有研究表明,红藻的藻胆蛋白是高效的捕光色素,对绿、黄、橙、红色光具有良好的吸收效果[24]。由于野生琼枝一般生长于较深的海域中,阳光经海水折射和散射后,仅较长波长的光能穿透更深海水被琼枝的藻胆蛋白捕获,并将光能传递给光合反应中心。因此,野生琼枝仅需较弱的光能就能满足生长需求。然而由于近海海域水位变浅、光强增加,人工栽培琼枝的藻胆蛋白可能因捕获到过多的光能从而带给藻体光损伤,但绿色琼枝突变体XY-01则可能通过降低藻胆蛋白的合成并提高叶绿素a的合成来适应高光强的生长环境,因而表现出优于野生型的生长特性。
3.3 琼枝XY-01的应用价值
已有研究表明,红藻的绿色品系或突变体更能适应高光环境。赵素芬等[25]研究发现,长心卡帕藻(Kappaphycus alvarezii)绿色品系最适光量子通量密度为150 μmol/(m2·s),而红色品系最适光量子通量密度仅为30 μmol/(m2·s)。徐燕等[26]研究了不同坛紫菜(Prophyra haitnensis)的色素突变体生长发育状况,发现翠绿色突变体后期生长速率最快。Faria等[27]在较高的驯化下,红藻的绿色突变体能优化光能吸收,并于后期培养中表现出较高的生长率。Fv/Fm是衡量PSⅡ功能的重要指标,反映了光合生物的PSⅡ在光合作用中最大光化学转换效率。藻类的Fv/Fm值约为0.65,当受到外部环境胁迫时其数值显著下降,可直接反映藻类受胁迫的程度[28]。综合本研究中PSⅡ最大光化学转换效率及生长试验结果,XY-01在高光强下比WT表现出较优的光合作用效率和明显的生长优势。因此,绿色琼枝突变体可能更有利于占据更高光强的生态位并在栽培种群中建立优势。
卡拉胶是一种重要的工业和食用原料,是琼枝的重要成分。对于琼枝育种而言,卡拉胶含量是重要的产业相关性状,在筛选耐高光琼枝品系时须保证其经济性状不退化。目前,养殖琼枝的种苗多为营养繁殖获得,其遗传性状单一,本研究中获得的XY-01丰富了栽培种质的遗传多样性,是潜在的育种材料。XY-01具有优良生长速度的同时并未影响其卡拉胶含量,表明栽培XY-01将会带来更好的经济效益,具有推广应用潜力。
4 结论
1)XY-01的最适光量子通量密度与PSⅡ最大光化学转换效率均高于WT,表明XY-01更适宜于高光条件下生长,是琼枝的耐高光藻株。
2)XY-01在海区试验中表现出较高的生长速率,且其含胶量与WT无显著性差异,表明XY-01具有良好的生产性能。
[1] 匡梅,曾呈奎,夏邦美.中国麒麟菜族的分类研究[J].海洋科学集刊,1999(1):168-189,235.
KUANG M,ZENG C K,XIA B M.Taxonomy of Eucheumatoidae in China[J].Studia Marina Sinica,1999(1):168-189,235.(in Chinese)
[2] JIN F J,ZHUO C Q,HE Z,et al.Anti-Herpes simplex virus activity of polysaccharides from Eucheuma gelatinae[J].World Journal of Microbiology and Biotechnology,2015,31(3):453-460.
[3] HA H T,CUONG D X,THUY L H,et al.Carrageenan of red algae Eucheuma gelatinae:extraction,antioxidant activity,rheology characteristics,and physicochemistry characterization[J].Molecules,2022,27(4):1268.
[4] SAITO H,TAMRIN M L.Antimycotic activity of seaweed extracts(Caulerpa lentillifera and Eucheuma cottonii) against two genera of marine oomycetes,Lagenidium spp.and Haliphthoros spp.[J].Biocontrol Science,2019,24(2):73-80.
[5] 马悦欣,许珂,王银华,等.κ-卡拉胶寡糖对仿刺参溶菌酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J].大连海洋大学学报,2010,25(3):224-227.
MA Y X,XU K,WANG Y H,et al.Effects of κ-carrageenan oligosaccharides on activities of lysozyme,alkaline phosphatase and superoxide dismutase of coelomic fluid in sea cucumber Apostichopus japonica[J].Journal of Dalian Ocean University,2010,25(3):224-227.(in Chinese)
[6] QIU X,ZHONG W.Antihyperglycemic and antihyperlipidemic effects of low-molecular-weight carrageenan in rats[J].Open Life Sciences,2018,13:379-384.
[7] BRAKEL J,SIBONGA R C,DUMILAG R V,et al.Exploring,harnessing and conserving marine genetic resources towards a sustainable seaweed aquaculture[J].Plants People Planet,2021,3(4):337-349.
[8] 张剑,徐步欣,郞尚昆,等.海南文昌沿岸大型海藻资源变化及影响因素分析[J].海洋湖沼通报,2022,44(3):129-138.
ZHANG J,XU B X,LANG S K,et al.Resource changes of macroalgae and analysis of their influencing factors in Wenchang coast of Hainan Province[J].Transactions of Oceanology and Limnology,2022,44(3):129-138.(in Chinese)
[9] 何翠翠,张文,魏志远,等.海南省海藻产业发展形势与对策[J].热带农业科学,2019,39(9):107-113.
HE C C,ZHANG W,WEI Z Y,et al.Development situation and measures of seaweed industry in Hainan Province[J].Chinese Journal of Tropical Agriculture,2019,39(9):107-113.(in Chinese)
[10] 杨湘勤,丁敬敬,黄勃,等.琼枝麒麟菜养殖方式及其效益分析[J].渔业现代化,2015,42(6):16-19,25.
YANG X Q,DING J J,HUANG B,et al.The techniques of Eucheuma gelatinae culture model and economic benefit analysis[J].Fishery Modernization,2015,42(6):16-19,25.(in Chinese)
[11] 曾俊,童立豪,吴翔宇,等.不同营养盐条件对琼枝生长的影响[J].渔业科学进展,2021,42(4):168-176.
ZENG J,TONG L H,WU X Y,et al.Effects of different nutrient conditions on the growth of Betaphycus gelatinae[J].Progress in Fishery Sciences,2021,42(4):168-176.(in Chinese)
[12] NISHIHAHA G N,TERADA R.In vitro growth and photosynthesis of three edible seaweeds,Betaphycus gelatinus,Eucheuma serra and Meristotheca papulosa (Solieriaceae,Rhodophyta) [J].Aquaculture Science,2011,59(4):563-571.
[13] 侯萍,陈小燕,李铭,等.海南野生与养殖琼枝麒麟菜形态和成分对比[J].安徽农业科学,2015,43(18):159,166.
HOU P,CHEN X Y,LI M,et al.The morphological comparison and component analysis between the wild and farmed Eucheuma of Hainan[J].Journal of Anhui Agricultural Sciences,2015,43(18):159,166.(in Chinese)
[14] 李继伟,杨贤庆,潘创,等.琼枝麒麟菜的营养成分分析与评价[J].食品与发酵工业,2020,46(15):265-269.
LI J W,YANG X Q,PAN C,et al.Nutritional analysis and evaluation of Eucheuma gelatinae[J].Food and Fermentation Industries,2020,46(15):265-269.(in Chinese)
[15] 卫燕云.海洋酸化、温度和磷对龙须菜光合特性和产胶的影响[D].广州:广州大学,2020:12.
WEI Y Y.Effects of ocean acidification,temperature and phosphorus on photosynthesis and agar yield in Gracilaria lemaneiformis[D].Guangzhou:Guangzhou University,2020:12.(in Chinese)
[16] 童立豪.琼枝组织切段培养及生长特性研究[D].海口:海南大学,2020:17.
TONG L H.Studies on tissue segment culture and growth characteristics of Betaphycus gelatinae[D].Haikou:Hainan University,2020:17.(in Chinese)
[17] KITAJIMA M, BUTLER W L.Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,1975,376(1):105-115.
[18] 付峰.龙须菜紫外诱变育种及抗逆速生优良品系的选育[D].青岛:中国海洋大学,2013:48.
FU F.The ultraviolet mutagenesis breeding and selection of stress tolerance and fast growth strains of Gracilariopsis lemaneiformis[D].Qingdao:Ocean University of China,2013:48.(in Chinese)
[19] 严兴洪,张淑娟,黄林彬.60Co-γ射线对条斑紫菜(Porphyra yezoensis)的诱变效果与色素突变体分离[J].海洋与湖沼,2009,40(1):56-61.
YAN X H,ZHANG S J,HUANG L B.Induction and isolation of pigmentation mutants of Porphyra yezoensis ueda(bangiales,rhodophyta) by 60Co-γ ray irradiation[J].Oceanologia et Limnologia Sinica,2009,40(1):56-61.(in Chinese)
[20] 孟琳,徐涤,陈伟洲,等.龙须菜新品系07-2的筛选及性状分析[J].中国海洋大学学报(自然科学版),2009,39(S1):94-98.
MENG L,XU D,CHEN W Z,et al.Selection and characterization of a new strain of Gracilaria lemaneiformis[J].Periodical of Ocean University of China(Nature Science Edition),2009,39(sup 1):94-98.(in Chinese)
[21] SANO F,MURATA K,NIWA K.Identification,growth,and pigment content of a spontaneous green mutant of Pyropia kinositae (Bangiales,Rhodophyta)[J].Journal of Applied Phycology,2020,32(3):1983-1994.
[22] MARCHI F,PLASTINO E M.Codominant inheritance of polymorphic color mutant and characterization of a bisexual mutant of Gracilaria caudata (Gracilariales,Rhodophyta)[J].Journal of Applied Phycology,2020,32(6):4385-4398.
[23] VEERAGURUNATHAN V,PRASAD K,SINGH N,et al.Growth and biochemical characterization of green and red strains of the tropical agarophytes Gracilaria debilis and Gracilaria edulis (Gracilariaceae,Rhodophyta)[J].Journal of Applied Phycology,2016,28(6):3479-3489.
[24] SIMKIN A J,KAPOOR L,DOSS C G P,et al.The role of photosynthesis related pigments in light harvesting,photoprotection and enhancement of photosynthetic yield in planta[J].Photosynthesis Research,2022,152(1):23-42.
[25] 赵素芬,何培民.光照强度和盐度对长心卡帕藻生长的影响[J].热带海洋学报,2009,28(1):74-79.
ZHAO S F,HE P M.Effects of light intensity and salinity on growth of Kappaphycus alvarezii[J].Journal of Tropical Oceanography,2009,28(1):74-79.(in Chinese)
[26] 徐燕,谢潮添,纪德华,等.坛紫菜品系间杂交分离色素突变体及其特性的初步研究[J].中国水产科学,2007,14(3):466-472.
XU Y,XIE C T,JI D H,et al.Isolation and characterization of strain crossbred pigmentation mutants in Porphyra haitanensis[J].Journal of Fishery Sciences of China,2007,14(3):466-472.(in Chinese)
[27] FARIA A V F,PLASTINO E M.Physiological assessment of the mariculture potential of a Gracilaria caudata (Gracilariales,Rhodophyta) variant[J].Journal of Applied Phycology,2016,28(4):2445-2452.
[28] KOLBER Z,ZEHR J,FALKOWSKI P.Effects of growth irradiance and nitrogen limitation on photosynthetic energy conversion in photosystem II 1[J].Plant Physiology,1988,88(3):923-929.