氧气是动物生存的限制因子,对动物的生长发育及各项生理活动具有重要影响。在同一分压下,水体中的氧含量不足陆地空气的1/20,且氧气在水中的扩散速度仅为空气中扩散速度的1/10 000[1]。因此,水体中的氧气消耗会显著影响水体中的溶解氧(DO)含量。随着全球工业化及城市化规模的进一步扩大,人为活动造成的陆源污染物大量排入江河湖海,溶解氧被大量消耗,使世界大面积海域成为溶解氧含量低于2 mg/L的低氧区[2]。水体含氧量的下降会引起鱼体代谢紊乱、氧化应激和组织损伤等一系列应激响应,甚至导致其死亡。
肝脏作为低氧响应敏感组织而成为研究热点。Zhang等[3]在对瓦氏黄颡鱼(Pelteobagrus vachelli)的低氧研究中,通过验证糖酵解相关酶和氧化酶活性,发现低氧可引起肝脏无氧代谢的增强并伴有有氧代谢的抑制。对金鱼(Carassius auratus)进行低氧胁迫处理30 d后,同样得到了肝脏无氧代谢水平提高的相似结论[4]。对军曹鱼(Rachycentron canadum)研究发现,鱼类肝脏在低氧条件下会出现抗氧化酶活性及抗氧化防护能力降低的状况[5]。目前,低氧胁迫相关研究普遍集中于急性或短期低氧研究,而长期低氧胁迫对鱼类肝脏糖脂代谢的研究鲜见报道。
已有研究表明,低氧环境是诱导产生非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的重要因素[6]。对于NAFLD的发病机制,主要有两种假说:一是Day等[7]在1998年提出的“二次打击”学说,即脂质代谢紊乱和胰岛素抵抗对肝脏造成一定损伤后,引发氧化应激,进一步加重肝脏损伤;二是近年来形成的“多重打击”学说[8],即NAFLD是由胰岛素抵抗、脂肪组织分泌的激素、营养因素、肠道微生物群及遗传等多种因素共同作用导致的。而长期低氧与NAFLD的联系,以及长期低氧诱发NAFLD的分子机制等相关问题,迄今均尚未解决。
转录组测序技术具有高通量、高准确性和可重复性的优势,已为水生动物生长发育、抗病免疫和环境应激等方面的研究提供了有力工具[9]。本研究中,针对长期低氧条件下的斑马鱼(Danio rerio),通过分析其肝脏转录组水平变化,并结合光镜和电镜观察,从宏观和微观角度,探究长期低氧对斑马鱼肝脏结构及糖脂代谢功能的影响,长期低氧胁迫与NAFLD相关性,以及斑马鱼应对长期低氧环境的适应机制,以期为深度挖掘鱼类的低氧适应机制提供科学参考。
1 材料与方法
1.1 材料
试验样本为大洋渔业资源可持续开发教育部重点实验室培育多代的野生型斑马鱼(WT),培育水温为28 ℃,光照周期为12 D∶12 L。
1.2 方法
1.2.1 试验设计 本研究中试验方案由上海海洋大学科学伦理委员会授权(SHOU-DW-20171022)。
低氧条件通过不断向水中注入氮气来实现。使用便携式溶解氧仪(YSI Pro20)定期测量DO水平。根据先前对斑马鱼的缺氧研究[10],本试验中设置长期低氧组和常氧组,DO质量浓度分别为(1.5±0.2)、(6.5±0.2)mg/L。所有样本由同一对亲本繁殖,并将受精卵随机平均分为两组,每组养殖斑马鱼20尾。驯化6个月后取斑马鱼各15尾,于冰上麻醉后解剖取其肝脏组织。以3尾斑马鱼作为一个试验单位进行后续试验,在转录组及实时荧光定量PCR(RT-qPCR)试验中,每组样本设置3个重复。N-1、N-2和N-3分别表示常氧组的3个生物学重复;H-1、H-2和H-3分别表示低氧组的3个生物学重复。
1.2.2 光镜和电镜观察 分别从常氧组与长期低氧组取3尾斑马鱼,麻醉后解剖取其肝脏组织,并固定于体积分数为4%的多聚甲醛溶液中。经石蜡包埋、切片后进行HE(Hematoxylin-Eosin)染色,分别在100倍和200倍放大镜下观察肝脏的细胞形态。
1.2.3 RNA的提取、cDNA文库建立和测序 分别从常氧组与长期低氧组中取9尾斑马鱼,每组将3尾斑马鱼的肝脏组织混合为一个样本,共设3个生物学重复。使用Trizol RNA抽提试剂盒(Invitrogen,Carlsbad,CA,USA)提取每个样本的总RNA。利用生物分析仪系统评估RNA的完整性和浓度(OD260 nm/OD280 nm的范围为1.8~2.1)。使用文库制备试剂盒(VAHTS Stranded mRNA-seq Library Prep Kit,Illumina)构建cDNA文库。利用Illumina hiseqtm 2000 测序仪 (San Diego,CA,USA)分别对两组的3个平行样本进行转录组测序。采用双端测序,测序分析的读取长度为150 bp。
1.2.4 差异基因分析 通过Trimmomatic 0.33软件获得双端clean reads。具体参数:AVGQUAL为20,TRAILING为20,MINEN为50。利用HISAT 2将所有的clean reads映射到参考基因序列(http://ftp.ensembl.org/pub/release-105/gtf/danio_rerio/)[11]。以GRCz11作为参考基因组。
在Cufflinks 软件的默认设置下,计算每个样本的基因表达水平,以确定每个基因每千个碱基转录物中每百万个映射片段的reads(fragments per kilobase of exon model per million,FPKM)。利用EdgeR 3.26.8软件筛选常氧组和低氧组之间肝脏组织中的差异基因。以|log2(fold change)|>1和adjusted P<0.002作为差异基因筛选标准。为防止多次平行试验中出现较高的错误发现率(false discovery rate,FDR),试验还对FDR控制的q值进行了计算,并进一步剔除q>0.05的差异基因。利用R软件中的ClusterProfiler 包进行基于超几何分布计算的GO功能富集和KEGG通路富集分析[12]。
1.2.5 实时荧光定量PCR验证 为验证RNA-Seq分析结果,随机选取6个差异基因进行RT-qPCR验证,将靶基因的表达水平标准化为β-肌动蛋白的表达,每个基因进行3个生物学重复和3个技术重复。总RNA提取自常氧组和长期低氧组的斑马鱼肝脏组织。按照反转录试剂盒(北京擎科生物科技有限公司)说明书步骤操作,以RNA合成的cDNA作为RT-qPCR的模板。采用2×T5快速qPCR混合试剂盒(SYBR Green,北京擎科生物科技有限公司)在cfx96荧光定量PCR仪(BioRad,Hercules,CA,USA)上对基因进行定量分析。PCR反应过程:95 ℃下预变性1 min;95 ℃下循环变性10 s,56 ℃下退火复性10 s,共进行40个循环。采用2-△△Ct方法计算每个样本的相对表达量[13]。使用Microsoft Excel软件进行Pearson相关分析,以评估RNA-Seq数据与RT-qPCR测量之间的关系强度。相关引物的详细信息见表1。
表1 试验所用引物
Tab.1 Primers used in this study
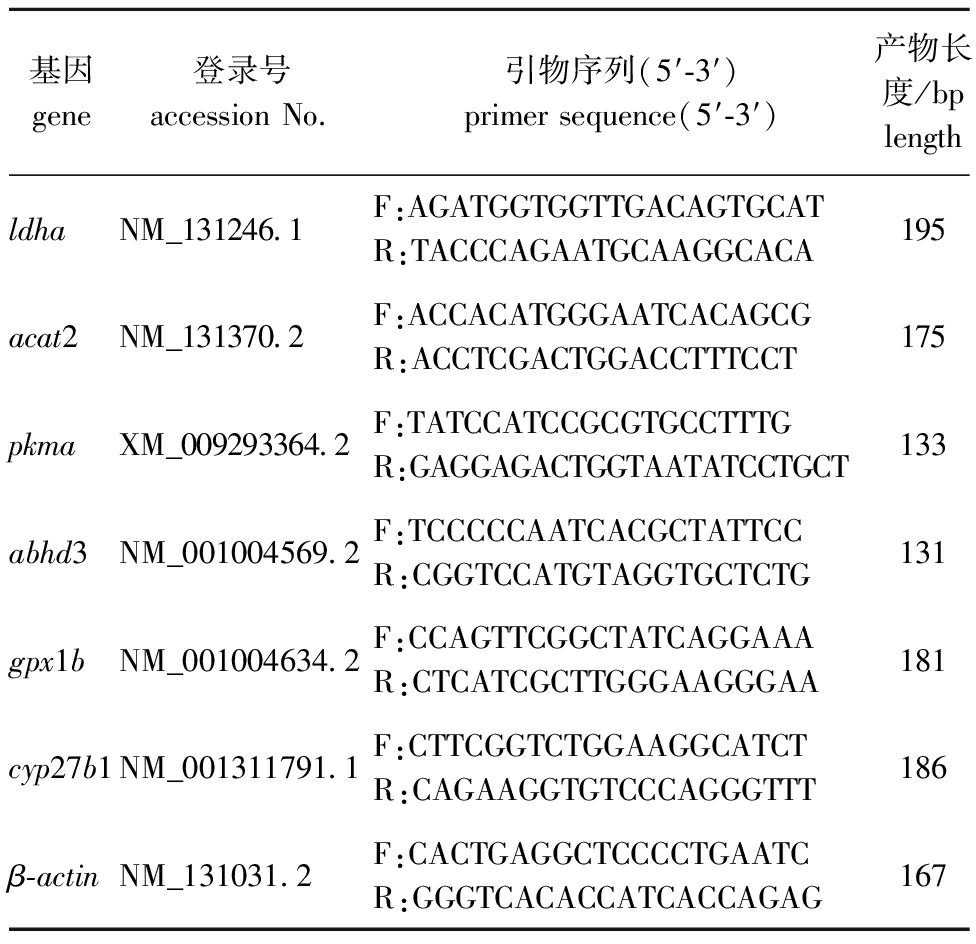
基因gene登录号accession No.引物序列(5′-3′)primer sequence(5′-3′)产物长度/bplengthldhaNM_131246.1F:AGATGGTGGTTGACAGTGCATR:TACCCAGAATGCAAGGCACA195acat2NM_131370.2F:ACCACATGGGAATCACAGCGR:ACCTCGACTGGACCTTTCCT175pkmaXM_009293364.2F:TATCCATCCGCGTGCCTTTGR:GAGGAGACTGGTAATATCCTGCT133abhd3NM_001004569.2F:TCCCCCAATCACGCTATTCCR:CGGTCCATGTAGGTGCTCTG131gpx1bNM_001004634.2F:CCAGTTCGGCTATCAGGAAAR:CTCATCGCTTGGGAAGGGAA181cyp27b1NM_001311791.1F:CTTCGGTCTGGAAGGCATCTR:CAGAAGGTGTCCCAGGGTTT186β-actinNM_131031.2F:CACTGAGGCTCCCCTGAATCR:GGGTCACACCATCACCAGAG167
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示。采用R 4.1.3软件进行数据统计及相关性分析,显著性水平设为0.05,极显著水平设为0.01。
2 结果与分析
2.1 斑马鱼肝脏组织的光镜观察
常氧组斑马鱼的肝脏细胞平滑,呈多角形,排列整齐,细胞核多呈圆形,位于细胞中央(图1A);大量肝血窦存在于肝脏细胞之间,血窦内可见大量红细胞分布,部分肝脏细胞质内有外表光滑而明亮的圆形脂滴(图1B)。而长期低氧组斑马鱼肝脏细胞外形不规则,杂乱排列,多数细胞出现空泡化,部分细胞出现气球样变,细胞核偏离细胞中央,贴近细胞膜(图1C);部分肝脏细胞出现核萎缩(图1D),肝血窦数量减少,血窦内仅有少量红细胞分布,并出现少量炎性细胞浸润现象(图1D,Ⅶ)。
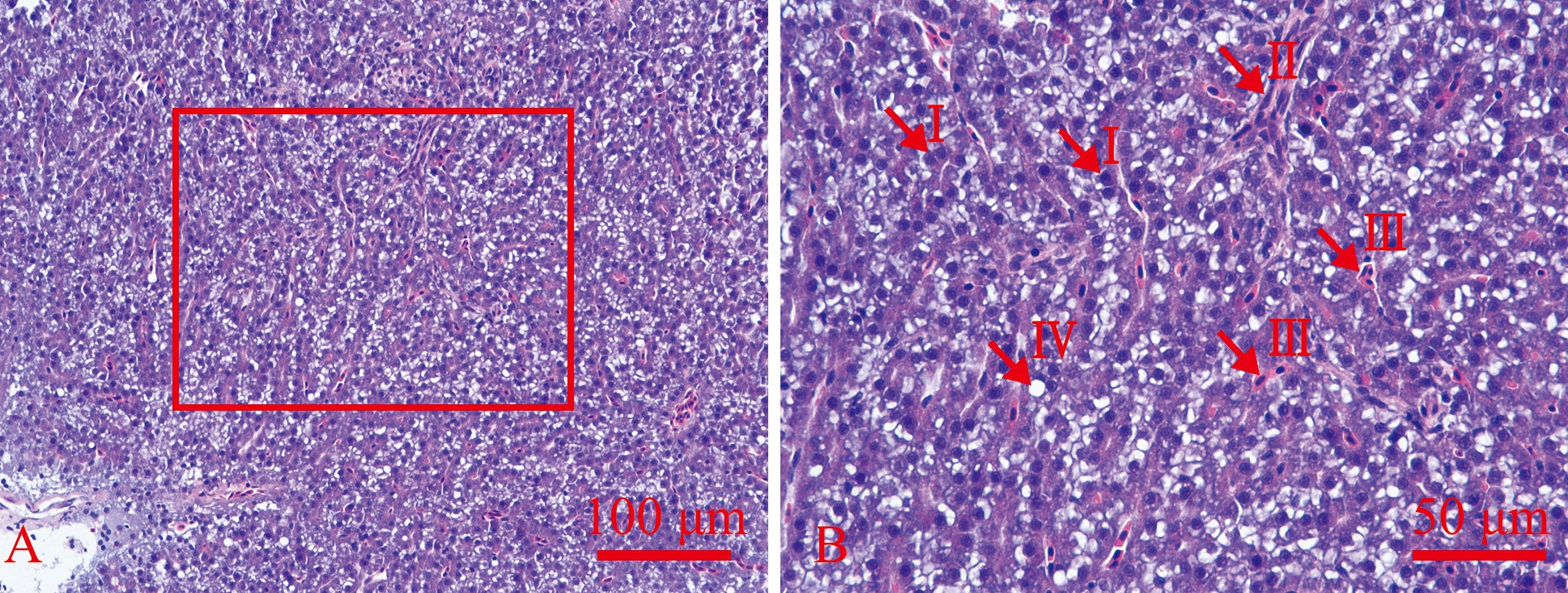
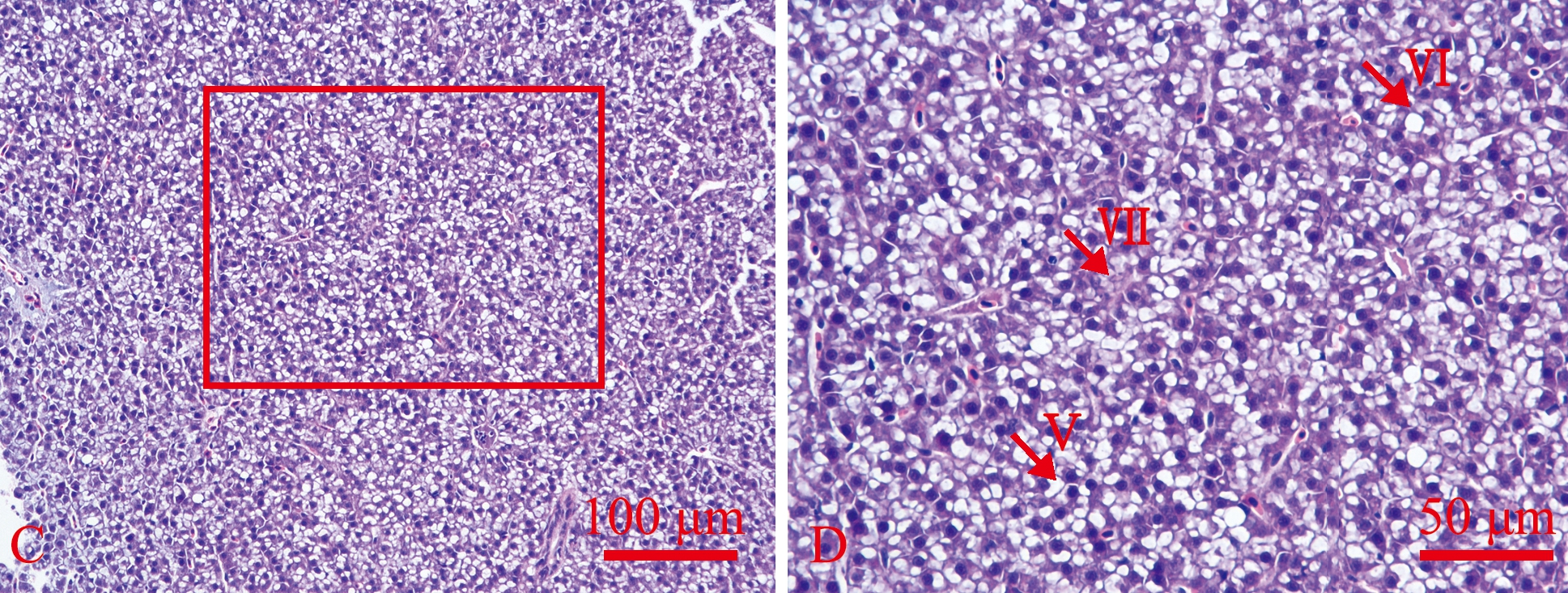
A—常氧组;B—A图中方框的局部放大;C—长期低氧组;D—C图中的局部放大。Ⅰ—细胞核,Ⅱ—肝血窦,Ⅲ—红细胞,Ⅳ—圆形脂滴,Ⅴ—空泡化的肝细胞,Ⅵ—萎缩的肝细胞核,Ⅶ—炎性细胞浸润。
A—normoxia group;B—enlargement of the box in the Fig.A;C—long-term hypoxia group;D—enlargement of the box in the Fig.C. Ⅰ—nucleus,Ⅱ—hepatic blood sinusoid,Ⅲ—red blood cell,Ⅳ—round lipid droplet,Ⅴ—vacuolated hepatocytes,Ⅵ—atrophied hepatocyte nuclei,Ⅶ—inflammatory cell infiltration.
图1 长期低氧组和常氧组斑马鱼肝脏组织形态(HE染色)
Fig.1 Histomorphology of the liver of Danio rerio in the long-term hypoxia acclimated and the normoxia groups(HE staining)
2.2 斑马鱼肝脏组织的电镜观察
对比长期低氧组和常氧组斑马鱼肝脏的电镜切片后发现,长期低氧对肝细胞形态和内部细胞器结构均有较大影响,并呈现较大差异。常氧组斑马鱼的肝脏细胞大小匀称、形状规则、排列整齐,细胞核一般分布于细胞中心 (图2A);细胞膜光滑,细胞器结构清晰,均匀分布在细胞质内(图2B);滑面内质网大量分布于细胞膜附近,呈片层状排列(图2C),线粒体呈棒状或椭球形分布在粗面内质网附近,双层膜结构清晰可辨,线粒体内嵴较多且排列整齐(图2C)。而低氧组斑马鱼的肝脏细胞外形不规则,多数细胞核偏离细胞中心位置,贴近细胞膜,细胞质基质中出现多个大面积亮区(图2D);细胞膜粗糙,有明显不规则突起,细胞器结构不清晰且分布不均(图2E);滑面内质网排列杂乱,线粒体明显膨胀为球形,内部结构模糊;同时,与过氧化物合成代谢密切相关的过氧化物酶体数量也明显上升,其多分布于线粒体和内质网附近(图2F)。结合光镜结果发现,低氧组斑马鱼肝脏细胞存在较多的脂质堆积和明显的脂肪性病变。

A~C—常氧组;D~F—长期低氧组。Ⅰ—肝细胞核;Ⅱ—肝糖原;Ⅲ—粗面内质网;Ⅳ—滑面内质网;Ⅴ—线粒体;Ⅵ—过氧化物酶体。
A-C—normoxia group;D-F—long-term hypoxia group.Ⅰ—hepatocyte nucleus;Ⅱ—liver glycogen;Ⅲ—rough endoplasmic reticulum;Ⅳ—smooth endoplasmic reticulum;Ⅴ—mitochondrion;Ⅵ—peroxisome.
图2 长期低氧组和常氧组斑马鱼肝脏细胞的超显微结构
Fig.2 Ultrastructure of the liver of Danio rerio in the long-term hypoxia acclimated and the normoxia groups
2.3 长期低氧造成的基因表达差异
对两组斑马鱼肝脏样品测序分别得到3个转录组数据:18.1、11.2、12.6 Gbp(低氧组)和8.3、9.0、7.2 Gbp(常氧组)。经过数据分析和质量过滤后分别得到967 100、1 358 991、1 478 980个clean reads(低氧组)和1 023 145、1 167 706、783 363个clean reads(常氧组)。表达基因数共13 966个。以|log2(fold change)|>1和P<0.002为标准进行差异基因筛选,长期低氧组与常氧组斑马鱼肝脏组织中共筛选出差异表达基因362个,其中,203个基因上调,159个基因下调。
对差异基因进行主成分分析显示,通过PC1成分的正负值即可将常氧组与长期低氧组的差异基因完全区分开。这表明,不同处理组间的差异基因表达存在显著性差异,且长期低氧组中3个样本的分布较常氧组更为分散(图3),这可能是由于不同个体对长期低氧环境适应能力有所差异导致。
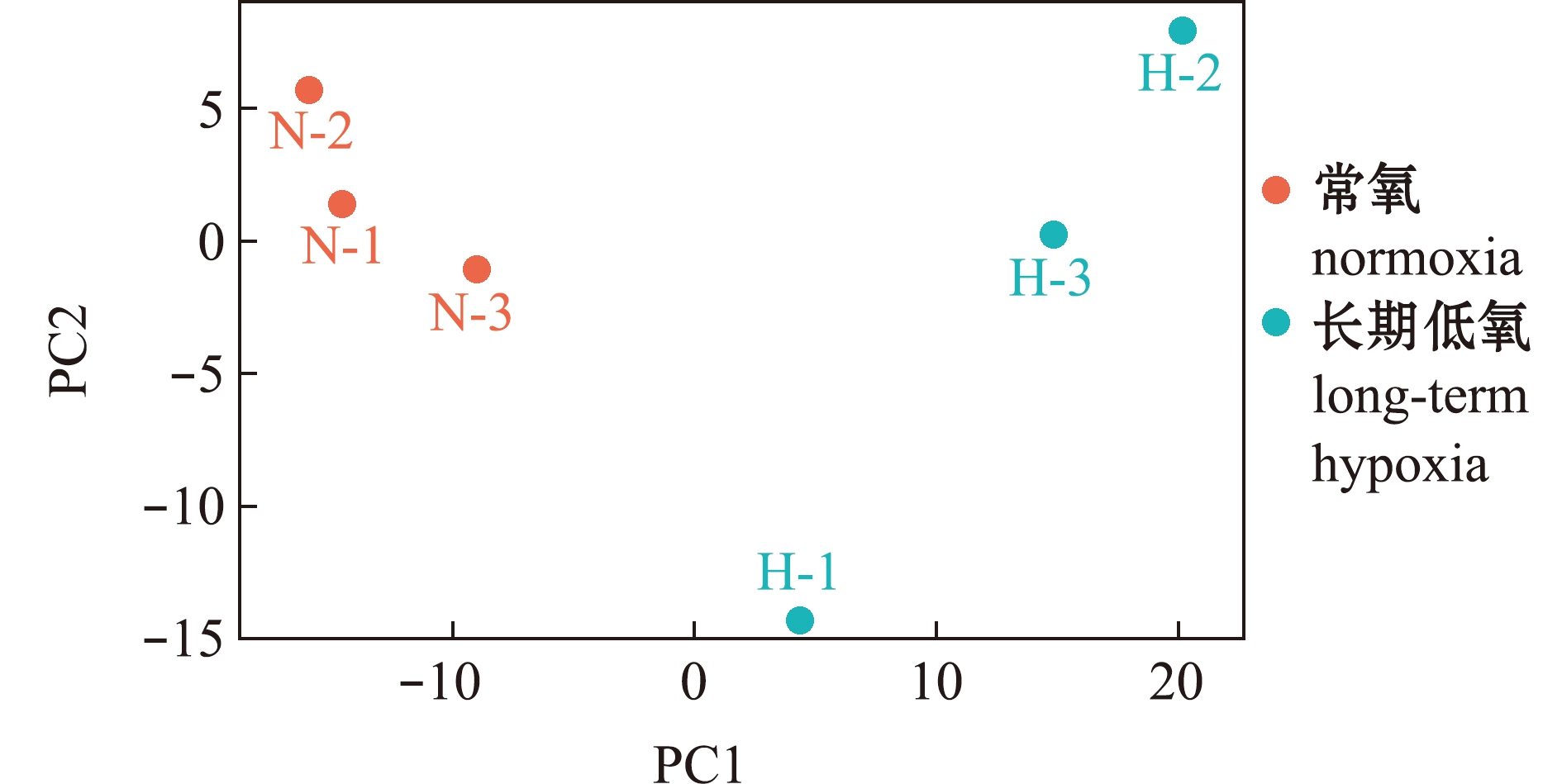
图3 PCA主成分分析
Fig.3 Principal component analysis (PCA)
2.4 基因富集分析
GO富集分析显示,362个差异基因共富集到2个主要功能类别:生物过程(biological process,BP)和细胞成分(cellular component,CC),分别包括16和2个子类别。在生物过程类别中,差异基因在一元羧酸代谢过程(GO:0032787)、脂质生物合成过程(GO:0008610)、有机酸转运(GO:0015849)、低氧应激(GO:0001666)、对氧气水平降低的相应(GO:0036293)和羧酸转运(GO:0046942)等中等显著富集;在细胞成分类别中,差异基因仅在PML小体(GO:0016605)和膜的外在成分(GO:0019898)中等显著富集(图4),其中,PML小体相关基因表现为极显著富集。
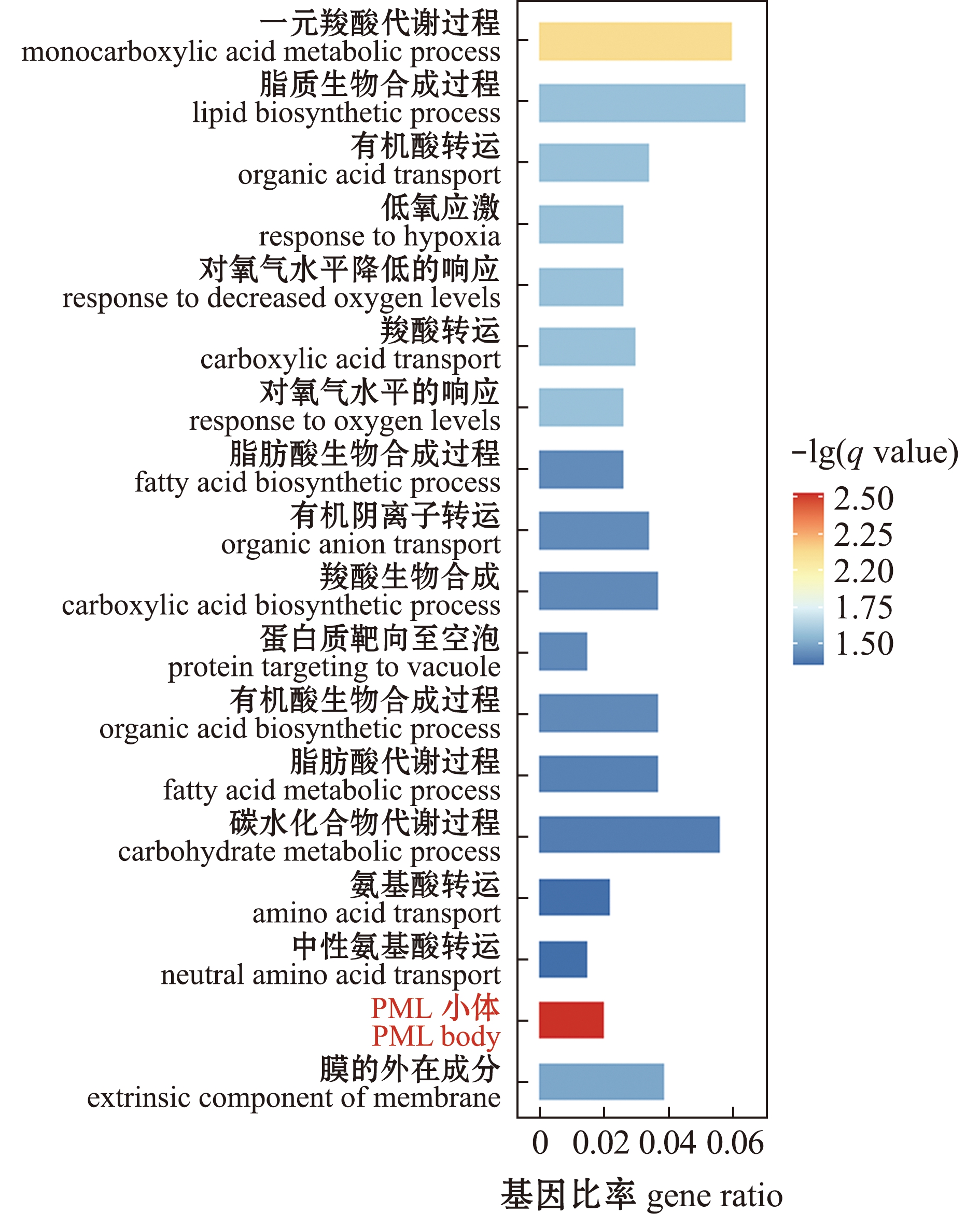
图4 GO富集分析
Fig.4 GO enrichment analysis
对203个上调和159个下调的差异基因进行KEGG分析,下调差异基因中未得到富集通路,上调差异基因主要富集于6条表达显著上调的通路中,包括碳代谢、脂肪酸代谢、谷胱甘肽代谢、丙酮酸代谢、PPAR信号通路和胰岛素信号通路(图5)。
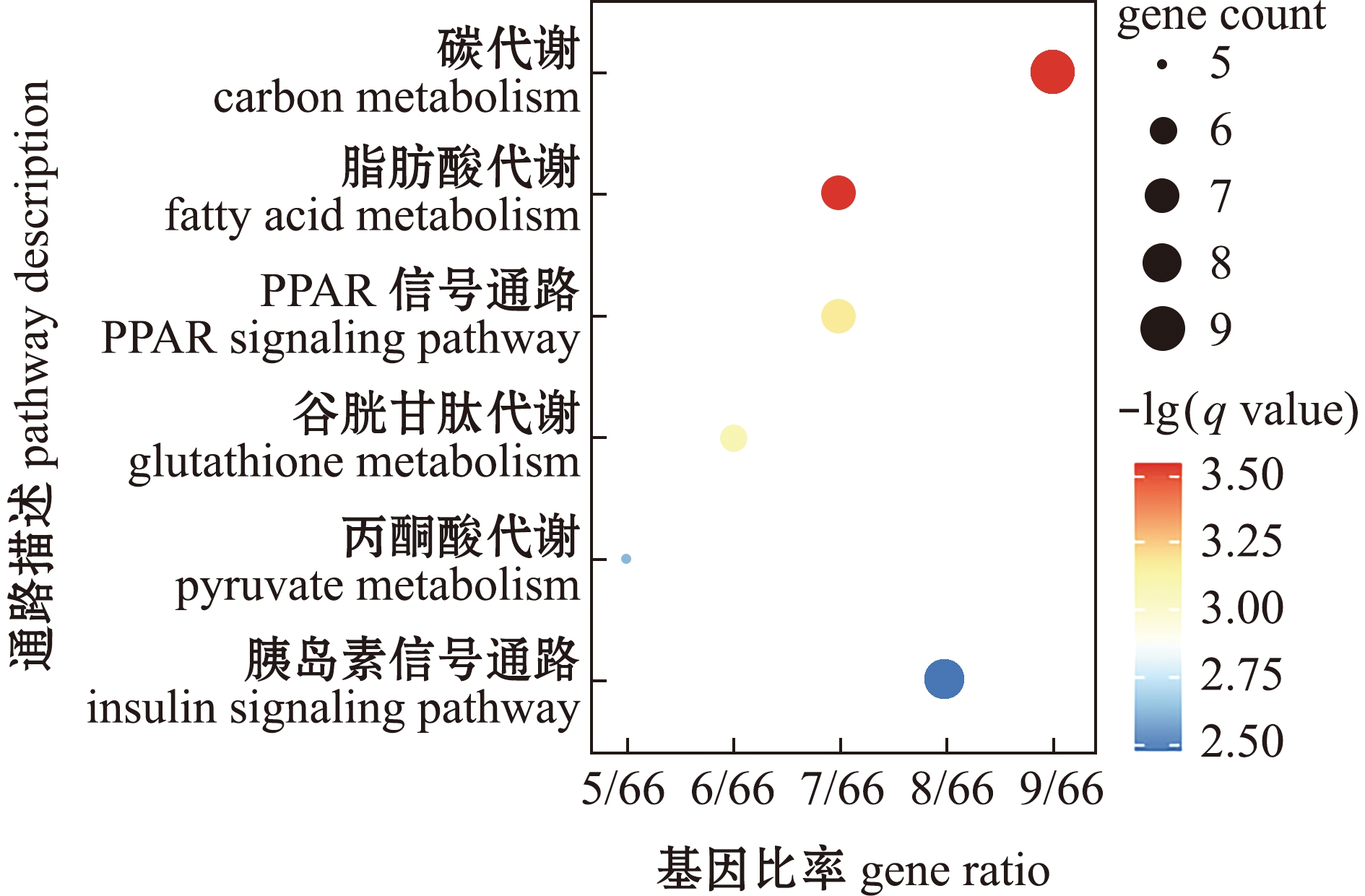
图5 KEGG通路富集分析
Fig.5 KEGG enrichment pathway analysis
对各组基因表达量进行均一化处理后分别绘制这6条通路的表达热图(图6)。富集途径主要涉及信号转导和糖脂代谢,与GO富集分析结果一致,碳代谢和脂肪酸代谢通路富集程度明显,且所占基因比率较大,分别有9个和7个基因富集于这两个通路。根据GO和KEGG富集结果发现,长期低氧胁迫对斑马鱼肝脏的影响主要集中于碳代谢、脂肪酸代谢和PML小体类别(图4、图5),这3条主要富集通路中的关键差异基因如表2所示,从低氧与常氧的读数比值可见,两条代谢通路中的基因表达量均显著上调,且P值均远小于0.05的显著性水平,故试验结果具有可靠性。

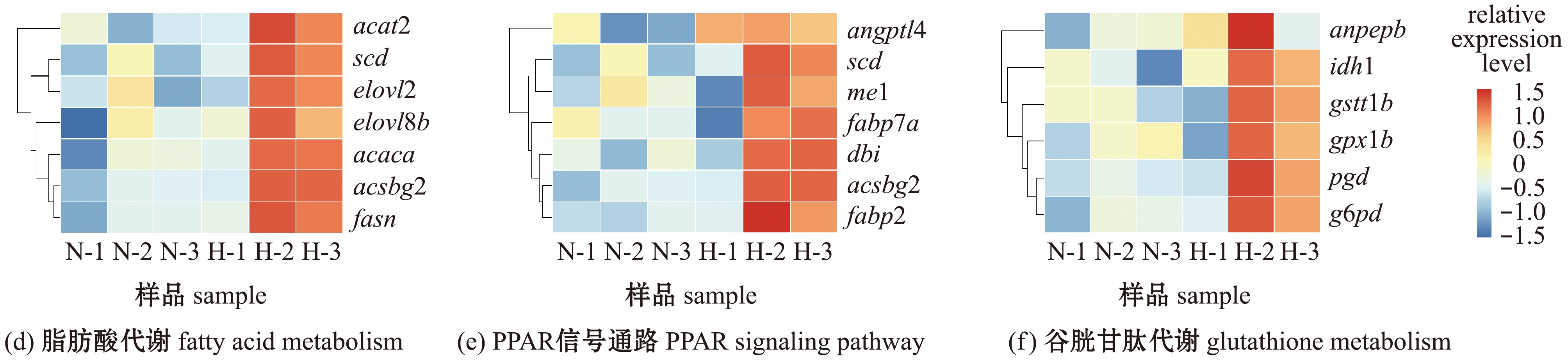
图6 KEGG通路的热图分析
Fig.6 Heat map analysis of KEGG pathways
表2 3个显著富集通路/类别中涉及的差异基因
Tab.2 List of DEGs involved in the three significantly enriched pathways or terms
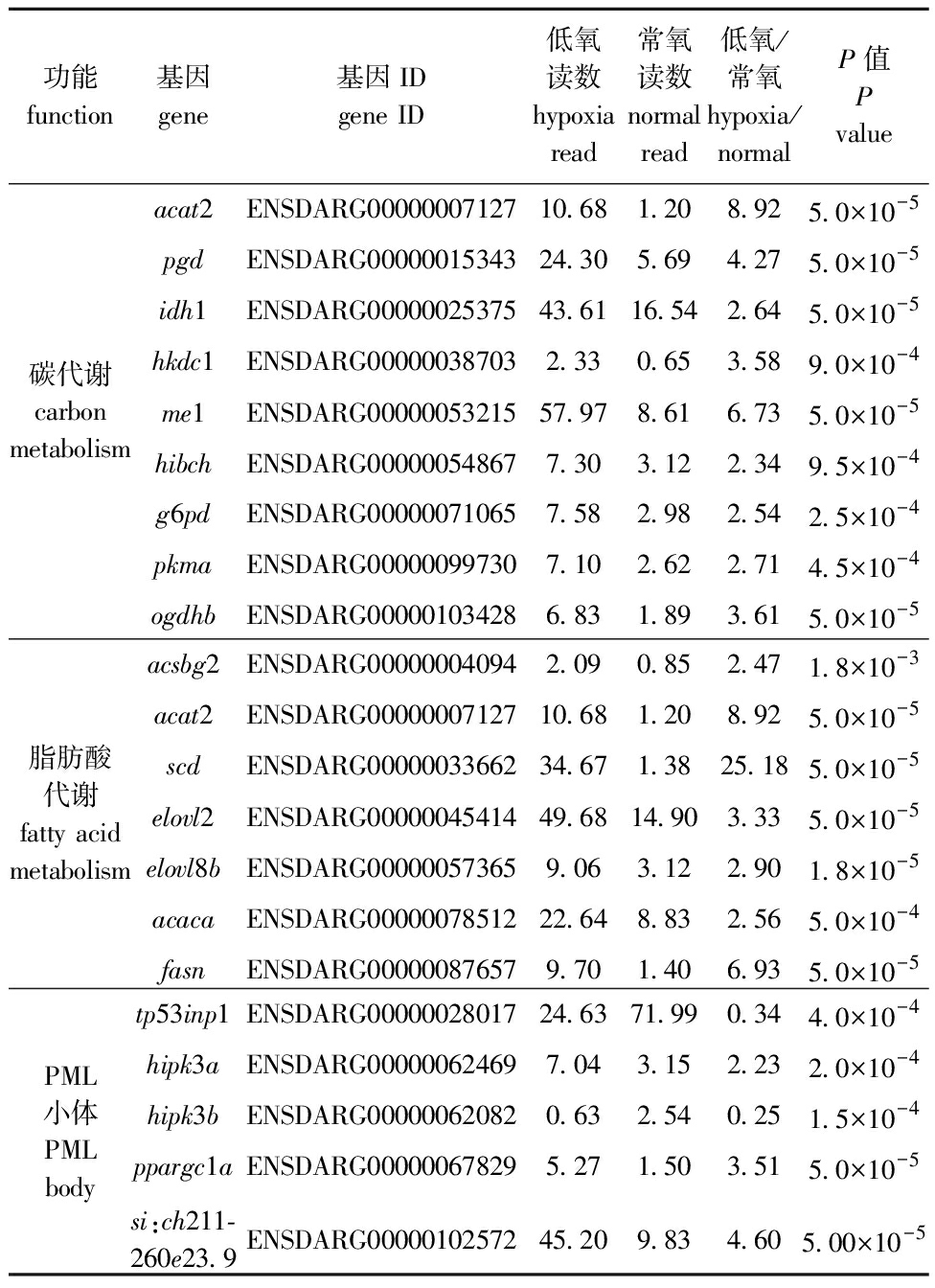
功能function基因gene基因IDgene ID低氧读数hypoxia read常氧读数normal read低氧/常氧hypoxia/normal P值P value碳代谢carbon metabolismacat2ENSDARG0000000712710.681.208.925.0×10-5pgdENSDARG0000001534324.305.694.275.0×10-5idh1ENSDARG0000002537543.6116.542.645.0×10-5hkdc1ENSDARG000000387032.330.653.589.0×10-4me1ENSDARG0000005321557.978.616.735.0×10-5hibchENSDARG000000548677.303.122.349.5×10-4g6pdENSDARG000000710657.582.982.542.5×10-4pkmaENSDARG000000997307.102.622.714.5×10-4ogdhbENSDARG000001034286.831.893.615.0×10-5脂肪酸代谢fatty acid metabolismacsbg2ENSDARG000000040942.090.852.471.8×10-3acat2ENSDARG0000000712710.681.208.925.0×10-5scdENSDARG0000003366234.671.3825.185.0×10-5elovl2ENSDARG0000004541449.6814.903.335.0×10-5elovl8bENSDARG000000573659.063.122.901.8×10-5acacaENSDARG0000007851222.648.832.565.0×10-4fasnENSDARG000000876579.701.406.935.0×10-5PML小体PML bodytp53inp1ENSDARG0000002801724.6371.990.344.0×10-4hipk3aENSDARG000000624697.043.152.232.0×10-4hipk3bENSDARG000000620820.632.540.251.5×10-4ppargc1aENSDARG000000678295.271.503.515.0×10-5si:ch211-260e23.9ENSDARG0000010257245.209.834.605.00×10-5
2.5 PML小体的富集
PML小体由早幼粒细胞白血病蛋白(promyelocytic leukemia protein,PML)装配,集中存在于细胞核中,作为一种肿瘤抑制蛋白,与细胞的衰老密切相关。长期低氧引起了PML小体的GO显著富集(图4),为探究PML小体富集原因,分别对富集于此类别的基因(tp53inp1、hipk3a、hipk3b、si: ch211-260e23.9和ppargc1a)与碳代谢相关基因和脂肪酸代谢相关基因进行相关性分析,涉及相关性检测的基因见表2。
在PML小体与碳代谢的相关性分析中,PML小体相关基因与碳代谢相关基因普遍呈现较强的正相关关系(图7(a))。其中,hipk3b与控制线粒体氧化的pkma、hibch基因呈显著负相关(P<0.05),表明其与线粒体内能量代谢过程有拮抗关系;ppargc1a、hipk3a与碳代谢相关基因多数达到相关性系数>0.5的正相关关系,这两个基因均与维持细胞葡萄糖稳态的hkdc1基因呈极显著正相关关系(P<0.01);si:ch211-260e23.9除与碳代谢相关基因间多数形成显著正相关关系外,与me1、g6pd和gpd等控制糖代谢中脱氢酶类活化的基因存在极显著正相关(P<0.01)(图7(a))。
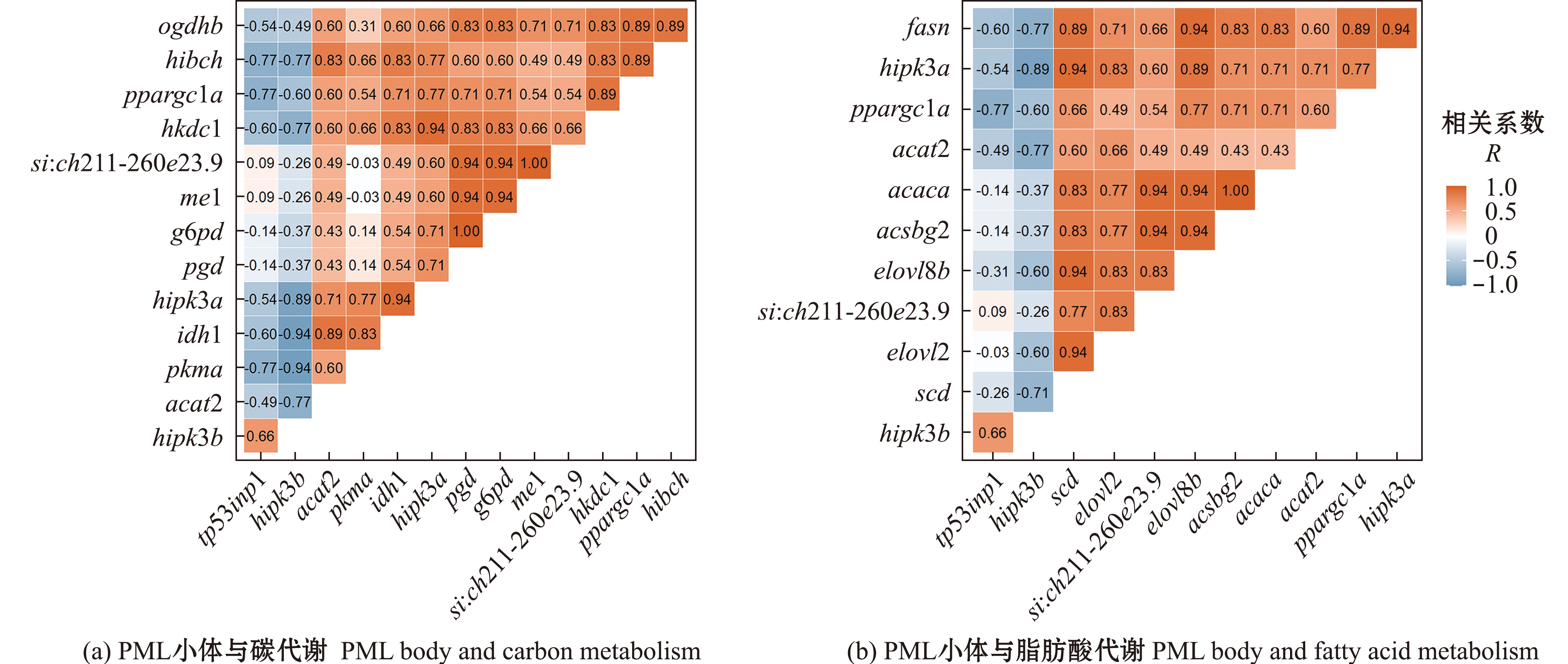
图7 PML小体与碳代谢、脂肪酸代谢的Pearson相关性分析
Fig.7 Pearson correlation analysis of PML body with the carbon metabolism and fatty acid metabolism
在PML小体与脂肪酸代谢的相关分析中,PML小体相关基因与脂质代谢相关基因同样普遍呈现较强的正相关关系(图7(b))。其中,hipk3a与脂质代谢相关基因的相关性较强,且与脂肪合成相关基因scd和elovl2呈显著正相关(P<0.05);si: ch211-260e23.9与脂质代谢相关基因普遍形成正相关关系,且均与脂肪酸合成相关基因acsbg2、acaca呈极显著正相关(P<0.01)(图7(b))。
2.6 转录组数据的RT-qPCR验证
利用RT-qPCR随机验证了6个差异基因的表达情况。在这些随机选择的差异基因中RT-qPCR结果与RNA-seq结果具有相似的表达情况(图8)。RT-qPCR和RNA-seq数据间的Pearson相关系数(R)为0.92(|R|≥0.7时,两个变量之间有较强的相关性),表明本研究中的转录组数据具有可靠性,筛选出的差异基因具有准确性。
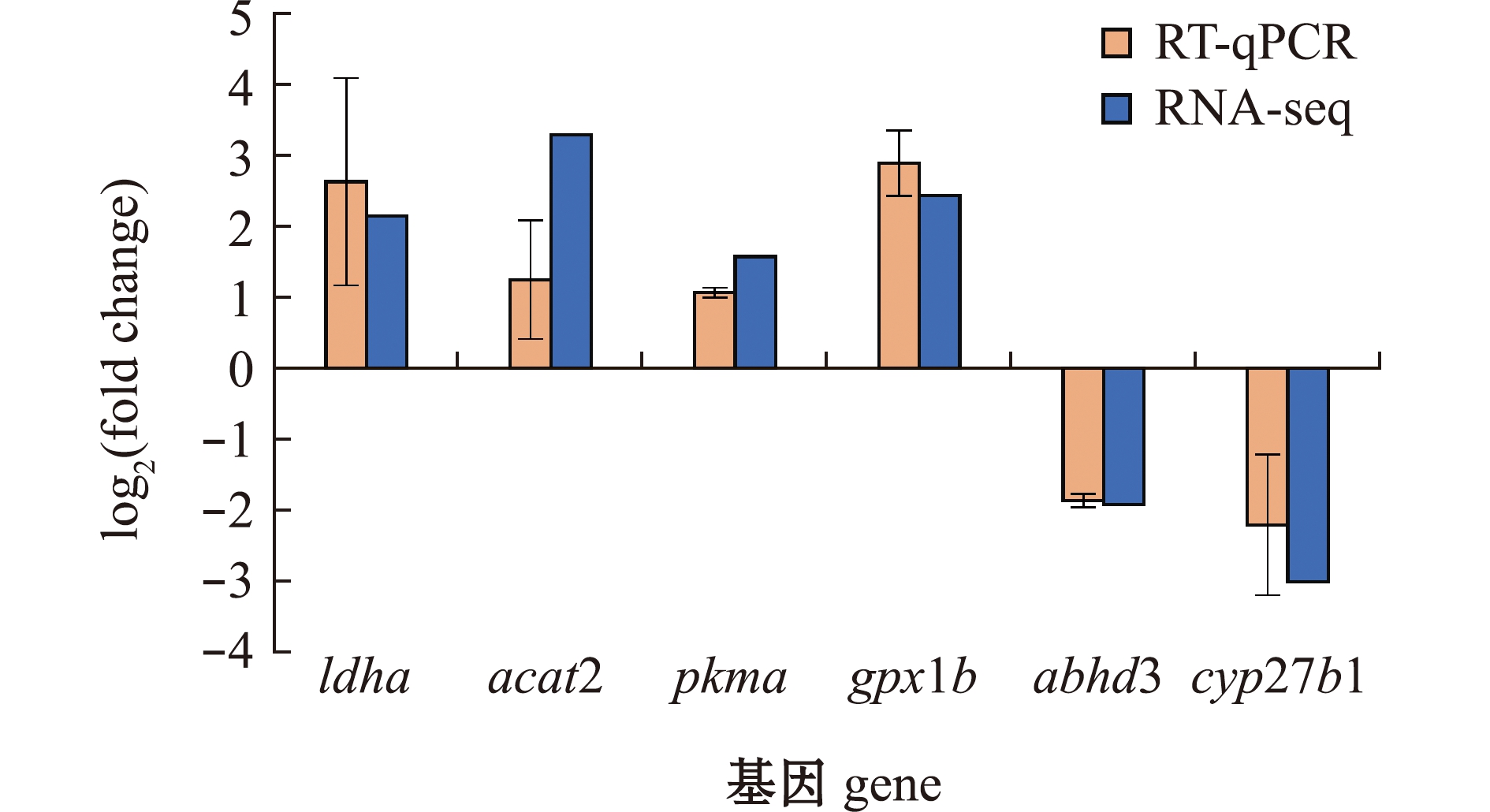
图8 差异基因在RNA-seq和RT-qPCR中的表达比较
Fig.8 Trends of differentially expressed genes in RNA-seq and RT-qPCR
3 讨论
3.1 长期低氧与NAFLD的关系
大量研究表明,间歇性缺氧导致的组织缺氧可能引起胰岛素抵抗、肝脏脂质代谢功能障碍和肝脏脂肪病变等不良影响,且均与NAFLD的形成有关,慢性间歇性低氧已成为NAFLD发生发展的独立危险因素[14]。肝脏作为机体能量代谢的重要场所,肝细胞内富含大量与糖代谢有关的线粒体,以及与蛋白质、脂质代谢有关的内质网等细胞器。本研究中,长期低氧胁迫的斑马鱼肝脏中出现大量脂质堆积,线粒体结构明显受损,过氧化物酶体显著增加,说明长期低氧影响了斑马鱼肝脏脂质及糖类的正常代谢,大量过氧化物酶体的出现则说明肝脏细胞中有大量过氧化物积累,符合NAFLD的病理特征。由此推测,长期低氧容易诱发NAFLD的形成。
3.2 长期低氧诱发NAFLD的分子机制
3.2.1 长期低氧造成肝脏脂质积累和胰岛素抵抗的产生 Day等[7]研究发现,由脂质积累和胰岛素抵抗引起的氧化应激和脂质过氧化及其相互作用,是引发NAFLD的主要原因。鱼类暴露于低氧环境时呼吸代谢最先受到影响。在低氧环境对水生生物呼吸代谢的影响研究中,急性低氧和长期低氧方面均有涉及。在急性低氧(2 mg/L)暴露的最初24 h内,大黄鱼(Larimichthys crocea)的有氧代谢受到抑制,无氧代谢增强,24 h后无氧代谢逐渐减弱[15]。持续30 d的慢性低氧胁迫后发现,乳酸脱氢酶含量在金鱼体内显著上升,无氧代谢增强[4]。Borowiec等[16]将鳉(Fundulus heteroclitus)分为急性低氧组、持续低氧组和间歇低氧组进行试验,发现在胁迫的18 h内,仅急性低氧组肝脏中乳酸含量显著上升。本研究中,KEGG富集分析发现,碳代谢和丙酮酸代谢通路相关基因显著上调(图6(a)、(b))。丙酮酸通路中的关键物质丙酮酸经过无氧呼吸后还原为乳酸,其中,激活L-乳酸脱氢酶活性的ldha基因明显上调,表明斑马鱼为适应长期低氧环境,依靠主动提高无氧代谢以减少氧气的消耗。乳酸脱氢酶能催化丙酮酸成为乳酸,该酶被认为是无氧呼吸的标志酶,其活力大小在一定程度上反映了无氧代谢的高低[17]。无氧呼吸产生大量乳酸,使组织中H+浓度升高,pH降低,产生的活性氧自由基(ROS)会攻击线粒体,抑制线粒体β氧化,导致线粒体功能紊乱。有研究表明,长期低氧会导致细胞内线粒体呼吸链受阻,这与本研究结果一致[18]。本研究中,GO富集分析发现,促进乳酸代谢与一元羧酸代谢相关的abat、acat2、pgd、idh1等基因显著上调,表明长期无氧呼吸造成大量乳酸堆积,机体通过增强一元羧酸的转运,提高乳酸代谢速率,以缓解乳酸堆积。尽管如此,鱼体也难以保持组织内部的稳态环境,正如电镜中观察到的大多数线粒体受ROS攻击后出现了功能障碍的外在表现,即线粒体外形膨胀呈球形、内部混浊嵴排列杂乱且结构不清晰(图2)。
肝脏是脂质代谢的重要场所,其含有的肝糖原和脂质是机体能量的主要来源,也是受到外界环境胁迫后最先做出响应的器官之一。肝脏细胞线粒体β氧化障碍,影响了细胞对脂肪酸的摄取、利用和分解代谢,进一步造成了细胞内脂质和游离脂肪酸的堆积。这一点在本研究中也得到了验证(图2),KEGG富集分析也发现,胰岛素信号通路显著上调(图6(c))。已有研究证明,线粒体功能障碍与胰岛素抵抗密切相关[19]。正常状态下,胰岛素促进肝脏脂肪合成,同时抑制糖异生进而降低肝脏葡萄糖产生;胰岛素抵抗状态下,糖异生途径对正常分泌的胰岛素不敏感,胰岛素抑制肝脏葡萄糖产生的作用降低导致肝脏葡萄糖积累,而肝脏脂肪合成仍保持较高水平[20-21],宏观表现在肝脏细胞中脂质大量积累。综上,长期低氧胁迫的斑马鱼肝脏细胞中线粒体β氧化过程受到抑制,导致脂质代谢异常,造成脂质积累,进而导致胰岛素抵抗,加剧脂质堆积,胰岛素抵抗与脂质代谢相互促进、相互影响,造成了诱发NAFLD的最初原因。
3.2.2 长期低氧促使氧化应激和脂质过氧化的形成 肝细胞中脂质的积累削弱了线粒体的氧化能力,增加了电子传递链复合物的还原状态,并刺激脂肪氧化的过氧化物酶体途径,形成氧化应激和脂质过氧化。大量ROS的产生是引起肝脏氧化应激的主要原因。肝脏在经过胰岛素抵抗等的一次打击后,肝脏中大量脂质、游离脂肪酸无法被及时代谢并造成堆积,成为进一步的氧化应激源[22]。本研究PPAR富集通路中,与激活PPAR-α受体相关的基因fabp2和fabp7a显著上调(图6(e)),表明PPAR-α受体被激活。过量的游离脂肪酸激活PPAR-α受体,增加脂肪酸β氧化,以减轻过量脂肪酸对机体的毒害作用。这一过程已经在Alvares等[23]对人类血浆和CHO细胞的研究,以及Gao等[24]利用HepG2细胞对人参皂苷Rg1(G-Rg1)的研究中得到验证。但脂肪酸β氧化活性上升,造成ROS大量积累,超出机体的抗氧化能力[25]。本研究中,gpx1b、gstt1b和anpepb等抗氧化基因上调(图6(f)),也表明斑马鱼肝脏组织中存在氧化应激。但Yao等[26]研究发现,PPAR受体的激活促进肝脂肪酸β氧化,从而改善肝脂质沉积,减轻NAFLD的病理改变,这与本研究的结果不同。推测此差异可能与长期低氧胁迫环境有关。本研究中,长达数月的低氧胁迫造成的脂质堆积已经难以通过PPAR受体的激活得到明显缓解,进而造成了ROS的积累。因此,由长期低氧造成的脂质积累产生的大量游离脂肪酸作为ROS的重要来源进一步加重了肝脏的氧化应激损伤。
脂质过氧化是由ROS攻击多不饱和脂肪酸(PUFA)引发,并产生MDA等过氧化物[26]。受到PPAR-α调节,具有单饱和脂肪酸的合成和长链脂肪酸去饱和作用的scd基因上调(图6(e)),增加了PUFA的数量,使其更易与大量的ROS进行氧化分解产生过氧化产物,造成脂质过氧化,与氧化应激一同构成诱导NAFLD发病的第二次打击。综上,长期低氧胁迫下,斑马鱼肝脏糖脂代谢受到显著影响,大量积累的脂质加重了肝脏细胞氧化应激和脂质过氧化程度,对肝脏造成严重损伤,出现了NAFLD的病理化反应,并诱发NAFLD的形成。
3.3 肝脏对长期低氧的适应
PML装配PML小体,作为一种与细胞衰老密切相关的肿瘤抑制蛋白,目前多集中在对乳腺癌[27]、肺癌[28]和肝癌[29]等癌症的抑制作用相关研究中。虽然PML在细胞代谢中的作用尚不明确,但也值得关注。Kim等[30]研究表明,PML可抑制脂肪生成,PML缺失的小鼠体内产生脂肪堆积。Carracedo等[31]也指出,PML在激活脂肪酸氧化途径中发挥积极作用,推测其可能缓解由脂肪变性引起的机体损伤。本研究中发现,KEGG富集通路中涉及的碳代谢和脂肪酸代谢相关基因与PML小体类别下的si: ch211-260e23.9和hipk3a基因均有较强的正相关关系(图7),这与上述研究结果一致。由此推测,PML小体的显著富集可能是斑马鱼肝脏适应长期低氧环境,减轻无氧呼吸和脂质积累对机体造成严重损伤的一种自我调控机制。
4 结论
1)长期低氧胁迫下斑马鱼肝脏结构呈现出肝脏细胞空泡化、脂质积累,以及线粒体外形膨胀为球形且内部结构紊乱等病理特征。
2)转录组学分析显示,长期低氧引起大量上调的差异基因富集于碳代谢和脂肪酸代谢通路,同时引起PML小体类别的富集。
3)综合肝脏结构及转录组学分析结果,长期低氧可能通过影响肝脏正常的糖脂代谢而诱发NAFLD产生。同时PML小体类别也在长期低氧斑马鱼肝脏中显著富集,说明其可能是斑马鱼适应长期低氧环境、减轻机体损伤的一种自我保护机制。
[1] BERNARDS J A.Principles of comparative respiratory physiology[J].European Journal of Obstetrics and Gynecology,1976,6(2):85-86.
[2] DIAZ R J,ROSENBERG R.Spreading dead zones and consequences for marine ecosystems[J].Science,2008,321(5891):926-929.
[3] ZHANG G S,ZHAO C,WANG Q T,et al.Identification of HIF-1 signaling pathway in Pelteobagrus vachelli using RNA-Seq:effects of acute hypoxia and reoxygenation on oxygen sensors,respiratory metabolism,and hematology indices[J].Journal of Comparative Physiology B,Biochemical,Systemic,and Environmental Physiology,2017,187(7):931-943.
[4] THORAL E,FARHAT E,ROUSSEL D,et al.Different patterns of chronic hypoxia lead to hierarchical adaptive mechanisms in goldfish metabolism[J].The Journal of Experimental Biology,2022,225(1):jeb243194.
[5] 李洪娟,陈刚,郭志雄,等.军曹鱼(Rachycentron canadum)幼鱼对环境低氧胁迫氧化应激与能量利用指标的响应[J].海洋学报,2020,42(4):12-19.
LI H J,CHEN G,GUO Z X,et al.Oxidative stress and energy utilization responses of juvenile cobia (Rachycentron canadum) to environmental hypoxia stress[J].Acta Oceanologica Sinica,2020,42(4):12-19.(in Chinese)
[6] PARIKH M P,GUPTA N M,MCCULLOUGH A J.Obstructive sleep apnea and the liver[J].Clinics in Liver Disease,2019,23(2):363-382.
[7] DAY C P,JAMES O F.Steatohepatitis:a tale of two hits?[J].Gastroenterology,1998,114(4):842-845.
[8] BUZZETTI E,PINZANI M,TSOCHATZIS E A.The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J].Metabolism:Clinical and Experimental,2016,65(8):1038-1048.
[9] XING H J,CHEN J Q,PENG M Q,et al.Identification of signal pathways for immunotoxicity in the spleen of common carp exposed to chlorpyrifos[J].Ecotoxicology and Environmental Safety,2019,182:109464.
[10] FENG J F,GUO Y,GAO Y F,et al.Effects of hypoxia on the physiology of zebrafish (Danio rerio):initial responses,acclimation and recovery[J].Bulletin of Environmental Contamination and Toxicology,2016,96(1):43-48.
[11] KIM D,LANGMEAD B,SALZBERG S L.HISAT:a fast spliced aligner with low memory requirements[J].Nature Methods,2015,12(4):357-360.
[12] DAI J J,ZHOU W B,WANG B.Identification of crucial genes associated with lung adenocarcinoma by bioinformatic analysis[J].Medicine,2020,99(44):e23052.
[13] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) method[J].Methods,2001,25(4):402-408.
[14] MESARWI O A,LOOMBA R,MALHOTRA A.Obstructive sleep apnea,hypoxia,and nonalcoholic fatty liver disease[J].American Journal of Respiratory and Critical Care Medicine,2019,199(7):830-841.
[15] DING J,LIU C,LUO S Y,et al.Transcriptome and physiology analysis identify key metabolic changes in the liver of the large yellow croaker (Larimichthys crocea) in response to acute hypoxia[J].Ecotoxicology and Environmental Safety,2020,189:109957.
[16] BOROWIEC B G,MCCLELLAND G B,REES B B,et al.Distinct metabolic adjustments arise from acclimation to constant hypoxia and intermittent hypoxia in estuarine killifish (Fundulus heteroclitus)[J].The Journal of Experimental Biology,2018,221(Pt 23):jeb190900.
[17] MIAO P,SHENG S L,SUN X G,et al.Lactate dehydrogenase A in cancer:a promising target for diagnosis and therapy[J].IUBMB Life,2013,65(11):904-910.
[18] MODICA-NAPOLITANO J S,SINGH K K.Mitochondrial dysfunction in cancer[J].Mitochondrion,2004,4(5/6):755-762.
[19] SHULMAN G I.Cellular mechanisms of insulin resistance[J].The Journal of Clinical Investigation,2000,106(2):171-176.
[20] SANDERS F W,GRIFFIN J L.De novo lipogenesis in the liver in health and disease:more than just a shunting yard for glucose[J].Biological Reviews of the Cambridge Philosophical Society,2016,91(2):452-468.
[21] YANG Q,VIJAYAKUMAR A,KAHN B B.Metabolites as regulators of insulin sensitivity and metabolism[J].Nature Reviews Molecular Cell Biology,2018,19(10):654-672.
[22] OCKNER R K,KAIKAUS R M,BASS N M.Fatty-acid metabolism and the pathogenesis of hepatocellular carcinoma:review and hypothesis[J].Hepatology,1993,18(3):669-676.
[23] ALVARES K,CARRILLO A,YUAN P M,et al.Identification of cytosolic peroxisome proliferator binding protein as a member of the heat shock protein HSP70 family[J].Proceedings of the National Academy of Sciences of the United States of America,1990,87(14):5293-5297.
[24] GAO Y,ZHANG S J,LI J J,et al.Effect and mechanism of ginsenoside Rg1-regulating hepatic steatosis in HepG2 cells induced by free fatty acid[J].Bioscience,Biotechnology,and Biochemistry,2020,84(11):2228-2240.
[25] NILAKANTAN V,SPEAR B T,GLAUERT H P.Effect of the peroxisome proliferator ciprofibrate on lipid peroxidation and 8-hydroxydeoxyguanosine formation in transgenic mice with elevated hepatic catalase activity[J].Free Radical Biology &Medicine,1998,24(9):1430-1436.
[26] YAO H R,LIU J,PLUMERI D,et al.Lipotoxicity in HepG2 cells triggered by free fatty acids[J].American Journal of Translational Research,2011,3(3):284-291.
[27] CARRACEDO A,WEISS D,LELIAERT A K,et al.A metabolic prosurvival role for PML in breast cancer[J].The Journal of Clinical Investigation,2012,122(9):3088-3100.
[28] KUO H Y,HUANG Y S,TSENG C H,et al.PML represses lung cancer metastasis by suppressing the nuclear EGFR-mediated transcriptional activation of MMP2[J].Cell Cycle,2014,13(19):3132-3142.
[29] HERZER K,GERKEN G,HOFMANN T G.Hepatitis C-associated liver carcinogenesis:role of PML nuclear bodies[J].World Journal of Gastroenterology,2014,20(35):12367-12371.
[30] KIM M K,YANG S T,LEE K H,et al.Promyelocytic leukemia inhibits adipogenesis,and loss of promyelocytic leukemia results in fat accumulation in mice[J].American Journal of Physiology Endocrinology and Metabolism,2011,301(6):E1130-E1142.
[31] CARRACEDO A,ROUSSEAU D,DOURIS N,et al.The promyelocytic leukemia protein is upregulated in conditions of obesity and liver steatosis[J].International Journal of Biological Sciences,2015,11(6):629-632.