贵州省黔西南州的万峰湖位于桂、黔和滇三省交界处,是建设国家重点项目天生桥水电站形成的湖泊,蓄水量丰富,可达102.6亿m3,湖区面积达176 km2,是黔西南地区最大的人工湖泊。万峰湖沿岸森林密布,少有农田,绿色生态旅游及生态养殖业发展迅速,因此,万峰湖的生态保护对珠江流域的水资源开发具有重要意义。目前,有关万峰湖的研究大多集中在浮游植物调查及水质评估[1],而基于高通量测序技术的万峰湖生物群落结构及水质监测尚未见报道。水生环境中聚集了最丰富的基因、酶和天然产物资源,微生物群落是生物地球化学循环和污染物生物降解的基础,在水生生态系统中具有非常重要的作用。评估水体系统中微生物群落结构的动态变化,调查水生环境中微生物的群落组成对开发和保护水资源意义重大。
前期许多研究均指出,湖泊水体中细菌群落结构会发生明显的季节性变化,如刘兰英等[2]揭示了福州左海湖细菌群落具有明显的季节性变化特征,且发现季节动态与水温、营养状况密切相关;沈烽等[3]研究发现,南京玄武湖浮游细菌群落结构存在明显的季节变化,影响玄武湖细菌群落结构最显著的环境因子为温度;邢鹏等[4]研究表明,太湖的细菌种群多样性也存在明显的季节变化规律,夏季及秋季浮游细菌的丰度、多样性及种群的均匀度明显高于冬季和春季;Ji等[5]研究表明,武汉3个富营养化湖泊的细菌富营养化指数和温度是影响湖水中细菌群落组成的主要因素;Paruch等[6]也认为,温度是影响细菌群落组成的主要非生物因素。这些研究结果均表明,在许多湖泊中细菌群落会发生季节性演替,动态跟踪水质的变化对全面了解水生微生物多样性、组成和动态,以及对于可持续生态系统功能的水质评估、预测和管理策略至关重要。
基于16S rRNA的高通量测序(next-generation sequencing)技术为探索水生环境中细菌群落提供了便利的技术手段。高通量测序技术不仅能精细表征细菌的基因组,而且可以更深入地对复杂细菌群落进行分类鉴定,利用NGS方法目前已对国内多个水域环境中的细菌群落进行了调查,如江苏太湖与阳澄湖[7]、贵州赤水河[8]、江西鄱阳湖[9]、河北白洋淀[10]、湖北梁子湖与后官湖[11]、南京花神湖与紫霞湖[12]及内蒙古达里诺尔湖[13]等。本研究中,首次利用16S rRNA基因通过Illumina二代测序技术,对万峰湖主航道各区段3个位点在丰水期和枯水期的细菌群落结构进行了调查,以期为进一步研究该湖泊的群落结构动态变化及其生态功能提供数据参考。
1 材料与方法
1.1 调查区域及采样站位
于2020年10月(丰水期)和2021年5月(枯水期)在万峰湖3个采样点采集表层(0~5 m)水样,3个采样点分别为大坝(105°10′E、24°94′N,记为DB)、梅家湾(105°08′E、24°90′N,记为MJW)和巴结(105°03′E、24°87′N,记为BJ),采样点位分布见图1。
本图以自然资源部标准地图服务网站GS(2019)3333号标准地图为底图,底图边界无修改。
The figure is based on the standard map GS(2019)3333 in the Standard Map Service website of Ministry of Natural Resources of the People’s Republic of China,with no modifications of the boundaries in the standard map.
图1 万峰湖采样点
Fig.1 Sampling sites in the Wanfeng Lake
1.2 方法
1.2.1 样本采集与预处理 用不锈钢采样器采集水样,从每个位点采集水样5 L,分装于5个1 L灭菌聚乙烯细口瓶中,水样置于冰上运输至实验室4 ℃下保存。不同水样用真空泵抽滤,滤膜直径为0.45 μm,抽滤后的滤膜立即置于-80 ℃超低温冰箱中保存。
1.2.2 高通量测序 将过滤后的滤膜送至上海生工生物工程有限公司进行样品基因组DNA提取、16S rDNA基因扩增和测序,并对数据进行多样性分析。PCR扩增区域为V3~V4,引物序列为341F:CCTACGGGNGGCWGCAG,805R:GACTACHVGGGTATCTAATCC。将Illumina MiSeq测序得到的原始序列(raw data)经处理后得到有效数据(clean data),采用QIIME 软件进行生物信息学分析,根据序列的相似度,将序列归为多个OTUs(operational taxonomic units),基于OTU计算稀释曲线、群落丰富度指数(Chao1、Ace)、群落多样性指数(Shannon、Simpson)和群落均匀度指数(Shannoneven)等。用PICRUSt软件进行菌群的功能和代谢途径预测分析[14],将OTUs在COG和KEGG数据库中进行比对,获得不同的数据库功能预测信息。
2 结果与分析
2.1 序列信息和多样性指数
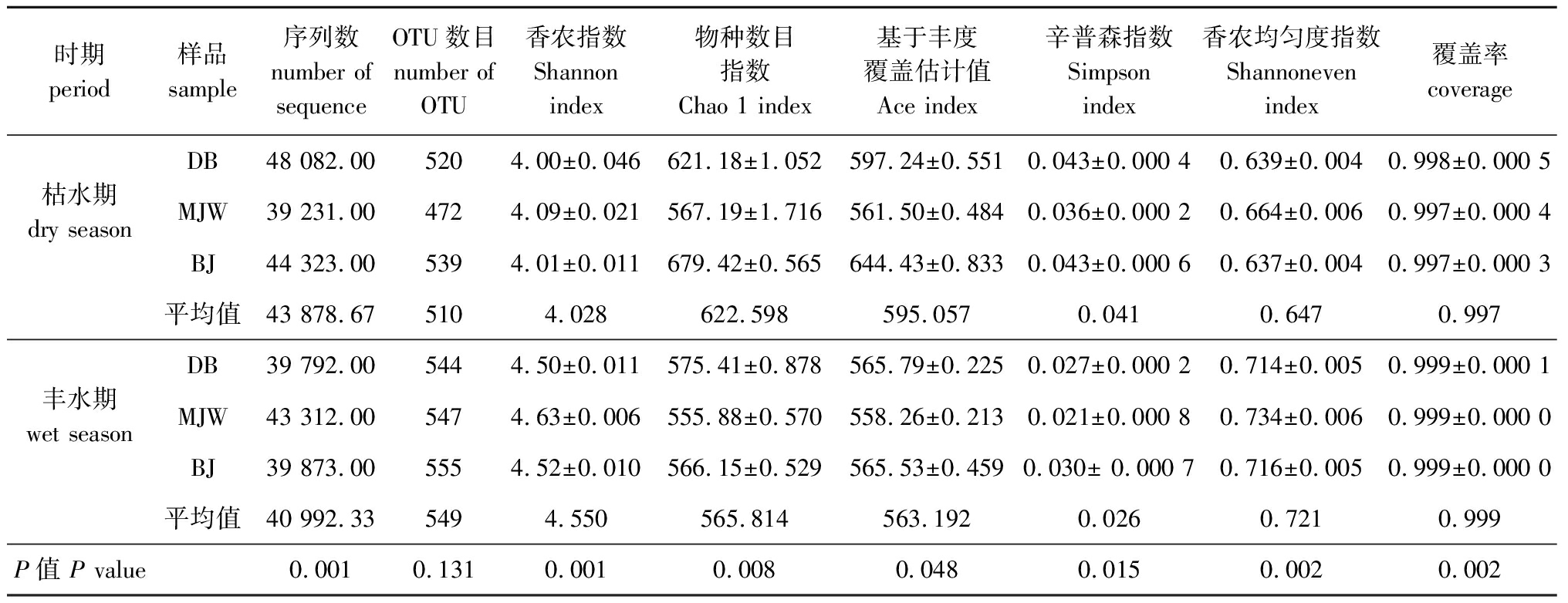
对万峰湖丰水期和枯水期3个采样点的样本进行测序,每个采样点设置3个生物学重复,共得到345 947个原始序列(raw reads),经过拼接和质控后,共得到了344 966个有效序列(clean reads)(占原始序列的99.71%)。之后,按照相似性对非重复序列进行OTU聚类,在所有样品中共得到3 177个OTUs,样品覆盖率均为99%以上。丰水期和枯水期细菌的16S rRNA基因片段总数分别为122 976、131 637,OTUs数目分别为1 647、1 530个(表1)。
表1 万峰湖丰水期和枯水期细菌群落的Alpha多样性和丰度
Tab.1 Alpha diversity and richness of bacterial community from wet season and dry season in the Wanfeng Lake
时期period样品sample序列数number of sequenceOTU数目number ofOTU香农指数Shannon index物种数目指数Chao 1 index基于丰度覆盖估计值Ace index辛普森指数Simpson index香农均匀度指数Shannoneven index覆盖率coverage枯水期dry seasonDB48 082.00 520 4.00±0.046621.18±1.052597.24±0.5510.043±0.000 40.639±0.0040.998±0.000 5MJW39 231.00 472 4.09±0.021567.19±1.716561.50±0.4840.036±0.000 20.664±0.0060.997±0.000 4BJ44 323.00 539 4.01±0.011679.42±0.565644.43±0.8330.043±0.000 60.637±0.0040.997±0.000 3平均值43 878.67 510 4.028 622.598 595.0570.041 0.647 0.997 丰水期wet seasonDB39 792.00 544 4.50±0.011575.41±0.878565.79±0.2250.027±0.000 20.714±0.0050.999±0.000 1MJW43 312.00 547 4.63±0.006555.88±0.570558.26±0.2130.021±0.000 80.734±0.0060.999±0.000 0BJ39 873.00 555 4.52±0.010566.15±0.529565.53±0.4590.030± 0.000 70.716±0.0050.999±0.000 0平均值40 992.33 549 4.550 565.814 563.192 0.0260.7210.999 P值 P value 0.001 0.131 0.001 0.0080.0480.0150.0020.002
从表1可见:在所有测序样品中,枯水期BJ样本的细菌丰度(Ace和Chao 1值)最高,其次是枯水期的DB和MJW样本,而丰水期DB样本的细菌丰度最高;丰水期和枯水期MJW样本的Shannon值均最高。方差分析显示,反映细菌丰度的Chao 1和Ace指标(P=0.008和0.047),反映细菌群落多样性的Shannon和Simpson指标(P=0.000 5和0.015),以及反映群落分布均匀度的Shannoneven指标(P=0.002)均在丰水期和枯水期间呈现出显著差异性。说明丰水期和枯水期细菌群落结构组成有显著差别。
为了进一步展示样本中细菌多样性的不同,进行了Beta多样性分析。从图2可见:丰水期DB、BJ和MJW样本间的距离较近,尤其是BJ与DB,说明3个样本中的细菌组成相似;而枯水期的3个样本间距离均较远,说明3个样本中的细菌群落组成差别较大。
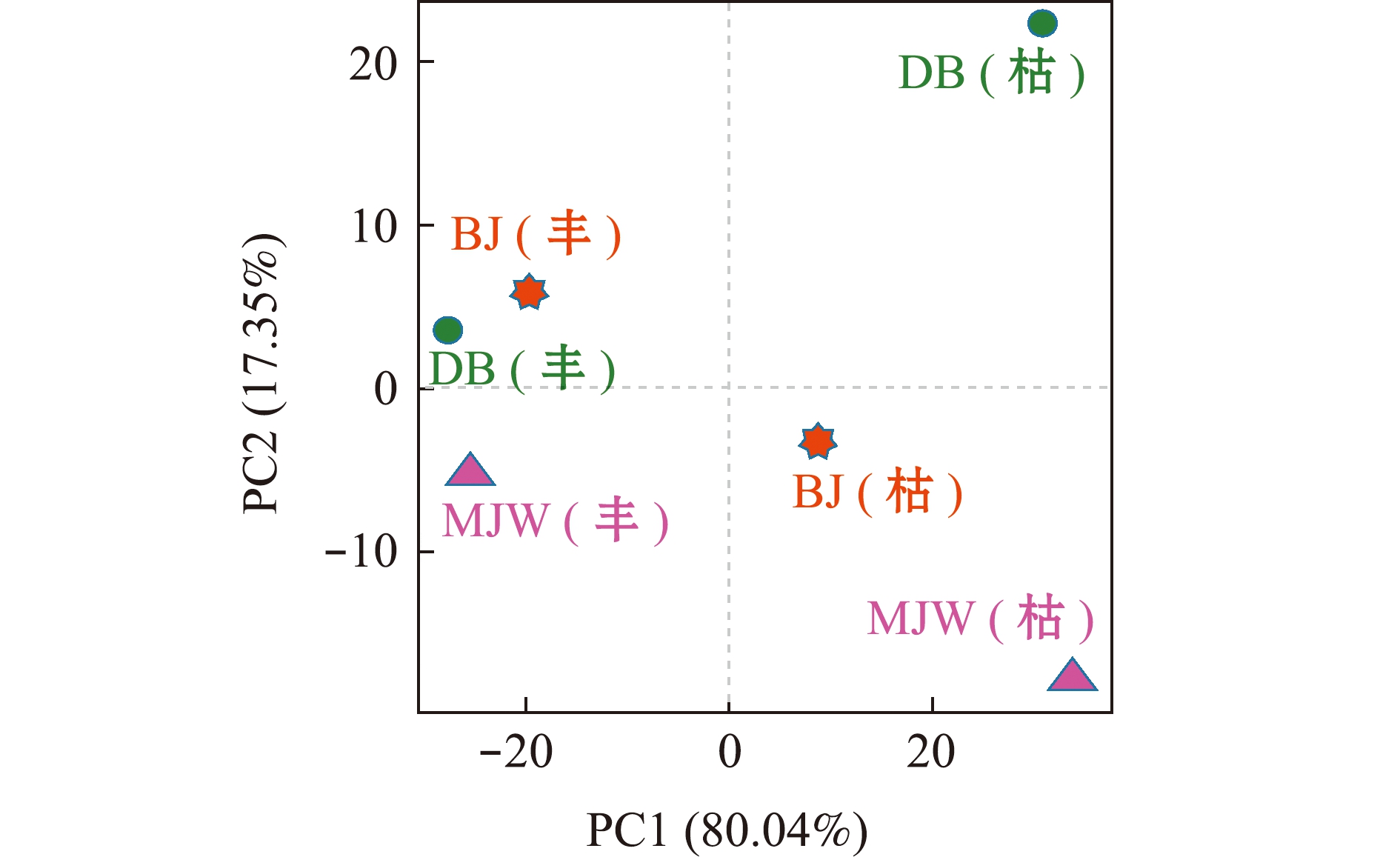
图2 丰水期和枯水期细菌群落的主坐标分析
Fig.2 Principal co-ordinates analysis of bacterial community in wet season and dry season
2.2 丰水期及枯水期细菌群落结构比较
样品的稀释曲线显示(图3(a)、(b)),万峰湖丰水期的BJ、DB和MJW 3个样本中OTUs均显示出较陡的稀释曲线,而枯水期样本OTUs的稀释曲线较平缓,这表明,丰水期和枯水期样本序列较好地反映了细菌群落的种类和数量,样品均为随机取样,其中,丰水期基本涵盖了全部细菌群落的多样性,枯水期可能还蕴藏着一些未被鉴定的微生物资源。
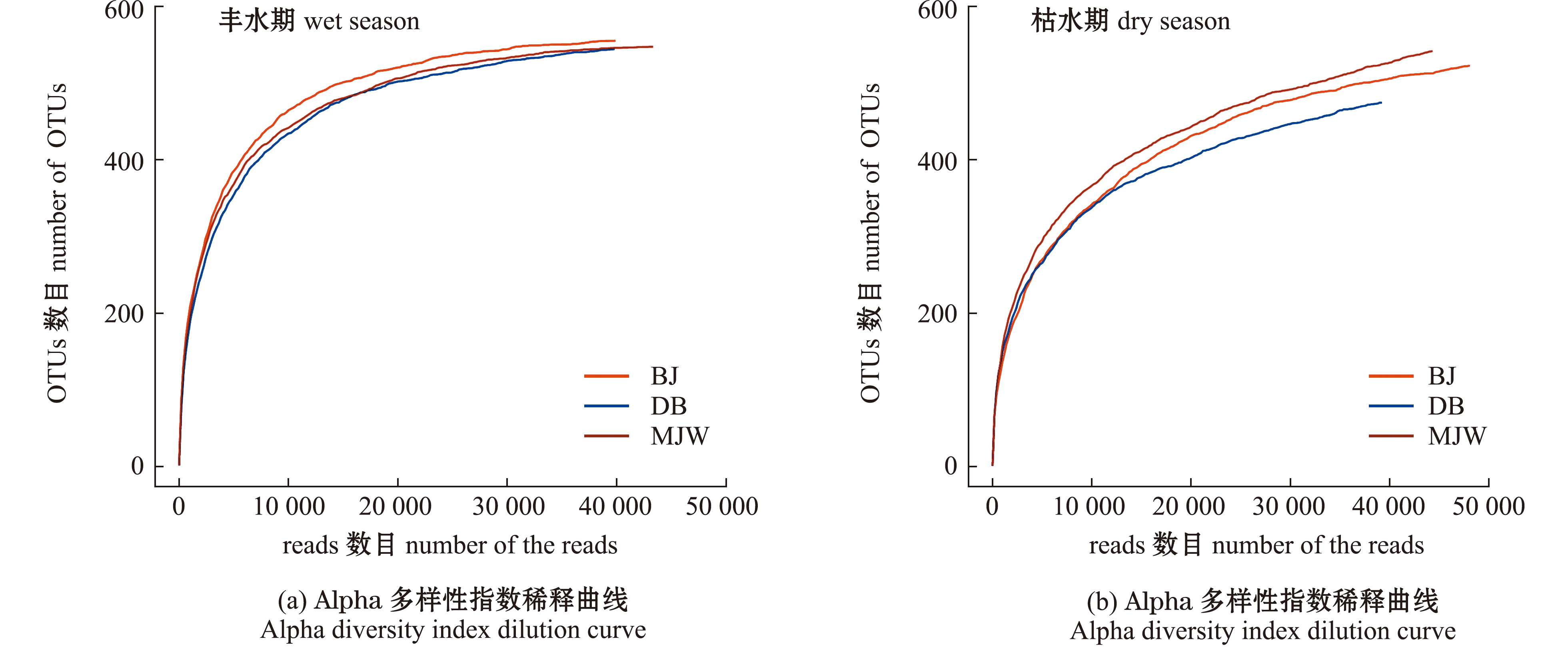
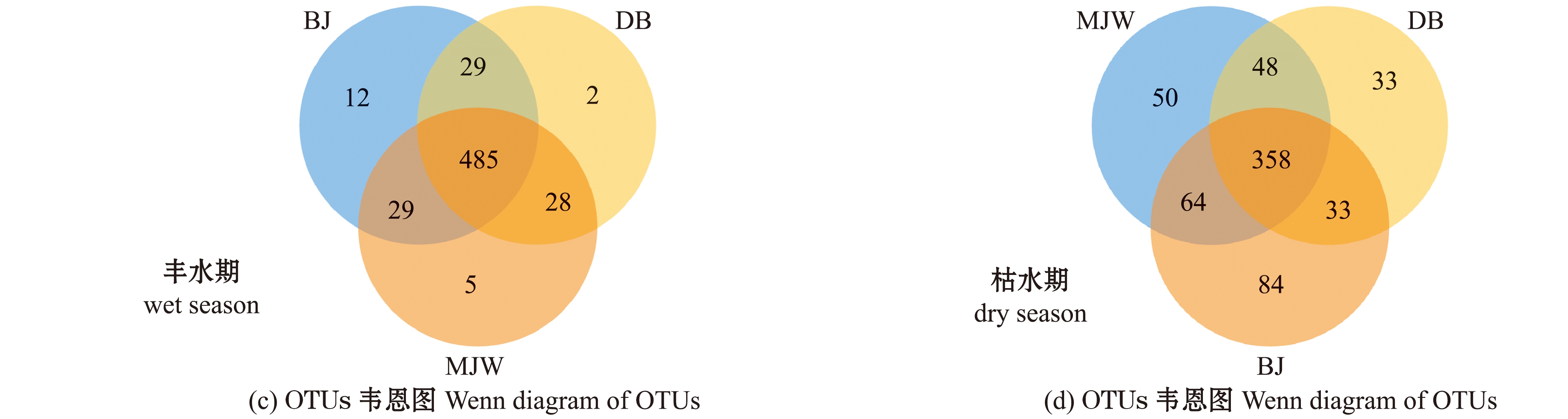
图3 丰水期和枯水期细菌群落的OTUs分析
Fig.3 OTUs analysis of bacterial community in wet season and dry season
对丰水期和枯水期细菌群落的OTUs韦恩图(图3(c)、(d))分析显示:丰水期3个样本有共同的485个OTUs,BJ样本特有的OTUs最多(12个),而MJW和DB样本特有的OTUs分别为5个和2个;枯水期3个样本有共同的358个OTUs,BJ样本特有OTUs最多(84个),MJW和DB样本特有的OTUs分别为50个和33个。这表明,3个样本具有较多共同的细菌。
通过RDP(ribosomal database project)法分析万峰湖丰水期和枯水期细菌的1 647个/1 530个OTUs分类,结果表明,丰水期细菌总数为122 976的序列隶属于18个门202属,枯水期细菌总数为131 637的序列隶属于20个门236属。UPGMA分析和相对丰度比较如图3所示。从门水平上对丰水期和枯水期细菌群落结构比较发现:丰水期3个样本中变形菌门(Proteobacteria)最为丰富,其次是放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)和疣微菌门(Verrucomicrobia);枯水期3个样本中放线菌门最丰富,其次是变形菌门、拟杆菌门、蓝藻门、浮霉菌门和疣微菌门,并在枯水期BJ样本中发现了其特有的装甲菌门(Armatimonadetes);从样本间的细菌丰度分布差异程度的距离热图可见,BJ和DB样本间的距离关系较近(图4)。
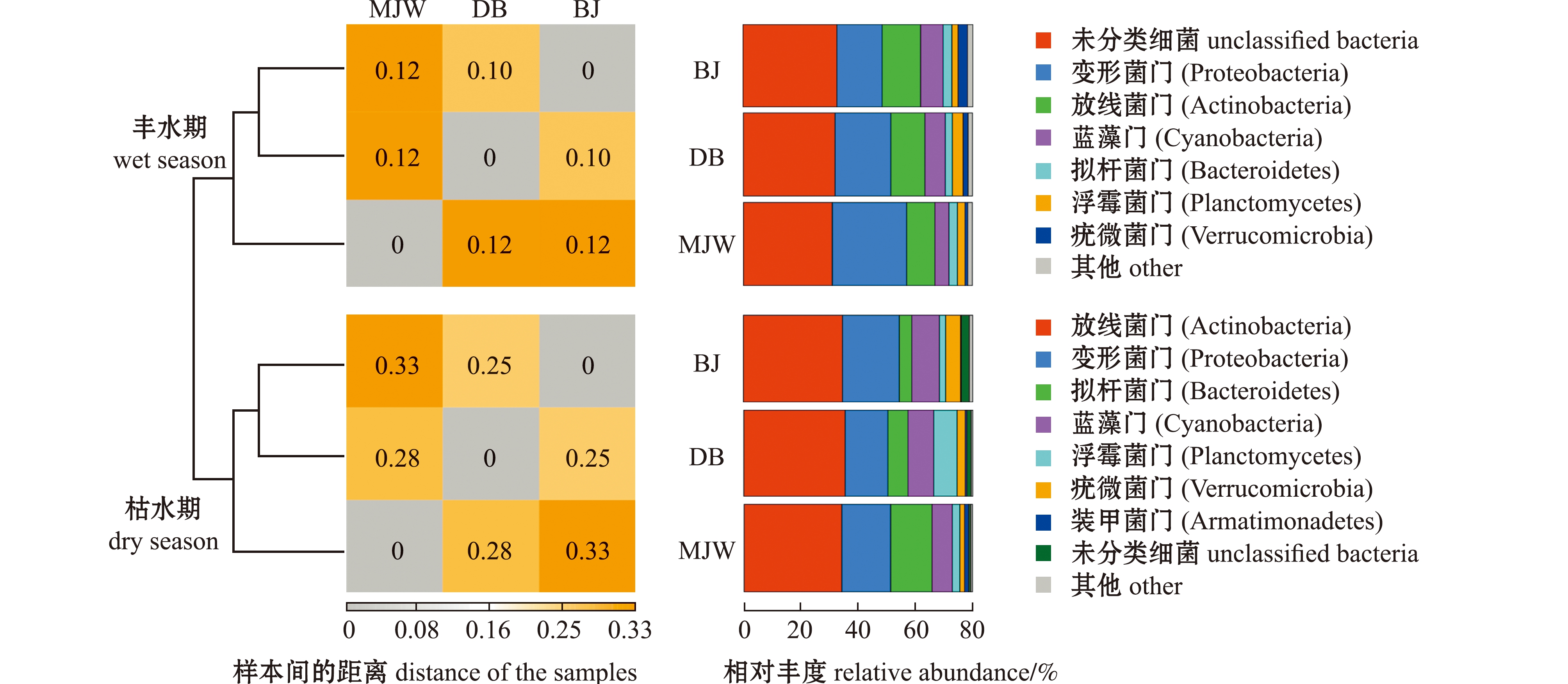
图4 门水平上丰水期和枯水期细菌群落的种类和相对丰度比较
Fig.4 Comparison of species and relative abundance of bacterial community between wet season and dry season at phylum level
通过分析发现,同一时期3个样本中的主要细菌组成和数量相似,因此,后续的分析只选取其中一个取样点的样本进行比较。以BJ样本为例,比较丰水期和枯水期丰度最高的前8个门发现:两个时期细菌结构组成基本相同,枯水期有1个独有的装甲菌门;丰水期细菌群落涵盖的未知菌群(42.00%)远大于枯水期(1.60%)(表2)。尽管变形菌门、放线菌门、蓝藻门和拟杆菌门均为丰水期和枯水期的优势菌群,但两个时期这些菌群的相对丰度差别较大,说明万峰湖丰水期和枯水期细菌群落间的丰度差异显著。
表2 门水平上丰水期和枯水期细菌群落组成比较(BJ样本)
Tab.2 Comparison of bacterial community composition between wet season and dry season at phylum level (BJ sample) %
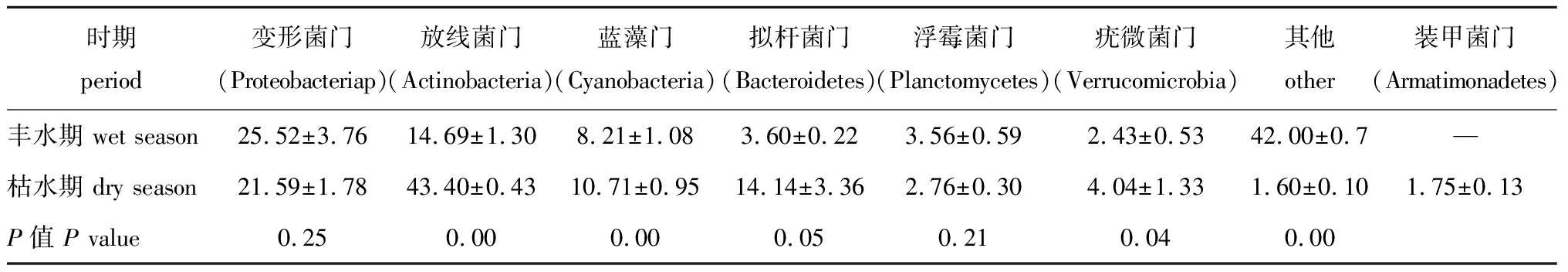
时期period变形菌门(Proteobacteriap)放线菌门(Actinobacteria)蓝藻门(Cyanobacteria)拟杆菌门(Bacteroidetes)浮霉菌门(Planctomycetes)疣微菌门(Verrucomicrobia)其他other装甲菌门(Armatimonadetes)丰水期 wet season25.52±3.7614.69±1.308.21±1.083.60±0.223.56±0.592.43±0.5342.00±0.7 —枯水期 dry season21.59±1.7843.40±0.4310.71±0.9514.14±3.362.76±0.304.04±1.331.60±0.101.75±0.13P值 P value0.25 0.00 0.00 0.05 0.21 0.04 0.00
以BJ样本为例,从属水平上对丰水期和枯水期细菌群落结构比较发现,全部细菌序列可分为438个不同的属,其中55个属为丰水期和枯水期细菌所共有,大部分为单胞菌和杆菌,147个属为丰水期所特有,181个属为枯水期所特有(图5)。
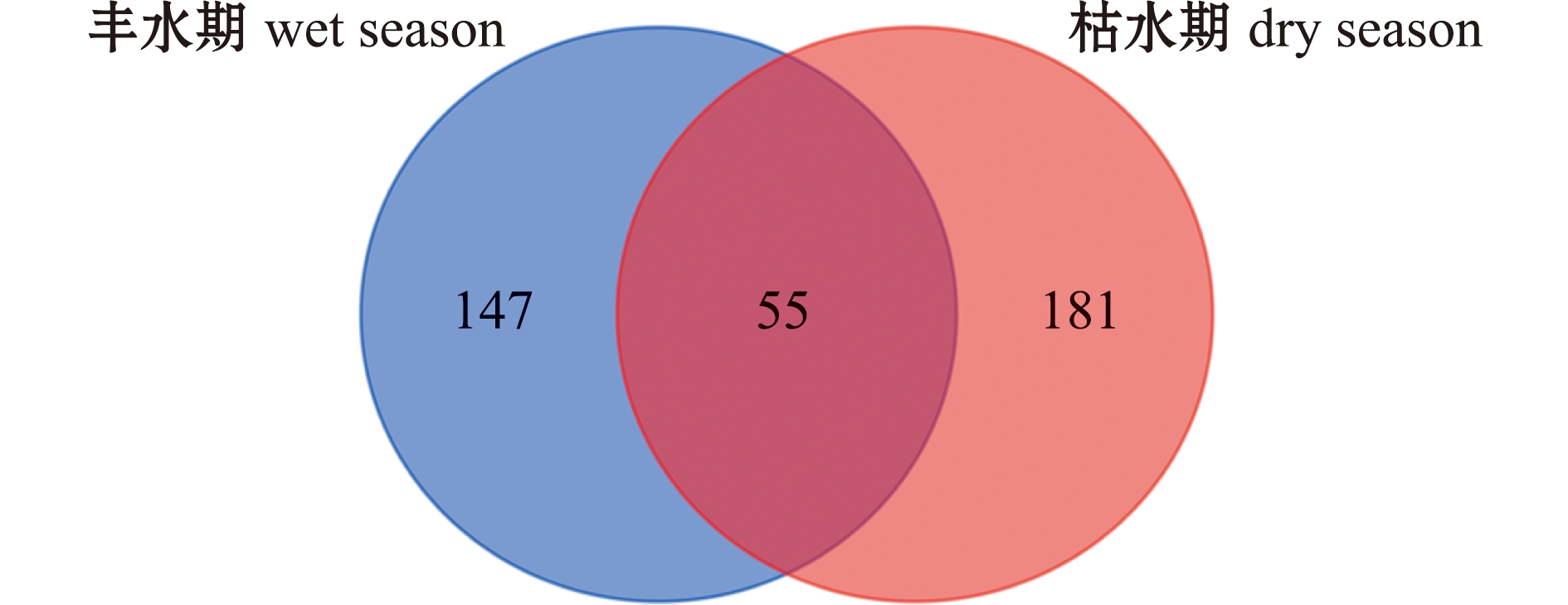
图5 属水平上丰水期和枯水期细菌群落组成韦恩图(BJ样本)
Fig.5 Venn diagram of bacterial community between wet season and dry season at genus level(BJ sample)
丰水期细菌隶属于202个属,丰度最高的属有细菌属(Bacteria,38.8%),其次为红细菌属(Rhodobacteraceae,8.01%)和放线菌属(Actinomyces,7.48%)等;枯水期细菌隶属于236个属,丰度最高的属有酸微菌属(Acidimicrobidae,24.39%),其次为微球菌属(Micrococcineae,11.95%)和蓝藻门的Gplla属(7.58%)等(表3)。
表3 属水平上丰水期和枯水期细菌群落组成比较(BJ样本)
Tab.3 Comparison of bacterial community composition between wet season and dry season at genus level(BJ sample) %
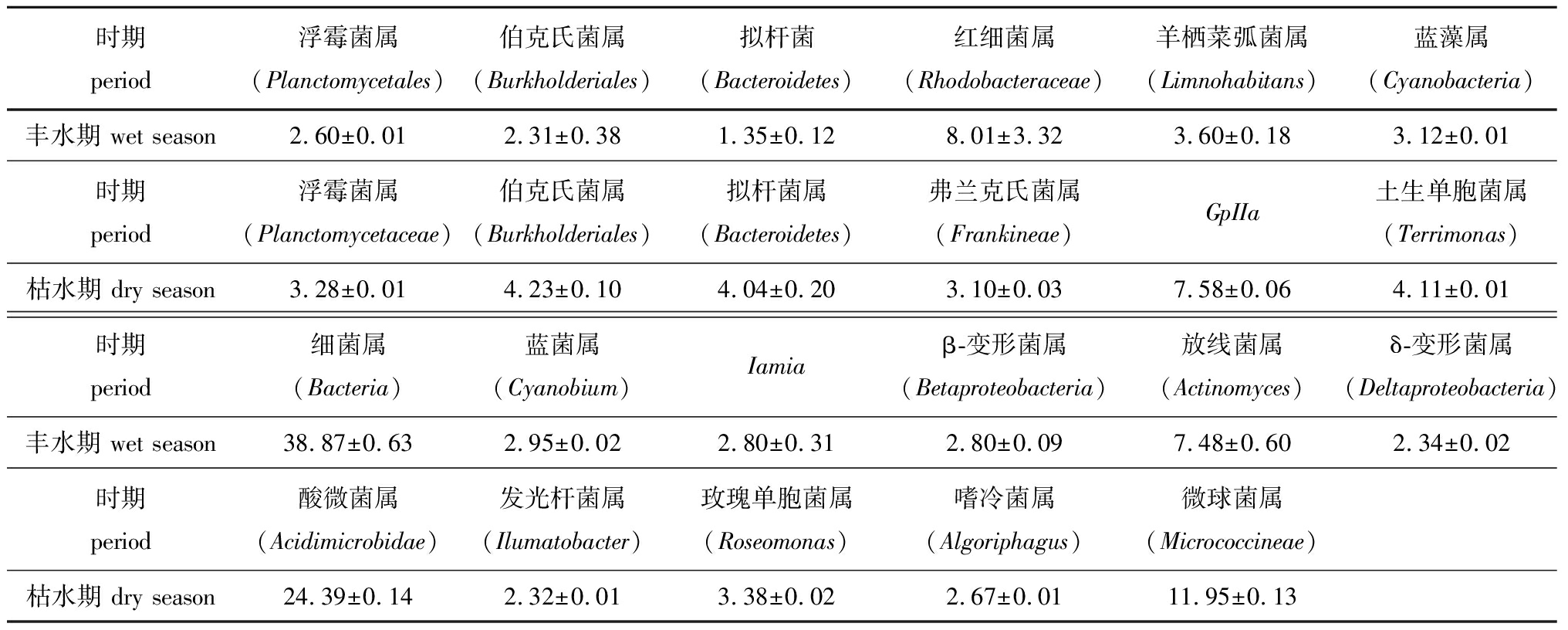
时期period浮霉菌属(Planctomycetales)伯克氏菌属(Burkholderiales)拟杆菌(Bacteroidetes)红细菌属(Rhodobacteraceae)羊栖菜弧菌属(Limnohabitans)蓝藻属(Cyanobacteria)丰水期 wet season2.60±0.012.31±0.381.35±0.128.01±3.323.60±0.183.12±0.01时期period浮霉菌属(Planctomycetaceae)伯克氏菌属(Burkholderiales)拟杆菌属(Bacteroidetes)弗兰克氏菌属(Frankineae)GpIIa土生单胞菌属(Terrimonas)枯水期 dry season3.28±0.014.23±0.104.04±0.203.10±0.037.58±0.064.11±0.01时期period细菌属(Bacteria)蓝菌属(Cyanobium)Iamiaβ-变形菌属(Betaproteobacteria)放线菌属(Actinomyces)δ-变形菌属(Deltaproteobacteria)丰水期 wet season38.87±0.632.95±0.022.80±0.312.80±0.097.48±0.602.34±0.02时期period酸微菌属(Acidimicrobidae)发光杆菌属(Ilumatobacter)玫瑰单胞菌属(Roseomonas)嗜冷菌属(Algoriphagus)微球菌属(Micrococcineae)枯水期 dry season24.39±0.142.32±0.013.38±0.022.67±0.0111.95±0.13
2.3 菌群功能预测
采用PICRUSt软件对丰水期和枯水期BJ样本的菌群进行功能预测。基于KEGG数据库的预测结果表明:在选取的丰度最高的代谢途径中,氨基酸转运、多肽转运、RNA聚合酶、糖转运及硫酸盐/硝酸盐转运五大类为主要功能基因家族;比较丰水期和枯水期菌群的功能基因拷贝数,发现大部分代谢途径中菌群预测的基因拷贝数为枯水期高于丰水期,且在抗生素运输系统、糖运输系统和多肽转运系统中菌群预测的基因拷贝数为枯水期明显高于丰水期(图6)。
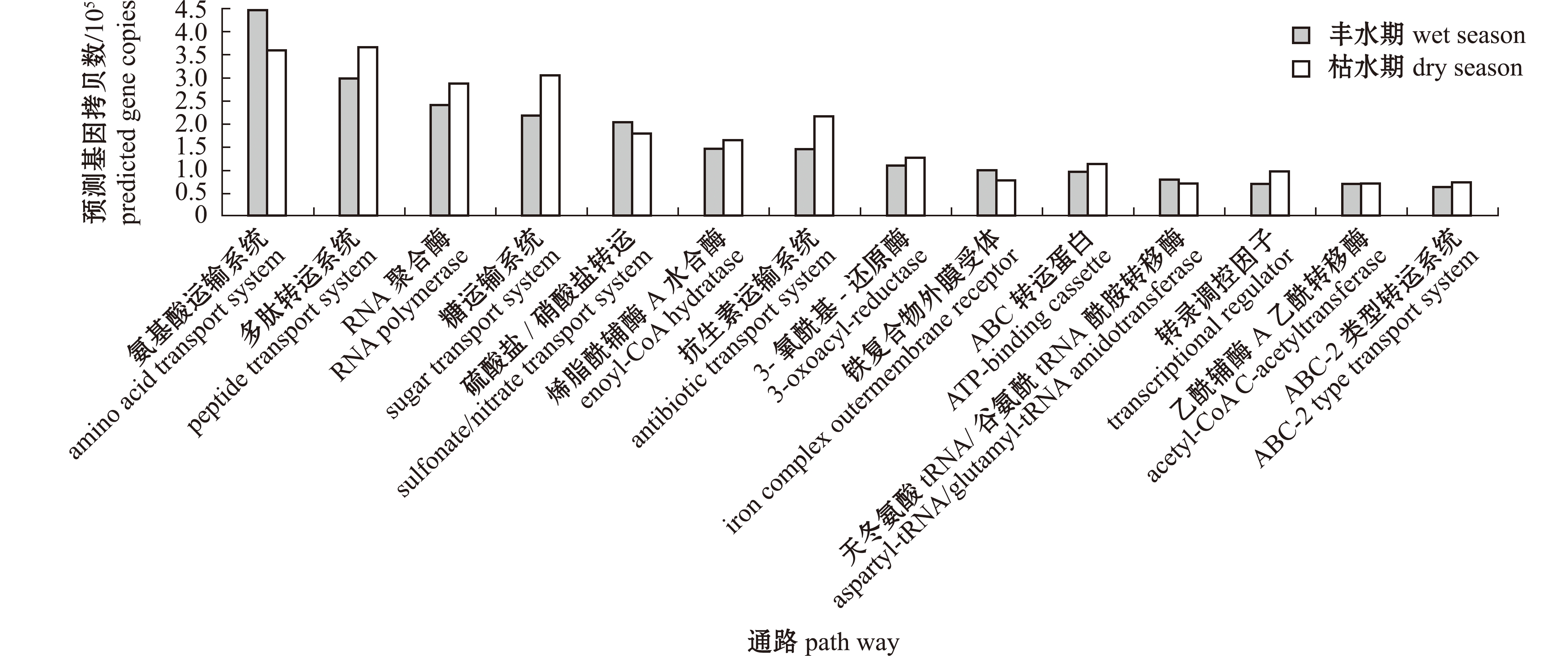
图6 基于KEGG数据库的丰水期和枯水期浮游细菌PICRUSt功能预测比较(BJ样本)
Fig.6 PICRUSt prediction comparison of the bacterioplankton community from different samples based on the KEGG database(BJ sample)
基于COG数据库预测结果表明:除了核结构功能基因缺失外,其他24个功能基因预测均有分布,其中,氨基酸运输和代谢,转录,能量产生和转化,碳水化合物运输和代谢,细胞壁、细胞膜和膜生物合成,信号转导机制,翻译、核糖体结构和生物合成,以及无机离子运输和代谢八大类为主要功能基因家族,占比分别为50.56%(丰水期)和51.07%(枯水期);除了细胞运动、细胞内物质运输分泌和膜泡运输功能外,其余22个功能预测基因拷贝数均为枯水期高于丰水期(图7)。
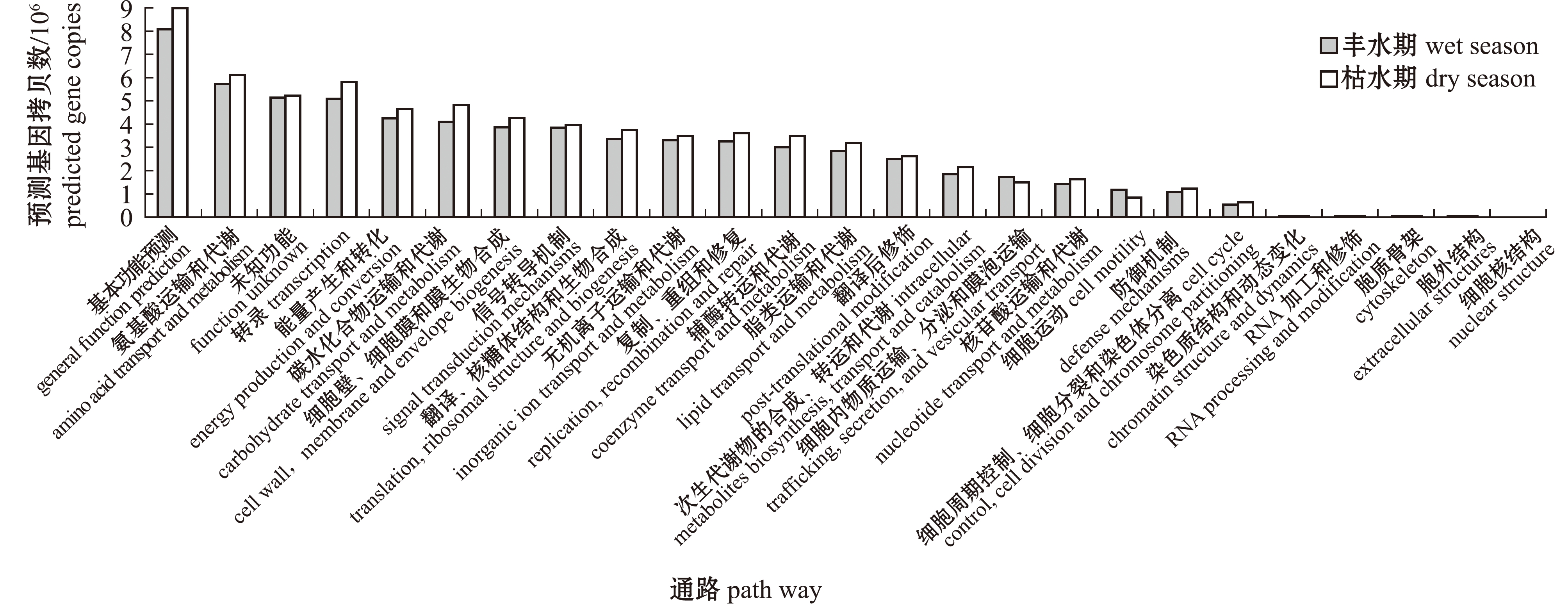
图7 基于COG数据库的丰水期和枯水期浮游细菌PICRUSt功能预测比较(BJ样本)
Fig.7 PICRUSt prediction comparison of the bacterioplankton community from different samples based on the COG database(BJ sample)
3 讨论
万峰湖是黔西南地区最大的人工湖泊,是沿岸居民重要的水资源,因此,万峰湖水资源的安全关乎沿岸的经济发展和居民的健康。本研究中,从万峰湖主航道各区段及其支流共计3个位点取样,通过比较万峰湖枯水期和丰水期细菌群落分布多样性和群落分布均匀度发现,不同时期的样本存在显著性差异,说明季节的变化会影响湖体细菌的数量和种类。本研究中,首次利用高通量测序技术对万峰湖丰水期和枯水期原核浮游生物进行多样性调查,通过分析OTUs的Alpha多样性指数稀释曲线,充分说明测序深度足够,数据合理。
3.1 丰水期和枯水期细菌群落结构比较
近年来,微生物群落结构成为研究的热点,通过对微生物群落的种群结构和多样性进行解析,可为优化群落结构和发现新的重要微生物提供依据。本研究中发现,丰水期和枯水期万峰湖的细菌群落组成主要由变形菌门、放线菌门、蓝藻门、拟杆菌门、浮霉菌门和疣微菌门组成,枯水期有1个独有的装甲菌门。万峰湖在枯水期温度比丰水期高,装甲菌门是广泛分布在湖泊尤其是温泉、热泉中的优势细菌类群,枯水期温度高可能是装甲菌只在枯水期出现的原因[15]。丰水期和枯水期中细菌群落的多样性和群落分布均匀度差异显著,说明季节是影响微生物种群的重要因素,这与Suh等[16]的报道一致。本研究中,枯水期细菌丰度高于丰水期,这与对日本Kasumigaura湖的研究结果一致[17]。但万峰湖丰水期的细菌群落多样性高于枯水期,这可能与万峰湖属亚热带季风气候有关,即使11月的丰水期,万峰湖的水温也在20 ℃左右,正是拉网收鱼的季节。细菌群落多样性受水产养殖的影响较大,如水产动物的粪便或者身体的流出物都会增加水生细菌的种类和数量[18]。万峰湖鱼类资源丰富并有少量网箱养鱼,丰水期BJ样本的细菌多样性较高,可能与丰水期鱼体密度较大有关。同时,万峰湖细菌群落的数量和多样性可能还受其他因素的影响,如游泳者、游客丢弃的垃圾、周围农田流失的农业肥料及游船排放物等。本研究中,样本间的细菌组成距离热图显示,丰水期上游取样点DB与下游取样点BJ样本间的距离关系较近,而两者与中游取样点MJW样本间的距离反而较远,这可能是因为MJW处于比较大的支流汇合点处,细菌组成有些变化。
本研究中发现,万峰湖丰水期3个取样点中变形菌门占比最高,其次是放线菌门、蓝藻门和拟杆菌门等,这与许多对其他湖泊的研究结果一致,如寇文伯等[19]报道,变形菌为鄱阳湖的优势菌门,其次为拟杆菌门和放线菌门。万峰湖同一时期不同区域水体中细菌群落组成差别不大,这与万峰湖属于通江湖泊,且水流速度较快有关。从属水平上分析细菌群落的组成发现,丰水期和枯水期均有一定数量的伯克氏菌属,该菌在一些文献中报道是鱼类和虾类养殖水体中普遍存在的菌[20-21],这可能受万峰湖中水产养殖的影响。之前许多研究表明,水体中许多固氮菌均由一些Alpha-、Beta-、Gamma-和Delta-变形菌和蓝藻组成,本研究中在属水平上鉴定出丰水期和枯水期均含有变形菌门的Polynucleobacter属、Dechlomonas属、Limnohabitans属,放线菌门的Dietzia属,以及拟杆菌门的Fluviicola属。这些菌分别在溶解性有机物的降![]() 还原为N2O[22]、有机氮降
还原为N2O[22]、有机氮降![]() 还原为
还原为![]() 和溶解性有机氮利用[25]等氮元素的循环中起着重要作用,提示万峰湖水体中这些菌可能影响水体中氮元素的生物循环。万峰湖丰水期还含有一些特有的细菌,如光合自养细菌中的红细菌属、羊栖菜弧菌属(Limnohabitans)和蓝藻属(Cyanobacteria),这可能与万峰湖在丰水期日照充足有关。枯水期特有的细菌包含较多的单胞菌,如玫瑰单胞菌属(Roseomonas)和嗜冷菌属(Algoriphagus),这些菌被认为在菌-藻共生体系培养中可促进水华鱼腥藻和铜绿微囊藻的生长[26-27],枯水期恰是藻类快速生长的季节。酸微菌属多分布在酸性湖泊、海洋等环境中[28],具有较强的氧化Fe2+和CO2固定能力。万峰湖枯水期酸微菌属比例高,可能与万峰湖属于喀斯特地貌水体,水中
和溶解性有机氮利用[25]等氮元素的循环中起着重要作用,提示万峰湖水体中这些菌可能影响水体中氮元素的生物循环。万峰湖丰水期还含有一些特有的细菌,如光合自养细菌中的红细菌属、羊栖菜弧菌属(Limnohabitans)和蓝藻属(Cyanobacteria),这可能与万峰湖在丰水期日照充足有关。枯水期特有的细菌包含较多的单胞菌,如玫瑰单胞菌属(Roseomonas)和嗜冷菌属(Algoriphagus),这些菌被认为在菌-藻共生体系培养中可促进水华鱼腥藻和铜绿微囊藻的生长[26-27],枯水期恰是藻类快速生长的季节。酸微菌属多分布在酸性湖泊、海洋等环境中[28],具有较强的氧化Fe2+和CO2固定能力。万峰湖枯水期酸微菌属比例高,可能与万峰湖属于喀斯特地貌水体,水中![]() 离子浓度高有关。
离子浓度高有关。
3.2 丰水期和枯水期菌群功能预测
基于高通量测序的PICRUSt功能预测分析因成本低、方便快捷和预测结果可靠等优点,已广泛应用于海洋、湖泊和土壤微生物等多种生境的研究中[29]。董志颖等[30]采用PICRUSt功能预测分析了氮输入对细菌群落代谢潜力的影响,发现氮输入是在一定程度上影响固氮、硝化、反硝化和同化硝酸盐还原等途径的关键基因。本研究结果显示,万峰湖的浮游细菌主要涉及物质运输、代谢机理和信号转导等生物代谢通路。以BJ取样点丰水期和枯水期的数据为例,基于KEGG和COG数据库的功能预测结果表明,氨基酸运输和代谢均为最主要的功能基因家族,且枯水期的基因拷贝数目明显高于丰水期,这表明,枯水期微生物的代谢活动尤其是氮循环代谢比较活跃。万峰湖丰水期(11月)的气温明显低于枯水期(5月),说明温度等季节环境因子是影响万峰湖细菌群落结构组成的重要因素。本研究中,将PICRUSt功能预测分析与高通量测序技术相结合,研究结果可为探明万峰湖细菌群落的组成和功能提供科学参考。
4 结论
1)万峰湖丰水期和枯水期细菌群落组成相似,但细菌丰度和多样性存在明显差异,说明季节因素是影响细菌群落组成的重要环境因子。
2)万峰湖在丰水期和枯水期均有其特有的细菌群落结构。
3)PICRUSt功能预测显示,枯水期菌群代谢途径的基因拷贝数明显高于丰水期,说明枯水期菌群代谢更为活跃。
[1] 李秋华,商立海,李广辉,等.万峰湖浮游植物群落的时空分布[J].生态学杂志,2011,30(5):1031-1038.
LI Q H,SHANG L H,LI G H,et al.Temporal and spatial characteristics of phytoplankton community in Wanfeng Reservoir[J].Chinese Journal of Ecology,2011,30(5):1031-1038.(in Chinese)
[2] 刘兰英,吕新,陈丽华,等.福州左海湖细菌群落的季节性变化特征及典范对应分析[J].福建农业学报,2016,31(7):758-764.
LIU L Y,LÜ X,CHEN L H,et al.Seasonal changes on and environmental factors affecting bacterial community at Zuohai Lake in Fuzhou[J].Fujian Journal of Agricultural Sciences,2016,31(7):758-764.(in Chinese)
[3] 沈烽,赵大勇,黄睿,等.南京玄武湖浮游细菌群落结构的季节变化及其与环境因子的关系[J].湖泊科学,2017,29(3):662-669.
SHEN F,ZHAO D Y,HUANG R,et al.Seasonal variation of bacterioplankton community structure in Xuanwu Lake(Nanjing)and its relationship with environmental factors[J].Journal of Lake Sciences,2017,29(3):662-669.(in Chinese)
[4] 邢鹏,孔繁翔,高光.太湖浮游细菌种群基因多样性及其季节变化规律[J].湖泊科学,2007,19(4):373-381.
XING P,KONG F X,GAO G.Phylogenetic diversity and seasonal variation of bacterioplankton communities in Lake Taihu[J].Journal of Lake Sciences,2007,19(4):373-381.(in Chinese)
[5] JI B,LIU C,LIANG J,et al.Seasonal succession of bacterial communities in three eutrophic freshwater lakes[J].International Journal of Environmental Research and Public Health,2021,18(13):6950.
[6] PARUCH L,PARUCH A M,EIKEN H G,et al.Seasonal dynamics of lotic bacterial communities assessed by 16S rRNA gene amplicon deep sequencing[J].Scientific Reports,2020,10:16399.
[7] LI X Y,LI Y,YANG Z L,et al. Comparison of the composition,diversity and spatiotemporal dynamics of bacterial communities in Lake Taihu and Lake Yangcheng,Jiangsu,China [J]. Life Science Research,2020,24(3): 187-198.
[8] 吕锡斌,吴云成,陈良强,等.赤水河流域浮游细菌群落特征及其与水质的关系[J].环境科学学报,2021,41(11):4596-4605.
LÜ X B,WU Y C,CHEN L Q,et al.Characteristics of the bacterioplankton community and their relationships with water quality in Chishui River basin[J].Acta Scientiae Circumstantiae,2021,41(11):4596-4605.(in Chinese)
[9] 郑国华,黄虹,涂祖新,等.鄱阳湖细菌群落多样性与水环境相关性分析[J].江西农业大学学报,2017,39(3):549-558.
ZHENG G H,HUANG H,TU Z X,et al.An analysis of correlation between bacterial diversity and water environment in Poyang Lake[J].Acta Agriculturae Universitatis Jiangxiensis,2017,39(3):549-558.(in Chinese)
[10] 罗同阳,高庆华,董聪,等.白洋淀水域夏季细菌群落结构及与环境因子的关系[J].淡水渔业,2021,51(1):96-102.
LUO T Y,GAO Q H,DONG C,et al.Bacterial community structure in Baiyangdian Lake in summer and its relationship with environmental factors[J].Freshwater Fisheries,2021,51(1):96-102.(in Chinese)
[11] 邹沈娟,尹立强,赵博礼,等.梁子湖与后官湖浮游细菌的群落结构特征[J].水生态学杂志,2021,42(2):33-41.
ZOU S J,YIN L Q,ZHAO B L,et al.Bacterioplankton community structure characteristics in Liangzi Lake and Houguan Lake,Wuhan[J].Journal of Hydroecology,2021,42(2):33-41.(in Chinese)
[12] 边园琦,邢鹏,李化炳,等.贫营养湖泊花神湖和紫霞湖浮游细菌群落结构分析[J].生态科学,2010,29(2):109-115.
BIAN Y Q,XING P,LI H B,et al.Analysis on bacterioplankton community structure in two oligotrophic lakes,Huashen Lake and Zixia Lake[J].Ecological Science,2010,29(2):109-115.(in Chinese)
[13] 杜蕾,李畅游,李文宝,等.夏季达里诺尔湖浮游细菌群落表、底层结构特征及其关键驱动因子[J].生态科学,2021,40(6):13-20.
DU L,LI C Y,LI W B,et al.Surface and bottom characteristics of bacterioplankton community in summer Dalinor Lake and its key driving factors[J].Ecological Science,2021,40(6):13-20.(in Chinese)
[14] LANGILLE M G I,ZANEVELD J,CAPORASO J G,et al.Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J].Nature Biotechnology,2013,31 (9):814-821.
[15] 赵卓丽.瑞滇热泉原核微生物多样性研究及纤维素酶和木聚糖酶资源挖掘[D].新乡:河南师范大学,2019.
ZHAO Z L.Study on prokaryotic microbial diversity of Ruidian hot spring and exploitation of cellulase and xylanase resources[D].Xinxiang:Henan Normal University,2019.(in Chinese)
[16] SUH S S,PARK M,HWANG J,et al.Seasonal dynamics of marine microbial community in the south sea of Korea[J].PLoS One,2015,10(6):e0131633.
[17] WATANABE K,KOMATSU N,ISHII Y,et al.Effective isolation of bacterioplankton genus Polynucleobacter from freshwater environments grown on photochemically degraded dissolved organic matter[J].FEMS Microbiology Ecology,2009,67(1):57-68.
[18] KARBASDEHI V N,DOBARADARAN S,NABIPOUR I,et al.Indicator bacteria community in seawater and coastal sediment:the Persian Gulf as a case[J].Journal of Environmental Health Science &Engineering,2017,15(1):6-20.
[19] 寇文伯,黄正云,张杰,等.鄱阳湖湖泊细菌群落组成及结构:以松门山为例[J].生态学报,2015,35(23):7608-7614.
KOU W B,HUANG Z Y,ZHANG J,et al.Bacterial community structure and composition in Lake Poyang:a case study in the Songmenshan Region,China[J].Acta Ecologica Sinica,2015,35(23):7608-7614.(in Chinese)
[20] 凌泽春,杨红玲,孙云章,等.斜带石斑鱼幼鱼消化道与养殖水体中可培养菌群的研究[J].大连水产学院学报,2009,24(6):497-503.
LING Z C,YANG H L,SUN Y Z,et al.Cultivable microbiota in the gut of juvenile grouper Epinephelus coioides and in aquaculture water[J].Journal of Dalian Fisheries College,2009,24(6):497-503.(in Chinese)
[21] 杨莺莺,李卓佳,林亮,等.人工饲料饲养的对虾肠道菌群和水体细菌区系的研究[J].热带海洋学报,2006,25(3):53-56.
YANG Y Y,LI Z J,LIN L,et al.Analyses on intestinal flora of cultured shrimp and water microbial flora[J].Journal of Tropical Oceanography,2006,25(3):53-56.(in Chinese)
[22] HORN M A,IHSSEN J,MATTHIES C,et al.Dechloromonas denitrificans sp.nov.,Flavobacterium denitrificans sp.nov.,Paenibacillus anaericanus sp.nov.and Paenibacillus terrae strain MH72,N2O-producing bacteria isolated from the gut of the earthworm Aporrectodea caliginosa[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(3):1255-1265.
[23] JETTEN M.The microbial nitrogen cycle[J].Environ Microbiol,2008,10(11):2903-2909.
[24] ZENG Y,KASALICKY V, IMEK K,et al.Genome sequences of two freshwater betaproteobacterial isolates,Limnohabitans species strains Rim28 and Rim47,indicate their capabilities as both photoautotrophs and ammonia oxidizers[J].Journal of Bacteriology,2012,194(22):6302-6303.
IMEK K,et al.Genome sequences of two freshwater betaproteobacterial isolates,Limnohabitans species strains Rim28 and Rim47,indicate their capabilities as both photoautotrophs and ammonia oxidizers[J].Journal of Bacteriology,2012,194(22):6302-6303.
[25] ORSI W D,SMITH J M,LIU S,et al.Diverse,uncultivated bacteria and Archaea underlying the cycling of dissolved protein in the ocean [J].The ISME Journal,2016,10 (9):2158-2173.
[26] 柳青.菌-藻共生体系稳定培养建立及条件优化研究[D].重庆:中国科学院大学(中国科学院重庆绿色智能技术研究院),2018.
LIU Q.Establishment of stable culture and optimization of symbiotic system of bacteria and algae[D].Chongqing:University of Chinese Academy of Sciences(Chongqing Institute of Green and Intelligent Technology,Chinese Academy of Sciences),2018.(in Chinese)
[27] 熊青山.对铜绿微囊藻具有溶藻作用的一组细菌群落研究[D].重庆:重庆师范大学,2016.
XIONG Q S.Research of A group bacterial community that lyse Microcystis aeruginosa[D].Chongqing:Chongqing Normal University,2016.(in Chinese)
[28] 何媛秋,龙丽娟,田新朋.酸微菌纲(Acidimicrobiia)的研究概况[J].微生物学通报,2020,47(6):1945-1957.
HE Y Q,LONG L J,TIAN X P.Recent advances in the class (Acidimicrobiia)[J].Microbiology China,2020,47(6):1945-1957.(in Chinese)
[29] 阴星望,田伟,丁一,等.丹江口库区表层沉积物细菌多样性及功能预测分析[J].湖泊科学,2018,30(4):1052-1063.
YIN X W,TIAN W,DING Y,et al.Composition and predictive functional analysis of bacterial communities in surface sediments of the Danjiangkou Reservoir[J].Journal of Lake Sciences,2018,30(4):1052-1063.(in Chinese)
[30] 董志颖,洪慢,胡晗静,等.过量氮输入对寡营养海水细菌群落代谢潜力的影响[J].环境科学学报,2018,38(2):457-466.
DONG Z Y,HONG M,HU H J,et al.Effect of excess nitrogen loading on the metabolic potential of the bacterial community in oligotrophic coastal water[J].Acta Scientiae Circumstantiae,2018,38(2):457-466.(in Chinese)