碳水化合物作为一种重要的非蛋白能量来源,具有价格低廉、来源丰富的优点,被广泛应用于水产饲料中。大量研究表明,在适宜的添加范围内,碳水化合物可以提高鱼类的生长效率[1]。在鲤(Cyprinus carpio)饲料中添加250 g/kg葡萄糖和500 g/kg淀粉,可以获得最佳的增重率和特定生长率[2]。摄食20%高淀粉饲料的鲈(Siniperca chuatsi)仔鱼和幼鱼生长性能(总长、体长和体质量)均显著高于对照组[3]。然而,饲料中过量的碳水化合物则会降低鱼类生长性能和免疫力,提高其血糖水平,导致糖代谢紊乱,并诱导鱼体内脂质的沉积。在草鱼(Ctenopharyngodon idella)中发现,高玉米淀粉饲料可诱导脂质沉积,升高血清中总胆固醇和总脂质含量,进而通过上调瘦素和厌食基因表达抑制食欲[4]。
益生菌是活的微生物,可以提供维生素、脂肪酸和必需氨基酸等微量营养素,促进水生动物的健康生长[5]。益生菌不仅可以影响宿主肠道菌群,通过调节肠道通透性来改善肠道免疫屏障功能[6],还具有促进宿主生长发育,增强肠道和黏膜耐受性,以及刺激免疫反应、提高抗病性的能力[7]。在鱼类中,饲料中补充芽孢杆菌、乳酸杆菌等益生菌可以提高其对饲料营养物质的吸收[8],改善生长性能,缓解炎症反应[9],提高成活率,同时还具有改善养殖水质的作用[10]。在哺乳动物中,大量研究报道证实了益生菌可以通过影响肠道菌群而调控碳水化合物等营养物质的代谢能力,从而影响机体对碳水化合物的利用[11-13]。在鱼类中也有类似的发现,刘寒等[14]研究表明,高糖高脂饲料可引起团头鲂(Megalobrama amblycephala)肠道菌群失调。以斑马鱼(Danio rerio)为模型的研究证明,饲料中补充鲸蜡杆菌(Cetobacterium somerae)可以增加胰岛素表达,起到改善葡萄糖稳态的作用[15]。
团头鲂是中国大宗淡水养殖鱼类品种之一,对饲料中碳水化合物的耐受能力和利用能力相对较弱。1989年,杨国华等[16]在团头鲂精制饲料中添加不同水平的碳水化合物,确定其适宜的碳水化合物添加量为25%~30%,体质量为15 g左右的团头鲂幼鱼饲料适宜的碳水化合物水平为31%[17]。摄食高碳水化合物饲料不利于团头鲂的生长,会引起其肝脏中脂质过量沉积,导致免疫能力下降[18]。本研究中,以团头鲂幼鱼“华海1号”为研究对象,通过在不同淀粉水平饲料中分别添加枯草芽孢杆菌和植物乳杆菌,探讨两种益生菌对团头鲂高淀粉饲料利用的影响,以期为团头鲂的饲料营养研究提供科学参考。
1 材料与方法
1.1 材料
试验用团头鲂“华海1号”来自国家级团头鲂原良种场(湖北武汉)。养殖试验在中国水产科学研究院淡水渔业研究中心南泉试验基地(120°28″E,31°43″N)开展。挑选360尾体质健康、规格均一的团头鲂幼鱼(初始体质量为13.5 g±0.5 g)暂养1周。
1.2 方法
1.2.1 试验饲料的制备 以鱼粉、豆粕、菜粕和棉粕为蛋白源,小麦淀粉为可消化淀粉源(均由通威股份有限公司提供),豆油为脂肪源,并添加预混料(由无锡华诺威动物保健品有限公司提供)及其他原料,配制低淀粉对照饲料(15%小麦淀粉,记为15WM)和高淀粉对照饲料(30%小麦淀粉,记为30WM)。在此基础上分别添加枯草芽孢杆菌(Bacillus subtilis,BAC)和植物乳杆菌(Lactobacillus plantarum,LAB)(菌种来源于江苏省苏微微生物研究有限公司),共配制4种含益生菌的试验饲料,分别记为低淀粉枯草芽孢杆菌15WM+BAC、低淀粉植物乳杆菌15WM+LAB、高淀粉枯草芽孢杆菌30WM+BAC和高淀粉植物乳杆菌30WM+LAB。经平板涂布确定最终饲料中益生菌浓度为1×106 CFU/g饲料。对照饲料配方见表1。
表1 不同小麦淀粉水平试验饲料配方及营养成分
Tab.1 Ingredients and nutrient composition of the experimental diets with different wheat starchw/%
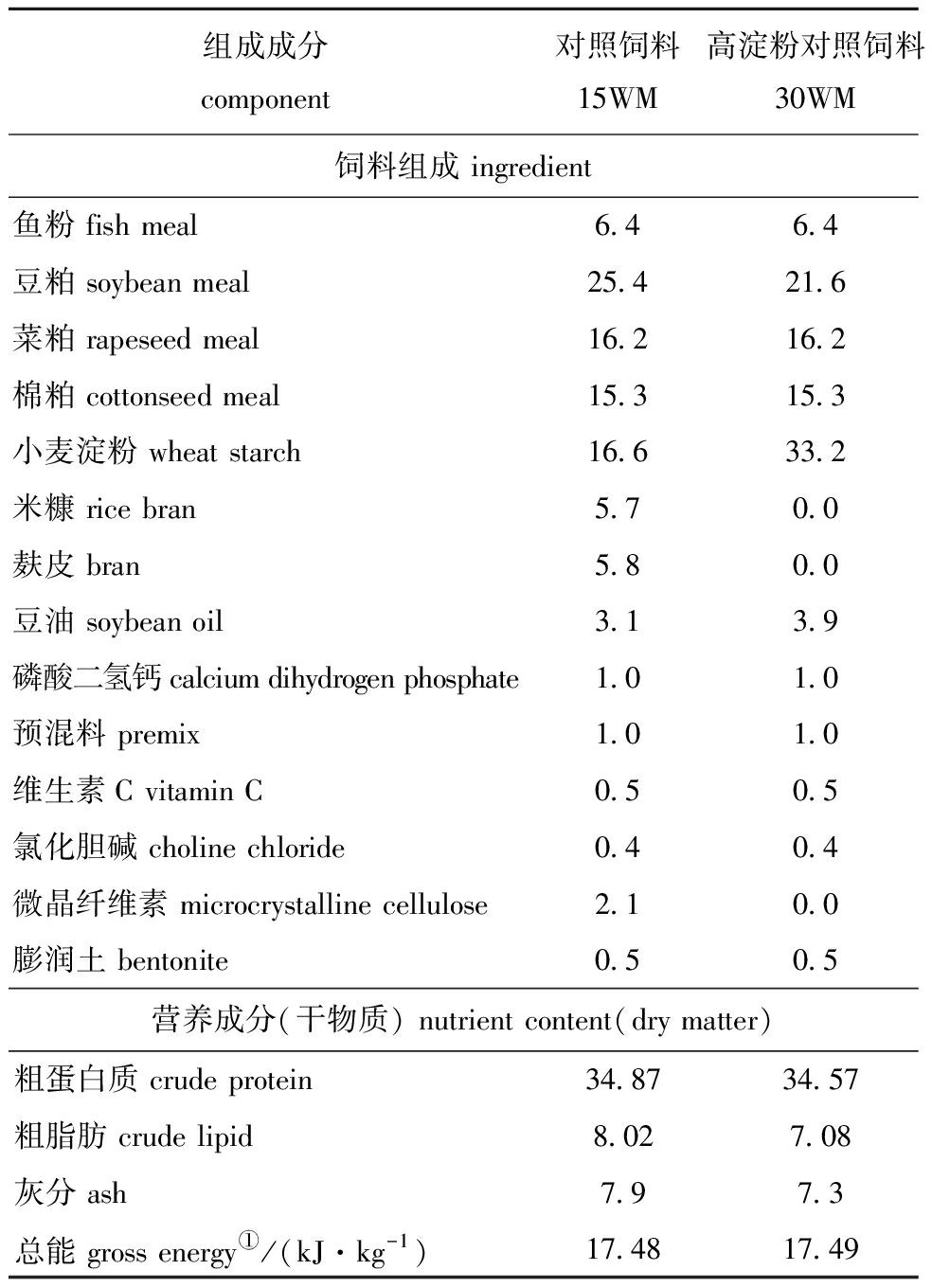
组成成分 component 对照饲料15WM高淀粉对照饲料30WM饲料组成 ingredient鱼粉 fish meal6.46.4豆粕 soybean meal25.421.6菜粕 rapeseed meal16.216.2棉粕 cottonseed meal15.315.3小麦淀粉 wheat starch16.633.2米糠 rice bran5.70.0麸皮 bran5.80.0豆油 soybean oil3.13.9磷酸二氢钙 calcium dihydrogen phosphate1.01.0预混料 premix1.01.0维生素C vitamin C0.50.5氯化胆碱 choline chloride0.40.4微晶纤维素 microcrystalline cellulose2.10.0膨润土 bentonite0.50.5营养成分(干物质) nutrient content(dry matter)粗蛋白质 crude protein34.8734.57粗脂肪 crude lipid8.027.08灰分 ash7.97.3总能 gross energy①/(kJ·kg-1)17.4817.49
注:①总能根据蛋白质、脂肪和碳水化合物的能量系数(分别为23.6、39.5和17.2 kJ/g)来计算。
Note:①Gross energy is calculated from the energy coefficients of protein,fat and carbohydrate (23.6,39.5 and 17.2 kJ/g,respectively).
1.2.2 养殖管理 试验鱼暂养结束后禁食24 h,挑选体格健壮、 规格均一的团头鲂幼鱼,随机分入18个室外网箱(1 m×1 m×1 m),每个网箱放置20尾鱼,分为6组,每组设置3个重复,每天饱食投喂试验饲料3次(8:00、12:00和17:00),养殖试验为期8周。养殖期间,水温为28~31 ℃,溶氧≥7 mg/L,氨氮≤0.1 mg/L,pH为7.3~7.8,采用自然光照周期,每周测定养殖水质情况。
1.2.3 样品采集 8周养殖试验结束后,禁食24 h。统计每个网箱中鱼的数量并称量总质量,用于分析增重率、特定生长率和饲料系数等生长指标。随后,从每个网箱中随机选取6尾鱼,用100 mg/L MS-222进行麻醉,称量个体质量后,立即用肝素钠润湿的注射器从尾静脉处抽血,将血液样品置于抗凝管中,低温静置30 min后,4 ℃、4 000 r/min离心10 min,收集上层血清样品-20 ℃冷冻保存,用于血清生化指标的测定。从抽血后的6尾鱼中,选择1尾鱼解剖,采集肝脏样品,用生理盐水冲洗后置于体积分数为4%的多聚甲醛中固定,用于冰冻切片制作。剩余5尾鱼从腹腔解剖,快速分离内脏团、肝脏和肠道,用于计算脏体比(viscera index,VSI)、肝体比(hepatosmatic index,HSI)和肠体比(viserosomatic index,VI)等脏器指数;采集肝脏样品-20 ℃冷冻保存,用于肝脏抗氧化指标的测定;采集背部去鳞肌肉-20 ℃冷冻保存,用于鱼体肌肉营养成分的测定。
1.2.4 生长性能指标的计算 增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、饲料系数(feed conversion ratio,FCR)、脏体比、肝体比和肠体比计算公式为
RWG=(Wt-W0)/W0×100%,
(1)
RSG=(lnWt-lnW0)/t×100%,
(2)
RFC=F/(Wt-W0),
(3)
IVS=WV/WB×100%,
(4)
IHS=WL/WB×100%,
(5)
IV=WI/WB×100%。
(6)
式中:RWG为增重率(%);RSG为特定生长率(%/d);RFC为饲料系数;IVS为脏体比(%);IHS为肝体比(%);IV为肠体比(%);W0为初始质量(g);Wt为终末质量(g);t为饲喂时间(d);F为摄食饲料总量(风干基础)(g);WB为每尾鱼终末个体质量(g);WV为每尾鱼内脏质量(g);WL为每尾鱼的肝脏质量(g);WI为每尾鱼的肠道质量(g)。
1.2.5 饲料和肌肉营养成分的测定 饲料和肌肉水分、粗蛋白质、粗脂肪和灰分含量参照国标规定方法进行测定。采用凯氏定氮法(GB/T 6432—1994)测定粗蛋白质含量;采用索氏抽提法(GB/T 6433—1994)测定粗脂肪含量;采用560 ℃灼烧法(GB/T 6438—1992)测定灰分含量。
1.2.6 血清生化指标的测定 采用深圳迈瑞全自动生化分析仪(BS-400 Q2080,中国深圳)测定血清中的血糖(glucose,GLU)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)和碱性磷酸酶(alkaline phosphatase,ALP)含量,所用试剂盒均购自深圳迈瑞有限公司。
1.2.7 肝脏抗氧化指标的测定 在冰水浴条件下,将肝脏样品用无菌生理盐水(二者按1 g∶9 mL)匀浆后,4 ℃、4000 r/min离心10 min,收集上清液获得10%肝脏匀浆液,用于肝脏总超氧化物歧化酶(total superoxide dismutase,T-SOD)活性、还原型谷胱甘肽(reduced glutathione,GSH)含量、过氧化氢酶(catalase,CAT)活性和丙二醛(malondialdehyde,MDA)含量的测定,试剂盒均购自南京建成生物工程研究所。
1.2.8 肝脏冰冻切片油红O染色分析 将固定于4%多聚甲醛中的肝脏组织块取出,用质量分数为30%的蔗糖溶液在4 ℃下脱水,待组织沉到溶液底部时脱水完成,然后用滤纸吸干组织表面的水分,用镊子调整组织方向,放置于包埋架上。加入包埋剂OTC(optimal cutting temperature compound),确保组织完全浸入,冷冻硬化后进行组织切片。用体积分数为60%的异丙醇漂洗组织切片20~30 s,用油红O染色30 min,之后用双蒸水清洗3次。待玻片晾干后,滴加苏木素,对细胞核染色1~2 min,再用自来水冲洗5 min,使玻片充分干燥后封片。用Image J软件分析油红O染色的脂滴面积。
1.3 数据处理
试验数据以平均值±标准误(mean±S.E.)表示,采用SPSS 25.0软件进行数据统计与分析。试验数据均符合正态分布(Shapiro-Wilk test)并通过方差齐性检验(Levene’s test)。对各试验组间进行单因素方差分析(one-way ANOVA),采用Duncan检验法进行组间多重比较。采用双因素方差分析(two-way ANOVA)检验小麦淀粉添加水平和益生菌添加种类及其相互作用的影响。显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 摄食不同饲料对团头鲂饲料利用和生长性能的影响
从表2可见,饲料淀粉水平和益生菌种类均为影响团头鲂WGR、SGR和FCR的主效应因子(P<0.01),饲料中益生菌种类为影响团头鲂脏体比的主效应因子(P<0.05),淀粉水平与益生菌种类对团头鲂幼鱼肠体比具有极显著交互作用(P<0.01)。各试验组间的单因素方差分析显示:与15WM组、30WM组和15WM+BAC组相比,高淀粉饲料中添加植物乳杆菌(30WM+LAB)和枯草芽孢杆菌(30WM+BAC)均能显著提高团头鲂的增重率和特定生长率(P<0.05),降低饲料系数(P<0.05);15WM+BAC组、15WM+LAB组和30WM+BAC组团头鲂的脏体比显著低于30WM组(P<0.05);30WM组的肠体比显著低于15WM组(P<0.05),但在高淀粉饲料中添加植物乳杆菌后肠体比显著提高(P<0.05),并达到15WM组水平(表2)。
表2 饲料中不同淀粉水平和益生菌种类对团头鲂幼鱼生长性能的影响
Tab.2 Effects of different dietary wheat starch and probiotics on growth performance of Megalobrama amblycephala
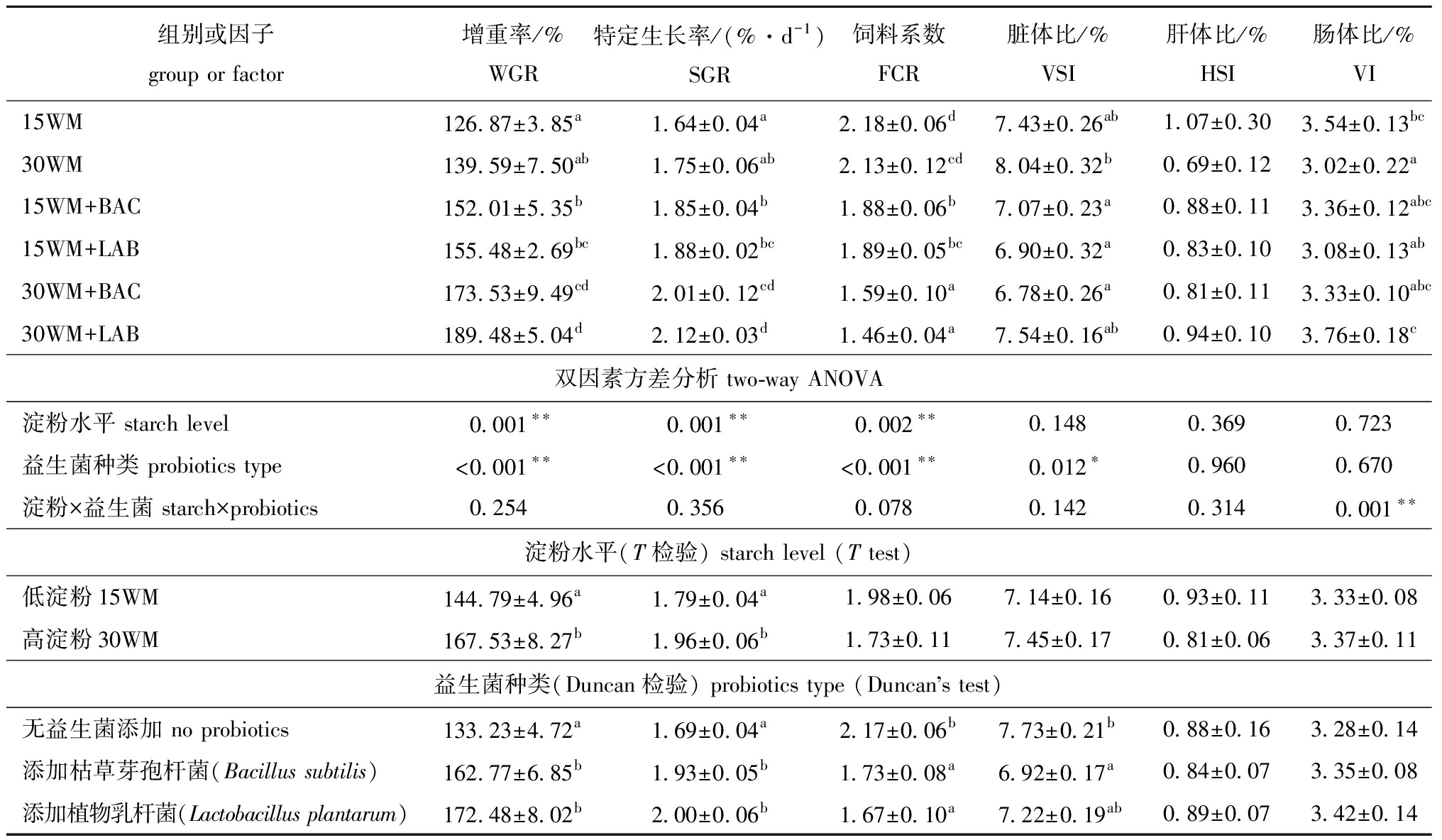
组别或因子 group or factor增重率/%WGR特定生长率/(%·d-1)SGR饲料系数FCR脏体比/%VSI肝体比/%HSI肠体比/%VI15WM126.87±3.85a1.64±0.04a2.18±0.06d7.43±0.26ab1.07±0.303.54±0.13bc30WM139.59±7.50ab1.75±0.06ab2.13±0.12cd8.04±0.32b0.69±0.123.02±0.22a15WM+BAC152.01±5.35b1.85±0.04b1.88±0.06b7.07±0.23a0.88±0.113.36±0.12abc15WM+LAB155.48±2.69bc1.88±0.02bc1.89±0.05bc6.90±0.32a0.83±0.103.08±0.13ab 30WM+BAC173.53±9.49cd2.01±0.12cd1.59±0.10a6.78±0.26a 0.81±0.113.33±0.10abc30WM+LAB189.48±5.04d2.12±0.03d1.46±0.04a7.54±0.16ab0.94±0.103.76±0.18c双因素方差分析 two-way ANOVA淀粉水平 starch level 0.001∗∗0.001∗∗0.002∗∗0.1480.3690.723益生菌种类 probiotics type <0.001∗∗<0.001∗∗<0.001∗∗0.012∗0.9600.670淀粉×益生菌 starch×probiotics0.2540.3560.0780.1420.3140.001∗∗淀粉水平(T检验) starch level (T test)低淀粉15WM144.79±4.96a1.79±0.04a1.98±0.067.14±0.160.93±0.113.33±0.08高淀粉30WM167.53±8.27b1.96±0.06b1.73±0.117.45±0.170.81±0.063.37±0.11益生菌种类(Duncan检验) probiotics type (Duncans test)无益生菌添加 no probiotics 133.23±4.72a1.69±0.04a2.17±0.06b7.73±0.21b0.88±0.163.28±0.14添加枯草芽孢杆菌(Bacillus subtilis)162.77±6.85b1.93±0.05b1.73±0.08a6.92±0.17a0.84±0.073.35±0.08添加植物乳杆菌(Lactobacillus plantarum)172.48±8.02b2.00±0.06b1.67±0.10a7.22±0.19ab0.89±0.073.42±0.14
注:同列中标有不同字母者表示不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05);*表示有显著性影响(P<0.05),**表示有极显著性影响(P<0.01);下同。
Note:The means with different letters within the same column are significant differences in different group at the 0.05 probability level,and the means with the same letter within the same column are not significant differences;*means significant effect(P<0.05),** means very significant effect(P<0.01);et sequentia.
2.2 摄食不同饲料对团头鲂肌肉营养成分的影响
从表3可见,饲料中淀粉水平和益生菌种类均是显著影响肌肉粗脂肪含量的主效应因子(P<0.05)。各试验组间的单因素方差分析显示:15WM+LAB组、30WM+BAC组和30WM+LAB组鱼体肌肉干物质中的粗脂肪含量均显著低于30WM组(P<0.05),而显著高于15WM+BAC组(P<0.05);各组间鱼体肌肉干物质中的粗蛋白质和灰分无显著性差异(P>0.05)(表3)。
表3 饲料中不同淀粉水平和益生菌种类对团头鲂幼鱼肌肉营养成分的影响(干基)
Tab.3 Effects of different dietary wheat starch and probiotics on muscle nutrient content in Megalobrama amblycephala (dry matter basis)

组别或因子group or factor粗脂肪/%crude lipid粗蛋白质/%crude protein灰分/%ash15WM4.75±0.39ab91.72±0.145.98±0.1430WM6.52±0.36c89.73±0.855.36±1.0015WM+BAC3.42±0.67a89.88±0.796.97±0.8215WM+LAB5.02±0.50b86.37±4.106.22±0.1930WM+BAC5.13±0.35b88.27±2.176.20±0.1230WM+LAB4.94±0.50b91.90±0.336.03±0.03双因素方差分析 two-way ANOVA 淀粉水平 starch level 0.007∗∗0.6890.254益生菌种类 probiotics type0.029∗0.6390.274淀粉×益生菌 starch×probiotics0.1060.1170.860淀粉水平(T检验)starch level (T test)低淀粉15WM4.40±0.3489.32±1.426.39±0.29高淀粉30WM5.53±0.2989.97±0.835.86±0.32益生菌种类(Duncan检验) probiotics type (Duncans test)无益生菌添加 no probiotics5.63±0.39b90.72±0.525.67±0.47添加枯草芽孢杆菌(Bacillus subtilis)4.28±0.45a89.08±1.126.59±0.41添加植物乳杆菌 (Lactobacillus plantarum)4.98±0.33ab89.13±2.156.12±0.10
2.3 摄食不同饲料对团头鲂血清生化指标的影响
从表4可见,饲料淀粉水平是影响血清GLU、LDL、TG和TC含量的主效应因子(P<0.05),益生菌种类是影响HDL和TC的主效应因子(P<0.05),淀粉水平与益生菌种类对幼鱼的GLU、HDL、TG、ALP均具有显著的交互作用(P<0.05)。各试验组间的单因素方法分析显示:与15WM组相比,30WM组的LDL、TC和ALP显著升高(P<0.05),而30WM+BAC组具有降低团头鲂血清LDL、TC和ALP含量的趋势,并接近15WM组水平(P>0.05);30WM+BAC组团头鲂血清GLU含量呈升高趋势,其GLU含量显著高于15WM+BAC组和15WM+LAB组(P<0.05)(表4)。
表4 饲料中不同淀粉水平和益生菌种类对团头鲂幼鱼血清生化指标的影响
Tab.4 Effects of different dietary wheat starch and probiotics on serum biochemical indices of Megalobrama amblycephala
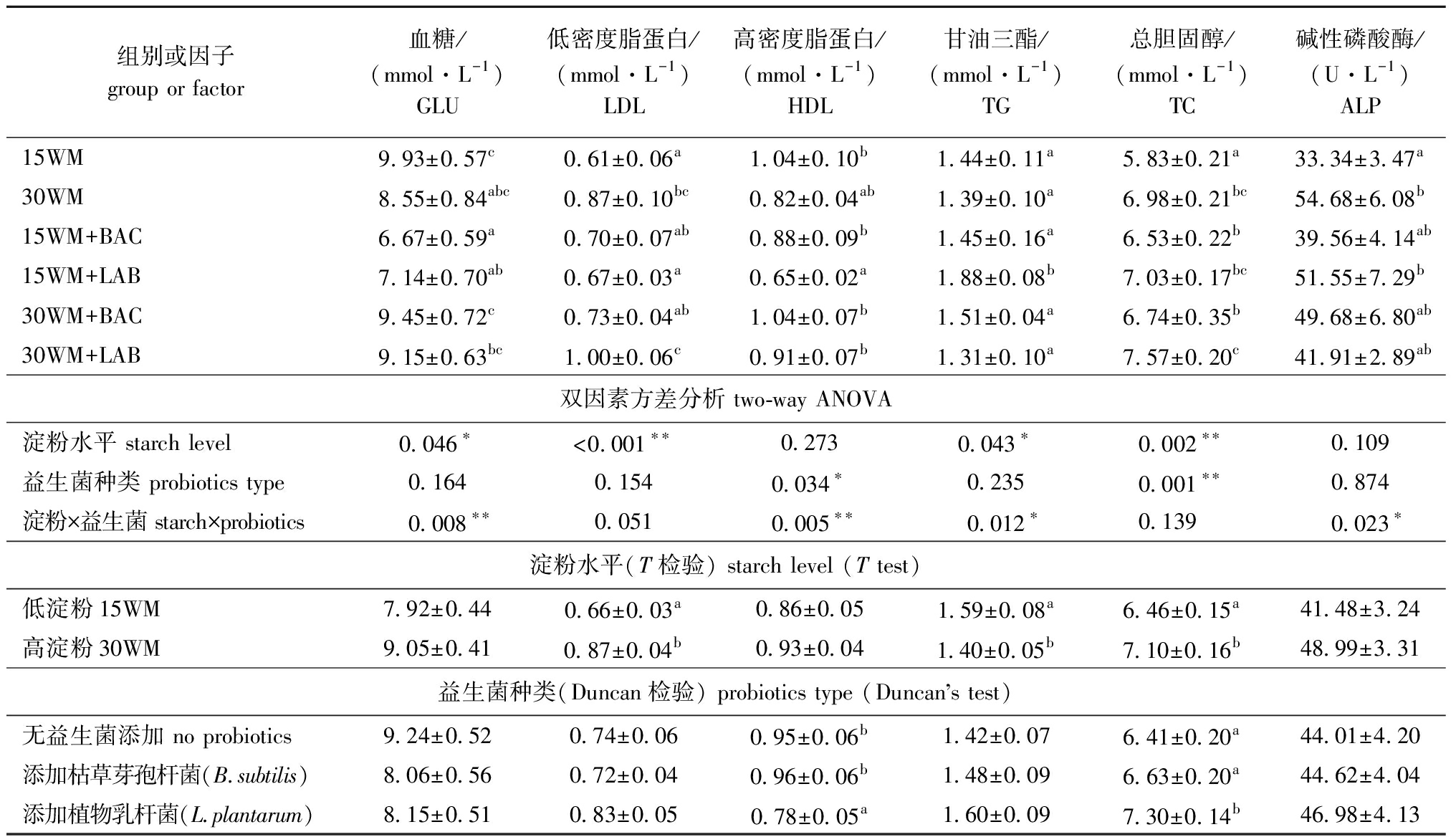
组别或因子group or factor血糖/(mmol·L-1) GLU低密度脂蛋白/(mmol·L-1) LDL高密度脂蛋白/(mmol·L-1) HDL甘油三酯/(mmol·L-1) TG总胆固醇/(mmol·L-1) TC碱性磷酸酶/(U·L-1) ALP15WM9.93±0.57c0.61±0.06a1.04±0.10b1.44±0.11a5.83±0.21a33.34±3.47a30WM8.55±0.84abc0.87±0.10bc0.82±0.04ab1.39±0.10a6.98±0.21bc54.68±6.08b15WM+BAC6.67±0.59a0.70±0.07ab0.88±0.09b1.45±0.16 a6.53±0.22b39.56±4.14ab15WM+LAB7.14±0.70ab0.67±0.03a0.65±0.02a1.88±0.08b7.03±0.17bc51.55±7.29b30WM+BAC9.45±0.72c0.73±0.04ab1.04±0.07b1.51±0.04a6.74±0.35b49.68±6.80ab30WM+LAB9.15±0.63bc1.00±0.06c0.91±0.07b1.31±0.10a7.57±0.20c41.91±2.89ab双因素方差分析 two-way ANOVA淀粉水平 starch level0.046∗<0.001∗∗0.2730.043∗0.002∗∗0.109益生菌种类 probiotics type0.1640.1540.034∗0.2350.001∗∗0.874淀粉×益生菌 starch×probiotics0.008∗∗0.0510.005∗∗0.012∗0.1390.023∗淀粉水平(T检验) starch level (T test)低淀粉15WM7.92±0.440.66±0.03a0.86±0.051.59±0.08a6.46±0.15a41.48±3.24高淀粉30WM9.05±0.410.87±0.04b0.93±0.041.40±0.05b7.10±0.16b48.99±3.31益生菌种类(Duncan检验) probiotics type (Duncans test)无益生菌添加 no probiotics9.24±0.520.74±0.060.95±0.06b1.42±0.076.41±0.20a44.01±4.20添加枯草芽孢杆菌(B.subtilis)8.06±0.560.72±0.040.96±0.06b1.48±0.096.63±0.20a44.62±4.04添加植物乳杆菌(L.plantarum)8.15±0.510.83±0.050.78±0.05a1.60±0.097.30±0.14b46.98±4.13
2.4 摄食不同饲料对团头鲂肝脏抗氧化能力的影响
从表5可见,饲料淀粉水平与益生菌种类对团头鲂幼鱼肝脏抗氧化指标无交互影响(P>0.05),但益生菌种类对肝脏T-SOD活性存在极显著性影响(P<0.01)。各试验组间单因素方差分析显示,30WM+LAB组团头鲂肝脏T-SOD活性显著高于15WM组、30WM组和15WM+BAC组(P<0.05),但各组间GSH含量、CAT活性和MDA含量无显著性差异(P>0.05)(表5)。
表5 饲料中不同淀粉水平和益生菌种类对团头鲂幼鱼肝脏抗氧化能力的影响
Tab.5 Effects of different dietary wheat starch and probiotics on antioxidant capability of Megalobrama amblycephala
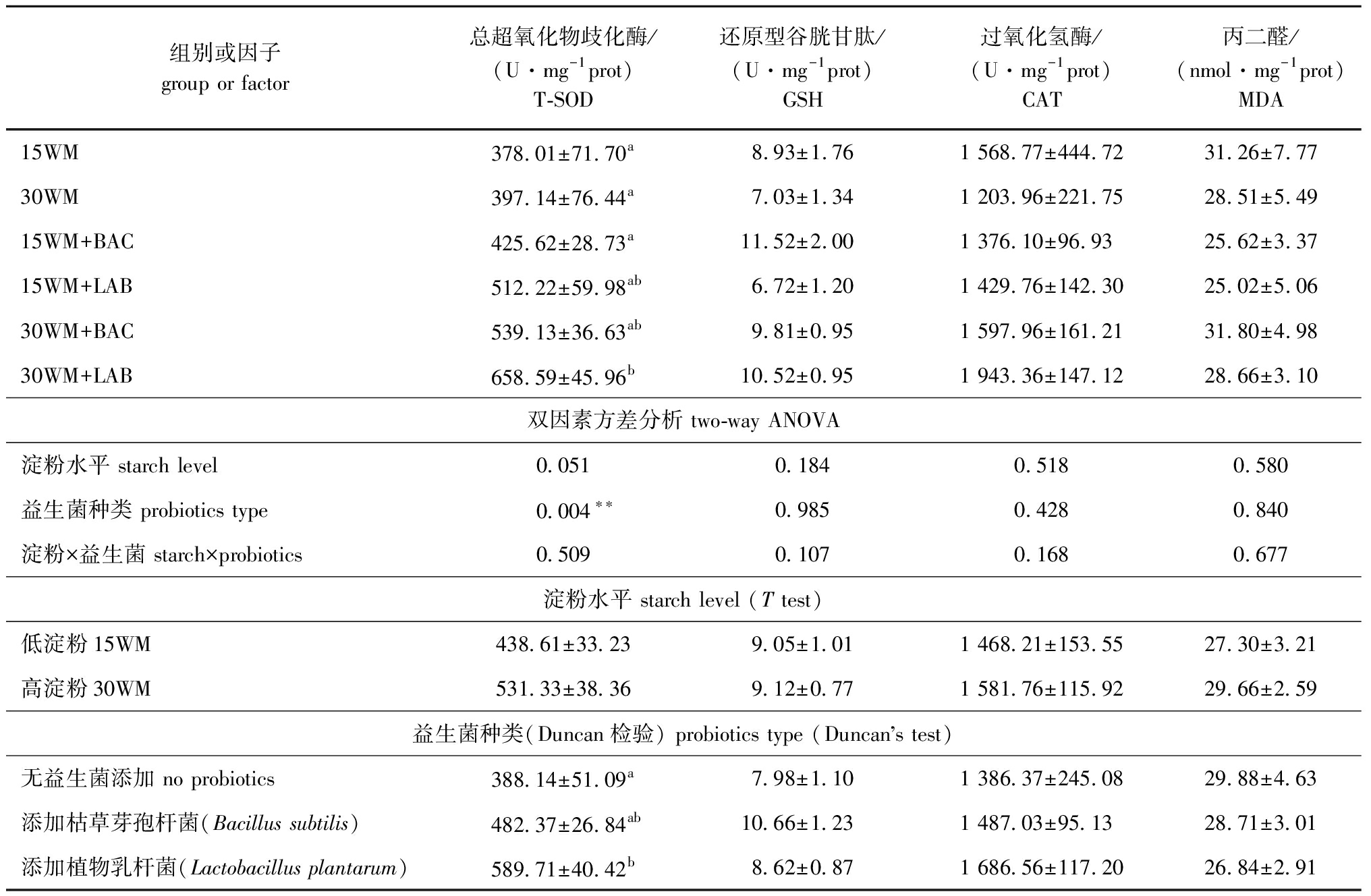
组别或因子group or factor总超氧化物歧化酶/(U·mg-1prot)T-SOD还原型谷胱甘肽/(U·mg-1prot)GSH过氧化氢酶/(U·mg-1prot)CAT丙二醛/(nmol·mg-1prot)MDA15WM378.01±71.70a8.93±1.761 568.77±444.7231.26±7.7730WM397.14±76.44a7.03±1.341 203.96±221.7528.51±5.49 15WM+BAC425.62±28.73a11.52±2.001 376.10±96.9325.62±3.3715WM+LAB512.22±59.98ab6.72±1.201 429.76±142.3025.02±5.0630WM+BAC539.13±36.63ab9.81±0.951 597.96±161.2131.80±4.9830WM+LAB658.59±45.96b10.52±0.951 943.36±147.1228.66±3.10双因素方差分析 two-way ANOVA淀粉水平 starch level 0.0510.1840.5180.580益生菌种类 probiotics type0.004∗∗0.9850.4280.840淀粉×益生菌 starch×probiotics0.5090.1070.1680.677淀粉水平 starch level (T test)低淀粉15WM438.61±33.239.05±1.011 468.21±153.5527.30±3.21高淀粉30WM531.33±38.369.12±0.771 581.76±115.9229.66±2.59益生菌种类(Duncan检验) probiotics type (Duncans test)无益生菌添加 no probiotics388.14±51.09a7.98±1.101 386.37±245.0829.88±4.63添加枯草芽孢杆菌(Bacillus subtilis)482.37±26.84ab10.66±1.231 487.03±95.1328.71±3.01添加植物乳杆菌(Lactobacillus plantarum)589.71±40.42b8.62±0.871 686.56±117.2026.84±2.91
2.5 摄食不同饲料对团头鲂肝脏切片脂质沉积的影响
肝组织切片油红O染色分析显示,养殖8周后,30WM组团头鲂幼鱼肝脏切片的脂质含量显著高于15WM组(P<0.05),而高淀粉饲料中添加植物乳杆菌(30WM+LAB)可显著减少脂滴含量(P<0.05)(图1、表6)。
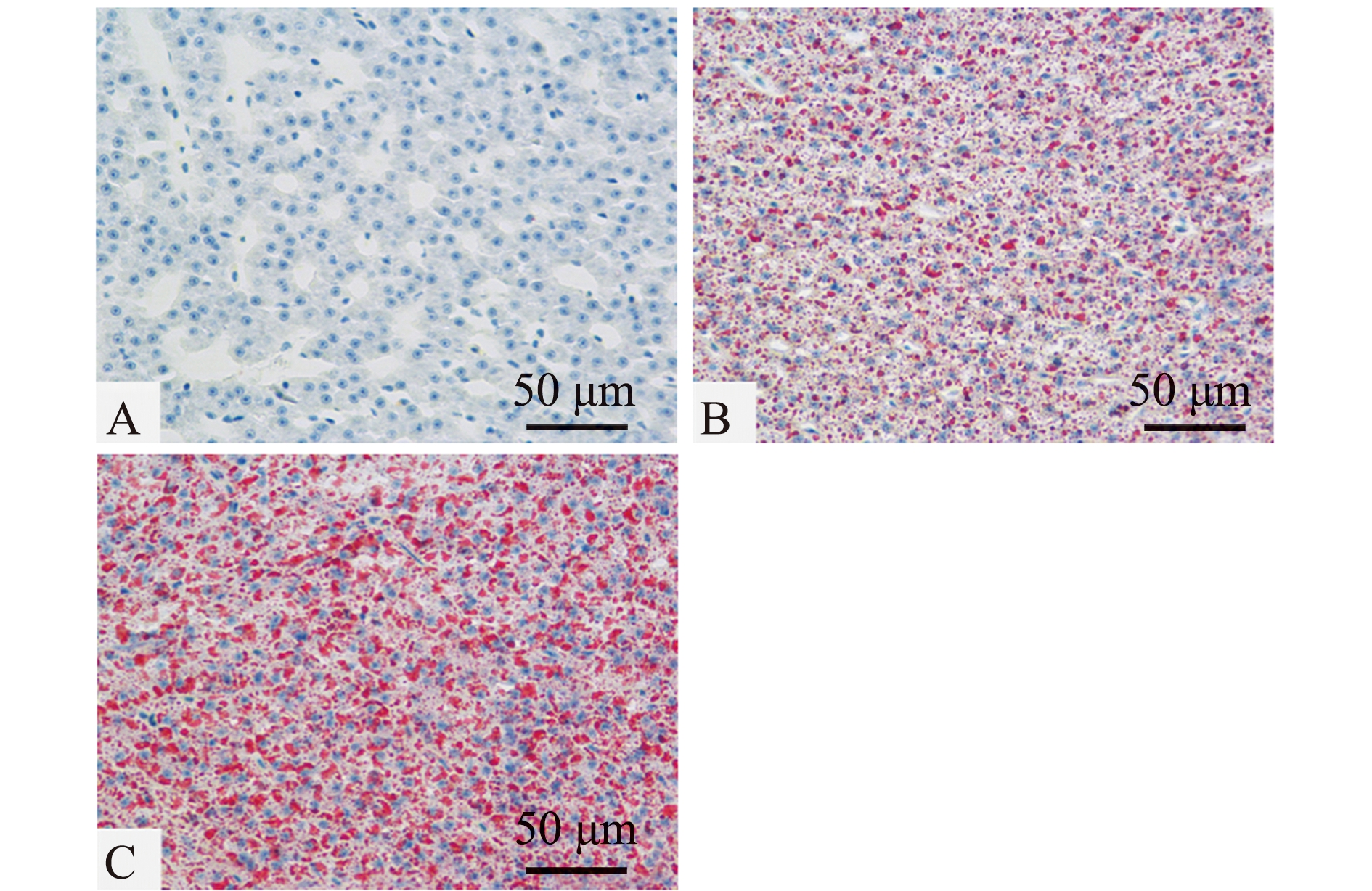
A—15WM组;B—30WM+LAB组;C—30WM组。图中红色表示脂滴,蓝色表示细胞核。
A—15WM group;B—30WM+LAB group;C—30WM group.In the figure,red indicates lipid droplets,and blue indicates cell nuclei.
图1 摄食不同饲料的团头鲂幼鱼肝脏油红O染色切片
Fig.1 Liver oil red O stained sections of Megalobrama amblycephala fed with different experimental diets
表6 摄食不同试验日粮的团头鲂幼鱼肝脏切片脂滴面积分析
Tab.6 Analysis of lipid droplet area in liver oil red O stained sections of Megalobrama amblycephala fed with different diets
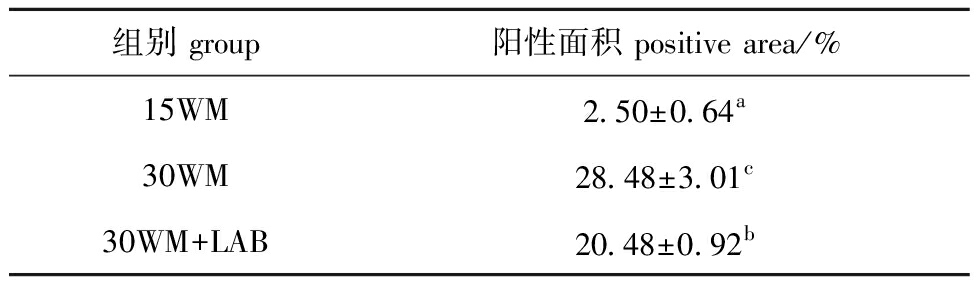
组别 group阳性面积 positive area/%15WM2.50±0.64a30WM28.48±3.01c30WM+LAB20.48±0.92b
3 讨论
3.1 摄食不同饲料对团头鲂幼鱼生长性能和肌肉营养成分的影响
鱼类可以利用一定量的碳水化合物,但淀粉水平过高可能会抑制鱼体生长[19]。本研究中,团头鲂幼鱼摄食高淀粉饲料8周后生长性能与低淀粉对照饲料组相比略有提高,但无显著性差异,这可能与试验饲料的配方组成有关。本研究中,对照组饲料模拟商品饲料组成,选用豆粕、菜粕、棉粕、米糠、麸皮和微晶纤维素等原料,利用豆粕、米糠、麸皮和微晶纤维素来调节小麦淀粉含量的变化。由于豆粕等植物蛋白中非淀粉多糖和纤维素含量较为丰富,而鱼类对植物非淀粉多糖和纤维素利用能力较差[20]。非淀粉多糖具有高保水能力,会影响鱼的食糜黏度,通过降低饲料转运时间,可减少鱼类肠道酶与饲料大分子的作用,因此,可能导致鱼类生长性能下降[21]。在饲料中添加益生菌能有效促进鱼类生长。有研究发现,在饲料中添加植物乳杆菌和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)均能够提高尼罗罗非鱼(Oreochromis niloticus)的饲料利用率和生长性能[22]。本研究中,与高淀粉对照饲料相比,在高淀粉饲料中添加106 CFU/g的枯草芽孢杆菌和植物乳杆菌均能显著提高团头鲂幼鱼的增重率、特定生长率,并降低饲料系数,表明枯草芽孢杆菌和植物乳杆菌同样改善了团头鲂对高淀粉饲料的利用效果并促进其生长。在哺乳动物中,用约氏乳杆菌(Lactobacillus johnsonii)饲喂肉鸡能够促进肠绒毛的发育,提高小肠对营养物质的吸收效率,进而提高生长性能[23]。同样,本研究高淀粉饲料中添加植物乳杆菌能提高鱼体肠体比,推断益生菌的摄入可以通过促进肠道发育和改善肠道功能提高鱼类对饲料淀粉的消化利用。
益生菌具有促进脂质代谢的作用,这一结论在以往的研究中也被证实。基因组分析表明,植物乳杆菌具有很强的碳水化合物利用能力,能够降低总胆固醇含量,缓解乳糖不耐受情况[24]。粪肠球菌(Enterococcus faecalis)和副干酪乳杆菌(Lactobacillus paracasei)通过降低丙氨酸氨基转移酶和组织炎症水平以改善脂质分布,并且可以通过减轻炎症反应减少脂肪的沉积[25]。鱼类在摄食高水平淀粉饲料后经常表现出持续高血糖和脂肪沉积[26],本研究中也有同样的发现。此外,高淀粉饲料中添加植物乳杆菌和枯草芽孢杆菌能够显著降低团头鲂肌肉粗脂肪含量,推测益生菌可能通过影响脂肪分解代谢来调节团头鲂对饲料可消化淀粉的利用和代谢。在水生动物虎龙斑(Epinephelus fuscoguttatus♀×E.lancedatiis♂)中与本研究有一致的发现,益生菌添加组降低了肌肉粗脂肪含量[27]。但是,在哺乳动物羔羊的研究中,补充益生菌影响羔羊肌肉纤维特性,增加了肌内脂肪沉积并改善肉质[28]。这些不同的研究结果可能与陆生动物和水生动物的消化道结构和生理功能具有较大的差异有关。
3.2 摄食不同饲料对团头鲂幼鱼血清生化和肝脏抗氧化能力的影响
血清生化指标易受饲料营养成分的影响,如血清血糖和脂质含量受饲料淀粉水平影响,高密度脂蛋白和总胆固醇受益生菌种类影响,血清总胆固醇、甘油三酯等脂质含量的变化通常受机体脂肪代谢的影响。本研究中,血清生化指标的结果也同样支持这一结论,但是通过在高淀粉饲料中添加枯草芽孢杆菌,团头鲂幼鱼血清低密度脂蛋白和总胆固醇的含量呈下降趋势。低密度脂蛋白是一种运载胆固醇进入外周组织细胞的脂蛋白颗粒,其过量时会造成在动脉管壁的积累,进而诱导动脉粥样硬化病变[29]。总胆固醇是合成胆汁酸等生理活性物质的重要原料[30]。本研究结果表明,高淀粉饲料会引起团头鲂血液脂质物质沉积,添加枯草芽孢杆菌后能够促进血液低密度脂蛋白和总胆固醇分解代谢。同样在异育银鲫(Carassius auratus gibelio)的研究中发现,添加240 mg/kg的枯草芽孢杆菌能够显著降低血清丙氨酸氨基转移酶和总胆固醇的含量[31]。然而,本研究中,在高淀粉饲料中添加植物乳杆菌会升高血清总胆固醇的含量,这与对欧洲鲈(Dicentrarchus labrax)的研究结果一致,植物乳杆菌的添加提高了血清总胆固醇和甘油三酯的水平[32],这可能与血清中甘油三酯的浓度易受到饲料脂肪水平影响有关。
本研究结果显示,在高淀粉饲料中添加植物乳杆菌可以显著提高肝脏总超氧化物歧化酶的活性。已报道的研究中发现,芽孢杆菌和丁酸梭菌(Clostridium butyricum)的添加能够提高虎龙斑血清碱性磷酸酶及肝脏抗氧化酶活性,显著促进虎龙斑的生长,提高虎龙斑的免疫力和抗病力[27];饲喂含107 CFU/g枯草芽孢杆菌饲料的日本鳗鲡(Anguilla japonica),其血清溶菌酶、超氧化物歧化酶和髓过氧化物酶等酶活性显著高于对照组[33]。Gao等[34]发现,在饲料中添加丁酸梭菌、植物乳杆菌和枯草芽孢杆菌能够提高银鲳(Pampas argenteus)血清溶菌酶、超氧化物歧化酶和免疫球蛋白的水平,增强其免疫反应,改善生长性能。此外,在一项基于哺乳动物的Meta分析中,作者指出益生菌的摄入可以减少Ⅱ型糖尿病患者的氧化应激生物标志物的升高,但不会显著改善血糖状态[35]。这与本研究存在相似之处,虽然不同淀粉水平对团头鲂肝脏抗氧化指标无显著影响,但是高淀粉饲料中添加植物乳杆菌可增强肝脏总超氧化物歧化酶活性,说明高淀粉饲料中添加植物乳杆菌,可以激活团头鲂肝脏抗氧化能力。
4 结论
1)饲料中添加益生菌能够改善团头鲂幼鱼对高淀粉饲料的利用,降低肌肉脂肪的沉积,促进生长。
2)高淀粉饲料中添加植物乳杆菌可以改善团头鲂幼鱼肝脏抗氧化功能,而添加枯草芽孢杆菌具有降低血液脂质沉积的作用。
[1] 缪凌鸿.高碳水化合物水平日粮对异育银鲫生产性能、免疫及应激蛋白HSP70的影响[D].南京:南京农业大学,2009.
MIAO L H.Effect of high carbohydrate levels in the dietary on growth performance,immunity and HSP70 of Carassius auratus gibelio[D].Nanjing:Nanjing Agricultural University,2009.(in Chinese)
[2] LI J N,XU Q Y,WANG C A,et al.Effects of dietary glucose and starch levels on the growth,haematological indices and hepatic hexokinase and glucokinase mRNA expression of juvenile mirror carp (Cyprinus carpio)[J].Aquaculture Nutrition,2016,22(3):550-558.
[3] XIAO Q Q,LI J,LIANG X F,et al.Programming of high-glucose diet acceptance in Chinese perch (Siniperca chuatsi) following an early exposure[J].Aquaculture Reports,2020,18:100534.
[4] CAI W J,LIANG X F,YUAN X C,et al.Different strategies of grass carp (Ctenopharyngodon idella) responding to insufficient or excessive dietary carbohydrate[J].Aquaculture,2018,497:292-298.
[5] WANG C,CHUPROM J,WANG Y,et al.Beneficial bacteria for aquaculture:nutrition,bacteriostasis and immunoregulation[J].Journal of Applied Microbiology,2020,128(1):28-40.
[6] FONTANA L,BERMUDEZ-BRITO M,PLAZA-DIAZ J,et al.Sources,isolation,characterisation and evaluation of probiotics[J].The British Journal of Nutrition,2013,109(sup 2):S35-S50.
[7] HARDY H,HARRIS J,LYON E,et al.Probiotics,prebiotics and immunomodulation of gut mucosal defences:homeostasis and immunopathology[J].Nutrients,2013,5(6):1869-1912.
[8] GILDBERG A,MIKKELSEN H,SANDAKER E,et al.Probiotic effect of lactic acid bacteria in the feed on growth and survival of fry of Atlantic cod (Gadus morhua)[J].Hydrobiologia,1997,352(1/2/3):279-285.
[9] FAEED M,KERMANSHAHI R K,POURKAZEMI M,et al.Study on effect feedings with probiotics in increasing resistance to Aeromonas hydrophila and changes in gut bacterial communities Sander lucioperca [J].Biological Journal of Microorganism,2018,7(27): 1-12.
[10] TABASSUM T,SOFI UDDIN MAHAMUD A G M,ACHARJEE T K,et al.Probiotic supplementations improve growth,water quality,hematology,gut microbiota and intestinal morphology of Nile tilapia[J].Aquaculture Reports,2021,21:100972.
[11] BOULANG C L,NEVES A L,CHILLOUX J,et al.Impact of the gut microbiota on inflammation,obesity,and metabolic disease[J].Genome Medicine,2016,8(1):42.
C L,NEVES A L,CHILLOUX J,et al.Impact of the gut microbiota on inflammation,obesity,and metabolic disease[J].Genome Medicine,2016,8(1):42.
[12] SCHROEDER B O,B CKHED F.Signals from the gut microbiota to distant organs in physiology and disease[J].Nature Medicine,2016,22(10):1079-1089.
CKHED F.Signals from the gut microbiota to distant organs in physiology and disease[J].Nature Medicine,2016,22(10):1079-1089.
[13] VERNOCCHI P,DEL CHIERICO F,PUTIGNANI L.Gut microbiota profiling:metabolomics based approach to unravel compounds affecting human health[J].Frontiers in Microbiology,2016,7:1144.
[14] 刘寒,吴芸倩,李会峰,等.日粮中高糖高脂对团头鲂肝脏及肠道微生物菌群组成的影响[J].华中农业大学学报,2018,37(4):85-92.
LIU H,WU Y Q,LI H F,et al.Effects of high-fat-high-carbohydrate diet on liver and composition of gut microbiota in blunt snout bream[J].Journal of Huazhong Agricultural University,2018,37(4):85-92.(in Chinese)
[15] WANG A R,ZHANG Z,DING Q W,et al.Intestinal Cetobacterium and acetate modify glucose homeostasis via parasympathetic activation in zebrafish[J].Gut Microbes,2021,13(1):1-15.
[16] 杨国华,戴祥庆,顾道良.团头鲂的营养、饲料配方和高产养殖技术[J].饲料工业,1989,10(1):7-10,46.
YANG G H,DAI X Q,GU D L.Nutrition, feed formulation and high-yield breeding techniques of Megalobrama amblycephala [J].Feed Industry,1989,10(1):7-10,46.(in Chinese)
[17] ZHOU C,LIU B,GE X,et al.Effect of dietary carbohydrate on the growth performance,immune response,hepatic antioxidant abilities and heat shock protein 70 expression of Wuchang bream,Megalobrama amblycephala[J].Journal of Applied Ichthyology,2013,29(6):1348-1356.
[18] 周传朋.不同水平碳水化合物日粮对团头鲂的生长、免疫及相关糖代谢酶的影响[D].南京:南京农业大学,2012.
ZHOU C P.Effect of different dietary carbohydrate levels on growth performance,immunity and carbohydrate metabolic enzymes in Wuchang bream (Megalobrama amblycephala)[D].Nanjing:Nanjing Agricultural University,2012.(in Chinese)
[19] LIU D N,ZHANG Y,PAN M Z,et al.Interactive effects of dietary biotin and carbohydrate on growth performance and glucose metabolism in juvenile turbot Scophthalmus maximus L.[J].Aquaculture,2021,540:736752.
[20] ZHOU Y,YUAN X C,LIANG X F,et al.Enhancement of growth and intestinal flora in grass carp:the effect of exogenous cellulase[J].Aquaculture,2013,416/417:1-7.
[21] SINHA A K,KUMAR V,MAKKAR H P S,et al.Non-starch polysaccharides and their role in fish nutrition-a review[J].Food Chemistry,2011,127(4):1409-1426.
[22] YU L L,ZHAI Q X,ZHU J M,et al.Dietary Lactobacillus plantarum supplementation enhances growth performance and alleviates aluminum toxicity in tilapia[J].Ecotoxicology and Environmental Safety,2017,143:307-314.
[23] SUN N,XUE Y,WEI S,et al.Compound probiotics improve body growth performance by enhancing intestinal development of broilers with subclinical necrotic enteritis[J].Probiotics and Antimicrobial Proteins,2021(4):1-15.
[24] CUI Y,WANG M,ZHENG Y,et al.The carbohydrate metabolism of Lactiplantibacillus plantarum[J].International Journal of Molecular Sciences,2021,22(24):13452.
[25] YANG L S,XIE X Q,LI Y,et al.Evaluation of the cholesterol-lowering mechanism of Enterococcus faecium Strain 132 and Lactobacillus paracasei Strain 201 in hypercholesterolemia rats[J].Nutrients,2021,13(6):1982.
[26] LI L Y,WANG Y,LIMBU S M,et al.Reduced fatty acid β-oxidation improves glucose catabolism and liver health in Nile tilapia (Oreochromis niloticus) juveniles fed a high-starch diet[J].Aquaculture,2021,535:736392.
[27] 黄灵.饲料中添加益生菌对虎龙斑(Epinephelus fuscoguttatus ♀×E.lancedatiis♂)幼鱼生长、非特异性免疫和抗病力影响的研究[D].广州:广州大学,2017.
HUANG L.The effects of dietary probiotics on growth,non-specific immunity and disease resistance of hybrid grouper(Epinephelus fuscoguttatus ♀×E.lanceolatus ♂)[D].Guangzhou:Guangzhou University,2017.(in Chinese)
[28] NIE C T,HU Y Q,CHEN R R,et al.Effect of probiotics and Chinese medicine polysaccharides on meat quality,muscle fibre type and intramuscular fat deposition in lambs[J].Italian Journal of Animal Science,2022,21(1):811-820.
[29] FERENCE B A,GINSBERG H N,GRAHAM I,et al.Low-density lipoproteins cause atherosclerotic cardiovascular disease.1.Evidence from genetic,epidemiologic,and clinical studies.A consensus statement from the European Atherosclerosis Society Consensus Panel[J].European Heart Journal,2017,38(32):2459-2472.
[30] HAYDON D A,HENDRY B M,LEVINSON S R,et al.Anaesthesia by the n-alkanes.A comparative study of nerve impulse blockage and the properties of black lipid bilayer membranes[J].Biochimica et biophysica acta,1977,470(1):17-34.
[31] CAI Y N,YIN Y W,WANG L T,et al.Effect on serum parameters and immune responses of Carassius auratus gibelio exposed to dietary lead and Bacillus subtilis[J].Biological Trace Element Research,2019,190(1): 217-225.
[32] PICCOLO G,BOVERA F,LOMBARDI P,et al.Effect of Lactobacillus plantarum on growth performance and hematological traits of European sea bass (Dicentrarchus labrax)[J].Aquaculture International,2015,23(4):1025-1032.
[33] LEE S,KATYA K,PARK Y,et al.Comparative evaluation of dietary probiotics Bacillus subtilis WB60 and Lactobacillus plantarum KCTC3928 on the growth performance,immunological parameters, gut morphology and disease resistance in Japanese eel,Anguilla japonica[J].Fish &Shellfish Immunology,2017,61:201-210.
[34] GAO Q X,XIAO C F,MIN M H,et al.Effects of probiotics dietary supplementation on growth performance;innate immunity and digestive enzymes of silver pomfret,Pampas argenteus[J].Indian Journal of Animal Research,2016,50(6): 936-941.
[35] ARDESHIRLARIJANI E,TABATABAEI-MALAZY O,MOHSENI S,et al.Effect of probiotics supplementation on glucose and oxidative stress in type 2 diabetes mellitus:a meta-analysis of randomized trials[J].Daru,2019,27(2):827-837.