大黄鱼(Larimichthys crocea)是中国养殖量最大的海水鱼类。由变形假单胞菌(Pseudomonas plecoglossicida)引发的内脏白点病是近年来网箱养殖大黄鱼的常见病害,其高死亡率给大黄鱼养殖业造成了严重的经济损失。目前,变形假单胞菌对常用抗菌素已产生了一定的耐药性,因此,有必要采用免疫的手段防控大黄鱼内脏白点病[1-2]。
三七总皂苷(Panax notoginseng saponins,PNS)是植物三七(Panax notoginseng)的主要活性成分,含人参皂苷Rb1、Rg1和三七皂苷R1等多种单体皂苷成分[3],具有抗炎、免疫调节、抗氧化和抗病毒等多种活性[4]。PNS在体外能显著促进小鼠B淋巴细胞增殖和T淋巴细胞IL-2分泌,具有一定的细胞免疫活性和诱生细胞因子的能力[5]。饲料中添加适宜水平的PNS,能提高罗非鱼(Oreochromis niloticus)和异育银鲫(Carassius auratus gibelio)的增重率、特定生长率和蛋白质效率,降低饲料系数,提高血清溶菌酶、酸性磷酸酶和碱性磷酸酶等非特异性免疫指标[6-9]。有关PNS影响养殖鱼类抗病原感染能力的研究鲜见报道。
本课题组前期试验表明,一定剂量的PNS投喂大黄鱼可提高血清溶菌酶活性,以及肝、脾和头肾组织黏病毒抗性蛋白(Mx)和主要组织相容性复合体Ⅱ类α链(MHCⅡα)的相对表达水平[10]。本研究中,用PNS腹腔注射大黄鱼,并结合人工感染试验,通过分析人工感染后大黄鱼的存活率,脾脏、肾脏中变形假单胞菌的相对含菌量,以及免疫相关因子表达水平的变化,评估了PNS对大黄鱼免疫机能及抗变形假单胞菌感染能力的影响,以期为大黄鱼内脏白点病的免疫防控提供科学参考。
1 材料与方法
1.1 材料
大黄鱼(体质量为20~30 g)取自福建宁德市富发水产有限公司。
PNS购于南京泽朗医药生物科技有限公司,纯度≥85%,其中,人参皂苷Rb1含量为 32.6%,Rg 1 含量为33.7%,Rd含量为 7.9%,Re含量为 4.4%,三七皂苷R1含量为 9.0%。
变形假单胞菌菌株H2017050402由本课题组分离保种,其复苏、培养方法同文献[10]。
1.2 方法
1.2.1 PNS体外抑制变形假单胞菌的作用
1)变形假单胞菌悬液的制备。将变形假单胞菌接种至胰酪大豆胨液体培养基(TSB),28 ℃下摇床(210 r/min)培养过夜。取过夜培养的变形假单胞菌液,按1∶100的比例接种于TSB中,28 ℃摇床(210 r/min)活化培养至菌液OD600 nm为0.66,活化的菌液以1∶100的比例用TSB稀释混匀后,作为抑菌试验的变形假单胞菌悬液备用。
2)样品OD值测定。称取适量PNS粉末溶于TSB,得到PNS质量浓度分别为62.50、31.25 mg/mL的液体培养基,用孔径为0.22 μm的滤膜过滤除菌,各取4 mL分别加入1 mL变形假单胞菌悬液,此时培养体系中PNS终浓度分别为50、25 mg/mL。阳性对照样品为4 mL不含PNS的TSB 中加入1 mL变形假单胞菌悬液。阴性对照样品为等体积仅含50 mg/mL PNS的TSB。每组样品设置3个重复。将试管于28 ℃摇床(210 r/min)培养24 h,每管各取2 mL,以TSB校零,在600 nm波长处测定并记录OD值。
1.2.2 PNS对大黄鱼抗变形假单胞菌感染能力的影响试验
1)试验分组及饲养管理。采用盐度为27~28的海水将大黄鱼暂养2周后,随机分为试验组(PNS)和对照组(CK),每组设置3个平行,每个平行放20尾鱼,分别饲养于容量为100 L海水的圆形PVC塑料桶中。试验期间水温为20~22 ℃,连续曝气。
2)注射给药。根据前期预试验结果,用无菌生理盐水配制质量浓度为0.5 mg/mL的PNS溶液。PNS试验组每尾鱼腹腔注射0.2 mL PNS溶液,对照组注射等体积的无菌生理盐水。试验期间不投喂,连续曝气。
3)人工感染。于注射给药后第3天,在每个平行桶的100 L海水中加入30 mL浓度为3.4×109 CFU/mL的菌悬液,使得桶中水体菌液浓度为1.02×109 CFU/L。浸泡2 h后,将试验鱼转移至另外盛有100 L海水的桶中,连续观察8 d,及时清理死鱼并记录死亡情况。试验期间水温为20~22 ℃,连续曝气。
4)样品采集。于浸泡感染前及感染后第4天和第8天采样。从每个平行桶取3尾大黄鱼,置于含MS-222(Sigma公司,质量浓度为100 mg/L)的海水中麻醉,采集全脾、后肾组织,立即放入液氮中速冻后于-80 ℃保存。将每个平行3尾鱼的同一组织混合为一个样品。
1.2.3 相对含菌量的检测 参照文献[11]中建立的大黄鱼感染变形假单胞菌定量检测方法,测定组织中的相对含菌量。
1)DNA提取。取上述采集的全脾和后肾组织样品进行匀浆,使用ONE-4-ALL基因组DNA小量提取试剂盒[生工生物工程(上海)股份有限公司]提取DNA,加50 μL灭菌水洗脱制备DNA原液,采用DS-11 Spectrophotometer(DeNovix公司)测定DNA浓度,用15 g/L琼脂糖凝胶电泳检测DNA质量,-20 ℃保存备用。另取健康大黄鱼的后肾组织及变形假单胞菌菌液,采用相同方法提取DNA,用于引物特异性与扩增效率的检测及荧光定量PCR反应标准曲线制作。
2)实时荧光定量PCR。参照文献[11]中的方法合成大黄鱼生长分化因子-8(gdf-8)基因和变形假单胞菌DNA促旋酶亚基B(gyrB)基因的引物序列。gdf-8的正、反向引物分别为5′TGGGAGATGACAACAGG 3′和5′GCACCGACCAATACACT 3′;gyrB的正、反向引物分别为5′GTTGGTGAAGCACAGCAGGTT 3′和5′GTTCGGGCAAGGAAGAGT 3′。
3)标准曲线制作。以变形假单胞菌和健康大黄鱼肾组织基因组DNA为模板,进行PCR扩增,扩增产物经20 g/L琼脂糖凝胶电泳后切取目的条带,采用DNA纯化试剂盒(Omega公司)进行纯化,纯化的产物用超微量分光光度计测定浓度(大黄鱼gdf-8和变形假单胞菌gyrB PCR产物的浓度分别为37.05、68.86 ng/μL)。然后,将纯化的PCR产物原液分别按照101、102、103、104、105、106、107、108、109倍稀释后作为模板,采用QuantStudio® 3 (Thermo)荧光定量PCR仪,按照TB Green® Premix Ex TaqTM Ⅱ(TaKaRa)使用说明书进行操作,检测其扩增效率,并根据结果制作标准曲线。实时荧光定量PCR反应体系(20 μL):TB Green Premix Ex Taq Ⅱ 10 μL,ROX Reference Dye Ⅱ 0.4 μL,gdf-8(或gyrB)10 μmol/L,上、下游引物各0.8 μL,稀释3倍后的DNA模板2.0 μL,ddH2O 6.0 μL。反应程序:95 ℃下预变性30 min;95 ℃下变性5 s,60 ℃下退火34 s,72 ℃下延伸20 s,共进行40个循环。其中,DNA模板是上述经纯化并稀释好的大黄鱼gdf-8基因或变形假单胞菌gyrB基因PCR产物。
4)人工感染后大黄鱼脾、后肾组织样品相对含菌量的检测与计算。将上述实时荧光定量 PCR反应体系中DNA模板换为各试验组大黄鱼脾、后肾组织样品中提取的DNA,其他条件相同。
通过各Ct值在标准曲线上所对应的拷贝数得到待测样品中大黄鱼gdf-8基因和变形假单胞菌gyrB拷贝数。同一样品中得出的gyrB拷贝数与gdf-8拷贝数的比值即为相对含菌量。
1.2.4 免疫相关因子的表达分析
1)RNA提取。采用RNA提取试剂盒RNAiso Plus(TaKaRa),提取大黄鱼全脾组织中的总RNA。采用超微量分光光度仪测定抽提所得RNA浓度。按照反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)反转录合成cDNA。
2)实时荧光定量PCR分析。使用Applied Biosystems 7500 Fast Real-Time PCR System仪器进行荧光定量PCR,检测大黄鱼脾组织中免疫相关因子白细胞介素1β(IL-1β)、白细胞介素8(IL-8)、白细胞介素10(IL-10)、肿瘤坏死因子-α(TNF-α)、CC趋化因子配体19(CCL19)、主要组织相容性复合体Ⅰ类(MHCⅠ)、MHCⅡα、骨髓分化因子88 (MYD88)和Mx的mRNA表达水平。内参基因β-actin与待测因子的引物序列见表1,其中,β-actin的引物序列参照文献[12]中的方法合成,TNF-α、MHCⅡα、Mx和IL-10的引物序列参照文献[13]中的方法合成,其余基因的引物序列参照NCBI中大黄鱼相应基因序列设计。各基因的实时荧光定量PCR反应体系及反应程序同“1.2.4节”gdf-8和gyrB基因的PCR。溶解曲线阶段包括 95 ℃反应15 s,60 ℃反应1 min,95 ℃反应15 s。采用2-ΔΔCt 法计算目的基因的相对表达量[14]。
表1 荧光定量PCR引物序列
Tab.1 Primers used for real-time PCR

基因 gene 引物序列 sequence of primer (5 ′-3′)β-actinF:GACCTGACAGACTACCTCATGR:AGTTGAAGGTGGTCTCGTGGAIL-1βF:CAGCTGTTCTCAAGTATGTGGCR:GTTGTAAATAGTGGGTGTGTCGIL-8F:CTATCGTGGCACTCCTGGTTR:GCAGGAATCACCTCCACTTGTTNF-αF:TAAGAACACCTACGAGACCATCCTGCR:CTCTTCTCCATCACCGTCTTCAGTTTIL-10F:CATCAACAGCATTTTAGATTTTTACCR:CTGAGTGTAAGTGGAGTTTAGGTTTGCCL19F:GACAGGGCTGCTCTCTTGATGR:CTTTGCAGCCTCTGGCCTTTMHCⅠF:GGCGATCCTGACCAACGAACR:GACAGGAGATGGAGGGCGTTMHCⅡαF:TCAGCTGCACTCGTTCCR:CCAGCATCAACGTTCCTCMYD88F:GTTGGAACAGACGGACTACAAGR:TCCTCTTACACCTCCTCTCAATGMxF:AGTTTTCCTCTTATTCGCCTGATTTTTR:TAAAAAGAACAAGTCAGCCAGGTGC
1.2.5 TNF-α蛋白免疫印迹(Western blotting)分析 将采集的全脾组织样品用Invent总蛋白提取试剂盒(美国 Invent SD001/SN002)提取总蛋白,并采用BCA 蛋白含量检测试剂盒(中国Bioplatform BP104)测定其蛋白浓度。从各样品中取等量蛋白,用SDS PAGE电泳分离,然后转移至PVDF膜(美国Millipore公司),并作标记,封闭后进行抗原抗体反应。目的蛋白TNF-α的一抗和二抗分别为鼠抗大黄鱼TNF-α多克隆抗体(稀释100倍,本课题组自制)和辣根过氧化物酶(HRP)标记羊抗鼠免疫球蛋白[HRP Goat Anti-Rat IgG (H+L),稀释5 000倍,中国Utibody公司]。内参β-actin的一抗和二抗分别为兔抗Actin单克隆抗体(Anti-Actin抗体,稀释1 000倍,英国Abcam公司)和HRP标记羊抗兔免疫球蛋白[HRP Goat Anti-Rabbit IgG (H+L),稀释5 000倍,Utibody公司]。二抗反应结束后,采用ECL化学发光试剂盒(美国 Thermo 公司)显色,使用凝胶成像仪成像,再用凝胶定量分析软件 Gel-Pro Analyzer 4(美国Media Cybernetics公司)测定目标蛋白条带灰度值,结果以TNF-α灰度值与β-actin灰度值的比值表示。
1.3 数据分析
试验结果以平均值±标准差(mean±S.D.)表示,采用GraphPad Prism 7.0软件对试验数据进行单因素方差分析及生存曲线差异分析,显著性水平设为0.05。
2 结果与分析
2.1 PNS对变形假单胞菌的体外抑制效果
从图1可见:阳性对照组OD值为0.928 0,质量浓度为50 mg/mL的PNS样品OD值为0.474 3,比阳性对照组显著降低了48.89%(P<0.05);质量浓度为25 mg/mL的PNS样品OD值为0.584 7,比阳性对照组显著降低了36.99%(P<0.05)。
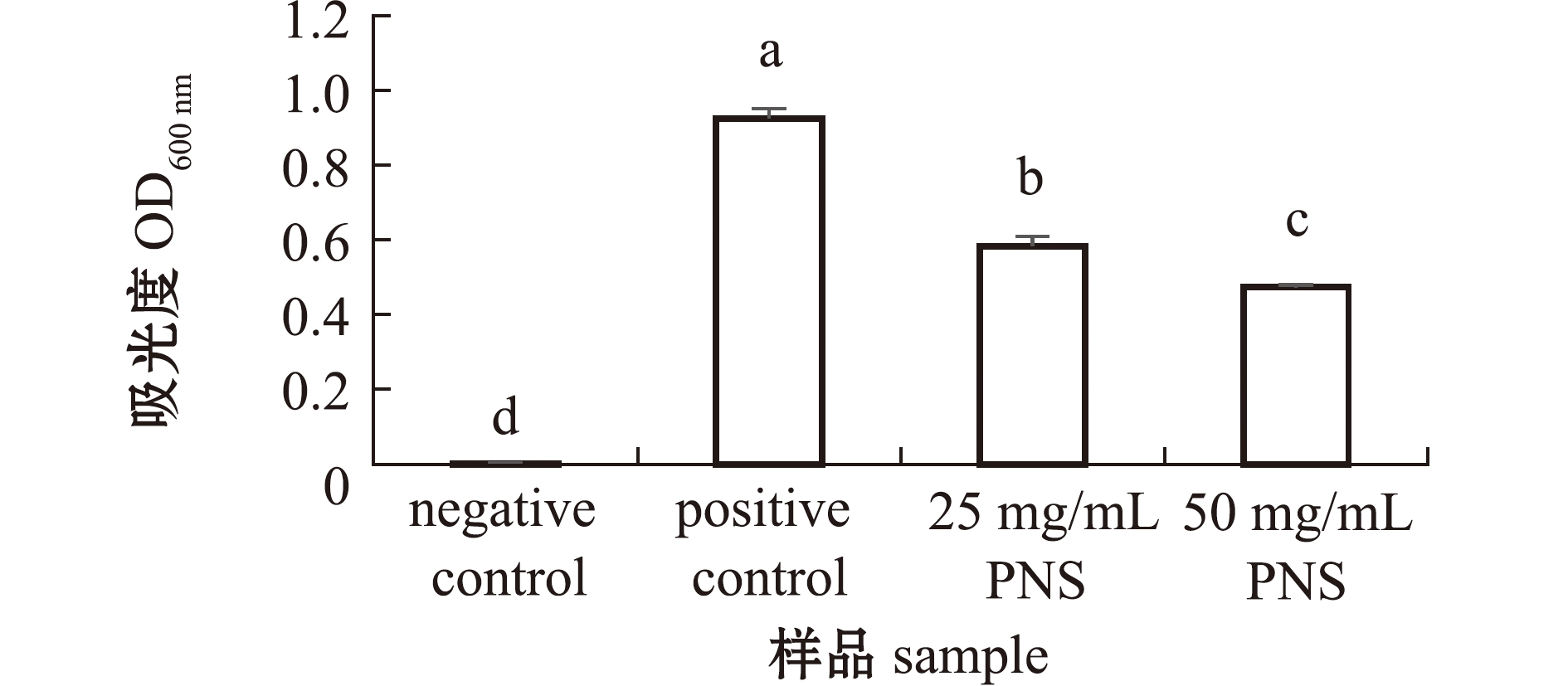
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significantly different.
图1 样品的吸光度值
Fig.1 OD value of the samples
2.2 浸泡感染死亡情况
从图2可见:PNS组曲线变化较对照组缓和,但二者无显著性差异(P=0.127 4);对照组大黄鱼在浸泡感染变形假单胞菌后第5天开始出现大量死亡,存活率大幅度下降,第8天存活率为20.56%±6.48%;PNS组大黄鱼则在第6天后出现较集中死亡,第8天存活率为39.02%±7.62%,较对照组高18.46%,但无显著性差异(P>0.05)。
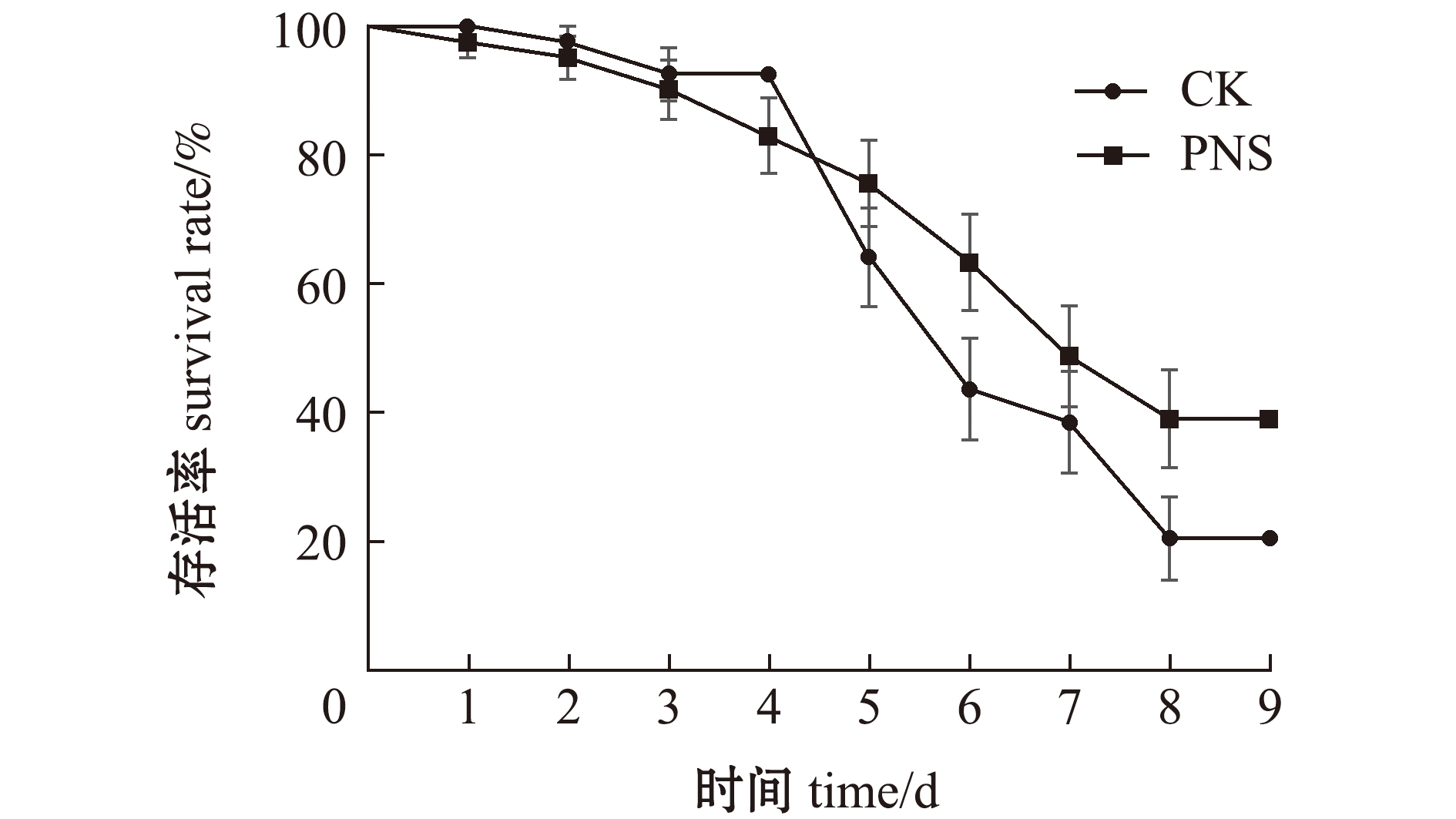
图2 大黄鱼感染变形假单胞菌后的存活率
Fig.2 Survival rate of Larimichthys crocea infected with Pseudomonas plecoglossicida
2.3 感染前后脾和后肾组织中变形假单胞菌的含量
从图3可见:在浸泡感染变形假单胞菌前,对照组和PNS组大黄鱼脾、后肾组织中的菌量为0;感染后第4、8天,对照组脾组织的相对含菌量分别是PNS组的10倍和2.7倍,对照组后肾组织的相对含菌量分别为PNS组的198倍和81倍,但均无显著性差异(P>0.05)。
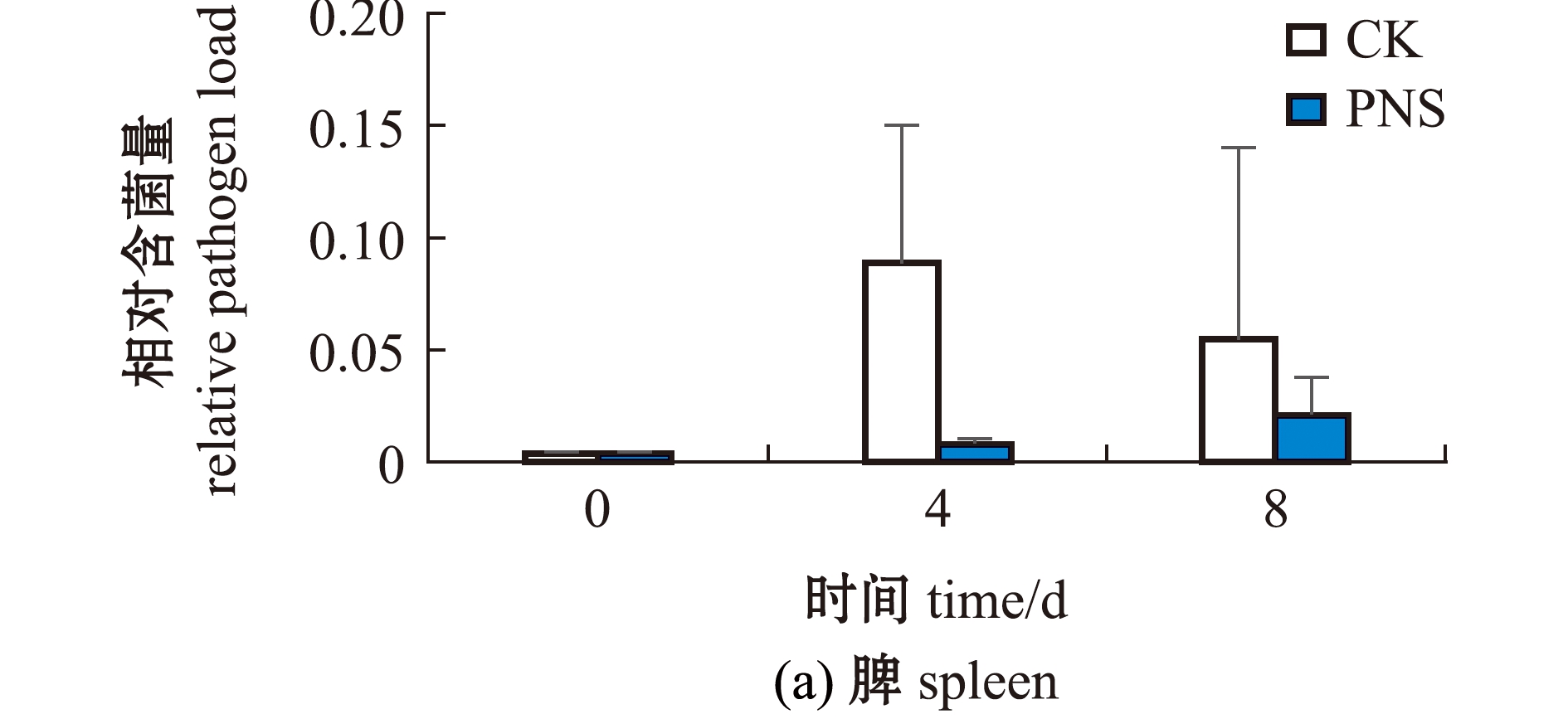

图3 人工感染前(0 d)及感染后(4、8 d)大黄鱼脾和后肾中的相对含菌量
Fig.3 Relative pathogen load in the spleen and hind kidney of Larimichthys crocea before(0 d)and after infection(4 and 8 d)
2.4 感染前后脾组织中免疫相关因子的表达
从图4可见:人工感染前(0 d),PNS组大黄鱼脾组织免疫相关基因IL-1β、IL-8、TNF-α、CCL19、MHCⅠ、MHCⅡα、MYD88、Mx和IL-10 mRNA水平均略低于对照组(P>0.05);感染后第4天,TNF-α和MYD88 mRNA水平显著高于对照组(P<0.05),其余7个基因的mRNA水平略高于对照组(P>0.05);感染后第8天,仅TNF-α mRNA水平显著高于对照组(P<0.05),其余8个基因的mRNA水平略高于对照组(P>0.05)。
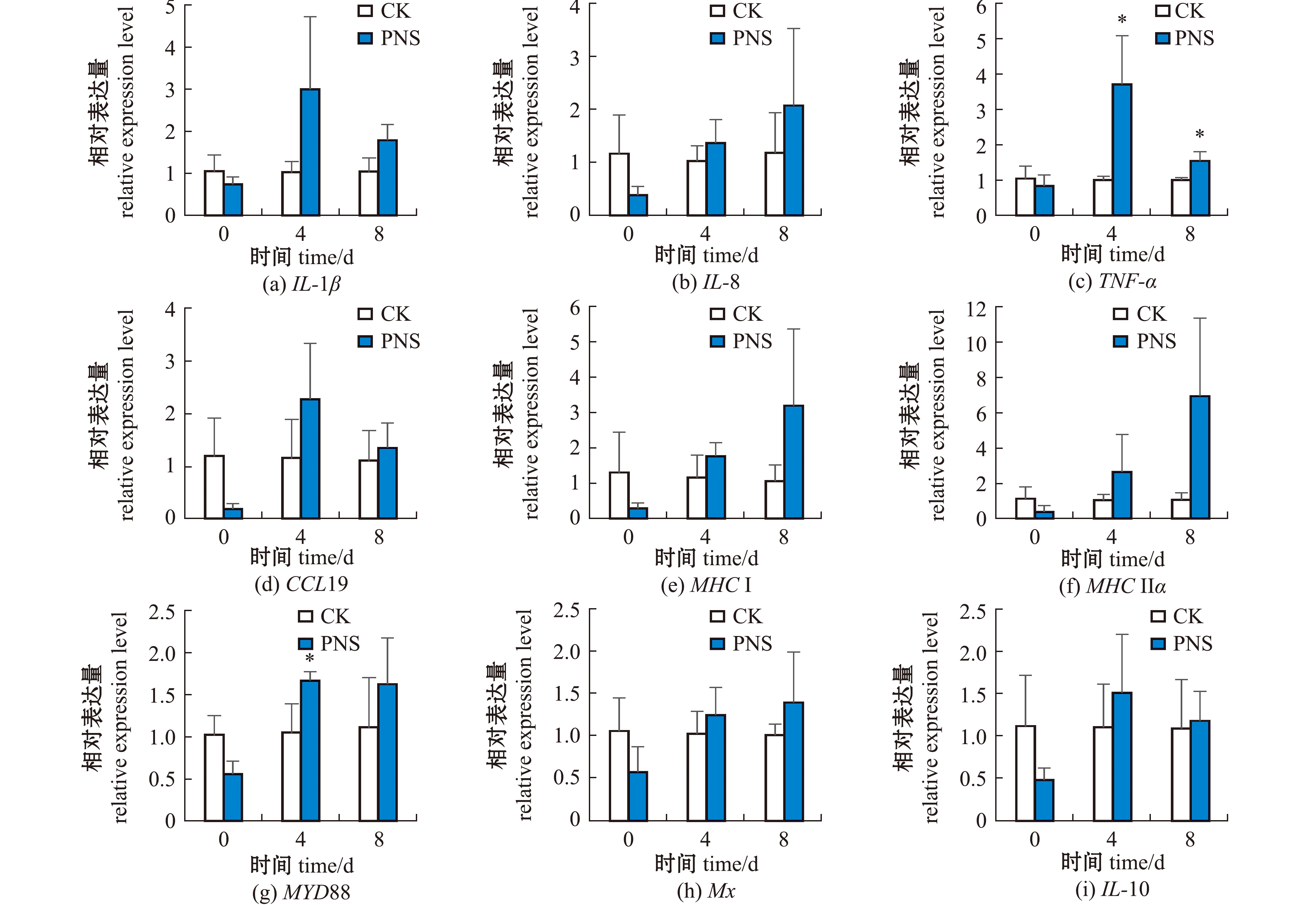
*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01),下同。
* means significant difference compared with the control (P<0.05);**means very significant difference compared with the control(P<0.01),et sequentia.
图4 人工感染前(0 d)及感染后(4、8 d)大黄鱼脾组织中免疫相关因子的相对表达水平
Fig.4 Relative expression level of immune related factors in the spleen of Larimichthys crocea croaker before (0 d)and after infection(4 and 8 d)
2.5 感染前后脾组织中TNF-α蛋白的相对含量
对照组和PNS组脾组织在人工感染前(0 d)及感染后第4、8天采集的样品与TNF-α特异抗体反应后均显示出单一条带,该条带相对分子质量约为40 000(图5(a))。蛋白条带定量结果显示,PNS组TNF-α蛋白相对含量(TNF-α与β-actin的灰度比值)在感染前显著低于对照组(P<0.05),感染后第4天略低于对照组(P>0.05),第8天则显著低于对照组(P<0.05)(图5(b))。
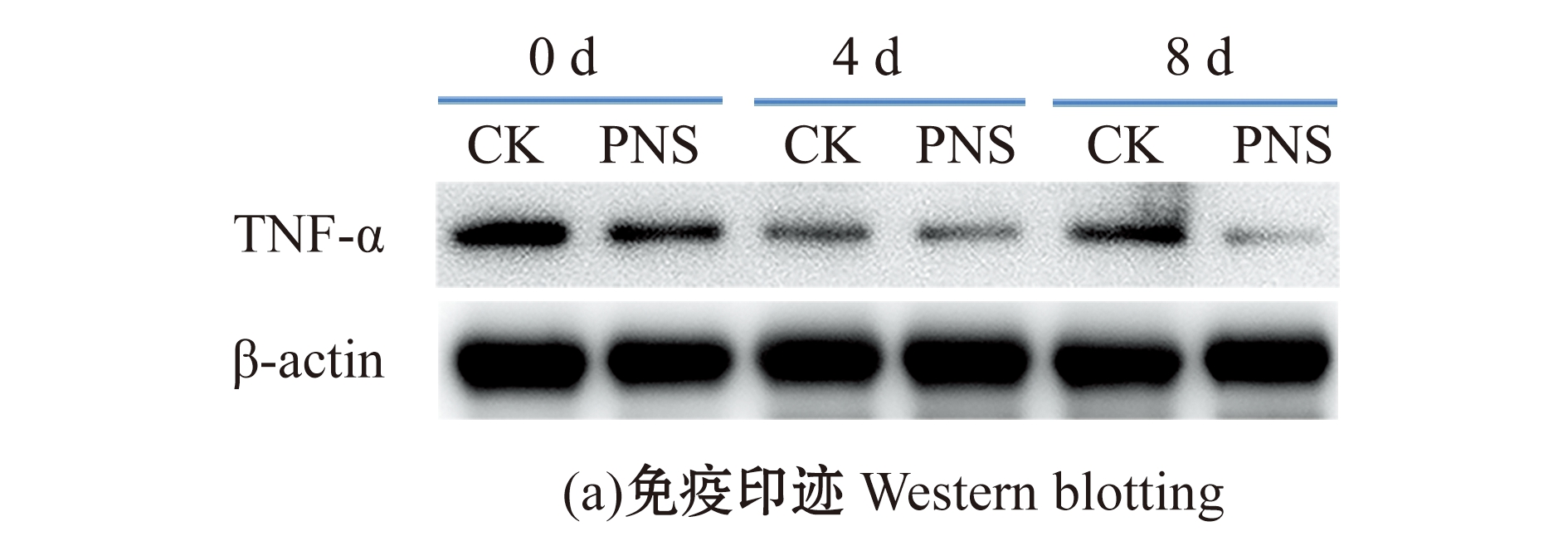
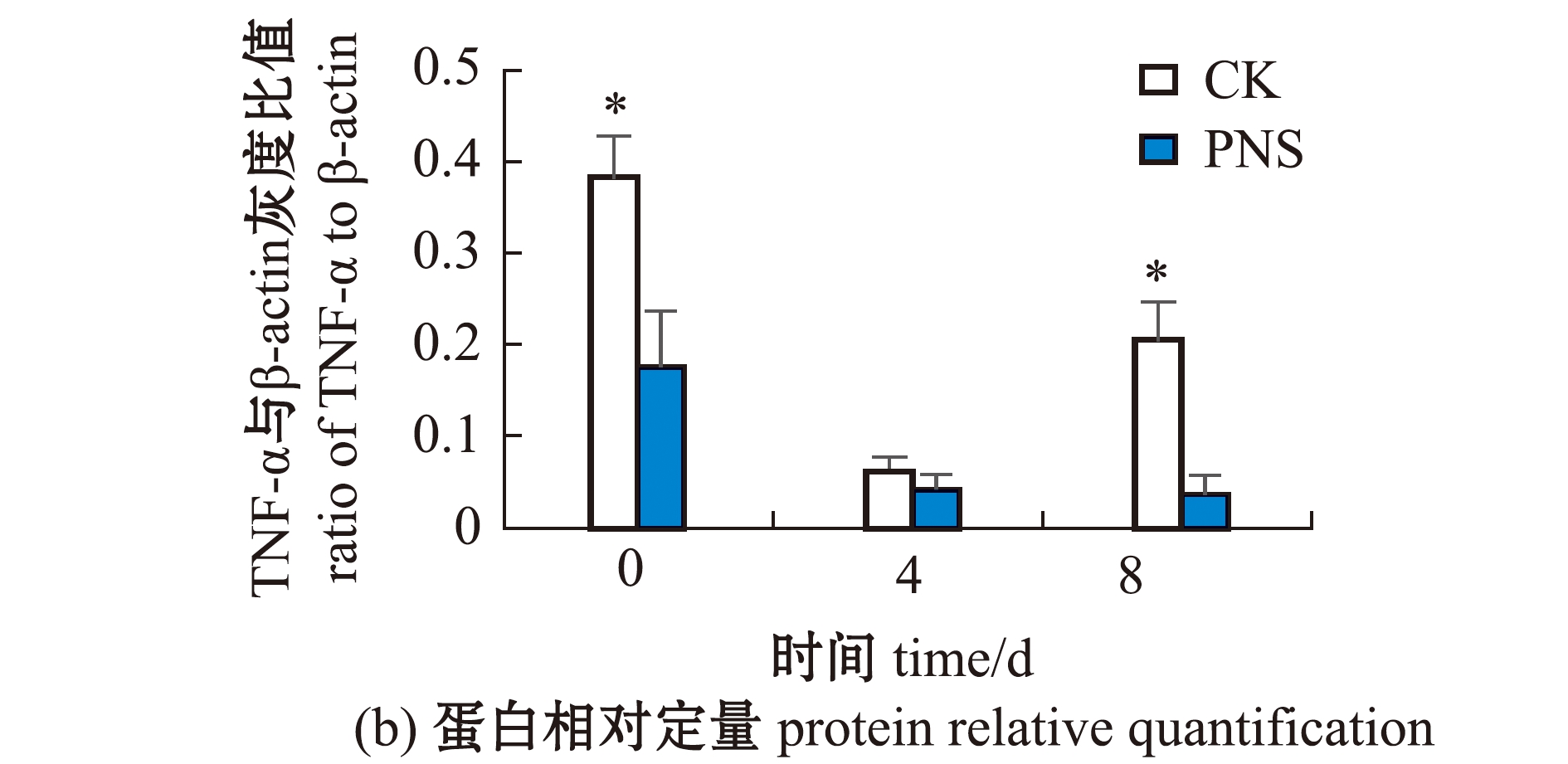
图5 人工感染前(0 d)及感染后(4、8 d)大黄鱼脾组织中TNF-α蛋白免疫印迹分析
Fig.5 Western blotting of TNF-α protein in spleen of Larimichthys crocea before(0 d)and after infection(4 and 8 d)
3 讨论
3.1 PNS对大黄鱼抗变形假单胞菌感染能力的影响
变形假单胞菌广泛分布于海水环境中,是大黄鱼秋冬季最主要的致病菌。添加免疫增强剂可提高鱼体非特异性免疫机能,从而提高抗病原感染能力。本研究中,将PNS以腹腔注射方式对大黄鱼给药,结果显示,在变形假单胞菌感染后8 d内,PNS组大黄鱼死亡高峰延迟,且存活率较对照组高18.47%。说明注射PNS能在一定程度上增强大黄鱼抗变形假单胞菌感染的能力。前期研究中,饲料中添加250 mg/kg的PNS,未能有效提高大黄鱼感染变形假单胞菌后的存活率[10]。有研究表明,PNS在胃液中易降解,尤以单体Rb1和Rg1易被破坏,用PNS溶液对大鼠灌胃给药后,单体Rb1和Rg1的绝对生物利用率分别为0.71%和3.29%[15]。此外,在肠道酶和微生物的作用下皂苷单体发生代谢转化,如Rg1代谢为Rh1和F1,Rb1转化成Rd和化合物K[16-17]。由此推测,PNS口服给药效果不理想的原因可能并非PNS无免疫效果,而是与其有效成分在大黄鱼胃肠中的吸收利用率较低有关。口服给药操作方便、不损伤鱼体,更适合在生产中推广应用[18]。根据本研究结果,在确认PNS效力的前提下,有必要筛选合适的包被剂,研发口服型的PNS制剂,提高PNS有效成分经胃肠道的利用率,从而使PNS能在大黄鱼病害防控中得到更充分应用。
3.2 PNS对变形假单胞菌的抑制效果
PNS及其皂苷单体对不同微生物抑制效果差别明显。三七皂苷粗提物对大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphyloccocus aureus)和枯草芽孢杆菌(Bacillus subtilis)等具有一定抑制作用,但对锈腐病菌(Cylindrocarpon destructans)和恶疫霉菌(Phytophthora cactorum)抑制作用不明显,在低浓度下甚至表现出促生长作用[19-20]。皂苷单体R1和Rb1对腐皮镰刀菌(Fusarium solani)具有较弱的促生长作用,而单体Rg1和Rd对该菌具有一定的抑制作用[19]。此外,不同方法提取的PNS抑菌活性不同。发酵法提取的PNS对蜡样芽孢杆菌(Bacillus cereus)、青霉菌(Penicillium sp.)和酿酒酵母(Saccharomyces cereviseae)的抑制作用比常规醇法提取的强[21]。本研究中的体外抑菌试验结果表明,PNS质量浓度为50、25 mg/mL的样品OD值(生长浊度)显著低于对照组,说明PNS对变形假单胞菌具有抑制作用。
大黄鱼的脾脏和肾脏是变形假单胞菌的主要靶器官[2]。本研究中鱼体试验表明,在变形假单胞菌感染后第4和8天,PNS组大黄鱼脾、后肾组织的菌量均较对照组低。PNS通过注射给药后,其可由毛细血管迅速扩散到各内脏组织[22]。感染变形假单胞菌后,PNS组试验鱼脾、后肾组织的菌量较低,可能与PNS对变形假单胞菌的抑制作用有一定的关联。
3.3 PNS对大黄鱼TNF-α表达的影响
PNS具有良好的抗炎活性,能抑制试验鼠Toll样受体4/核因子-κB(TLR4/NF-κB)等炎症相关信号通路的活化,降低TNF-α、IL-1β和IL-6等促炎细胞因子水平,减轻组织炎性损伤[23-24]。本研究中,PNS组大黄鱼脾组织TNF-α的蛋白表达水平在感染变形假单胞菌前后均低于对照组,其原因可能与PNS抗炎性反应这一药理特性有关。令人意外的是,TNF-α mRNA水平与其蛋白表达不一致,表现为PNS组大黄鱼TNF-α mRNA水平在感染变形假单胞菌前低于对照组,而在感染后第4、8天却显著高于对照组。造成这种现象的原因可能是:注射PNS后,PNS抑制了TNF-α的表达,大黄鱼体内TNF-α蛋白含量下降,当病原侵染后,机体为了应对病原,需要较多的TNF-α等炎症因子,从而导致PNS组大黄鱼TNF-α mRNA水平的代偿性提高。此外,有研究认为,TNF-α蛋白表达与转录存在不一致的情况与TNF-α翻译过程中的调控有关[25]。因此,PNS对大黄鱼TNF-α的作用机制还需进一步深入研究。
细菌病原体和其他伤害性刺激通过Toll样受体(TLRs)和核因子-κB(NF-κB)信号通路诱导TNF表达[26]。适度表达的TNF-α具有重要的免疫调节作用,但过量表达会导致慢性炎症及全身性消瘦,如果急性产生大量TNF,则会导致急性感染性休克[27-28]。据报道,免疫调节剂寡脱氧核苷酸(CpG-ODN)通过抑制斑马鱼(Danio rerio)在人工感染创伤弧菌(Vibrio vulnificus)后体内TNF-α的过表达保护鱼体,降低累计死亡率[29]。本研究结果显示,PNS可调控TNF-α的表达,且PNS组大黄鱼感染变形假单胞菌后的存活率略高于对照组,这说明PNS在大黄鱼细菌病防控中具有一定的应用前景。
4 结论
1)PNS对变形假单胞菌具有一定的体外抑制作用。PNS通过腹腔注射方式给药能降低变形假单胞菌感染后大黄鱼脾、后肾组织的菌量。
2)PNS可调控TNF-α等炎症因子的表达。
3)通过腹腔注射方式给药,PNS能在一定程度上增强大黄鱼抗变形假单胞菌感染的能力,提高感染后的存活率。
[1] 胡娇,张飞,徐晓津,等.大黄鱼(Pseudosciaena crocea)内脏白点病病原分离鉴定及致病性研究[J].海洋与湖沼,2014,45(2):409-417.
HU J,ZHANG F,XU X J,et al.Isolation,identification and virulence of the pathogen of white-spots disease in internal organs of Pseudosciaena crocea[J].Oceanologia et Limnologia Sinica,2014,45(2):409-417.(in Chinese)
[2] 徐春霞.网箱养殖大黄鱼内脏白点病病原菌分离鉴定及致病性研究[J].水产科学,2021,40(5):670-678.
XU C X.Isolation,identification and pathogenicity of white-nodules disease in internal organs of large yellow croaker Pseudosciaena crocea in a sea cage[J].Fisheries Science,2021,40(5):670-678.(in Chinese)
[3] 谭亮,汤秋凯,王守章,等.三七皂苷R1药理作用的研究进展[J].中国药理学通报,2018,34(5):604-607.
TAN L,TANG Q K,WANG S Z,et al.Research progress on pharmacological action of notoginsenoside R1[J].Chinese Pharmacological Bulletin,2018,34(5):604-607.(in Chinese)
[4] 王磊,高琳,侯慧文.三七皂苷的生物活性及其在畜牧生产中的应用[J].动物营养学报,2020,32(12):5540-5546.
WANG L,GAO L,HOU H W.Biological activity of notoginsenoside and its application in livestock production[J].Chinese Journal of Animal Nutrition,2020,32(12):5540-5546.(in Chinese)
[5] 陈毓,秦枫,朱善元,等.三七总皂苷粗提物S-3溶血性及体外免疫活性的研究[J].扬州大学学报(农业与生命科学版),2019,40(4):84-88.
CHEN Y,QIN F,ZHU S Y,et al.Study on hemolytic characteristics and immune modulating activity of Panax notoginseng saponins S-3 in vitro[J].Journal of Yangzhou University (Agricultural and Life Science Edition),2019,40(4):84-88.(in Chinese)
[6] 杨志刚,忻晨,郑剑伟,等.三七总皂苷在罗非鱼饲料中的应用试验[J].饲料研究,2008(10):51-52.
YANG Z G,XIN C,ZHENG J W,et al.Application of Panax notoginseng saponins in tilapia feed [J].Feed Research,2008(10):51-52.(in Chinese)
[7] 杨志刚,忻晨,阙有清,等.三七总皂苷对罗非鱼体成分及非特异免疫的影响[J].饲料工业,2010,31(14):10-12.
YANG Z G,XIN C,QUE Y Q,et al.Effects of Panax notoginseng saponins on body composition and non-specific immunity of tilapia [J].Feed Industry,2010,31(14):10-12.(in Chinese)
[8] 陈阿琴,刘志伟,黄庆.三七总皂苷对异育银鲫生长及体成分的影响[J].饲料研究,2011(1):63-65.
CHEN A Q,LIU Z W,HUANG Q.Effects of Panax notoginseng saponins on the growth and body composition of Carassius auratus gibelio [J].Feed Research,2011(1):63-65.(in Chinese)
[9] 杨志刚,陈志刚,刘志伟,等.三七总皂苷对异育银鲫非特异免疫及抗氧化性能的影响[J].饲料研究,2010(8):66-68.
YANG Z G,CHEN Z G,LIU Z W,et al.Effects of Panax notoginseng saponins on the nonspecific immunity and oxidation resistance in Carassius auratus gibelio[J].Feed Research,2010(8):66-68.(in Chinese)
[10] 陈秀霞,池洪树,许斌福,等.口服三七总皂甙对大黄鱼免疫功能的影响[J].浙江农业学报,2021,33(4):610-617.
CHEN X X,CHI H S,XU B F,et al.Effects of oral Panax notoginseng saponins on immunity of large yellow croaker (Pseudosciaena crocea)[J].Acta Agriculturae Zhejiangensis,2021,33(4):610-617.(in Chinese)
[11] 崔晓莹,李泽宇,李完波,等.一种定量检测大黄鱼感染变形假单胞菌方法的建立与应用[J].集美大学学报(自然科学版),2019,24(5):328-334.
CUI X Y,LI Z Y,LI W B,et al.Establishment and application of a quantitative method for detecting of Pseudomonas plecoglossicid infection in large yellow croaker(Larimichthys crocea)[J].Journal of Jimei University (Natural Science Edition),2019,24(5):328-334.(in Chinese)
[12] LI S Y,YANG Z J,AO J Q,et al.Molecular and functional characterization of a novel stefin analogue in large yellow croaker (Pseudosciaena crocea)[J].Developmental &Comparative Immunology,2009,33(12):1268-1277.
[13] CHEN X X,CHI H S,XU B F,et al.Oral bovine serum albumin immune-stimulating complexes improve the immune responses and resistance of large yellow croaker (Pseudosciaena crocea,Richardson,1846) against Vibrio alginolyticus[J].Aquaculture Research,2019,50(10):2802-2809.
[14] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J].Methods,2001,25(4):402-408.
[15] 韩旻,韩丽妹,王青松,等.三七皂苷的口服吸收机制[J].药学学报,2006,41(6):498-505.
HAN M,HAN L M,WANG Q S,et al.Mechanism of oral absorption of Panax notoginseng saponins[J].Acta Pharmaceutica Sinica,2006,41(6):498-505.(in Chinese)
[16] 王毅,刘铁汉,王巍,等.人参皂苷Rg1的肠内菌代谢及其代谢产物吸收入血的研究[J].药学学报,2000,35(4):284-288.
WANG Y,LIU T H,WANG W,et al.Studies on the metabolism of ginsenoside Rg1 by intestinal bacteria and its absorbed metabolites in rat and human sera[J].Acta Pharmaceutica Sinica,2000,35(4):284-288.(in Chinese)
[17] AKAO T,KIDA H,KANAOKA M,et al.Intestinal bacterial hydrolysis is required for the appearance of compound K in rat plasma after oral administration of ginsenoside Rb1 from Panax ginseng[J].The Journal of Pharmacy and Pharmacology,1998,50(10):1155-1160.
[18] 张振国,郝爽,李继,等.鱼用三联口服疫苗的制备方法及其对大菱鲆的免疫效果[J].大连海洋大学学报,2016,31(3):252-255.
ZHANG Z G,HAO S,LI J,et al.Preparation of triple oral vaccine for fish and primary immune effect on turbot Scophthalmus maximus[J].Journal of Dalian Ocean University,2016,31(3):252-255.(in Chinese)
[19] 杨敏,梅馨月,郑建芬,等.三七主要病原菌对皂苷的敏感性分析[J].植物保护,2014,40(3):76-81.
YANG M,MEI X Y,ZHENG J F,et al.Sensitivity of the pathogens of Panax notoginseng to ginsenosides[J].Plant Protection,2014,40(3):76-81.(in Chinese)
[20] 吴丽霞,梁翠霞,廖乐乐,等.加压提取与加热回流提取三七皂苷物抗氧化活性比较研究[J].中国医药导报,2013,10(26):119-121,151.
WU L X,LIANG C X,LIAO L L,et al.Comparative study on the anti-oxidant activity of Panax notoginseng saponins by pressing extraction and heating reflux extraction[J].China Medical Herald,2013,10(26):119-121,151.(in Chinese)
[21] 杨婧娟,于海宁,林秋生,等.发酵辅助提取对三七总皂苷提取物生物活性的影响[J].天然产物研究与开发,2012,24(12):1816-1820,1852.
YANG J J,YU H N,LIN Q S,et al.Effect of fermentation-assisted extraction on the bioactivity of Panax notoginseng saponins[J].Natural Product Research and Development,2012,24(12):1816-1820,1852.(in Chinese)
[22] ODANI T,TANIZAWA H,TAKINO Y.Studies on the absorption,distribution,excretion and metabolism of ginseng saponins.IV.decomposition of ginsenoside-Rg1 and-Rb1 in the digestive tract of rats[J].Chemical and Pharmaceutical Bulletin,1983,31(10):3691-3697.
[23] 高利超,徐兵,刘永安,等.三七皂苷R1抑制TGF-β1/Smad3信号传导对糖尿病肾病大鼠肾脏纤维化和炎症细胞因子的调节作用研究[J].中国免疫学杂志,2020,36(10):1188-1193.
GAO L C,XU B,LIU Y A,et al.Regulatory effect of Notoginsenoside R1 on renal fibrosis and inflammatory cyto-kines in diabetic nephropathy rats via inhibiting of TGF-β1/Smad3 signal transduction[J].Chinese Journal of Immunology,2020,36(10):1188-1193.(in Chinese)
[24] 卫丽,穆志龙,贺望,等.三七总皂苷对川崎病模型小鼠血管炎性损伤的影响[J].中国药师,2021,24(8):482-486,499.
WEI L,MU Z L,HE W,et al.Effects of Panax notoginseng saponins on vasculitis injury in Kawasaki disease model mice[J].China Pharmacist,2021,24(8):482-486,499.(in Chinese)
[25] TANAKA Y,KAWANISHI N,SHIVA D,et al.Exhaustive exercise reduces tumor necrosis factor-alpha production in response to lipopolysaccharide in mice[J].Neuroimmunomodulation,2010,17(4):279-286.
[26] TRACEY D,KLARESKOG L,SASSO E H,et al.Tumor necrosis factor antagonist mechanisms of action:a comprehensive review[J].Pharmacology &Therapeutics,2008,117(2):244-279.
[27] TANG Y,XIN G,ZHAO L M,et al.Novel insights into host-pathogen interactions of large yellow croakers (Larimichthys crocea) and pathogenic bacterium Pseudomonas plecoglossicida using time-resolved dual RNA-seq of infected spleens[J].Zoological Research,2020,41(3):314-327.
[28] BALKWILL F.Tumour necrosis factor and cancer[J].Nature Reviews Cancer,2009,9(5):361-371.
[29] CHEN H,ZHANG L J,KE L,et al.CpG-ODN 2007 protects zebrafish (Danio rerio) against Vibrio vulnificus infection[J].Aquaculture Research,2021,52(3):897-905.