铜藻(Sargassum horneri)隶属于褐藻门(Phaeophyta)墨角藻目(Fucales)马尾藻科(Sargassaceae)马尾藻属(Sargassum),是中国暖温带海域浅海区海藻场中的大型褐藻[1],主要分布在中国辽东半岛、福建、浙江和广东等近海海域。铜藻藻株高大、枝叶繁茂,藻体为黄褐色,呈树状,最高可达5 m[2],其不仅是优质的藻胶工业原料,而且在医药、食品领域及有机肥料等行业也有应用。研究发现,铜藻是修复海底藻场和海洋生态环境的重要物种之一[3-4],其市场前景十分广阔[5]。
铜藻不仅富含褐藻胶、膳食纤维和矿物质等成分,还含有较高的岩藻聚糖硫酸酯(fucoidan)、岩藻黄素(fucoxanthin)和褐藻多酚(phlorotannins)等功能活性物质[6-9],而且具有消炎止痰、清热健脾等药用功能,因此,其具有较高的研究价值[10-11]。目前,岩藻聚糖硫酸酯已成为褐藻活性物质的研究热点。从铜藻中提取的岩藻聚糖硫酸酯具有抗氧化、抗炎和抗衰老等多种生物活性[12-14]。魏双艳等[15]研究表明,从铜藻中分离的多糖对H2O2诱导的HaCaT细胞氧化应激损伤具有保护作用。Wen等[16]研究发现,从铜藻中分离的多糖对脂多糖(LPS)刺激的RAW264.7巨噬细胞具有体外抗炎作用。
近年来,中老年人高脂血症等疾病的发病率明显上升,如冠心病和动脉硬化等,而市场上有效的降血脂药物服用后大多会产生副作用,损伤肝组织,且需要定期检查肝功能,因此,迫切需要开发低毒无害的降血脂药物。有研究表明,从褐藻中提取的岩藻聚糖硫酸酯具有较好的降脂效果[17],但目前对铜藻岩藻聚糖硫酸酯降血脂活性的研究鲜见报道。本研究中,以铜藻为原料,使用复合酶解法提取岩藻聚糖硫酸酯,并对其单糖组成和结构进行分析,通过灌胃小鼠建立其高脂模型,探究了铜藻岩藻聚糖硫酸酯的体内降血脂作用,以期为低毒无害的降血脂药物的开发提供科学参考。
1 材料与方法
1.1 材料
原料:铜藻采自辽宁省大连市黑石礁海域,去除附生植物和沙粒,在海水中荡洗干净,自然干燥后密封包装,于-18 ℃冷柜中保存。
试验动物:试验用SPF级昆明种(KM)雄性小鼠,购自大连医科大学动物实验中心(动物生产许可证号:SYXK-2013-0006)。
药品与试剂:蛋白酶(北京索莱宝科技有限公司);纤维素酶、果胶酶(上海蓝季科技发展有限公司);高密度脂蛋白胆固醇(HDL-C)、丙二醛(MDA)、一氧化氮(NO)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、谷胱甘肽过氧化物酶(GSH-Px)和总超氧化物歧化酶(T-SOD)等测定试剂盒(南京建成生物工程公司);脂必妥片(成都地奥九鸿制药厂);其他试剂均为分析纯。
仪器设备:LDS-2A型离心机(北京医用离心机厂);HH-4型数显恒温水浴锅(常州国华电器有限公司);SC210A-230型低温真空浓缩机(美国TheretoSavant公司);安捷伦 1260 型高效液相色谱仪(美国 Agilent 公司);Nicolet-470 型红外光谱仪(美国 Nicolet 公司);Jim-XerII型漩涡混合仪(上海沪西分析仪器厂)。
1.2 方法
1.2.1 铜藻岩藻聚糖硫酸酯的制备 采用复合酶解法[18]提取岩藻聚糖硫酸酯(以下简称“SF”)。称取解冻后的铜藻样品,加入15倍的水,使用搅碎机捣碎,加入纤维素酶、果胶酶和蛋白酶,50 ℃下水浴复合酶解50 min,在98 ℃水浴中抽提3 h,冷却至室温,离心(5 000 r/min,15 min);弃上清液后,向沉淀中加入95%(体积分数,下同)的食用乙醇,使溶液中的乙醇含量为20%,醇沉过夜,离心(5 000 r/min,15 min);再弃上清液,加入95%食用乙醇使溶液中乙醇含量为60%,醇沉过夜,此时会产生白色沉淀,离心(5 000 r/min,15 min),弃上清液,将沉淀冷冻干燥,得到岩藻聚糖硫酸酯粗品。
1.2.2 总糖含量的测定 使用苯酚-硫酸法测定总糖含量[19]。按照L-岩藻糖与D-半乳糖质量比为3∶1制作标准曲线,样品质量浓度为10 mg/mL,测定吸光度值,依据标准曲线计算总糖含量。
1.2.3 硫酸基团含量的测定 用盐酸水解-硫酸钡比浊法测定硫酸基团含量[20]。先绘制出标准曲线,将样品酸解后测定吸光度值,然后按照标准曲线计算样品中硫酸基团的含量。
1.2.4 傅里叶红外光谱分析 准确称取SF粗提物2 mg,干燥条件下加入100 mg溴化钾研磨,压制成透明均匀的薄片,用Nicolet-470型红外光谱仪测定,在4 000~400 cm-1波数范围内进行扫描。
1.2.5 单糖组成的测定
样品水解:准确称取干燥恒重的SF粗品20 mg置于消化管中,溶胀过夜,加入1.5 mL浓度为8 mol/L的TFA溶液,混匀,水解6 h,冷却至室温,4 ℃下过夜,用浓度为4 mol/L NaOH 调节pH至6~7,离心取上清液备用。
样品衍生化:吸取上清液200 μL置于1.5 mL 离心管中,加入200 μL浓度为3 mol/L NaOH 溶液,漩涡振荡,再加入200 μL浓度为0.5 mol/L的PMP甲醇溶液,混匀,70 ℃下水浴90 min,冷却至室温;加入200 μL浓度为0.3 mol/L的醋酸溶液和200 μL浓度为0.1 mol/L的 KH2PO4溶液,混匀后加入1 mL氯仿,漩涡振荡,反复萃取3次,利用孔径为0.45 μm 的水系膜过滤,使用高效液相色谱仪进行分析。
色谱条件:Agilent ZORBAX Eclipse XDB C-18 色谱柱(5 μm,4.6 mm×250 mm);柱温为30 ℃;流速为1 mL/min;检测波长为250 nm;进样体积为20 μL。流动相A:15%乙腈(体积分数)+50 mmol/L KH2PO4(pH 6.0)。流动相 B:40%乙腈(体积分数)+50 mmol/L K2HPO4(pH 6.0)。进样程序参数:0 min 100% A→10 min 85% A→55 min 50% A →65 min 100% A。
1.2.6 动物试验
1)高脂饲料的制作。使用10%的猪油、2%的胆固醇、0.5%的胆盐和87.5%的基础饲料制作高脂饲料。将基础饲料粉碎后与胆固醇、胆盐逐步混合均匀后,放入斩拌机中一边搅拌一边加水,缓慢倒入加热融化后的猪油,搅拌均匀后挤压制作成型,烘干,常温下密封保存待用。
2)试验设计及日常管理。将60只健康SPF级KM小鼠适应性饲养5 d后,随机分成6个组,每组10只,分为空白组、模型组、阳性对照组,以及SF低、中和高剂量组(记为SFL、SFM、SFH),具体分组和灌胃情况如表1所示。试验开始后每天记录小鼠体质量,每天按表1中的剂量进行灌胃,连续灌胃28 d。饲养期间,温度为(25±5)℃,相对湿度为(65%±5%),光照周期为12 L∶12 D。
表1 KM小鼠试验分组与饲养灌胃剂量
Tab.1 Grouping of test KM mice with feeding gavage dose
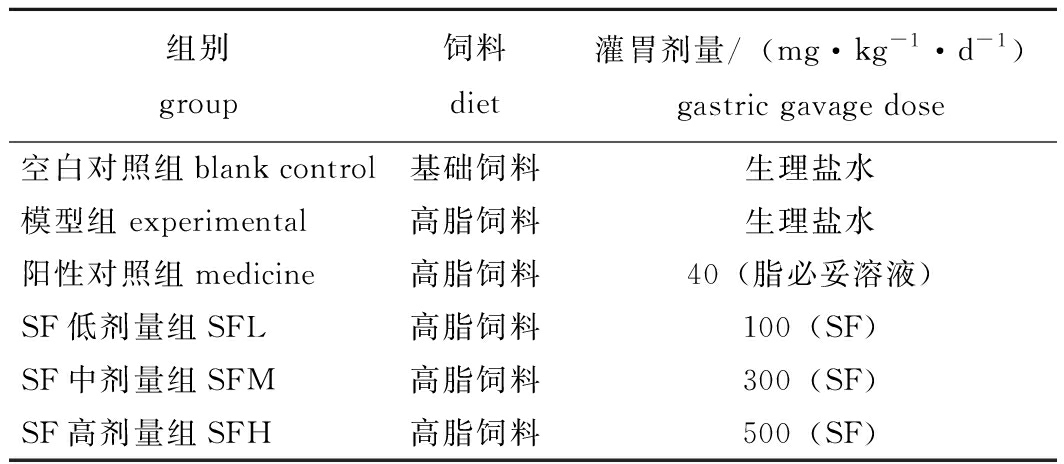
组别group饲料diet灌胃剂量/(mg·kg-1·d-1)gastric gavage dose空白对照组blank control基础饲料生理盐水模型组experimental高脂饲料生理盐水阳性对照组medicine高脂饲料40(脂必妥溶液)SF低剂量组SFL高脂饲料100(SF)SF中剂量组SFM高脂饲料300(SF)SF高剂量组SFH高脂饲料500(SF)
末次灌胃小鼠后禁食12 h,摘眼球取血,牺牲小鼠后立即进行解剖,取其肝脏和脾脏在生理盐水中充分漂洗,用滤纸吸干水分后称量其质量,并于-80 ℃超低温冰箱中保存,用于后续指标测定。
1.2.7 生化指标的测定与计算
1)脏器指数。计算公式为
脾脏(肝脏)指数=脾脏质量(肝脏质量)/
小鼠质量×100%。
(1)
2)血清血脂指标。常温下将抽取的血液静置15 min,以3 000 r/min离心15 min,分离的血清在 4 ℃下保存。使用相应试剂盒测定小鼠血清中HDL-C、TC、TG和LDL-C含量。
3)肝脏酶活指标。取小鼠肝脏组织,按质量(g)与体积(mL)比为1∶9加入生理盐水,使用组织匀浆机进行冰水浴匀浆,离心后取上清液,使用相应试剂盒测定小鼠肝脏中MDA、GSH-Px、T-SOD和NO的含量。
4)动脉粥样硬化指数AI(IA)和极低密度脂蛋白VLDL-C。计算公式为
IA=cTC/cHDL-C,
(2)
cVLDL-C=cTG×0.2。
(3)
其中:cTC、cHDL-C分别为TG和HDL-C的浓度(mmol/L);cVLDL-C、cTG分别为VLDL-C和TG的浓度(mmol/L)。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,并采用SPSS 18.0软件进行单因素方差分析,采用Duncan法进行组间多重比较。显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 铜藻岩藻聚糖硫酸酯的理化性质
使用复合酶解法提取SF的提取率为3.68%±0.33%,总糖含量为42.63%±0.96%,硫酸基团含量为13.35%±0.35%,纯度为55.98%(总糖含量与硫酸基团含量之和)。
2.2 铜藻岩藻聚糖硫酸酯的红外光谱分析
从图1可见:在3 269 cm-1处的强吸收峰是由于糖类O—H伸缩振动引起的;在2 919 cm-1处的窄吸收峰是岩藻糖的甲基特征吸收峰,是由C—H伸缩振动导致的;在1 631 cm-1处的强吸收峰是由C![]() O伸缩振动引起的,表明多糖中存在羧基;在1 418 cm-1处的吸收峰是由C—O振动收缩产生的,是多糖的特征吸收峰;在1 299 cm-1处的吸收峰是硫酸基团S
O伸缩振动引起的,表明多糖中存在羧基;在1 418 cm-1处的吸收峰是由C—O振动收缩产生的,是多糖的特征吸收峰;在1 299 cm-1处的吸收峰是硫酸基团S![]() O拉伸振动引起的;在1 020 cm-1处的吸收峰是由C—O—C拉伸振动导致的,表明多糖具有吡喃型糖环;在943 cm-1处的吸收峰是由O—H弯曲振动引起的,是β-糖苷键的特征峰;在817 cm-1处的吸收峰是由C—O—S伸缩振动引起的,表明硫酸基团在轴向C—4的位置被取代。
O拉伸振动引起的;在1 020 cm-1处的吸收峰是由C—O—C拉伸振动导致的,表明多糖具有吡喃型糖环;在943 cm-1处的吸收峰是由O—H弯曲振动引起的,是β-糖苷键的特征峰;在817 cm-1处的吸收峰是由C—O—S伸缩振动引起的,表明硫酸基团在轴向C—4的位置被取代。
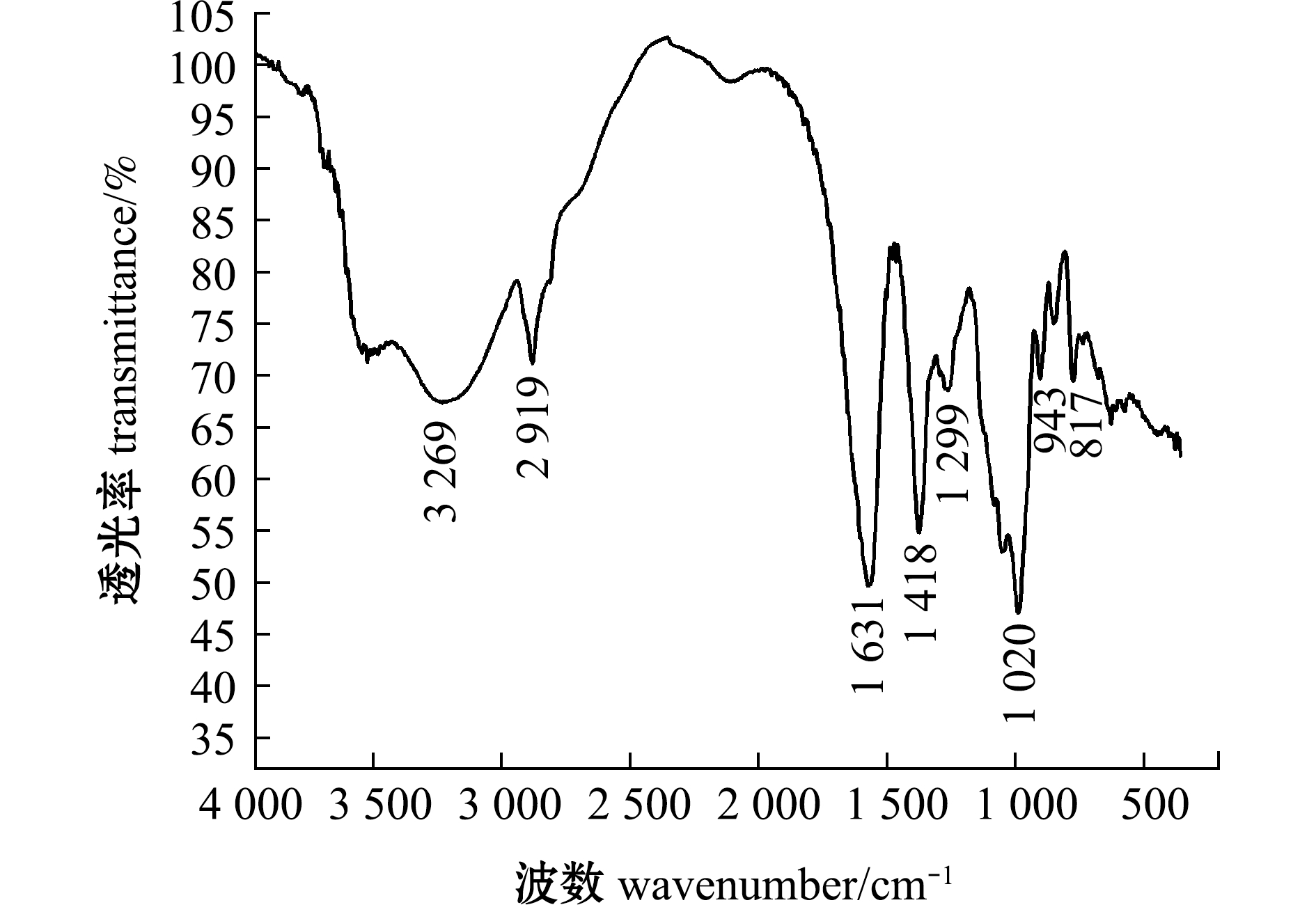
图1 铜藻岩藻聚糖硫酸酯的红外光谱分析
Fig.1 Structural analysis of Sargassum horneri fucoidan by IR
2.3 铜藻岩藻聚糖硫酸酯的单糖组成
使用PMP柱前衍生高效液相色谱法进行分析,以甘露糖、岩藻糖、鼠李糖、葡萄糖、半乳糖、木糖、葡糖醛酸、半乳糖醛酸作为标准品,通过对照样品和标准品的保留时间,根据峰面积计算样品的摩尔比。从表2可见,SF主要由岩藻糖、半乳糖和木糖构成,含量分别为39.83%、28.37%和14.62%,半乳糖醛酸(GalUA)未检出。
表2 铜藻岩藻聚糖硫酸酯的单糖组成
Tab.2 Monosaccharide composition of Sargassum horneri fucoidan %
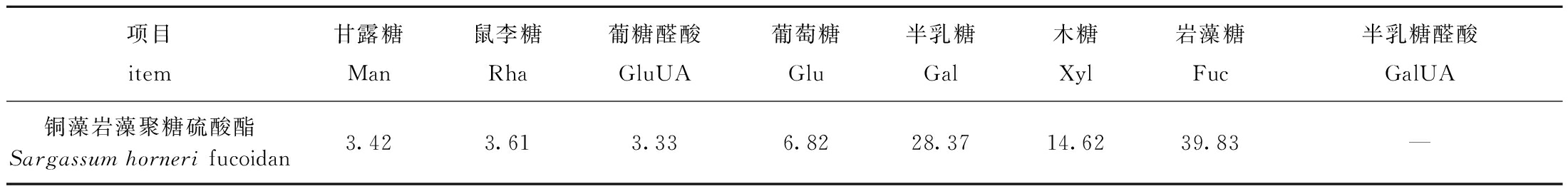
项目item甘露糖Man鼠李糖Rha葡糖醛酸GluUA葡萄糖Glu半乳糖Gal木糖Xyl岩藻糖Fuc半乳糖醛酸GalUA铜藻岩藻聚糖硫酸酯Sargassum horneri fucoidan3.423.613.336.8228.3714.6239.83—
注:—表示未检出。
Note:—means undetected.
2.4 SF对小鼠体质量的影响
从表3可见:喂养初期的小鼠体质量(SFL组除外)无显著性差异(P>0.05);灌胃4周后,与空白组相比,模型组小鼠的体质量极显著升高(P<0.01),证明高脂模型造模成功;与模型组相比,各SF剂量组体质量均极显著降低(P<0.01)。这表明,各剂量的SF多糖具有调节小鼠体质量的作用,且降低小鼠体质量的效果要高于药物,其中SFH组效果最好。
表3 铜藻岩藻聚糖硫酸酯对小鼠体质量的影响
Tab.3 Effects of Sargassum horneri fucoidan on body weight in mice
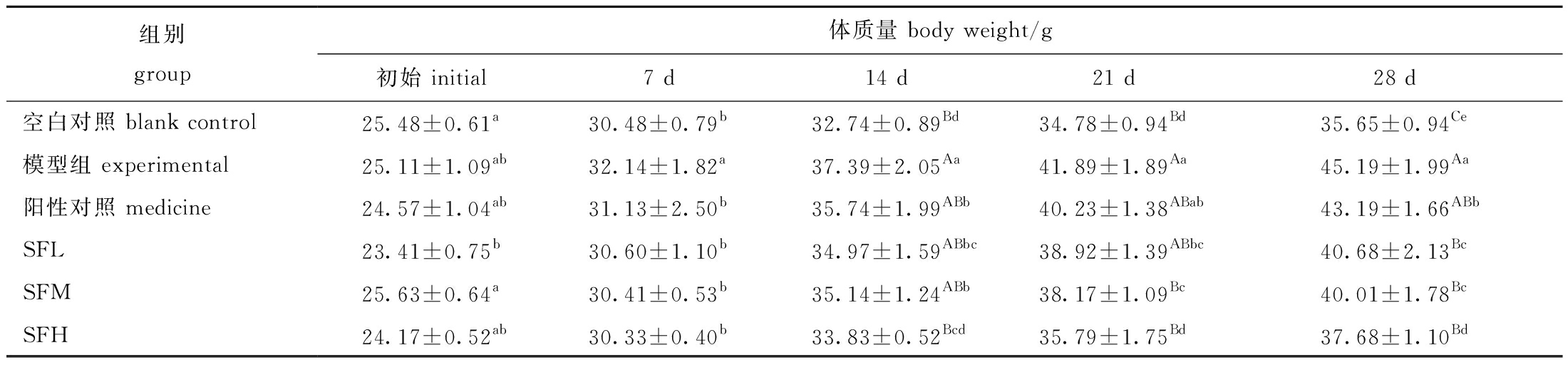
组别group体质量 body weight/g初始 initial7 d14 d21 d28 d空白对照 blank control25.48±0.61a30.48±0.79b32.74±0.89Bd34.78±0.94Bd35.65±0.94Ce模型组 experimental25.11±1.09ab32.14±1.82a37.39±2.05Aa41.89±1.89Aa45.19±1.99Aa阳性对照 medicine24.57±1.04ab31.13±2.50b35.74±1.99ABb40.23±1.38ABab43.19±1.66ABbSFL23.41±0.75b30.60±1.10b34.97±1.59ABbc38.92±1.39ABbc40.68±2.13BcSFM25.63±0.64a30.41±0.53b35.14±1.24ABb38.17±1.09Bc40.01±1.78BcSFH24.17±0.52ab30.33±0.40b33.83±0.52Bcd35.79±1.75Bd37.68±1.10Bd
注:同列中标有不同大写字母者表示组间有极显著性差异(P<0.01),标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different capital letters within the same column are very significantly different among the groups at the 0.01 probability level,means with different letters within the same column being significantly different at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
2.5 SF对小鼠脏器指数的影响
从表4可见:与空白组相比,模型组的肝脏指数和脾脏指数均显著升高(P<0.05);与模型组相比,各SF剂量组和药物组肝脏指数均显著降低(P<0.05),SFM和SFH组脾脏指数显著降低(P<0.05),其中,SFH抑制肝脏指数和脾脏指数升高的效果优于药物,这与小鼠体质量的结果一致。
表4 铜藻岩藻聚糖硫酸酯对小鼠脏器指数的影响
Tab.4 Effects of Sargassum horneri fucoidan on organ index in mice %
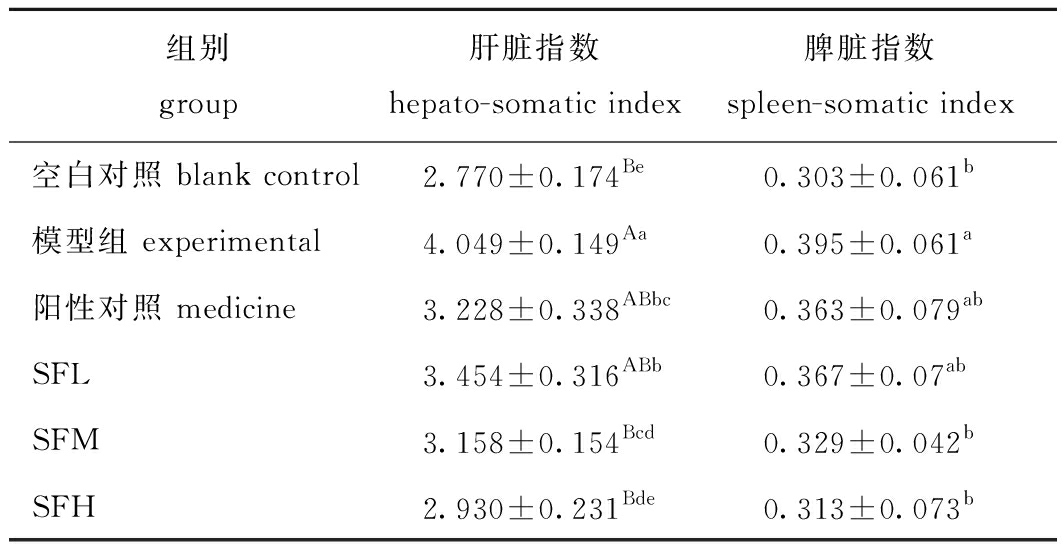
组别group肝脏指数hepato-somatic index脾脏指数spleen-somatic index空白对照 blank control2.770±0.174Be0.303±0.061b模型组 experimental4.049±0.149Aa0.395±0.061a阳性对照 medicine3.228±0.338ABbc0.363±0.079abSFL3.454±0.316ABb0.367±0.07abSFM3.158±0.154Bcd0.329±0.042bSFH2.930±0.231Bde0.313±0.073b
2.6 SF对小鼠血脂指标的影响
从表5可见:与空白组相比,模型组的小鼠血清中TC、TG和LDL-C水平极显著升高(P<0.01),HDL-C水平极显著降低(P<0.01),说明喂食高脂饲料可以极显著影响小鼠血清的血脂指标,证明模型造模成功;与模型组相比,药物组血清中仅LDL-C水平显著降低(P<0.05);各SF剂量组血清中TC、TG和LDL-C水平均显著降低(P<0.05),HDL-C水平均显著升高(P<0.05)。这表明,灌胃一定剂量的SF能够较好地调节高脂小鼠的血清血脂指标,对高脂血症的改善有重要作用,且改善效果比药物要好。
表5 铜藻岩藻聚糖硫酸酯对小鼠血清生化指标的影响
Tab.5 Effects of Sargassum horneri fucoidan on serum biochemical indices of mice mmol/L
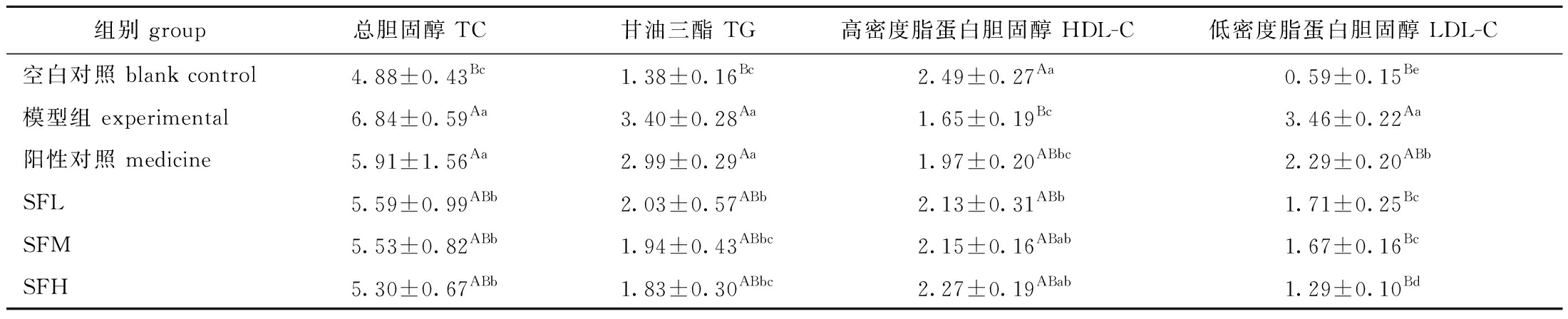
组别 group总胆固醇 TC甘油三酯 TG高密度脂蛋白胆固醇 HDL-C低密度脂蛋白胆固醇 LDL-C空白对照 blank control4.88±0.43Bc1.38±0.16Bc2.49±0.27Aa0.59±0.15Be模型组 experimental6.84±0.59Aa3.40±0.28Aa1.65±0.19Bc3.46±0.22Aa阳性对照 medicine5.91±1.56Aa2.99±0.29Aa1.97±0.20ABbc2.29±0.20ABbSFL5.59±0.99ABb2.03±0.57ABb2.13±0.31ABb1.71±0.25BcSFM5.53±0.82ABb1.94±0.43ABbc2.15±0.16ABab1.67±0.16BcSFH5.30±0.67ABb1.83±0.30ABbc2.27±0.19ABab1.29±0.10Bd
2.7 SF对小鼠肝脏抗氧化指标的影响
从表6可见:与空白组相比,模型组MDA含量极显著升高(P<0.01),GSH-Px、SOD活力极显著降低(P<0.01),证明高脂模型造模成功,表明高热量饮食会增加机体的氧化应激反应;与模型组相比,药物调节肝脏MDA含量和SOD活力的能力并不显著(P>0.05),但可以显著升高GSH-Px活力(P<0.05);SF干预后能调节各项抗氧化指标,与模型组相比,SFL调节作用不明显,而SFM能显著降低MDA含量和提高GSH-Px活力(P<0.05),SFH能显著降低MDA含量和提高GSH-Px、SOD活力(P<0.05);各SF剂量组NO水平均显著提高(P<0.05)。这表明,SF可以通过增强机体内抗氧化物质的活性,并呈剂量依赖性影响高脂造成的机体抗氧化能力紊乱,提高小鼠的抗氧化能力,预防进一步的肝脏脂肪病变。
表6 铜藻岩藻聚糖硫酸酯对小鼠肝脏氧化应激指标的影响
Tab.6 Effects of Sargassum horneri fucoidan on markers of oxidative stress in mouse liver
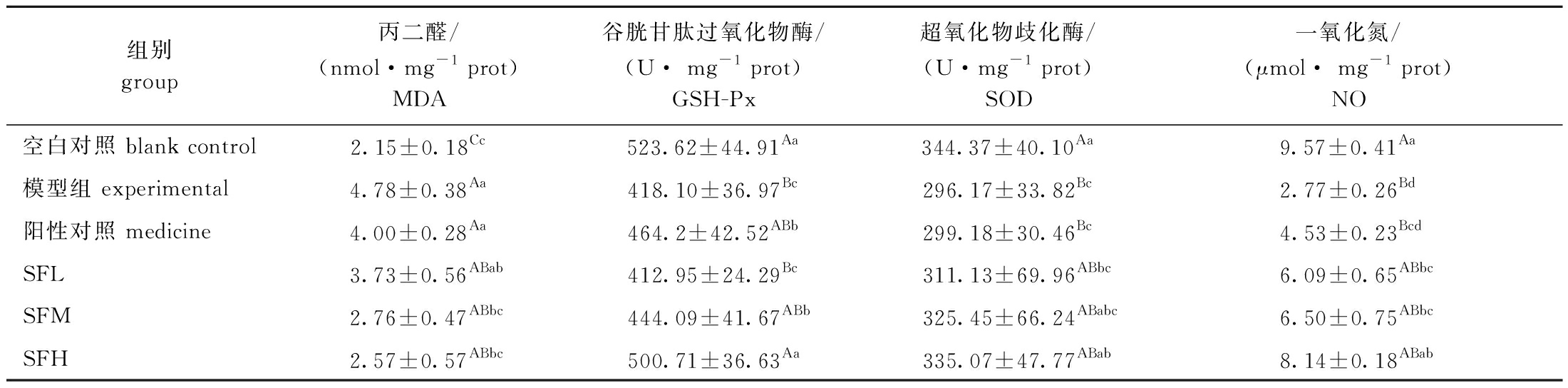
组别group丙二醛/(nmol·mg-1 prot)MDA谷胱甘肽过氧化物酶/(U· mg-1 prot)GSH-Px超氧化物歧化酶/(U·mg-1 prot)SOD一氧化氮/(μmol· mg-1 prot)NO空白对照 blank control2.15±0.18Cc523.62±44.91Aa344.37±40.10Aa9.57±0.41Aa模型组 experimental4.78±0.38Aa418.10±36.97Bc296.17±33.82Bc2.77±0.26Bd阳性对照 medicine4.00±0.28Aa464.2±42.52ABb299.18±30.46Bc4.53±0.23BcdSFL3.73±0.56ABab412.95±24.29Bc311.13±69.96ABbc6.09±0.65ABbcSFM2.76±0.47ABbc444.09±41.67ABb325.45±66.24ABabc6.50±0.75ABbcSFH2.57±0.57ABbc500.71±36.63Aa335.07±47.77ABab8.14±0.18ABab
2.8 SF对小鼠AI和VLDL-C的影响
从表7可见:相比于空白组,模型组AI指数显著升高(P<0.05),超过正常值(AI<4),与模型组相比,药物组AI指数显著降低到正常值范围内(P<0.05),而灌胃SF的各剂量组AI指数均显著下降(P<0.05),且SF降低AI指数的效果均优于药物;与空白组相比,模型组肝脏VLDL-C浓度极显著升高(P<0.01),与模型组相比,药物组VLDL-C浓度略有下降(P>0.05),而灌胃SF的各剂量组VLDL-C浓度均显著降低(P<0.05)。这表明,灌胃一定剂量的SF可以有效抑制肝脏中脂肪蓄积,且抑制效果优于药物。
表7 铜藻岩藻聚糖硫酸酯对小鼠AI、VLDL-C的影响
Tab.7 Effects of Sargassum horneri fucoidan on AI and VLDL in mice
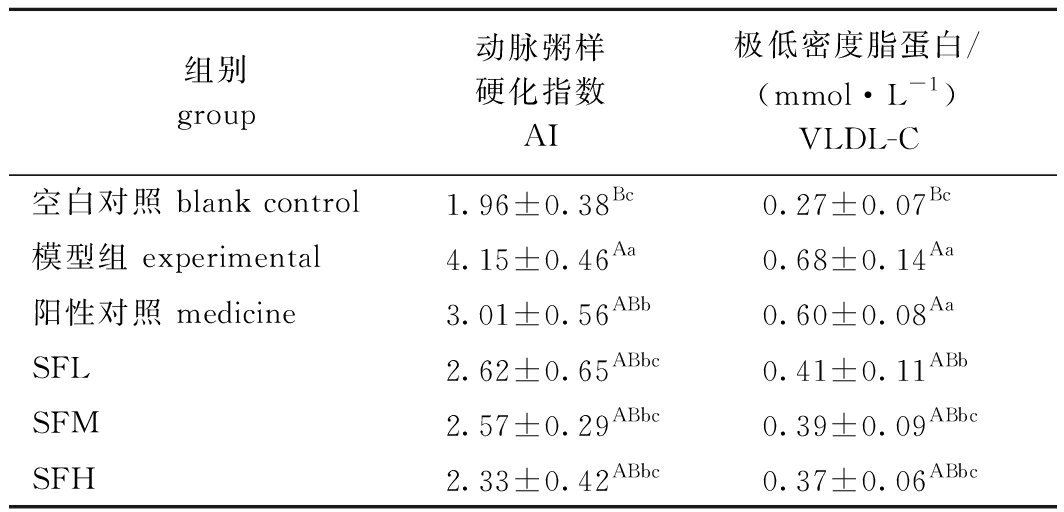
组别group动脉粥样硬化指数AI极低密度脂蛋白/(mmol·L-1)VLDL-C空白对照 blank control1.96±0.38Bc0.27±0.07Bc模型组 experimental4.15±0.46Aa0.68±0.14Aa阳性对照 medicine3.01±0.56ABb0.60±0.08AaSFL2.62±0.65ABbc0.41±0.11ABbSFM2.57±0.29ABbc0.39±0.09ABbcSFH2.33±0.42ABbc0.37±0.06ABbc
3 讨论
3.1 铜藻岩藻聚糖硫酸酯的结构组成特征
从不同种类的褐藻中提取的岩藻聚糖硫酸酯结构有所差异。本研究表明,铜藻岩藻聚糖硫酸酯是一种含有β-吡喃糖环的硫酸多糖,硫酸基团在C—4的位置取代,主要由岩藻糖、半乳糖和木糖等单糖构成。武苏凤[21]从海带中提取的岩藻聚糖硫酸酯,主要由岩藻糖、半乳糖和甘露糖等单糖构成,红外光谱分析表明,其是硫酸基取代位置在C—4位上的高度硫酸化的半乳岩藻聚糖;郑桂青[22]使用水提醇沉法从裙带菜中提取的多糖,主要由葡萄糖和木糖等单糖构成,红外光谱扫描发现,裙带菜多糖含有一定的硫酸基团和羧基,且含有β-吡喃型糖苷。本研究结果与刘佳[23]、李伟[24]研究的铜藻多糖结构结果较为一致,单糖组成表明,铜藻多糖以岩藻糖为主,这与其他褐藻多糖有差异,而多糖的结构对生物活性有较大的影响,因此,可能表现出特异性的生物活性和药理作用。
3.2 铜藻岩藻聚糖硫酸酯的降血脂作用
小鼠长期摄食高脂饲料可导致其脏器脂质积累及病变,脏器指数可以直观反映小鼠肝脏、脾脏的健康程度[25]。本研究表明,铜藻岩藻聚糖硫酸酯具有较好的降血脂作用,小鼠试验发现,灌胃铜藻岩藻聚糖硫酸酯能有效地调节机体质量、脏器质量,减少脂肪沉积。本研究中,通过分析高脂小鼠血清指标的变化,证明一定剂量的SF干预能显著改善机体的脂质代谢紊乱、脂肪蓄积或脂质转运代谢途径异常。喂食小鼠高脂饮食在形成高脂血症的同时,由于脂质在体内的过度蓄积,会导致小鼠的抗氧化体系失调[26],机体抗氧化系统的紊乱则会导致高脂血症进一步发展,对肝脏产生影响,从而造成脂肪肝,或者肝脏等器官进一步的脂肪病变[27]。本研究中,通过SF的干预能显著降低高脂小鼠肝脏中脂质过氧化物MDA含量,升高SOD和GSH-Px活力以清除氧自由基和OH-自由基,有效地减少细胞膜脂质的过氧化反应及氧化应激带来的损伤,同时灌胃SF还能提高机体NO水平,通过抑制炎症因子来降低自由基浓度,从而减少高脂血症并发炎症的产生。AI被称为动脉粥样硬化指数,VLDL-C是极低密度脂蛋白,主要由肝细胞合成,是内源性甘油三酯。本研究中,灌胃SF可以调节AI值到正常范围内,并可以显著降低VLDL-C浓度,达到预防高脂血症诱发心血管疾病的作用。
Jinhe等[28]研究表明,从墨角藻中提取的褐藻多糖能够显著降低高脂血症小鼠血清中TC、TG、LDL-C水平,升高HDL-C水平,可以较好地调节血脂水平,改善动脉粥样硬化。倪华等[29]研究表明,用一定剂量的海带多糖灌胃高脂大鼠,能够降低血清TC、TG、LDL-C水平,升高HDL-C水平和NO浓度,改善动脉粥样硬化。唐茹萌等[30]研究表明,从裙带菜中提取的多糖能够抑制因高脂饮食导致的血清中TC、TG和LDL-C水平增加,升高HDL-C水平,提高小鼠肝脏抗氧化体系相关物质的水平,降低肝脏MAD水平。本研究中,铜藻岩藻聚糖硫酸酯降血脂的结果与上述研究结果均一致。大量的研究表明,褐藻中的多糖及富含多糖的化合物均具有较好的降血脂作用,本研究中铜藻岩藻聚糖硫酸酯的结构与其他褐藻多糖结构有一定差异,包括单糖组成、硫酸基团的含量、取代位置及官能团构成等,这都可能影响多糖的生物活性,因此,进一步解析褐藻多糖结构对探究其降血脂作用的机制具有重要意义。
本研究中,通过建立小鼠高脂模型,证实铜藻中岩藻聚糖硫酸酯能够降低胆固醇、甘油三酯及低密度脂蛋白含量,明显改善高脂造成的血脂异常;降低体内过氧化程度,提高NO水平。这表明,铜藻岩藻聚糖硫酸酯能有效地预防心血管疾病,具有很好的降血脂作用,但其降血脂作用机制还有待进一步研究。
4 结论
1)从铜藻中提取的岩藻聚糖硫酸酯提取率为3.68%,总糖含量为42.63%,硫酸基含量为13.35%,主要由岩藻糖、半乳糖和木糖构成,是一种含有β-吡喃糖环的硫酸多糖,硫酸基团在C—4的位置被取代。
2)铜藻岩藻聚糖硫酸酯能改善高脂小鼠体质量和脏器指数,降低血清中TC、TG和LDL-C水平,升高HDL-C水平;降低小鼠肝脏中MDA含量,升高SOD、GSH-Px酶活力,提高NO水平,说明其能有效改善小鼠动脉粥样硬化指数,具有良好的降血脂作用。
[1] 曾呈奎,吴超元.海带养殖学[M].北京:科学出版社,1962.
ZENG C K,WU C Y.Kelp culture[M].Beijing:Science Press,1962.(in Chinese)
[2] 孙建璋,庄定根,杨加波,等.南麂列岛铜藻增殖技术的初步研究[J].现代渔业信息,2010,25(1):23-27.
SUN J Z,ZHUANG D G,YANG J B,et al.Primary study on enhancement technique of Sargassum horneri around Nanji Islands[J].Modern Fisheries Information,2010,25(1):23-27.(in Chinese)
[3] 孙建璋,庄定根,陈万东,等.铜藻繁殖生物学及种苗培育研究[J].南方水产,2008,29(4):6-14.
SUN J Z,ZHUANG D G,CHEN W D,et al.Studies on sexual reproduction and seedling production of the brown alga Sargassum horneri [J].South China Fisheries Science,2008,29(4):6-14.(in Chinese)
[4] MINAMI K,KITA C,SHIRAKAWA H,et al.Acoustic characteristics of a potentially important macroalgae, Sargassum horneri,for coastal fisheries[J].Fisheries Research,2021,240.
[5] 李红艳,王颖,刘天红,等.铜藻岩藻黄素提取及纯化工艺研究[J].生物技术进展,2020,10(2):205-213.
LI H Y,WANG Y,LIU T H,et al.Study on extraction and purification technology of fucoxanthin from copper algae[J].Current Biotechnology,2020,10(2):205-213.(in Chinese)
[6] 纪蕾,孙元芹,王颖,等.铜藻膳食纤维的提取及其理化特性研究[J].保鲜与加工,2018,18(6):62-69.
JI L,SUN Y Q,WANG Y,et al.Study on extraction,physical and chemical properties of dietary fiber from Sargassum horneri[J].Storage and Process,2018,18(6):62-69.(in Chinese)
[7] 郑丽杰,缪晓冬,韩威,等.铜藻主要化学成分分析及抗氧化活性评价[J].食品工业科技,2020,41(22):232-239.
ZHENG L J,MIAO X D,HAN W,et al.Analysis of main chemical components and evaluation of antioxidant activity of Sargassum horneri[J].Science and Technology of Food Industry,2020,41(22):232-239.(in Chinese)
[8] 杨凌杰,胡永东,张雷芳,等.铜藻中岩藻黄质对H2O2诱导RAW264.7细胞氧化损伤的保护作用[J].浙江海洋大学学报(自然科学版),2022,41(1):38-44.
YANG L J,HU Y D,ZHANG L F,et al.Protective effects of fucoxanthin from Sargassum horneri on hydrogen peroxide-induced oxidative injury in RAW264.7 cells[J].Journal of Zhejiang Ocean University (Natural Science Edition),2022,41(1):38-44.(in Chinese)
[9] 何袅袅,陈雅鑫,蔡树芸,等.铜藻多酚的分离纯化及抗氧化活性研究[J].食品工业科技,2023,44(3):183-191.
HE N N,CHEN Y X,CAI S Y,et al.Separation and purification and antioxidant activity of polyphenols from Sargassum horneri[J].Science and Technology of Food Industry,2023,44(3):183-191.(in Chinese)
[10] 郑海羽,饶道专,陈高峰,等.保护性开发南麂列岛铜藻Sargassaum horneri(Turn.)Ag.资源的思考[J].现代渔业信息,2008,23(10):25-26.
ZHENG H Y,RAO D Z,CHEN G F,et al.Consideration on protective exploitation of Sargassaum horneri(Turn.)Ag. resource around Nanji Islands[J].Modern Fisheries Information,2008,23(10):25-26.(in Chinese)
[11] 王作芸,赵学武.铜藻的褐藻糖胶、褐藻淀粉和褐藻胶的分离及提纯[J].水产学报,1985,9(1):71-77.
WANG Z Y,ZHAO X W.Extraction and isolation of alginic acid,laminaran and fucoidan from Sargassum horneri (Turn) C.AG[J].Journal of Fisheries of China,1985,9(1):71-77.(in Chinese)
[12] SHAO P,CHEN X X,SUN P L.Improvement of antioxidant and moisture-preserving activities of Sargassum horneri polysaccharide enzymatic hydrolyzates[J].International Journal of Biological Macromolecules,2015,74:420-427.
[13] 杨亚云.四种大型海藻在化妆品上综合应用研究[D].上海:上海海洋大学,2016.
YANG Y Y.Comprehensive application of four algae in cosmetics[D].Shanghai:Shanghai Ocean University,2016.(in Chinese)
[14] SANJEEWA K K A,FERNANDO I P S,KIM S Y,et al.In vitro and in vivo anti-inflammatory activities of high molecular weight sulfated polysaccharide;containing fucose separated from Sargassum horneri:short communication[J].International Journal of Biological Macromolecules,2018,107(Pt A):803-807.
[15] 魏双艳,蔡春尔,何培民,等.铜藻多糖对H2O2诱导的HaCaT细胞氧化应激的保护作用[J].热带亚热带植物学报,2023,31(2):232-240.
WEI S Y,CAI C E,HE P M,et al.Protective effect of polysaccharide from Sargassum horneri on H2O2-induced oxidative stress in HaCaT cells[J].Journal of Tropical and Subtropical Botany,2023,31(2):232-240.(in Chinese)
[16] WEN Z S,XIANG X W,JIN H X,et al.Composition and anti-inflammatory effect of polysaccharides from Sargassum horneri in RAW264.7 macrophages[J].International Journal of Biological Macromolecules,2016,88:403-413.
[17] 杨夏,冯颖淑,童珊珊,等.降血脂多糖活性机制及构效关系研究进展[J].中国中药杂志,2018,43(20):4011-4018.
YANG X,FENG Y S,TONG S S,et al.Study on mechanism and structure-activity relationship of hypolipidemic polysaccharides:a review[J].China Journal of Chinese Materia Medica,2018,43(20):4011-4018.(in Chinese)
[18] 何云海,汪秋宽,刘红丹.用复合酶酶解提取海带岩藻聚糖硫酸酯的工艺研究[J].大连水产学院学报,2006,21(1):55-58.
HE Y H,WANG Q K,LIU H D.Extracting technology of fucoidan from kelp Laminaria japonica by enzymatic hydrolysis[J].Journal of Dalian Fisheries College,2006,21(1):55-58.(in Chinese)
[19] 张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987:6-7.
ZHANG W J.Biochemical research technology of compound polysaccharide[M].Shanghai:Shanghai Scientific &Technical Publishers,1987:6-7.(in Chinese)
[20] 张惠芬,李宝才,范家恒,等.盐酸水解-硫酸钡重量法测定硫酸酯化多糖硫酸基含量方法考察[J].食品科学,2002,23(5):107-111.
ZHANG H F,LI B C,FAN J H,et al.Study on gravimetric analysis of hydrochloric acid hydrolysis and barium sulfate precipitation in sulfated polysaccharides[J].Food Science,2002,23(5):107-111.(in Chinese)
[21] 武苏凤.海带岩藻聚糖硫酸酯的体外消化与酵解特征研究[D].大连:大连工业大学,2019.
WU S F.Study on the characterization of fucoidan from Laminaria japonica and its digestibility and fermentability in vitro[D].Dalian:Dalian Polytechnic University,2019.(in Chinese)
[22] 郑桂青.裙带菜多糖的分离纯化、结构表征及其免疫调节作用研究[D].广州:华南理工大学,2018.
ZHENG G Q.Purification,structural characterization and immunomodulatory activity of polysaccharides from Undaria pinnatifida[D].Guangzhou:South China University of Technology,2018.(in Chinese)
[23] 刘佳.铜藻多糖的提取纯化、活性研究及结构鉴定[D].杭州:浙江工业大学,2014.
LIU J.Extraction,purification,activity study and structural analysis of polysaccharides from Sargassum horneri[D].Hangzhou:Zhejiang University of Technology,2014.(in Chinese)
[24] 李伟.铜藻多糖的纯化、结构及免疫活性的研究[D].温州:温州大学,2015.
LI W.The purification,structure and immunological activity of polysaccharides from Sargassum horneri[D].Wenzhou:Wenzhou University,2015.(in Chinese)
[25] 卓丹琪,张雪楠,李雨晴,等.铜藻褐藻聚糖硫酸酯的分离纯化、结构组成及保肝护肝作用[J].大连海洋大学学报,2022,37(2):295-303.
ZHUO D Q,ZHANG X N,LI Y Q,et al.Purification,structural characteristics and hepatoprotective effects of fucoidan from seaweed Sargassum horneri[J].Journal of Dalian Ocean University,2022,37(2):295-303.(in Chinese)
[26] 郑娟霞,陈文宁,月金玲,等.海带多糖降血脂活性研究进展[J].食品与机械,2020,36(6):220-225.
ZHENG J X,CHEN W N,YUE J L,et al.Progress in the research on the lipid-lowering activity of polysacchairdes from kelp[J].Food &Machinery,2020,36(6):220-225.(in Chinese)
[27] 黄桂华.高纯度海带岩藻聚糖的制备及其生物活性研究[D].泉州:华侨大学,2018:5-6.
HUANG G H.Study on the preparation and bioactivity of high purity fucoidan from Laminaria japonica[D].Quanzhou:Huaqiao University,2018:5-6.(in Chinese)
[28] JINHE E,PAR K,MIJUNG Y,et al.Fucoidan improves serum lipid levels and atherosclerosis through hepatic SREBP-2-mediated regulation[J].Journal of Pharmacological Sciences,2016,131(2):84-92.
[29] 倪华,方田,陈向凡.海带多糖对高脂饮食性大鼠主动脉一氧化氮合酶和细胞外基质的调节作用[J].中药药理与临床,2016,32(6):97-101.
NI H,FANG T,CHEN X F.Laminaria japonica polysaccharides rebalances the expressions of eNOS,iNOS,MMP-2 and MMP-9 in aorta of rats with hyperlipidemia induced by high fat diet[J].Pharmacology and Clinics of Chinese Materia Medica,2016,32(6):97-101.(in Chinese)
[30] 唐茹萌,焦文雅,桑亚新,等.裙带菜多糖体外和体内降血脂活性[J].食品科学,2022,43(1):142-149.
TANG R M,JIAO W Y,SANG Y X,et al.In vitro and in vivo hypolipidemic effect of Undaria pinnatifida polysaccharide[J].Food Science,2022,43(1):142-149.(in Chinese)