自1929年人类发明抗生素以来[1],抗生素在人类医疗及畜牧养殖等行业得到了广泛使用[2],2015年全球抗生素使用量较2000年增长了65%[3]。有研究预测,在无政策干预的情况下,2030年全球抗生素消费量可能比2015年高出200%[3]。长期过量使用抗生素促进了细菌耐药性的产生,从而导致抗生素抗性基因(antibiotic resistance gene,ARGs)的出现[4]。水生生态系统中的抗生素通过河流和小溪等途径进入到河口和海湾,进而导致抗生素和ARGs在河口和海湾的污染[4-5]。释放到这些环境中的抗生素通过多种途径不断地传播、扩散和积累,给近海生态、海洋资源利用及人类健康带来了严重威胁[6]。因此,研究ARGs在环境中的分布及其影响机制,对于环境治理及生态风险的预防具有极其重要的意义。
有关抗生素和ARGs在河口、海湾和近海海洋环境中的分布状况已有报道[5,7]。对海湾中ARGs的研究包括澳大利亚的菲利普港湾[8],以及中国的渤海海湾(辽州湾、渤海湾和莱州湾)[9-10]及东海海湾(杭州湾、香山湾和台州湾)[7]等。研究显示,生活污水、工业废水和养殖废水的排放,导致了海湾理化因子、抗生素和重金属等污染物的变化,影响了海湾ARGs的分布[7,9-11]。目前,对ARGs的研究主要集中在海湾中的空间分布特征,对其时间尺度(如4个季节的变化)上的分布特征,仅见Guo等[12]对长江河口环境进行了相关研究,而有关海湾中ARGs 4个季节的变化特征及其影响因素尚缺乏相关研究。
本研究中,对湛江湾的重金属、抗生素和环境理化因子等指标进行了测定,采用实时荧光定量PCR(qPCR)方法,对四环素类、磺胺类和氟喹诺酮类ARGs在湛江湾表层沉积物中的时空分布特征进行了分析,同步检测可移动遗传元件的一类整合子基因(intI1)作为ARGs水平转移的指示剂,并结合重金属、抗生素和环境理化因子等指标,探讨了自然环境和人为污染对海湾ARGs季节分布的潜在影响,以期为ARGs在海湾环境中的风险评估及控制提供科学依据。
1 材料与方法
1.1 研究区域和样品采集
分别于2017年4月(春)、8月(夏)、11月(秋)及2018年1月(冬)在湛江湾海域(109°40′~110°58′E,20°13′~21°57′N)的3个代表性站位采集表层沉积物样品(图1)。湛江湾属于半封闭海湾,海水流动交换较缓慢[13]。其中,Z04站位设置在接近湛江市霞山区附近的排污口,用以表征城市生活污水区域;Z21站位设置在东海岛上的湛江宝钢钢铁厂的排污口,用于表征工业污水区域;Z06站位则是远离污水口的站位,用以表征远离污水污染区域,将其作为对照站位。使用抓取式采样器采集各站位表层沉积物(0~3 cm),立即收集到无菌塑封袋中,4 ℃低温下贮存并快速运输到实验室。用于后续基因丰度检测的样品使用5 mL冻存管贮存于-80 ℃超低温冰箱中,其余样品在-20 ℃下保存用于后续理化性质分析。
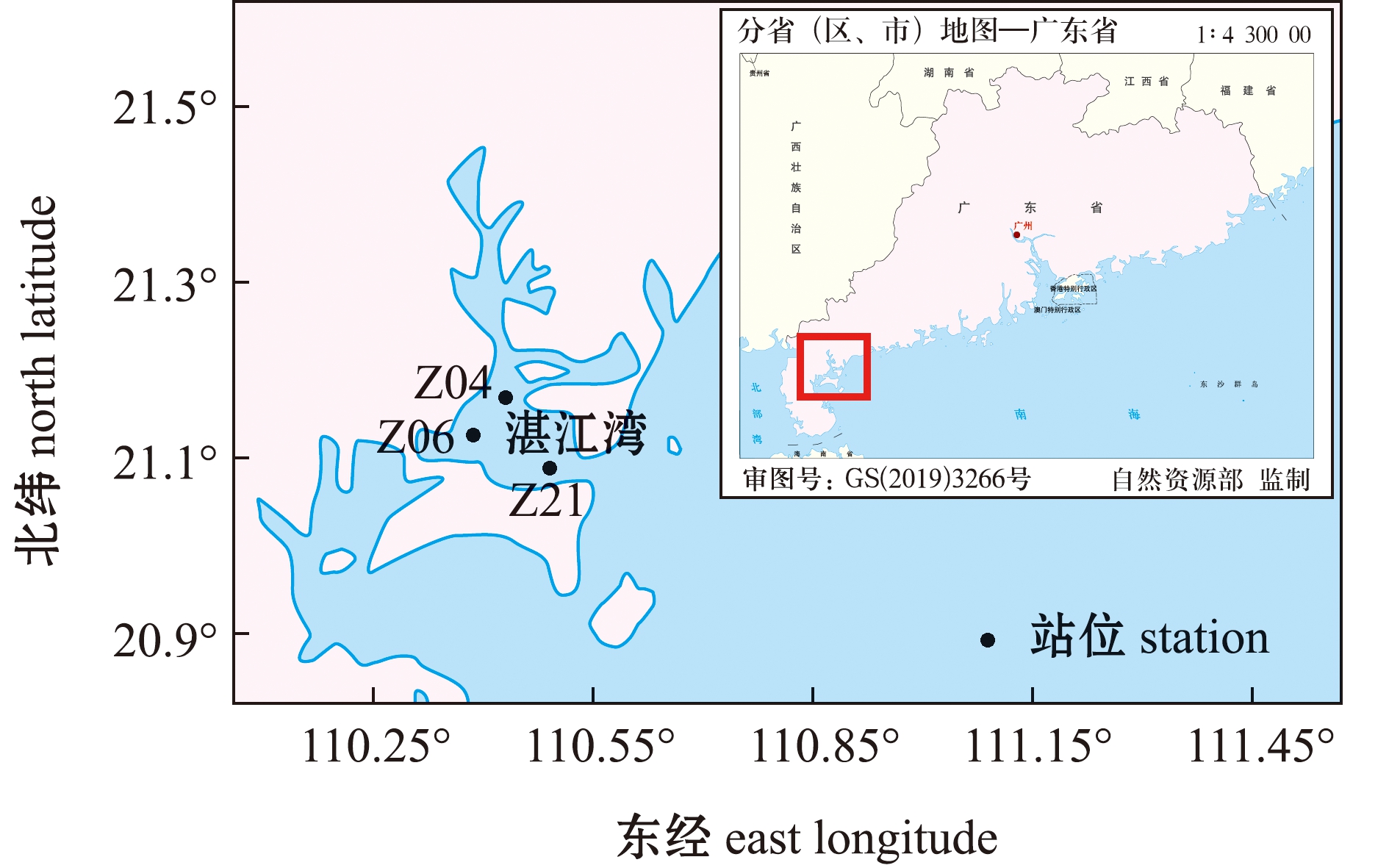
本图基于自然资源部标准地图服务网站GS(2019)3266号标准地图为底图,底图边界无修改。
The figure is based on the standard map GS(2019)3266 in the Standard Map Service website of Ministry of Natural Resources of the People’s Republic of China,with no modifications of the boundaries in the standard map.
图1 湛江湾采样站位图
Fig.1 Sampling sites in the Zhanjiang Bay
1.2 方法
1.2.1 环境理化因子检测 温度和pH的测定在采样时现场测定,使用pH计(雷磁,上海仪电科学)测定pH,使用温度计(雷磁,上海仪电科学)测定沉积物的温度。将适量沉积物装入离心管中,以12 000 r/min离心后收集孔隙水,并使用WYY-Ⅱ盐度计测定盐度。采用碘量滴定法测定沉积物上覆水的溶解氧(DO)含量。参照《土壤农化分析》[14]中的方法,用2 mol/L的KCl恒温振荡浸提沉积物样品,离心收集上清液,再用聚醚砜针式滤头(13 mm,0.45 μm,安普,上海)进行过滤,采用连续流动分析仪(Skalar Analytical B.V SAN++)测定滤液中的营养盐含量![]()
1.2.2 抗生素检测 选取中国近海环境中检出频率较高的四环素类、磺胺类和氟喹诺酮类抗生素进行湛江湾抗生素季节分布特征的分析[15]。其中,四环素类的代表包括土霉素(oxytetracycline,OTC)和四环素(tetracycline,TC),磺胺类的代表包括磺胺嘧啶(sulfadiazine,SD)和磺胺甲基异恶唑(sulfamethoxazole,SMX),氟喹诺酮类的代表包括诺氟沙星(norfloxacin,NFC)、环丙沙星(ciprofloxacin,CFC)和氧氟沙星(ofloxacin,OFC)。所有沉积物样品均送至中国广州分析测试中心进行抗生素检测,具体过程:取适量沉积物样品,加入适量乙腈-磷酸缓冲液(体积比为1∶1),涡旋超声后,离心取上清液过滤,随后采用超高效液相色谱串联质谱方法(LC-MS/MS,Agilent 1290,US),对上述7种抗生素进行检测。
1.2.3 重金属检测 选取近海沉积物中出现频率较高的重金属[16],结合前期研究对湛江湾重金属的检测结果[17],对湛江湾表层沉积物中9类重金属总浓度进行检测,包括铬(Cr)、铜(Cu)、锌(Zn)、镉(Cd)、铅(Pb)、锰(Mn)、镍(Ni)、砷(As)和汞(Hg)。所有沉积物样品均送至广东海洋大学分析测试中心进行检测,具体过程:沉积物样品经冷冻干燥后研磨,过孔径为120 μm的筛,利用安东帕微波消解仪(Multiwave PRO 41 HVT56),在室温下用盐酸与硝酸混合溶液对样品进行微波消解后,过滤、定容,用电感耦合等离子体质谱法(HY/T 147.2—2013/6),在电感耦合等离子体质谱仪(安捷伦,7500Cx)上分别测定提取液中Cr、Cu、Zn、Cd、Pb、Mn、Ni和As 8种重金属的总浓度;采用原子荧光法(GB 17378.5—2007/5.1),在金索坤SK-锐析AFS双道原子荧光光谱仪上检测Hg浓度。
1.2.4 DNA提取与目的基因的qPCR定量检测 称取0.25 g表层沉积物样品,用PowerSoil® DNA Isolation Kit(MoBio Laboratories,Carls bad,CA)对每个样品的总DNA进行提取。使用Nano VueTM Plus微量分析仪(GE Healthcare Life S,UK)测定DNA的浓度,DNA的OD260 nm/OD280 nm值为1.8~2.0时,方可进行下一步试验。选取四环素类抗性基因(tetQ)、磺胺类抗性基因(sul1)、喹诺酮抗性基因(qnrS)、整合子基因(intI1)和总细菌16S rRNA作为目标基因,各基因的引物和退火温度见表1。qPCR反应体系配制和反应程序设置参照Guo等[12]使用的方法。
表1 目的基因的qPCR引物序列
Tab.1 qPCR primer sequences of target genes

基因gene引物序列(5'-3')primer sequence (5'-3')长度/bpsize退火温度/℃annealing temperature参考文献reference16S rRNAF:ACGGTCCAGACTCCTACGGGR:TTA CCGCGGCTGCTGGCAC17956.5West等[18]sul1F:CGCACCGGAAACATCGCTGCACR:TGAAGTTCCGCCGCAAGGCTCG16356Pei等[19]tetQF:AGAATCTGCTGTTTGCCAGTGR:CGGAGTGTCAATGATATTGCA16955Aminov等[20]qnrSF:GTGAGTAATCGTATGTACTTTTGR:AAACACCTCGACTTAAGTCT16960Guillard等[21]intI1F:CAGTGGACATAAGCCTGTTCR:CCCGAGGCATAGACTGTA16056Koeleman等[22]
通过对目标基因进行PCR扩增后构建质粒,并送至生工生物工程(上海)股份有限公司进行测序。对测序正确的质粒按照10倍梯度稀释构建质粒标准曲线,所有目的基因的标准曲线结果均满足R2>0.99,扩增效率在90%~100%,达到试验质量标准。根据标准曲线和质粒浓度计算出基因绝对丰度拷贝数。为了消除生物量的影响,通过16S rRNA基因将ARGs和 intI1的绝对丰度标准化[19],通过计算各个基因与16S rRNA基因拷贝数的比值得到基因相对丰度。
1.3 数据处理
采用IBM SPSS Statistics 25软件进行单因素方差分析,显著性水平设为0.05,探讨ARGs之间及其与环境理化因子、抗生素和重金属之间的相关性。采用Ocean Data View 5.3软件绘制站位图,采用OriginPro 2021软件绘制基因丰度柱状图和相关性热图,采用Canoco 5软件进行RDA分析,采用美吉生物云工具进行VPA分析。
2 结果与分析
2.1 湛江湾表层沉积物中环境因子的时空分布
对湛江湾表层沉积物的6种理化因子检测显示:温度、盐度、pH和溶解氧的季节变化较明显,但站位变化不显著,在春、夏季温度和pH较高,盐度和溶解氧较低;铵盐的站位变化较明显,在Z04站位的平均浓度高于Z06和Z21站位,硝酸盐的平均浓度在春季最高、夏季最低,最高浓度出现在春季Z04站位(表2)。
对沉积物样品中三大类共7种抗生素的时空分布特征分析显示:磺胺甲基异恶唑和氧氟沙星在所有样品中均检出,磺胺嘧啶在所有样品中均未检出,其余抗生素在部分样品中检出;在已检出的样品中,平均浓度最高的抗生素类型为氟喹诺酮类,其次为四环素类,磺胺类平均浓度最低;结合站位和季节变化来看,三类抗生素的最高浓度均出现在冬季Z04站位,且四环素类和氟喹诺酮类的平均浓度季节变化均为冬季最高、夏季最低(表2)。
表2 湛江湾表层沉积物中理化因子与抗生素4个季节的检测值
Tab.2 Detection values of physicochemical factors and antibiotics in surface sediments of Zhanjiang Bay in four seasons
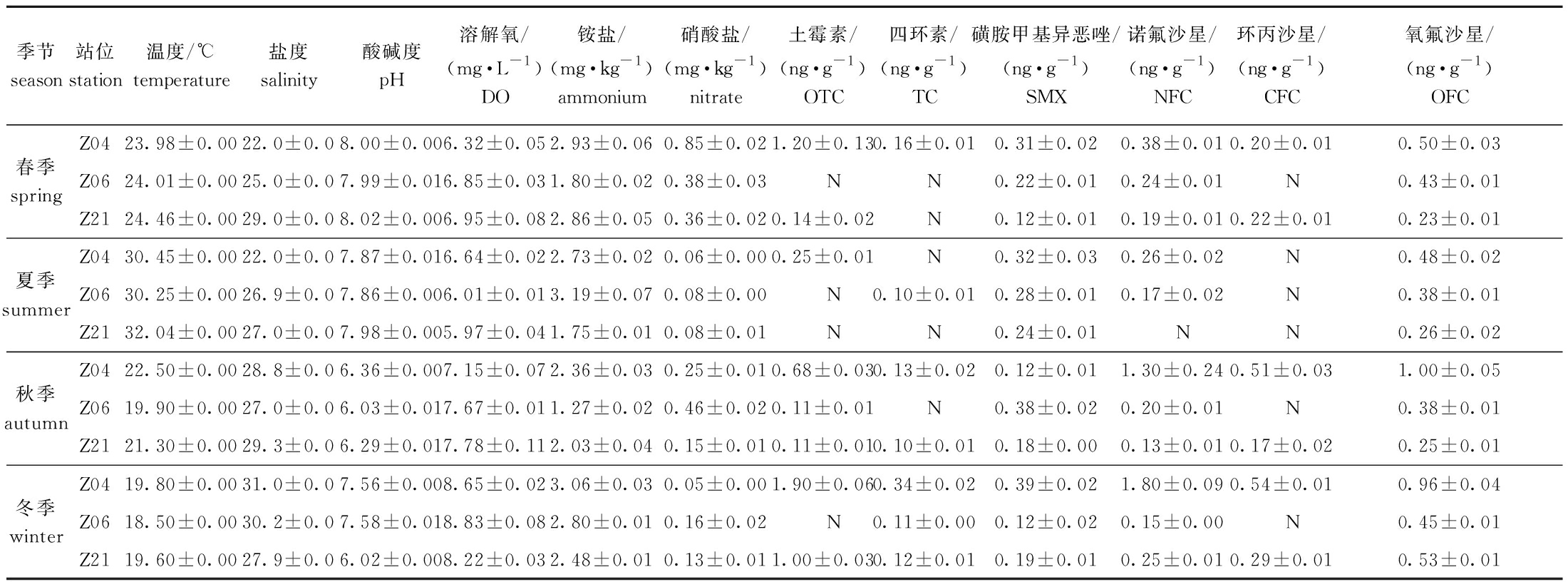
季节season站位station温度/℃temperature盐度salinity酸碱度pH溶解氧/(mg·L-1)DO铵盐/(mg·kg-1)ammonium硝酸盐/(mg·kg-1)nitrate土霉素/(ng·g-1)OTC四环素/(ng·g-1)TC磺胺甲基异恶唑/(ng·g-1)SMX诺氟沙星/(ng·g-1)NFC环丙沙星/(ng·g-1)CFC氧氟沙星/(ng·g-1)OFCZ0423.98±0.0022.0±0.08.00±0.006.32±0.052.93±0.060.85±0.021.20±0.130.16±0.010.31±0.020.38±0.010.20±0.010.50±0.03春季springZ0624.01±0.0025.0±0.07.99±0.016.85±0.031.80±0.020.38±0.03 N N0.22±0.010.24±0.01 N0.43±0.01Z2124.46±0.0029.0±0.08.02±0.006.95±0.082.86±0.050.36±0.020.14±0.02 N0.12±0.010.19±0.010.22±0.010.23±0.01Z0430.45±0.0022.0±0.07.87±0.016.64±0.022.73±0.020.06±0.000.25±0.01 N0.32±0.030.26±0.02 N0.48±0.02夏季summerZ0630.25±0.0026.9±0.07.86±0.006.01±0.013.19±0.070.08±0.00 N0.10±0.010.28±0.010.17±0.02 N0.38±0.01Z2132.04±0.0027.0±0.07.98±0.005.97±0.041.75±0.010.08±0.01 N N0.24±0.01 N N0.26±0.02Z0422.50±0.0028.8±0.06.36±0.007.15±0.072.36±0.030.25±0.010.68±0.030.13±0.020.12±0.011.30±0.240.51±0.031.00±0.05秋季autumnZ0619.90±0.0027.0±0.06.03±0.017.67±0.011.27±0.020.46±0.020.11±0.01 N0.38±0.020.20±0.01 N0.38±0.01Z2121.30±0.0029.3±0.06.29±0.017.78±0.112.03±0.040.15±0.010.11±0.010.10±0.010.18±0.000.13±0.010.17±0.020.25±0.01Z0419.80±0.0031.0±0.07.56±0.008.65±0.023.06±0.030.05±0.001.90±0.060.34±0.020.39±0.021.80±0.090.54±0.010.96±0.04冬季winterZ0618.50±0.0030.2±0.07.58±0.018.83±0.082.80±0.010.16±0.02 N0.11±0.000.12±0.020.15±0.00 N0.45±0.01Z2119.60±0.0027.9±0.06.02±0.008.22±0.032.48±0.010.13±0.011.00±0.030.12±0.010.19±0.010.25±0.010.29±0.010.53±0.01
注:磺胺嘧啶未检出;N为未检出。Note:sulfadizine is undetected;N mean that the item does not detected.
对沉积物样品中的重金属分析显示:在所有样品中均检出9种重金属,其中Mn是4个季节中平均浓度最高的重金属;从季节变化上看,大部分重金属的平均浓度在夏季达到最低值;从站位变化上看,大部分重金属平均浓度在Z04站位最高,在Z21站位最低(表3)。
表3 湛江湾表层沉积物中重金属4个季节的检测值
Tab.3 Detection values of heavy metals in surface sediments of Zhanjiang Bay in four seasons μg/g
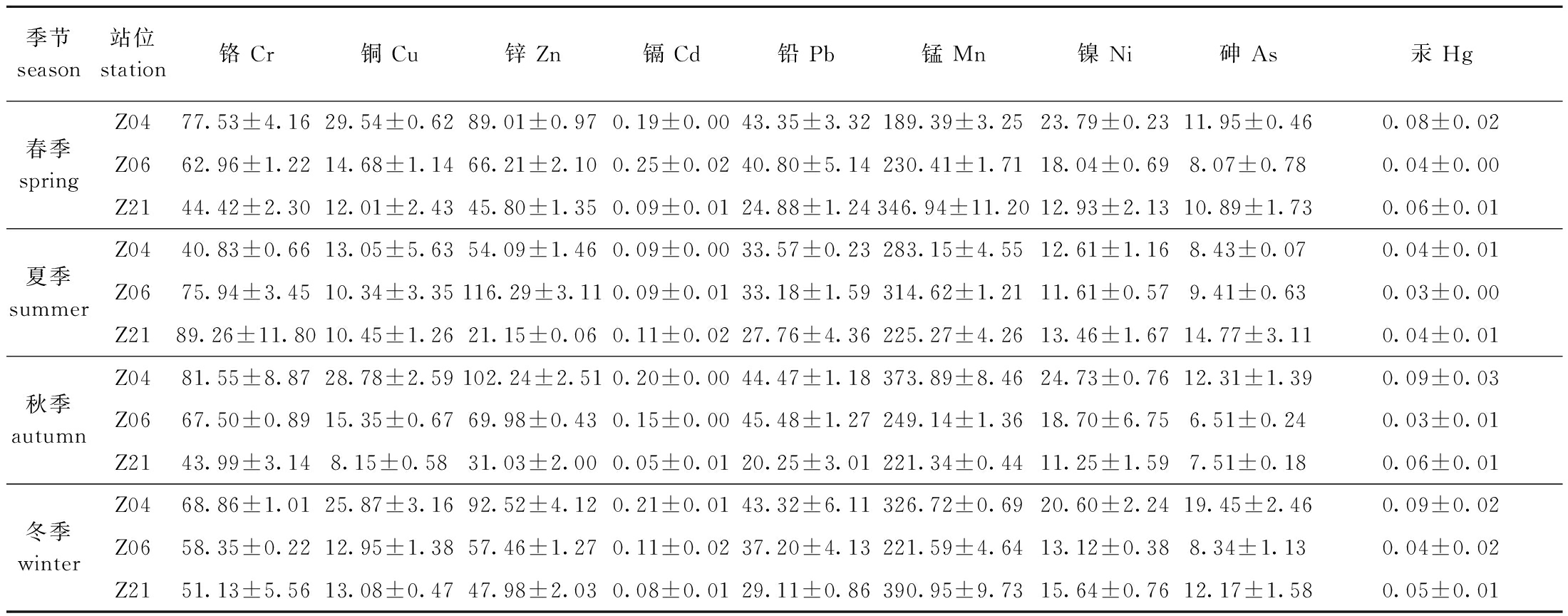
季节season站位station铬 Cr铜 Cu锌 Zn镉 Cd铅 Pb锰 Mn镍 Ni砷 As汞 HgZ0477.53±4.1629.54±0.6289.01±0.970.19±0.0043.35±3.32189.39±3.2523.79±0.2311.95±0.460.08±0.02春季springZ0662.96±1.2214.68±1.1466.21±2.100.25±0.0240.80±5.14230.41±1.7118.04±0.698.07±0.780.04±0.00Z2144.42±2.3012.01±2.4345.80±1.350.09±0.0124.88±1.24346.94±11.2012.93±2.1310.89±1.730.06±0.01Z0440.83±0.6613.05±5.6354.09±1.460.09±0.0033.57±0.23283.15±4.5512.61±1.168.43±0.070.04±0.01夏季summerZ0675.94±3.4510.34±3.35116.29±3.110.09±0.0133.18±1.59314.62±1.2111.61±0.579.41±0.630.03±0.00Z2189.26±11.8010.45±1.2621.15±0.060.11±0.0227.76±4.36225.27±4.2613.46±1.6714.77±3.110.04±0.01Z0481.55±8.8728.78±2.59102.24±2.510.20±0.0044.47±1.18373.89±8.4624.73±0.7612.31±1.390.09±0.03秋季autumnZ0667.50±0.8915.35±0.6769.98±0.430.15±0.0045.48±1.27249.14±1.3618.70±6.756.51±0.240.03±0.01Z2143.99±3.148.15±0.5831.03±2.000.05±0.0120.25±3.01221.34±0.4411.25±1.597.51±0.180.06±0.01Z0468.86±1.0125.87±3.1692.52±4.120.21±0.0143.32±6.11326.72±0.6920.60±2.2419.45±2.460.09±0.02冬季winterZ0658.35±0.2212.95±1.3857.46±1.270.11±0.0237.20±4.13221.59±4.6413.12±0.388.34±1.130.04±0.02Z2151.13±5.5613.08±0.4747.98±2.030.08±0.0129.11±0.86390.95±9.7315.64±0.7612.17±1.580.05±0.01
2.2 16S rRNA、ARGs和intI1绝对丰度的时空分布特征
从图2可见:16S rRNA基因、3种ARGs(sul1、tetQ和qnrS)和intI1在所有样品中的检出频率均为100%;16S rRNA基因、sul1、tetQ、qnrS和intI1在4个季节所有样品中的平均绝对丰度依次为5.27×106 、7.23×104 、2.68×104 、7.93×102 、1.62×105 copies/g。所有基因的平均绝对丰度值均呈现出时间和空间尺度上的差异:从时间尺度来看,16S rRNA基因、3种ARGs和intI1的平均绝对丰度值均呈现出冬季最高,春、秋季次之,夏季最低的现象;从空间尺度来看,16S rRNA基因在各站位的平均绝对丰度变化规律为Z04>Z21>Z06,而3种ARGs和intI1的平均绝对丰度值均呈现出Z21>Z04>Z06的现象(图2)。
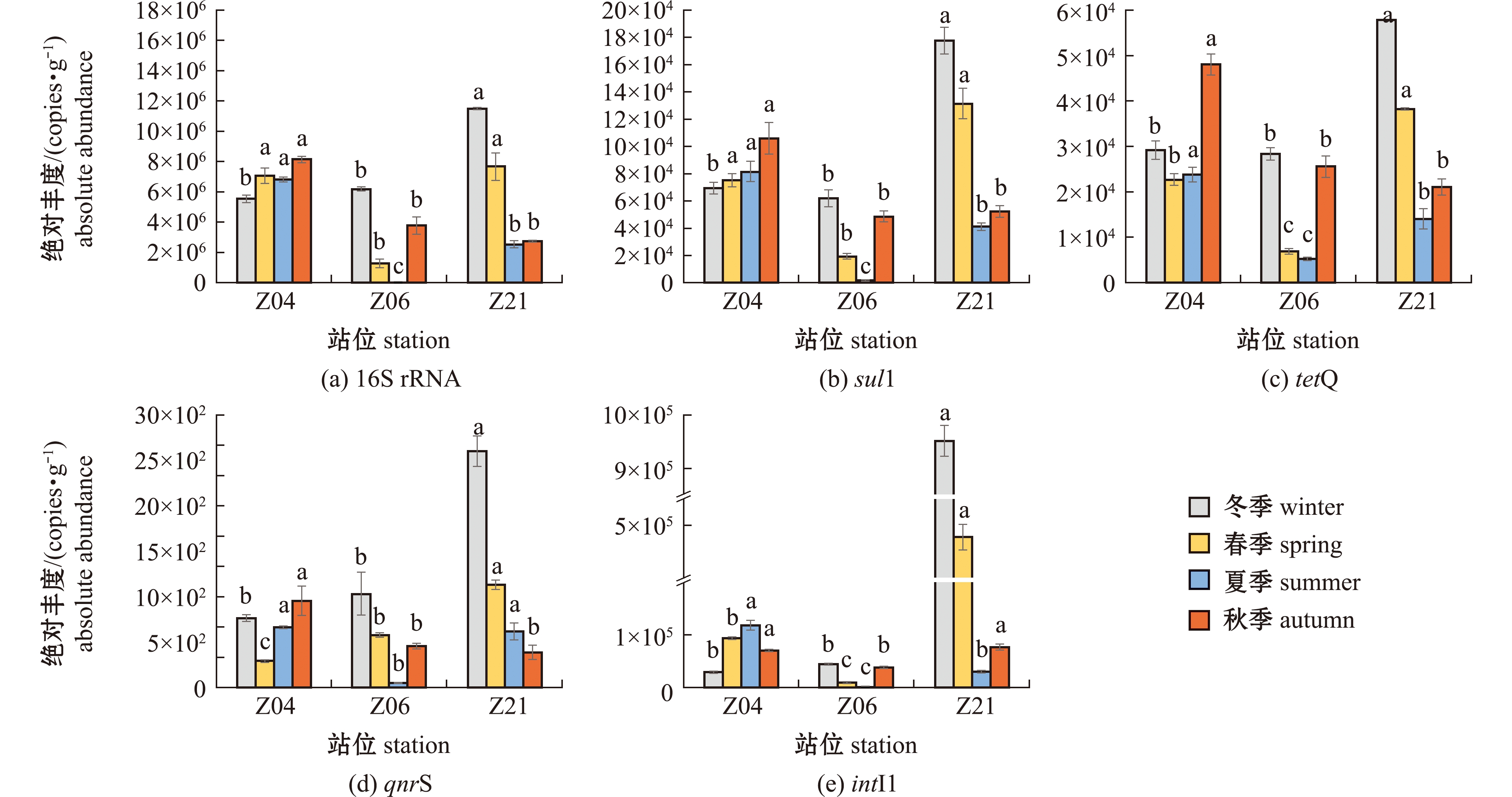
标有不同字母者表示同一季节不同站位间存在显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters in the same season are significantly different between different stations at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图2 湛江湾表层沉积物中目的基因绝对丰度的季节分布
Fig.2 Seasonal distribution of absolute abundance of target genes in surface sediments of Zhanjiang Bay
2.3 ARGs和intI1相对丰度的时空分布特征
3种抗性基因和intI1在沉积物样品中的相对丰度分布如图3所示,3种抗性基因sul1、tetQ和qnrS的相对丰度均在夏季Z06样品异常高,分别达4.55×10-2、2.28×10-1、2.08×10-3,而在其余样品中分布较均匀,其余样品4个季节的平均相对丰度依次为1.41×10-2、5.26×10-3和1.72×10-4。
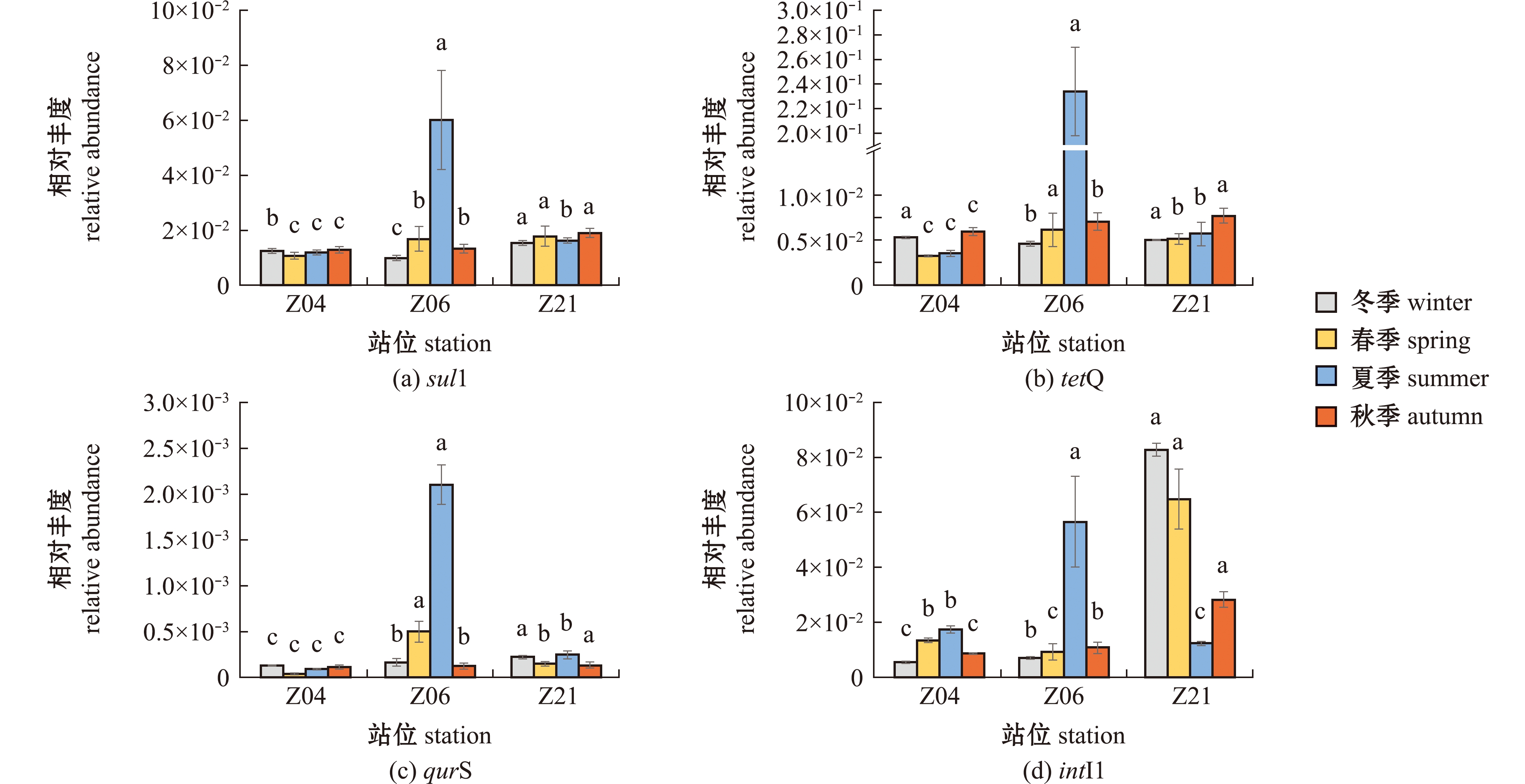
图3 湛江湾表层沉积物中目的基因相对丰度的季节分布
Fig.3 Seasonal distribution of relative abundance of target genes in surface sediments of Zhanjiang Bay
从季节尺度看,3种ARGs的平均相对丰度均呈现出夏季最高的现象;从空间尺度看,3种ARGs在各站位平均相对丰度均为Z06>Z21>Z04。intI1 4个季节的平均相对丰度为2.59×10-2,其分布规律与3种ARGs明显不同,季节平均相对丰度冬季高于夏季,与平均绝对丰度季节变化相似;各站位平均相对丰度均为Z21>Z06>Z04(图3)。
2.4 各基因丰度间的相关性分析
基因绝对丰度间的Sperarman相关性分析显示:3种ARGs(sul1、qnrS和tetQ)彼此之间均呈显著正相关(r>0.700,P<0.01);sul1、tetQ与intI1之间均呈显著正相关(r>0.600,P<0.05),而qnrS与intI1无相关关系(P>0.05),且3种ARGs、intI1均与16S rRNA基因间呈显著正相关(r>0.600,P<0.05)(图4(a))。基因相对丰度间的Speratman相关性分析显示:除了sul1相对丰度分别与qnrS、tetQ和intI1相对丰度间呈显著正相关(r>0.600,P<0.05)之外,其余基因的相对丰度之间均无相关关系(P>0.05)(图4(b))。

图4 各基因丰度间及其与环境因子间的Spearman相关性分析
Fig.4 Spearman correlation analysis between ARGs,and between ARGs and environmental factors
2.5 各基因丰度与环境因子间的相关性分析
5个基因的丰度与环境因子的Spearman相关性分析显示,理化因子仅DO与tetQ绝对丰度呈正相关(r=0.636,P<0.05)(图4(c))。5个基因丰度与抗生素的Spearman相关性分析显示:四环素类和氟喹诺酮类抗生素与基因丰度间相关性较显著;环丙沙星与sul1、tetQ和16S rRNA基因,以及土霉素与sul1、16S rRNA基因绝对丰度间均呈显著正相关(r>0.600,P<0.05)(图4(c));氧氟沙星与sul1相对丰度间呈显著负相关(r<-0.500,P<0.05),土霉素、诺氟沙星与qnrS相对丰度间均呈显著负相关(r<-0.500,P<0.05)(图4(d))。5个基因丰度与重金属的Spearman相关性分析显示:Mn与qnrS、tetQ的绝对丰度间均呈显著正相关(r>0.600,P<0.05)(图4(c));Cu、Pb与部分ARGs(sul1或qnrS)相对丰度间呈显著负相关(r<-0.500,P<0.05),Cd、Pb与intI1相对丰度间均呈显著负相关(r<-0.600,P<0.05)(图4(d))。
将16S rRNA基因、ARGs(sul1、qnrS和tetQ)和intI1基因的丰度与各项理化因子、抗生素及重金属进行冗余分析(RDA分析)(图5)。基因绝对丰度的RDA分析显示:仅重金属Cd与目的基因绝对丰度的分布和变化密切相关(Pseudo-F=5.8,P<0.05)(图5(c)),重金属对基因绝对丰度分布的总解释度为93.01%,并且该值也为前两个坐标轴(RDA1和RDA2)的累计解释度;其他环境因子对基因绝对丰度影响较弱(图5(a)、(b)),理化因子和抗生素对基因绝对丰度分布的总解释度分别为48.21%和77.44%,两者均未与各基因绝对丰度显著相关。基因相对丰度的RDA分析显示:重金属Cu可能是影响目的基因相对丰度分布和变化的主要环境因子(Pseudo-F=18.3,P<0.01)(图5(f)),且Pb、Cr和Mn也是潜在影响目的基因相对丰度分布的重要环境因子(4.7
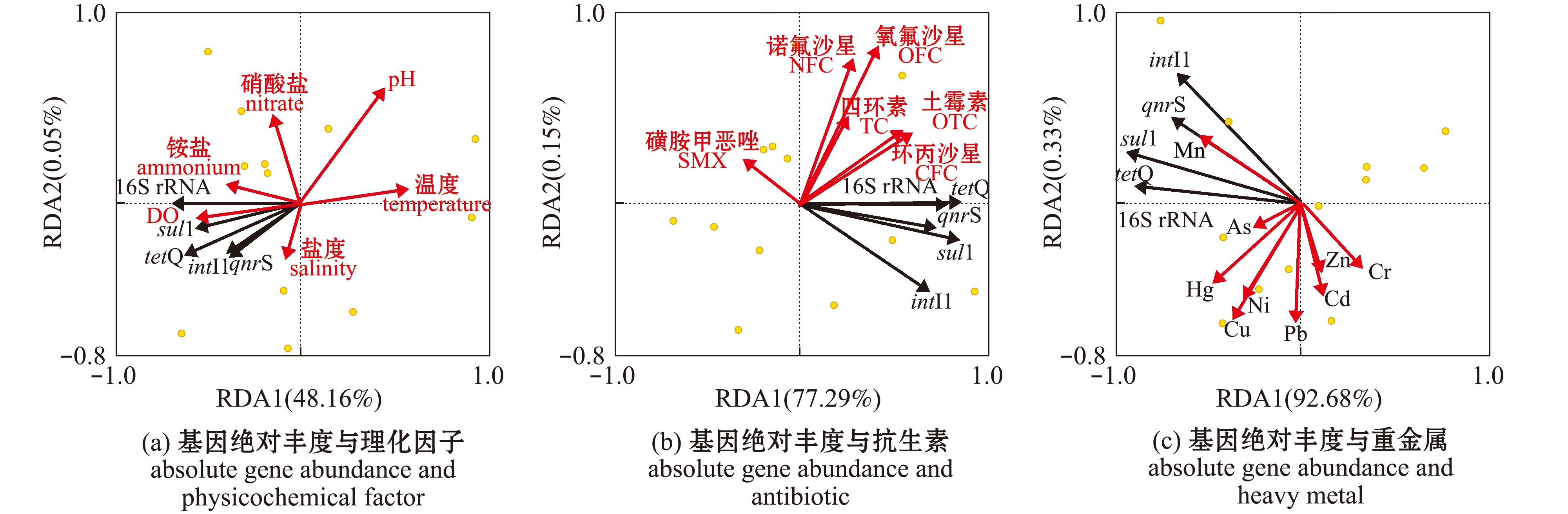
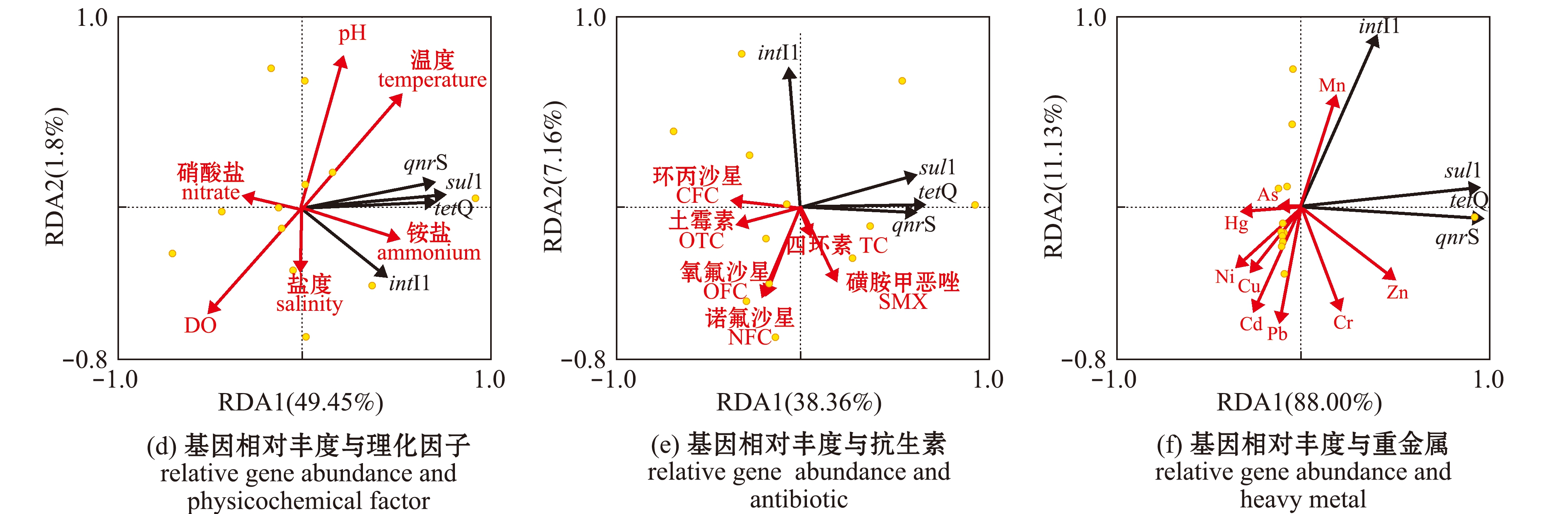
图5 基因绝对丰度和相对丰度分别与三类环境因子的RDA分析
Fig.5 Redundancy discriminant analysis (RDA)of gene absolute abundance and relative abundance with three kinds of environmental factors
进一步对各类环境因子与ARGs相对丰度进行方差分解分析,发现重金属对海湾ARGs相对丰度变化的贡献大于理化因子和抗生素,高达87.15%,三类环境因子的共同贡献小于20%(图6)。

图6 三类环境因子对ARGs相对丰度分布解释度的方差分解分析(VPA)
Fig.6 Variation portioning analysis (VPA)of three kinds of environmental factors on the ARGs distribution (based on relative abundance)
3 讨论
3.1 ARGs的季节分布
16S rRNA基因的绝对丰度值能反映出对应沉积物样品中的细菌总量,而intI1作为一种能携带抗生素抗性基因的整合子,其丰度的分布情况反映了ARGs水平转移的情况。从绝对丰度来看,湛江湾表层沉积物中各类ARGs和intI1的平均绝对丰度在各季节的分布,整体上呈现出冬季最高、夏季最低的季节分布规律,该结果与中国大陆沿岸水域ARGs和intI1的平均绝对丰度值呈现出冬季高于夏季[23]的结果相似,但该结果与长江河口区表层沉积物中各类ARGs夏季高、冬季低的研究结果相反[12]。从相对丰度来看,3种ARGs的平均相对丰度在夏季异常增大的原因与16S rRNA基因的丰度有关,因为细菌平均绝对丰度在夏季样品中最低。Spearman相关性分析显示,各类ARGs的绝对丰度均与16S rRNA基因绝对丰度间显著相关,进一步验证了这一观点,同时前人对长江河口的相关研究结果也支持这一观点[24],说明细菌丰度对ARGs相对丰度与绝对丰度分布有重要影响。
本研究中,从3种类型的ARGs在湛江湾表层沉积物中的绝对丰度和相对丰度值可知,磺胺类抗性基因sul1是湛江湾表层沉积物中最丰富的ARGs,其次是四环素类抗性基因tetQ,而氟喹诺酮类抗性基因qnrS丰度最低。此外,前人在多个河口和近海表层沉积物环境中的研究结果均表明,sul1基因是ARGs中最丰富的一类[7,10,12,25],sul1基因在多个近海环境中分布最广和最丰富的现象与其在环境中较高的持久性密切相关[26]。
将湛江湾沉积物中各季节不同类型ARGs的绝对丰度值与相对丰度值同其他近海环境进行比较。与春季东海3个海湾(杭州湾、象山湾和台州湾)相比,春季湛江湾沉积物中磺胺类抗性基因sul1的绝对丰度值(104~105 copies/g)比东海台州湾(106~107 copies/g)约低2个数量级[7];四环素类抗性基因tetQ的绝对丰度值(103~104 copies/g)远低于东海3个海湾(104~107 copies/g)[7]。与夏冬季渤海湾相比,夏冬季湛江湾沉积物中磺胺类抗性基因sul1的绝对丰度值(103~105 copies/g)低于渤海湾沉积物(104~107 copies/g)[25];四环素类抗性基因tetQ的绝对丰度值(103~104 copies/g)低于渤海湾沉积物(105~107 copies/g)[25];氟喹诺酮类抗性基因(qnrS)的最高绝对丰度值(约103 copies/g)比渤海湾沉积物(约108 copies/g)低5个数量级,最高相对丰度(10-3)比其对应值(约10-2)约低1个数量级[25]。此外,湛江湾除夏季Z06站位样品外,其余站位样品中sul1 4个季节的平均相对丰度值(1.41×10-2)与全球河口和近海环境中的数值(1.46×10-2)接近[27]。上述结果表明,湛江湾沉积物中存在一定程度的ARGs污染,但污染程度整体低于其他海湾。
3.2 ARGs的空间分布
本研究中,从绝对丰度来看,湛江湾表层沉积物中ARGs和intI1的平均绝对丰度在靠近宝钢钢铁厂的Z21站位污染情况最严重,其次是受城市生活污水排放影响的Z04站位,而Z06站位的污染程度最低。从相对丰度来看,ARGs的平均相对丰度均在Z06站位最高,可能是受细菌丰度影响的原因。在其他海湾和河口环境的研究中,也出现类似现象。Chen等[7]发现,在靠近医药基地的站位中检测到ARGs出现的频率和丰度均相对更高;Guo等[12]和Lu等[23]发现,大多数ARGs和intI1在污水处理厂尾水排放区域的丰度相对较高;Lu等[28]和Zhu等[5]发现,海岸带和河流样品或不同河口样品中,ARGs和可移动遗传元件的丰度差异显著。Zhang等[25]指出,ARGs的不同空间分布是受到海洋污染和陆基污染的相互作用,以及密集的人为活动影响。这些结果表明,环境中不同区域的ARGs分布普遍存在差异。
3.3 ARGs与整合子基因intI1的关系
整合子是可移动遗传元件(mobile genetic elements,MGEs)的一种,当两种微生物接触时,MGEs可驱动DNA从供体微生物转移到受体微生物,从而使受体微生物的基因组发生变化[29],这种基因转移机制有利于抗性基因的传播。而整合子(如intI1)已被报道广泛存在于多个河口和近海环境中[27]。本研究中,intI1在湛江湾沉积物中的平均绝对丰度值仅次于16S rRNA基因,其绝对丰度比整体渤海湾和黄海沉积物中的最高绝对丰度低2~3个数量级[25,28],而其最高相对丰度(10-2)比莱州湾中的intI1(约10-3)高1个数量级[9]。湛江湾沉积物中intI1的绝对丰度和相对丰度均与磺胺类抗性基因sul1显著相关(P<0.05),这与前人在河口和海岸环境中的诸多报道一致[5,7,9-10,12],据分析是由于sul1能经常叠加于intI1基因序列上所致[30]。除了磺胺类抗性基因外,湛江湾表层沉积物中的intI1与四环素类抗性基因tetQ的绝对丰度显著相关(P<0.05),与前人在河口和海岸环境中二者显著相关的研究结果一致[7,12,23],说明intI1可能驱动了四环素类抗性基因在近海环境中的传播。本研究中,湛江湾表层沉积物中的intI1与氟喹诺酮类抗性基因qnrS并无相关关系,该结果与Lu等[28]对渤海、黄海海域的相关研究结果一致,但与Guo等[12]对长江河口中二者显著相关的研究结果不符,说明intI1与氟喹诺酮类抗性基因的关系还需进一步研究。综合以上研究,intI1可能驱动了近海环境中磺胺类抗性基因和四环素类抗性基因的传播,而对氟喹诺酮类抗性基因的潜在影响有待进一步研究。
3.4 ARGs与环境因子的关系
研究发现,污水处理厂和城市河流排放的重金属、化学需氧量(DOC)和总氮(TN)等污染物与长江口表层沉积物中的ARGs相关且呈现出相似的季节变化规律,表明沿岸产业的污水排放可能会对ARGs的局部分布规律产生影响[12]。对于ARGs的空间分布而言,Zhu等[5]分析了中国近岸多个河口水域表层沉积物中ARGs的分布特征,指出环境理化因子和细菌群落并不是驱动ARGs在近岸河口水域分布的因素,而人类活动如城市生活污水的排放、抗生素的污染等是影响海湾ARGs空间分布的重要因素。
3.4.1 抗生素 本研究中,湛江湾沉积物中三类抗生素的平均浓度依次为氟喹诺酮类>四环素类>磺胺类,并且三类抗生素最高浓度均出现在Z04站位冬季样品中,该结果与前人对水域环境中抗生素浓度冬季高于夏季的结果相似,主要是由于冬季人类患病增多和夏季雨水稀释等原因所致[15]。虽然湛江湾沉积物中磺胺类抗生素的平均浓度在三类抗生素中最低,但是磺胺类抗性基因sul1在3种ARGs中占主导地位,磺胺类抗生素与sul1之间并无显著的相关性,该现象与前人对河口和近海环境中ARGs的报道相似,即磺胺类抗性基因可能是由河口附近的污染源排放,而不是经抗生素压力而原位形成[12,31]。对湛江湾沉积物中氟喹诺酮类抗生素与其抗性基因的相关性研究发现,氟喹诺酮类抗生素在检测的三类抗生素中平均浓度最高,但其对应的抗性基因qnrS丰度却在3种ARGs中最低,氟喹诺酮类抗生素诺氟沙星与抗性基因qnrS的相对丰度呈显著负相关,前人对长江河口区的研究中也曾发现,氟喹诺酮类是最主要的抗生素,但氟喹诺酮类抗性基因并不是占主导的ARGs[12]。此外,ARGs与抗生素的相关性分析还显示,四环素类抗生素(土霉素)除与其对应的抗性基因tetQ的绝对丰度呈显著正相关外,其与非对应的磺胺类抗性基因sul1的绝对丰度和氟喹诺酮类抗性基因qnrS的相对丰度也存在相关关系。氟喹诺酮类抗生素除与相对应的抗性基因qnrS的相对丰度呈负相关外,其与非对应的磺胺类抗性基因sul1的绝对丰度和相对丰度及四环素类抗性基因tetQ的相对丰度存在相关性。这种ARGs与非对应抗生素之间存在相关性的现象在其他沿海环境中也曾出现[5,9-10,23,27]。然而RDA分析结果却显示,抗生素与抗性基因绝对丰度和相对丰度的时空分布均无显著相关性,说明抗生素对抗性基因整体分布的影响较小,而对特定基因的影响程度可能更显著。以上结果表明,湛江湾表层沉积物中各类ARGs的分布除了受到污染源的直接排放影响外,还可能受到对应抗生素或非对应抗生素选择性压力的影响。
3.4.2 重金属 除了抗生素,重金属作为重要的非对应污染物对ARGs的分布具有长期选择性压力[32]。苗荪等[33]对全球水体和沉积环境中的重金属与ARGs的相关性研究发现,环境中的多种重金属(如Cu、Cd、Hg等)与ARGs显著相关。本研究中,比较湛江湾与近海环境中的Cu与磺胺类抗性基因sul1相对丰度的相关关系发现,湛江湾表层沉积物中二者间呈显著负相关,这与长江口水域中磺胺类抗性基因sul2相对丰度与Cu呈负相关的结果相似[24],但与莱州湾和湘江中段水域的Cu与磺胺类抗性基因(sul1或sul2)相对丰度呈正相关的结果不同[9,34]。本研究中,湛江湾沉积物中的Pb与磺胺类抗性基因sul1和整合子intI1相对丰度呈显著负相关,该结果与长江口水域中Pb与抗性基因sul2相对丰度呈显著负相关的结果相似[24],但与莱州湾中Pb与抗性基因sul2、整合子intI1相对丰度呈正相关的结果相反[9]。本研究中,RDA分析结果显示,Cd与ARGs绝对丰度的分布变化密切相关,并显示Cu可能是影响湛江湾ARGs相对丰度分布变化的主要环境因子,以及Pb、Cr和Mn对ARGs相对丰度也有潜在影响,重金属与ARGs的相关性较显著。同时,ARGs相对丰度与理化因子、抗生素和重金属的VPA分析结果,进一步验证了重金属对ARGs时空分布的贡献要大于其他环境因子,这与东海海湾沉积物中ARGs的分布结果一致[7]。上述结果表明,三类环境因子中重金属可能对ARGs时空分布产生了重要影响。
3.4.3 环境理化因子 除了抗生素和重金属,一些环境参数也可能对ARGs的分布产生影响,如温度、盐度、pH和各种营养盐等。Zheng等[27]认为,不同ARGs在全球范围内的丰度分布产生显著的纬度差异,其可能归因于不同ARGs的最适温度差异。对澳大利亚菲利浦港湾沿岸滩涂中ARGs的研究显示,盐度是控制其分布的主导因素[8]。Zhang等[10]发现,渤海湾水体样品中的磺胺类抗性基因sul2的相对丰度与pH呈显著负相关,并由此指出,中性条件下的海水能使ARGs更持久。此外,各种形式的C、N和P等营养物质也被报道与ARGs的分布相关[12,24-25,27]。本研究中,湛江湾沉积物中除了DO与四环素类抗性基因tetQ的绝对丰度显著正相关外,其余ARGs和intI1均与理化因子间无显著相关性。在对莱州湾和辽东湾水域的研究中,也有ARGs与所测定的理化因子(如温度、盐度、pH、COD、总氮、铵盐和硝酸盐等)之间无相关性或相关性较少的报道[9,31]。本研究中,RDA分析结果显示,理化因子与抗性基因绝对丰度和相对丰度均无显著相关性。上述结果表明,在不同的海洋环境中,理化因子对ARGs分布的影响程度存在差异。
4 结论
1)湛江湾表层沉积物中ARGs、16S rRNA和intI1基因的丰度分布存在明显的空间和季节性分布特征,说明海湾中ARGs的分布具有不均匀性,同时会受到气候变化的影响。
2)Spearman相关性分析、RDA分析和VPA分析结果共同揭示了细菌总量(16S rRNA基因丰度)、intI1、理化因子、抗生素和重金属是影响ARGs丰度的潜在因素,其中重金属是起最主要作用的环境因子,而污染物浓度在人类生活区域更高,说明人类活动会对海湾中ARGs的分布造成显著影响。
[1] FLEMING A.On the antibacterial action of cultures of a penicillium,with special reference to their use in the isolation of B.influenzae[J].Reviews of Infectious Diseases,1980,2(1):129-139.
[2] VERSPORTEN A,BOLOKHOVETS G,GHAZARYAN L,et al.Antibiotic use in eastern Europe:a cross-national database study in coordination with the WHO Regional Office for Europe[J].The Lancet Infectious Diseases,2014,14(5):381-387.
[3] KLEIN E Y,VAN BOECKEL T P,MARTINEZ E M,et al.Global increase and geographic convergence in antibiotic consumption between 2000 and 2015[J].Proceedings of the National Academy of Sciences of the United States of America,2018,115(15):E3463-E3470.
[4] MARTINEZ J L.Antibiotics and antibiotic resistance genes in natural environments[J].Science,2008,321:365-367.
[5] ZHU Y G,ZHAO Y,LI B,et al.Continental-scale pollution of estuaries with antibiotic resistance genes[J].Nature Microbiology,2017,2:16270.
[6] 蔡天贵,张龙,张晋东.抗生素抗性基因的生态风险研究进展[J].应用生态学报,2022,33(5):1435-1440.
CAI T G,ZHANG L,ZHANG J D.Research advances in ecological risk of antibiotic resistance genes[J].Chinese Journal of Applied Ecology,2022,33(5):1435-1440.(in Chinese)
[7] CHEN J Y,SU Z G,DAI T J,et al.Occurrence and distribution of antibiotic resistance genes in the sediments of the East China Sea Bays[J].Journal of Environmental Sciences,2019,81:156-167.
[8] ZHANG Y J,HU H W,YAN H,et al.Salinity as a predominant factor modulating the distribution patterns of antibiotic resistance genes in ocean and river beach soils[J].Science of the Total Environment,2019,668:193-203.
[9] LI Q W,NA G S,ZHANG L X,et al.Effects of corresponding and non-corresponding contaminants on the fate of sulfonamide and quinolone resistance genes in the Laizhou Bay,China[J].Marine Pollution Bulletin,2018,128:475-482.
[10] ZHANG Y P,NIU Z G,ZHANG Y,et al.Occurrence of intracellular and extracellular antibiotic resistance genes in coastal areas of Bohai Bay (China) and the factors affecting them[J].Environmental Pollution,2018,236:126-136.
[11] 刘萱,赵慧敏,王华,等.大连典型滩涂养殖区沉积物中抗生素协同重金属和环境因素对抗性基因分布的影响[J].大连海洋大学学报,2020,35(2):229-238.
LIU X,ZHAO H M,WANG H,et al.Impacts of heavy metals and environmental factors assisted antibiotics on antibiotic resistance genes in sediments in Dalian typical intertidal mudflat culture areas[J].Journal of Dalian Ocean University,2020,35(2):229-238.(in Chinese)
[12] GUO X P,LIU X R,NIU Z S,et al.Seasonal and spatial distribution of antibiotic resistance genes in the sediments along the Yangtze Estuary,China[J].Environmental Pollution,2018,242:576-584.
[13] 石泳昊,贾良文,张恒.湛江湾水体滞留时间及影响因子分析[J].环境科学与技术,2020,43(11):17-24.
SHI Y H,JIA L W,ZHANG H.Analysis of the water residence time and influencing factors in Zhanjiang Bay[J].Environmental Science & Technology,2020,43(11):17-24.(in Chinese)
[14] 鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2000.
BAO S D.Soil and agricultural chemistry analysis[M].3rd edition.Beijing:China Agriculture Press,2000.(in Chinese)
[15] 章强,辛琦,朱静敏,等.中国主要水域抗生素污染现状及其生态环境效应研究进展[J].环境化学,2014,33(7):1075-1083.
ZHANG Q,XIN Q,ZHU J M,et al.The antibiotic contaminations in the main water bodies in China and the associated environmental and human health impacts[J].Environmental Chemistry,2014,33(7):1075-1083.(in Chinese)
[16] 张勇,张现荣,毕世普,等.我国近海海域沉积物重金属分布特征与环境质量评价[J].海洋地质前沿,2012,28(11):38-42,64.
ZHANG Y,ZHANG X R,BI S P,et al.Heavy metal distribution patterns in Chinese coastal sediments and environment quality assessment[J].Marine Geology Frontiers,2012,28(11):38-42,64.(in Chinese)
[17] ZHANG J,ZHOU F,CHEN C,et al.Spatial distribution and correlation characteristics of heavy metals in the seawater,suspended particulate matter and sediments in Zhanjiang Bay,China[J].PLoS One,2018,13(8):e0201414.
[18] WEST N J,LEP RE C,MANES C L,et al.Distinct spatial patterns of SAR11,SAR86,and actinobacteria diversity along a transect in the ultra-oligotrophic south Pacific Ocean[J].Frontiers in Microbiology,2016,7:234.
RE C,MANES C L,et al.Distinct spatial patterns of SAR11,SAR86,and actinobacteria diversity along a transect in the ultra-oligotrophic south Pacific Ocean[J].Frontiers in Microbiology,2016,7:234.
[19] PEI R T,KIM S C,CARLSON K H,et al.Effect of river landscape on the sediment concentrations of antibiotics and corresponding antibiotic resistance genes (ARG)[J].Water Research,2006,40(12):2427-2435.
[20] AMINOV R I,GARRIGUES-JEANJEAN N,MACKIE R I.Molecular ecology of tetracycline resistance:development and validation of primers for detection of tetracycline resistance genes encoding ribosomal protection proteins[J].Applied and Environmental Microbiology,2001,67(1):22-32.
[21] GUILLARD T,MORET H,BRASME L,et al.Rapid detection of qnr and qepA plasmid-mediated quinolone resistance genes using real-time PCR[J].Diagnostic Microbiology and Infectious Disease,2011,70(2):253-259.
[22] KOELEMAN J G,STOOF J,VAN DER BIJL M W,et al.Identification of epidemic strains of Acinetobacter baumannii by integrase gene PCR[J].Journal of Clinical Microbiology,2001,39(1):8-13.
[23] LU J,ZHANG Y X,WU J.Continental-scale spatio-temporal distribution of antibiotic resistance genes in coastal waters along coastline of China[J].Chemosphere,2020,247:125908.
[24] CHEN Y R,GUO X P,NIU Z S,et al.Antibiotic resistance genes (ARGs) and their associated environmental factors in the Yangtze Estuary,China:from inlet to outlet[J].Marine Pollution Bulletin,2020,158:111360.
[25] ZHANG Y X,LU J,WU J,et al.Occurrence and distribution of antibiotic resistance genes in sediments in a semi-enclosed continental shelf sea[J].Science of the Total Environment,2020,720:137712.
[26] BEAN D C,LIVERMORE D M,PAPA I,et al.Resistance among Escherichia coli to sulphonamides and other antimicrobials now little used in man[J].The Journal of Antimicrobial Chemotherapy,2005,56(5):962-964.
[27] ZHENG D S,YIN G Y,LIU M,et al.A systematic review of antibiotics and antibiotic resistance genes in estuarine and coastal environments[J].Science of the Total Environment,2021,777:146009.
[28] LU J,ZHANG Y X,WU J,et al.Occurrence and spatial distribution of antibiotic resistance genes in the Bohai Sea and Yellow Sea areas,China[J].Environmental Pollution,2019,252:450-460.
[29] BRIGULLA M,WACKERNAGEL W.Molecular aspects of gene transfer and foreign DNA acquisition in prokaryotes with regard to safety issues[J].Applied Microbiology and Biotechnology,2010,86(4):1027-1041.
[30] NIGRO S J,FARRUGIA D N,PAULSEN I T,et al.A novel family of genomic resistance Islands,AbGRI2,contributing to aminoglycoside resistance in Acinetobacter baumannii isolates belonging to global clone 2[J].Journal of Antimicrobial Chemotherapy,2012,68(3):554-557.
[31] LU Z H,NA G S,GAO H,et al.Fate of sulfonamide resistance genes in estuary environment and effect of anthropogenic activities[J].Science of the Total Environment,2015,527/528:429-438.
[32] 邱文婕,秦艳,高品.环境中重金属暴露对抗生素抗性基因演变影响研究进展[J].环境工程技术学报,2021,11(6):1226-1231.
QIU W J,QIN Y,GAO P.Research progress on the effect of heavy metal exposure on the evolution of antibiotic resistance genes in the environment[J].Journal of Environmental Engineering Technology,2021,11(6):1226-1231.(in Chinese)
[33] 苗荪,陈磊,左剑恶.环境中抗生素抗性基因丰度与抗生素和重金属含量的相关性分析:基于Web of Science数据库检索[J].环境科学,2021,42(10):4925-4932.
MIAO S,CHEN L,ZUO J E.Correlation analysis among environmental antibiotic resistance genes abundance,antibiotics concentrations,and heavy metals concentrations based on Web of Science searches[J].Environmental Science,2021,42(10):4925-4932.(in Chinese)
[34] XU Y,XU J,MAO D Q,et al.Effect of the selective pressure of sub-lethal level of heavy metals on the fate and distribution of ARGs in the catchment scale[J].Environmental Pollution,2017,220:900-908.