凡纳滨对虾(Litopenaeus vannamei)又名南美白对虾,具有生长迅速、营养价值高、抗病力强、易粗养、易运输和加工出肉率高等优点,其产量和养殖面积均居中国养殖对虾的首位[1]。
鱼粉蛋白含量高,富含水产养殖动物所需的必需氨基酸、高不饱和脂肪酸、矿物质和维生素等营养物质,是水产动物饲料中最重要的蛋白源之一。近年来,随着中国水产养殖业的迅速发展,作为对虾饲料主要蛋白质来源的鱼粉价格正逐年攀升。寻求可代替鱼粉的新型蛋白源迫在眉睫,植物蛋白源如豆粕、大豆浓缩蛋白、棉籽浓缩蛋白等在凡纳滨对虾饲料中均呈现出较为理想的鱼粉替代效果,但由于其中的抗营养因子如植酸、大豆抗胰蛋白酶和硫葡萄糖苷含量高,以及氨基酸失衡等因素的影响,其过量添加会导致水产动物生产性能下降、免疫功能受损及肠道消化与吸收能力下降[2-4]。
植酸几乎存在于所有的植物原料中,在一定条件下易与植物原料中的二价磷离子螯合形成植酸磷,很难被消化吸收,也可以与蛋白质、维生素等结合形成不溶物,降低其利用和吸收效率[5]。近年来,随着畜禽动物饲料中植酸酶应用的不断拓展,水产动物饲料中添加植酸酶的研究也不断深入。研究表明,植酸能影响许多水产养殖经济动物如对虾、罗氏沼虾(Macrobrachium rosenbergii)和虹鳟(Oncorhynchus mykiss)等的生长和消化吸收能力[6-8],饲料中植酸酶的添加不仅能增加饲养动物的日增重和日采食量,降低饵料系数和死亡率,还能提高磷的利用率,减少饲料中无机磷的含量,从而减轻磷对养殖水体的污染[9]。凡纳滨对虾作为中国主要的水产养殖品种,其饲料开发与应用备受关注,但有关饲料中添加植酸酶对其生长性能及饲料利用影响的研究却鲜见报道。本试验中,研究了低鱼粉饲料中添加植酸酶,对凡纳滨对虾生长性能、肠道形态、抗氧化能力及非特异性免疫的影响,以期为对虾低鱼粉饲料的开发提供参考。
1 材料与方法
1.1 材料
试验在广东省湛江东海岛恒兴南方海洋科技公司863基地进行,试验虾由基地提供,为当年同一批孵化的虾苗。鱼粉和鱼油均从秘鲁进口,大豆浓缩蛋白由益海嘉里集团(北京)提供,血粉由爱不停蛋白质饲料有限公司(北京)提供,其他原料均由广州星星饲料有限公司提供。植酸酶(5 000 U/g)由广东珠海溢多利有限公司提供,晶体氨基酸除蛋氨酸(德固赛,北京)外,均购于阿拉丁试剂公司(上海)。
1.2 方法
1.2.1 试验饲料的配制 试验前检测主要原料的营养成分(表1)。试验共配制3种饲料,其中高鱼粉饲料含质量分数为25%的鱼粉(HF),另外两种饲料均含质量分数为10%的鱼粉(以大豆浓缩蛋白、虾粉、血粉、鸡肉粉替代15%鱼粉),分别为低鱼粉饲料(LF)和添加质量分数为0.02%的植酸酶(5 000 U/g)低鱼粉饲料(LFP),饲料配方如表2所示。
表1 主要试验原料营养组成(干物质)
Tab.1 Nutrition composition of the main experimental ingredients (dry matter) w/%
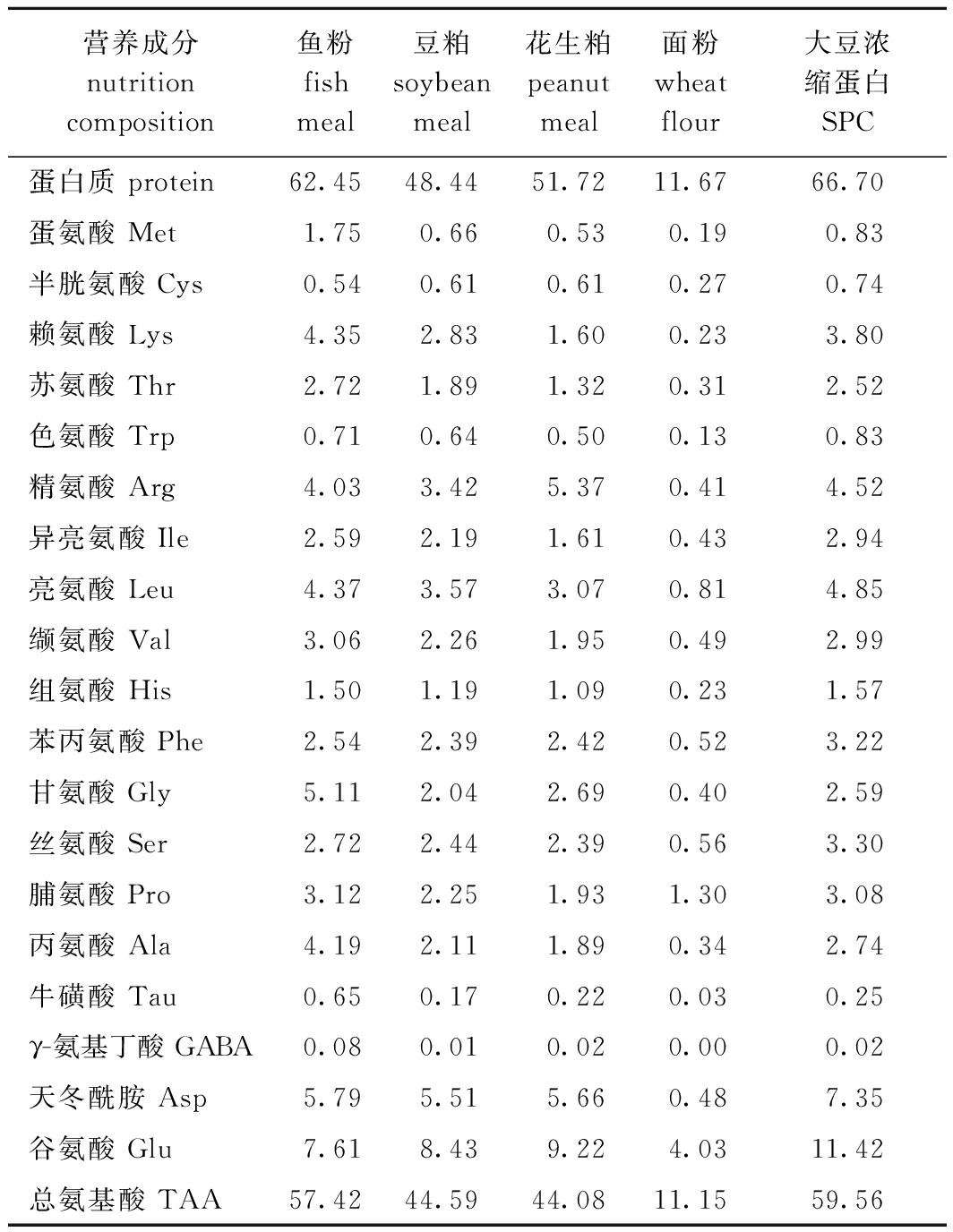
营养成分nutrition composition鱼粉fish meal豆粕soybeanmeal花生粕peanut meal面粉wheat flour大豆浓缩蛋白SPC蛋白质 protein62.4548.4451.7211.6766.70蛋氨酸 Met1.750.660.530.190.83半胱氨酸 Cys0.540.610.610.270.74赖氨酸 Lys4.352.831.600.233.80苏氨酸 Thr2.721.891.320.312.52色氨酸 Trp0.710.640.500.130.83精氨酸 Arg4.033.425.370.414.52异亮氨酸 Ile2.592.191.610.432.94亮氨酸 Leu4.373.573.070.814.85缬氨酸 Val3.062.261.950.492.99组氨酸 His1.501.191.090.231.57苯丙氨酸 Phe2.542.392.420.523.22甘氨酸 Gly5.112.042.690.402.59丝氨酸 Ser2.722.442.390.563.30脯氨酸 Pro3.122.251.931.303.08丙氨酸 Ala4.192.111.890.342.74牛磺酸 Tau0.650.170.220.030.25γ-氨基丁酸 GABA0.080.010.020.000.02天冬酰胺 Asp5.795.515.660.487.35谷氨酸 Glu7.618.439.224.0311.42总氨基酸 TAA57.4244.5944.0811.1559.56
表2 试验饲料配方
Tab.2 Ingredients of the diets used in the experiment w/%
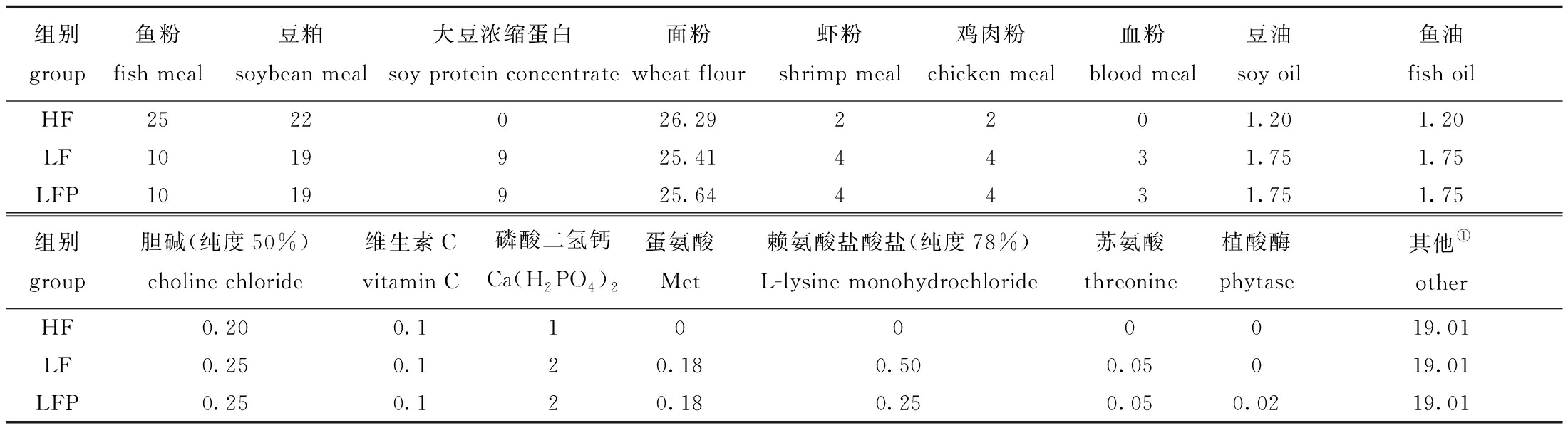
组别group鱼粉fish meal豆粕soybean meal大豆浓缩蛋白soy protein concentrate面粉wheat flour虾粉shrimp meal鸡肉粉chicken meal血粉blood meal豆油soy oil鱼油fish oilHF2522026.292201.201.20LF1019925.414431.751.75LFP1019925.644431.751.75组别group胆碱(纯度50%)choline chloride维生素C vitamin C磷酸二氢钙Ca(H2PO4)2蛋氨酸Met赖氨酸盐酸盐(纯度78%)L-lysine monohydrochloride苏氨酸threonine植酸酶phytase其他①otherHF0.200.11000019.01LF0.250.120.180.500.05019.01LFP0.250.120.180.250.050.0219.01
注:①其他原料中包括花生粕 12%、啤酒酵母3%、大豆卵磷脂1%、复合维生素1%、复合矿物质1%、羧甲基纤维素1%、Y2O3 0.01%,其中,复合维生素和复合矿物盐均购于广州星星饲料有限公司。
Note:① Test diets include 12% of peanut meal,3% of beer yeast,1% of soy lecithin,1% of vitamin mixture,1% of mineral mixture,1% of carboxy methy cellulose,and 0.01% of Y2O3,vitamin premix and mineral premix are all purchased from Guangzhou Stars Feed Co.Ltd.
晶体氨基酸用10 g/kg(饲料)的羧甲基纤维素包被,溶入60 ℃水中搅拌均匀,直至无可见白色颗粒。全部饲料原料粉碎后过孔径为245 μm的筛网,按照配方准确称重,在搅拌机中混合均匀,加入豆油、鱼油和大豆卵磷脂混合,再加入40%的水混合均匀。然后用双螺杆挤条机压制成直径为1.2 mm的条状饲料,再用造粒机制成颗粒状饲料,饲料成型之后在烘箱(70 ℃)中烘60 min后,将饲料风干至水分含量低于10%,装入塑料密封袋中,存放于-20 ℃冰柜中保存备用。
1.2.2 饲料营养成分的测定 按照GB/T 6435—2006、GB/T 6432—1994、GB/T 6433—2006和GB/T 6438—2007中的方法分别测定水分、粗蛋白质、粗脂肪和粗灰分含量(表3)。
表3 试验饲料成分分析(干物质)
Tab.3 Composition analysis of experimental diets(dry matter) w/%
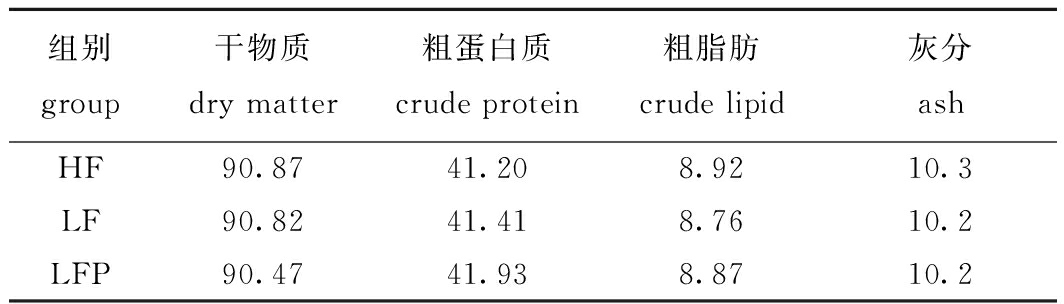
组别group干物质dry matter粗蛋白质crude protein粗脂肪crude lipid灰分ashHF90.8741.208.9210.3LF90.8241.418.7610.2LFP90.4741.938.8710.2
1.2.3 试验设计及养殖管理 试验开始前,将试验虾暂养于1 000 L水族箱中,驯养前两周投喂商品虾苗饲料,第三周投喂高鱼粉饲料。养殖系统为静水水族箱养殖,试验用水为沙滤海水。
驯养结束后,挑选规格一致、健康活泼、体质量为0.43 g的虾苗360尾进行试验,试验设高鱼粉饲料组(HF,对照)、低鱼粉饲料组(LF)和添加植酸酶的低鱼粉饲料组(LFP),分别投喂3种试验饲料,每个处理组设置4个重复,每个水族箱放30尾虾苗。每天饱食投喂4次(7:00、12:00、17:00和21:00),养殖周期为8周。前4周每4 d换水一次,每次换水量为30%,后4周每3 d换水一次,每次换水量为50%。整个试验期间,水温为26~30 ℃,盐度为27~30,溶解氧>6.5 mg/L,氨氮<0.05 mg/L,pH为7.7~8.0,自然光照。
试验期间每天记录水温,定时观察对虾摄食情况和剩料情况,及时用虹吸法吸取剩余饲料并调整投喂量,记录每日的饲料投喂量和对虾死亡情况。在饲养试验的最后两周收集粪便进行分析;喂食1 h后,在每天的13:00和18:00收集两次粪便,并于-20 ℃下保存。
1.2.4 生长指标的测定与计算 试验开始之前,随机选取100尾左右虾苗存放于-20 ℃冰柜中,用以分析初始常规营养组成。8周养殖试验结束时,停止投喂24 h后,称量每个养殖箱的对虾总质量,并记录每箱的对虾尾数。生长指标计算公式为
GBW=(Wt-W0)/W0×100%,
(1)
RS=nt/ n0×100%,
(2)
RSG=(lnWt-lnW0)/t×100%,
(3)
EF=(Wt-W0)/F,
(4)
IF=F/nt。
(5)
其中:GBW为增重率(%);RS为存活率(%);RSG为特定生长率(%·d-1);EF为饲料效率;IF饲料摄入量(g/ind.);W0、Wt分别为试验虾的初始体质量(g)和终末体质量(g);t为 试 验 时 间(d);F为饲料总摄入量(g);nt、n0分别为试验结束和试验开始时的对虾数量(ind.)。
采用Y2O3指示剂法测定消化率,蛋白质消化率(D)和干物质消化率(D′)计算公式为
D=[1-(A′/A)×(B/B′)] ×100%,
(6)
D′=[1-(B/B′)] ×100%。
(7)
其中:A、A′分别为饲料和粪便中的蛋白质含量(%);B、B′分别为饲料和粪便中的Y2O3含量(%)。
1.2.5 样品的采集与处理 试验结束时,从每个水族箱中随机选取15尾虾,用丁香酚麻醉后,5尾全虾样品用于分析常规营养组成,3尾解剖取其肝胰腺用于测定肝体比,7尾用1 mL注射器从试验虾的头胸甲后缘与第一腹节的连接处抽取血液。将血液样品在4 ℃冰箱中过夜后,于4 ℃下以8 000 r/min离心10 min,取上清液置于-80 ℃超低温冰箱中保存,用于酶活分析。将抽血后的试验虾解剖,取其肝胰腺置于-80 ℃下保存,用于酶活分析和RNA提取,取其中肠置于体积分数为4%的甲醛溶液中浸泡,用于肠道形态学分析。
1.2.6 中肠形态学分析 将保存的中肠样品转移至波恩氏液中固定24 h,然后转移到体积分数为70%的乙醇中。将肠道样品在一系列分级乙醇中脱水,用石蜡包埋、苏木精-伊红染色,在显微镜(Nikon Ni-U,日本)下观察并拍照。用Image J软件测量肠道皱襞的高度和肌肉层的厚度,通过这两项指标来评价肠道组织形态。
1.2.7 肝胰腺基因表达检测 检测肝胰腺中胰蛋白酶(Trypsin)、糜蛋白酶(Chymotrypsin)等消化酶基因,以及SOD酶、CAT酶、酚氧化酶(PO)和β-1,3-葡聚糖结合蛋白(Lgbp)等免疫蛋白基因的表达。使用Trizol Reagent(Invitrogen,上海)提取肝胰腺总RNA,用10 g/L琼脂糖凝胶电泳检测RNA质量,使用超微量分光光度计Nano 2000(Thermo Scientific,美国)检测RNA浓度(A260 nm/A280 nm)。然后用Fermentas DNase Ⅰ 试剂盒去除基因组DNA污染,再使用PrimeScriptTM RT Reagent Kit(TaKaRa,大连)合成cDNA。Real-time PCR所用引物信息如表4所示,所有引物均由Invitrogen(上海)合成,使用前均验证其扩增效率为90%~110%。
表4 Real-time PCR引物信息
Tab.4 Primer information of the Real-time PCR

目标基因target gene引物序列 (5'-3')primer sequence (5'-3')文献来源referencepoF:GCCTTGGCAACGCTTTCAR:CGCGCATCAGTTCAGTTTGTLai等[10]sodF:GCAATGAATGCCCTTCTACCR:CAGAGCCTTTCACTCCAACGCardona等[11]trypsinF:TCCAAGATCATCCAACACGAR:GACCCTGAGCGGGAATATCFlores-Miranda等[12]chymotrypsinF:GGCTCTCTTCATCGACGLR:CGTGAGTGAAGAAGTCGGStephens等[13]catF:TACTGCAAGTTCCATTACAAGACGR:GTAATTCTTTGGATTGCGGTCACardona等[11]lgbpF:CCATGTCCGGCGGTGGAAR:GTCATCGCCCTTCCAGTTGZhang等[14]
在罗氏LightCycler 480(巴塞尔,瑞士)仪器上进行Real-time PCR反应,所用试剂为SYBR® Premix Ex TaqTM Ⅱ (TaKaRa,大连),每个反应设置3个复孔。反应条件:95 ℃下预变性2 min;95 ℃下变性15 s,60 ℃下退火45 s,共进行40个循环。之后进行溶解曲线分析,结束后导出Ct值,使用2-ΔΔCt方法分析定量数据。
1.2.8 生理酶活的测定 使用南京建成生物工程研究所试剂盒,检测血清和肝胰腺中过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性及谷胱甘肽(GSH)含量。
1.3 数据处理
试验数据均以平均值±标准误(mean±S.E.)表示,使用SPSS 22.0统计软件对所有数据进行处理分析。首先对数据进行齐次性检验,如果方差齐次,则使用单因素方差分析,用Duncan法进行组间多重比较,显著性水平设为0.05;如果方差不齐次,则使用非参数检验(Kruskal-Wallis test)进行组间差异比较,显著性水平设为0.05。
2 结果与分析
2.1 不同饲料组凡纳滨对虾的生长性能
从表5可见,在8周养殖试验结束后,摄食低鱼粉饲料的LF组对虾各项生长指标最差,低鱼粉饲料中添加植酸酶后,LFP组对虾的增重率、特定生长率、蛋白质消化率和饲料效率显著提高(P<0.05),存活率和干物质消化率也有所提升。
表5 不同饲料对凡纳滨对虾生长性能和饲料利用的影响
Tab.5 Effects of different diets on growth performance and feed utilization of Litopenaeus vannamei
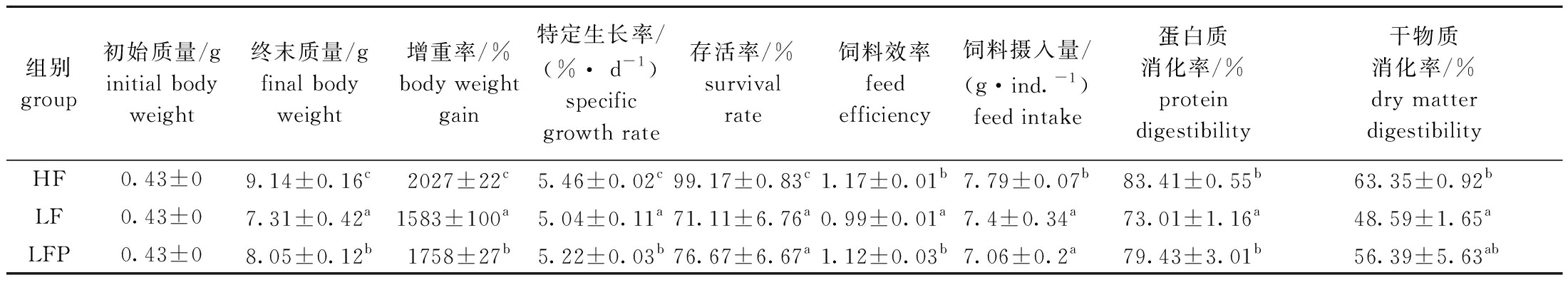
组别group初始质量/ginitial body weight终末质量/gfinal body weight增重率/%body weight gain 特定生长率/(%· d-1)specific growth rate存活率/%survival rate饲料效率feed efficiency饲料摄入量/(g·ind.-1)feed intake蛋白质消化率/%protein digestibility干物质消化率/%dry matter digestibilityHF0.43±09.14±0.16c2027±22c5.46±0.02c99.17±0.83c1.17±0.01b7.79±0.07b83.41±0.55b63.35±0.92bLF0.43±07.31±0.42a1583±100a5.04±0.11a71.11±6.76a0.99±0.01a7.4±0.34a73.01±1.16a48.59±1.65aLFP0.43±08.05±0.12b1758±27b5.22±0.03b76.67±6.67a1.12±0.03b7.06±0.2a79.43±3.01b56.39±5.63ab
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
2.2 凡纳滨对虾肠道形态学分析
凡纳滨对虾中肠形态的苏木精-伊红染色切片见图1。LF组对虾肠道的皱襞高度和肌层厚度显著低于高鱼粉组(P<0.05),低鱼粉饲料中添加植酸酶后,LFP组这两个肠道形态指标明显提升,并达到或接近高鱼粉组HF水平(P>0.05)(表6)。
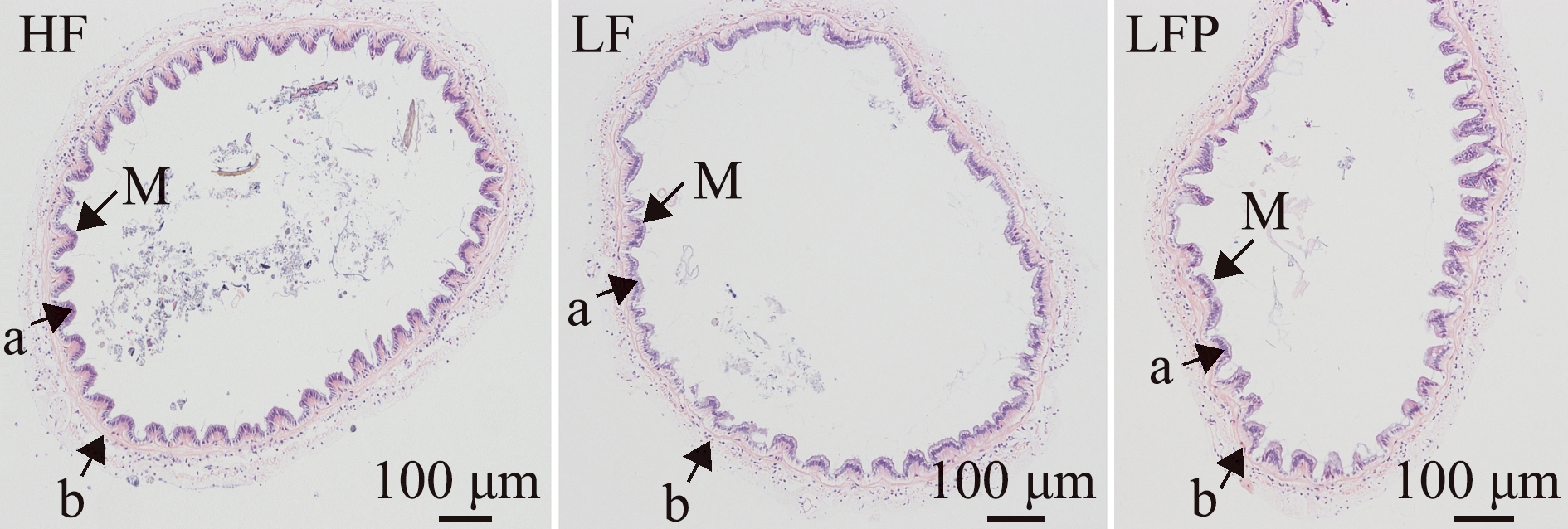
M—黏膜皱襞;a—黏膜皱襞的高度;b—肌层的厚度。
M—mucosal folds;a—height of mucosal folds;b—width of mucosal folds.
图1 中肠形态(苏木精-伊红染色)
Fig.1 Mid-intestinal morphology (HE staining)
表6 肠道形态指标的变化
Tab.6 Changes in intestinal morphological index

组别group皱襞高度/μmheight of mucosal folds肌层厚度/μmthickness of muscle layerHF58.63±1.82b63.10±3.34bLF45.24±1.94a44.38±3.53aLFP60.89±2.20b50.02±3.08ab
2.3 肝胰腺中免疫基因和消化酶基因的表达变化
从图2可见:LF组对虾肝胰腺中免疫基因chymotrypsin、sod、po、lgbp mRNA表达量显著低于高鱼粉组(P<0.05),低鱼粉饲料中添加植酸酶后,LFP组lgbp mRNA水平显著提高(P<0.05),chymotrypsin mRNA表达量有所提高,并接近高鱼粉水平(P>0.05);各组间cat、trypsin mRNA表达量无显著性差异(P>0.05)。
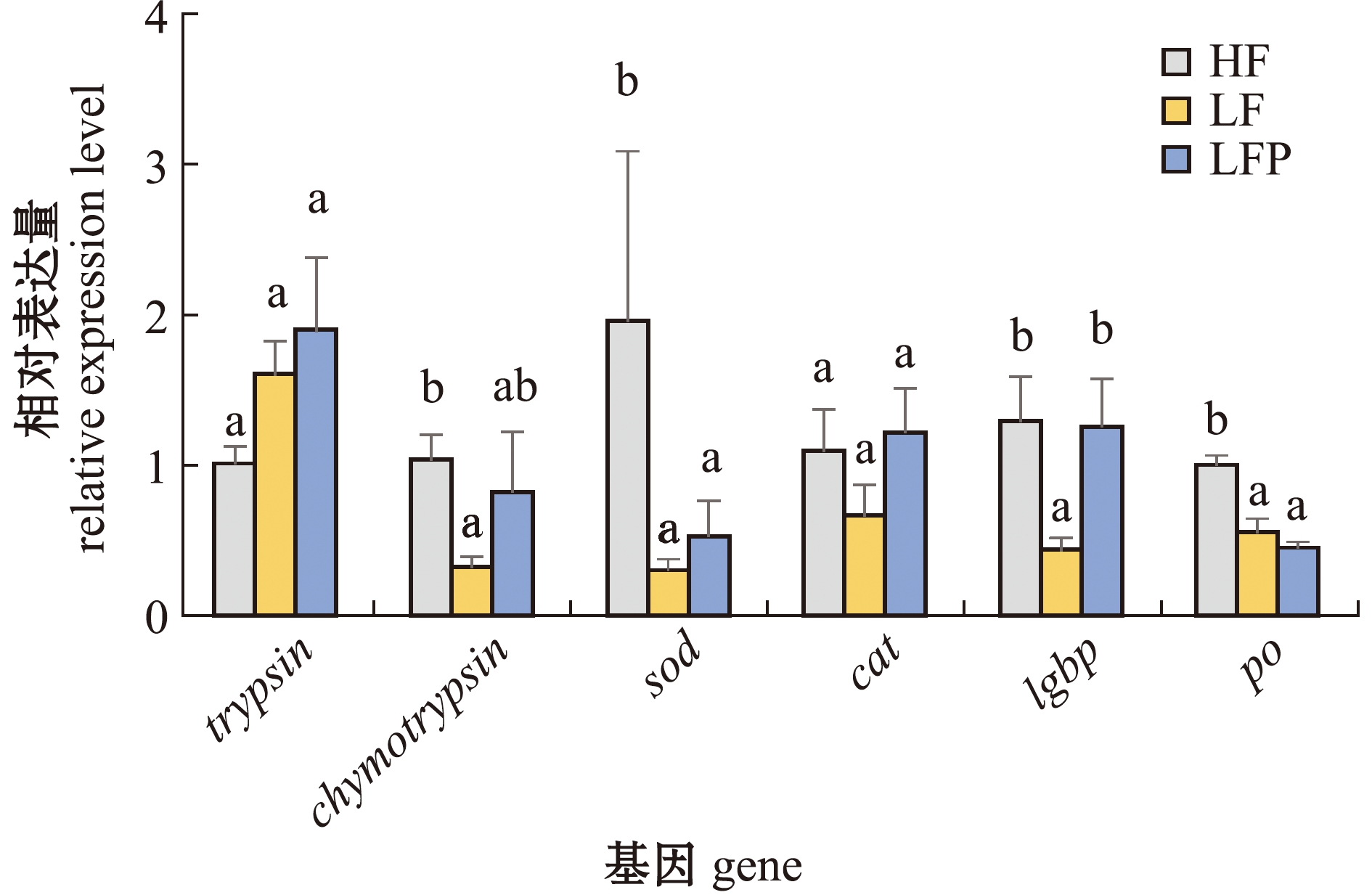
同一基因中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters within the same gene are significantly different in the different groups at the 0.05 probability level,and the means with the same letter are not significant differences.
图2 不同饲料对凡纳滨对虾肝胰腺中基因表达的影响
Fig.2 Effects of different diets on gene expressions in hepatopancreas of Litopenaeus vannamei
2.4 血清和肝胰腺中酶活力的变化
从表7可见:在血清中,LF组对虾的SOD活力显著高于高鱼粉组(P<0.05),GSH含量显著低于高鱼粉组(P<0.05),低鱼粉饲料中添加植酸酶后,LFP组的SOD活力有所降低,并接近高鱼粉组水平(P>0.05);在肝胰腺中,LF组对虾的CAT活力和GSH含量显著低于高鱼粉组(P<0.05),添加植酸酶后,LFP组CAT活力和GSH含量有所提升,并接近高鱼粉组水平(P>0.05)。
表7 不同饲料对凡纳滨对虾血清和肝胰腺酶活力的影响
Tab.7 Effects of different diets on enzyme activities in serum and hepatopancreas of Litopenaeus vannamei
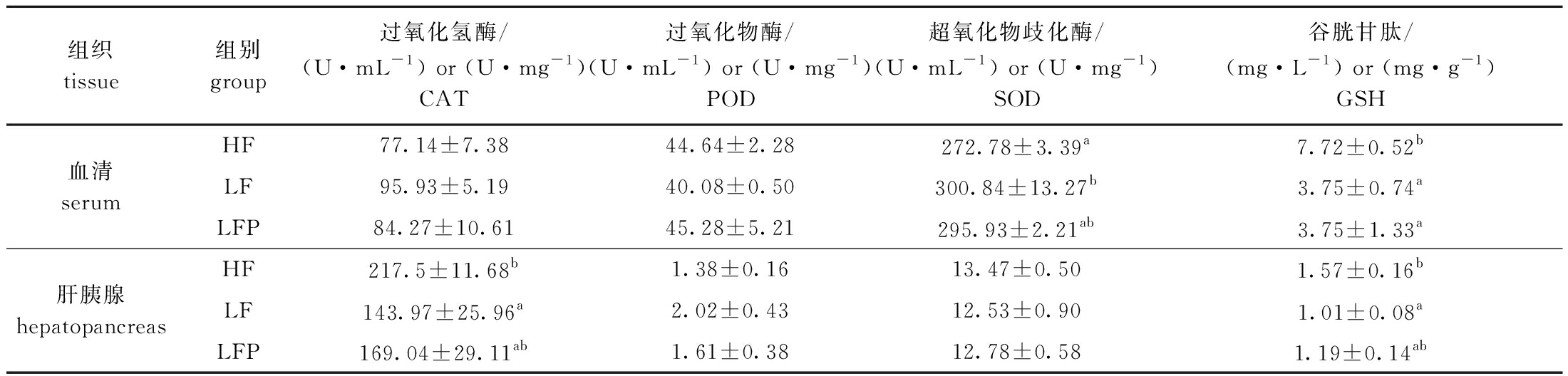
组织 tissue组别group过氧化氢酶/(U·mL-1) or (U·mg-1)CAT过氧化物酶/(U·mL-1) or (U·mg-1)POD超氧化物歧化酶/(U·mL-1) or (U·mg-1)SOD谷胱甘肽/(mg·L-1) or (mg·g-1)GSHHF77.14±7.3844.64±2.28272.78±3.39a7.72±0.52b血清serumLF95.93±5.1940.08±0.50300.84±13.27b3.75±0.74aLFP84.27±10.6145.28±5.21295.93±2.21ab3.75±1.33aHF217.5±11.68b1.38±0.1613.47±0.501.57±0.16b肝胰腺hepatopancreasLF143.97±25.96a2.02±0.4312.53±0.901.01±0.08aLFP169.04±29.11ab1.61±0.3812.78±0.581.19±0.14ab
3 讨论
3.1 植酸酶对凡纳滨对虾生长性能的影响
在对虾和其他水产动物饲料中添加植酸酶的研究结果是有争议的。本试验中,降低饲料鱼粉的添加量后,在含19%豆粕的两个低鱼粉饲料组中,对虾的生长性能显著低于高鱼粉对照组,但在添加5 000 U/g植酸酶(0.02%)的低鱼粉组,对虾的增重率和饲料效率均显著提高。这与孟祥科等[15]以豆粕替代30%鱼粉后,添加1~1.5 U/g植酸酶可以促进红鳍东方鲀(Takifugu rubripes)幼鱼生长并改善消化能力的结果一致。但也有研究表明,在含30%豆粕的基础饲料中添加2 U/g植酸酶后,对罗非鱼的生长和饲料利用无影响[16];在含37.8%豆粕的饲料中添加1 U/g植酸酶后,对斑节对虾(Penaeus monodon)的成活率也无影响[17]。研究结果出现差异的原因,可能与物种差异相关,也可能是植酸酶添加量低或豆粕替代鱼粉比例过高所致。
饲料系数、蛋白质效率是衡量水产动物饲料利用效率的重要指标。杨璐等[18]研究发现,在添加合理剂量的植酸酶后,中华绒螯蟹(Eriocheir sinensi)的饲料系数显著降低,蛋白质效率显著提高。本研究中,低鱼粉组对虾的饲料效率显著低于高鱼粉组,添加植酸酶后的低鱼粉组饲料效率显著提高,并接近高鱼粉组水平,说明植酸酶同样提高了凡纳滨对虾的饲料利用率。在水产动物中,鱼粉的消化率通常高于其他原料,而本研究中选用的大豆浓缩蛋白、虾粉、鸡肉粉和血粉等都是凡纳滨对虾消化率较高的原料。本研究中,低鱼粉组对虾的营养物质消化率显著低于高鱼粉组,添加植酸酶后的低鱼粉组营养物质消化率显著提高,说明植酸酶能够减弱或者消除植物蛋白源对凡纳滨对虾消化能力的不利影响;同时,低鱼粉组的糜蛋白酶基因chymotrypsin mRNA水平也显著低于高鱼粉组,说明植物蛋白源降低了饲料的消化率和对虾的消化能力,但添加植酸酶后的低鱼粉组chymotrypsin mRNA水平有所提高,并接近高鱼粉组水平。这与用添加植酸酶的低鱼粉饲料投喂草鱼(Ctenopharyngodon idella)能够提高草鱼营养物质表观消化率和肠道消化酶活性的结果相似[19]。
3.2 植酸酶对凡纳滨对虾中肠形态的影响
动物的肠道屏障具有保护机体的功能,如果肠道组织的完整性被破坏,有害病原体和外界毒素便能穿透肠上皮细胞,降低机体的免疫力[20]。同时,肠道也是吸收营养物质的重要器官,肠道的形态结构对虾类的生长和免疫起着重要作用。一般来说,肠道皱襞高度和肌层厚度是反映肠道健康的两个基本指标[21]。张鑫等[22]研究表明,用豆粕替代饲料中高比例的鱼粉会对乌鳢(Channa argus)的生长性能产生不利影响,影响肠道褶皱形态并导致部分褶皱受到破坏。本研究结果与此类似,低鱼粉饲料(10%鱼粉蛋白)投喂组凡纳滨对虾肠道皱襞高度和肌层厚度最低,当低鱼粉饲料中添加一定量的植酸酶后,对虾的肠道皱襞高度和肌层厚度均有明显提高,说明添加植酸酶可以缓解低鱼粉饲料诱发的对虾肠道损伤。这与王国霞等[23]研究得到的饲料中添加植酸酶(1 U/g)能够提高黄颡鱼(Pelteobagrus fulvidraco)前肠肠壁厚度和肠绒毛高度的结果一致。由此可见,在以植物蛋白源为主的低鱼粉饲料中添加质量分数为0.02%的植酸酶(5 000 U/g),可在一定程度上缓解低鱼粉诱发的虾肠道损伤。
3.3 植酸酶对凡纳滨对虾非特异性免疫力的影响
甲壳类免疫防御的重要一环是酚氧化酶原系统(proPO)介导的黑化作用,proPO上调会导致PO活性的提高[24],而β-1,3-葡聚糖结合蛋白(Lgbp)是proPO系统中的一个重要的模式识别蛋白,能够与真菌细胞壁的脂多糖和β-1,3-葡聚糖结合,从而达到保护机体的作用[25]。本试验中,与高鱼粉组相比,低鱼粉中po和lgbp mRNA水平显著降低,而在低鱼粉饲料中添加植酸酶后,lgbp mRNA水平显著提高,说明在低鱼粉饲料中添加植酸酶可以提高对虾的免疫力。与本试验结果类似,在全植物蛋白饲料中添加植酸酶(1 000 U/g)后,能促进斑点叉尾鮰(Ictalurus punctatus)的生长和鱼体蛋白沉积,并能预防脊椎畸形和提高鱼体非特异性免疫相关酶活力[26]。由此可见,以植物蛋白源为主的低鱼粉饲料中添加0.02%的植酸酶(5 000 U/g)在一定程度上能提高对虾免疫力,减少病原侵害。
3.4 植酸酶对凡纳滨对虾抗氧化能力的影响
使用豆粕、菜籽粕等植物蛋白替代鱼粉的饲料投喂水产动物,植物蛋白中的抗胰蛋白酶、植酸和游离棉酚等抗营养因子经过水产动物消化道的消化吸收进入动物体内各个组织,从而导致机体发生氧化应激反应[27-28]。本试验中,肝胰腺和血清中的一些抗氧化相关酶活性受到饲料鱼粉水平的显著影响,同时体内重要的抗氧化物质GSH含量也低于高鱼粉组,说明低鱼粉饲料降低了对虾的抗氧化能力。除了GSH外,其他抗氧化指标在高鱼粉组和添加植酸酶的低鱼粉组间无显著性差异,说明低鱼粉饲料中添加植酸酶后能够部分缓解低鱼粉诱发的氧化损伤,提高对虾抗氧化能力。Xie等[29]研究发现,随着饲料中鱼粉替代水平的增加,凡纳滨对虾CAT活力下降,这表明鱼粉的替代会导致其抗氧化能力下降。王国霞等[23]研究发现,在以鱼粉、豆粕、棉籽粕和双低菜籽粕为蛋白源的实用饲料中添加1 000 U/g植酸酶,能在一定程度上提高黄颡鱼血清SOD、GSH-Px、T-AOC活性,降低MDA含量,改善鱼体抗氧化力。这些结果与本试验结果相似,说明在以植物蛋白源为主的低鱼粉饲料中添加质量分数为0.02%的植酸酶(5 000 U/g),在一定程度上能改善凡纳滨对虾的抗氧化能力。
4 结论
1)本试验条件下,利用以植物蛋白源为主的复合蛋白源替代鱼粉后,添加质量分数为0.02%的植酸酶(5 000 U/g),能够显著增强凡纳滨对虾对营养物质的消化利用率,进而提高其生长性能。
2)在低鱼粉饲料中添加植酸酶可增强凡纳滨对虾抗氧化能力和免疫力,并在一定程度上缓解低鱼粉饲料诱发的肠道损伤。
[1] 王彩理,毕国栋,于爱美,等.凡纳滨对虾的营养功效和安全利用[J].农产品加工,2021(24):72-74.
WANG C L,BI G D,YU A M,et al.Nutritional effect and safe utilization of Penaeus vannamei[J].Farm Products Processing,2021(24):72-74.(in Chinese)
[2] 徐田田,许丹,刘兴旺,等.去皮豆粕替代鱼粉对凡纳滨对虾生长及体组成的影响[J].饲料研究,2021,44(13):72-76.
XU T T,XU D,LIU X W,et al.Effect of dehulled soybean meal instead of fish meal on growth and body composition of Litopenaeus vannamei[J].Feed Research,2021,44(13):72-76.(in Chinese)
[3] 彭松,李小勤,蔡国林,等.发酵花生粕替代鱼粉对凡纳滨对虾生长、肌肉成分和非特异性免疫的影响[J].饲料工业,2015,36(14):19-23.
PENG S,LI X Q,CAI G L,et al.Effect of replacing fish meal with fermented peanut meal on growth performance,muscle composition and non-specific immunity of white shrimp,Litopenaeus vannamei(Boone)[J].Feed Industry,2015,36(14):19-23.(in Chinese)
[4] LIN Y H,CHEN Y T.Lactobacillus spp.fermented soybean meal partially substitution to fish meal enhances innate immune responses and nutrient digestibility of white shrimp (Litopenaeus vannamei) fed diet with low fish meal[J].Aquaculture,2022,548:737634.
[5] 张相鑫,罗静如,Nasser Odetallah.植酸酶对动物饲料中营养物质利用的影响[J].国外畜牧学(猪与禽),2021,41(2):99-102.
ZHANG X X,LUO J R,NASSER ODETALLAH.The impact of phytase on nutrient utilization of animal feed[J].Animal Science Abroad (Pigs and Poultry),2021,41(2):99-102.(in Chinese)
[6] QIU X,DAVIS D A.Effects of dietary phytase supplementation on growth performance and apparent digestibility coefficients of Pacific white shrimp Litopenaeus vannamei[J].Aquaculture Nutrition,2017,23(5):942-951.
[7] BIRADAR S,SHIVANANDA MURTHY H,PATIL P,et al.Dietary supplementation of microbial phytase improves growth and protein efficiency ratio of freshwater prawn (Macrobrachium rosenbergii)[J].Aquaculture International,2017,25(2):567-575.
[8] ÇANTA![]()
![]() B,YILDIRIM Ö.Supplementation of microbial phytase with safflower meal in rainbow trout (Oncorhynchus mykiss):the effects on growth,digestibility,environmental,and serum biological parameters[J].Journal of Chemistry,2020,2020:1-8.
B,YILDIRIM Ö.Supplementation of microbial phytase with safflower meal in rainbow trout (Oncorhynchus mykiss):the effects on growth,digestibility,environmental,and serum biological parameters[J].Journal of Chemistry,2020,2020:1-8.
[9] ABBASI F,FAKHUR-UN-NISA T,LIU J,et al.Low digestibility of phytate phosphorus,their impacts on the environment,and phytase opportunity in the poultry industry[J].Environmental Science and Pollution Research,2019,26(10):9469-9479.
[10] LAI C Y,CHENG W,KUO C M.Molecular cloning and characterisation of prophenoloxidase from haemocytes of the white shrimp,Litopenaeus vannamei[J].Fish &Shellfish Immunology,2005,18(5):417-430.
[11] CARDONA E,SAULNIER D,LORGEOUX B,et al.Rearing effect of biofloc on antioxidant and antimicrobial transcriptional response in Litopenaeus stylirostris shrimp facing an experimental sub-lethal hydrogen peroxide stress[J].Fish &Shellfish Immunology,2015,45(2):933-939.
[12] FLORES-MIRANDA M D C,LUNA-GONZ LEZ A,CORT
LEZ A,CORT S-ESPINOSA D V,et al.Effects of diets with fermented duckweed (Lemna sp.) on growth performance and gene expression in the Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture International,2015,23(2):547-561.
S-ESPINOSA D V,et al.Effects of diets with fermented duckweed (Lemna sp.) on growth performance and gene expression in the Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture International,2015,23(2):547-561.
[13] STEPHENS A,ROJO L,ARAUJO-BERNAL S,et al.Cathepsin B from the white shrimp Litopenaeus vannamei:cDNA sequence analysis,tissues-specific expression and biological activity[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2012,161(1):32-40.
[14] ZHANG S P,LI J F,WU X C,et al.Effects of different dietary lipid level on the growth,survival and immune-relating genes expression in Pacific white shrimp,Litopenaeus vannamei[J].Fish &Shellfish Immunology,2013,34(5):1131-1138.
[15] 孟祥科,孙阳,屈菲,等.植酸酶对红鳍东方鲀幼鱼生长、消化酶及消化率的影响[J].大连海洋大学学报,2013,28(4):323-328.
MENG X K,SUN Y,QU F,et al.Effects of phytase on growth,digestive enzyme activity and digestibility in juvenile redfin puffer Takifugu rubripes[J].Journal of Dalian Ocean University,2013,28(4):323-328.(in Chinese)
[16] LI X Q,ZHANG X Q,KABIR CHOWDHURY M A,et al.Dietary phytase and protease improved growth and nutrient utilization in tilapia (Oreochromis niloticus×Oreochromis aureus) fed low phosphorus and fishmeal-free diets[J].Aquaculture Nutrition,2019,25(1):46-55.
[17] RACHMAWATI D,SAMIDJAN I.Effect of phytase enzyme on growth boost in the artificial feed made of plant protein to shorten production time of giant tiger prawn (Penaeus monodon)[J].Aquatic Procedia,2016,7:46-53.
[18] 杨璐,韩凤禄,戚常乐,等.植酸酶对中华绒螯蟹幼蟹生长、消化性能及物质利用率的影响[J].水生生物学报,2019,43(6):1164-1171.
YANG L,HAN F L,QI C L,et al.Effects of phytase on growth,digestion and nutrient utilization of juvenile Chinese mitten crabs(Eriocheir sinensis)[J].Acta Hydrobiologica Sinica,2019,43(6):1164-1171.(in Chinese)
[19] 郑欣,徐树德,唐启峰,等.低磷低鱼粉饲料中添加植酸酶和蛋白酶对草鱼生长性能和消化生理的影响[J].动物营养学报,2020,32(4):1788-1799.
ZHENG X,XU S D,TANG Q F,et al.Effects of adding phytase and protease in low phosphorus and low fish meal diets on growth performance and digestive physiology of grass carp(Ctenopharyngodon idella)[J].Chinese Journal of Animal Nutrition,2020,32(4):1788-1799.(in Chinese)
[20] RUNGRASSAMEE W,KLANCHUI A,MAIBUNKAEW S,et al.Bacterial dynamics in intestines of the black tiger shrimp and the Pacific white shrimp during Vibrio harveyi exposure[J].Journal of Invertebrate Pathology,2016,133:12-19.
[21] MANZANILLA E G,PEREZ J F,MARTIN M,et al.Effect of plant extracts and formic acid on the intestinal equilibrium of early-weaned pigs[J].Journal of Animal Science,2004,82(11):3210-3218.
[22] 张鑫,韩蓓,胡俊涛,等.豆粕替代鱼粉对乌鳢生长性能、蛋白质利用及肠道组织形态的影响[J].动物营养学报,2020,32(6):2799-2807.
ZHANG X,HAN B,HU J T,et al.Effects of replacement of fish meal by soybean meal on growth performance,protein utilization and intestinal tissue morphology of Channa argus[J].Chinese Journal of Animal Nutrition,2020,32(6):2799-2807.(in Chinese)
[23] 王国霞,曹俊明,牛凤池,等.外源酶制剂对黄颡鱼免疫抗氧化指标和肠道形态结构的影响[J].饲料工业,2017,38(16):17-21.
WANG G X,CAO J M,NIU F C,et al.Effects of exogenous enzyme supplementation on immune and antioxidant indexes and intestinal morphology of yellow catfish[J].Feed Industry,2017,38(16):17-21.(in Chinese)
[24] SÖDERH L L K,CERENIUS L.Role of the prophenoloxidase-activating system in invertebrate immunity[J].Current Opinion in Immunology,1998,10(1):23-28.
L L K,CERENIUS L.Role of the prophenoloxidase-activating system in invertebrate immunity[J].Current Opinion in Immunology,1998,10(1):23-28.
[25] ZOKAEIFAR H,BALC ZAR J L,SAAD C R,et al.Effects of Bacillus subtilis on the growth performance,digestive enzymes,immune gene expression and disease resistance of white shrimp,Litopenaeus vannamei[J].Fish &Shellfish Immunology,2012,33(4):683-689.
ZAR J L,SAAD C R,et al.Effects of Bacillus subtilis on the growth performance,digestive enzymes,immune gene expression and disease resistance of white shrimp,Litopenaeus vannamei[J].Fish &Shellfish Immunology,2012,33(4):683-689.
[26] 华雪铭,王世忠,陈瑶琴,等.植酸酶对斑点叉尾鮰脊椎形态和非特异性免疫相关酶活力的影响[J].浙江大学学报(农业与生命科学版),2014,40(1):94-102.
HUA X M,WANG S Z,CHEN Y Q,et al.Effects of phytase on vertebral shapes and non-specific immune related enzymes activities in channel catfish(Ictalurus punctatus)[J].Journal of Zhejiang University (Agriculture and Life Sciences),2014,40(1):94-102.(in Chinese)
[27] 申建飞,陈铭灿,刘泓宇,等.浓缩棉籽蛋白替代鱼粉对卵形鲳鲹幼鱼生长性能、血清生化指标、肝脏抗氧化指标及胃肠道蛋白酶活性的影响[J].动物营养学报,2019,31(2):746-756.
SHEN J F,CHEN M C,LIU H Y,et al.Effects of fish meal replacement by concentrated cottonseed protein on growth performance,serum biochemical indices,liver antioxidant indices and gastrointestinal tract protease activities of juvenile Trachinotus ovatus[J].Chinese Journal of Animal Nutrition,2019,31(2):746-756.(in Chinese)
[28] 殷海成,黄进,李昕朔,等.豆粕和发酵豆粕替代鱼粉对黄河鲤生长和血清抗氧化性能及消化酶活性的影响[J].饲料工业,2019,40(12):46-52.
YIN H C,HUANG J,LI X S,et al.Effect of replacing fish meal with fermented and unfermented soybean meal on growth performance,serum antioxidant capacity and digestive enzymes of juvenile Cyprinus carpio haematopterus[J].Feed Industry,2019,40(12):46-52.(in Chinese)
[29] XIE S W,LIU Y J,ZENG S L,et al.Partial replacement of fish-meal by soy protein concentrate and soybean meal based protein blend for juvenile Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture,2016,464:296-302.