哈氏刻肋海胆(Temnopleurus hardwickii)隶属于海胆纲(Echinoidea)拱齿目(Camarodonta)刻肋海胆科(Temnopleuridae)刻肋海胆属(Temnopleurus)[1],与细雕刻肋海胆(T.alexandri)的亲缘关系较近[2],分布于中国的黄海、渤海、东海舟山群岛海域和台湾海峡。其壳较低平,呈半球形,最大壳径为4.5 cm,高约2 cm,步带狭窄,此间步带稍隆起(图1)。
哈氏刻肋海胆棘刺较细,呈规则排列,棘一节深一节浅,形态美观,观赏性极高,在水族造景中应用广泛,对水族缸内壁藻类的控制也有着较好的效果,有利于调节水质。因此,其观赏应用潜力较大。目前,有关哈氏刻肋海胆的研究较少,主要集中在其遗传进化和生态方面[3-4]。国外有关哈氏刻肋海胆的养殖文献也较稀少,仅见Yaguchi等[5]对该海胆的生殖周期进行过研究。哈氏刻肋海胆种群数量较少,开展哈氏刻肋海胆的人工繁殖,不仅对生态环境的保护具有积极作用,而且缓解了水族造景等产业的需求。本研究中,首次探究了哈氏刻肋海胆人工繁育技术,并观察其胚胎及幼体发育过程,以期为该海胆的遗传和人工繁育提供基础资料。
1 材料与方法
1.1 材料
试验用亲胆200枚,于2018年9月采自旅顺黄泥川海域(图1),壳径为3.0~4.5 cm,活力充沛,体表无损伤,亲胆运送至大连海洋大学农业农村部北方海水增养殖重点实验室暂养3 d。

图1 哈氏刻肋海胆形态
Fig.1 Morphology of Temnopleurus hardwickii
1.2 方法
1.2.1 亲胆管理 将哈氏刻肋海胆亲胆暂养于实验室内,自然光照,水温为(24.2±1.0)℃,盐度为29~32。暂养池中24 h充气,每天换水一次并投喂马尾藻,换水量为2/3,换水时缓慢加水以减少对亲胆的刺激。
1.2.2 亲胆促熟 通过投喂充足饵料对哈氏刻肋海胆亲胆进行促熟。温度较低时,可通过缓慢升温促熟,促熟过程中投喂海带、裙带菜、石莼及少量煮熟的贻贝,保证亲胆食物充足,使亲胆在性腺发育过程中有着较好的丰满度。自然光周期下,每天换水一次,换水量为1/3,轻度充气,并用虹吸管将亲胆所排粪便吸出,温度控制在23 ℃左右。
1.2.3 受精卵的获得与观察 参考王宝锋等[6]的方法对海胆进行催产。在23.7 ℃水温下,使用1 mL的注射器,分别从围口膜处给10枚亲胆注射0.5 mol/L的KCl溶液0.4 mL。注射KCl溶液后,将亲胆倒扣在500 mL的矿泉水瓶上。亲胆排精、产卵后,收集适量活力好的精子加入已经准备好的卵子中,轻轻搅动,等待卵子的受精。在显微镜下观察到卵子有极体放出时,表明该卵子已受精。取1 mL精卵混合液在显微镜下观察受精卵的变化并记录数量。受精率(%)计算公式为
受精率=2细胞数量/总卵数量×100%。
1.2.4 胚胎和幼体发育观察 受精卵在水温23~24 ℃、盐度29~32下进行孵化,受精时卵密度为60~80枚/mL。胚胎发育至纤毛囊胚期后上浮于水面,用虹吸法吸取上层囊胚进入育苗池进行培养,在选育时也可用孔径为57 μm的筛绢网在水面上层进行筛选。选育后的优良胚胎发育至棱柱幼体时期时,开始投喂牟氏角毛藻(Chaetoceros muelleri),起始投喂量为每日2 000 cells/mL,通过光学显微镜观察幼体胃部饱满情况并逐渐增加投喂量。二腕幼体至四腕幼体时期,每日投喂量为3 500~8 100 cells/mL;六腕幼体至八腕幼体时期,每日投喂量逐渐增加至12 500~20 000 cells/mL。在浮游幼体培育过程中,幼体密度约为0.5 枚/mL,此时空间适宜,成活率较高。室内水温保持在22~23.3 ℃,盐度保持在29~32,养殖池中24 h微充气。在幼体发育期间,通过光学显微镜观察幼体发育过程,并用电子设备进行拍照,观察记录胚胎和幼体的发育特征及时间,测量相关时期特征数据。各期胚胎和幼体发育时间以随机样本中出现该时期50%的个体为标准。
1.2.5 稚胆培育 八腕幼体变态成为稚胆后,管足开始伸出,此时将培育好的波纹板放入稚胆池中,稚胆通过管足附着在硅藻板上,开始摄食底栖硅藻,纤毛带上的纤毛活动逐渐减弱。每日换水一次,换水量为1/2,保持水质清洁,自然光照,微充气。随着稚胆的生长,开始投喂海带、裙带菜和石莼,每日一次,及时查看,保证海胆的摄食充足。此时进行网箱养殖,将相同大小的同家系海胆置于同一个网箱,以防止因食物竞争导致海胆生长差距过大。另外,仍需防范病害的发生,防止弧菌等病菌滋生,并加强人工管理,勤换水,或进行流水养殖。
波纹板附着基的培育:先将水泥池消毒,取潮间带底栖硅藻,用孔径为50 μm的筛绢网反复筛取后加入池水中,再加入用硅酸钠、过磷酸钙和硫酸铵配制的营养盐,将消毒后的波纹板放入池中,充气,每隔两天换水一次,如有桡足类等敌害生物发生,可加入敌百虫等药物控制。
1.2.6 人工繁育3龄海胆生长指标及性腺指数的测定 将繁育的稚胆继续在实验室养殖3年。于2022年7月9日开始,一周内先后取3批3龄海胆样本,包括产卵的51枚和未产卵的39枚,每批样本30枚。先称量每一枚海胆的活体质量,取其平均值,然后解剖取其性腺,称量湿性腺质量,取其平均值,再计算每一批海胆的性腺指数(IGS),即
IGS=湿性腺质量/活体质量×100%。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS软件进行单因素方差分析,显著性水平设为0.05。
2 结果与分析
2.1 亲胆促熟效果
在亲胆促熟过程中,一般来说,体积越大的海胆性腺发育越好。壳径在2 cm以上的哈氏刻肋海胆产卵量较大。给亲胆注射KCl溶液1.5~5 min后,雌性海胆开始产卵,在灯光下可见卵透明且呈细小球状体;雄性海胆开始排精,精液为白色乳状液体。说明亲胆催熟效果较好。
2.2 人工催产及受精卵观察
在23.7 ℃水温下,给哈氏刻肋海胆亲胆注射KCl溶液1.5~5 min后,亲胆开始产卵、排精。亲胆在产卵、排精时,管足不停摇摆,生殖孔周围的棘在无规则摆动,所排出的精子和卵细胞呈细线状从多个生殖孔排出,随之在海水中散开。2018年9月5日共催产10枚亲胆,其中4枚亲胆产卵,在5倍显微镜下可见均黄卵(图2(a)),带有极体,易沉,在灯光下可见细小透明球体;3枚亲胆产精子,为细线状乳白色液体,排入水体后散成雾状,在40倍显微镜下可见精子呈带有长尾的类似锥形体(图2(b)),精子活性好,不停地无规则游动。取适量精子倒入卵子中进行授精,10 min左右后在5倍镜下可见卵膜(图2(c)),每枚卵子周围有3~5个精子不停游动;受精卵色泽淡黄,外形饱满,无不规则卵,卵膜无破损;受精率较高,为90.6%~96.4%,平均为93.6%±2.1%。在此后又催产3次(表1),每次解剖催产成功的亲胆和未产卵的海胆共30枚,观察其性腺发育情况。
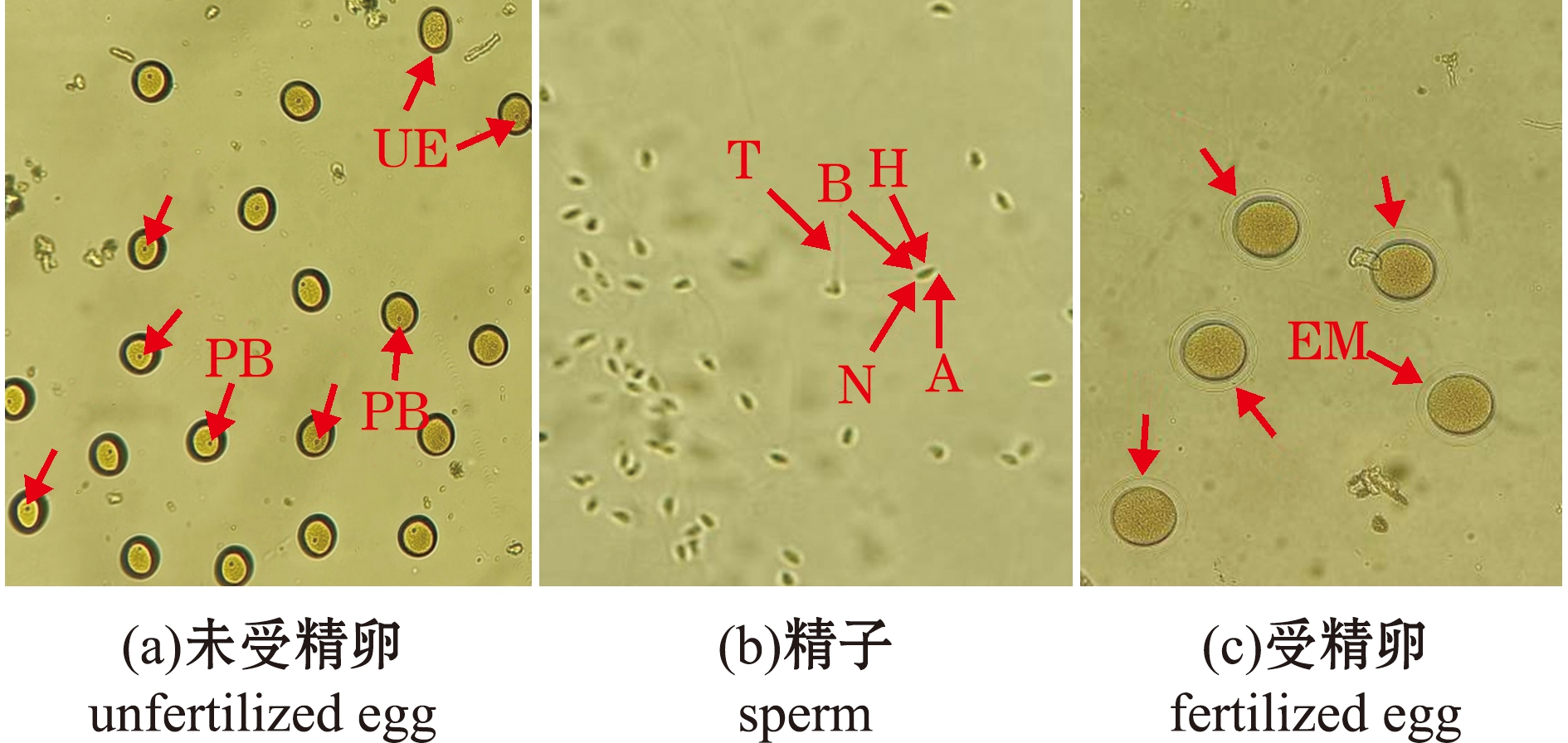
PB—极体;UE—未受精卵;T—尾;H—头;N—颈;A—顶体;EM—卵膜。
PB—polar body;UE—unfertilized egg;T—tail;H—head;N—neck;A—acrosome;EM—egg membrane.
图2 哈氏刻肋海胆的生殖细胞和受精卵
Fig.2 Germ cells and fertilized egg of Temnopleurus hardwickii
表1 哈氏刻肋海胆的催产、受精及孵化
Tab.1 Induced to spawn,fertilization and incubation of the Temnopleurus hardwickii
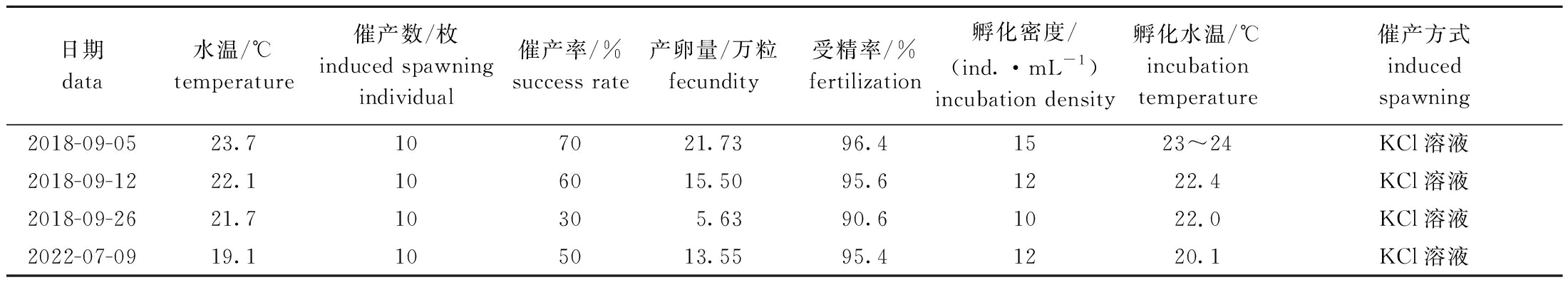
日期data水温/℃temperature催产数/枚induced spawningindividual催产率/%success rate产卵量/万粒fecundity受精率/%fertilization孵化密度/(ind.·mL-1)incubation density孵化水温/℃incubation temperature催产方式induced spawning2018-09-0523.7107021.7396.41523~24KCl溶液2018-09-1222.1106015.5095.61222.4KCl溶液2018-09-2621.710305.6390.61022.0KCl溶液2022-07-0919.1105013.5595.41220.1KCl溶液
2.3 胚胎发育过程
1)卵与受精卵。哈氏刻肋海胆成熟卵细胞卵径为(131.0±13.9)μm,呈淡黄色,当水中不充气时,卵子易沉于水,属于均黄沉性卵。卵呈椭圆形,光学显微镜下卵膜明显,且具有卵膜孔(图3A)。精子进入卵细胞后,卵细胞周围形成一层受精膜,受精卵卵径为(132.71±4.68)μm(图3B,表2)。
表2 哈氏刻肋海胆的胚胎和幼体发育过程
Tab.2 Embryonic and larval development process of Temnopleurus hardwickii
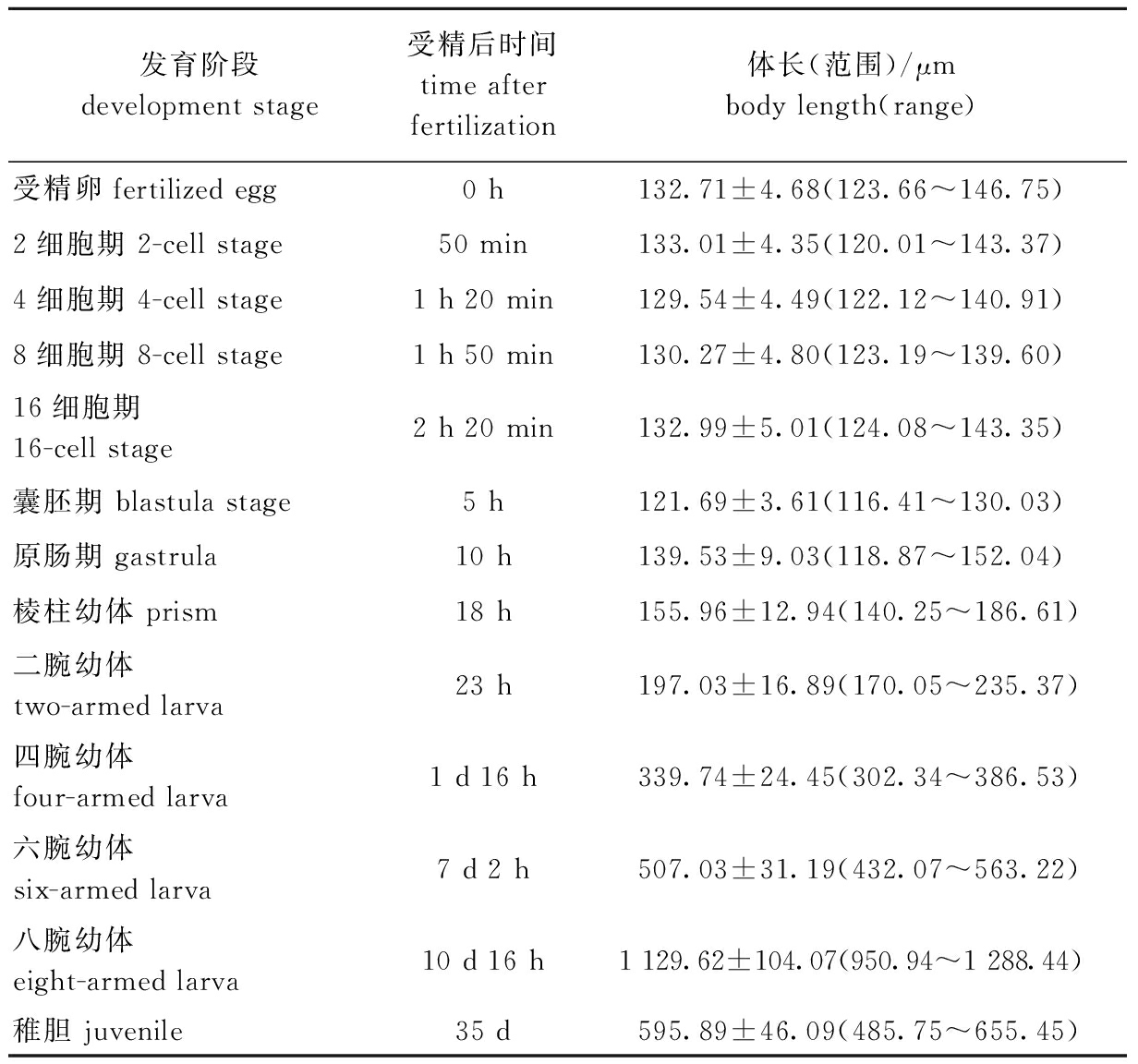
发育阶段 development stage受精后时间 time after fertilization体长(范围)/μm body length(range)受精卵fertilized egg0 h132.71±4.68(123.66~146.75)2细胞期 2-cell stage50 min133.01±4.35(120.01~143.37)4细胞期 4-cell stage1 h 20 min129.54±4.49(122.12~140.91) 8细胞期 8-cell stage1 h 50 min130.27±4.80(123.19~139.60)16细胞期 16-cell stage2 h 20 min132.99±5.01(124.08~143.35)囊胚期 blastula stage5 h121.69±3.61(116.41~130.03)原肠期 gastrula10 h139.53±9.03(118.87~152.04)棱柱幼体 prism18 h155.96±12.94(140.25~186.61)二腕幼体 two-armed larva23 h197.03±16.89(170.05~235.37)四腕幼体 four-armed larva1 d 16 h339.74±24.45(302.34~386.53)六腕幼体 six-armed larva7 d 2 h507.03±31.19(432.07~563.22)八腕幼体 eight-armed larva10 d 16 h1 129.62±104.07(950.94~1 288.44)稚胆 juvenile35 d595.89±46.09(485.75~655.45)
注:以50%个体出现发育阶段的特征为标准。
Note:developmental stage is determined by the developmental characteristics of 50% individuals.

A—卵;B—受精卵;C—2细胞期;D—4细胞期;E—8细胞期;F—16细胞期;G—囊胚期;H—原肠期;I—棱柱幼体期;J—二腕幼体;K—四腕幼体;L—六腕幼体;M—八腕幼体;N、O—稚胆。
A—egg;B—fertilized egg;C—2-cell stage;D—4-cell stage;E—8-cell stage;F—16-cell stage;G—blastula stage;H—gastrula stage;I—prism stage;J—two-armed larva;K—four-armed larva;L—six-armed larva;M—eight-armed larva;N and O—juvenile.
图3 哈氏刻肋海胆胚胎发育过程
Fig.3 Embryonic development of Temnopleurus hardwickii
2)卵裂期。受精卵经50 min左右进入卵裂期。受精卵开始辐射型卵裂,卵细胞中部向内凹陷,分裂成两个相似大小的细胞(图3C),第一次卵裂20 min后进入第二次卵裂,受精卵分裂成4个相似大小的细胞(图3D)。此后每经30 min 进行一次卵裂,历经8细胞期(图3E)、16细胞期(图3F)。
3)囊胚期。受精卵历经约5 h进入囊胚期(图3G)。囊胚期胚胎是由少数几层细胞围成的中空球体,胚胎长度为(121.69±3.61)μm(表2),约2 h 后,囊胚脱去卵膜,开始在水中自主旋转。
4)原肠期。受精卵经过10 h发育后,胚胎进入原肠期(图3H)。原肠期胚胎长度为(139.53±9.03)μm(表2)。原肠期开始时,囊胚植物极出现扁平平面,处在植物极的中胚层细胞开始相互脱离,成为单个细胞并迁移到囊胚腔中,在植物极附近形成两簇细胞团。之后,内胚层细胞整体内陷并延伸形成原肠腔。
2.4 幼体发育过程
1)棱柱幼体。受精卵经过18 h左右发育至棱柱幼体(图3I),幼体体长为(155.96±12.94)μm(表2)。棱柱幼虫的口叶突出,前端呈弧形。幼虫左右两侧的三射骨针已长大,一支伸向幼虫的后端,一支伸至幼虫的前端。此期内,消化道未开通,尚不能摄食,幼虫趋光性较强,多密聚于水表层。
2)二腕幼体。受精卵经过23 h发育形成二腕幼体(图3J)。二腕幼体整体呈三角锥形,其显著特征为肛门所在的平面形成两个锥形的长腕,腕内有骨针支撑,使腕不能弯曲。二腕幼体体长为(197.03±16.89)μm(表2)。此时幼体的肠和胃已基本形成,肠呈细小管状,有开口,为肛门。幼体周围的纤毛不停地摆动,使幼体在水中游动,口上方形成的口前纤毛环不停地摆动。摄食角毛藻时食管开始缓慢蠕动,并伴随胃部和肠的节律性收缩。到二腕幼体后期,幼体体长达到306.15 μm,位于口叶中线的横枝凸起,顶端形成了前侧腕芽突。
3)四腕幼体。受精卵经过1 d 16 h进入四腕幼体期(图3K)。幼体明显长大,体长为(339.74±24.45)μm(表2)。此期幼体的典型特征是口叶凸起,顶端形成2个前侧腕,与之前的2个腕共同构成四腕幼体的4个腕。幼体形态和内部器官发育较快,胃部进一步膨大,摄食量增加,胃部食物清晰可见。
4)六腕幼体。受精卵历经7 d 2 h进入六腕幼体(图3L),体长达到(507.03±31.19)μm(表2)。幼体从前侧腕和口后腕之间的口端面周缘生出2个后背腕,与之前的4个腕共同构成六腕幼体的6个腕。胃部膨大呈卵圆形,颜色变深。体壁变厚,后期幼体反口端顶部逐渐变钝圆。
5)八腕幼体。受精卵历经10 d 16 h进入八腕幼体(图3M)。此阶段最后一对口前腕从前侧腕的内侧生出,与之前的6个腕共同构成八腕幼体的8个腕。幼体体长为(1 129.62±104.07)μm(表2)。后背腕与前侧腕继续生长变得更加宽大,使幼体体宽增加,与体长几乎相等。八腕幼体中期,后背腕与口后腕靠外一侧在与反口端较近的位置出现一条带状凸起,其上密布纤毛。反口端顶部变平,两侧向外扩张形成了2个肉褶。八腕幼体后期,前庭复合体不断增大,将幼体的胃向一侧挤压,后期可见前庭复合体内的初生管足蠕动。
6)稚胆。受精卵历经35 d后进入稚海胆阶段(图3N、O)。八腕幼体末期,幼体的体壁和腕在水中水解,前庭复合体中的初生棘长出体壁,初生触手伸出与外界接触,开始摆动,幼体经过变态成为稚海胆。稚海胆体长为(595.89±46.09)μm(表2),其口面位于原来幼体的左侧面,反口面位于原来幼体的右侧面。依靠初生的5只管足,固着在波纹板及池壁上,并且通过固着开始摄食波纹板上附着的底栖硅藻。随着棘和管足不断生长,数量也在不断增多,管足随着水流不停摆动,稚海胆的活动性增大,在波纹板上可以运动摄食,此时稚海胆生长速度加快,体壁棘和管足仍在不断生长,直至外壳布满棘刺,此后稚海胆基本与亲胆外形相似。
2.5 胚胎及幼体的生长
在23~24 ℃水温下,通过测量胚胎及幼体的体长,绘制其生长曲线。在测量过程中,使用同一台电子显微镜,由同一人测量,每个时期测量的个体数量不少于30个。从图4可见,海胆胚胎及幼体发育过程中,胚胎期卵径会稍微缩小,到幼体期则开始增大,体长开始增长,从二腕幼体到四腕幼体,以及六腕幼体到八腕幼体时,幼体生长有显著性差异(P<0.05);生长到八腕幼体后,体长达到最大,为(1 129.62±104.07)μm,而八腕幼体经过变态到稚胆时,体长则明显缩小,并有显著性差异(P<0.05)。
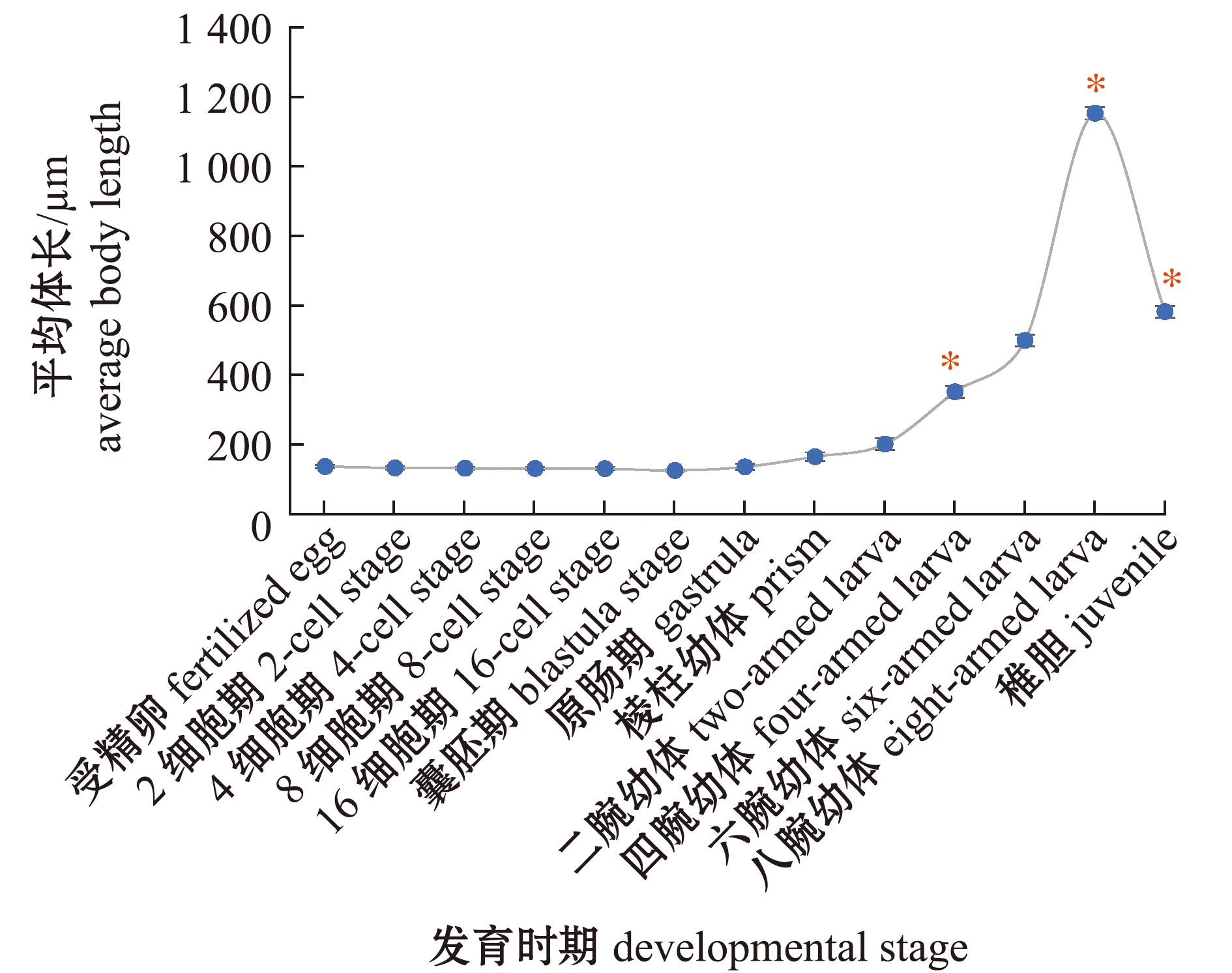
*为该时期相对前一时期生长有显著性差异(P<0.05)。
*,relatively significant difference in growth is compared from the previous growth stage during this period(P<0.05).
图4 哈氏刻肋海胆胚胎及幼体生长曲线
Fig.4 Embryo and larva growth curve of Temnopleurus hardwickii
2.6 稚胆的培育
稚胆培育2~3月后,体长达到0.5~2.0 cm,生长差异较大,这可能与其基因及摄食情况不同有关。此期间,应加强巡视,保证食物充足和水质良好,观察池底是否起弧菌等病原,仔细检查稚胆状态,将大小一致的稚胆置入一个网箱中培育。
2.7 海胆的生长及性腺指数
对3龄人工繁育的哈氏刻肋海胆解剖发现,雌、雄海胆性腺颜色主要呈橙黄色、黄色和黄绿色。产完卵的雌性海胆性腺多呈淡黄绿色、黄色,在解剖镜下呈暗黄色且可见细小的卵细胞;雄性海胆性腺多呈橙黄色、黄色,在解剖镜下可见亮黄色。将雌、雄海胆性腺用体积分数为10%的福尔马林溶液固定在1 mL离心管中,解剖镜观察发现,3种颜色的雌、雄海胆性腺饱满,呈簇状球体(图5)。

A—雌海胆性腺;B—解剖镜下雌海胆性腺;C—雄海胆性腺;D—解剖镜下雄海胆性腺;E—取出的性腺,左雌右雄;F—黄色性腺(♂);G—橙黄色性腺(♂);H—黄色性腺(♀);I—黄绿色性腺(♀);J—黄绿色性腺(♀);Go—性腺;Ee—卵;Se—精液。
A—gonads of female sea urchin;B—anatomical view of gonads of female sea urchin;C—male sea urchin gonads;D—anatomical view of male sea urchin gonads;E—removed gonads,female on the left and male on the right;F—yellow gonad(♂);G—orange yellow gonad(♂);H—yellow gonad(♀);I—yellowish green gonad(♀);J—yellowish green gonad(♀);Go—Gonad;Ee—egg;Se—semen.
图5 3龄哈氏刻肋海胆性腺观察
Fig.5 Observation of gonads of the 3 years old Temnopleurus hardwickii
对3龄人工繁育的哈氏刻肋海胆性腺指数分3次进行取样测定,每次隔两天。计算结果表明,3龄哈氏刻肋海胆的平均性腺指数为7%~12%(表3),此时海胆已达性成熟,注射0.5 mol/L的KCl溶液即可进行催产,开展人工繁育。
表3 3龄人工繁殖哈氏刻肋海胆的生长及性腺指数
Tab.3 Growth and gonado-somatic index(GSI)of the 3 years old Temnopleurus hardwickii by artificial reproduction

样本批号No.样本数量number of sample平均壳径/mmaverage test diameter平均壳高/mmaverage shell height平均活体质量/gaverage live body weight平均性腺湿质量/gaverage gonadal wet weight性腺指数/%GSI取样温度/℃temperature13021.02±1.5913.69±0.903.980±0.6960.280±0.0817.0419.123021.63±1.3012.89±0.492.660±0.3540.31±0.06011.6520.833018.10±0.5411.54±0.502.900±0.3200.290±0.05310.0020.3
3 讨论
3.1 哈氏刻肋海胆的生殖特征
海胆在生殖过程中,产卵、排精不仅受水流、温度等环境因素的影响,还与月盈月亏有着较大关系[7]。本研究中所用的哈氏刻肋海胆亲本采自大连市黄泥川海域,7—9月份是哈氏刻肋海胆的高产期,9月份达到最高峰[7]。哈氏刻肋海胆在性腺成熟时,雌性性腺颜色较深,雄性性腺颜色鲜艳,雌、雄性腺颜色具有明显差异,这与常亚青等[8]得出的马粪海胆性腺的颜色亮度值(L*)、红度值(a*)和黄度值(b*),在雌、雄海胆间具有极显著性差异的研究结果相似。哈氏刻肋海胆卵子直径为131 μm左右,形态特征与中间球海胆等其他海胆卵子相似,在排卵时极体已经排出[9],此时向卵细胞中加入适量精液,即可开始人工授精,在光学显微镜下观察到每个卵周围有5个精子,此时精子适量[10]。受精后的卵细胞可见类似小圆点的第二极体放出,特征明显。在养殖过程中还发现,换水、温差过大和干露情况下均会发生零星产卵现象[11]。
3.2 哈氏刻肋海胆胚胎及幼体发育特征
哈氏刻肋海胆生长速度较快,胚胎时间短。本研究中,哈氏刻肋海胆受精后50 min时进入卵裂期,快于29.22~30.18 ℃下的紫海胆(Anthocidaris crassispina)进入卵裂期的时间(1 h 30 min)[12],稍慢于25.8~27.5 ℃下的白棘三列海胆(Teipneustes gratilla)进入卵裂期的时间(40 min)[13],快于17~21 ℃下的马粪海胆(Hemicentfotus pulcherrimus)[14] 和25~26 ℃下的高腰海胆(Mespilia globulus)[6]进入卵裂期的时间(分别为1 h 30 min和1 h)。哈氏刻肋海胆分别在受精后5、10 h时进入囊胚期和原肠期,与20~24 ℃下的光棘球海胆(Mesocentrotus nudus)[15]和中间球海胆( S. intermedius)[16]进入囊胚期的时间接近,与白棘三列海胆[13]进入囊胚期和原肠期的时间接近,慢于紫海胆[12],但快于马粪海胆[14]和高腰海胆[6]。哈氏刻肋海胆进入棱柱期的时间(18 h)快于马粪海胆[14]和高腰海胆[6](表4)。
在幼体发育时期,哈氏刻肋海胆进入四腕幼体、六腕幼体、八腕幼体的时间分别为1 d 16 h、7 d 2 h和10 d 16 h,与白棘三列海胆进入四腕幼体的时间接近,但整体进入速度快于白棘三列海胆[13]、马粪海胆[14]、光棘球海胆[15]和中间球海胆[16](表4)。
表4 哈氏刻肋海胆与其他海胆胚胎发育时序比较
Tab.4 Comparison of embryonic developmental timing of Temnopleurus hardwickii with other sea urchins
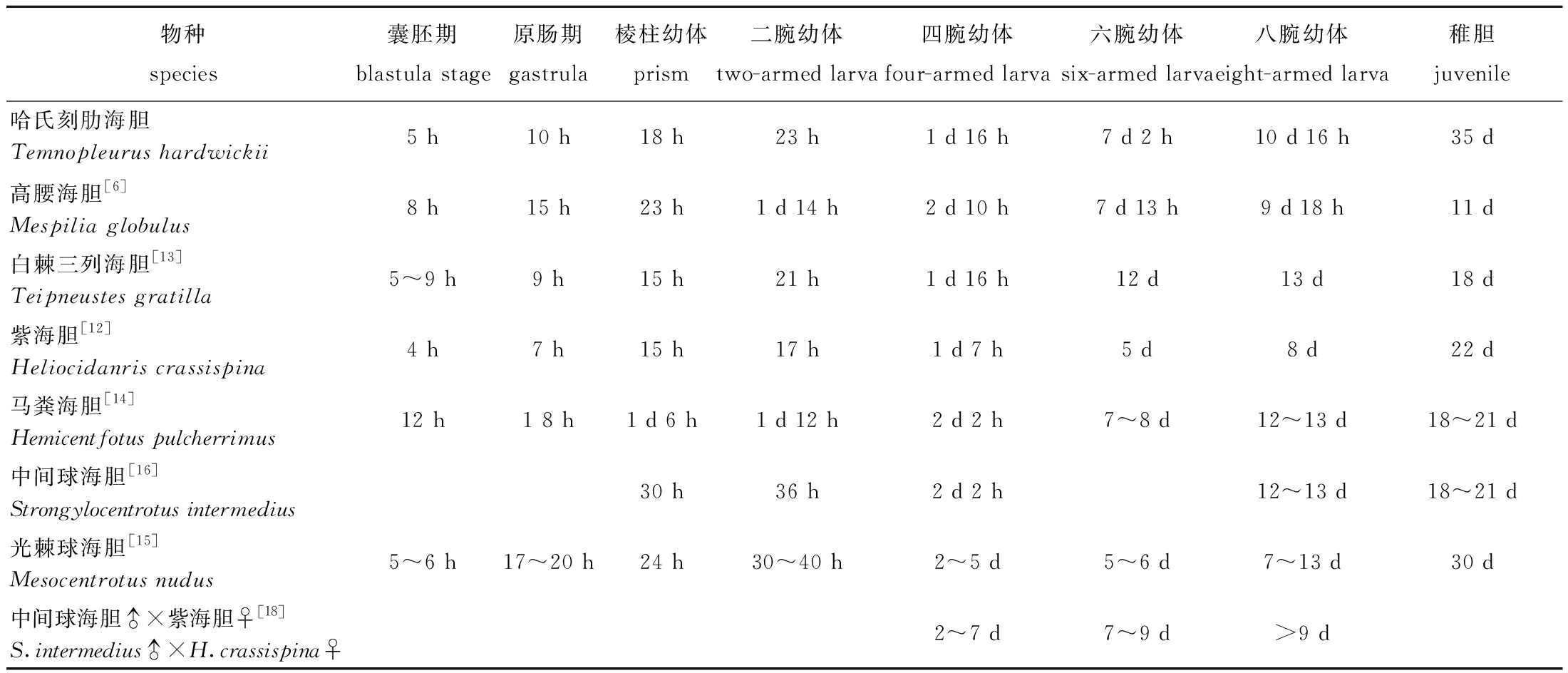
物种species囊胚期blastula stage原肠期gastrula棱柱幼体prism二腕幼体two-armed larva四腕幼体four-armed larva六腕幼体six-armed larva八腕幼体eight-armed larva稚胆juvenile哈氏刻肋海胆Temnopleurus hardwickii5 h10 h18 h23 h1 d 16 h7 d 2 h10 d 16 h35 d高腰海胆[6]Mespilia globulus8 h15 h23 h1 d 14 h2 d 10 h7 d 13 h9 d 18 h11 d白棘三列海胆[13]Teipneustes gratilla5~9 h9 h15 h21 h1 d 16 h12 d13 d18 d紫海胆[12]Heliocidanris crassispina4 h7 h15 h17 h1 d 7 h5 d8 d22 d马粪海胆[14]Hemicentfotus pulcherrimus12 h1 8 h1 d 6 h1 d 12 h2 d 2 h7~8 d12~13 d18~21 d中间球海胆[16]Strongylocentrotus intermedius30 h36 h2 d 2 h12~13 d18~21 d光棘球海胆[15]Mesocentrotus nudus5~6 h17~20 h24 h30~40 h2~5 d5~6 d7~13 d30 d中间球海胆♂×紫海胆♀[18]S.intermedius♂×H.crassispina♀2~7 d7~9 d>9 d
在外形上,哈氏刻肋海胆在胚胎期时,细胞期、桑葚期、囊胚期、原肠期的形态与光棘球海胆、中间球海胆、高腰海胆等[6,15-16]除卵径外并无太大的区别;在棱柱幼体时,哈氏刻肋海胆一侧形成平面,原肠分化成胃、口和肠,出现了后口腕,两侧骨针开始生长,这与马粪海胆[14]、中间球海胆[16]相似;在二腕幼体时,两侧骨针生长形成弧形顶,这与高腰海胆[6]、紫海胆[12]和白棘三列海胆[13]类似,而中间球海胆[16]、光棘球海胆[15]和马粪海胆两侧骨针相交合形成顶尖。四腕幼体时,哈氏刻肋海胆骨针断裂,形成椭圆形顶,出现两个前侧腕,胃部食物明显,口腕伸长,器官更加明显,这与高腰海胆[6]、紫海胆[12]比较相似,比中间球海胆[16]、光棘球海胆[15]和白棘三列海胆[13]的腕宽。在六腕幼体时,哈氏刻肋海胆后背腕长出,体壁加厚,胃颜色加深,这与高腰海胆[6]、紫海胆[12]相似,腕继续变宽,骨针继续断裂变成钝圆形,中间球海胆[16]、光棘球海胆[17]和白棘三列海胆[13]的骨针同样断裂,形成钝圆顶;在八腕幼虫时,哈氏刻肋海胆口前腕生出,其他腕继续增大,前庭复合体不断增大,将胃挤向一侧,可见初生管蠕动,这与高腰海胆[6]、中间球海胆[16]相似(表5)。可见,从二腕幼体到八腕幼体,哈氏刻肋海胆的腕比其他一些海胆宽,不同种类的海胆腕的增长不尽相同,腕的生长时期也各不相同,直到后期附着在硅藻板,各个时期的海胆腕的形状和生长速度也存在一定的差异。
表5 哈氏刻肋海胆与其他海胆体长发育比较
Tab.5 Comparison of body length development of Temnopleurus hardwickii with other sea urchins μm
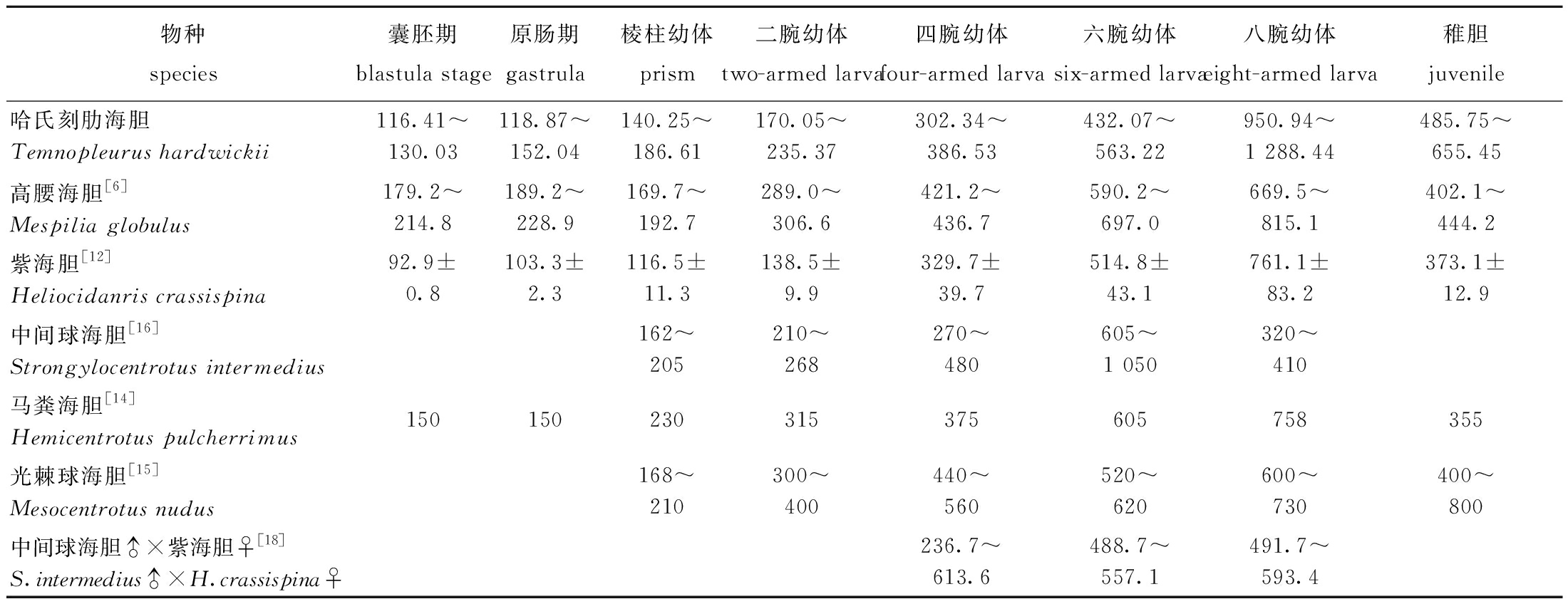
物种species囊胚期blastula stage原肠期gastrula棱柱幼体prism二腕幼体two-armed larva四腕幼体four-armed larva六腕幼体six-armed larva八腕幼体eight-armed larva稚胆juvenile哈氏刻肋海胆Temnopleurus hardwickii116.41~130.03118.87~152.04140.25~186.61170.05~235.37302.34~386.53432.07~563.22950.94~1 288.44485.75~655.45高腰海胆[6]Mespilia globulus179.2~214.8189.2~228.9169.7~192.7289.0~306.6421.2~436.7590.2~697.0669.5~815.1402.1~444.2紫海胆[12]Heliocidanris crassispina92.9±0.8103.3±2.3116.5±11.3138.5±9.9329.7±39.7514.8±43.1761.1±83.2373.1±12.9中间球海胆[16]Strongylocentrotus intermedius162~205210~268270~480605~1 050320~410马粪海胆[14]Hemicentrotus pulcherrimus150150230315375605758355光棘球海胆[15]Mesocentrotus nudus168~210300~400440~560520~620600~730400~800中间球海胆♂×紫海胆♀[18]S.intermedius♂×H.crassispina♀236.7~613.6488.7~557.1491.7~593.4
3.3 哈氏刻肋海胆的繁殖生物学
在哈氏刻肋海胆养殖过程中,水质、饵料和人工管理等方面显得尤为重要。在哈氏刻肋海胆亲胆促熟过程中,通过慢升温、保证饵料充足等手段均可促熟,使性腺更加丰满,与中间球海胆的促熟相似[16]。梁其旭等[10]在2021年紫海胆的人工育苗中指出,也可通过投喂牡蛎等肉类食物进行催熟。海胆催产的方法较多,包括阴干、流水、电刺激和渗透压等,在实际操作过程中,较常用的还是KCl溶液注射法[16]。海胆是否能够产出生殖细胞,关键在于性腺的发育程度,哈氏刻肋海胆性腺形态和颜色与中间球海胆等稍有不同,雌、雄海胆的性腺颜色亦有不同,这可能是由于雌、雄性腺中组成成分不同导致的[19]。在水温23~24 ℃、盐度29~32条件下,哈氏刻肋海胆能够正常生长,附板后其以底栖硅藻为食,之后以海带等褐藻为食,哈氏刻肋海胆为杂食性,对绿藻(如石莼等)和肉类亦食,这与大连紫海胆食性相似[20]。在繁育过程中,病害对哈氏刻肋海胆也有较大的威胁,如黑嘴病、弧菌病等。因此,在哈氏刻肋海胆繁殖过程中,不仅要精准地控制繁殖条件和保持饵料的充足,而且要防止病害的发生。
4 结论
1)在水温23~24 ℃、盐度29~32、海胆幼体培育密度为0.5 ind./mL、投喂饵料牟氏角毛藻的条件下,可以实现在室内对哈氏刻肋海胆的人工育苗,并进行大量增殖。哈氏刻肋海胆幼体培育周期较短,从受精卵到八腕幼体仅需要10 d左右,饵料投喂成本低,生长周期快,人工管理较为容易,易于大量繁殖。
2)使用0.5 mol/L的KCl溶液催产效果较好。在促熟过程中,投喂海带、裙带菜及少量煮熟的贻贝等对哈氏刻肋海胆的促熟效果较好。在胚胎及幼体发育过程中,从四腕幼体时体长显著增长,而从八腕幼体变态成稚胆时,体长又显著缩小。在稚胆的培育中,哈氏刻肋海胆生长显著,偏好海带和裙带菜,需要保证饵料充足,将大小相同的海胆置于同一网箱中饲养,以减小食物竞争。
3)哈氏刻肋海胆的大量繁殖有利于缓解对其他地区供应的问题,经过人工繁育的哈氏刻肋海胆生命力增强,从而减少了运输途中的死亡率。哈氏刻肋海胆的人工繁育成功,极大地缓解了自然捕捞的压力,为保护自然野生种和促进生态建设及提高经济效益具有一定的积极作用。
[1] 刘成龙,曾晓起.刻肋海胆属三种刻肋海胆形态多变量分析和基于线粒体基因系统发育学探究[C]//“全球变化下的海洋与湖沼生态安全”学术交流会论文摘要集.南京:中国海洋湖沼学会,2014:110-111.
LIU C L,ZENG X Q.Morphological multivariate analysis of three species of sea urchins and a study based on mitochondrial gene phylogeny[C]//Abstract of the academic exchange conference on the ecological security of oceans and lakes under global change.Nanjing:China Society of Oceanology and Limnology,2014:110-111.(in Chinese)
[2] 曾晓起,张文峰,高天翔.基于线粒体16S rRNA与COI基因序列的刻肋海胆属系统发育研究[J].中国海洋大学学报(自然科学版),2012,42(6):47-51.
ZENG X Q,ZHANG W F,GAO T X.Molecular phylogenetics of genus Temnopleurus based on 16S rRNA and COI sequences[J].Periodical of Ocean University of China(Natural Science Edition),2012,42(6):47-51.(in Chinese)
[3] 张文峰.3种刻肋海胆的形态学与遗传学及中国刻肋海胆科分类学研究[D].青岛:中国海洋大学,2011.
ZHANG W F.Studies on the morphology and genetics of Temnopleurus and the taxonomy of Temnopleuridae inshore water of China Sea[D].Qingdao:Ocean University of China,2011.(in Chinese)
[4] 喻倩.不同生境下的浅海大型底栖动物群落特征解析:以日本福岛町为例[D].上海:上海海洋大学,2013.
YU Q.Macrobenthos communities under different habitat—Fukushima-Cho as an example[D].Shanghai:Shanghai Ocean University,2013.(in Chinese)
[5] YAGUCHI S,MORINO Y,SASAKURA Y.Development of marine invertebrates[M].Japanese marine life.Singapore:Springer Singapore,2020:109-124.
[6] 王宝锋,张伟杰,胡方圆,等.高腰海胆胚胎及幼体发育过程[J].大连海洋大学学报,2019,34(4):526-530.
WANG B F,ZHANG W J,HU F Y,et al.Embryonic and larval development of sea urchin Mespilia globulus[J].Journal of Dalian Ocean University,2019,34(4):526-530.(in Chinese)
[7] KOBAYASHI N.Spawning periodicity of sea urchins at seto-i.mespilia globulus[J].Publications of the Seto Marine Biological Laboratory,1967,14(5):403-414.
[8] 常亚青,张伟杰,丁君,等.虾夷马粪海胆不同家系和性别间性腺性状的比较[J].水产学报,2010,34(7):1080-1088.
CHANG Y Q,ZHANG W J,DING J,et al.Comparison of gonad traits among families and between genders of the sea urchin Strongylocentrotus intermedius[J].Journal of Fisheries of China,2010,34(7):1080-1088.(in Chinese)
[9] 高绪生,常亚青.中国经济海胆及其增养殖[M].北京:中国农业出版社,1999.
GAO X S,CHANG Y Q.Chinese economic sea urchin and its aquaculture[M].Beijing:China Agriculture Press,1999.(in Chinese)
[10] 梁其旭,张丽莉,王国栋,等.紫海胆人工育苗技术的改进[J].集美大学学报(自然科学版),2021,26(6):481-488.
LIANG Q X,ZHANG L L,WANG G D,et al.Improvement on the artificial seed rearing technology of Anthocidaris crassispina[J].Journal of Jimei University (Natural Science Edition),2021,26(6):481-488.(in Chinese)
[11] WASSON K,WATTS S.Endocrine regulation of echinoid reproduction[J].Developments in Aquaculture &Fisheries Science,2013,38(13):59-67.
[12] 席世改.紫海胆胚胎与幼体发育研究[D].天津:天津农学院,2020.
XI S G.Embryonic and larval development of purple sea urchin Anthocidaris crassispina[D].Tianjin:Tianjin Agricultural University,2020.(in Chinese)
[13] 蒲利云.白棘三列海胆繁殖生物学研究[D].海口:海南大学,2009.
PU L Y.Research progress on reproductive biology of Tripneustes gratilla Linnaeus[D].Haikou:Hainan University,2009.(in Chinese)
[14] 张鹏.马粪海胆(Hemicentrotus pulcherrimus)早期发育及成体能量代谢的研究[D].青岛:中国海洋大学,2004.
ZHANG P.Experimental studies on the larval development and individual energy budget of sea urchin,Hemicentrotus pulcherrimus[D].Qingdao:Ocean University of China,2004.(in Chinese)
[15] 王波,张建中,施岩.光棘球海胆育苗技术的初步研究[J].黄渤海海洋,1993,11(2):55-61.
WANG B,ZHANG J Z,SHI Y.A study on seedling rearing technic of purple sea urchin (Strongylocentrotus nudus)[J].Journal of Oceanooraphy of Huanghai &Bohai Seas,1993,11(2):55-61.(in Chinese)
[16] 曹学彬,常亚青.我国主要经济海胆的工厂化育苗技术[J].渔业现代化,2007,34(4):30-32,43.
CAO X B,CHANG Y Q.Main economy sea urchin factory breeding technology of China[J].Fishery Modernization,2007,34(4):30-32,43.(in Chinese)
[17] 田晓飞,常亚青,张伟杰,等.中间球海胆、光棘球海胆自繁和杂交后代幼体发育及对高温的反应[J].大连海洋大学学报,2014,29(5):431-438.
TIAN X F,CHANG Y Q,ZHANG W J,et al.Development and heat responses of larvae self propagated and hybridized from sea urchins Strongylocentrotus intermedius and S.nudus[J].Journal of Dalian Ocean University,2014,29(5):431-438.(in Chinese)
[18] 经晨晨,张伟杰,宋坚,等.中间球海胆与紫海胆种间杂交的受精、孵化和幼体发育研究[J].大连海洋大学学报,2015,30(6):620-626.
JING C C,ZHANG W J,SONG J,et al.Fertilization,hatching and larval development of sea urchin hybrid between Strongylocentrotus intermedius and Heliocidanris crassispina[J].Journal of Dalian Ocean University,2015,30(6):620-626.(in Chinese)
[19] 廖承义,邱铁凯.大连紫海胆人工育苗的初步研究[J].山东海洋学院学报,1985,15(4):71-81.
LIAO C Y,QIU T K.A preliminary study on artificial cultivation of purple sea urchin in Dalian Strongylocentrotus nudus[J].Journal of Shandong College of Oceanology,1985,15(4):71-81.(in Chinese)
[20] 高绪生,孙勉英,李国友,等.大连紫海胆食性的初步探讨[J].水产学报,1990,14(3):227-232.
GAO X S,SUN M Y,LI G Y,et al.Preliminary study on feeding habits of purple sea urchin Strongylocetrotus nudus[J].Journal of Fisheries of China,1990,14(3):227-232.(in Chinese)