银鼓鱼(Selenotoca multifasciata),又称为多纹钱蝶鱼,隶属于辐鳍鱼纲(Actinopterygii)鲈形目(Perciformes)金钱鱼科(Scatophagidae),广泛分布于澳大利亚、菲律宾和泰国等地的江河入海口,在中国东海南部至南海,以及北部湾区域亦有分布,该鱼栖息于海湾、河口、红树林及淡水河流和小溪的下游,目前,已开始在广东省、海南省和广西壮族自治区的网箱和池塘中大量养殖。银鼓鱼属于偏植食性的杂食性海水鱼类,具有耐高温和广盐的特性,其肉质嫩滑鲜美,深受广大消费者的喜爱,是一种兼具观赏和食用价值的重要经济鱼类。有关银鼓鱼的研究报道,主要涉及其胚胎发育、胚后发育观察[1-2]及对其完整线粒体基因组的测序[3]等方面,但对银鼓鱼的病害研究鲜见报道,仅见罗璋等[4]从天津某观赏鱼养殖场银鼓鱼中分离出一株海豚链球菌(Streptococcus iniae)。
2021年,北部湾地区银鼓鱼养殖场病害频发,造成大批量死亡。本研究中,对现场采集的患病银鼓鱼进行病原菌的分离鉴定,并全面开展了组织病理学、人工感染、毒力基因检测及药物敏感性等较为系统的研究,以期为后续北部湾地区银鼓鱼养殖中的病害防控提供科学依据。
1 材料与方法
1.1 材料
患病银鼓鱼于2021年分别采自广东省湛江市坡头区南三镇、廉江市和广西北海市的3个不同养殖场,从每个养殖场采集3尾,体长为(18±4)cm。回归感染试验用健康银鼓鱼体长为10~15 cm,购自湛江市某养殖场。
试剂:BHI液体培养基、BHI琼脂培养基、M-H血琼脂培养基和革兰氏染色试剂均购自青岛海博生物技术有限公司;血琼脂平板培养基购自广州环凯微生物有限公司;HE染色试剂盒购自北京索莱宝科技有限公司;PCR所用试剂购自宝生物(大连)有限公司;细菌生化微量鉴定管、药敏纸片购自杭州滨和微生物试剂有限公司;细菌DNA提取试剂盒购自北京天根生化科技有限公司;引物合成由生工生物工程(上海)股份有限公司完成;海豚链球菌ATCC29178株购自美国ATCC菌种保藏中心。
1.2 方法
1.2.1 组织病理学观察 取自然感染发病银鼓鱼的脑、心和肝脏等组织,迅速置于体积分数为10%的中性福尔马林中,固定24 h后,用乙醇进行梯度脱水,二甲苯透明、石蜡包埋后进行切片(4~6 μm),使用HE染色剂试剂盒进行染色,用中性树胶将切片封藏于玻片上,在显微镜下观察并对典型病变组织进行拍照。
1.2.2 病原菌的分离纯化 用体积分数为75%的乙醇棉球反复擦拭患病银鼓鱼体表后,在无菌条件下进行解剖,观察记录其内部器官的病症,取其脑、脾脏和肝脏组织,用无菌水冲洗、研磨,划线接种于BHI琼脂培养基,倒置于生化培养箱,28 ℃下培养24~48 h后,挑取优势单菌落在BHI琼脂培养基上反复划线纯化2~3次,获得纯化菌株。挑取纯化后的菌落于BHI液体培养基中扩大培养,并进行后续鉴定工作。
1.2.3 分离菌株的鉴定
1)菌落和菌体形态观察。用接种环挑取纯化后的单菌落,接种于血琼脂平板培养基上,倒置于生化培养箱,在28 ℃下培养24~48 h后,挑取单菌落制备菌液涂片,使用革兰氏染色试剂进行染色,观察其菌落形态及菌体形态并进行拍照。
2)生理生化鉴定。挑取纯化后的单菌落接种于细菌微量生化反应管中,倒置于生化培养箱,在28 ℃下培养24~48 h,以参考菌株ATCC29178作为阳性对照,根据《伯杰氏系统细菌学手册》[5]对菌株培养结果进行初步鉴定。
3)16S rRNA序列分析。利用细菌DNA提取试剂盒提取分离菌株的DNA,使用细菌16S rRNA通用引物27F(5′AGAGTTTGATCCTGGCTCAG 3′)和1492R(5′GGTTACCTTGTTA CGACTT 3′)对分离菌株的16S rRNA基因进行扩增。PCR体系(20 μL):上、下游引物各1 μL,DNA模板1 μL,Ex-Taq 10 μL,用ddH2O补足至20 μL。PCR反应程序:95 ℃下预变性5 min;95 ℃下变性30 s,56 ℃下退火1.5 min,72 ℃下延伸1 min,共进行36个循环;最后在72 ℃下再延伸5 min。PCR产物经电泳检测验证后送至生工生物工程(上海)股份有限公司进行测序。将分离菌株的16S rRNA序列与GenBank数据库中已知核酸序列进行BLAST分析。采用MEGA 5.0软件,将分离株(BBW S1、BBW S2和BBW S3)与其他细菌的16S rRNA核苷酸序列一起构建系统发育树,节点的置信度检验采取Bootstrap分析(1 000个循环)。
1.2.4 人工回归感染试验 回归感染试验于广东海洋大学海洋生物研究基地室内养殖桶(体积为0.1 m3)中进行,水温控制在28 ℃,24 h持续充气,每天换水量为1/3,每日投喂两次商品配合饲料。将分离获得的菌株接种于BHI液体培养基,培养18~24 h后,用无菌PBS制成不同浓度的菌悬液。试验前随机取5尾实验室暂养14 d的健康银鼓鱼进行解剖,检测确认其无细菌、寄生虫和病毒感染后,将试验鱼随机分为6组,每组30尾。试验组银鼓鱼每尾腹腔注射0.2 mL浓度分别为1.5×104、1.5×105、1.5×106、1.5×107、1.5×108 CFU/mL的菌悬液,对照组注射等量无菌PBS。接种后观察并记14 d内鱼的发病死亡情况,及时剖检濒死试验鱼,并再次对其致病菌进行分离鉴定。使用改进的寇氏法[6]计算半数致死量(LD50)。
1.2.5 海豚链球菌主要毒力基因的PCR检测 毒力基因pgmA和cfi的引物参照熊向英等[7]的方法设计合成,其余毒力基因scpI、simA、pdi、sagA和cpsD的引物参照Baums等[8]的方法设计合成。用PCR检测分离菌株携带scpI、simA、pdi、sagA、cpsD、pgmA和cfi 7个主要毒力基因的情况,各毒力基因的引物序列、目的片段大小及退火温度见表1。PCR体系20 μL,同“1.2.3节”16S rRNA的PCR扩增。PCR反应程序:95 ℃下预变性5 min;95 ℃下变性30 s,按各基因的退火温度(表1),退火1 min,72 ℃下延伸1 min,共进行36个循环;最后在72 ℃下再延伸5 min。取5 μL PCR扩增产物,用10 g/L琼脂糖凝胶进行电泳,检测PCR扩增反应产物和长度。
表1 海豚链球菌主要毒力基因的引物信息
Tab.1 Primer information of the main virulence genes of Streptococcus iniae

基因 gene序列(5'-3') sequence (5'-3')目标条带/bp product size退火温度/℃ annealing temperature参考文献 referencepgmAF:TATTAGCTGCTCACGGCATCR:TTAGGGTCTGCTTTGGCTTG48955熊向英等[7]cfiF:GTGCCTCAACATCAAACAR:TAGCAAATCCCATATCAA32846.5熊向英等[7]scpIF:GCAACGGGTTGTCAAAAATCR:GAGCAAAAGGAGTTGCTTGG82253.5Baums等[8]simAF:AATTCGCTCAGCAGGTCTTGR:AACCATAACCGCGATAGCAC99455.5Baums等[8]pdiF:TTTCGACGACAGCATGATTGR:GCTAGCAAGGCCTTCATTTG38154Baums等[8]sagAF:AGGAGGTAAGCGTTATGT-TACR:AAGAAGTGAATTACTTTGG19047Baums等[8]cpsDF:TGGTGAAGGAAAGTCAACCACR:TCTCCGTAGGAACCGTAAGC53456Baums等[8]
1.2.6 药敏试验 采用K-B法[9]测定分离菌株对18种抗菌药物的敏感性。将分离菌株菌悬液浓度稀释至 1.0×108 CFU/mL,均匀涂布于M-H血琼脂培养基,贴上药敏纸片,倒置于生化培养箱,在28 ℃下培养24 h后,使用游标卡尺测量抑菌圈大小,并按照产品说明书判定菌株的耐药性,试验设置3个重复并取其平均值。
2 结果与分析
2.1 患病银鼓鱼的临床症状
患病银鼓鱼离群独游,靠岸打转,体表特征为腹部肿胀,鳍基部充血发红(图1A),眼球突出、充血(图1B);剖检发现,肠道内有积水或黄色黏液,肝脏萎缩、发黄(图1C)。
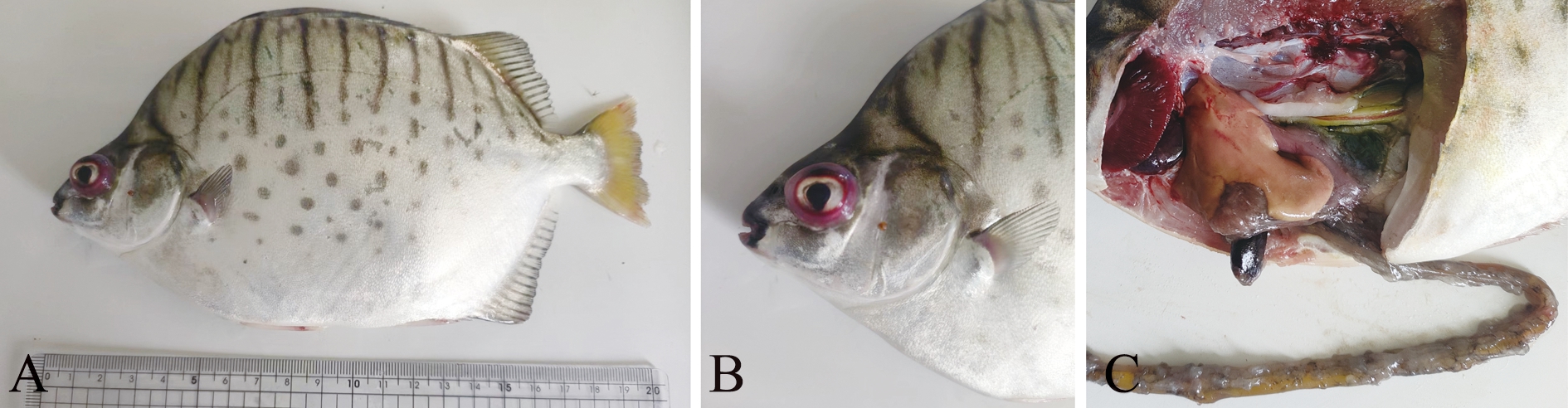
A—鳍基部充血发红;B—眼球突出、充血;C—肠道积液、肝脏萎缩。
A—red and congested fins;B—exophthalmos and hyperemia;C—intestinal effusion and liver atrophy.
图1 患病银鼓鱼的临床症状
Fig.1 Clinical syndrome of diseased Selenotoca multifasciata
2.2 组织病理学变化
对患病银鼓鱼进行组织病理观察发现,各组织器官均有不同程度的病变。患病的银鼓鱼脑膜增厚,伴随着毛细血管充血,大量淋巴细胞浸润(图2A),且脑膜疏松水肿(图2B);眼球的脉络膜血管细胞崩解、脱落(图2C);心外膜增厚且伴随着炎性细胞浸润(图2D);肝实质出现空泡变性,肝细胞有多灶性坏死(图2E);脾实质组织多处液化坏死、疏松(图2F),伴随着充血,炎性细胞浸润;肾小管萎缩、溶解 (图2G);鳃基部细胞增生伴有充血(图2H);肠道出现空泡样结构,肠黏膜破裂受损(图2I)。
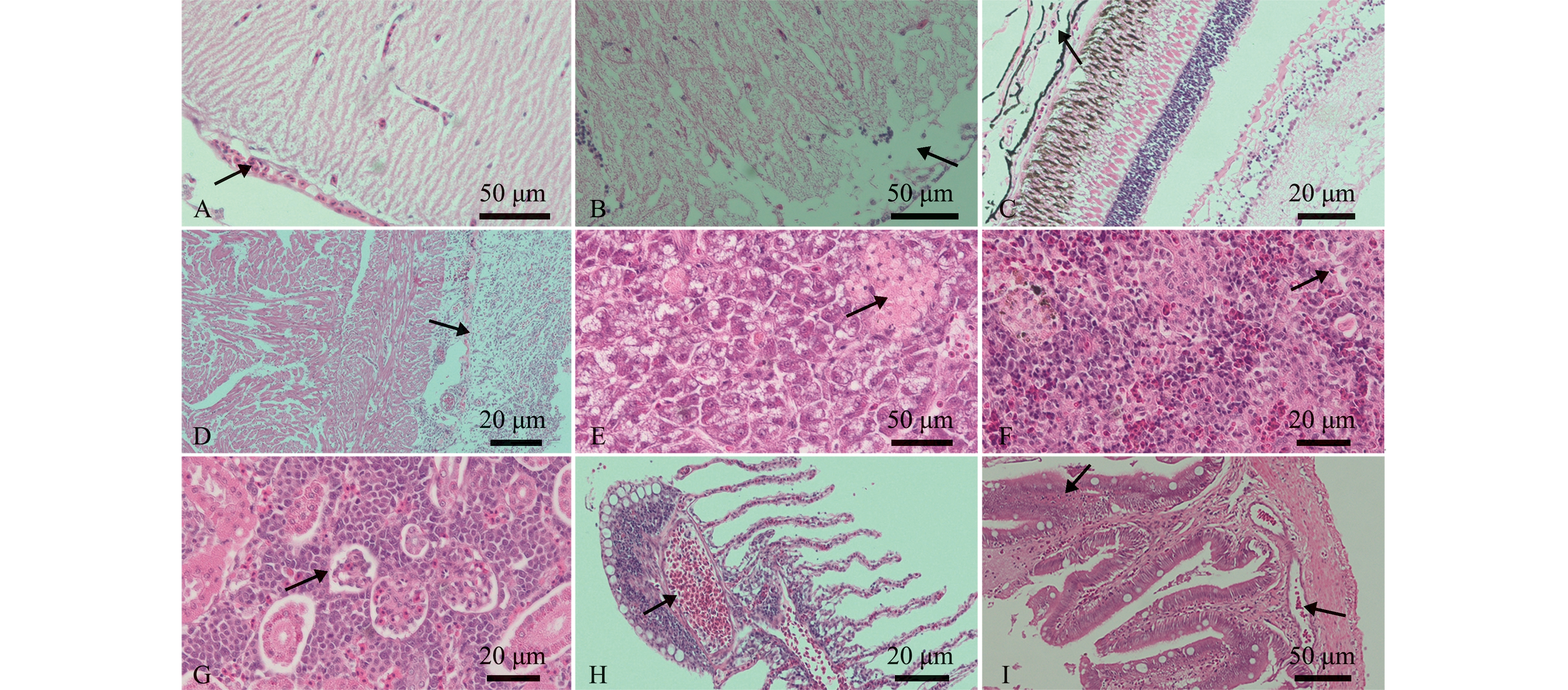
A—脑膜增厚;B—脑膜疏松水肿;C—脉络膜血管细胞崩解、脱落;D—心外膜增厚;E—肝实质空泡变性,肝细胞坏死;F—脾组织坏死;G—肾小管萎缩;H—鳃细胞充血增生;I—肠道出现空泡样结构,肠黏膜脱落。
A—meningeal thickening;B—rarefaction edema of meninges;C—disintegration and abscission of choroidal vascular cells;D—epicardial thickening;E—vacuolar degeneration of liver parenchyma,hepatocyte necrosis;F—spleen tissue necrosis;G—renal tubule atrophy;H—hyperemia and proliferation of gill cells;I—vacuole structures of intestine,intestinal mucosal abscission.
图2 患病银鼓鱼的组织病理学变化
Fig.2 Histopathological changes of the diseased Selenotoca multifasciata
2.3 病原菌分离鉴定
2.3.1 病原菌分离与形态学观察 从湛江市南三镇、廉江市和北海市3个不同养殖场的患病银鼓鱼组织中分别分离得到1株优势菌株,命名为BBW S1、BBW S2和BBW S3。3株分离菌株在BHI培养基中培养24 h后,均形成圆形、中央隆起、边缘光滑、直径约为0.7 mm的乳白色菌落,同时在血琼脂平板培养基上生长产生β溶血(透明溶血环)的菌落(图3A),经革兰氏染色后镜检观察,均为紫色链状革兰氏阳性菌(图3B)。
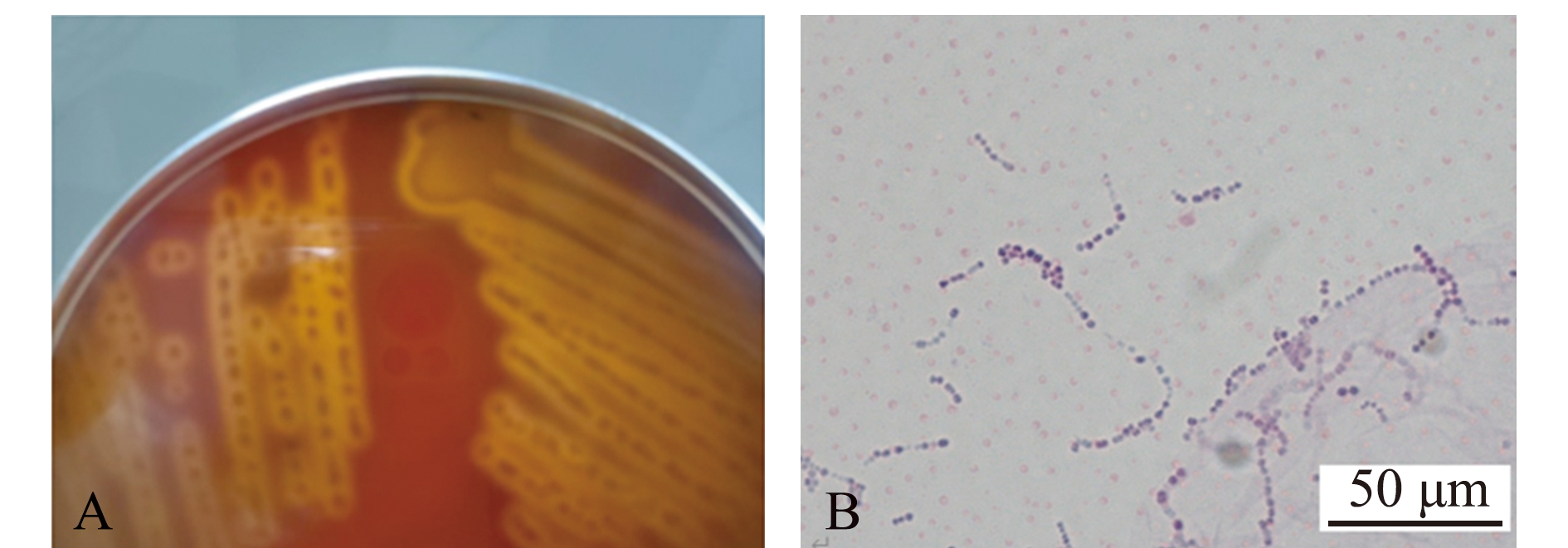
A—血琼脂平板菌落形态;B—革兰氏染色后菌体的显微观察。
A—colony morphology on blood agar;B—microscopic observation of bacterial strains after Gram staining.
图3 分离菌株的菌落和菌体形态特征
Fig.3 Colony and morphological characteristics of isolated strains
2.3.2 生理生化鉴定 从表2可见,3株分离菌株在10 ℃不生长,在37、45 ℃生长,溶血类型为β溶血,均可发酵麦芽糖、木糖、七叶苷、葡萄糖和蔗糖,不发酵甘露醇、山梨醇、乳糖、棉子糖和阿拉伯糖,V-P试验、触酶试验、赖氨酸、鸟氨酸、β-半乳糖苷酶和H2S检测呈阴性,精氨酸双水解酶呈阳性。其结果与阳性对照组ATCC29178基本一致,符合海豚链球菌的生化特性。
表2 病原菌部分生理生化特征
Tab.2 Selected physiological and biochemical characteristics of pathogenic bacteria

测定项目 itemBBW S1BBW S2BBW S2ATCC2917810 ℃37 ℃45 ℃革兰氏染液 Gram stain溶血 hemolysisV-P试验 V-P test触酶试验 catalase test葡萄糖 glucose麦芽糖 maltose棉子糖 raffinose蔗糖 sucrose木糖 xylose乳糖 lactose阿拉伯糖 arabinose甘露醇 mannitol山梨醇 sorbitol七叶苷 esculin hydrate赖氨酸 lysine鸟氨酸 ornithine精氨酸双水解酶 arginine dihydrolaseβ-半乳糖苷酶 β-galactoseH2S—+++β——++—++————+——+———+++β——++—++————+——+———+++β——++—++————+——+———+++β——++—++——+—+——+——
注:+,阳性;—,阴性;β,β溶血。
Note:+,stands for positive;—,stands for negative;β,β hemolysis.
2.3.3 16S rRNA序列分析 使用细菌16S rRNA通用引物对分离菌株BBW S1、BBW S2和BBW S3进行PCR扩增后,均获得预期大小约为1 500 bp的基因片段(图4)。将测序得到的序列使用BLAST进行比对,结果显示,均与海豚链球菌的同源性最高,一致性均达到99%以上。系统进化分析显示,分离菌株BBW S1、BBW S2和BBW S3与S.iniae亲缘关系最近(图5)。
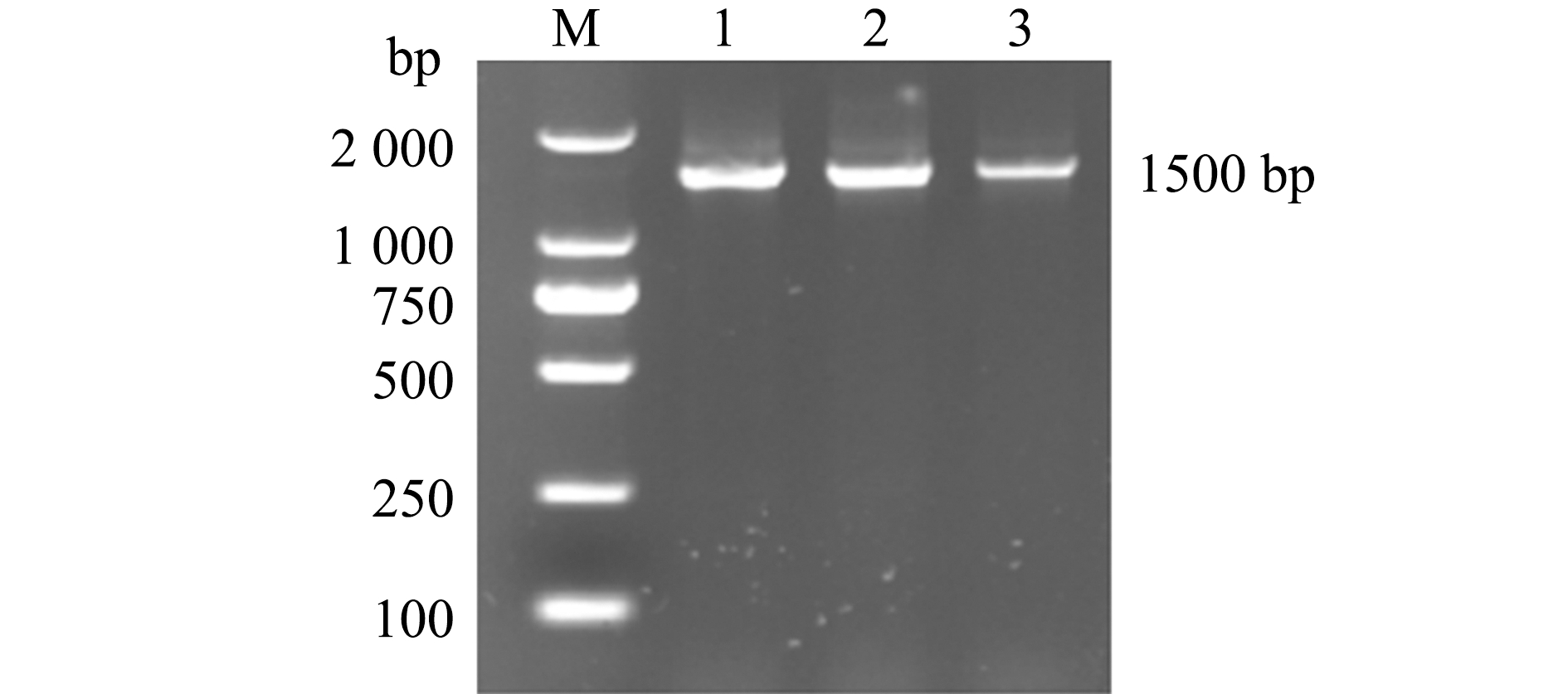
M—DL2000 DNA marker;1-3—strain BBW S1,BBW S2 and BBW S3.
图4 分离菌株16S rRNA的PCR扩增结果
Fig.4 Results of 16S rRNA PCR amplification of isolated strains
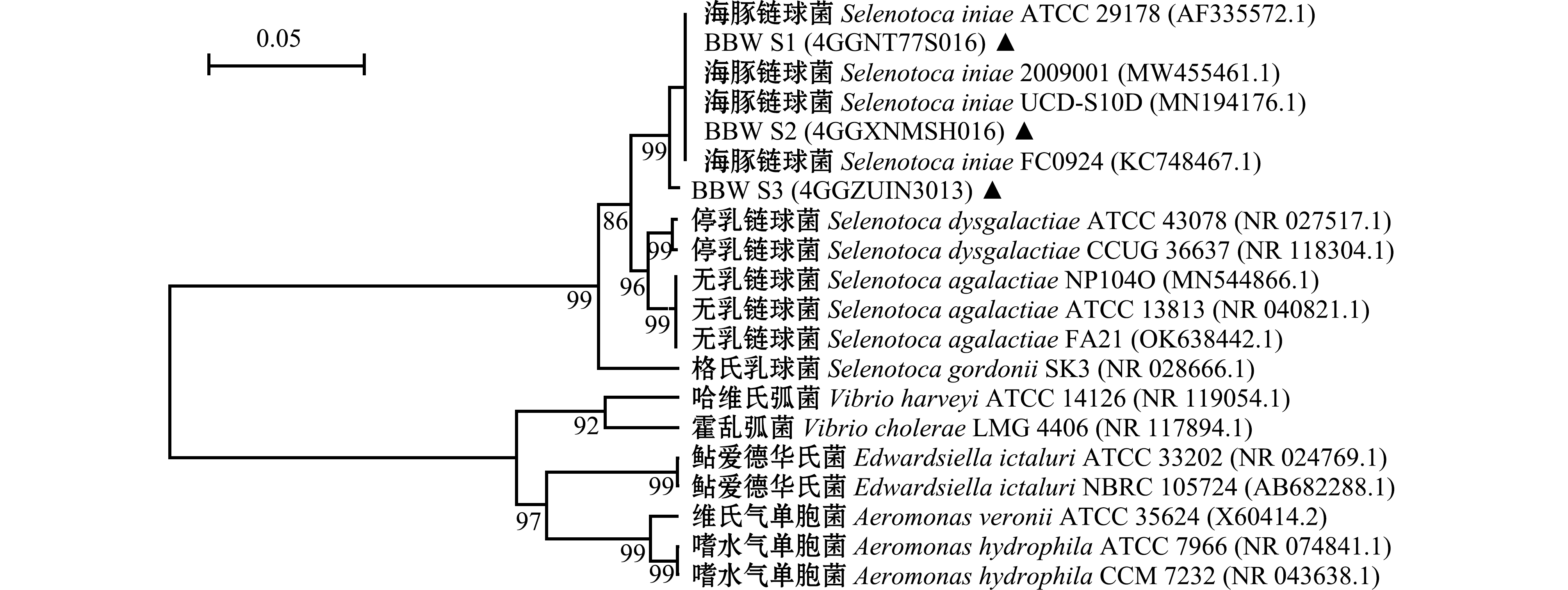
图5 基于16S rRNA核苷酸序列构建的系统发育树
Fig.5 Phylogenetic tree constructed by Neighbor-Joining method based on 16S rRNA nucleotide sequences
综合分离菌株的形态特征及生理生化特性,并结合16S rRNA序列、BLAST比对及系统发育分析结果,判定3株分离菌株BBW S1、BBW S2、BBW S3均为S.iniae。
2.4 人工回归感染试验
从表3可见,3株分离菌株的LD50分别为3.75×105、7.11×105、4.85×105 CFU/mL。试验鱼感染发病的症状与自然感染发病的银鼓鱼相似,从感染发病死亡的银鼓鱼体中再次分离细菌,均与原分离菌的形态特征一致,经16S rRNA鉴定仍为S.iniae。因此,确定3株分离菌株均为引起3个地区人工养殖银鼓鱼暴发性死亡的病原菌。
表3 银鼓鱼人工感染试验结果
Tab.3 Results of artificial infection of Selenotoca multifasciata
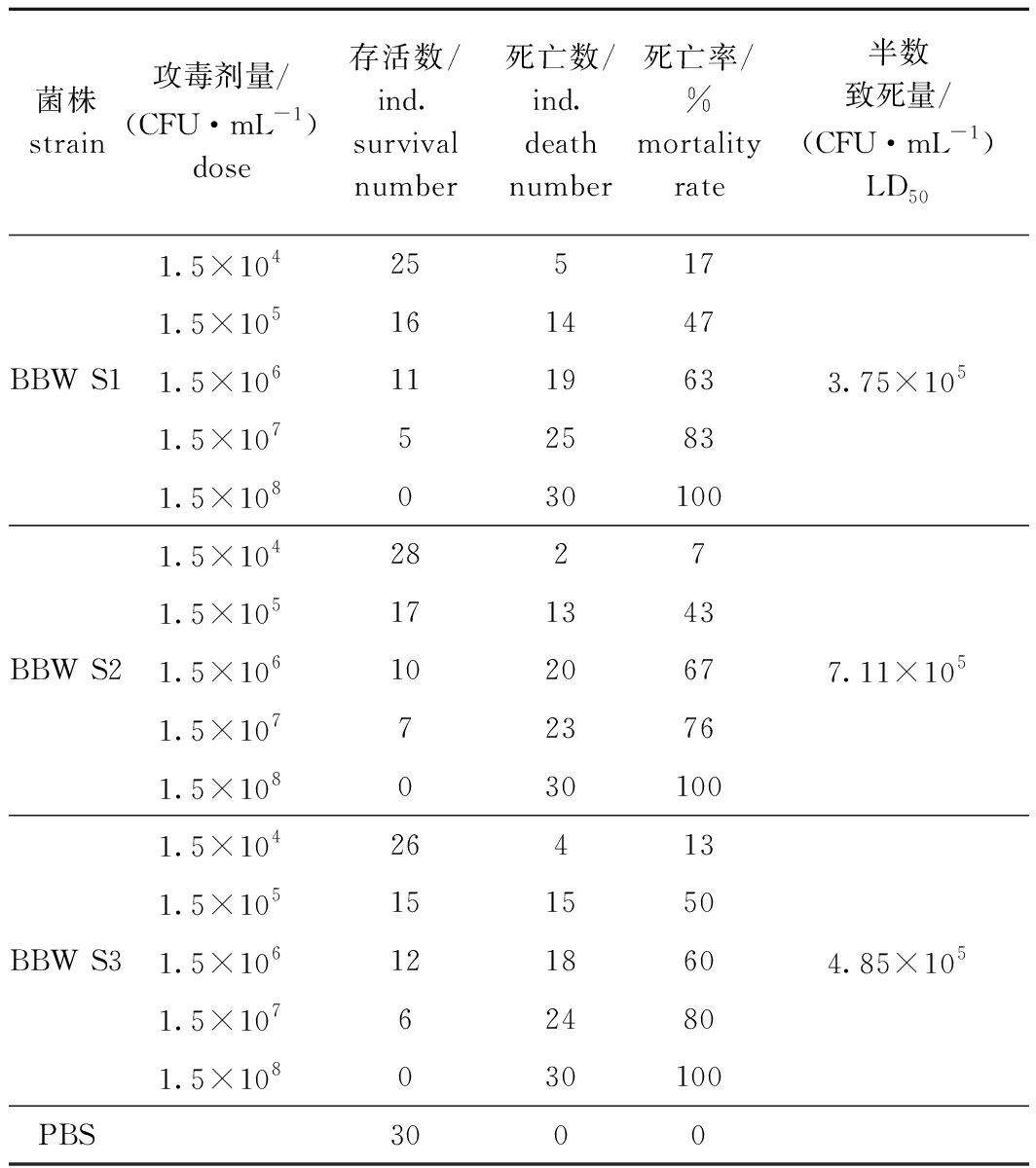
菌株strain攻毒剂量/(CFU·mL-1)dose存活数/ind.survival number死亡数/ind.death number死亡率/%mortality rate半数致死量/(CFU·mL-1)LD501.5×104255171.5×105161447BBW S11.5×1061119633.75×1051.5×107525831.5×1080301001.5×10428271.5×105171343BBW S21.5×1061020677.11×1051.5×107723761.5×1080301001.5×104264131.5×105151550BBW S31.5×1061218604.85×1051.5×107624801.5×108030100PBS3000
2.5 海豚链球菌主要毒力基因的PCR检测
对3株海豚链球菌的scpI、simA、pdi、sagA、cpsD、pgmA和cfi 7种毒力基因进行PCR检测,均扩增出了预期大小的片段(图6),这表明3株海豚链球菌均含有以上7种主要的毒力基因。
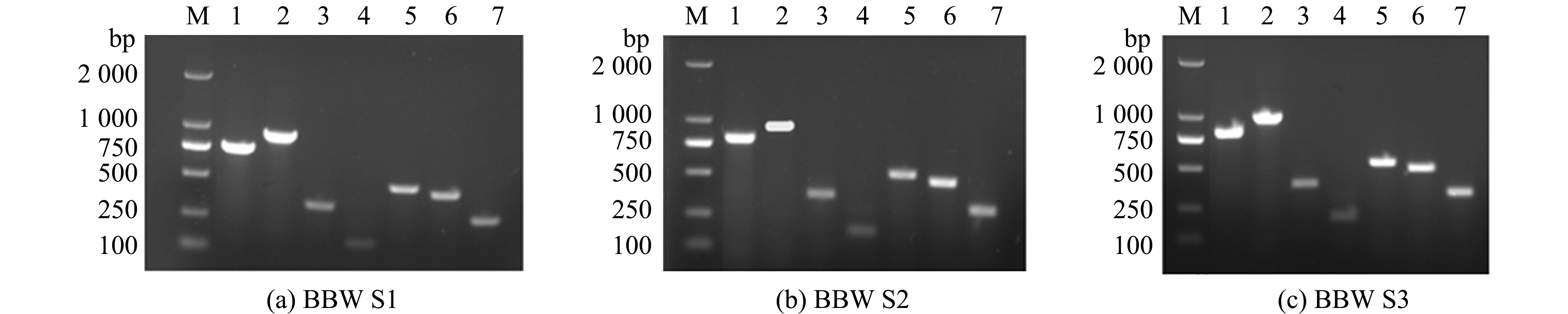
M—DL2000 DNA marker;1-7—scpI,simA,pdi,sagA,cpsD,pgmA and cfi genes.
图6 海豚链球菌主要毒力基因的PCR检测
Fig.6 PCR detection of major virulence genes of Streptococcus iniae
2.6 药敏检测
采用纸片扩散法检测分离菌株对氟苯尼考和恩诺沙星等18种抗菌药物的敏感性,结果如表4所示,3株分离菌株均对阿莫西林、四环素、盐酸多西环素、恩诺沙星、氧氟沙星、呋喃妥因、环丙沙星和多黏菌素B敏感,对头孢噻吩、青霉素G、红霉素等耐药,对氨苄西林、头孢他啶、庆大霉素、大观霉素、氟苯尼考、万古霉素和卡那霉素等有不同程度的敏感性。
表4 菌株的药物敏感性试验结果
Tab.4 Drug susceptibility results of bacterial strains
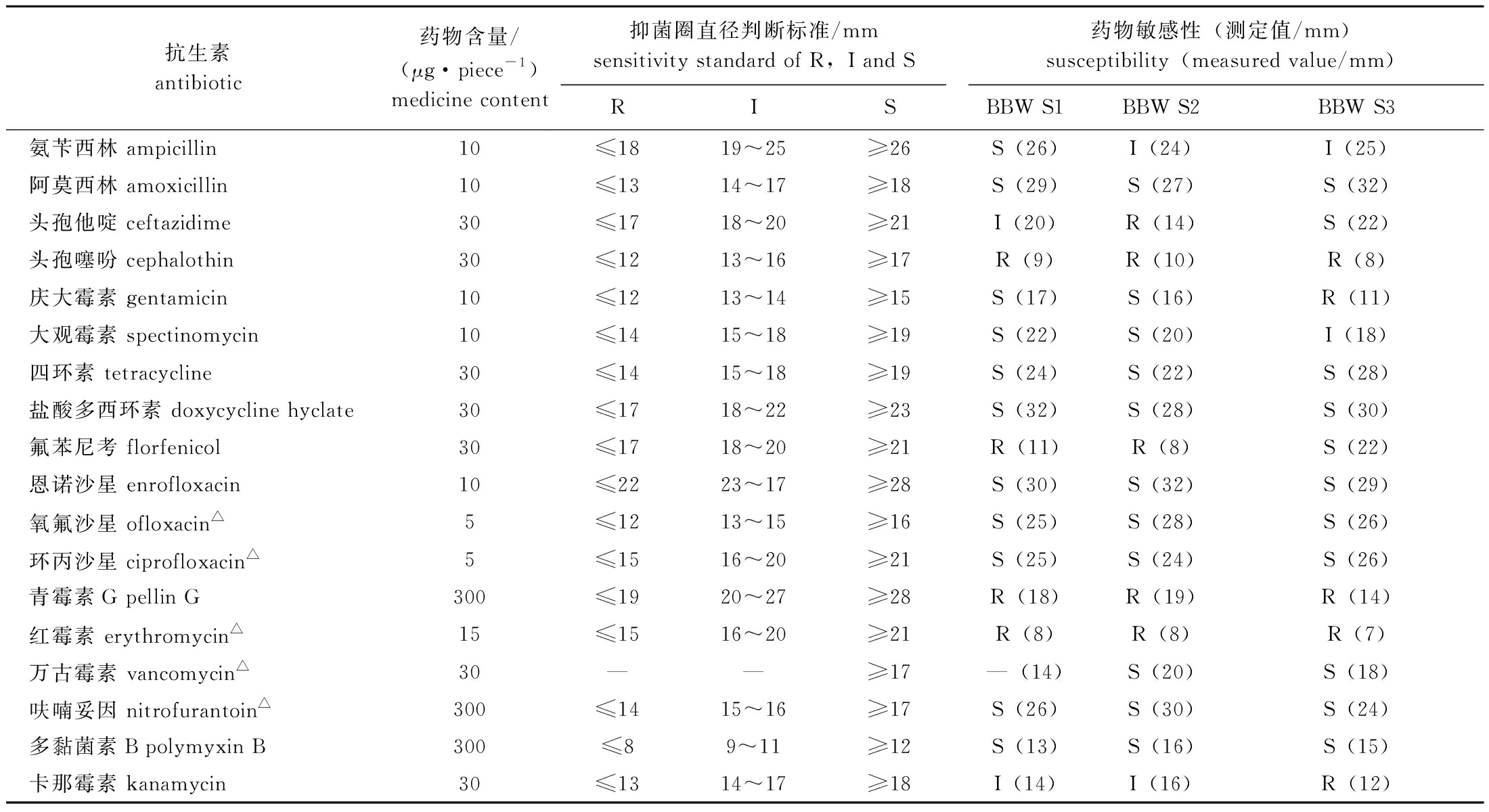
抗生素antibiotic药物含量/(μg·piece-1) medicine content抑菌圈直径判断标准/mmsensitivity standard of R,I and S药物敏感性(测定值/mm)susceptibility(measured value/mm)RISBBW S1BBW S2BBW S3氨苄西林 ampicillin10≤1819~25≥26S(26)I(24)I(25)阿莫西林 amoxicillin10≤1314~17≥18S(29)S(27)S(32)头孢他啶 ceftazidime30≤1718~20≥21I(20)R(14)S(22)头孢噻吩 cephalothin30≤1213~16≥17R(9)R(10)R(8)庆大霉素 gentamicin10≤1213~14≥15S(17)S(16)R(11)大观霉素 spectinomycin10≤1415~18≥19S(22)S(20)I(18)四环素 tetracycline30≤1415~18≥19S(24)S(22)S(28)盐酸多西环素 doxycycline hyclate30≤1718~22≥23S(32)S(28)S(30)氟苯尼考 florfenicol30≤1718~20≥21R(11)R(8)S(22)恩诺沙星 enrofloxacin10≤2223~17≥28S(30)S(32)S(29)氧氟沙星 ofloxacin△5≤1213~15≥16S(25)S(28)S(26)环丙沙星 ciprofloxacin△5≤1516~20≥21S(25)S(24)S(26)青霉素G pellin G300≤1920~27≥28R(18)R(19)R(14)红霉素 erythromycin△15≤1516~20≥21R(8)R(8)R(7)万古霉素 vancomycin△30——≥17—(14)S(20)S(18)呋喃妥因 nitrofurantoin△300≤1415~16≥17S(26)S(30)S(24)多黏菌素B polymyxin B300≤89~11≥12S(13)S(16)S(15)卡那霉素 kanamycin30≤1314~17≥18I(14)I(16)R(12)
注:R,耐药;I,中介;S,敏感;—,无数据;△,禁用兽药,仅用于科研。
Note:R,resistant;I,intermediately sensitive;S,sensitive;—,no data;△,forbidden veterinary drugs,for research only.
3 讨论
3.1 病原菌的分离鉴定
从20世纪70年代开始,世界范围内就陆续有链球菌侵染鱼类导致死亡的案例报道,至今链球菌依旧是水产养殖动物患病的主要病原菌。海豚链球菌由Pier等[10]从亚马逊淡水海豚中首次分离得到,故被命名为海豚链球菌。Kitao等[11]于20世纪80年代首次报道海豚链球菌感染鱼类,并在患病的虹鳟(Oncorhynchus mykiss)、香鱼(Plecoglossus altivelis)和尼罗罗非鱼(Oreochromis nilotica)中分离出海豚链球菌。迄今为止,海豚链球菌广泛流行于中国、美国、新加坡、日本、加拿大和澳大利亚等世界各地水域,可感染多种淡水、海水养殖品种及野生鱼类,导致鱼类大量死亡,对全球水产养殖业造成了巨大的经济损失。此外,海豚链球菌还能够威胁人类的健康与安全,目前,已有多例人感染海豚链球菌的报道。在中国已有海豚链球菌感染罗非鱼(O.niloticus)[12]、 卵形鲳鲹(Trachinotus ovatus)[12-13]和斑点叉尾鮰(Ictalurus punctatus)[14]等相关报道。本研究中,从3个养殖场的患病银鼓鱼中共分离得到3株优势菌BBW S1、BBW S2和BBW S3,通过菌株形态学、生理生化试验、16S rRNA序列分析和回归感染试验,鉴定其均为海豚链球菌,这与罗璋等[4]的研究结果一致,说明银鼓鱼是海豚链球菌的天然宿主。
3.2 海豚链球菌对银鼓鱼的致病性
鱼类感染海豚链球菌后的主要临床症状为眼球突出、全身性败血、心包炎及脑膜炎等[15]。脾脏和肾脏是鱼类重要的免疫器官,银鼓鱼感染海豚链球菌后,肾脏和脾脏严重损伤,进一步降低了银鼓鱼的防御能力,并引发多器官发生病变。本研究中,患病银鼓鱼出现脑膜增厚、疏松水肿等特征性病变,表明海豚链球菌能够突破银鼓鱼血脑屏障进入中枢神经系统,引起脑膜炎,其与鲟(Acipenser sinensis)[16]、罗非鱼[17]感染海豚链球菌的病理特征相似。此外,本研究中发现,患病银鼓鱼的肝脏、鳃和肠道均有损伤,表明海豚链球菌通过血液循环到达各组织器官,导致多器官功能受损,最后致鱼器官衰竭死亡。
本研究中,人工回归感染试验显示,BBW S1、BBW S2和BBW S3的LD50分别为3.75×105、7.11×105、4.85×105 CFU/mL,且受感染的银鼓鱼与自然发病银鼓鱼症状相似,说明3株海豚链球菌均对银鼓鱼具有较强的致病性。3株分离菌株间的LD50与杂交鲟源海豚链球菌的LD50(1.20×105 CFU/mL)[18]及西伯利亚鲟(Acipenser baerii)源海豚链球菌的LD50(3.20×106 CFU/mL)[19]值存在差异,说明海豚链球菌株的致病性与菌株来源、 宿主种类和大小等有关。
3.3 银鼓鱼海豚链球菌的毒力基因检测
海豚链球菌编码的大量毒力因子与其致病机制密切相关,在细菌黏附、定植、侵入和体内增殖及免疫逃逸等方面起着重要作用。研究表明,链球菌的致病力取决于细菌在宿主免疫细胞中的存活,以及感染、诱导细胞凋亡的能力[20]。simA基因编码的M蛋白是高度保守的毒力因子,在海豚链球菌的致病过程中起着重要作用,能够为海豚链球菌提供抗吞噬细胞的吞噬作用,有助于海豚链球菌对细胞的黏附和侵染[21];sagA基因编码的溶血素S是目前已知最有效的细胞毒素之一[22],能够破坏红细胞、血小板、中性粒细胞和淋巴细胞等细胞膜,以及线粒体、溶酶体等亚细胞器[23];scpI基因编码的C5a肽酶能够水解中性粒细胞化学诱导物补体因子C5a,有助于海豚链球菌黏附宿主上皮细胞[21];pdi基因编码的脱乙酰基酶能够使海豚链球菌对溶酶体产生耐受,增强海豚链球菌对宿主细胞的黏附和入侵能力[24];cps编码的荚膜多糖能够调节和抑制吞噬细胞的吞噬,阻止宿主补体因子C3a的沉积,也能增强溶血素S的生成[25];pgmA基因编码的葡萄糖磷酸变位酶对海豚链球菌的毒力至关重要,在维持正常的细胞壁形态、荚膜表达和抵抗先天免疫清除机制中发挥作用,参与细胞壁和荚膜生物合成,并能抵抗阳离子抗菌肽[26];cfi基因编码的CAMP因子能使海豚链球菌以两种方式侵害宿主机体,第一种是协同其他能够分泌鞘磷脂酶的细菌溶解宿主细胞膜,第二种是结合免疫球蛋白Fc片段,拦截抗体向补体释放抗原[27]。海豚链球菌的致病力完全取决于其毒力因子,对菌株致病力的判断可以通过检测毒力因子加以辨别[28]。本研究中,对海豚链球菌7种主要毒力基因进行PCR检测,均能扩增出相应大小的条带,这与熊向英等[7]对卵形鲳鲹源海豚链球菌及白明焕等[29] 对鲟源海豚链球菌的毒力基因检测结果高度相似,均含有上述毒力基因,表明3株海豚链球菌均为强毒株型。
3.4 海豚链球菌病的防治
鱼类链球菌病的发生是由环境、宿主和病原菌共同作用的结果,对其防治措施主要包括改善养殖水环境、免疫预防和药物治疗等方法。接种疫苗是预防链球菌病的有效方法,目前研发的海豚链球菌疫苗主要有灭活疫苗、减毒疫苗、亚单位疫苗和DNA疫苗。如王静波等[30]利用分离自患病杂交鲟的海豚链球菌制备灭活疫苗免疫杂交鲟,其相对保护率(RPS)高达92.8%;Locke等[21]将构建的海豚链球菌△simA突变菌株作为减毒疫苗,对条纹鲈(Morone saxatilis)和斑马鱼(Danio rerio)均显示出较好的保护效果。目前,国外已有商品化的海豚链球菌疫苗。在养殖生产中,使用抗菌药物来预防和治疗细菌类疾病是最为简单和便捷的方法,药物敏感性试验对临床合理选择抗菌药物不仅具有重要的指导意义,而且能够避免因滥用抗生素而导致细菌的耐药性增强,减少多重耐药性菌株的产生。本研究中,自患病银鼓鱼分离的3株海豚链球菌均对恩诺沙星、盐酸多西环素等8种抗菌药物敏感,参考2020年6月农业农村部发布的最新《水产养殖用药明白纸》,银鼓鱼发病后,可采用水产用盐酸多西环素、恩诺沙星粉对银鼓鱼海豚链球菌病进行治疗。对于不同规格和养殖环境的患病银鼓鱼,其给药途径、剂量和间隔时间等尚需要进一步研究,以便制定合理方案,确保科学用药。此外,应鼓励开发绿色和安全的防治技术,如开发免疫调节剂、益生菌和中草药等绿色抗生素替代药物。
4 结论
1)从北部湾地区3个不同地域的养殖银鼓鱼中共分离出3株优势菌BBW S1、BBW S2和BBW S3,经形态学、生理生化和16S rRNA序列分析鉴定,均为海豚链球菌。3个菌株对银鼓鱼的半数致死量(LD50)分别为3.75×105、7.11×105、4.85×105 CFU/mL,均具有较强致病性。
2)海豚链球菌可造成银鼓鱼脑、肝和脾等多脏器不同程度损伤,表现为变性、坏死及炎性细胞浸润等。
3)3株海豚链球菌均携带scpI、simA、pdi、sagA、cpsD、pgmA和cfi 7种毒力基因,属于强毒株型。
4)根据药敏试验结果,在海豚链球菌引起银鼓鱼链球菌病的防治中,推荐交替使用水产用盐酸多西环素粉和恩诺沙星粉,并分别执行750度日和500度日的休药期。
[1] 刘鉴毅,李琪,孙艳秋,等.多纹钱蝶鱼胚胎发育及胚后发育观察[J].中国水产科学,2021,28(8):978-987.
LIU J Y,LI Q,SUN Y Q,et al.Embryonic and post-embryonic development of Selenotoca multifasciata[J].Journal of Fishery Sciences of China,2021,28(8):978-987.(in Chinese)
[2] 孙艳秋,刘鉴毅,庄平,等.温度、盐度和pH对多纹钱蝶鱼胚胎发育的影响[J].南方水产科学,2021,17(6):122-129.
SUN Y Q,LIU J Y,ZHUANG P,et al.Effects of water temperature,salinity and pH on embryonic development of Selenotoca multifasciata[J].South China Fisheries Science,2021,17(6):122-129.(in Chinese)
[3] LIU Z H,MU X J,LI H,et al.Complete mitochondrial genome of the striped scat Selenotoca multifasciata (Perciformes:Scatophagidae)[J].Mitochondrial DNA Part A:DNA Mapping,Sequencing,and Analysis,2016,27(4):2691-2692.
[4] 罗璋,许杰,韩进刚,等.银鼓鱼病原菌(海豚链球菌)的分离与鉴定[J].华中农业大学学报,2012,31(1):95-99.
LUO Z,XU J,HAN J G,et al.Isolation and identification of pathogenetic Streptococcus iniae from Selenotoca multifasciata[J].Journal of Huazhong Agricultural University,2012,31(1):95-99.(in Chinese)
[5] R E布坎南,N E吉本斯.伯杰细菌鉴定手册[M].第8版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:677-830.
BUCHANAN R E,GIBBONS N E.Bergey’s manual of determinative bacteriology[M].8th edition.Translation team of Berger Bacteria Identification Manual,Institute of Microbiology,Chinese Academy of Sciences,Trans.Beijing:Science Press,1984:677-830.(in Chinese)
[6] 李翠萍,吴民耀,王宏元.3种半数致死浓度计算方法之比较[J].动物医学进展,2012,33(9):89-92.
LI C P,WU M Y,WANG H Y.LC50 caculated by Kochi,probit analysis and linear regression methods[J].Progress in Veterinary Medicine,2012,33(9):89-92.(in Chinese)
[7] 熊向英,黄国强,王志成,等.广西卵形鲳鲹海豚链球菌基因分型、耐药谱型以及毒力基因检测[J].水产学报,2018,42(4):586-595.
XIONG X Y,HUANG G Q,WANG Z C,et al.Molecular typing,antibiogram type and detection of virulence genes of Stereptococcus iniae strains isolated from golden pompano(Tranchinotus ovatus) in Guangxi Province[J].Journal of Fisheries of China,2018,42(4):586-595.(in Chinese)
[8] BAUMS C G,HERMEYER K,LEIMBACH S,et al.Establishment of a model of Streptococcus iniae meningoencephalitis in Nile tilapia (Oreochromis niloticus)[J].Journal of Comparative Pathology,2013,149(1):94-102.
[9] 马越,李景云,金少鸿.美国临床实验室标准委员会推荐药敏试验操作方法和判断标准(2005年修订版)[J].中华医学杂志,2005,85(17):1182-1184.
MA Y,LI J Y,JIN S H.National Committee for Clinical Laboratory Standards (NCCLS) recommends drug susceptibility testing practices and judgment criteria (revised edition 2005) [J].National Medical Journal of China,2005,85(17):1182-1184.(in Chinese)
[10] PIER G B,MADIN S H.Streptococcus iniae sp.nov.,a beta-hemolytic Streptococcus isolated from an Amazon freshwater dolphin,Inia geoffrensis[J].International Journal of Systematic Bacteriology,1976,26(4):545-553.
[11] KITAO T,AOKI T,SAKOH R.Epizootic caused by β-haemoltytic Streptococcus species in cultured freshwater fish[J].Fish Pathology,1981,15(3/4):301-307.
[12] 黄婷,李莉萍,王瑞,等.广西罗非鱼和卵形鲳鲹海豚链球菌的生化特性及基因多态性分析[J].大连海洋大学学报,2014,29(5):459-462.
HUANG T,LI L P,WANG R,et al.Biochemistry and gene polymorphism analysis of Streptococcus iniae strains isolated from Nile tilapia Oreochromis niloticus and Trachinotus ovatus in Guangxi Province[J].Journal of Dalian Ocean University,2014,29(5):459-462.(in Chinese)
[13] 黄婷,李莉萍,王瑞,等.卵形鲳鲹感染无乳链球菌与海豚链球菌的研究[J].大连海洋大学学报,2014,29(2):161-166.
HUANG T,LI L P,WANG R,et al.Pathogenic bacteria Streptococcus agalactiae and S.iniae in diseased ovate pompano Trachinotus ovatus[J].Journal of Dalian Ocean University,2014,29(2):161-166.(in Chinese)
[14] 余晓丽,陈明,李超,等.斑点叉尾鮰暴发性海豚链球菌病的研究[J].大连水产学院学报,2008,23(3):185-191.
YU X L,CHEN M,LI C,et al.Channel catfish Ictalurus punctatus outbreak infected by bacterium Streptococcus iniae[J].Journal of Dalian Fisheries University,2008,23(3):185-191.(in Chinese)
[15] AGNEW W,BARNES A C.Streptococcus iniae:an aquatic pathogen of global veterinary significance and a challenging candidate for reliable vaccination[J].Veterinary Microbiology,2007,122(1/2):1-15.
[16] 王静波,徐立蒲,刘建男,等.鲟感染海豚链球菌组织病理学研究[J].中国水产,2021(11):94-96.
WANG J B,XU L P,LIU J N,et al.Histopathological study of Streptococcus iniae infection in Acipenser sinensis[J].China Fisheries,2021(11):94-96.(in Chinese)
[17] 祝璟琳,柒壮林,李大宇,等.罗非鱼海豚链球菌病的病理学观察[J].水产学报,2014,38(5):722-730.
ZHU J L,QI Z L,LI D Y,et al.Pathological changes in tilapia(Oreochromis niloticus) naturally infected by Streptococcus iniae[J].Journal of Fisheries of China,2014,38(5):722-730.(in Chinese)
[18] 王静,邓玉婷,姜兰,等.杂交鲟海豚链球菌分离鉴定及药物敏感性[J].云南农业大学学报(自然科学版),2020,35(6):1010-1015.
WANG J,DENG Y T,JIANG L,et al.Isolation,identification and susceptibilities of hybrid sturgeon Streptococcus iniae[J].Journal of Yunnan Agricultural University (Natural Science Edition),2020,35(6):1010-1015.(in Chinese)
[19] 邓梦玲,耿毅,刘丹,等.西伯利亚鲟海豚链球菌的分离鉴定及毒力基因检测[J].水产学报,2015,39(1):127-135.
DENG M L,GENG Y,LIU D,et al.Isolation,identification and detection of virulence genes of Streptococcus iniae from Acipenser baerii[J].Journal of Fisheries of China,2015,39(1):127-135.(in Chinese)
[20] MISHRA A,NAM G H,GIM J A,et al.Comparative evaluation of 16S rRNA gene in world-wide strains of Streptococcus iniae and Streptococcus parauberis for early diagnostic marker[J].Genes &Genomics,2017,39(7):779-791.
[21] LOCKE J B,AZIZ R K,VICKNAIR M R,et al.Streptococcus iniae M-like protein contributes to virulence in fish and is a target for live attenuated vaccine development[J].PLoS One,2008,3(7):e2824.
[22] KOYAMA J.Biochemical studies on streptolysin s’.Ⅱ.properties of a polypeptide component and its role in the toxin activity[J].Journal of Biochemistry,1963,54:146-151.
[23] NIZET V,BEALL B,BAST D J,et al.Genetic locus for streptolysin S production by group A Streptococcus[J].Infection and Immunity,2000,68(7):4245-4254.
[24] MILANI C J E,AZIZ R K,LOCKE J B,et al.The novel polysaccharide deacetylase homologue Pdi contributes to virulence of the aquatic pathogen Streptococcus iniae[J].Microbiology,2010,156(Pt 2):543-544.
[25] MILLER J D,NEELY M N.Large-scale screen highlights the importance of capsule for virulence in the zoonotic pathogen Streptococcus iniae[J].Infection and Immunity,2005,73(2):921-934.
[26] BUCHANAN J T,STANNARD J A,LAUTH X,et al.Streptococcus iniae phosphoglucomutase is a virulence factor and a target for vaccine development[J].Infection and Immunity,2005,73(10):6935-6944.
[27] JÜRGENS D,STERZIK B,FEHRENBACH F J.Unspecific binding of group B streptococcal cocytolysin (CAMP factor) to immunoglobulins and its possible role in pathogenicity[J].The Journal of Experimental Medicine,1987,165(3):720-732.
[28] WOO S H,PARK S I.Effects of phosphoglucomutase gene (PGM) in Streptococcus parauberis on innate immune response and pathogenicity of olive flounder (Paralichthys olivaceus)[J].Fish &Shellfish Immunology,2014,41(2):317-325.
[29] 白明焕,耿毅,赵若璇,等.四川鲟源海豚链球菌的毒力基因谱及分子分型[J].华南农业大学学报,2020,41(5):36-42.
BAI M H,GENG Y,ZHAO R X,et al.Virulence gene profiles and molecular typing of Streptococcus iniae isolated from sturgeon in Sichuan[J].Journal of South China Agricultural University,2020,41(5):36-42.(in Chinese)
[30] 王静波,王小亮,曹欢,等.海豚链球菌灭活疫苗对杂交鲟免疫效果的研究[J].中国水产,2022(1):98-101.
WANG J B,WANG X L,CAO H,et al.Studies on immune protective effect of Streptococcus iniae inactivated vaccine in Hybrid sturgeon [J].China Fisheries,2022(1):98-101.(in Chinese)