中国养殖对虾年产量已经突破200万t[1],对虾养殖业已成为渔业经济的重要支柱。然而在对虾养殖业快速发展的同时,对虾疾病也成为影响产业发展的关键问题,特别是近年来新出现的由病原菌感染导致的对虾急性肝胰腺坏死病、玻璃苗症等,给中国的对虾养殖业带来了严重危害[2-3]。目前,已确定的对虾病原有副溶血弧菌(Vibrio parahaemolyticus)[4]、哈维氏弧菌(V.harveyi)[5]、坎贝氏弧菌(V.campbellii)[6]、欧文氏弧菌(V.owensii)[7]、溶藻弧菌(V.alginolyticus)[8]和美人鱼发光杆菌(Photobacterium damselae)[9]等。
水产养殖中对细菌病的防控方法,传统上多采用抗生素进行处理[10],而抗生素的使用可对环境及人类健康产生较多的潜在危害[11]。近年来,为满足市场对绿色健康水产品的需求,水产动物疾病的生物防控技术受到了广泛重视,其中,益生菌已广泛用于水产养殖中的多个环节[12],并在改善水质、提高养殖动物免疫力、促进鱼虾肠道健康等方面发挥了不同的作用。研究发现,在海洋环境中有些假交替单胞菌属的细菌能够分泌抑菌物质[13-14],并表现出极大的潜在开发前景。
本研究中,从海南一个对虾育苗场的虾苗池水中,分离到一株对对虾多种病原菌具有明显抑制作用的海洋细菌,并对该菌的分类地位进行了初步的研究,开展了该菌对多种病原菌的拮抗效果评价,分析了该菌株的生物安全性及应用效果,以期为解决对虾细菌病危害严重的问题提供技术参考。
1 材料与方法
1.1 材料
菌株安全性评价所用凡纳滨对虾(Litopenaeus vannamei)购于山东潍坊某对虾养殖场,体长为(7.40±0.49)cm,体质量为(4.26±0.21)g。养殖用凡纳滨对虾来源于海南某育苗场,体长为(3.14±0.33)cm,体质量为(0.26±0.02)g。
弧菌拮抗用指示菌分别为副溶血弧菌、哈维氏弧菌、坎贝氏弧菌、欧文氏弧菌、溶藻弧菌和美人鱼发光杆菌;攻毒感染试验中,对照组细菌用副溶血弧菌、枯草芽孢杆菌(Bacillus subtilis);溶血对照组细菌及生理生化鉴定用参考菌株为杀鱼假交替单胞菌(Pseudoalteromonas piscicida 2515)[15](以下简称“2515”)。上述菌株均来自农业农村部海水养殖病害防治重点实验室。
羊血平板购自北京陆桥技术股份有限公司,鱼血平板制备参考张宇哲等[15]的方法。
1.2 方法
1.2.1 菌株采集与分离纯化 从海南省某对虾育苗场虾苗池中采集水样,置于1.5 mL无菌离心管,低温保存带回实验室。在无菌条件下,取水样于2216E平板上划线分离纯化,共分离出15株海洋细菌,通过平板点种法筛选出一株对哈维氏弧菌、副溶血弧菌和欧文氏弧菌均具有拮抗作用的菌株,编号为2021041402-14(简称“菌株02HN”),将纯培养后的菌株02HN保存备用。
1.2.2 拮抗菌的筛选 将副溶血弧菌、哈维氏弧菌、坎贝氏弧菌、欧文氏弧菌、溶藻弧菌和美人鱼发光杆菌分别接种于2216E液体培养基,在28 ℃下以150 r/min恒温摇床振荡培养24 h,用无菌PBS稀释成浓度为1×107 CFU/mL的菌悬液,取100 μL菌悬液均匀涂布于2216E固体平板。用接种环挑取少量活化24 h的待筛选菌株,点种于上述平板上,并对各测试菌株进行编号,于28 ℃ 恒温培养箱中培养24 h后,观察点样区是否有透明抑菌圈,每个样品设3个平行。
1.2.3 拮抗菌抑菌效果的测定 参考李静舒等[16]的方法,采用牛津杯打孔法进行拮抗菌抑菌效果的测定。分别取浓度为1×107 CFU/mL的副溶血弧菌、哈维氏弧菌、坎贝氏弧菌、欧文氏弧菌、溶藻弧菌和美人鱼发光杆菌的发酵液100 μL,均匀涂布于2216E固体培养基上,用牛津杯在平板上等距打4个孔,其中,2个孔内放置50 μL拮抗菌发酵液(浓度为1×108 CFU/mL),另2个孔放置50 μL无菌PBS作为空白对照,每个平板设3个重复,待菌液被完全吸收后,倒置于28 ℃恒温培养箱中培养24 h。采用游标卡尺十字交叉法测量抑菌圈直径,结果取3个平行的平均值。
1.2.4 最低抑菌浓度的测定 将浓度为2.32×108 CFU/mL的拮抗菌发酵液,用无菌PBS进行10倍梯度稀释,最低稀释到2.32×102 CFU/mL,参照“1.2.3节”的方法,以浓度为1×107 CFU/mL的副溶血弧菌、哈维氏弧菌、坎贝氏弧菌、欧文氏弧菌、溶藻弧菌和美人鱼发光杆菌为指示菌,进行各稀释梯度发酵液的抑菌试验,每个平板打4个孔,用无菌PBS作为空白对照,每个平板设3个平行,于28 ℃恒温培养箱中静置培养24 h后,观察抑菌情况。参照李成海等[17]的判断方法,结果用“+”或“—”表示。
1.2.5 菌株的分子鉴定及系统发育树构建
1)16S rRNA基因鉴定。将菌株发酵液以4 300 g离心5 min,弃上清液,菌体用PBS缓冲液离心洗涤2次后,用细菌基因组提取试剂盒提取细菌DNA[天根生化科技(北京)有限公司]。以提取的细菌DNA为模板,采用细菌16S rRNA序列扩增的通用引物27F(5′ AGAGTTTGATCMTGGCTCAG 3′)和1492R(5′ GGTTACCTTGTTACGACTT 3′)进行PCR扩增。PCR反应体系(共25 μL):ddH2O 9.5 μL,DNA模板1.0 μL,上、下游引物各1.0 μL,Premix Ex Taq 12.5 μL[宝生物工程(大连)有限公司]。PCR扩增条件:94 ℃下预变性10 min;94 ℃下变性50 s,55 ℃下退火30 s,72 ℃下延伸1.5 min,共进行35个循环;最后在72 ℃下再延伸10 min。PCR产物由生工生物工程(上海)股份有限公司进行测序,将测序结果用NCBI数据库的BLAST进行同源性比对,采用MEGA 7.0软件将菌株与同源性较高的其他菌株序列进行多重序列比较,并通过邻接法构建系统发育树,初步判定菌株种类。
2)gyrB与rpoD基因鉴定。反应体系(共25 μL):ddH2O 9.5 μL,DNA模板 1.0 μL,上、下引物各1.0 μL(表1),Premix Taq酶12.5 μL。扩增条件:95 ℃下预变性10 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸60 s,共进行35个循环;最后在72 ℃下再延伸7 min。PCR产物由生工生物工程(上海)股份有限公司进行测序,将测序结果用BLAST进行同源性比对,选取同源性较高的其他菌株基因序列,结合标准菌株相应的基因序列进行多重序列比对,并通过邻接法构建系统发育树。
表1 试验引物及序列
Tab.1 Primers and their sequences used in the experiment
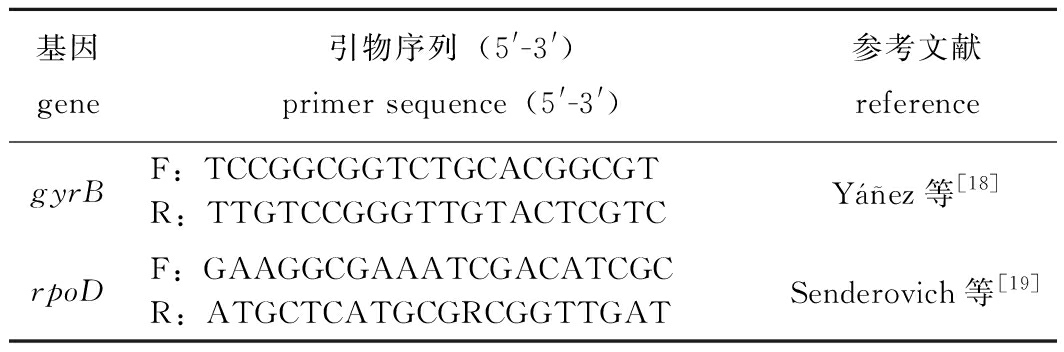
基因gene引物序列(5'-3')primer sequence(5'-3')参考文献referencegyrBF:TCCGGCGGTCTGCACGGCGTR:TTGTCCGGGTTGTACTCGTCYñez等[18]rpoDF:GAAGGCGAAATCGACATCGCR:ATGCTCATGCGRCGGTTGATSenderovich等[19]
1.2.6 菌株生化鉴定 参考Khalifa等[20]的方法,采用Biolog Gen Ⅲ微生物鉴定系统(Biolog,美国)对菌株02HN进行生理生化鉴定。以杀鱼假交替单胞菌2515为参考菌株,具体操作步骤参考Biolog Gen Ⅲ MicroPlate使用说明书,采用Microlog 3软件读取试验结果。
1.2.7 菌株02HN对对虾的生物毒性测试 采用2216E海水培养基摇瓶发酵菌株02HN、副溶血弧菌和枯草芽孢杆菌24 h,发酵液经4 000 g离心10 min,将离心后的沉淀用PBS洗涤2次备用。采用浸泡攻毒方法评价菌株02HN对对虾的安全性,将暂养1周的健康凡纳滨对虾分别置于16个有效水体为20 L的水槽中,每个水槽中放对虾10尾。试验设菌株02HN组、阳性对虾组、阴性对照组和空白组4个组。其中,菌株02HN组,设置菌株终浓度分别为1.70×108、1.70×107、1.70×106、1.70×105、1.70×104 CFU/mL;阳性对照组为副溶血弧菌组,设置菌株终浓度分别为1.55×108、1.55×107、1.55×106、1.55×105、1.55×104 CFU/mL;阴性对照组为枯草芽孢杆菌组,设置菌株终浓度分别为1.58×108、1.58×107、1.58×106、1.57×105、1.56×104 CFU/mL;空白对照组只添加PBS。浸泡感染24 h后正常投喂、吸污、日换水50%,养殖水温为(26.0~29.0)℃,pH为7.8±0.5,盐度为32。每日记录对虾死亡情况,至各组对虾稳定后,统计对虾累计死亡率。整个感染试验重复两次,采用SPSS 16.0软件计算对虾的半致死浓度(LC50),安全浓度定义为LC50的1/10。
1.2.8 菌株02HN的溶血活性 28 ℃条件下于2216E平板上接种菌株02HN及对照用杀鱼假交替单胞菌2515,培养24 h后刮取菌落,分别用PBS制成浓度为1.90×109 CFU/mL、1.75×109 CFU/mL的菌悬液,各取5 μL等距点种在羊血和鱼血琼脂平板上,每种菌株设3个重复。于28 ℃恒温培养箱中培养48 h,观察溶血情况。
1.2.9 菌株02HN在对虾养殖中的抑菌效果试验
1)饲料制备及试验设计。参照王枫林等[21]的方法进行饲料制备。通过摇瓶发酵菌株02HN获取菌体,采用平板涂布法测定02HN发酵液浓度后,按照含量1×105 、1×107 cells/g将02HN发酵菌液添加到对虾原饲料中,以质量分数为1%的褐藻酸钠为黏合剂进行制粒,作为试验组饲料,空白对照饲料不添加菌株,在常温下晾干备用。
试验设置2个含菌饲料投喂组(含菌株02HN 1×105 、1×107 cells/g饲料),另设1个空白对照组,投喂不含菌株的饲料。每个处理组设置4个重复,其中1个组用于补齐其他3个组采样后的对虾数量。对虾养殖于体积为60 L的水族箱中,有效水体为40 L,每个箱内随机放养30尾健康凡纳滨对虾。各组每天按照饲料量的70%添加蔗糖,以培养生物絮团控制养殖池水体中的氨氮含量[22],每日投喂3次,日投喂量为对虾体质量的3%,试验的第一周不换水,之后每天换水10%。养殖期间水温为(27.0±2.2)℃,盐度为32.1±1.8,连续充气。
2)对虾肠道及肝胰腺中的弧菌定量。于养殖试验开始后的第3天和结束时(第28天),从各组取样,分析其肠道及肝胰腺中的弧菌数量,取样前12 h停止投喂。从每组随机取对虾3尾,无菌条件下剪取部分对虾肠道和肝胰腺,精确称重后加入10倍质量的PBS缓冲液并充分研磨,再进行10倍梯度稀释(肝胰腺样品进行101~103倍稀释,肠道样品进行102~104倍稀释),取每个稀释后的样品100 μL涂布于TCBS平板上,28 ℃下恒温培养24 h后,取菌落数为10~100的平板计数。每个样品涂布3个平行样。
3)对虾存活率及生长率测定。在养殖试验结束时,记录每组虾的存活数,统计各组虾的生物学体长,并计算存活率(RS,%)和体长增长率(GBL,%)。计算公式为
RS=Nt/N0×100%,
GBL=(Lt-L0)/L0×100%。
其中:Nt为试验结束时对虾存活的数量(ind.);N0为试验初始时对虾的数量(ind.);Lt、L0分别为试验结束时和初始时对虾的体长(cm)。
4)生物絮团定量。养殖试验结束时,对养殖水体中生物絮团量进行测定,在距离水面20 cm处,用灭菌的50 mL离心管取3个不同点的水样各40 mL,以4 000 g离心10 min后弃上清液,取絮团湿质量进行称重后,计算絮团的浓度。
2 结果与分析
2.1 拮抗菌的筛选
菌株02HN在2216E平板上的菌落形态为圆形,边缘整齐,橙黄色。用副溶血弧菌、哈维氏弧菌、坎贝氏弧菌、欧文氏弧菌、溶藻弧菌和美人鱼发光杆菌测试菌株02HN的拮抗作用(图1),可见菌株02HN对6株致病菌的生长均具有一定的抑制作用,但抑制效果存在差异。
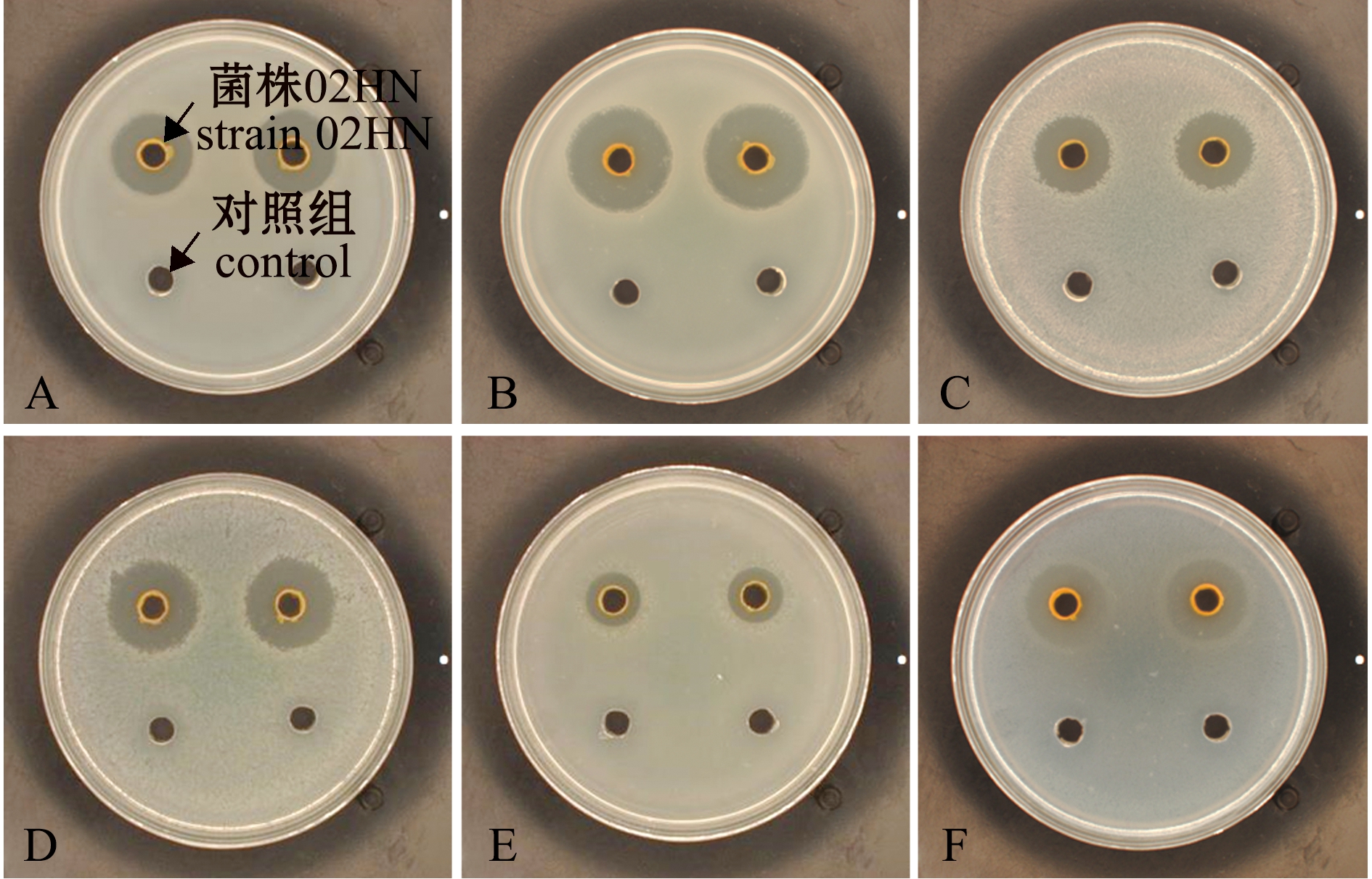
A~F—副溶血弧菌、哈维氏弧菌、坎贝氏弧菌、欧文氏弧菌、溶藻弧菌和美人鱼发光杆菌。
A-F—V.parahaemolyticus,V.harveyi,V.cambellii,V.owensii,V. alginolyticus and P.damselae,respectively.
图1 菌株02HN对6株虾病原菌的抑菌效果
Fig.1 Antibacterial effect of strain 02HN against 6 strains of shrimp pathogenic bacteria
测量菌株02HN对6株虾病原菌的抑菌圈直径,结果显示,菌株02HN对病原菌抑制效果最强的是哈维氏弧菌,其次是欧文氏弧菌,溶藻弧菌的抑菌圈直径最小(表2)。
表2 菌株02HN对不同病原菌的拮抗效果评价
Tab.2 Evaluation of antagonistic effect of strain 02HN against different pathogenic bacteria
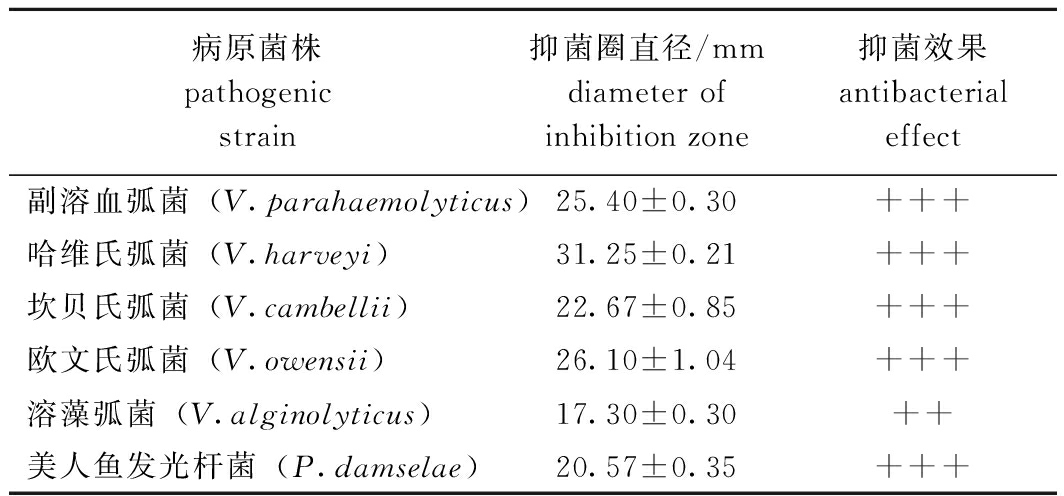
病原菌株pathogenic strain抑菌圈直径/mmdiameter of inhibition zone抑菌效果antibacterial effect副溶血弧菌(V.parahaemolyticus)25.40±0.30+++哈维氏弧菌(V.harveyi)31.25±0.21+++坎贝氏弧菌(V.cambellii)22.67±0.85+++欧文氏弧菌(V.owensii)26.10±1.04+++溶藻弧菌(V.alginolyticus)17.30±0.30++美人鱼发光杆菌(P.damselae)20.57±0.35+++
注:+++表示高度抑菌效果,定义直径>20 mm;++表示中等抑菌效果,16 mm<直径≤20 mm;+表示弱抑菌效果,7.8 mm<直径≤16 mm;-表示无抑菌效果,直径=7.8 mm。
Note:+++ means highly bacteriostatic,and the defined diameter is>20 mm;++ means medium bacteriostatic effect,16 mm < diameter ≤ 20 mm;+ indicates weak bacteriostatic effect,7.8 mm < diameter ≤ 16 mm;- means no bacteriostatic effect,diameter=7.8 mm.
2.2 菌株02HN对6株致病菌的最低抑菌浓度
菌株02HN发酵液经10倍梯度稀释后,检测不同浓度菌液对6株致病菌的最低抑菌浓度,结果显示,菌株02HN对欧文氏弧菌、哈维氏弧菌、坎贝氏弧菌、溶藻弧菌、副溶血弧菌和美人鱼发光杆菌的最低抑菌浓度分别为2.32×104、2.32×103、2.32×106、2.32×106、2.32×103、2.32×106 CFU/mL(表3)。表明菌株02HN对哈维氏弧菌和副溶血弧菌2种对虾病原菌极为敏感。
表3 菌株02HN对6株虾病原菌的最低抑菌浓度
Tab.3 Minimum inhibitory concentration of strain 02HN against 6 pathogens bacteria of shrimp

指示菌indicator bacterium菌株02HN浓度 concentration of strain 02HN/(CFU·mL-1)2.32×1072.32×1062.32×1052.32×1042.32×1032.32×102欧文氏弧菌(V.owensii)++++——哈维氏弧菌(V.harveyi)+++++—坎贝氏弧菌(V.cambellii)++————溶藻弧菌(V.alginolyticus)++————副溶血弧菌(V.parahaemolyticus)+++++—美人鱼发光杆菌(P.damselae)++————
注:+表示有抑菌活性;—表示无抑菌活性。
Note:+ means with bacteriostatic activity;—means without bacteriostatic activity.
2.3 菌株的分子鉴定
用PCR扩增菌株02HN的16S rRNA序列,结果显示,16S rRNA扩增产物经测序得到1 437 bp的基因序列(图2),将该序列提交到GenBank(登录号ON619585)。将测得的序列在NCBI上进行BLAST同源性分析,结果显示,该菌株与杀鱼假交替单胞菌(KY366347.1)的一致性最高,为99.7%。选取与菌株02HN同源性较高的假交替单胞菌及其他属细菌的15个16S rRNA序列,构建系统发育进化树(图3),结果显示,该菌株与杀鱼假交替单胞菌(Pseudoalteromonas piscicida)聚为一支,表明菌株02HN为一株假交替单胞菌。
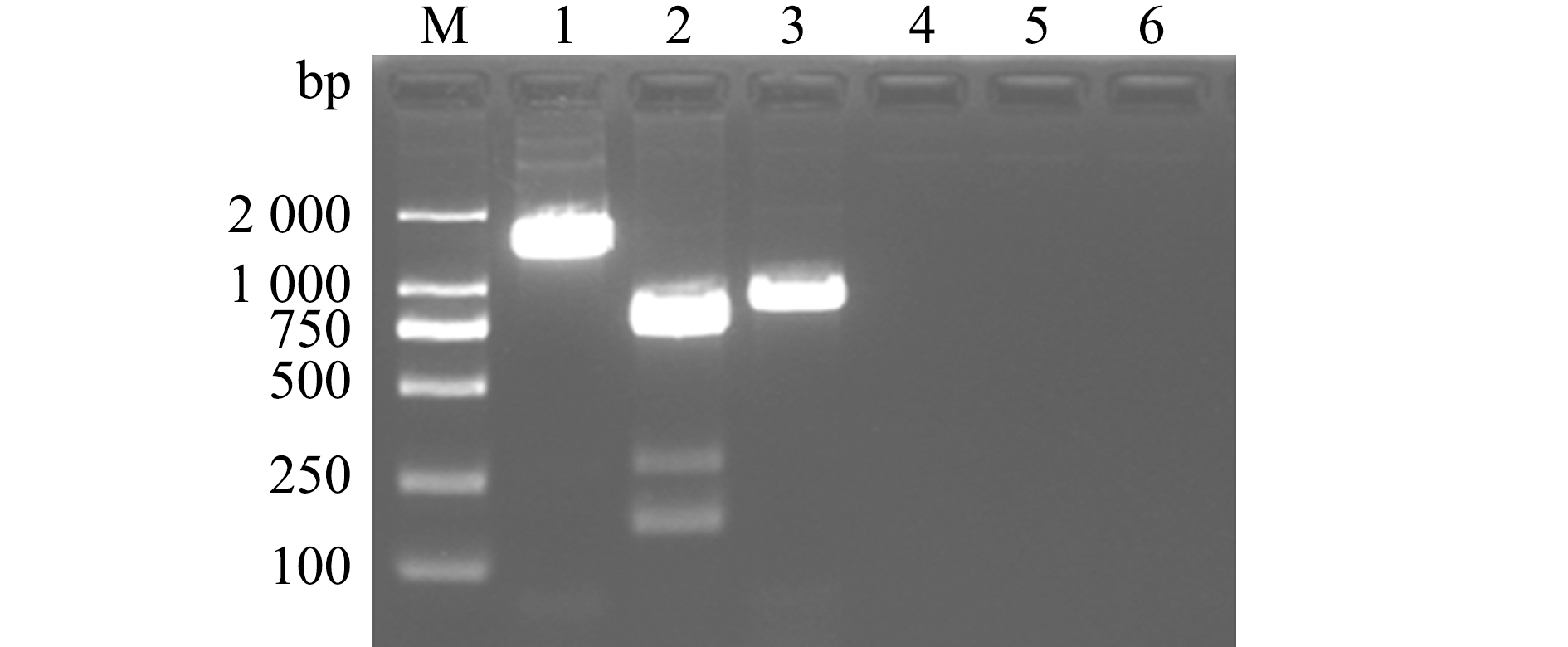
M—DL2000 DNA marker;1—16S rRNA基因;2—gyrB基因;3—rpoD基因;4~6—空白对照。
M—DL2000 DNA marker;1—16S rRNA gene;2—gyrB gene;3—rpoD gene;4-6—blank control.
图2 菌株02HN管家基因电泳结果
Fig.2 Electrophoresis results of housekeeping gene of strain 02HN
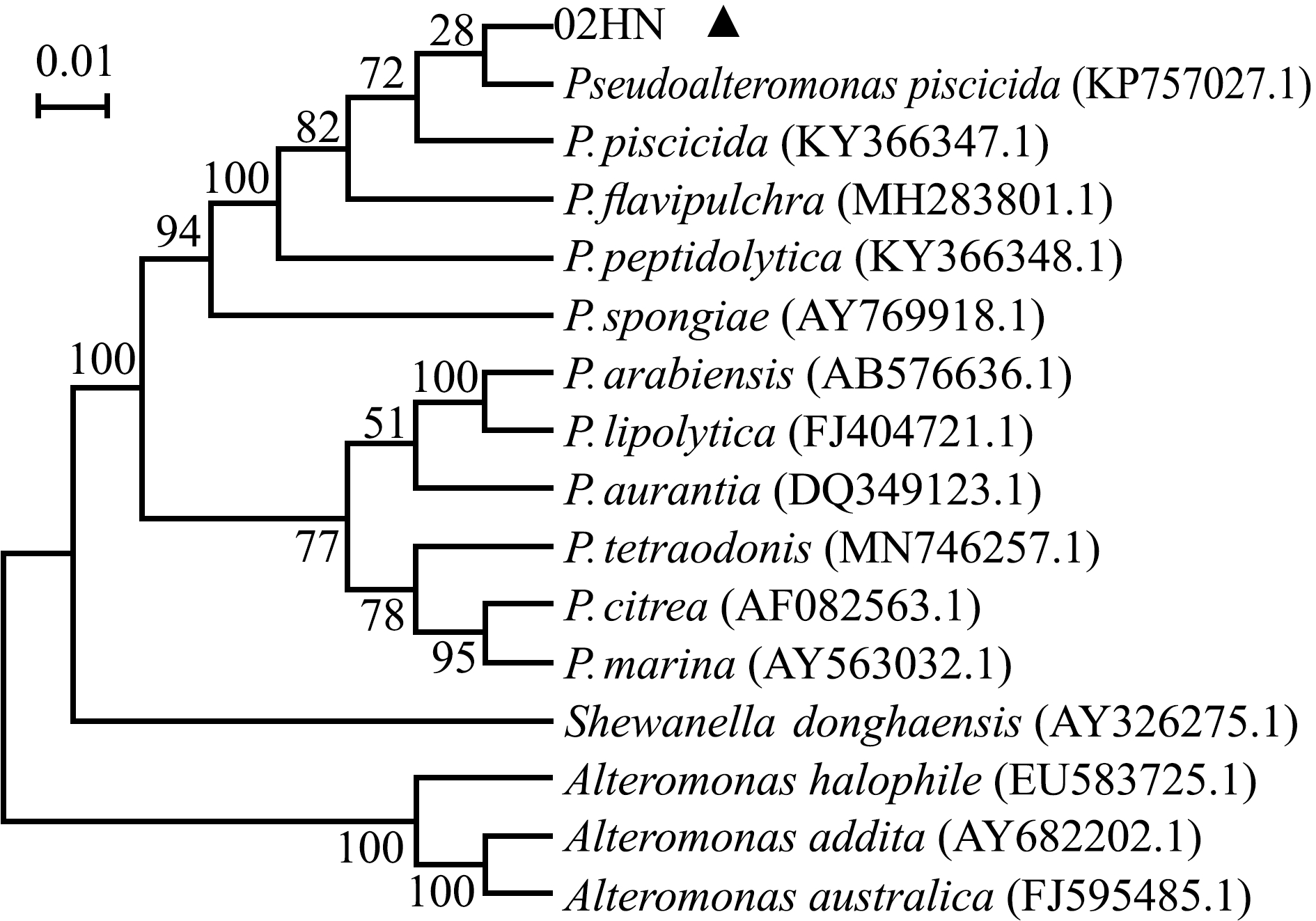
节点数字表示bootstrap支持率,1 000次重复,下同。
Numbers at nodes indicate the percentage of bootstrap support after 1 000 replicates,et sequentia.
图3 基于16S rRNA序列构建的菌株02HN与相近菌株的系统进化树
Fig.3 Phylogenetic tree of strain 02HN and its closest relatives based on 16S rRNA sequence
用PCR扩增菌株02HN的gyrB和rpoD基因序列,对扩增产物进行测序,将测得的核苷酸序列在NCBI上进行BLAST同源性分析,结果显示,两个基因均与杀鱼假交替单胞菌的核苷酸序列一致性最高,分别为99.66%和99.86%。基于gyrB-rpoD串联基因序列构建菌株02HN的系统进化树,结果显示,菌株02HN的分类地位界于P.piscicida与P.flavipulchra之间(图4),表明菌株02HN为假交替单胞菌属中的一个种。
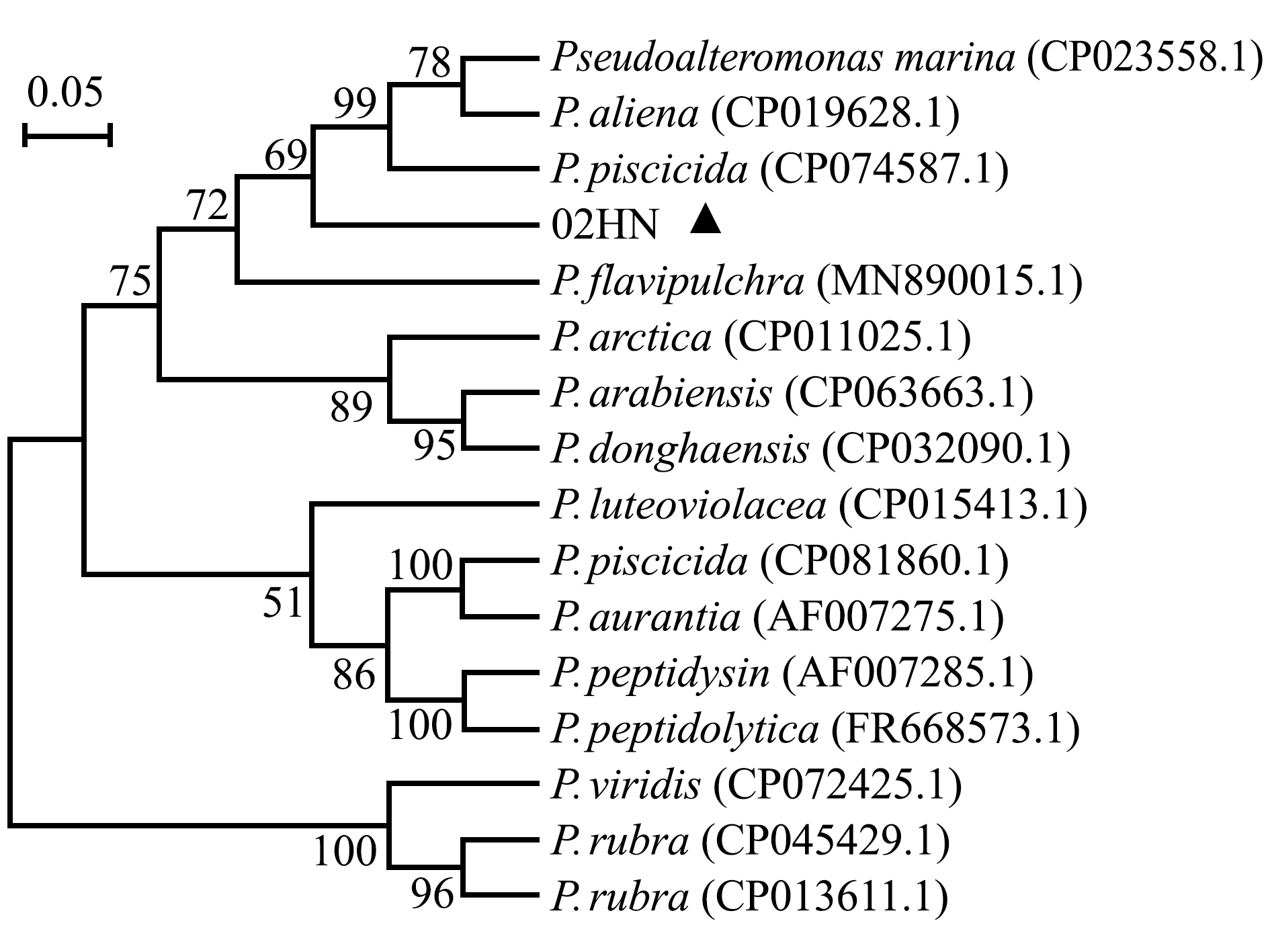
图4 基于gyrB-rpoD串联基因序列构建的菌株02HN的系统进化树
Fig.4 Phylogenetic tree of strain 02HN and its closest relatives based on gyrB-rpoD sequence
2.4 菌株02HN的生化鉴定
采用Biolog Gen Ⅲ微孔板细菌鉴定系统,测试菌株02HN的94个表型(表4)。从表4可见,菌株02HN对26个检测指标表现出阳性,而参考菌株2515对31个检测指标表现出阳性。菌株02HN和2515均可在1% NaCl、4% NaCl、8% NaCl、乳酸钠、pH 6、梭链孢酸和四唑蓝的条件下生长,在林肯霉素中菌株02HN能够生长,而菌株2515的生长受到抑制;菌株2515可在α-D-葡糖、D-甘露糖、D-麦芽糖、蜜二糖等存在下生长,而菌株02HN呈阴性反应。这表明,菌株02HN与参考菌株杀鱼假交替单胞菌2515在生理生化检测中存在一定差异。通过Microlog 3软件读取菌株02HN的鉴定结果,显示该菌的最大SIM值及DIST均较低,分别为0.06与14.25,表明该数据库中无分类地位与之匹配的菌株。
表4 菌株02HN的生化鉴定结果
Tab.4 Biochemical identification results of strain 02HN

鉴定项目identification item02HN2515鉴定项目identification item02HN2515鉴定项目identification item02HN2515糊精 dextrin++D-海藻糖 D-trehalose/+α-酮-丁酸 α-keto-butyric acid—/D-半乳糖 D-galactose+/L-精氨酸 L-arginine—+D-葡糖-6-磷酸 D-glucose6-PO4—/L-半乳糖醛酸内酯L-galactonic acid lactone+/β-羟基-D,L丁酸β-hydroxy-D,L butyric acid/+α-酮-戊二酸 α-keto-glutaric acid——D-水杨苷 D-salicin+/龙胆二糖 gentiobiose/+L-谷氨酸 L-glutamic acid——N-乙酰神经氨酸N-acetyl neuraminic acid+/N-乙酰-D-葡糖胺N-acetyl-D-glucosamine—+N-乙酰-β-D-甘露糖胺N-acetyl-β-D-mannosamine—/D-果糖 D-fructose++蔗糖 sucrose—+D-果糖-6-磷酸 D-fructose-6-PO4—/葡糖醛酰胺 glucuronamide+/L-苹果酸 L-malic acid/+黏液酸 mucic acid——乙酰乙酸 acetoacetic acid++L-丝氨酸 L-serine—+D-苹果酸 D-malic acid——L-果糖 L-fructose++棉子糖 D-raffinose//D-天冬氨酸 D-aspartic acid//L-组胺 L-histidine+/D-山梨醇 D-sorbitol//L-焦谷氨酸 L-pyroglutamic acid—/丙酸 propionic acid+/明胶 gelatin—/奎宁酸 quinic acid——D-松二糖 D-turanose++果胶 pectin——水苏糖 stachyose—/N-乙酰-D-半乳糖胺 N-acetyl-D-galactosamine++p-羟基-苯乙酸 p-hydroxy-phenylacetic acid/—糖质酸 D-saccharic acid//L-鼠李糖 L-rhamnose++吐温40 tween 40——溴-丁二酸 bromo-succinic acid——乙酸 acetic acid++α-D-乳糖 α-D-lactose//甲酸 formic acid——3-甲酰葡糖 3-methyl glucose++D-甘露醇 D-mannitol—/醋竹桃霉素 troleandomycin——肌苷 inosine++e氨基乙酰-L-脯氨酸 glycyl-L-prolin—/万古霉素 vancomycin//D-丝氨酸 D-serine+/D-半乳糖醛酸 D-galacturonic acid—/萘啶酸 nalidixic acid——1% NaCl++丙酮酸甲酯 methyl pyruvate——氨曲南 aztreonam//乳酸钠 1% sodium lactate++γ-氨基-丁酸 γ-amino-butyric acid//利福霉素SV rifamycin SV——林肯霉素 lincomycin+/D-阿拉伯醇 D-arabitol//盐酸胍 guanidine HCl——pH 6++D-乳酸甲酯 D-lactic acid methyl ester——四唑紫 tetrazolium violet//4% NaCl++α-羟基-丁酸 α-hydroxy-butyric acid/ —氯化锂 lithium chloride——梭链孢酸 fusidic acid++β-甲酰-D-葡糖苷 β-methyl-D-glucoside//丁酸钠 sodium butyrate——8% NaCl++肌醇 myo-inositol//pH 5——四唑蓝 tetrazolium blue++D-葡糖酸 D-gluconic acid/—D-丝氨酸 D-serine//α-D-葡糖 α-D-glucose/+L-乳酸 L-lactic acid——二甲胺四环素 minocycline——D-甘露糖 D-mannose—+D-纤维二糖 D-cellobiose—/硫酸四癸钠 niaproof 4——D-麦芽糖 D-maltose—+甘油 glycerol—/亚碲酸钾 potassium tellurite——蜜二糖 D-melibiose/+L-天冬氨酸 L-aspartic acid——溴酸钠 sodium bromate——D-果糖 D-fructose—+D-葡糖醛酸 D-glucuronic acid//L-丙氨酸 L-alanine—+柠檬酸 citric acid——
注:+表示阳性;—表示阴性;/表示边界值。
Note:+ means positive reaction;— means negative reaction;/ means borderline.
2.5 菌株02HN对对虾的生物毒性
用不同浓度的菌株02HN浸泡感染凡纳滨对虾,试验至6 d后统计其死亡率(表5)。养殖过程中发现,菌株02HN高浓度组(1.70×108 CFU/mL)在感染后48 h内无死亡,至第3天时有一只对虾死亡,而在第5天时1.70×107 CFU/mL组也有一只对虾死亡;阳性对照副溶血弧菌的2个高浓度组(1.55×108、1.55×107 CFU/mL),在浸泡24 h内死亡率分别高达100%、90%,感染后的对虾空肠空胃,肝胰腺呈淡黄色;阴性对照枯草芽孢杆菌1.58×107 CFU/mL组,在试验第3天时有一只对虾死亡;空白对照组对虾活力正常,无死亡。菌株02HN浸泡感染对虾的LC50为1.96×1010 CFU/mL,安全浓度为1.96×109 CFU/mL,副溶血弧菌浸泡感染对虾的LC50为3.15×106 CFU/mL,菌株02HN的LC50是副溶血弧菌的6 222倍,表明菌株02HN在浓度为107 CFU/mL以下时,对对虾生物毒性不明显。
表5 浸泡感染菌株02HN后凡纳滨对虾的死亡率
Tab.5 Mortalities of Litopenaeus vannamei challenged by strain 02HN immersion
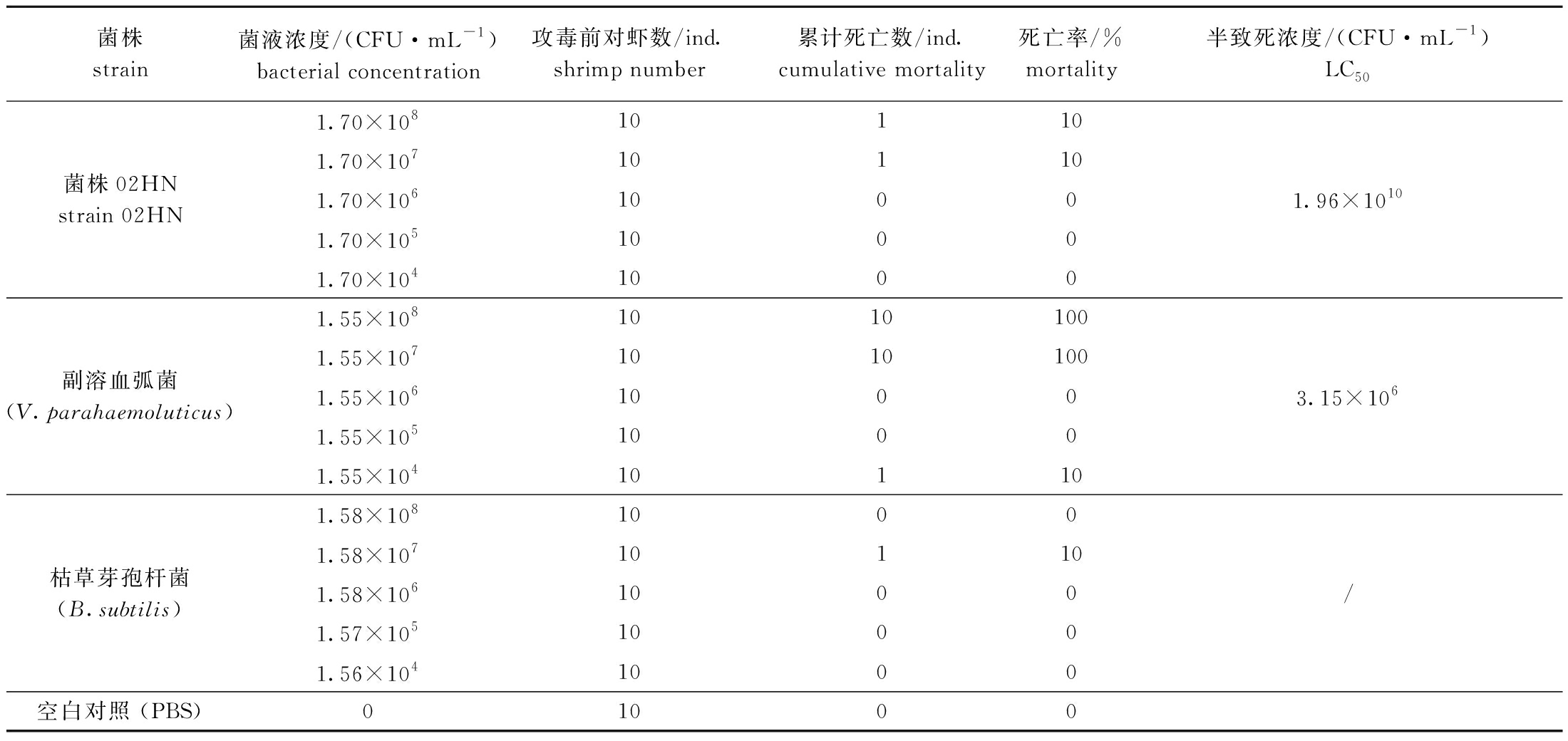
菌株strain菌液浓度/(CFU·mL-1)bacterial concentration攻毒前对虾数/ind.shrimp number累计死亡数/ind.cumulative mortality死亡率/%mortality半致死浓度/(CFU·mL-1)LC501.70×108101101.70×10710110菌株02HNstrain 02HN1.70×10610001.96×10101.70×10510001.70×10410001.55×10810101001.55×1071010100副溶血弧菌(V.parahaemoluticus)1.55×10610003.15×1061.55×10510001.55×104101101.58×10810001.58×10710110枯草芽孢杆菌(B.subtilis)1.58×1061000/1.57×10510001.56×1041000空白对照 (PBS)01000
注:/表示LC50值高,测量不出。
Note:/ means that the LC50 is too high to be measured.
2.6 菌株02HN的溶血活性
菌株02HN在羊血和鱼血琼脂平板上的溶血效果见图5,菌株02HN对羊及鱼的红细胞均具有溶血活性,菌株02HN的溶血效果与阳性对照菌株2515在两种血平板上的溶血活性相似。
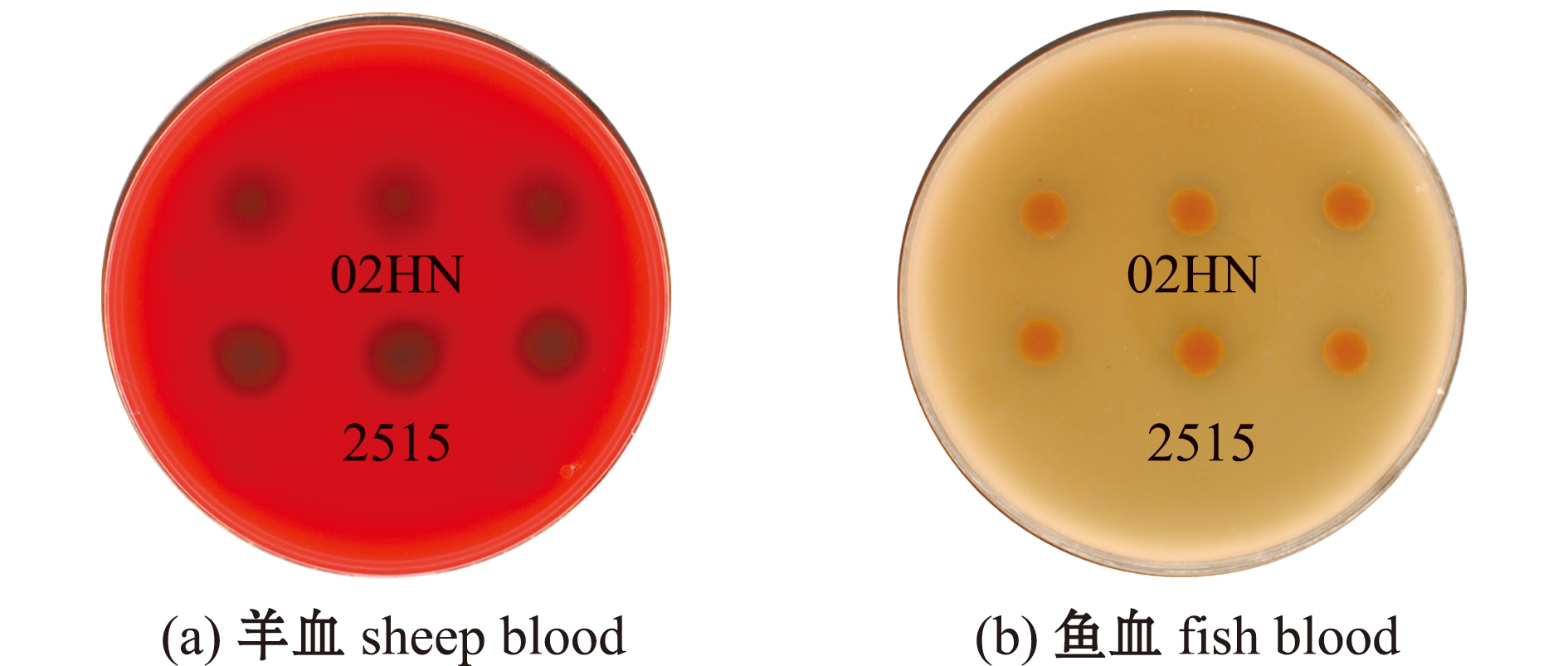
图5 菌株02HN在羊血和鱼血平板上的溶血情况
Fig.5 Hemolysis of strain 02HN on sheep blood and fish blood agar plates
2.7 菌株02HN在对虾养殖中的抑菌效果
投喂分别添加菌株02HN含量为1×105 、1×107 cells/g的饲料养殖凡纳滨对虾28 d后,对虾的存活率及体长增长率与对照组无显著性差异(P>0.05),表明饲料中添加菌株02HN不影响对虾的生长及存活(表6)。分析各组对虾肝胰腺、肠道中的弧菌总数,试验组与对照组间存在一定差异。养殖3、28 d时,与对照组相比,饲料中分别添加含量为1×105、1×107 cells/g的菌株02HN,均能显著降低虾肝胰腺中弧菌的数量(P<0.05);养殖至第3天时,低菌含量试验组(1×105 cells/g)虾肠道中的弧菌数量显著低于对照组(P<0.05),至第28天时,试验组与对照组均维持在104 数量级,但低菌含量组显著高于高菌含量组与对照组(P<0.05)(表7)。统计第28天时各组养殖水体中生物絮团的密度,饲料中添加含量为1×105 、1×107 cells/g的菌株02HN后,养殖水体生物絮团的密度与对照组均无显著性差异(P>0.05)(表8)。
表6 各组对虾的存活率和体长增长率
Tab.6 Survival rate and body length growth rate of shrimp in each group

02HN含量/(cells·g-1)02HN content存活率/%survival rate体长增长率/%body length gain1×10596.67±4.71 a31.85±15.70a1×10797.78±3.85a28.66±6.60a0 (对照 control)98.89±1.92a23.57±10.17a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
表7 对虾肝胰腺、肠道中的弧菌数量
Tab.7 Vibrios count in hepatopancreas and intestine of shrimp
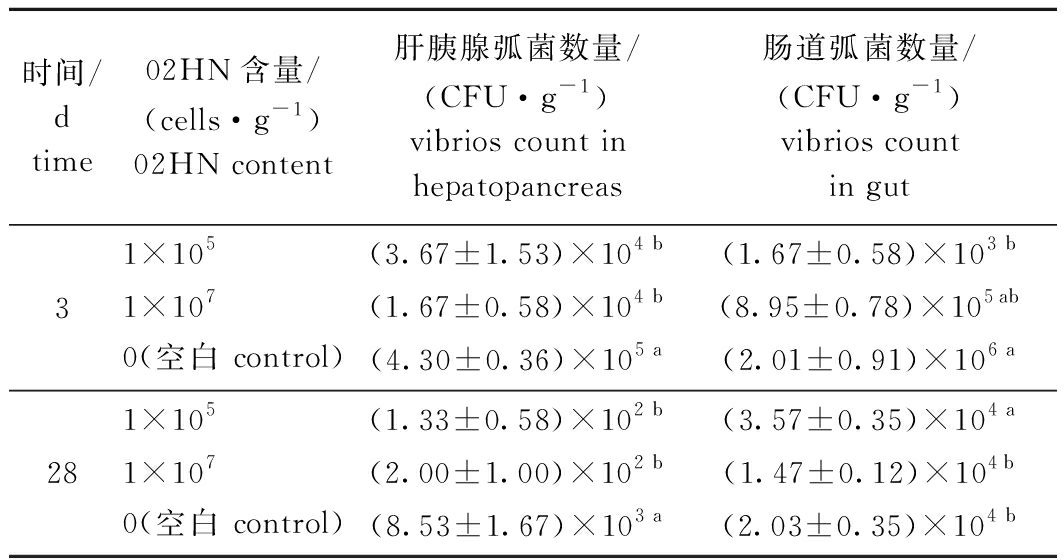
时间/dtime02HN含量/(cells·g-1)02HN content肝胰腺弧菌数量/(CFU·g-1)vibrios count in hepatopancreas肠道弧菌数量/(CFU·g-1)vibrios countin gut31×105(3.67±1.53)×104 b(1.67±0.58)×103 b1×107(1.67±0.58)×104 b(8.95±0.78)×105ab0(空白 control)(4.30±0.36)×105 a(2.01±0.91)×106 a281×105(1.33±0.58)×102 b(3.57±0.35)×104 a1×107(2.00±1.00)×102 b(1.47±0.12)×104b0(空白 control)(8.53±1.67)×103 a(2.03±0.35)×104 b
表8 各组养殖水体中生物絮团密度
Tab.8 Density of biofloc in water of each group

02HN含量/(cells·g-1)02HN content絮团密度/(g·L-1)density of biofloc1×1057.75±0.43 a1×1078.45±1.54a0 (对照 control)8.88±0.80a
3 讨论
3.1 菌株02HN的分离鉴定
假交替单胞菌是由Gaulthier等[23]于1995年发现并命名的一类好氧异养型不产芽孢、具有鞭毛的革兰氏阴性细菌。已发现的假交替单胞菌均分离自海洋环境,该属细菌能在甲壳动物、无脊椎动物幼虫等生物表面附着,多种多样的适应机制使其在海洋生态系统中扮演着重要的角色。据研究报道,该属菌株能够分泌多种胞外活性物质,包括抗菌溶菌物质、抗生素、抗真菌物质、胞外酶类及胞外多糖等,在海洋生物地化循环中发挥着重要作用,并具有良好的应用前景[24-25]。假交替单胞菌属细菌分为产生色素和不产生色素两类,两类菌产生的生物活性物质在功能上存在较大差异[24],产生抗菌代谢产物的假交替单胞菌多分泌色素类[26]。本研究中的菌株02HN分离自海水环境,可产黄色色素,该菌与Biolog Gen Ⅲ 微生物鉴定系统中的已知菌均存在较大差别,不能给出准确的鉴定结果,与已知的杀鱼假交替单胞菌2515在测试的94个反应表型中也存在较大区别,但通过分子生物学、形态学及生物活性的特点,可综合判定该菌应为一株假交替单胞菌。
3.2 菌株02HN对病原菌的拮抗效果
许多拮抗菌产生的抑菌物质能够杀死病原菌或对病原菌的生长起到一定抑制作用。从大菱鲆(Scophthalmus maximus)养殖水中分离的一株金丽假交替单胞菌(P.flavipulchra),能合成具有L-氨基酸氧化酶活性的假交替单胞菌抗菌蛋白(PfaP)和5种小分子化合物,对多种弧菌、气单胞菌和芽孢杆菌具有抑制作用[27]。Wang等[28]从健康凡纳滨对虾体中分离出的两株假交替单胞菌可以形成黄色菌落,产生氧化酶和水解明胶,两个菌株均表现出对对虾肝胰腺坏死病原VpAHPND具有拮抗活性,应用于对虾养殖中能降低对虾感染VpAHPND后的死亡率。Richards等[29]研究表明,假交替单胞菌会释放蛋白水解酶等抗菌物质,并转移水解囊泡来破坏弧菌。本研究中分离并鉴定的假交替单胞菌02HN,对副溶血弧菌、哈维氏弧菌、坎贝氏弧菌、欧文氏弧菌、溶藻弧菌和美人鱼发光杆菌均表现出良好的拮抗效果,但其拮抗机制还有待深入研究。
3.3 菌株02HN对对虾的生物毒性
研究发现,某些假交替单胞菌属细菌对病原菌有良好的拮抗作用,但也有报道显示,假交替单胞菌属中的有些细菌对养殖动物表现出一定的致病性,可产生胞外毒素并引起鱼类或蟹类死亡[30],以及海参溃疡、腐皮[31]。一株与菌株02HN分类地位相近的假交替单胞菌对鱼类红细胞具有溶血活性,而对对虾的血细胞无溶血效果[15]。本研究中,菌株02HN为分离自健康对虾育苗池中的海洋菌,尽管该菌对对虾的LC50高达1.96×1010 CFU/mL,但在攻毒过程中仍然出现个别虾死亡,表明该菌可能对对虾存在弱毒性。作为一种对对虾弧菌病原具有广谱拮抗效果的潜在益生菌,为使其能在海水养殖中开发应用,在生物安全性评价方面尚需进行综合研究,阐明其可能存在毒素的种类、敏感宿主、脱除方法及抗药性等,确保该菌株在有效的前提下,对养殖动物、养殖环境及人具有良好的安全性。
3.4 口服菌株02HN对对虾体内弧菌的抑制作用
Wang等[28]将假交替单胞菌添加到凡纳滨对虾饲料中,结果显示,对虾肠道内的弧菌数有所降低,并显著降低了受副溶血弧菌感染后的死亡率。胡毅等[32]研究发现,饲料中添加枯草芽孢杆菌在试验前期和末期均能显著降低对虾肠道的弧菌数量。本研究中也有类似结果,在饲料中分别添加含量为1×105、1×107 cells/g的菌株02HN,对对虾的生长和存活无显著性影响。在试验初及试验末的两次检测中,两个试验组与对照组相比均能显著降低对虾肝胰腺中的弧菌数量;而对对虾肠道中的弧菌数量,仅低菌含量组弧菌数在试验初期有显著降低,在试验后期,试验组对虾肠道弧菌数量尽管存在差别,但基本趋于一致,维持在相同的数量级。纵向比较两次检测结果可知,各组肝胰腺中的弧菌数量随养殖时间增长而减少,而肠道中的弧菌数量在高菌含量试验组与对照组中均出现减少趋势,在低菌含量试验组中出现增加趋势。推测可能是随着投喂时间的延长,菌株02HN的抗菌成分在肝胰腺中持续发挥作用,同时在养殖环境中因生物絮团养殖系统的稳定运行,弧菌的密度也存在逐渐下降的趋势[33],但菌株抗菌物质对对虾肠道中弧菌的抑制效果不显著,提示对虾口服菌株02HN后,抗菌活性物质在对虾消化系统中的代谢机制尚待阐明。
综上可知,假交替单胞菌菌株02HN对多种对虾病原菌具有拮抗作用,当饲料中菌株02HN添加量为1×107 cells/g以下时,不仅对凡纳滨对虾无明显的副作用,而且能够降低肝胰腺中弧菌的数量,表明该菌具有较高的产业开发价值。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会编制.2021中国渔业统计年鉴 [M].北京:中国农业出版社,2021.
Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Station,China Society of Fisheries.2021 China fisheries statistical yearbook [M].Beijing:China Agriculture Press,2021.(in Chinese)
[2] DE LA PE A L D,CABILLON N A R,CATEDRAL D D,et al.Acute hepatopancreatic necrosis disease (AHPND) outbreaks in Penaeus vannamei and P.monodon cultured in the Philippines[J].Diseases of Aquatic Organisms,2015,116(3):251-254.
A L D,CABILLON N A R,CATEDRAL D D,et al.Acute hepatopancreatic necrosis disease (AHPND) outbreaks in Penaeus vannamei and P.monodon cultured in the Philippines[J].Diseases of Aquatic Organisms,2015,116(3):251-254.
[3] ZOU Y,XIE G S,JIA T C,et al.Determination of the infectious agent of translucent post-larva disease (TPD) in Penaeus vannamei[J].Pathogens,2020,9(9):741.
[4] ZHANG D H,BADER T J,LANGE M D,et al.Toxicity of recombinant PirA and PirB derived from Vibrio parahaemolyticus in shrimp[J].Microbial Pathogenesis,2021,155:104886.
[5] ROBERTSON P,CALDERON J,CARRERA L,et al.Experimental Vibrio harveyi infections in Penaeus vannamei larvae[J].Diseases of Aquatic Organisms,1998,32:151-155.
[6] THIRUGNANASAMBANDAM R,INBAKANDAN D,ABRAHAM L S,et al.De novo assembly and annotation of the whole genomic analysis of Vibrio campbellii RT-1 strain,from infected shrimp:Litopenaeus vannamei[J].Microbial Pathogenesis,2017,113:372-377.
[7] LIU L Y,XIAO J Z,ZHANG M M,et al.A Vibrio owensii strain as the causative agent of AHPND in cultured shrimp,Litopenaeus vannamei[J].Journal of Invertebrate Pathology,2018,153:156-164.
[8] NGO H V,HUANG H T,LEE P T,et al.Effects of Phyllanthus amarus extract on nonspecific immune responses,growth,and resistance to Vibrio alginolyticus in white shrimp Litopenaeus vannamei[J].Fish &Shellfish Immunology,2020,107(Pt A):1-8.
[9] AKBARY P,ADESHINA I,JAHANBAKHSHI A.Growth performance,digestive enzymes,antioxidant activity and immune responses of Litopenaeus vannamei fed with Jania adhaerens J.V.supplemented diet against Photobacterium damselae infection[J].Animal Feed Science and Technology,2020,270:114696.
[10] PANTOJAC R,LIGHTNER D V,NOBLE B L,et al.Early mortality syndrome affects shrimp in Asia [J].Global Aquaculture Advocate,2012,15(1):40.
[11] THITAMADEE S,PRACHUMWAT A,SRISALA J,et al.Review of current disease threats for cultivated penaeid shrimp in Asia[J].Aquaculture,2016,452:69-87.
[12] LEYVA-MADRIGAL K Y,LUNA-GONZ LEZ A,ESCOBEDO-BONILLA C M,et al.Screening for potential probiotic bacteria to reduce prevalence of WSSV and IHHNV in whiteleg shrimp (Litopenaeus vannamei) under experimental conditions[J].Aquaculture,2011,322/323:16-22.
LEZ A,ESCOBEDO-BONILLA C M,et al.Screening for potential probiotic bacteria to reduce prevalence of WSSV and IHHNV in whiteleg shrimp (Litopenaeus vannamei) under experimental conditions[J].Aquaculture,2011,322/323:16-22.
[13] 张欢欢,王秀华,李晨,等.对虾养殖池中一株弧菌拮抗菌的分离鉴定[J].渔业科学进展,2016,37(3):85-92.
ZHANG H H,WANG X H,LI C,et al.Isolation and identification of a bacterial strain with vibrios-antagonism from shrimp ponds[J].Progress in Fishery Sciences,2016,37(3):85-92.(in Chinese)
[14] 于敏.金丽假交替单胞菌JG1抑菌机理研究[D].青岛:中国海洋大学,2013.
YU M.The antibacterial mechanism of Pseudoalteromonas flavipulchra JG1[D].Qingdao:Ocean University of China,2013.(in Chinese)
[15] 张宇哲,王秀华,于党辉,等.抗弧菌杀鱼假交替单胞菌2515的潜在毒性及热处理脱毒后抗菌效果[J].大连海洋大学学报,2021,36(3):399-405.
ZHANG Y Z,WANG X H,YU D H,et al.Potential toxicity,antibacterial effect and antagonistic activity against Vibrio of a strain of bacterium Pseudoalteromonas piscicida 2515 exposed to heat treatment detoxification[J].Journal of Dalian Ocean University,2021,36(3):399-405.(in Chinese)
[16] 李静舒,张恒慧,贺东亮.高活菌数微生态制剂的制备及其抑菌活性研究[J].饲料研究,2020,43(1):96-100.
LI J S,ZHANG H H,HE D L.Study on preparation and antibacterial activity of probiotics with high viable count[J].Feed Research,2020,43(1):96-100.(in Chinese)
[17] 李成海,贠建民,艾对元,等.金黄色葡萄球菌拮抗菌株的筛选及鉴定[J].食品工业科技,2013,34(7):195-198.
LI C H,YUN J M,AI D Y,et al.Screening and identification of bacterial strain against Staphyloccocus aureus[J].Science and Technology of Food Industry,2013,34(7):195-198.(in Chinese)
[18] Y
 EZ M A,CATAL
EZ M A,CATAL N V,APR
N V,APR IZ D,et al.Phylogenetic analysis of members of the genus Aeromonas based on gyrB gene sequences[J].International Journal of Systematic and Evolutionary Microbiology,2003,53(Pt 3):875-883.
IZ D,et al.Phylogenetic analysis of members of the genus Aeromonas based on gyrB gene sequences[J].International Journal of Systematic and Evolutionary Microbiology,2003,53(Pt 3):875-883.
[19] SENDEROVICH Y,KEN-DROR S,VAINBLAT I,et al.A molecular study on the prevalence and virulence potential of Aeromonas spp.recovered from patients suffering from diarrhea in Israel[J].PLoS One,2012,7(2):e30070.
[20] KHALIFA A,ALDAYEL M.Isolation and characterisation of the agarolytic bacterium Pseudoalteromonas ruthenica[J].Open Life Sciences,2019,14:588-594.
[21] 王枫林,王秀华,张宇哲,等.杀鱼假交替单胞菌2515的抗弧菌效果及在对虾养殖中的应用[J].中国水产科学,2021,28(7):903-913.
WANG F L,WANG X H,ZHANG Y Z,et al.Anti-Vibrio effect of Pseudoalteromonas piscicida 2515 and its application in shrimp culture[J].Journal of Fishery Sciences of China,2021,28(7):903-913.(in Chinese)
[22] 王磊.脱氮菌的筛选及在凡纳滨对虾生物絮团养殖中的应用[D].上海:上海海洋大学,2015.
WANG L.The selection and application of denitrifying bacteria in Litopenaeus vannamei biological floccules breeding[D].Shanghai:Shanghai Ocean University,2015.(in Chinese)
[23] GAUTHIER G,GAUTHIER M,CHRISTEN R.Phylogenetic analysis of the genera Alteromonas,Shewanella,and Moritella using genes coding for small-subunit rRNA sequences and division of the genus Alteromonas into two genera,Alteromonas (emended) and Pseudoalteromonas gen.nov.,and proposal of twelve new species combinations[J].International Journal of Systematic Bacteriology,1995,45(4):755-761.
[24] BOWMAN J P.Bioactive compound synthetic capacity and ecological significance of marine bacterial genus Pseudoalteromonas[J].Marine Drugs,2007,5(4):220-241.
[25] ZHOU M Y,CHEN X L,ZHAO H L,et al.Diversity of both the cultivable protease-producing bacteria and their extracellular proteases in the sediments of the South China Sea[J].Microbial Ecology,2009,58(3):582-590.
[26] HUANG Y L,LI M,YU Z L,et al.Correlation between pigmentation and larval settlement deterrence by Pseudoalteromonas sp.sf57[J].Biofouling,2011,27(3):287-293.
[27] YU M,TANG K H,LIU J W,et al.Genome analysis of Pseudoalteromonas flavipulchra JG1 reveals various survival advantages in marine environment[J].BMC Genomics,2013,14:707.
[28] WANG H L,WANG C D,TANG Y,et al.Pseudoalteromonas probiotics as potential biocontrol agents improve the survival of Penaeus vannamei challenged with acute hepatopancreatic necrosis disease (AHPND)-causing Vibrio parahaemolyticus[J].Aquaculture,2018,494:30-36.
[29] RICHARDS G P,WATSON M A,NEEDLEMAN D S,et al.Mechanisms for Pseudoalteromonas piscicida-induced killing of vibrios and other bacterial pathogens[J].Applied and Environmental Microbiology,2017,83(11):e00175-e00117.
[30] 席宇,朱大恒,刘红涛,等.假交替单胞菌及其胞外生物活性物质研究进展[J].微生物学通报,2005,32(3):108-112.
XI Y,ZHU D H,LIU H T,et al.Advances on Pseudoalteromonas species and their extracellular bioactive compounds[J].Microbiology,2005,32(3):108-112.(in Chinese)
[31] 王印庚,方波,张春云,等.养殖刺参保苗期重大疾病“腐皮综合征”病原及其感染源分析[J].中国水产科学,2006,13(4):610-616.
WANG Y G,FANG B,ZHANG C Y,et al.Etiology of skin ulcer syndrome in cultured juveniles of Apostichopus japonicus and analysis of reservoir of the pathogens[J].Journal of Fishery Sciences of China,2006,13(4):610-616.(in Chinese)
[32] 胡毅,谭北平,麦康森,等.饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J].中国水产科学,2008,15(2):244-251.
HU Y,TAN B P,MAI K S,et al.Effects of dietary probiotic on growth,immunity and intestinal bacteria of juvenile Litopenaeus vannamei[J].Journal of Fishery Sciences of China,2008,15(2):244-251.(in Chinese)
[33] CRAB R,DEFOIRDT T,BOSSIER P,et al.Biofloc technology in aquaculture:beneficial effects and future challenges[J].Aquaculture,2012,356/357:351-356.