钝吻黄盖鲽(Pseudopleuronectes yokohamae)隶属于鲽形目(Pleuronectiformes)鲽科(Pleruonectida)黄盖鲽属(Pseudopleuronectes)[1],主要分布于太平洋西部近海,多产于中国的黄海和渤海,是北温带浅海冷水底栖鱼类[2]。其肉质细嫩、食性温和、适应性强并喜好集群[3],是黄海、渤海地区拖网作业的重要对象及理想的增殖对象[4]。
近年来,随着中国海水养殖业的迅速发展,钝吻黄盖鲽的集约化养殖不断扩大。钝吻黄盖鲽养殖过程中使用的饲料主要有冰鲜杂鱼和配合饲料。随着水产绿色健康养殖“五大行动”中“配合饲料替代幼杂鱼行动”的不断推广,养殖饵料已经开始逐渐向人工配合饲料转变。目前,关于冰鲜杂鱼和配合饲料的饲喂对比研究已在大菱鲆(Scophthalmus maximus)、大黄鱼(Larmichthys crocea)、大口黑鲈(Micropterus salmoides)和斜带石斑鱼(Epinephelus coioides)等各种经济鱼类中相继开展,主要涉及生长性能、肌肉营养成分、免疫功能和肠道微生物结构等方面[5-8],但在钝吻黄盖鲽的相关研究中未见报道。不同饲料对鱼类肠道健康状况和菌群组成影响较大,如摄食配合饲料和冰鲜杂鱼的大口黑鲈肠道菌群多样性不同[9],摄食植物和海洋动物的虹鳟(Oncorhynchus mykiss)肠道内优势菌群不同[10]。本研究中,通过高通量测序等方法,对投喂不同饲料的钝吻黄盖鲽进行了生长性能、肠道结构及肠道菌群分析,从其宏观生长及微观结构、肠道菌群等方面探索了钝吻黄盖鲽的营养需求,以期为其饲料的合理配制提供科学参考。
1 材料与方法
1.1 材料
试验用钝吻黄盖鲽为烟台宗哲海洋科技有限公司自繁自育的健康鱼苗,体长为(10.16±0.06)cm。配合饲料为赛格林仔稚鱼育苗专用饲料,其常规营养成分为粗蛋白质52%、粗脂肪8%、粗灰分17%、粗纤维8%和水分12%;冰鲜杂鱼捕捞自烟台沿海,其常规营养成分为粗蛋白质21%、粗脂肪3%、粗灰分4%和水分66%(均为质量分数)。
1.2 方法
1.2.1 试验设计 选取健康且规格整齐的钝吻黄盖鲽270尾,随机分为配合饲料投喂组(CF)、冰鲜杂鱼与配合饲料混合投喂组(MF)及冰鲜杂鱼投喂组(FF)。每组设置3个重复,每个重复30尾鱼,分别放入126 L的塑料箱中养殖,水温为(15±1)℃,盐度为24~30。为保证水质,每天定时更换鱼箱中20%的水量。试验期间,每天7:30和16:30各投喂一次,混合投喂组上午投喂配合饲料,下午投喂冰鲜杂鱼,冰鲜杂鱼经过粉碎后,每次投饵量为鱼体质量的3%,配合饲料每次投饵量为鱼体质量的1%。养殖试验共进行42 d。
1.2.2 生长性能指标的测定 在试验的第0、14、28、42天时分别称量鱼体质量,第42天时测量鱼体长,每天记录各组鱼的摄食量。称量前停食24 h,分别从各组随机取10尾鱼进行测量。
试验结束后,计算各组鱼的增重率(GBW,%)、特定生长率(RSG,%/d)、饲料系数(RFC)和肥满度(FC,g/cm3)。计算公式为
GBW=(Wt-W0)/W0×100%,
(1)
RSG=(lnWt-lnW0)/t×100%,
(2)
RFC=F/(Wt-W0),
(3)
FC=Wt/L3×100。
(4)
其中:W0、Wt分别为试验鱼初始体质量(g)和终末体质量(g);t为试验时间(d);F为养殖周期内的摄食量(g);L为试验结束时的鱼体长(cm)。
1.2.3 肠道结构观察 养殖试验结束后停食24 h,从各组随机取3尾鱼,解剖取其肠道,并立即浸入体积分数为4%的多聚甲醛固定液中固定。肠道组织石蜡切片由生工生物工程(上海)股份有限公司制作。后肠组织在固定液中固定24 h后,用体积分数为70%的乙醇溶液反复冲洗,用叔丁醇脱水,浸蜡包埋,再用冷冻切片机连续切片(厚度6 μm),HE染色。肠道切片在显微镜下观察拍照,并测量绒毛长度、绒毛宽度和基层厚度等指标。
1.2.4 肠道DNA提取与PCR扩增 养殖试验结束后,分别从各组随机取9尾鱼,无菌条件下解剖取出完整肠道,每3尾鱼的肠道内容物作为1个混合样品置入冻存管中,将3个混合样品用液氮速冻后保存待测。肠道样品基因组DNA的提取和测序由生工生物工程(上海)股份有限公司完成。将提取的肠道微生物总DNA用341F(5′CCTAC- GGGNGGCWGCAG 3′)和805R(5′GACTACHVGGGTATCTAATCC 3′)特定引物扩增16S rDNA的V3+V4区,构建测序文库后在Illumina平台完成测序。
1.2.5 肠道菌群生物信息学分析 下机数据使用FLASH 1.2.7[11]、QIIME 1.7.0[11]对样品原始数据(raw reads)进行拼接、过滤及质控,去除嵌合体后获得有效数据(effective tags)。应用Uparse 7.0.1001软件[12]在97%的一致性水平上对样品所有effective tags进行聚类分析,获得OTUs。基于可操作性分类单元OTUs计算Chao1、Shannon、Simpson和ACE指数,并进行Alpha多样性分析。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。采用SPSS 19.0软件进行单因素方差分析,采用Duncan法进行组间多重比较。显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 不同饲料组钝吻黄盖鲽的生长性能
从表1可见:与冰鲜杂鱼组相比,配合饲料组钝吻黄盖蝶增重率、特定生长率显著降低(P<0.05),肥满度变化不大(P>0.05);混合投喂组鱼体的增重率、特定生长率及肥满度等指标均高于配合饲料组,但低于冰鲜杂鱼组(P>0.05);以湿物质为基础的饲料系数表现为冰鲜杂鱼组显著高于配合饲料组(P<0.05),而以干物质为基础的饲料系数则表现为配合饲料组显著高于冰鲜杂鱼组(P<0.05)。
表1 各组钝吻黄盖鲽的生长性能
Tab.1 Growth of Pleuronectes yokohama in each group
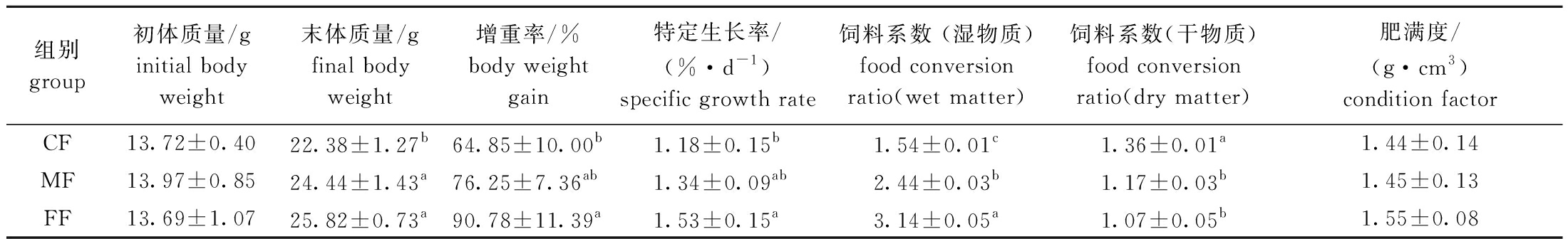
组别group初体质量/ginitial body weight末体质量/g final body weight增重率/%body weight gain特定生长率/(%·d-1)specific growth rate饲料系数 (湿物质)food conversion ratio(wet matter)饲料系数(干物质) food conversion ratio(dry matter)肥满度/(g·cm3)condition factorCF13.72±0.4022.38±1.27b64.85±10.00b1.18±0.15b1.54±0.01c1.36±0.01a1.44±0.14MF13.97±0.8524.44±1.43a76.25±7.36ab1.34±0.09ab2.44±0.03b1.17±0.03b1.45±0.13FF13.69±1.0725.82±0.73a90.78±11.39a1.53±0.15a3.14±0.05a1.07±0.05b1.55±0.08
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
2.2 不同饲料组钝吻黄盖鲽的肠道结构
钝吻黄盖鲽肠道黏膜形态如图1所示,不同饲料影响了钝吻黄盖鲽肠道组织形态,冰鲜杂鱼组绒毛相对致密且高度较高,排列整齐,配合饲料组及混合投喂组的绒毛稀疏且高度较低。
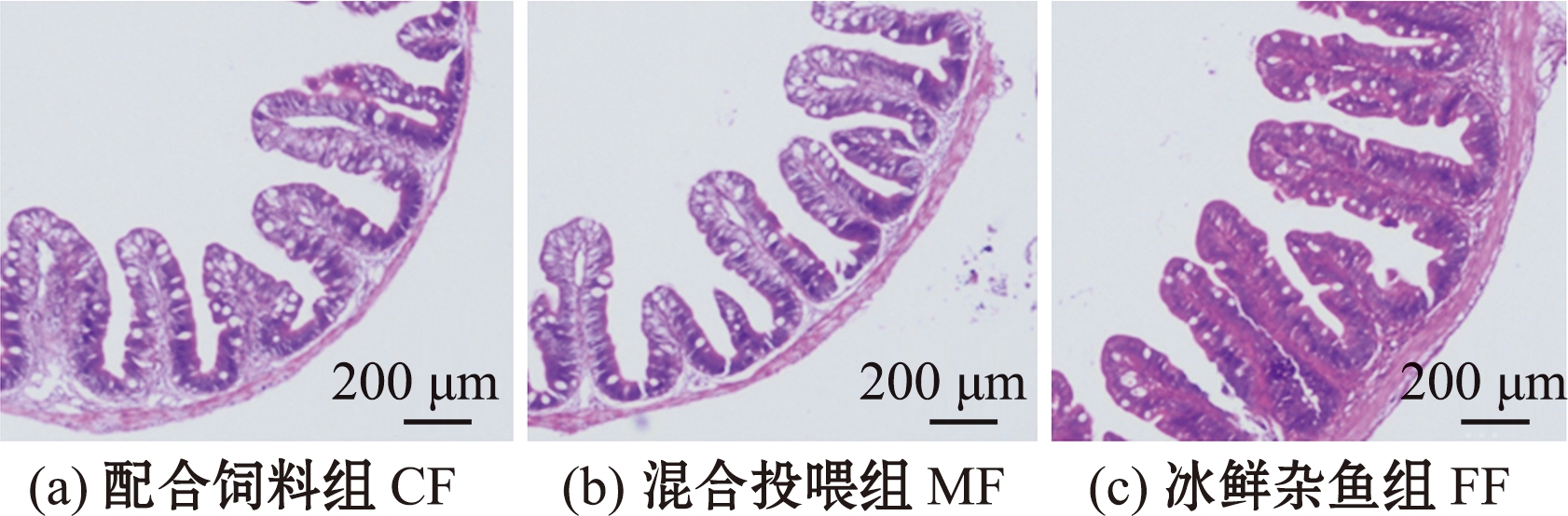
图1 钝吻黄盖鲽后肠黏膜形态
Fig.1 Mucosal morphology in distal intestine of Pleuronectes yokohama
从表2可见,冰鲜杂鱼组钝吻黄盖鲽肠道的绒毛长度和基层厚度显著高于配合饲料组和混合投喂组(P<0.05),配合饲料组最低;3组间绒毛宽度无显著性差异(P>0.05)。
表2 各组肠道黏膜形态参数
Tab.2 Morphological parameters of intestinal mucosa in each group μm

组别group绒毛长度villus length绒毛宽度villus width基层厚度muscular thicknessCF410.92±53.39b176.35±32.0941.40±2.30bMF422.56±54.04b178.86±24.9046.40±3.85bFF610.23±62.75a205.63±60.2169.60±7.33a
2.3 钝吻黄盖鲽肠道菌群的多样性
对MiSeg测序原始数据处理后,3组样品共产生157 646条优化序列,有效序列数为49 331~56 251条。从图2可见,3组钝吻黄盖鲽肠道样品产生的OTUs数目为429~483个,3组共有OTUs为107个,CF、MF和FF组特有OTUs分别为234、225和269个。
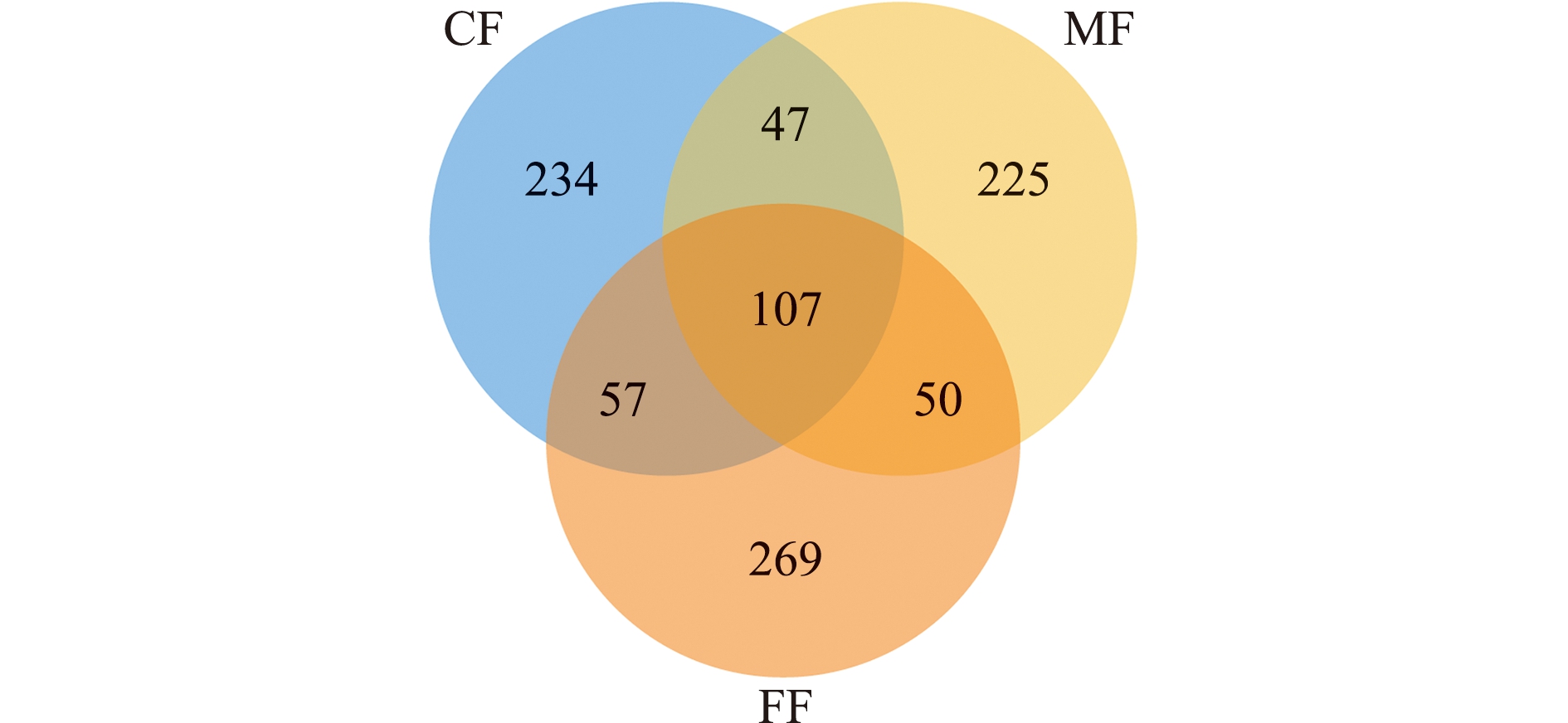
图2 各组肠道微生物分类Venn图
Fig.2 Venn diagram of intestinal microbiome in each group
对3组钝吻黄盖鲽的Alpha多样性进行分析,结果如表3所示,3组钝吻黄盖鲽肠道菌群的Chao1和ACE指数依次为FF组>CF组>MF组,说明冰鲜杂鱼组鱼肠道菌群的物种丰富度最高,混合投喂组物种丰富度最低;混合投喂组鱼肠道菌群的Shannon指数最小,Simpson指数最大,说明其多样性较低,其余2组肠道菌群多样性基本相似。
表3 各组肠道菌群多样性指数
Tab.3 Diversity index of intestinal flora in each group
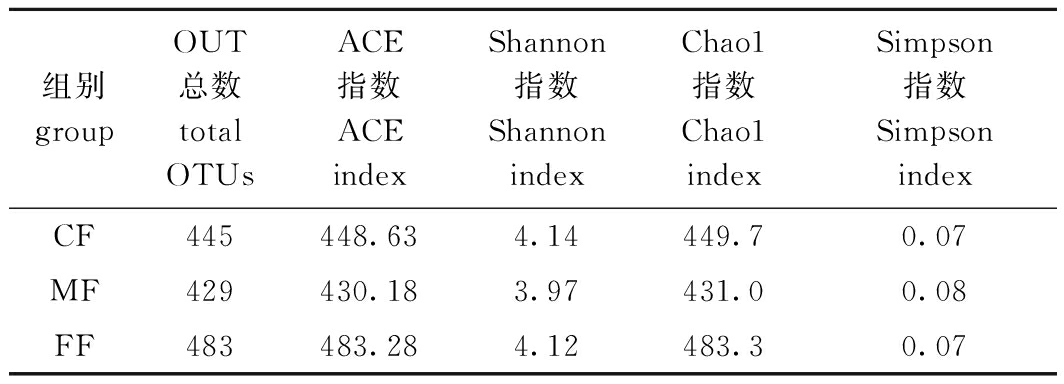
组别groupOUT总数total OTUsACE指数ACE indexShannon 指数Shannon indexChao1指数Chao1 indexSimpson指数Simpson indexCF445448.634.14449.70.07MF429430.183.97431.00.08FF483483.284.12483.30.07
2.4 钝吻黄盖鲽肠道菌群的结构组成
在门水平上,钝吻黄盖鲽肠道微生物中丰度排列前10的菌群如图3所示,冰鲜杂鱼和配合饲料对钝吻黄盖鲽肠道优势菌门的相对丰度影响不同,3组鱼肠道主要菌群均为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和异常球菌-栖热菌门(Deinococcus-Thermus)等,随饲料中冰鲜杂鱼比例的增高,钝吻黄盖鲽肠道菌群中变形菌门相对丰度增大,而厚壁菌门相对丰度则降低。
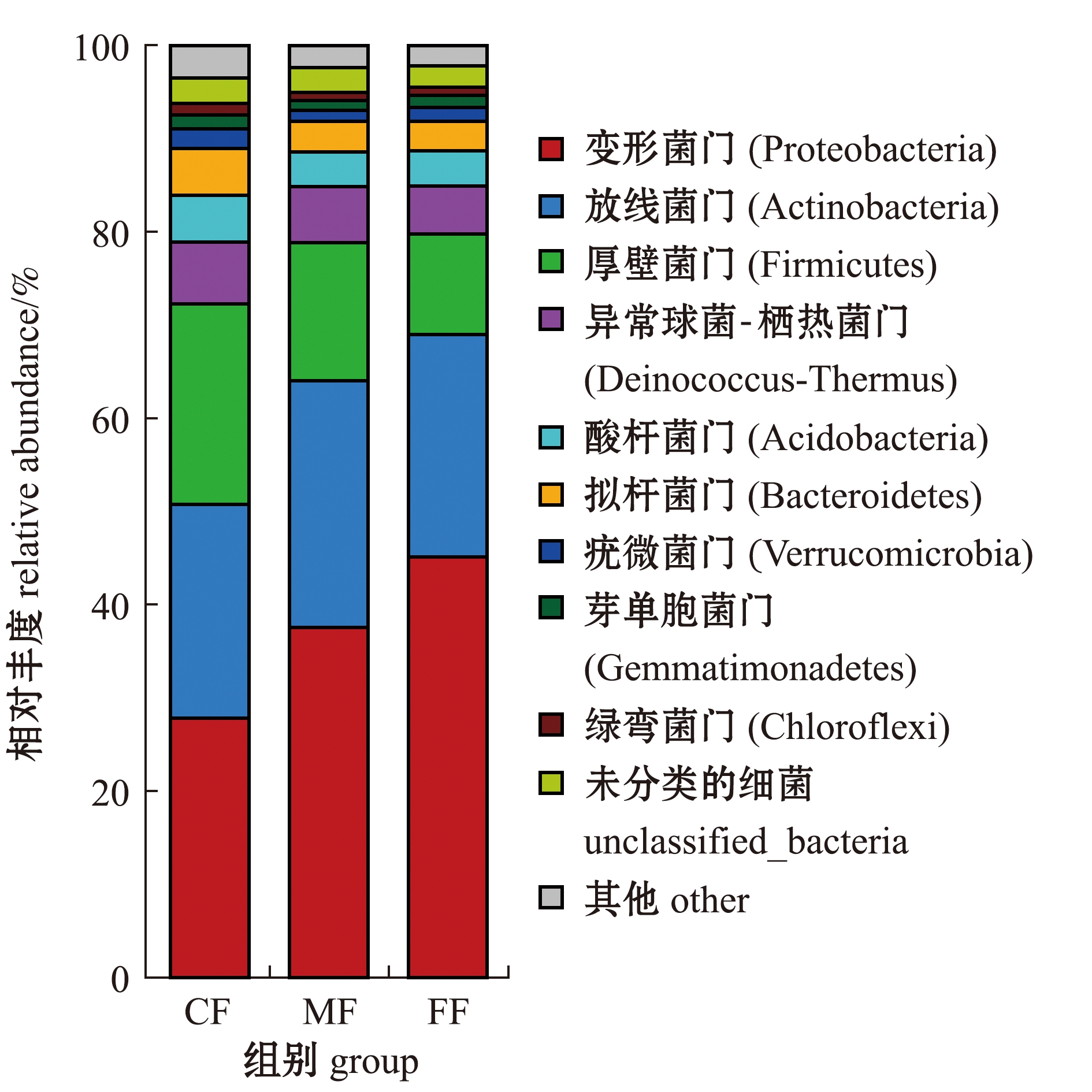
图3 钝吻黄盖鲽肠道门水平上的物种相对丰度
Fig.3 Bacterial communities in intestinal flora of Pleuronectes yokohama at the phylum level
在属水平上,钝吻黄盖鲽肠道菌群中相对丰度较高的10个主要菌群如表4所示,3组鱼肠道的优势菌群均为微杆菌属(Microbacterium),其中,配合饲料组的次优势菌群为巨型球菌属(Macrococcus)和异常球菌属(Deinococcus),混合投喂组的次优势菌群为巨型球菌属(Macrococcus)和发光杆菌属(Photobacterium),冰鲜杂鱼组的次优势菌群为红杆菌科未分类菌群unclassified_Rhodobacteraceae和巨型球菌属(Macrococcus)。
表4 各组钝吻黄盖鲽肠道菌群优势度最高的10个属
Tab.4 Top ten genera of bacterial communities in intestinal flora of Pleuronectes yokohama in each group
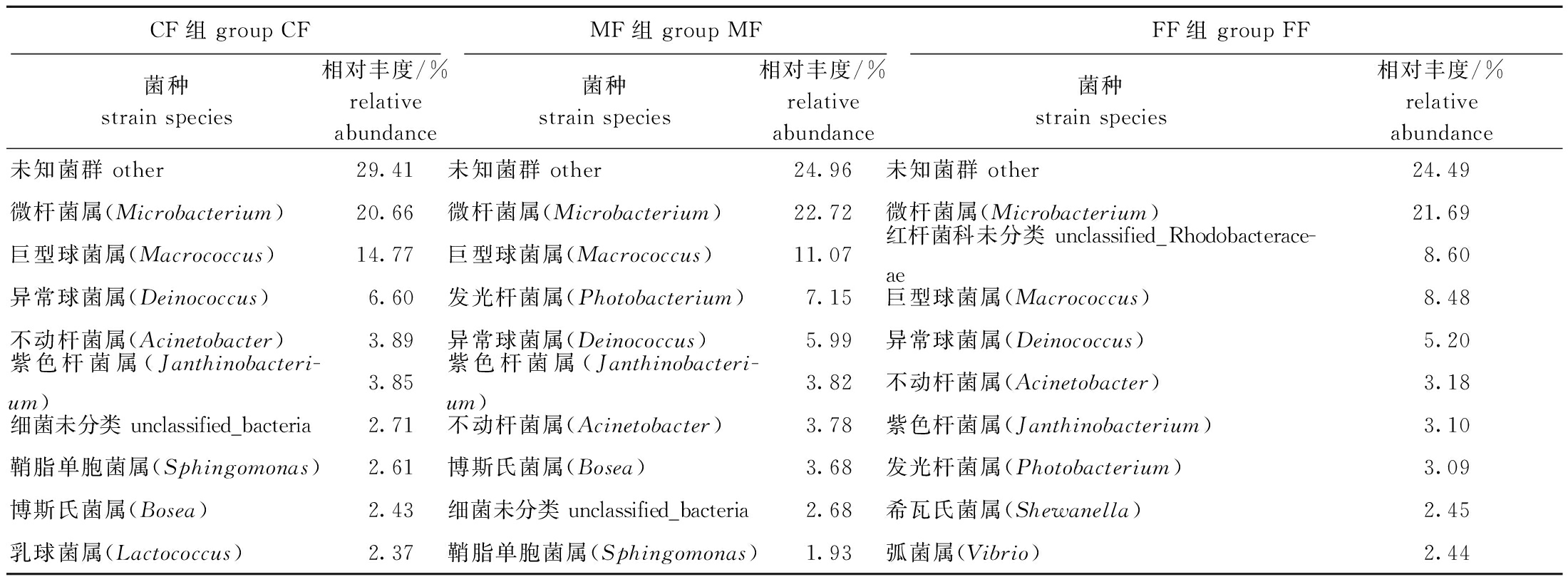
CF组 group CFMF组 group MFFF组 group FF菌种strain species相对丰度/%relative abundance菌种strain species相对丰度/%relative abundance菌种strain species相对丰度/%relative abundance未知菌群 other29.41未知菌群 other24.96未知菌群 other24.49微杆菌属(Microbacterium)20.66微杆菌属(Microbacterium)22.72微杆菌属(Microbacterium)21.69巨型球菌属(Macrococcus)14.77巨型球菌属(Macrococcus)11.07红杆菌科未分类 unclassified_Rhodobacterace-ae8.60异常球菌属(Deinococcus)6.60发光杆菌属(Photobacterium)7.15巨型球菌属(Macrococcus)8.48不动杆菌属(Acinetobacter)3.89异常球菌属(Deinococcus)5.99异常球菌属(Deinococcus)5.20紫色杆菌属(Janthinobacteri-um)3.85紫色杆菌属(Janthinobacteri-um)3.82不动杆菌属(Acinetobacter)3.18细菌未分类 unclassified_bacteria2.71不动杆菌属(Acinetobacter)3.78紫色杆菌属(Janthinobacterium)3.10鞘脂单胞菌属(Sphingomonas)2.61博斯氏菌属(Bosea)3.68发光杆菌属(Photobacterium)3.09博斯氏菌属(Bosea)2.43细菌未分类 unclassified_bacteria2.68希瓦氏菌属(Shewanella)2.45乳球菌属(Lactococcus)2.37鞘脂单胞菌属(Sphingomonas)1.93弧菌属(Vibrio)2.44
3 讨论
3.1 不同饲料对钝吻黄盖鲽生长的影响
集约化养殖鱼类的营养取决于饲料,饲料的质量决定了养殖鱼类的生长发育情况。本研究中,冰鲜杂鱼组钝吻黄盖鲽的特定生长率分别比配合饲料组和混合投喂组提高了29.66%和14.18%,说明冰鲜杂鱼更能促进钝吻黄盖鲽的生长,这与佟伟等[13]对大菱鲆、丛林梅等[14]对珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×E.lanceolatus♂)、牛行健等[7]对斜带石斑鱼及朱择敏等[15]对大口黑鲈的研究结果一致。人工配合饲料虽营养丰富,但与天然饵料在营养成分、适口性等方面仍存在较大差异。本研究中,钝吻黄盖鲽对人工配合饲料还未形成很好的适应性,因而影响了养殖鱼体的生长速度。就饲料系数而言,虽然冰鲜杂鱼组的湿物质饲料系数比配合饲料组增加了2倍,但因冰鲜杂鱼水分含量较高,通过计算干物质量饲料系数发现,冰鲜杂鱼组的干物质量饲料系数比配合饲料组更低,加之冰鲜杂鱼的价格优势,配合饲料还应进一步改善质量以提升其饲料利用率,增加市场优势。
3.2 不同饲料对钝吻黄盖鲽肠道结构的影响
鱼类肠道健康与肠道绒毛形态密切相关,绒毛的长度和宽度影响着肠道对营养物质的消化和吸收[16]。肠道基层厚度影响肠道稳固性,对鱼体健康极为重要。本研究中,摄食配合饲料的钝吻黄盖鲽肠道绒毛长度显著低于冰鲜杂鱼组,结合生长数据,配合饲料组的钝吻黄盖鲽生长较慢,这可能是配合饲料适口性差、诱食作用弱等原因,导致钝吻黄盖鲽肠道形态发育不如冰鲜杂鱼组好,从而影响肠道对营养物质的吸收,进而影响了鱼的生长。
3.3 不同饲料对钝吻黄盖鲽肠道菌群多样性的影响
鱼类肠道中微生物与宿主在长期进化过程中形成稳定的共生关系,直接或间接地影响着宿主的营养吸收、代谢免疫等功能[17]。鱼类肠道菌群组成与其摄食的饲料也有关[18]。本研究中,配合饲料降低了钝吻黄盖鲽肠道菌群的多样性,结合配合饲料高温高压的生产加工方式,这可能与配合饲料中的微生物多样性较低有关。
本研究中,3组钝吻黄盖鲽肠道的优势菌门均为变形菌门,第二位是放线菌门,第三位是厚壁菌门。变形菌门是细菌中最大的门,许多病原菌均位列其中,可导致生物功能失调,增加疾病风险[19]。冰鲜杂鱼组变形菌门丰度最高,这可能与冰鲜杂鱼携带的微生物数量高于配合饲料有关。放线菌门是水生生态系统中普遍存在的细菌门,是抗生素的主要生产菌,其中许多种类属于潜在的益生菌[20]。厚壁菌门中存在许多能够促进碳水化合物转化的细菌,有助于提高宿主对饲料的消化能力[21]。研究表明,拟杆菌门与厚壁菌门丰度的比值影响养殖鱼类的生长速度[9]。本研究中,配合饲料组拟杆菌门与厚壁菌门丰度的比值最低,钝吻黄盖鲽的生长速度也最慢,这与郁二蒙等[9]对摄食不同饲料的大口黑鲈肠道菌群的研究结果一致。推测摄食配合饲料的钝吻黄盖鲽生长较慢,可能与其肠道中拟杆菌门与厚壁菌门丰度的比值下降有关。
研究表明,红杆菌科中的大多数成员具有合成维生素B12的路径,而维生素B12可促进水产动物的生长[22]。红杆菌科中的鲁杰氏菌(Ruegeria mobilis)对致病菌有抑制作用,具有开发成为益生菌的潜能[23]。本研究中,在属水平上对钝吻黄盖鲽肠道进行分析发现,冰鲜杂鱼组未分类的红杆菌科丰度显著高于配合饲料组和混合投喂组。由此可见,投喂冰鲜杂鱼相对提高了钝吻黄盖鲽肠道有益菌的含量,这也为钝吻黄盖鲽肠道微生态制剂的开发提供了数据支撑。
4 结论
1)通过分析投喂配合饲料和冰鲜杂鱼在钝吻黄盖鲽生长性能、肠道结构和肠道菌群方面的差异,发现冰鲜杂鱼更能促进钝吻黄盖鲽的生长及肠道健康。
2)配合饲料组钝吻黄盖鲽肠道菌群多样性减少,可能与人工配合饲料的营养成分无法满足鱼体及其肠道内土著细菌的生长需求有关。因此,在养殖过程中可在配合饲料中添加有利于钝吻黄盖鲽肠道健康的益生菌,以促进钝吻黄盖鲽的健康生长。
[1] 李思忠,王惠民.中国动物志:硬骨鱼纲 鲽形目[M].北京:科学出版社,1995:214-216.
LI S Z,WANG H M.Zoology of China:Bonefish,Pleuronectiformes[M].Beijing:Science Press,1995:214-216.(in Chinese)
[2] 张岩,肖永双,高天翔,等.钝吻黄盖鲽野生群体遗传多样性分析[J].水产学报,2008,32(3):492-496.
ZHANG Y,XIAO Y S,GAO T X,et al.Analysis of genetic diversity of natural population in Pleuronectes yokohamae[J].Journal of Fisheries of China,2008,32(3):492-496.(in Chinese)
[3] 窦硕增,杨纪明.黄河口黄盖鲽的食性及摄食的季节性变化[J].海洋学报,1992,14(6):103-112.
DOU S Z,YANG J M.Seasonal changes of feeding habits and food intake of Pseudopleuronectes yokohamae in the Yellow River Mouth [J].Haiyang Xuebao,1992,14(6):103-112.(in Chinese)
[4] 陈大刚.黄渤海渔业生态学[M].北京:海洋出版社,1991.
CHEN D G.Fisheries ecology in the Yellow and Bohai Seas [M].Beijing:Ocean Press,1991.(in Chinese)
[5] 王煜恒,丁威,陈军,等.投喂配合饲料和冰鲜杂鱼对大菱鲆生长速度和饲料成本的影响[J].江苏农业科学,2016,44(7):282-285.
WANG Y H,DING W,CHEN J,et al.Effects of mixed feed and chilled mixed fish on growth rate and feed cost of Scophthalmus maximus [J].Jiangsu Agricultural Sciences,2016,44(7):282-285.(in Chinese)
[6] 李志斐,龚望宝,王金林,等.冰鲜杂鱼和人工配合饲料对大口黑鲈肌肉品质及健康状况影响的评价[J].动物营养学报,2017,29(11):4180-4188.
LI Z F,GONG W B,WANG J L,et al.Evaluation of effects of frozen fresh fish and artificial compound feed on muscle quality and health status of Micropterus salmoides[J].Chinese Journal of Animal Nutrition,2017,29(11):4180-4188.(in Chinese)
[7] 牛行健,冯瀚墨,赵兴巧,等.冰鲜杂鱼与颗粒饲料对斜带石斑鱼的对比饲养效果[J].集美大学学报(自然科学版),2021,26(1):8-13.
NIU X J,FENG H M,ZHAO X Q,et al.The effect comparisons between frozen trash fish and artifical compound feed for grouper(Epinephelus coioides)[J].Journal of Jimei University (Natural Science Edition),2021,26(1):8-13.(in Chinese)
[8] 关胜军,吴锐全,谢骏,等.两种饲料对大口黑鲈生长、消化道指数和消化酶活性的影响[J].饲料工业,2007,28(2):32-36.
GUAN S J,WU R Q,XIE J,et al.Effects of two diets on growth, digestive tract index and digestive enzyme activities of Micropterus salmoides [J].Feed Industry,2007,28(2):32-36.(in Chinese)
[9] 郁二蒙,张振男,夏耘,等.摄食不同饵料的大口黑鲈肠道菌群分析[J].水产学报,2015,39(1):118-126.
YU E M,ZHANG Z N,XIA Y,et al.Effects of different diets on intestinal microflora of largemouth bass (Micropterus salmoides)[J].Journal of Fisheries of China,2015,39(1):118-126.(in Chinese)
[10] INGERSLEV H C,JØRGENSEN L V G,STRUBE M L,et al.The development of the gut microbiota in rainbow trout (Oncorhynchus mykiss) is affected by first feeding and diet type[J].Aquaculture,2014,424/425:24-34.
[11] 段健诚,胡吉卉,沈宇航,等.虾肝肠胞虫感染对脊尾白虾肠道菌群的影响[J].渔业科学进展,2022,43(3):75-83.
DUAN J C,HU J H,SHEN Y H,et al.Effect of Enterocytozoon hepatopenaei infection on the intestinal microflora of Exopalaemon carinicauda[J].Progress in Fishery Sciences,2022,43(3):75-83.(in Chinese)
[12] WANG Q,GARRITY G M,TIEDJE J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Applied and Environmental Microbiology,2007,73(16):5261-5267.
[13] 佟伟,张劲松,寇锋,等.大菱鲆养殖全程使用全价配合饵料与冰鲜杂鱼对比试验[J].河北渔业,2014(2):38-39,69.
TONG W,ZHANG J S,KOU F,et al.A comparative study on Scophthalmus maximus by using full price combined bait and chilled mixed fish [J].Hebei Fisheries,2014(2):38-39,69.(in Chinese)
[14] 丛林梅,王蔚芳,高淳仁,等.配合饲料和冰鲜太平洋玉筋鱼对珍珠龙胆石斑鱼幼鱼生长、抗氧化和脂质代谢的影响[J].水产学报,2016,40(9):1398-1407.
CONG L M,WANG W F,GAO C R,et al.Effects of compound diet and fresh frozen Ammodytes personatus on growth,antioxidant ability and lipid metabolism of hybrid grouper(Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus♂) juveniles[J].Journal of Fisheries of China,2016,40(9):1398-1407.(in Chinese)
[15] 朱择敏,马冬梅,白俊杰,等.配合饲料、冰鲜杂鱼对大口黑鲈生长和LPL基因mRNA表达的影响[J].大连海洋大学学报,2014,29(4):360-363.
ZHU Z M,MA D M,BAI J J,et al.Effects of formulated diets and frozen trash fish on growth and expression of LPL gene mRNA in largemouth bass Micropterus salmoides[J].Journal of Dalian Ocean University,2014,29(4):360-363.(in Chinese)
[16] WANG Y P,LU Y,ZHANG Y,et al.The draft genome of the grass carp (Ctenopharyngodon idellus) provides insights into its evolution and vegetarian adaptation[J].Nature Genetics,2015,47(6):625-631.
[17] SHU Y L,HONG P,TANG D,et al.Comparison of intestinal microbes in female and male Chinese concave-eared frogs (Odorrana tormota) and effect of nematode infection on gut bacterial communities[J].Microbiology Open,2019,8(6):e00749.
[18] MANSFIELD G S,DESAI A R,NILSON S A,et al.Characterization of rainbow trout (Oncorhynchus mykiss) intestinal microbiota and inflammatory marker gene expression in a recirculating aquaculture system[J].Aquaculture,2010,307(1/2):95-104.
[19] SHIN N R,WHON T W,BAE J W.Proteobacteria:microbial signature of dysbiosis in gut microbiota[J].Trends in Biotechnology,2015,33(9):496-503.
[20] 杜瑞,王梦歌,彭金金,等.环境未培养微生物中新型抗生素的发掘研究进展[J].生物加工过程,2022,20(2):172-181.
DU R,WANG M G,PENG J J,et al.Advances in discovery of new antibiotics in uncultured microorganisms[J].Chinese Journal of Bioprocess Engineering,2022,20(2):172-181.(in Chinese)
[21] EVANS N J,BROWN J M,MURRAY R D,et al.Characterization of novel bovine gastrointestinal tract Treponema isolates and comparison with bovine digital dermatitis treponemes[J].Applied and Environmental Microbiology,2011,77(1):138-147.
[22] 吴凡,文华,蒋明,等.维生素B12对草鱼幼鱼生长、体组分和造血机能的影响[J].吉林农业大学学报,2007,29(6):695-699.
WU F,WEN H,JIANG M,et al.Effects of dietary vitamin B12 on growth,body composition and hemopoiesis of juvenile grass carp(Ctenopharyngodon idellus)[J].Journal of Jilin Agricultural University,2007,29(6):695-699.(in Chinese)
[23] SONNENSCHEIN E C,NIELSEN K F,D’ALVISE P,et al.Global occurrence and heterogeneity of the Roseobacter clade species Ruegeria mobilis[J].The ISME Journal,2017,11(2):569-583.