污水排放可导致水体环境受到污染,通过污水厂、人工湿地等主要利用生物作用的构筑物可以经济、可靠地大幅削减排入水体的污染物。然而,含氮化合物一般不如普通有机物易在生物作用下达到较高去除率,也不如磷化合物可以在构筑物末端通过化学法强化去除,因此,污水深度脱氮一直是水处理的技术难题之一[1]。生物膜法水处理工艺适合处理低污染程度的污水,依靠生物膜发挥主要净化功能的构筑物包括生物转盘、曝气生物膜反应器、生物滤池、生态滤床和人工湿地等[2-3]。生物膜依靠其表面及内部的硝化菌、反硝化菌和厌氧氨氧化菌等去除污水中的含氮化合物。但这些微生物由于生物量低、成长为优势菌耗时长,以及对不利因素(如水质变化等)过于敏感,使得生物膜系统存在脱氮效率低、性能不稳定等缺点[4]。
大量研究发现,硝化菌、反硝化菌和厌氧氨氧化菌能产生、释放和感知某些化学信号分子,当这些分子浓度达到一定阈值时,就会被这些氮转化功能菌识别,并在群体水平上调控相关基因的表达,从而调节其代谢行为并对不同环境做出反应[5-6]。这种微生物通过感知周围环境中细菌浓度变化来调控自身生理行为的现象称为群体感应(quorum sensing,QS)[5]。自1994年发现并定义QS至今,QS及其信号分子在污水净化中的作用机制受到持续关注[7]。其中,酰基高丝氨酸内酯(acyl-homoserine lactones,AHLs)作为QS的一类关键信号分子,在生物膜形成、微生物聚集、转化、平衡、硝化和反硝化调节中尤为重要[8-9]。目前,已有文献综述了AHLs介导的QS在水处理中的研究进展[10-13],但这些综述主要关注了活性污泥颗粒除污性能及机制,而对AHLs介导的QS强化生物膜系统脱氮性能方面的评述较少,对AHLs提升生物膜系统脱氮性能的添加方法和影响因素分析不足,尤其是不同外源AHLs的选择、添加浓度及添加频次对生物膜系统脱氮性能的影响缺乏深入研究。
本研究中,围绕近年来AHLs介导的QS在生物膜系统中的脱氮研究进行了综述,分析了各种AHLs介导的QS在生物膜系统脱氮过程中的机制和影响因素,以期为研究外源AHLs介导的QS系统在生物膜中的潜在应用提供科学参考。
1 外源性AHLs分子的多样性及功能
1.1 AHLs分子的基本结构及多样性
AHLs作为感知和诱导革兰氏阴性细菌信息交流的主要QS信号分子,是通过酰胺键将高丝氨酸内酯环与酰基侧链相连的分子结构(图1),其酰基链通常包含偶数个碳并以两个碳氮进行增加,如C4、C6、C8、C10、C12等[14]。但由于酰基侧链的长短(4~18个碳)、碳链骨架饱和度,以及3位碳上的取代基种类(羟基取代、羰基取代)不同,形成了种类多样、功能特异的AHLs结构[15-16]。以C4-AHL为例,3种结构分别为C4-HSL(C4-N-butyryl-L-homoserine lactone)、3-oxo-C4-HSL(OC4-N-(3-oxobutyryl)-L-homoserine lactone)和3-OH-C4-HSL(HC4-N-(3-hydroxybutyryl)-L-homoserine lactone)(图1)。
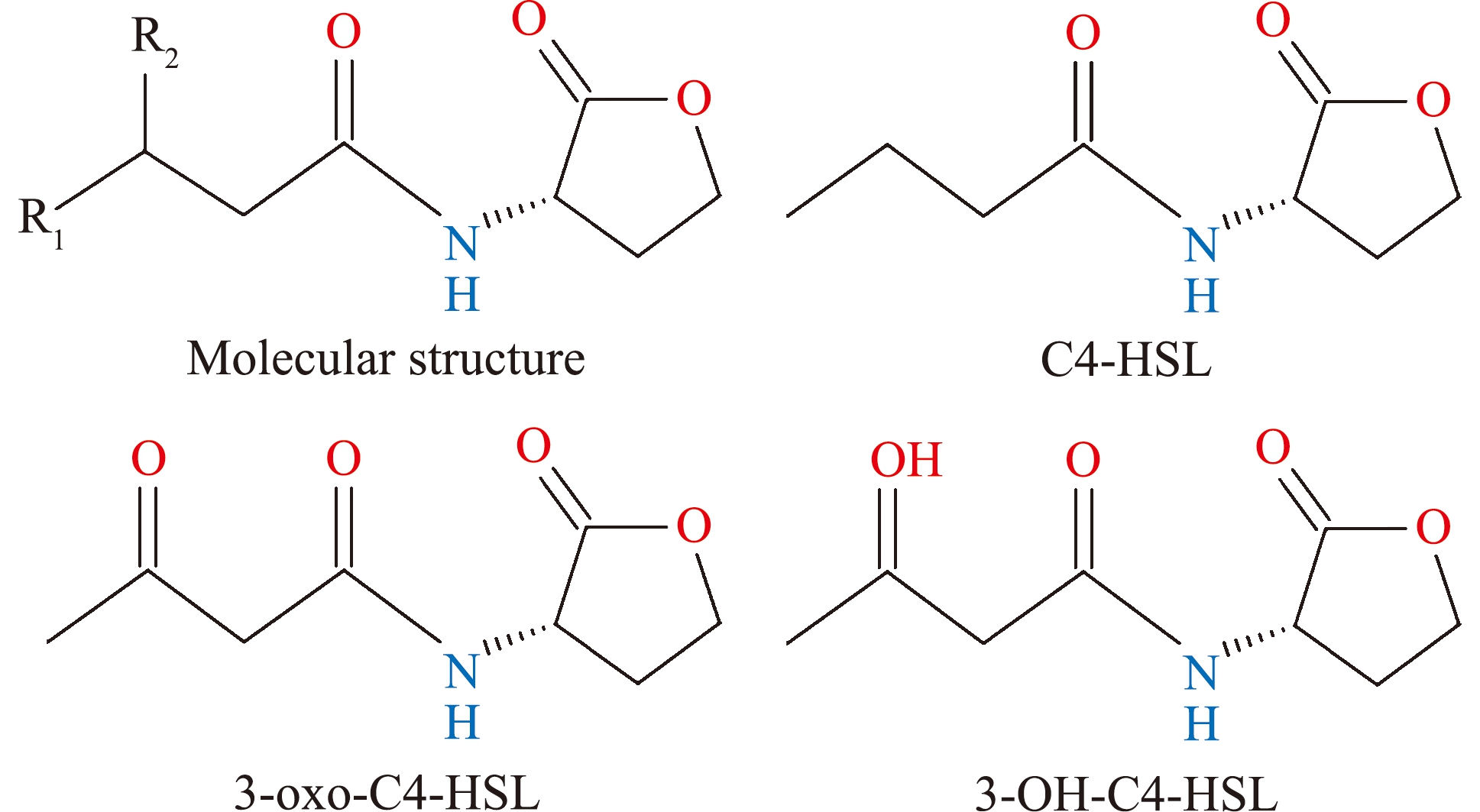
图1 AHLs分子结构及C4-AHL的种类
Fig.1 Molecular structure of AHLs and types of C4-AHL
1.2 外源AHLs分子在氮转化中的作用
在氮转化过程中,不同结构的AHLs对功能菌的刺激存在差异。C6-HSL、C8-HSL在厌氧氨氧化系统中常被检测到,其与![]() 的去除效率相关[17];C4-HSL主要与
的去除效率相关[17];C4-HSL主要与![]() 积累率和氨氧化细菌(ammonia oxidizing bacteria, AOB) 活性相关[18-19];3-oxo-C8-HSL促进了三磷酸腺苷(ATP)的合成[20]。此外,添加C6-HSL、3-oxo-C6-HSL、C10-HSL和3-oxo-C12-HSL等外源信号分子可加速生物膜形成,提高微生物丰度进而增强反应装置对
积累率和氨氧化细菌(ammonia oxidizing bacteria, AOB) 活性相关[18-19];3-oxo-C8-HSL促进了三磷酸腺苷(ATP)的合成[20]。此外,添加C6-HSL、3-oxo-C6-HSL、C10-HSL和3-oxo-C12-HSL等外源信号分子可加速生物膜形成,提高微生物丰度进而增强反应装置对![]() 的去除[4,21]。除促进氨氧化提高脱氮效率外,向装置中添加外源信号分子3-oxo-C12-HSL和3-oxo-C14-HSL可促进反硝化菌对有限碳源的充分利用,提高脱氮效果[21]。然而,并不是所有外源信号分子都会强化任意微生物进而提高脱氮效率。Cheng等[21]研究表明,外源信号分子C6-HSL抑制了假单胞菌的反硝化过程。在多种信号物质共存条件下,外源信号分子是否有促进/抑制作用与其比例有关。李玖龄[22]研究发现,当3-oxo-C14-HSL/C14-HSL>1时,厌氧氨氧化作用受到抑制,在厌氧条件下3-oxo-C14-HSL的积累水平越高,厌氧氨氧化作用受到的抑制作用越强;而当3-oxo-C14-HSL/C14-HSL<1时,厌氧氨氧化作用可顺利进行。
的去除[4,21]。除促进氨氧化提高脱氮效率外,向装置中添加外源信号分子3-oxo-C12-HSL和3-oxo-C14-HSL可促进反硝化菌对有限碳源的充分利用,提高脱氮效果[21]。然而,并不是所有外源信号分子都会强化任意微生物进而提高脱氮效率。Cheng等[21]研究表明,外源信号分子C6-HSL抑制了假单胞菌的反硝化过程。在多种信号物质共存条件下,外源信号分子是否有促进/抑制作用与其比例有关。李玖龄[22]研究发现,当3-oxo-C14-HSL/C14-HSL>1时,厌氧氨氧化作用受到抑制,在厌氧条件下3-oxo-C14-HSL的积累水平越高,厌氧氨氧化作用受到的抑制作用越强;而当3-oxo-C14-HSL/C14-HSL<1时,厌氧氨氧化作用可顺利进行。
1.3 链长对外源AHLs分子功能的影响
AHLs的链长是影响AHLs调节微生物除氮性能的一个关键因素。不同链长的AHLs表现出明显的差异:长链AHLs(12~14个碳原子)具有更强的疏水性、耐水解性和生物质黏附性,对于受基因调控的反硝化还原酶的活性也有显著影响[23],从而对生物膜脱氮表现出更强的时效性;相反,随着AHLs信号分子侧链长度的减少,氨氮的去除效果增加[24],其中,具有10个碳原子的中链AHLs具有相对较差的耐水解性,但显示出更快的细菌黏附促进作用[25]。此外,在AHLs链长相同的情况下,侧链不同位置上的取代基不同,使得生物膜系统最终脱氮效果产生差异。当投加不含β位取代基的AHLs分子(C6-HSL、C8-HSL、C10-HSL)时,随着N-基侧链长度的增加,微生物从悬浮状态向附着状态的转化增强;当AHLs的β位取代基是羰基(3-oxo-C6-HSL、3-oxo-C8-HSL、3-oxo-C10-HSL)时,反应器内微污泥的黏附生长能力随N-基团侧链长度的减少而增强。因此,与具有相同侧链长度但以羰基作为取代基的AHLs相比,β位取代基的AHLs对氨降解的促进作用更大[24]。
2 外源性AHLs强化微生物脱氮的机制
2.1 AHLs对生物膜系统及胞外聚合物分泌的影响
基于AHLs的QS在生物膜系统中具有加速启动、提高微生物丰度等多种作用(图2)。生物膜形成和微生物附着在生物载体上需要多个步骤,包括浮游细胞的初始附着、微生物繁殖、胞外聚合物(extracellular polymeric substances,EPS)产生、生物膜成熟和微生物脱离等[26-27]。初始黏附细菌产生的信号分子水平较低,基于AHLs的QS系统传输较弱,有效传输距离受限,外部表现为反应器启动时间较长[28]。AHLs可显著加速生物增强反应器的启动过程并增加生物量[29]。Wang等[30]使用超声波时域反射剂(ultrasonic time-domain reflectometry,UTDR)作为原位和非侵入性检测技术对AHLs调节的废水生物膜附着进行量化,发现反应系统的可逆黏附时间显著缩短,生物膜厚度随初始AHLs浓度的增加而显著增加,C4-HSL、C6-HSL、C10-HSL等化学信号物质浓度与生物膜的活性呈显著正相关。一方面,细菌可能将类似于黏附力一类的表面反应传递给其他细胞,导致大量细胞获得紧急黏附特性,促进牢固黏附[31-32];另一方面,细菌群落间存在交叉交流,即不同菌种产生的AHLs可能在异质生物膜中的革兰氏阴性菌间共享[33]。这些由AHLs分子传递引起的共定植、共聚集和通信等合作行为有利于细菌的初始黏附[34]。
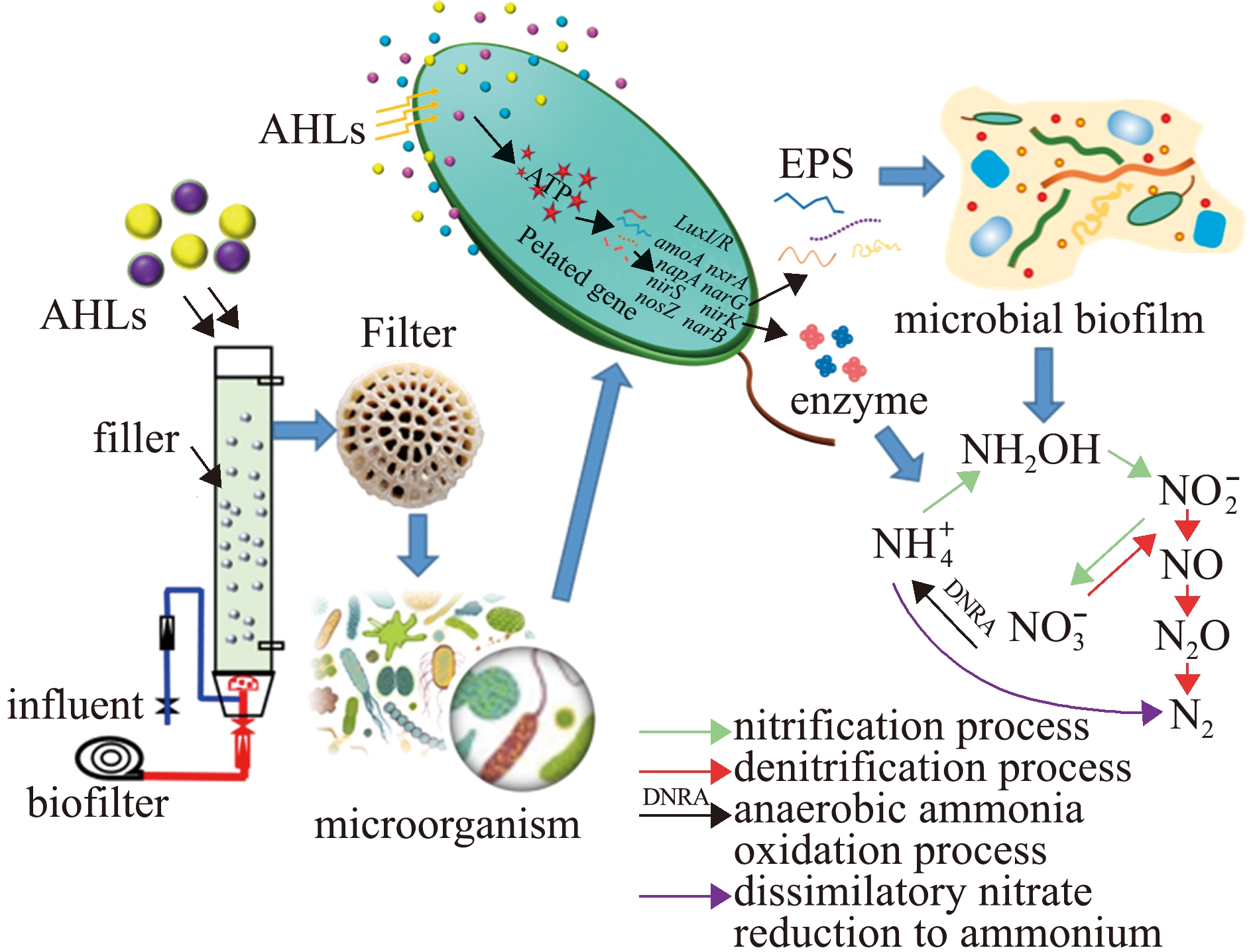
图2 基于AHLs的群体感应在生物膜系统中的作用过程
Fig.2 Action diagram of quorum sensing(QS) in biofilm system based on AHLs
微生物细胞产生的EPS作为生物膜形成的重要成分,由多种有机物组成,包括多糖、蛋白质、核酸、脂质和腐植酸[35]。其中,多糖是生物膜或颗粒污泥中的骨架,也是形成嵌入微生物细胞的框架结构;蛋白质可以改变细胞的表面电荷和疏水性,并提高细胞的黏附能力。添加AHLs会导致EPS中的多糖和蛋白质显著增加,如在较低C/N(C/N=4)和溶解氧(0.8 mg/L)条件下,AHLs可显著提高EPS含量,从而增强细菌黏附性[36]。AHLs介导的QS 还可以利用C10-HSL、C12-HSL和C6-HSL增强自养硝化菌间的种间通信,调节需氧颗粒中的紧密结合型EPS[37]。对其作用机制研究发现,QS是通过调节细胞内ATP的合成,进而影响微生物细胞的合成及EPS的分泌[38-39]。Zhang等[20]研究表明,在利用外源AHLs调节EPS分泌过程中,当ATP被破坏时,即使加入AHLs,EPS含量也不会增加。此外,研究还发现,AHLs主要调节丙氨酸(Ala)、缬氨酸(Val)和谷氨酰胺(Gln)的合成,并选择性地调节天冬氨酸(Asp)和亮氨酸(Leu),从而影响细胞外蛋白[40]。因此,外源AHLs主要通过调节硝化菌和反硝化菌氨基酸的合成来提高EPS含量,并促进生物膜的形成,从而提高脱氮效率[18]。
2.2 AHLs对脱氮功能菌群丰度变化的影响
生物膜性能通常随微生物群落变化而改变(图2),有益脱氮菌的富集会强化生物膜系统的氮代谢效果。然而,生物膜形成是一个相互选择的过程,具有脱氮功能的菌群不一定能在生物膜中成功定植生长。研究发现,添加不同化学结构的AHLs会形成不同的微生物群落结构和相对丰度,从而导致生物膜系统脱氮效率不同程度地增加[41-42]。外源性AHLs的添加降低了内源细菌之间的竞争,加强了QS对微生物聚集的控制。当AHLs浓度增高时,可提前激活QS阈值并诱导细菌QS,进一步增强EPS产物,有利于生物膜的建立[30,43]。AHLs可提高参与QS的混合反硝化菌属丰度,如缺氧反硝化菌(黄杆菌,相对丰度12.7%)、好氧反硝化菌(Zooglaea,相对丰度16.9%)和自养反硝化菌(硅单胞菌,相对丰度5.2%)[36]。但由于AHLs在生物膜系统中较强的选择性,随着AHLs的加入,可能会出现填料和阴极生物膜中微生物Shannon指数显著降低的现象[26,44],推测可能是在反应器启动初期,AHLs作为细菌细胞的重要QS信号和共用有益物质,增强了物种间的竞争[45-46]。因此,为使细菌充分利用AHLs进行微生物间的协同作用并不断增殖,可以考虑添加多种AHLs[4]。
在添加AHLs后,系统内微生物出现持续释放AHLs的现象,推测是由于AHLs可以诱导气单胞菌、假单胞菌(Pseudomonas stutzeri ADP-19与P.mendocina IHB602)和变形杆菌(P.cupriavidus H29)等细菌的富集[47-49],并刺激这些微生物自身多种内源AHLs的分泌,如C6-HSL、3-oxo-C6-HSL和C8-HSL[50-51]等。
2.3 AHLs对氮去除相关功能酶的影响
在硝化作用脱氮过程中,由于AOB和氨氧化古菌(ammonia oxidizing archaea,AOA)生长缓慢且对环境敏感,氨氧化过程成为强化生物膜脱氮的主要限制步骤。C4-HSL、C6-HSL和C8-HSL等AHLs与硝化活性、硝化相关基因丰度相关,QS利用AOB、亚硝酸盐氧化菌(nitrite oxidizing bacteria,NOB)自身和周围其他微生物分泌的AHLs调节相关酶的基因表达,提高硝化脱氮效率[42]。同样,反硝化过程相关酶也受QS调节,研究发现,添加一定浓度的外源C6-HSL和C8-HSL会显著影响亚硝酸盐还原酶(NIR)、一氧化氮还原酶(NOR)和硝酸还原酶(NXR)的基因转录[21,43],进而调节生物膜系统中微生物反硝化脱氮性能。
基于AHLs的QS在硝化菌、反硝化菌和氨氧化菌复杂的相互作用中普遍存在并发挥重要作用。首先,AHLs通过QS可影响生物膜内的微生物群落及其形成,微生物群落结构变化调节了EPS的产生和生物膜的形成,进而影响生物膜反应器对氮的去除效率。其次,硝化菌、反硝化菌和氨氧化菌中的AHLs合成酶利用复杂的序列和结构变化,也会产生不同类型的酰基链结构进而影响脱氮效率[52]。不同的AHLs均提升了对多数生物膜反应器的氮污染物和其他污染物的去除效果(表1)。目前,由于AHLs合成酶可以识别的底物类型和相应酰基链长度不同,在不同的合成酶中会出现较复杂的序列和结构变异。基于现有研究结果,仍不能充分分析不同AHLs合成酶产生的不同AHLs信号之间的进化关系,AHLs对生物膜系统脱氮过程中相关酶的具体影响机制仍有待深入研究[53]。
3 AHLs强化生物膜脱氮的影响因素
3.1 AHLs添加阶段、浓度及频次对脱氮的影响
当AHLs的细胞外浓度达到一定阈值时,能刺激QS相关基因的表达,激活QS的控制功能[54]。不同细菌启动QS的阈值不同,AHLs对细菌QS阈值具有调节作用[55]。在铜绿假单胞菌中,受QS控制的基因有rsaL、lasB、pa1656和lasL,其细胞密度阈值的OD600 nm值分别为0.34、0.87、0.32、0.61[56]。在铜绿假单胞菌缺乏QslA基因的情况下,3OC12-HSL可刺激铜绿假单胞菌的QS,使其阈值增加9倍[57]。Wang等[25]观察到AHLs的细菌QS阈值为10 ng/L~10 μg/L。然而,由于废水生物膜群落中AHLs驱动QS的复杂性,故仍不能明确各种类型生物膜对不同AHLs的具体反应。
1)AHLs添加阶段。添加AHLs时应考虑生物膜所处的生长阶段:在生物膜形成初期,添加外源信号物质有助于细菌分泌EPS,促进初始生物膜的稳定形成,缩短反应系统的启动时间;在成熟的生物膜中,紧密型生物膜由于受到表面生物膜的保护及营养物质的交叉输送,使得成熟阶段紧密型生物膜拥有分泌高浓度AHLs所需的环境条件,故此时AHLs可以较好地调节生物膜活性 [58]。
2)AHLs添加浓度。虽然添加AHLs可提前到达能够刺激QS机制的胞外AHLs浓度,强化QS的控制功能[30,59],但AHLs的促进作用并未随其浓度的增加而线性增加,当AHLs浓度增加到一定值时,细菌生物膜的形成可能受到其他因素限制[59]。因此,考虑到作用效果和经济效益,应该添加适量的AHLs以达到最佳的氮化合物去除率。Fang等[60]添加10 μmol/L的C6-HSL和3-oxo-C12-HSL后,对阴极Geobacter soli菌的启动进行评估,结果表明,阴极电活性生物膜(electroactive biofilm,EAB)的生物量和EPS均增加,且EPS和阴极EAB最外层蛋白质的氧化还原活性增强,反应器的启动滞后期缩短了50%,添加混合AHLs处理16 d后,硝酸盐的还原率达到76%。大多数试验均添加两种或多种AHLs,这加强了细菌间多个QS的表达,强化了生物膜系统的脱氮性能(表1)。当添加两种不同的AHLs时,QS细菌会根据AHLs分子的数量到达双稳态阈值[54],进而促进QS细菌的脱氮作用。
表1 添加外源AHLs的生物膜反应器中脱氮情况
Tab.1 Nitrogen removal in biofilm reactor with exogenous AHLs

注:++表示污染物去除显著;+-表示污染物去除不显著;*表示最终混合浓度。
Note:++,the removal of pollutants is significant; +-,the removal of target pollutants is not significant; *,indicates the final mixing concentration.
分子类型molecular type添加浓度/(μmol·L-1)added concentration目标污染物target pollutant提升效果enhancement effect文献来源referenceC6-HSLC8-HSLC14-HSL3-oxo-C12-HSL0.01250.01250.01250.0125COD、NH+4-N、NO-3-N++Hu等[61]C6-HSL2NO-3-N+-Cheng等[21]C6-HSLC8-HSL——NH+4-N、NO-3-N、NO-2-N++Liu等[62]C6-HSLC8-HSL0.10.1TOC、TN、NH+4-N、NO-3-N++Huang等[43]C6-HSL3OC6-HSL11NH+4-N++Xiong等[4]C6-HSL3OC12-HSL10*10*NO-3-N++Fang等[60]
3)AHLs添加频次。虽然1次添加AHLs不能对QS的控制立即产生影响,这是由于AHLs在废水中较易降解[63],但多次添加可能对细菌群落的构建有利。Xiong等[4]在几乎相同的时间间隔内(1、6、10 d)向生物膜装置中3次添加AHLs和酰化酶后发现,多糖含量第3天时升高32.4%,第8天时升到最高水平。因此,在相同时间间隔内多次添加外源信号分子可保持其在整个运行期间的持续刺激作用。
随着生物膜脱氮工艺的不断发展,一些研究将生态处理系统与电化学相结合,如人工湿地-微生物燃料电池、人工湿地-生物膜电极系统等。目前,外源AHLs在生物电化学中的应用研究较为有限,但现有的研究表明,在生物电化学系统中添加AHLs有利于系统脱氮性能的提高[60]。此外,更多与外源相结合的电化学应用,如AHLs改善微生物电解槽的生物电化学性能和能量回收,以及QS体系在高性能微生物燃料电池中的应用等[64-65],均证明外源AHLs在生物膜系统脱氮过程中的潜在价值。
3.2 环境因素对AHLs脱氮效果的影响
植物根系、溶解氧、温度、盐度及无机金属离子等均是影响QS效应的主要因素。
1)植物根系。植物根系作为系统中微生物高度富集的区域之一,相关研究从湿地芦苇根系样品中发现了气单胞菌、假单胞菌、根瘤菌和中华根瘤菌等多种可产生AHLs的菌属[66]。因此,湿地植物根系可能存在较高水平的QS作用,对于AHLs的释放与脱氮的调控具有一定影响。红树林湿地中QS增强了异养硝化-好氧反硝化细菌(HN-AD)的反硝化和生物膜形成能力[67]。但是,不同植物对于AHLs又表现出不同的反应,如蒺藜根提取物表现出对QS性能的抑制作用[68]。因此,针对不同的湿地植物,其与AHLs间具有的复杂作用机制,仍需进一步探索。
2)溶解氧。溶解氧通过调节脱氮相关酶的含量,影响微生物硝化、反硝化过程。同时,QS通过调控nirS、norB、norC、nosZ等关键酶基因的表达,也影响了NAR、NIR、NOR、NOS等脱氮相关酶的活性[69]。因此,溶解氧浓度的变化对于受QS调控的脱氮过程具有重要作用,尤其是反硝化过程表现出了更明显的差异:在好氧条件下,受nosZ一类关键酶控制的微生物丰度下降,导致反硝化过程中![]() 间的还原转化受到抑制[69];相比之下,外源信号分子对厌氧反硝化过程中nirS、norB、norC等基因的表达有明显的上调,增强了厌氧反硝化过程[21]。
间的还原转化受到抑制[69];相比之下,外源信号分子对厌氧反硝化过程中nirS、norB、norC等基因的表达有明显的上调,增强了厌氧反硝化过程[21]。
3)温度。温度的变化也会影响细菌的活性和3-oxo-C4-HSL、3-oxo-C5-HSL和3-oxo-C6-HSL等AHLs的释放,其中,水相中AHLs的释放浓度往往随温度的降低而降低[70-71]。由于AHLs的种类繁多,不同AHLs在不同温度下的作用也不相同。如C8-HSL在室温下显著促进生物膜生长和EPS分泌,而C6-HSL则在低温下效果显著,这两种信号分子在其适宜温度环境下均可提高微生物丰度及脱氮效率[43]。因此,需对不同AHLs参与的生物膜脱氮系统进行温度优化试验。
4)盐度。对于高盐度废水而言,含盐浓度过高会导致水处理系统中微生物细胞渗透压增高和质壁分离,使脱氮系统性能降低[72]。因此,揭示耐盐微生物QS的脱氮机制,进而提高脱氮微生物的耐盐性至关重要。Zhu等[73]研究了盐胁迫下厌氧氨氧化菌QS的反馈机制,结果表明,3-oxo-C5-HSL浓度随盐度增加而增加,AHLs介导的QS变得更加活跃并改善了厌氧氨氧化联合体的协同作用。这可能由于高盐度条件下,通过调节QS刺激相关AHLs的释放,促进细菌产生更多的胞外聚合物,提高了细菌对盐胁迫的耐受性[16]。
5)无机金属离子。在实际的废水中存在多种无机盐离子,AHLs可能受到废水样品中离子强度的影响[74]。碱性单价阳离子Na+和K+是调节噬菌体聚集状态的关键信号,其离子强度可以影响细菌的群体行为和群体感应[75]。但是对于AHLs在实际污水处理中的应用鲜见报道,仅见Peng等[74]在实际高氨氮废水中添加C6-HSL和C8-HSL,增强了微生物黏附力,在盐度和有机物含量相同的实际废水中,优势细菌及其生物膜决定了AHLs的作用,表明添加AHLs后加速了生物膜法脱氮的潜力。因此,若想实现基于AHLs的QS在实际污水中的成功应用,仍需分析复杂环境下生物膜系统中基于AHLs的QS脱氮情况。
4 存在问题与展望
4.1 AHLs强化生物膜脱氮研究中存在的问题
目前,相关研究已经揭示了QS强化微生物脱氮过程中的部分机制,为通过添加AHLs提高生物膜系统脱氮性能提供了一定的理论基础,但仍一些以下问题。
1)外源AHLs对不同脱氮功能菌的作用效果存在差异,缺少对AHLs功能的足够认识;由于AHLs结构和相关基因酶复杂多样,AHLs强化纯培养QS细菌脱氮的成膜条件、相关酶的作用机制尚不明确。
2)缺乏外源AHLs对生物膜反应器启动和运行全周期时效性的研究,无法为长期运行的生物膜系统提供数据和理论支撑;通过改变AHLs添加浓度、频次等操作参数,如何影响AHLs强化生物膜脱氮效果有待进一步阐明。
3)环境条件优化可进一步提高AHLs强化生物膜脱氮性能,然而相关效应和机制尚不清晰。
4)添加AHLs的使用效果受到多种条件限制,几乎所有研究结果均基于实验室数据得到,缺少AHLs强化生物膜脱氮的实际应用研究。
4.2 未来重点研究方向
为保证外源AHLs作用的高效性和准确性,针对AHLs强化生物膜脱氮的研究现状,未来应在以下几方面重点开展研究。
1)提高对不同种类AHLs功能的认识及其对生物膜作用机制的探索。不同的AHLs对细菌成膜、脱氮具有不同的功能,添加AHLs已被证明可以增强生物膜系统的脱氮性能,但未能揭示AHLs作用下微生物成膜条件和相关功能酶的具体机制。今后可利用异源表达、基因失活、元转录组学、宏基因组学和代谢分析组学等提高QS作用机制,加强AHLs合成酶和受体鉴定,进一步监测复杂群落中脱氮功能微生物的代谢活动和代谢途径。
2)明确AHLs在生物膜反应器不同阶段的作用机制和效果。今后应全面评估AHLs在生物膜生长全周期内的作用效果,进一步明确不同AHLs在硝化、反硝化、氨氧化等氮代谢过程中的作用,通过调节AHLs的添加频次与浓度,确定最佳的AHLs添加方法,使利用外源AHLs精确调控生物膜反应器的脱氮过程成为可能。
3)强化环境条件对AHLs影响下的生物膜系统研究。今后应利用多种生物学技术手段,鉴别不同环境条件下相关酶的种类和浓度变化,深入了解DO、温度和盐度等因子对AHLs效应的影响,通过对操作条件和环境条件的优化,实现AHLs对生物膜反应器脱氮性能增强的最大化。
4)利用规模化生物膜反应器验证外源AHLs在污水处理中的实际效果。AHLs实际应用过程中会受到反应器内部和外部多种因素的影响,今后应加强污水处理构筑物的中试和规模化研究;针对生物滤池、人工湿地及结合电化学的新型生物膜工艺,加强AHLs对反应系统整体性能的研究,将试验结果扩展到实际废水处理中,并以实际废水处理效果验证其有效性。
综上,关于外源AHLs强化生物膜脱氮研究已取得了一些有价值的成果,但还有一些未知的关键问题亟待解决。随着研究的不断深入,未来添加AHLs强化生物膜的脱氮性能将有很大潜力成为重要的污水处理新方法,为水污染的治理作出重要贡献。
[1] WAN L,WANG H B.Control of urban river water pollution is studied based on SMS[J].Environmental Technology & Innovation,2021,22:101468.
[2] 吴英海,韩蕊,张翠雅.人工湿地构造及生物因素研究进展[J].化工环保,2021,41(1):1-8.
WU Y H,HAN R,ZHANG C Y.Research progresses on constructed wetland structure and biological factors[J].Environmental Protection of Chemical Industry,2021,41(1):1-8.(in Chinese)
[3] 隗陈征,刘鹰,任纪龙,等.曝气条件对铁基复合填料生物滤器脱氮性能及菌群变化的影响[J].大连海洋大学学报,2021,36(3):470-477.
WEI C Z,LIU Y,REN J L,et al.Effects of aeration conditions on nitrogen removal performance and microbial community changes in biological aerated filter with iron-based composite packing[J].Journal of Dalian Ocean University,2021,36(3):470-477.(in Chinese)
[4] XIONG F Z,ZHAO X X,WEN D H,et al.Effects of N-acyl-homoserine lactones-based quorum sensing on biofilm formation,sludge characteristics,and bacterial community during the start-up of bioaugmented reactors[J].The Science of the Total Environment,2020,735:139449.
[5] 李玖龄,孙凯,孟佳,等.超高效液相色谱-串联质谱法检测微氧生物脱氮菌群酰基高丝氨酸内酯信号分子[J].分析化学,2016,44(8):1165-1170.
LI J L,SUN K,MENG J,et al.Detection of N-acyl-homoserine lactones signal molecules of quorum sensing secreted by denitrification flora in microaerobic nitrogen removal processes by ultra performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2016,44(8):1165-1170.(in Chinese)
[6] WATERS C M,BASSLER B L.Quorum sensing:cell-to-cell communication in bacteria[J].Annual Review of Cell and Developmental Biology,2005,21:319-346.
[7] REGULATORST T,CLAIBORNEFUQUA W,PETERGREENBERG E.Minireview quorum sensing in bacteria:the luxR-luxI family of cell density-responsive[J].Journal of Bacteriology,1994,176(2):269-275.
[8] MA J X,WANG Z W,LI H,et al.Metagenomes reveal microbial structures,functional potentials,and biofouling-related genes in a membrane bioreactor[J].Applied Microbiology and Biotechnology,2016,100(11):5109-5121.
[9] TAN C H,KOH K S,XIE C,et al.Community quorum sensing signalling and quenching:microbial granular biofilm assembly[J].NPJ Biofilms and Microbiomes,2015,1:15006.
[10] ASLAM M,AHMAD R,KIM J.Recent developments in biofouling control in membrane bioreactors for domestic wastewater treatment[J].Separation and Purification Technology,2018,206:297-315.
[11] HUANG J H,SHI Y H,ZENG G M,et al.Acyl-homoserine lactone-based quorum sensing and quorum quenching hold promise to determine the performance of biological wastewater treatments:an overview[J].Chemosphere,2016,157:137-151.
[12] MADDELA N R,SHENG B B,YUAN S S,et al.Roles of quorum sensing in biological wastewater treatment:a critical review[J].Chemosphere,2019,221:616-629.
[13] TRIPATHI S,CHANDRA R,PURCHASE D,et al.Quorum sensing-a promising tool for degradation of industrial waste containing persistent organic pollutants[J].Environmental Pollution,2022,292(Pt B):118342.
[14] FUQUA C,GREENBERG E P.Listening in on bacteria:acyl-homoserine lactone signalling[J].Nature Reviews Molecular Cell Biology,2002,3(9):685-695.
[15] GALLOWAY W R J D,HODGKINSON J T,BOWDEN S D,et al.Quorum sensing in Gram-negative bacteria:small-molecule modulation of AHL and AI-2 quorum sensing pathways[J].Chemical Reviews,2011,111(1):28-67.
[16] SHROUT J D,NERENBERG R.Monitoring bacterial twitter:does quorum sensing determine the behavior of water and wastewater treatment biofilms?[J].Environmental Science & Technology,2012,46(4):1995-2005.
[17] SUN Y P,GUAN Y T,ZENG D F,et al.Metagenomics-based interpretation of AHLs-mediated quorum sensing in Anammox biofilm reactors for low-strength wastewater treatment[J].Chemical Engineering Journal,2018,344:42-52.
[18] FENG Z L,SUN Y P,LI T L,et al.Operational pattern affects nitritation,microbial community and quorum sensing in nitrifying wastewater treatment systems[J].The Science of the Total Environment,2019,677:456-465.
[19] ZHANG B,GUO Y,LENS P N L,et al.Effect of light intensity on the characteristics of algal-bacterial granular sludge and the role of N-acyl-homoserine lactone in the granulation[J].The Science of the Total Environment,2019,659:372-383.
[20] ZHANG Z M,CAO R J,JIN L N,et al.The regulation of N-acyl-homoserine lactones (AHLs)-based quorum sensing on EPS secretion via ATP synthetic for the stability of aerobic granular sludge[J].The Science of the Total Environment,2019,673:83-91.
[21] CHENG Y,ZHANG Y,SHEN Q X,et al.Effects of exogenous short-chain N-acyl homoserine lactone on denitrifying process of Paracoccus denitrificans[J].Journal of Environmental Sciences (China),2017,54:33-39.
[22] 李玖龄.基于信号分子AHLs检测的微氧废水处理系统脱氮机制研究[D].哈尔滨:哈尔滨工业大学,2016.
LI J L.The mechanism of nitrogen removal in a microaerobic wastewater treatment system based on the detection of signal molecule AHLs[D].Harbin:Harbin Institute of Technology,2016.(in Chinese)
[23] 程芸.外源信号分子对脱氮副球菌反硝化过程调控作用的研究[D].合肥:中国科学技术大学,2016.
CHENG Y.The regulation of exogenous N-acyl homoserine lactone on the denitrifying process of Paracoccus denitrificans[D].Hefei:University of Science and Technology of China,2016.(in Chinese)
[24] LI A J,HOU B L,LI M X.Cell adhesion,ammonia removal and granulation of autotrophic nitrifying sludge facilitated by N-acyl-homoserine lactones[J].Bioresource Technology,2015,196:550-558.
[25] WANG J F,LIU Q J,DONG D Y,et al.AHLs-mediated quorum sensing threshold and its response towards initial adhesion of wastewater biofilms[J].Water Research,2021,194:116925.
[26] WANG J F,DING L L,LI K,et al.Estimation of spatial distribution of quorum sensing signaling in sequencing batch biofilm reactor (SBBR) biofilms[J].The Science of the Total Environment,2018,612:405-414.
[27] HU H Z,HE J G,LIU J,et al.Role of N-acyl-homoserine lactone (AHL) based quorum sensing on biofilm formation on packing media in wastewater treatment process[J].RSC Advances,2016,6(14):11128-11139.
[28] GANTNER S,SCHMID M,DÜRR C,et al.In situ quantitation of the spatial scale of calling distances and population density-independent N-acyl homoserine lactone-mediated communication by rhizobacteria colonized on plant roots[J].FEMS Microbiology Ecology,2006,56(2):188-194.
[29] SUN Z Q,XI J Y,YEUNG M,et al.Two quorum sensing enhancement methods optimized the biofilm of biofilters treating gaseous chlorobenzene[J].The Science of the Total Environment,2022,807(Pt 1):150589.
[30] WANG J F,LIU Q J,LI X H,et al.In-situ monitoring AHL-mediated quorum-sensing regulation of the initial phase of wastewater biofilm formation[J].Environment International,2020,135:105326.
[31] LEE C K,DE ANDA J,BAKER A E,et al.Multigenerational memory and adaptive adhesion in early bacterial biofilm communities[J].Proceedings of the National Academy of Sciences of the United States of America,2018,115(17):4471-4476.
[32] PAPENFORT K,BASSLER B L.Quorum sensing signal-response systems in Gram-negative bacteria[J].Nature Reviews Microbiology,2016,14(9):576-588.
[33] GONZ LEZ A,BELLENBERG S,MAMANI S,et al.AHL signaling molecules with a large acyl chain enhance biofilm formation on sulfur and metal sulfides by the bioleaching bacterium Acidithiobacillus ferrooxidans[J].Applied Microbiology and Biotechnology,2013,97(8):3729-3737.
LEZ A,BELLENBERG S,MAMANI S,et al.AHL signaling molecules with a large acyl chain enhance biofilm formation on sulfur and metal sulfides by the bioleaching bacterium Acidithiobacillus ferrooxidans[J].Applied Microbiology and Biotechnology,2013,97(8):3729-3737.
[34] LIU Q J,WANG J F,HE R N,et al.Bacterial assembly during the initial adhesion phase in wastewater treatment biofilms[J].Water Research,2020,184:116147.
[35] SONG T,ZHANG X L,LI J,et al.A review of research progress of heterotrophic nitrification and aerobic denitrification microorganisms (HNADMs)[J].The Science of the Total Environment,2021,801:149319.
[36] LIU T,XU J W,TIAN R Q,et al.Enhanced simultaneous nitrification and denitrification via adding N-acyl-homoserine lactones (AHLs) in integrated floating fixed-film activated sludge process[J].Biochemical Engineering Journal,2021,166:107884.
[37] CHEN H,LI A,CUI C W,et al.AHL-mediated quorum sensing regulates the variations of microbial community and sludge properties of aerobic granular sludge under low organic loading[J].Environment International,2019,130:104946.
[38] AL-KHARUSI S,ABED R M M,DOBRETSOV S.Changes in respiration activities and bacterial communities in a bioaugmented oil-polluted soil in response to the addition of acyl homoserine lactones[J].International Biodeterioration & Biodegradation,2016,107:165-173.
[39] LI Y C,ZHU J R.Role of N-acyl homoserine lactone (AHL)-based quorum sensing (QS) in aerobic sludge granulation[J].Applied Microbiology and Biotechnology,2014,98(17):7623-7632.
[40] TANG X,GUO Y Z,WU S S,et al.Metabolomics uncovers the regulatory pathway of acyl-homoserine lactones based quorum sensing in anammox consortia[J].Environmental Science & Technology,2018,52(4):2206-2216.
[41] LV L Y,LI W G,ZHENG Z J,et al.Exogenous acyl-homoserine lactones adjust community structures of bacteria and methanogens to ameliorate the performance of anaerobic granular sludge[J].Journal of Hazardous Materials,2018,354:72-80.
[42] SUN Y P,GUAN Y T,WANG D,et al.Potential roles of acyl homoserine lactone based quorum sensing in sequencing batch nitrifying biofilm reactors with or without the addition of organic carbon[J].Bioresource Technology,2018,259:136-145.
[43] HUANG H,FAN X,PENG P C,et al.Two birds with one stone:simultaneous improvement of biofilm formation and nitrogen transformation in MBBR treating high ammonia nitrogen wastewater via exogenous N-acyl homoserine lactones[J].Chemical Engineering Journal,2020,386:124001.
[44] CAI W W,ZHANG Z J,REN G,et al.Quorum sensing alters the microbial community of electrode-respiring bacteria and hydrogen scavengers toward improving hydrogen yield in microbial electrolysis cells[J].Applied Energy,2016,183:1133-1141.
[45] SCHUSTER M,SEXTON D J,DIGGLE S P,et al.Acyl-homoserine lactone quorum sensing:from evolution to application[J].Annual Review of Microbiology,2013,67:43-63.
[46] WHITELEY M,DIGGLE S P,GREENBERG E P.Progress in and promise of bacterial quorum sensing research[J].Nature,2017,551(7680):313-320.
[47] HONG P,WU X Q,SHU Y L,et al.Bioaugmentation treatment of nitrogen-rich wastewater with a denitrifier with biofilm-formation and nitrogen-removal capacities in a sequencing batch biofilm reactor[J].Bioresource Technology,2020,303:122905.
[48] LI Y Y,HUANG X W,LI X Y.Use of a packed-bed biofilm reactor to achieve rapid formation of anammox biofilms for high-rate nitrogen removal[J].Journal of Cleaner Production,2021,321:128999.
[49] SU J F,WANG Z,HUANG T L,et al.Simultaneous removal of nitrate,phosphorous and cadmium using a novel multifunctional biomaterial immobilized aerobic strain Proteobacteria Cupriavidus H29[J].Bioresource Technology,2020,307:123196.
[50] ZHANG B,LI W,GUO Y,et al.A sustainable strategy for effective regulation of aerobic granulation:augmentation of the signaling molecule content by cultivating AHL-producing strains[J].Water Research,2020,169:115193.
[51] ZHOU Q,XIE X Y,FENG F L,et al.Impact of acyl-homoserine lactones on the response of nitrogen cycling in sediment to florfenicol stress[J].The Science of the Total Environment,2021,785:147294.
[52] DONG S H,FRANE N D,CHRISTENSEN Q H,et al.Molecular basis for the substrate specificity of quorum signal synthases[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(34):9092-9097.
[53] WANG N,GAO J,LIU Y,et al.Realizing the role of N-acyl-homoserine lactone-mediated quorum sensing in nitrification and denitrification:a review[J].Chemosphere,2021,274:129970.
[54] CORNFORTH D M,POPAT R,MCNALLY L,et al.Combinatorial quorum sensing allows bacteria to resolve their social and physical environment[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(11):4280-4284.
[55] PÉREZ-VEL ZQUEZ J,GÖLGELI M,GARC
ZQUEZ J,GÖLGELI M,GARC A-CONTRERAS R.Mathematical modelling of bacterial quorum sensing:a review[J].Bulletin of Mathematical Biology,2016,78(8):1585-1639.
A-CONTRERAS R.Mathematical modelling of bacterial quorum sensing:a review[J].Bulletin of Mathematical Biology,2016,78(8):1585-1639.
[56] SIEHNEL R,TRAXLER B,AN D D,et al.A unique regulator controls the activation threshold of quorum-regulated genes in Pseudomonas aeruginosa[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(17):7916-7921.
[57] SEET Q,ZHANG L H.Anti-activator QslA defines the quorum sensing threshold and response in Pseudomonas aeruginosa[J].Molecular Microbiology,2011,80(4):951-965.
[58] WANG J F,LIU Q J,HU H D,et al.Insight into mature biofilm quorum sensing in full-scale wastewater treatment plants[J].Chemosphere,2019,234:310-317.
[59] FENG Q,LUO L W,CHEN X D,et al.Facilitating biofilm formation of Pseudomonas aeruginosa via exogenous N-acy-L-homoserine lactones stimulation:regulation on the bacterial motility,adhesive ability and metabolic activity[J].Bioresource Technology,2021,341:125727.
[60] FANG Y L,DENG C S,CHEN J,et al.Accelerating the start-up of the cathodic biofilm by adding acyl-homoserine lactone signaling molecules[J].Bioresource Technology,2018,266:548-554.
[61] HU H Z,HE J G,LIU J,et al.Biofilm activity and sludge characteristics affected by exogenous N-acyl homoserine lactones in biofilm reactors[J].Bioresource Technology,2016,211:339-347.
[62] LIU L J,XU S H,WANG F,et al.Effect of exogenous N-acyl-homoserine lactones on the anammox process at 15 ℃:nitrogen removal performance,gene expression and metagenomics analysis[J].Bioresource Technology,2021,341:125760.
[63] TANG X,LIU S T,ZHANG Z T,et al.Identification of the release and effects of AHLs in anammox culture for bacteria communication[J].Chemical Engineering Journal,2015,273:184-191.
[64] LIU W Z,CAI W W,MA A Z,et al.Improvement of bioelectrochemical property and energy recovery by acylhomoserine lactones (AHLs) in microbial electrolysis cells (MECs)[J].Journal of Power Sources,2015,284:56-59.
[65] YONG Y C,WU X Y,SUN J Z,et al.Engineering quorum sensing signaling of Pseudomonas for enhanced wastewater treatment and electricity harvest:a review[J].Chemosphere,2015,140:18-25.
[66] ZENG Y H,YU Z L,HUANG Y L.Combination of culture-dependent and-independent methods reveals diverse acyl homoserine lactone-producers from rhizosphere of wetland plants[J].Current Microbiology,2014,68(5):587-593.
[67] ZHAO L,FU G P,TANG J,et al.Efficient nitrogen removal of mangrove constructed wetlands:enhancing heterotrophic nitrification-aerobic denitrification microflora through quorum sensing[J].Chemical Engineering Journal,2022,430:133048.
[68] VADAKKAN K,GUNASEKARAN R,CHOUDHURY A A,et al.Response Surface Modelling through Box-Behnken approach to optimize bacterial quorum sensing inhibitory action of Tribulus terrestris root extract[J].Rhizosphere,2018,6:134-140.
[69] ZHANG G J,PANG Y,ZHOU Y C,et al.Effect of dissolved oxygen on N2O release in the sewer system during controlling hydrogen sulfide by nitrate dosing[J].The Science of the Total Environment,2022,816:151581.
[70] LIU L J,JI M,WANG F,et al.N-acyl-L-homoserine lactones release and microbial community changes in response to operation temperature in an anammox biofilm reactor[J].Chemosphere,2021,262:127602.
[71] BHEDI C D,PREVATTE C W,LOOKADOO M S,et al.Elevated temperature enhances short- to medium-chain acyl homoserine lactone production by black band disease-associated vibrios[J].FEMS Microbiology Ecology,2017,93(3):2017Mar1;93(3).
[72] LI J,FENG L,BISWAL B K,et al.Bioaugmentation of marine anammox bacteria (MAB)-based anaerobic ammonia oxidation by adding Fe(III) in saline wastewater treatment under low temperature[J].Bioresource Technology,2020,295:122292.
[73] ZHU Z B,ZHANG Y L,LI J,et al.Insight into quorum sensing and microbial community of an anammox consortium in response to salt stress:from Candaditus brocadia to Candaditus scalindua[J].The Science of the Total Environment,2021,796:148979.
[74] PENG P C,HUANG H,REN H Q,et al.Exogenous N-acyl homoserine lactones facilitate microbial adhesion of high ammonia nitrogen wastewater on biocarrier surfaces[J].The Science of the Total Environment,2018,624:1013-1022.
[75] SZERMER-OLEARNIK B,DRAB M,M![]() KOSA M,et al.Aggregation/dispersion transitions of T4 phage triggered by environmental ion availability[J].Journal of Nanobiotechnology,2017,15(1):32.
KOSA M,et al.Aggregation/dispersion transitions of T4 phage triggered by environmental ion availability[J].Journal of Nanobiotechnology,2017,15(1):32.