麦哲伦扇贝(Placopectenma gellanicus),又称海扇贝、大西洋深海扇贝、巨型扇贝,隶属于软体动物门(Mollusca)双壳纲(Bivalvia)瓣鳃亚纲(Lamellibranchia)异柱目(Anisomyaria)扇贝科(Pectinidae),是世界上重要的大型经济扇贝,自然分布于大西洋西北沿岸,从加拿大纽芬兰岛(Newfoundland)和圣劳伦斯湾(Gulf of Saint Lawrence)北岸,至美国北卡罗来纳州哈特拉斯角(Cape Hatteras)一带,是加拿大和美国最有价值的渔业资源物种之一[1-2]。目前,受气候变暖、海洋酸化及日益增高的市场需求影响,麦哲伦扇贝自然资源总量呈现逐年下降趋势。有关扇贝增养殖和资源保护等研究越来越受到重视[3-6]。麦哲伦扇贝闭壳肌肉质鲜美且出柱率高,具有很高的营养价值和经济价值,自2005年引入中国北方海区以来,研究者开展了人工苗种繁育及增养殖初步试验,取得了一定成果和阶段性技术突破[7]。本文综述了麦哲伦扇贝的养殖生物学、遗传学、种苗繁育和增养殖等国内外相关研究进展,并展望了其作为养殖新品种的开发潜力,以期为推动该物种在中国的增养殖开发、种质资源的迁地保护和遗传育种等提供科学参考。
1 生物学特性
1.1 资源分布与生境
麦哲伦扇贝属于冷水性种,通常以种群集聚体或零散群体栖息于水深18~110 m的砂砾质或礁石海底[5]。在其自然分布区的北部,如美国缅因州(Maine)沿岸及加拿大的河口和海湾,麦哲伦扇贝常见于浅水区(最浅至2 m);而在其自然分布区的南端,麦哲伦扇贝会在更深的水域(一般超过55 m,最深至384 m)栖息[1]。相较于其他经济扇贝,麦哲伦扇贝的自然资源量较丰富,主要渔业种群位于大西洋中部、美国的缅因湾(Gulf of Saint Lawrence)、乔治海岸(Georges Bank)及加拿大的芬迪湾(Bay of Fundy)、圣劳伦斯湾(Gulf of Saint Lawrence)等(图1)。Stokesbury等[8]对大西洋西北沿岸麦哲伦扇贝自然生境(约6.8万km2)调查发现,其资源总量约为340亿枚,其中,乔治海湾的资源量最为丰富,约占总量的71%(表1)。随着全球气候变化加剧,海洋变暖和海洋酸化可能会影响麦哲伦扇贝的资源与分布。Cooley等[3]根据IPCC未来气候评估报告的典型浓度路径情景模式RCP 8.5进行相关研究,预测在无气候变化政策干预时,二氧化碳等温室气体排放和浓度不断增加,在不改变当前捕捞规则的前提下,2050年麦哲伦扇贝的捕获量会大幅下降。
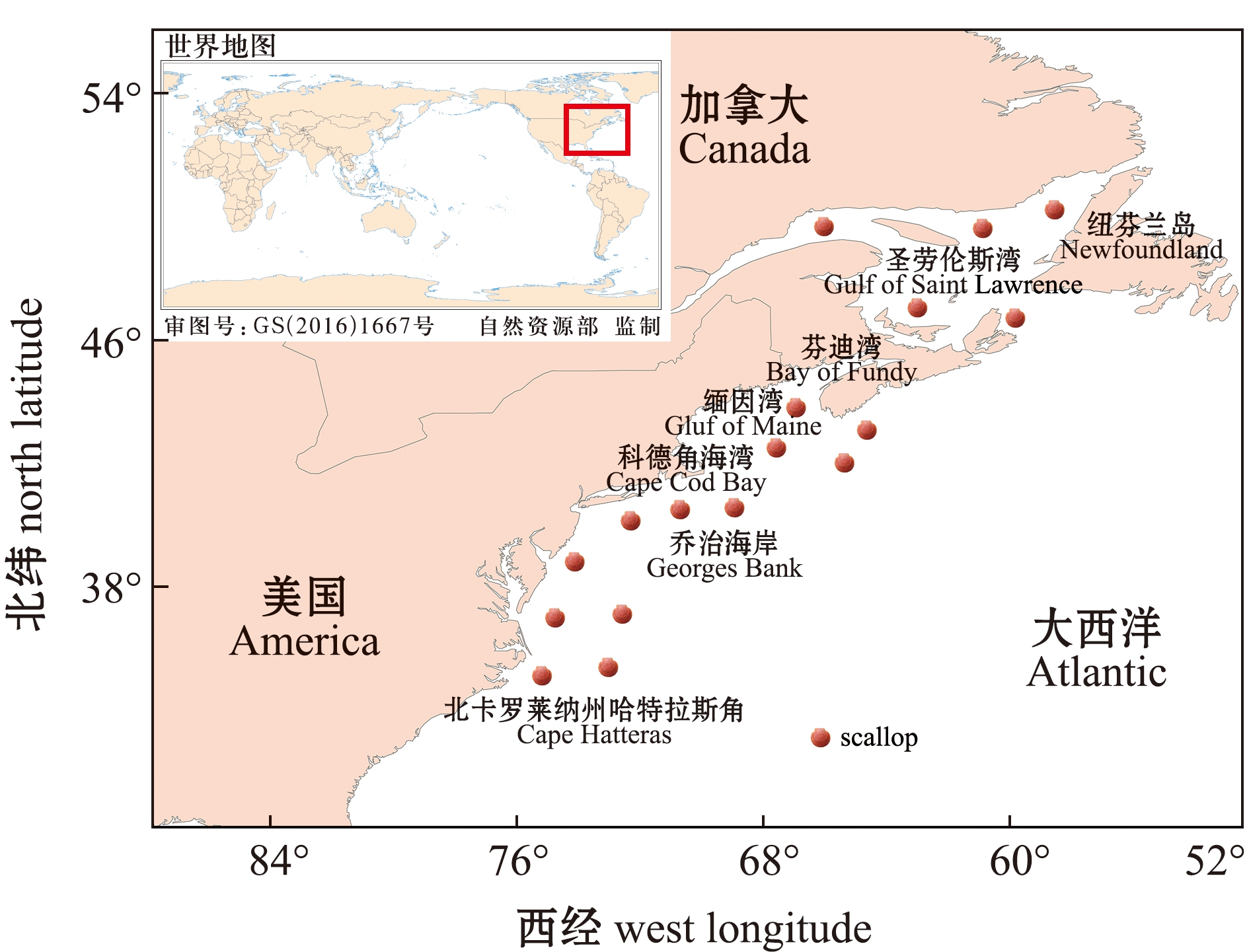
本图基于自然资源部标准地图服务网站GS(2016)1667号标准地图为底图制作, 底图边界无修改。The figure is based on the standard map GS(2016)1667 in the Standard Map Service website of Ministry of Natural Resources of the People’s Republic of China, with no modifications of the boundaries in the standard map.
图1 麦哲伦扇贝地理分布图
Fig.1 A geographical distribution map of Placopectenma magellanicus
表1 麦哲伦扇贝丰度和分布估计[8]
Tab.1 Abundance and distribution estimation of Placopectenma magellanicus[8]
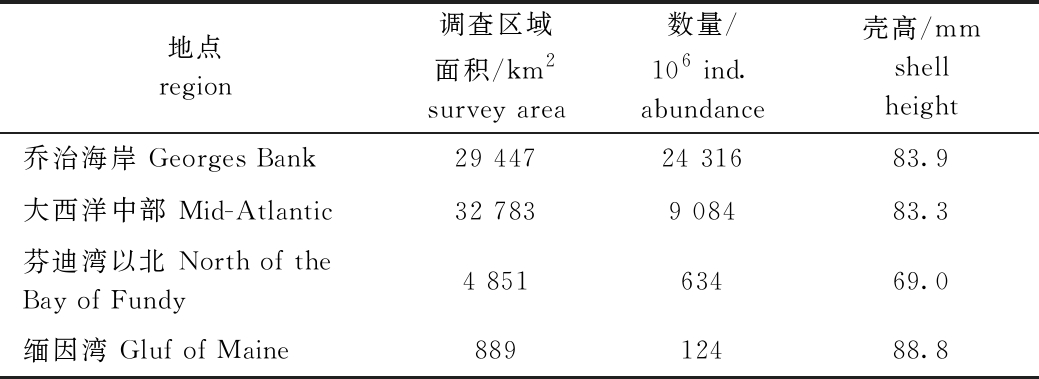
地点region调查区域面积/km2survey area数量/106 ind.abundance壳高/mmshell height乔治海岸 Georges Bank29 44724 31683.9大西洋中部 Mid-Atlantic32 7839 08483.3芬迪湾以北 North of the Bay of Fundy4 85163469.0缅因湾 Gluf of Maine88912488.8
1.2 形态特征
基于形态学特征的通径分析可为海水贝类选择育种提供测度指标参考。成年麦哲伦扇贝的贝壳较大,壳长为80~200 mm,规格通常为100~150 mm[9]。麦哲伦扇贝贝壳呈圆形,左壳较凸,右壳微平,壳高通常大于壳宽;前后耳大小等同,铰合部细长,左壳表面总体略显粗糙,有大量细小密集的放射肋和环状暗色生长纹;左壳多为砖红色、薰衣草色和黄色,右壳多为灰白色(图2);贝壳内面均为瓷白色,具光泽。其闭壳肌硕大,直径为30~40 mm。外套膜颜色变化明显,通常呈现白色、黑色和红色,其上具有触须和眼点。
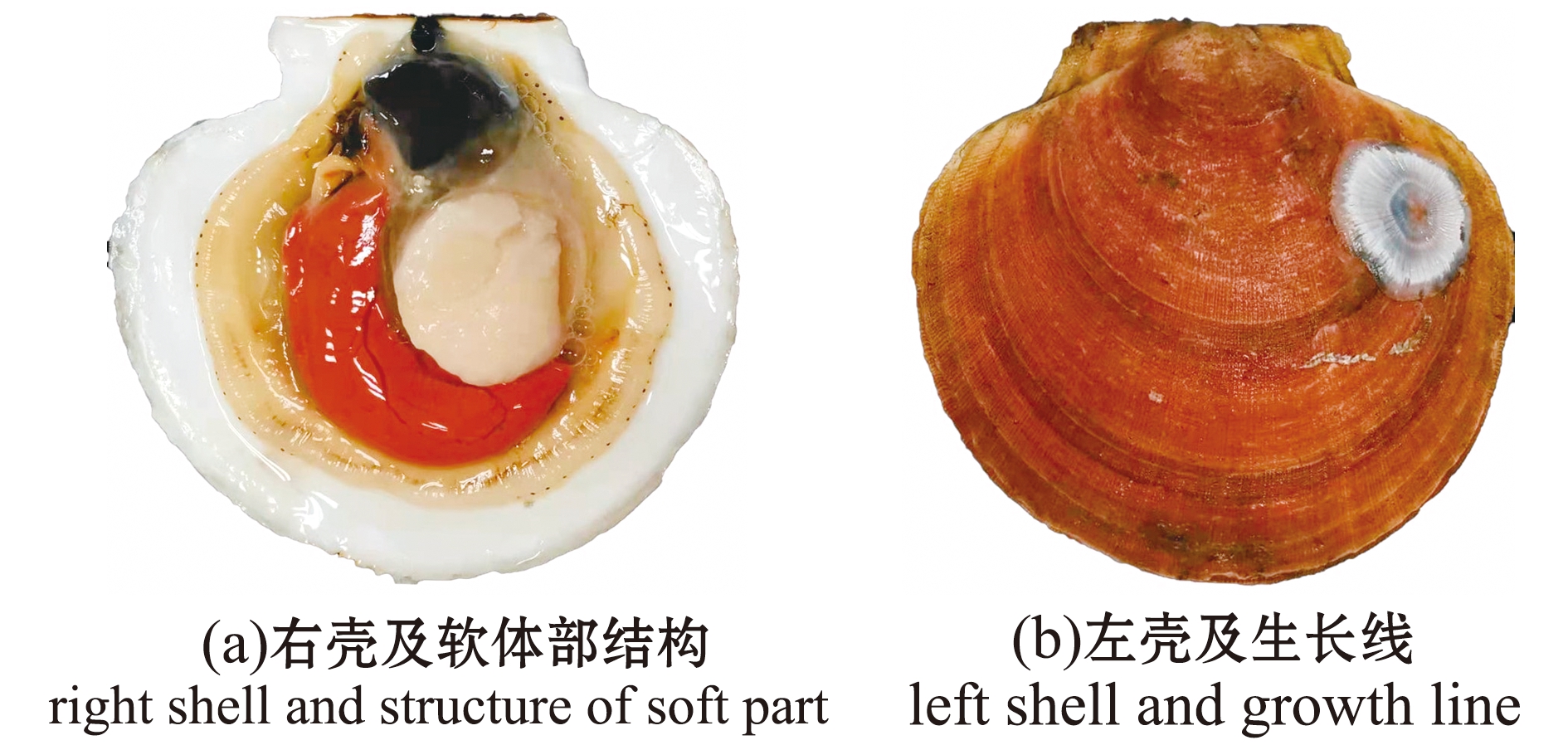
图2 麦哲伦扇贝的形态结构
Fig.2 Morphological structure of Placopectenma magellanicus
1.3 繁殖生物学
1.3.1 性腺特征 麦哲伦扇贝为雌雄异体,偶有雌雄同体现象[5]。性腺位于足腹面与闭壳肌前方,其内有弯曲的上行肠和下行肠。在繁殖季节,生殖腺发达,厚度显著增加,可扩展至消化腺外围。精巢呈乳白色,卵巢呈橘红色(图2)。性腺由滤泡、生殖管和输出管组成。滤泡为生殖管分支末端膨大而成的泡囊状结构,其壁由生殖上皮及结缔组织构成。生殖上皮增殖为精原细胞或卵原细胞,并进一步发育为初级精母细胞或初级卵母细胞。性腺中结缔组织的数量取决于性腺的成熟状态,成熟性腺中几乎无结缔组织。当成熟配子经腺体左右两侧肾生殖孔排出体外,且新的精子或卵子开始发育之前,生殖腺外形显得柔软皱缩,雌雄腺体色泽渐变为淡黄色,此时两性生殖腺于外形上无显著区别[6]。
1.3.2 生殖习性 麦哲伦扇贝最早可在1龄雌性个体中发现成熟配子,并于当年或翌年进行产卵,但这一现象在4龄之前并不常见。通常4龄左右的性成熟麦哲伦扇贝(壳高85~90 mm)的繁殖力(怀卵量)最高,单次最大怀卵量约为200万个,一生累计怀卵量可高达约2.7亿个[10-11],且浅水种群(水深10~20 m)通常比深水种群(水深170~180 m)的产卵量更大[12]。麦哲伦扇贝将精卵排于水中进行受精和发育。受到水温、纬度和饵料等环境因子影响,不同地域的麦哲伦扇贝繁殖期也略有不同,绝大部分种群繁殖期集中在每年8—10月(表2)。麦哲伦扇贝性腺的外部形态和组织结构随着年龄增加、季节更换和性发育周期而变化。基于性腺组织形态学特征和双壳贝类性腺发育规律,麦哲伦扇贝的性腺发育周期可以分为休止期、形成期、增殖期、成熟期、排放期和耗尽期(表3)。
表2 不同海域麦哲伦扇贝的繁殖时期
Tab.2 Reproductive period of Placopectenma magellanicus in different regions

地点 region时间 time温度 temperature/℃地理位置 position参考文献 reference乔治海岸 Georges Bank9—10月9^1141°15'N、66°22'WPosgay等[13]科德角海湾 Cape Cod Bay9—10月—41°41'N、70°12'WPosgay[14]纽芬兰岛东南部 Southeast Newfoundland6、8—10月8.649°09'10.69″N、56°07'5.39″WNaidu[6]芬迪湾 Bay of Fundy8—9月13^1545°07'N、67°04'WBeninger[15]缅因湾 Gluf of Maine8—9月—43°37'54″N、70°16'22″WPosgay等[13]大西洋中部海湾 Mid-Atlantic gulf5、11月8^1240°00'^37°20'N、73°00'^74°30'WSchmitzer等[16]
表3 麦哲伦扇贝的性腺发育分期[6]
Tab.3 Stages of gonadal development in Placopectenma magellanicus[6]

时期 stage特征 characteristic休止期resting stage性腺不明显,具有结缔组织,透明无色。生殖细胞未发育,无法分辨性别形成期proliferative stage性腺开始发育;雌性可见较小的卵原细胞和初级卵母细胞,滤泡之间具有大量的结缔组织;雄性可见精原细胞和精母细胞,无精细胞和精子增殖期developing stage性腺快速发育,滤泡间可见结缔组织;雌性滤泡腔中出现少量成熟的卵子,多数为卵母细胞;雄性滤泡中同时存在精原细胞、精母细胞、精细胞和精子成熟期maturation stage性腺体积增大,生殖细胞大量成熟;雌性滤泡腔内充满大量成熟的卵子,卵子呈现多边形;雄性滤泡腔内充满大量成熟的精子,精子呈放射状排放期ripe stage生殖细胞开始排放,雌性滤泡内游离的卵子开始减少或全部排空,滤泡壁破裂;雄性滤泡中会有少量精子的残留耗尽期spent stage性腺滤泡破裂、分散,发生吞噬作用;雌性仅有少量卵子残留;雄性也仅少量精子残留,属于重吸收阶段
2 苗种繁育与增养殖
2.1 人工育苗
虽然麦哲伦扇贝的人工养殖集中于北美东北海岸,但有关其人工育苗的研究报道较少。加拿大曾经成功培育出麦哲伦扇贝贝苗,然而由于缺少持续的研究与推广,养殖从业者主要还是通过人工采苗获得麦哲伦扇贝稚贝。麦哲伦扇贝引入中国后,借鉴于虾夷扇贝人工繁育的成功经验,其人工育苗关键技术得到了快速突破,包括亲贝的采捕与促熟、产卵与孵化、幼虫培育与中间育成等基本环节。
2.1.1 亲本选择与促熟 通常在每年繁殖季节(6—7月)的前几周完成亲贝采捕工作,选择壳形完整且壳长在80 mm以上的健壮个体进行短期暂养。主要通过升温促熟,即由自然水温(3.5~4.5 ℃)逐步升高到9~11 ℃,恒温培育40~50 d,暂养和促熟期间投喂单胞藻,包括新月菱形藻(Nitzschia closterium)、牟氏角毛藻(Chaetoceros mulleri)和绿色巴夫藻(Pavlova viridis),开始时每日投喂2次,从第7天开始每日投喂4次,直至麦哲伦扇贝性腺成熟[7]。一般在催产前几天停止投喂,以避免扇贝改变能量分配用于生长,从而延误产卵时机[17]。
2.1.2 产卵与孵化 麦哲伦扇贝催产方式有多种,可以利用改变水温、增加水循环和注射五羟色胺等方法诱导其产卵[18]。养殖场通常采用升温和降温方法诱导麦哲伦扇贝产卵,如Fournier等[19]通过将温度从10 ℃降至4 ℃来诱导麦哲伦扇贝产卵;Culliney[18]则通过将温度提高3~5 ℃来刺激麦哲伦扇贝产卵。麦哲伦扇贝产卵过程中也可受到非生物因素影响,如有学者认为光周期是调节麦哲伦扇贝全年成功产卵的关键[20],而产卵时间的季节性差异也会对幼虫活力产生影响[21]。因此,需减少非生物因素的影响,以确保产卵和孵化顺利进行。当麦哲伦扇贝性腺发育成熟时,通常以阴干结合升温方法进行催产。受精卵在14~15 ℃下,经45~47 h发育成D形幼虫,其壳长为(88.9±3.7) μm,当大部分幼虫发育至D形幼虫后进行选育[7]。
2.1.3 幼虫培育和中间育成 幼虫培育的适宜水温为14.0~15.6 ℃,培育到第16~17天时,大部分幼虫出现眼点,到第18天时发育至足面盘幼虫,此时幼虫壳长约为250 μm,平均壳长生长率为5.6~5.9 μm/d[7]。通过观察幼虫是否分泌足丝判断投放附着基的时机[7,22],幼虫通常在6~10 d内完成附着,其后可以将附着基转移至适宜海域进行中间育成。育成时先将附着基放入孔径为245~440 μm的网袋中,经过60~70 d可以相继转入孔径为550、880 μm的网袋中进行分苗[7],经过中间育成后麦哲伦扇贝规格为40~60 mm(16~26月龄),最终达到商品规格。
2.2 人工采苗
人工采苗是一种获得麦哲伦扇贝苗种的传统方法,主要依据扇贝浮游幼虫发育后期有变态附着的生活习性,向扇贝自然资源丰富且敌害生物少等环境适宜的海区和养殖区投放附着基或人工采苗器采集天然苗种。1988—2000年,对大西洋麦哲伦扇贝养殖情况的调查发现,加拿大新斯科舍省马宏湾(Mahone Bay, Nova Scotia)秋季的人工采苗量逐年上升,一些较好采苗地点的采苗量可达到平均每个采苗器100~1 000枚贝苗[23],具体采苗效果通常与附着基或采苗器的投放时机、材质与颜色有关。
2.2.1 采苗时机 采苗时机一般与海区自然条件(包括洋流、水深和捕食者等生物或非生物因素),以及麦哲伦扇贝的繁殖生物学特征有关。在人工采苗初期,应调查麦哲伦扇贝的性腺发育周期、性腺指数和幼虫附着时期等参数,有助于确定采集器的最佳投放时间[23-24]。Parsons[24]发现,麦哲伦扇贝产卵后35~40 d是最佳采苗时机,此时投放采苗器效果最好。Lanteigne等[25]通过改进采苗技术并掌握采苗海湾洋流时间和变化情况,可使幼虫的采苗量保持在每袋3 000枚以上。调查发现,帕萨马科迪湾(Passamacoddy Bay)的海星幼体附着高峰期通常出现在麦哲伦扇贝沉降附着期前的2~3周内,因此,可以在海星高峰期过后再投放扇贝采苗器[24]。此外,采苗的数量通常随幼虫的附着强度发生变化,而附着强度又随水深的变化而变化,故水深对采苗效果有一定影响。研究表明,贴近水面和海底附近的幼虫数量较少,而在水层中部最多[2,26]。
2.2.2 采苗器材质和颜色 在自然生境中,大多数麦哲伦扇贝的稚贝附着在小型鹅卵石、玻璃及贝壳碎片底部[17];而在养殖环境中,各种人工基质材料通常用作稚贝附着基。麦哲伦扇贝苗种采集量受到附着基不同材质和颜色的影响。涂有甲壳素薄膜(虾、蟹类的外骨骼提纯物)的人造丝质材料,能够提高幼虫的采集量[27];单刺丝网的采苗量优于聚乙烯网片,但其总体存活率(84.4%)明显低于聚乙烯网片(96.7%),单刺丝网材质的网袋可以获得最佳采苗量[28]。Davidson等[29]还发现,不同颜色采苗袋的采苗效率也存在差异,其中,蓝色采苗袋的采苗量最多,特别是其投放在15~30 m深的水层中时,采苗量可以增加10%~20%。
2.3 增养殖
2.3.1 养殖历史 麦哲伦扇贝增养殖业是随其渔业资源的衰退而发展起来的。19世纪70年代,加拿大纽芬兰省(Newfoundland)率先通过采收自然苗种补充当地麦哲伦扇贝种群,此后在魁北克(Quebec)也进行了苗种繁育试验[30]。20世纪80年代,麦哲伦扇贝的苗种自然补充、苗种采集、中间培育和最终养成方法得到了系统研究[22,24,26]。美国缅因州和马萨诸塞州(Massachusetts)也进行了浮筏和底播的养殖技术研究[31]。1995年,为了维持鳕捕捞业衰退后的当地经济,法国在圣皮埃尔和密克隆群岛(Saint Pierre and Miquelon)对麦哲伦扇贝进行了人工养殖试验[32]。中国于2005年后也开展了麦哲伦扇贝引种、人工育苗和增养殖等工作,并取得了突破性进展[7]。目前,麦哲伦扇贝的养殖方式主要为底播增殖和浮筏养殖。
2.3.2 底播增殖 扇贝底播增殖是将苗种直接投放在适合生长的海床上,使之自然生长的一种养殖方式。经过中间育成达到40~60 mm(16~26月龄)的麦哲伦扇贝就可以进行底播养殖,整个过程需要2~3年达到商品规格[33]。底播海床与麦哲伦扇贝自然生长生境的海床应具有相似的物理和生物特性,海床中食物的数量与质量、沉积物类型、沙粒水深、温度、湍流和水流对扇贝附着有一定的影响[34],因此,底播海床需要满足麦哲伦扇贝对水域生态环境和底质环境的要求。为了提高麦哲伦扇贝的产量,需考虑底播面积与该地区天然扇贝床面积的相关性,对乔治海岸的麦哲伦扇贝床调查发现,每个扇贝床平均直径为3~10 km,其平均密度可达到1.24枚/m2。若麦哲伦扇贝种群规模较小,易导致底播扇贝被捕食者(海星等)捕食[35]。底播增殖麦哲伦扇贝,可最大限度地使其在自然环境中生长,还可以充分利用海水的自净能力保障麦哲伦扇贝品质安全,并能有效预防病害发生,是一种绿色生态健康养殖模式,不过其产量会受到扇贝生长速率、底播方法和时机等因素的影响[36]。
2.3.3 浮筏养殖 浮筏养殖是提高扇贝产量的有效方法,包括吊耳养殖和网箱养殖。筏养的麦哲伦扇贝在0.5~2年后就能够进行收获[33-34]。相较于底播增殖,浮筏养殖的麦哲伦扇贝具有更快的生长速率(壳长生长速率约为0.06 mm/d),存活率也高于天然或底播增殖[37]。在帕萨马科迪湾(Passamacoddy Bay)的养殖生产过程中发现,吊耳养殖和网箱养殖麦哲伦扇贝的壳长生长率分别为0.072、0.08 mm/d[26]。与网箱养殖相比,吊耳养殖的麦哲伦扇贝养殖量更大、出肉率更多、成活率更高、生长速率也更快[34],但吊耳养殖需要更大的劳动成本[38]。网箱养殖的优势是麦哲伦扇贝能够依据水流选择最佳的呼吸代谢开口方向,从而使其在水体波动的条件下保持良好的生长速度,但随着扇贝生长,网笼内沉积物的增加会导致其生长速率降低[39-40],网箱养殖用具主要包括传统的珍珠网和灯笼网等,灯笼网主要用于中期培育[26]。
3 生理与生态
3.1 温度与盐度
温度和盐度是海洋生态系统中重要的生态因子,对贝类的生长、发育、生殖、行为和分布有决定性影响[41]。研究发现,不同发育阶段的麦哲伦扇贝最适温度和盐度存在差异,幼虫的最适温度为14~15.6 ℃,成贝的最适盐度为30~32(表4)。自然生境下麦哲伦扇贝的繁殖温度为6.5~16 ℃,而在人工繁育环境下麦哲伦扇贝通常会在12~14 ℃时进行产卵[1,7]。麦哲伦扇贝幼虫在盐度低于10.5的条件下,会出现贝壳张开并伴随外套膜内缩和快速游动等异常行为,处于这种状态下的麦哲伦扇贝更容易被捕食者捕获,从而导致其种群数量下降[18]。在盐度高于25及温度低于18 ℃的条件下,稚贝(壳高10~35 mm)的存活率几乎为100%;但随着温度升高,其生理机能和耐受性均会随之减弱,当温度升至21 ℃时,麦哲伦扇贝的鳃、外套膜和性腺等直接暴露于水中,这些组织因上皮细胞大量脱落而造成器官受损,从而增加麦哲伦扇贝死亡率[42]。野生种群成贝在超过23.5 ℃水温下会出现大规模死亡,超过21 ℃时也可能处于亚致死状态[43]。
表4 不同发育阶段麦哲伦扇贝生存的温度和盐度
Tab.4 Survival temperature and salinity of Placopectenma magellanicus at different developmental stages

发育时期 developmental stage 存活温度/℃survival temperature最适温度/℃optimal temperature存活盐度survival salinity最适盐度optimal salinity参考文献reference幼虫 larva12^1814.0^15.6>10.516.9^30.0Culliney[18]稚贝 juvenile<21≤18>16.0≥25Frenette[42]成贝 adult<23.510^15>16.530^32Dickie[43]
3.2 食性选择
麦哲伦扇贝主要滤食浮游植物、底栖微藻及微型浮游动物(如纤毛原生动物等),有时也会摄入一些有机碎屑颗粒[44]。在麦哲伦扇贝人工育苗过程中,科学合理的饵料选择与配合投喂是确保亲贝促熟和幼虫生长发育成功的关键。研究发现,亲贝促熟期饵料通常包括新月菱形藻、牟氏角毛藻和绿色巴夫藻等单细胞藻类,而浮游幼虫期投喂的饵料微藻大多为球等鞭金藻(Isochrysis galbana)、钙质角毛藻(C.calcitrans)和巴夫藻等[7]。在个体早期发育阶段,饵料质量是决定幼虫数量和质量的关键因素,幼虫能从微型藻类中获得DPA(ω-6脂肪酸)代替其所需的DHA(ω-3脂肪酸),且幼虫的生长与海藻的甾醇和甲基酮含量间存在正相关关系[45]。当浮游植物浓度较低时,或者在鳃发育的早期,幼虫可以通过鳃上的掌状器官,把溶解在水中的有机碳(DOC)转化为甘氨酸,作为其生长的营养来源[46]。加拿大人工养殖的麦哲伦扇贝幼虫摄食当地沿海水域3种浮游植物,包括北部角毛藻(C.sentrionalis)、舟形藻(N.pelliculosa)和定鞭金藻(Prymneium sp.)[47]。在养殖生产实践中发现,摄食混合微藻(如叉鞭金藻(I.zhanjianggensis)、巴夫藻等)的麦哲伦扇贝比摄食单种微藻的幼虫壳长增加2 μm,且具有更快的生长速率和更高的存活率[7]。在国内的养殖试验中,麦哲伦扇贝主要是以新月菱形藻、三角褐指藻(Phaeodactylum tricornutum)、牟氏角毛藻和金藻(Chrysophyta sp.)的混合饵料为食[7]。此外,养殖场地理位置不同也会造成其摄食成分的差异,沿海和海湾地区的麦哲伦扇贝通常有摄食海藻和海草碎屑的行为;而近海离岸养殖的麦哲伦扇贝则会摄食浮游植物和悬浮的有机碎屑等[48]。
3.3 捕食者
麦哲伦扇贝的捕食者包括硬骨鱼类大西洋鳕(Gadus morhua L.)、棘皮动物海星(Asterias spp.)、软体动物鹦鹉螺(Crossaster polaris),以及甲壳动物黄道蟹(Cancer irroratus)、青蟹(Carcinus maenas)和龙虾(Homarus americanus)等,其中,海星和黄道蟹是麦哲伦扇贝的主要捕食者,可导致稚贝在底播增养殖的前8周内存活率显著降低[49]。进一步研究表明,麦哲伦扇贝的被捕食量会随着贝壳高度的增加而减少[36]。当不同规格的麦哲伦扇贝和幼贝共存时,由于较大规格的麦哲伦扇贝游泳逃逸行为更强,故能够成功躲避捕食者,海星会被动地选择壳高为 1~5 mm的小型扇贝个体;相反,由于黄道蟹的移动速度和抓捕能力更强,通常会主动选择壳高为20~25 mm的大型扇贝个体,原因是大规格的麦哲伦扇贝更容易被发现和捕食[50]。此外,海星的捕食行为还会受到生活环境中底质和颗粒物密度的影响,其捕食率随底质颗粒直径的减小而增大(卵石最低,颗粒次之,沙粒最高),在高密度的颗粒物环境下会比低密度下捕食更多的小麦哲伦扇贝幼贝。因此,了解麦哲伦扇贝捕食者组成及其摄食行为生态学,将有助于采取预防措施,进而提高麦哲伦扇贝增养殖过程的成活率。如在浮筏养殖关键期,可以通过人工采捕或者换网来控制捕食者的数量;在底播增殖过程中,应严格控制养殖麦哲伦扇贝的初始密度、播种时的规格及地点,以及提前进行天敌的清除,或通过增加贻贝等低值猎物对麦哲伦扇贝进行短期保护,还可以通过在麦哲伦扇贝床周围建立围栏装置以确保幼贝的存活率[51]。
4 遗传育种
4.1 染色体
由于染色体数目和形态结构特征在遗传学、细胞生物学和分类学中具有重要意义,所以对生物染色体的形态和结构特征进行研究,不仅有助于鉴定物种,探讨属间和种间的系统进化关系,阐明染色体的结构变异等重要遗传问题,还对预测种间杂交和多倍体育种结果等具有重要实际意义。染色体研究包括核型分析和带型分析,对麦哲伦扇贝的核型分析发现,其染色体数目为n=19、2n=38,染色体大小为3.3~8.5 μm,核型包括亚稳心型、亚端心型和端心型3种形态[52]。应用随机扩增多态DNA (RAPD)技术对麦哲伦扇贝DNA进行检测,利用40个阳性引物对处于不同深度扇贝层的24个个体的RAPD图谱进行比较,发现至少有15个引物存在明显多态性,该多态性重复出现,具有一定的稳定性,可以作为一个额外的工具用于了解麦哲伦扇贝的群体遗传结构[53]。
4.2 遗传多样性
为保护麦哲伦扇贝的野生种质资源并制定有效的保护措施,有必要了解其遗传多样性现状。在对纽芬兰省近海麦哲伦扇贝的研究中,利用合成含有寡核苷酸引物扩增出18S rRNA基因,该基因与太平洋石鳖(Cryptoiton stelleri)、大西洋蛤仔(Spisula solidissima)、软壳蛤(Mya arenaria)和异尖线虫(Anisodoris nobilis) 18S rRNA的一致性分别为89.6%、88.6%、87.2%和85.9%[54]。对麦哲伦扇贝线粒体DNA研究发现,其mtDNA大小约为34 000 bp,且不同个体之间mtDNA的大小存在显著性差异,从最小32 100 bp到最大39 300 bp不等[55]。对大西洋中部12个地点245个麦哲伦扇贝样本,利用RAD简化基因组测序鉴定并分型了7 163个SNP,发现南北样本间存在不连续性,42.9%的离群位点和24.6%的中性位点存在等位基因偏离[56]。利用6个微卫星标记对加拿大纽芬兰到美国新泽西州12个种群的遗传多样性分析发现,不同地理种群的麦哲伦扇贝具有高水平的遗传分化,最大值为0.61[57]。利用AFLP标记对麦哲伦扇贝和中国北方主要养殖的虾夷扇贝(Patinopecten yessoensis)、栉孔扇贝(Chlamys farreri)和海湾扇贝(Argopecten irradians)的种群遗传分析表明,麦哲伦扇贝与虾夷扇贝亲缘关系最近,与海湾扇贝遗传距离最远[58]。
5 病害
近年来,野生和养殖的麦哲伦扇贝种群中均曾暴发过大规模死亡现象,影响了扇贝产业的发展。关于麦哲伦扇贝病害的研究最早开始于18世纪,研究发现,扇贝死亡原因可能由多种因素造成,包括环境、生理、遗传、疾病和捕食等[59]。根据不同病原,可分为微生物、原生生物、后生生物和非寄生性贝病4类[60]。病原微生物通常包括立克次氏体和细菌。研究者早在1979—1980年就发现了由立克次氏体引起的麦哲伦扇贝大规模死亡现象,死亡扇贝的鳃组织细胞被立克次氏体感染,个体游泳能力减弱,易被捕食者捕获猎食[61]。20世纪90年代初,加拿大圣劳伦斯湾北岸的麦哲伦扇贝种群死亡率由最初的19%骤升到80%以上,在死亡个体组织内发现3种寄生生物,包括立克次氏体、鳃涡虫和肠道涡虫,感染率分别为3.7%、7.4%和3.7%。进一步研究发现,附着生物不是导致麦哲伦扇贝死亡的直接原因,而是使组织坏死并孳生腐生细菌,进而导致其死亡[35]。
在加拿大芬迪湾的麦哲伦扇贝中首次发现了灰色细长的闭壳肌(图3),组织病理学分析显示,这种变色现象不是因衰老引起,而是由其组织内一种具有顶端复合体的原生动物寄生所致。在此寄生虫感染情况下,个体产生免疫反应的能量成本增加,寄生虫活动所导致储能区域和肌肉组织的结构病变,从而使闭壳肌内储存的能量减少,在外观上呈现灰色的症状[62]。
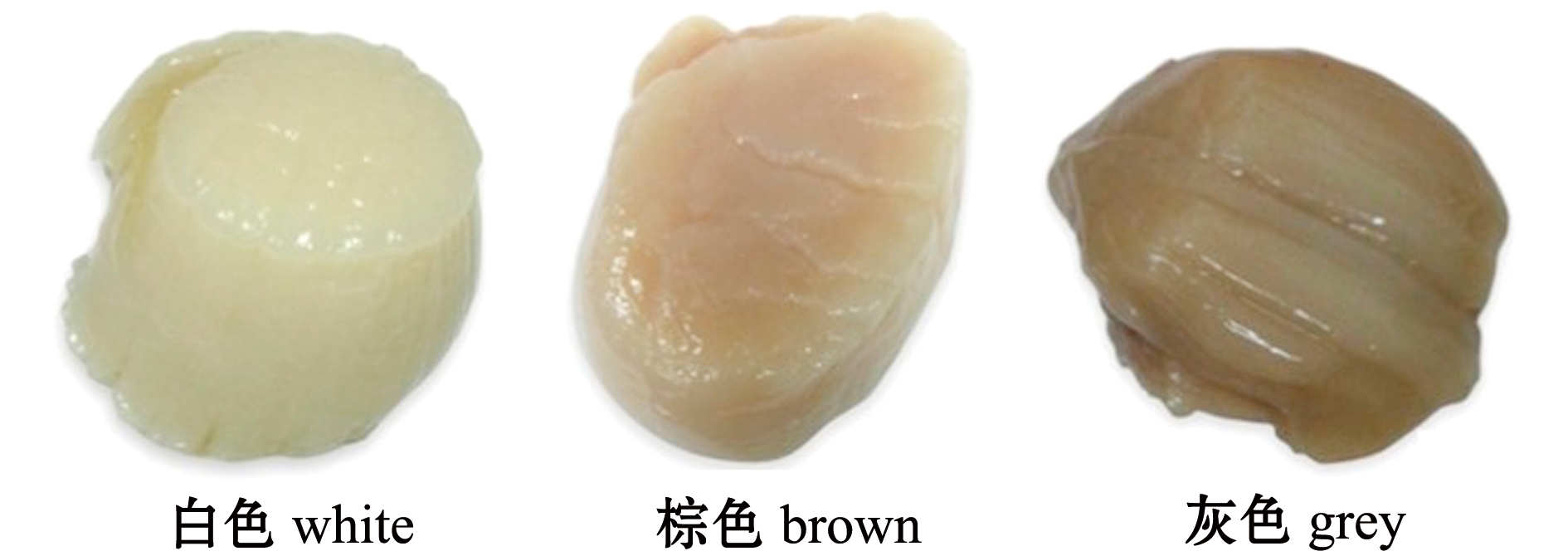
图3 成体麦哲伦扇贝闭壳肌颜色[62]
Fig.3 Color of adductor muscle of adult Placopectenma magellanicus[62]
此外,麦哲伦扇贝贝壳上的寄生生物通常是被囊类、藤壶类和海鞘类等滤食性生物。喉囊藻(Tubularia larynx)是麦哲伦扇贝壳体上最常见的污损物种,当扇贝生长在较浅水域时,其对扇贝生长速率无显著影响[27];威氏才女虫(Polydora websteri)会在麦哲伦扇贝贝壳中挖洞,导致贝壳内部分泌额外的珍珠层,破坏贝壳结构完整性,从而增加被捕食的风险[63];海鞘(Didemnum vexillum)覆盖后麦哲伦扇贝的游动速率会变慢,导致扇贝更容易被捕食[64],但海鞘中含有酸类物质,可以在一定程度上阻碍海星和鱼类的捕食[65]。养殖过程中发现,通过在秋季更换渔网或者利用生物控制,如将海胆、海参等物种和麦哲伦扇贝进行混养或多营养层次综合养殖,可以减少污损生物的着生。
6 展望
中国扇贝养殖始于20世纪60—70年代,自80年代引种海湾扇贝和虾夷扇贝后得到快速发展,并成为海水养殖业的主导产业,2020年养殖产量超过1.7×106 t,是世界上扇贝产量最大的国家。中国养殖的大型扇贝主要是虾夷扇贝,其原产于日本北部及俄罗斯远东地区沿海,自20世纪80年代成功引种以来,取得了巨大的经济和生态效益。近年来,由于虾夷扇贝养殖过程中死亡率较高,导致产品供应极不稳定,产业正经历低谷,亟须补充新的扇贝优良品种。麦哲伦扇贝闭壳肌硕大且营养丰富,在北美和欧洲市场供不应求,其温盐生态适应性与北黄海海域虾夷扇贝的增养殖环境相近,具有良好的市场开发潜力,有必要尽早开展人工繁育、养殖模式开发、种质资源保护和优良品种培育等研究工作。目前,对麦哲伦扇贝的苗种繁育与养成技术研究已取得了初步进展,在北黄海构建了少量自繁群体,未来应围绕该物种的养殖技术开发、种质资源迁地保护和遗传育种等方面开展深入研究,以期为国家和地方水产种业振兴和渔业绿色高质量发展提供理论和技术支撑。
6.1 建立绿色增养殖新模式
目前,北黄海的麦哲伦扇贝自繁群体有限且养殖相关技术仍处在起步阶段,进一步开发该物种的养殖潜力,首先需要完善人工育苗技术,包括亲贝促熟与饵料筛选、采卵与孵化、幼虫培养、苗种中间培育与养成等关键技术问题,并建立一整套工厂化育苗及全人工养成技术,为大规模发展麦哲伦扇贝养殖业提供高品质的苗种供应。其次亟须查明最适宜幼虫生长发育和变态的条件,建议从环境因素入手,对海水温度和盐度、不同饵料的分量与搭配、扇贝与稚贝不同培育密度等因素的影响效果进行深入研究。建议借鉴虾夷扇贝养殖的成功经验,因地制宜研发符合水产绿色健康养殖发展要求的技术模式,科学评估基于生态系统水平的养殖容量,调整养殖密度,避免增养殖种类和模式单一,积极探索麦哲伦扇贝的多营养层次综合养殖和离岸养殖等新模式,从而保证贝类养殖产业向着环境和过程的标准化、可控化、智能化和生态化方向发展。
6.2 保护现有种群种质资源
麦哲伦扇贝原产于大西洋西北沿岸,中国北黄海海区虽然与其原有生境相似,但自2005年引种后所形成的自繁种群数量较小。根据海洋贝类区系的性质及海洋地理生态学规律,在实现麦哲伦扇贝人工繁育和养殖过程全人工化的基础上,重视对现有种群边开发边保护,同时确保不会对本地扇贝的种质资源造成负面影响。建议加强对麦哲伦扇贝自繁群体栖息环境的保护和管理,可适当迁移部分种群至有条件的原良种场或建立相应的种质资源保护区进行迁地保护。
6.3 培育优质抗逆新品种
中国扇贝养殖经过几十年的发展,其规模化和专业化均达到了世界领先水平。鉴于全球气候变化导致的海水升温和酸化等海洋生态环境变化已是不争的事实,扇贝的繁育与养殖仍然会不断面临新的挑战。选育和改良现有的养殖品种,使其具有更强的抗病害及抵御不良环境的能力,从根本上避免扇贝因长期人工育苗所导致的种质衰退等系列问题。中国引进的麦哲伦扇贝尚未经过系统的人工选育,其遗传基础还是野生型,生长速度及抗逆性乃至品质质量亟须遗传改良,建议在系统开展选择育种的同时,在全基因组水平研究麦哲伦扇贝复杂性状的遗传机制,并应用基因组编辑等现代生物技术,获得适应海洋生境变化的优质麦哲伦扇贝新品种。
6.4 推动贝类产业高质量发展
作为中国海水养殖业的重要组成,海水贝类养殖规模和效益的稳定增长,对中国渔业经济健康发展发挥了重要推动作用。当前国家经济高质量发展的时代背景对渔业提出了新的要求,传统养殖、捕捞、加工等产业均需着力推进转型升级,不断提升质量效益和竞争力。对有开发潜力的渔业新品种,应高起点谋划、高标准发展。未来,应积极落实“稳产保供、创新增效、绿色低碳、规范安全、富裕渔民”的理念,探索麦哲伦扇贝等贝类增养殖业的产业生态化、装备工程化、技术现代化、生产工厂化和管理工业化的全产业链技术支撑,在全面分析市场需求、资源禀赋和潜力空间的基础上,根据产业集中连片发展需要,做好顶层设计。同时,要强化科技支撑引领,加强跨学科交叉协作和资源整合,围绕推进绿色健康养殖、促进水产种业振兴和提升渔业产业现代化水平等加快产业融合发展,深入开展相关基础理论和关键技术研究。
[1] NAIDU K S,ROBERT G.Chapter 15 fisheries sea scallop,Placopecten magellanicus[M]//Scallops:biology,ecology and aquaculture.Amsterdam:Elsevier,2006:869-905.
[2] KENCHINGTON E L,PATWARY M U,ZOUROS E,et al.Genetic differentiation in relation to marine landscape in a broadcast-spawning bivalve mollusc (Placopecten magellanicus)[J].Molecular Ecology,2006,15(7):1781-1796.
[3] COOLEY S R,RHEUBAN J E,HART D R,et al.An integrated assessment model for helping the United States sea scallop (Placopecten magellanicus) fishery plan ahead for ocean acidification and warming[J].PLoS One,2015,10(5):e0124145.
[4] HARE J A,MANDERSON J P,NYE J A,et al.Cusk (Brosme brosme) and climate change:assessing the threat to a candidate marine fish species under the US Endangered Species Act[J].ICES Journal of Marine Science,2012,69(10):1753-1768.
[5] BRAND A R.Chapter 12 scallop ecology:distributions and behaviour[J].Developments in Aquaculture and Fisheries Science,2006,35:651-744.
[6] NAIDU K S.Reproduction and breeding cycle of the giant scallop Placopecten magellanicus (Gmelin) in Port au Port Bay,Newfoundland[J].Canadian Journal of Zoology,1970,48(5):1003-1012.
[7] 魏振禄,王春德,李春茂.大西洋深海扇贝的繁育与增养殖方法:CN104719200B[P].2017-01-25.
WEI Z L,WANG C D,LI C M.Breeding and propagation method for Atlantic deep sea scallops:CN104719200B[P].2017-01-25.(in Chinese).
[8] STOKESBURY K D,BETHONEY N D.How many sea scallops are there and why does it matter?[J].Frontiers in Ecology and the Environment,2020,18(9):513-519.
[9] BLACK G A P.Atlas of the biology and distribution of the sea scallop Placopecten magellanicus and Iceland scallop Chlamys islandica in the Northwest Atlantic[M].Scotia-Fundy Region:Department of Fisheries and Oceans,Scotia-Fundy Region,Biological Sciences Branch,1993.
[10] LANGTON R W,ROBINSON W E.Faunal associations on scallop grounds in the western Gulf of Maine[J].Journal of Experimental Marine Biology and Ecology,1990,144(2/3):157-171.
[11] LANGTON R W,ROBINSON W E,SCHICK D.Fecundity and reproductive effort of sea scallops Placopecten magellanicus from the Gulf of Maine[J].Marine Ecology Progress Series,1987,37:19-25.
[12] NAIDU K S,ANDERSON J T.Aspects of scallop recruitment on St.Pierre Bank in relation to oceanography and implications for resource management[C].Research document.Nova Scotia:Canadian Atlantic of Fisheries Scientific Advisory Committee,1984,84(29):9.
[13] POSGAY J A,NORMAN K D.An observation on the spawning of the sea scallop,Placopecten magellanicus (Gmelin),on Georges Bank[J].Limnology and Oceanography,1958,3(4):478.
[14] POSGAY J A.Investigations of the sea scallop,Pecten grandis[M]//Third report on investigations of the shellfisheries of Massachusetts.Massachusetts:Woods Hole Oceanographic Institution,1950:24-30.
[15] BENINGER P G.A qualitative and quantitative study of the reproductive cycle of the giant scallop,Placopecten magellanicus,in the Bay of Fundy (New Brunswick,Canada)[J].Canadian Journal of Zoology,1987,65(3):495-498.
[16] SCHMITZER A C,DUPAUL W D,KIRKLEY J E.Gametogenic cycle of sea scallops Placopecten magellanicus Gmelin 1791 in the mid-Atlantic bight[J].Journal of Shellfish Research,1991,10(1):221-228.
[17] PAON L A,KENCHINGTON L R.Changes in somatic and reproductive tissues during artificial conditioning of the sea scallop,Placopecten magellanicus (Gmelin,1791)[J].Journal of Shellfish Research,1995,14(1):53-58.
[18] CULLINEY J L.Larval development of the giant scallop Placopecten magellanicus (Gmelin)[J].The Biological Bulletin,1974,147(2):321-332.
[19] FOURNIER R,MARSOT P. closerie expérimentale de larves du pétonclegéant (Placopectenma gellanicus)[R].Québec:Colloque sur l’aquiculture,Conseil des Productions Animales du Québec,1986:163-166.
closerie expérimentale de larves du pétonclegéant (Placopectenma gellanicus)[R].Québec:Colloque sur l’aquiculture,Conseil des Productions Animales du Québec,1986:163-166.
[20] COUTURIER C,AIKEN D E.Possible role of photoperiod in sea scallop reproduction[C]//Aquaculture association of Canada symposium,proceedings of the annual meeting.Canada:Aquaculture Association of Canada,1989:65-67.
[21] MASON J,SHUMWAY S,SANDIFER P.An international compendium of scallop biology and culture:a tribute to James Mason[C].Baton Rouge:World Aquaculture Society,1991.
[22] DADSWELL M J,CHANDLER R A,PARSONS G J.Spat settlement and early growth of Placopectenma gellanicus in Passamaquoddy Bay,Canada[J].Journal of Shellfish Research,1988,7:153-154.
[23] DADSWELL M J.A review of the status of sea scallop (Placopectenma gellanicus) aquaculture in Atlantic Canada in the year 2000[J].Aquaculture Association of Canada Special Publication,2001,4:72-75.
[24] PARSONS G J.Reproduction and recruitment of the giant scallop Placopectenma gellanicus and its relationship to environmental variables[M].Guelph,Ontario,Canada:University of Guelph,1994.
[25] LANTEIGNE M,DAVIDSON L A,ANDREWS J.Collecting juvenile sea scallops (Placopectenma gellanicus) with artificial collectors,in Port au Port Bay,Newfoundland (Canada)[J].Journal of Shellfish,1991,10: 297.
[26] DADSWELL M J,PARSONS G J.Potential for aquaculture of sea scallop,Placopectenma gellanicus (Gmelin,1791) in the Canadian Maritimes using naturally produced spat[C]//An international compendium of scallop biology and culture:a tribute to James Mason.Baton Rouge:World Aquaculture Workshops,1991:300-307.
[27] HARVEY M,BOURGET E,GAGN N.Spat settlement of the giant scallop,Placopecten magellanicus (Gmelin,1791),and other bivalve species on artificial filamentous collectors coated with chitinous material[J].Aquaculture,1997,148(4):277-298.
N.Spat settlement of the giant scallop,Placopecten magellanicus (Gmelin,1791),and other bivalve species on artificial filamentous collectors coated with chitinous material[J].Aquaculture,1997,148(4):277-298.
[28] NAIDU K S,CAHILL F M,LEWIS D B.Relative efficacy of two artificial substrates in the collection of sea scallop (Placopecten magellanicus) spat[J].Journal of the World Mariculture Society,2009,12(2):163-171.
[29] DAVIDSON L A,NILES M,L G
G RE L.Proceedings of the southern gulf scallop fishery workshop:Moncton,New Brunswick,March 30-31,2006[C]//Canadian Technical Report of Fisheries and Aquatic Sciences.Canada: Department of Fisheries and Oceans Canada,2007.
RE L.Proceedings of the southern gulf scallop fishery workshop:Moncton,New Brunswick,March 30-31,2006[C]//Canadian Technical Report of Fisheries and Aquatic Sciences.Canada: Department of Fisheries and Oceans Canada,2007.
[30] CLICHE G,VIGNEAU S,GIGU RE M.Status of a commercial sea scallop enhancement project in Iles-de-la-Madeleine (Quebec,Canada) [J].Aquaculture International,1997,5(3):259-266.
RE M.Status of a commercial sea scallop enhancement project in Iles-de-la-Madeleine (Quebec,Canada) [J].Aquaculture International,1997,5(3):259-266.
[31] GOUDEY C,SMOLOWITZ R J.Open-ocean culture of sea scallops off New England[C]//Proceedings of an International Conference.New Hampshire:University of New Hampshire/University of Maine Sea Grant College Program,1996:179-191.
[32] DAVIDSON L A.Proceedings of the scallop aquaculture workshop:Halifax,Nova Scotia,January 24,2004[C]//Canadian technical report of fisheries and aquatic sciences.Canada: Department of Fisheries and Oceans Canada,2005.
[33] MCLACHLAN J.Aquaculture in shallow seas:progress in shallow sea culture[J].Phycologia,1979,18(2):172-173.
[34] STOKESBURY K D E,HIMMELMAN J H.Biological and physical variables associated with aggregations of the giant scallop Placopecten magellanicus[J].Canadian Journal of Fisheries and Aquatic Sciences,1995,52(4):743-753.
[35] BELVIN S,TREMBLAY R,ROUSSY M,et al.Inoculation experiments to understand mass mortalities in sea scallop,Placopecten magellanicus[J].Journal of Shellfish Research,2008,27(2):251-260.
[36] WILDISH D J.Biological and economic feasibility of four grow-out methods for the culture of giant scallops in the Bay of Fundy[C]//Canadian technical report of fisheries and aquatic sciences.Canada: Department of Fisheries and Oceans Canada,1988.
[37] MACDONALD B A.Production and resource partitioning in the giant scallop Placopecten magellanicus grown on the bottom and in suspended culture[J].Marine Ecology Progress Series,1986,34:79-86.
[38] GRANT J,EMERSON C W,MALLET A,et al.Growth advantages of ear hanging compared to cage culture for sea scallops,Placopecten magellanicus[J].Aquaculture,2003,217(1/2/3/4):301-323.
[39] WILDISH D J,KRISTMANSON D D,HOAR R L,et al.Giant scallop feeding and growth responses to flow[J].Journal of Experimental Marine Biology and Ecology,1987,113(3):207-220.
[40] CROPP D A,HORTLE M E.Midwater cage culture of the commercial scallop Pecten fumatus Reeve 1852 in Tasmania[J].Aquaculture,1992,102(1/2):55-64.
[41] SHUMWAY S.Scallops:biology,ecology,aquaculture,and fisheries[M].Amsterdam:Elsevier,1991.
[42] FRENETTE B.Environmental factors influencing the growth and survival of juvenile sea scallops,Placopecten magellanicus (Gmelin,1791)[D].Newfoundland:Memorial University of Newfoundland,2004.
[43] DICKIE L M.Effects of high temperature on survival of the giant scallop[J].Journal of the Fisheries Research Board of Canada,1958,15(6):1189-1211.
[44] SHUMWAY S E.Food resources related to habitat in the scallop,Placopecten magellanicus (Gmelin 1791):a qualitative study[J].Journal of Shellfish Research,1987,6(2):89-95.
[45] PERNET F,BRICELJ V M,PARRISH C C.Effect of varying dietary levels of ω6 polyunsaturated fatty acids during the early ontogeny of the sea scallop,Placopecten magellanicus[J].Journal of Experimental Marine Biology and Ecology,2005,327(2):115-133.
[46] MARSHALL C T,LEE K.Uptake of dissolved glycine by sea scallop (Placopecten magellanicus (Gmelin,1791)) larvae[C]//An international compendium of scallop biology and culture:a tribute to James Mason.Baton Rouge:World Aquaculture Society,1991: 60-66.
[47] GOUDA R,KENCHINGTON E,HATCHER B,et al.Effects of locally-isolated micro-phytoplankton diets on growth and survival of sea scallop (Placopecten magellanicus) larvae[J].Aquaculture,2006,259(1/2/3/4):169-180.
[48] CRANFORD P J,GRANT J.Particle clearance and absorption of phytoplankton and detritus by the sea scallop Placopecten magellanicus (Gmelin)[J].Journal of Experimental Marine Biology and Ecology,1990,137(2):105-121.
[49] BARBEAU M A,SCHEIBLING R E,HATCHER B G.Behavioural responses of predatory crabs and sea stars to varying density of juvenile sea scallops[J].Aquaculture,1998,169(1/2):87-98.
[50] BARBEAU M A,SCHEIBLING R E.Behavioral mechanisms of prey size selection by sea stars (Asterias vulgaris Verrill) and crabs (Cancer irroratus Say) preying on juvenile sea scallops (Placopecten magellanicus (Gmelin))[J].Journal of Experimental Marine Biology and Ecology,1994,180(1):103-136.
[51] WONG M C,BARBEAU M A,HENNIGAR A W,et al.Protective refuges for seeded juvenile scallops (Placopecten magellanicus) from sea star (Asterias spp.) and crab (Cancer irroratus and Carcinus maenas) predation[J].Canadian Journal of Fisheries and Aquatic Sciences,2005,62(8):1766-1781.
[52] XIANG J H,DESROSIERS R R,DUB F.Studies on the chromosomes of the giant scallop Placopecten magellanicus (Gmelin) and the surf clam Spisula solidissima (Dillwyn)[J].Cytologia,1993,58(2):125-132.
F.Studies on the chromosomes of the giant scallop Placopecten magellanicus (Gmelin) and the surf clam Spisula solidissima (Dillwyn)[J].Cytologia,1993,58(2):125-132.
[53] PATWARY M U,KENCHINGTON E,BIRD C J,et al.The use of random amplified polymorphic DNA markers in genetic studies of the sea scallop Placopecten magellanicus (Gmelin,1791)[J].Journal of Shellfish Research,1994,13(2):547-553.
[54] RICE E L.Nucleotide sequence of the 18S ribosomal RNA gene from the Atlantic sea scallop Placopecten magellanicus (Gmelin,1791)[J].Nucleic Acids Research,1990,18(18):5551.
[55] SNYDER M,FRASER A R,LAROCHE J,et al.Atypical mitochondrial DNA from the deep-sea scallop Placopecten magellanicus[J].Proceedings of the National Academy of Sciences,1987,84(21):7595-7599.
[56] VAN WYNGAARDEN M,SNELGROVE P V R,DIBACCO C,et al.Identifying patterns of dispersal,connectivity and selection in the sea scallop,Placopecten magellanicus,using RADseq-derived SNPs[J].Evolutionary Applications,2016,10(1):102-117.
[57] KENCHINGTON E L,PATWARY M U,ZOUROS E,et al.Genetic differentiation in relation to marine landscape in a broadcast-spawning bivalve mollusc (Placopecten magellanicus)[J].Molecular Ecology,2006,15(7):1781-1796.
[58] 秦艳杰,李霞,周伯文,等.利用AFLP技术分析海扇贝与三种扇贝的亲缘关系[J].东北农业大学学报,2009,40(10):69-74.
QIN Y J,LI X,ZHOU B W,et al.Genetic relationship of Placopecten magellanicus and three scallop species by AFLP[J].Journal of Northeast Agricultural University,2009,40(10):69-74.(in Chinese)
[59] DICKIE L M,MEDCOF J C.Causes of mass mortalities of scallops (Placopecten magellanicus) in the southwestern gulf of St.Lawrence[J].Journal of the Fisheries Research Board of Canada,1963,20(2):451-482.
[60] 周永灿.海洋贝类病害及其研究进展[J].海南大学学报(自然科学版),2000,18(2):207-212.
ZHOU Y C.Marine shellfish diseases and research progress[J].Journal of Hainan University(Natural Science Edition),2000,18(2):207-212.(in Chinese)
[61] GULKA G,CHANG P W,MARTI K A.Prokaryotic infection associated with a mass mortality of the sea scallop,Placopecten magellanicus[J].Journal of Fish Diseases,1983,6(4):355-364.
[62] INGLIS S D,KRISTMUNDSSON  ,FREEMAN M A,et al.Gray meat in the Atlantic sea scallop,Placopecten magellanicus,and the identification of a known pathogenic scallop api complexan[J].Journal of Invertebrate Pathology,2016,141:66-75.
,FREEMAN M A,et al.Gray meat in the Atlantic sea scallop,Placopecten magellanicus,and the identification of a known pathogenic scallop api complexan[J].Journal of Invertebrate Pathology,2016,141:66-75.
[63] BERGMAN K M,ELNER R W,RISK M J.The influence of Polydora websteri borings on the strength of the shell of the sea scallop,Placopecten magellanicus[J].Canadian Journal of Zoology,1982,60(11):2551-2556.
[64] DIJKSTRA J,NOLAN R.Potential of the invasive colonial ascidian,Didemnum vexillum,to limit escape response of the sea scallop,Placopecten magellanicus[J].Aquatic Invasions,2011,6(4):451-456.
[65] BULLARD G,LAMBERT G,CARMAN M,et al.The colonial ascidian Didemnum sp.A:current distribution,basic biology and potential threat to marine communities of the northeast and west coasts of North America[J].Journal of Experimental Marine Biology and Ecology,2007,342(1):99-108.