近年来,人们生活质量的改善及老龄化程度加深等原因,导致中国糖尿病的患病率逐年上升。其中,Ⅱ型糖尿病(T2DM)为主要的发病类型,占中国糖尿病患者人数的95% 以上,并逐渐成为现代社会的常见慢性病之一。糖尿病与糖尿病引起的一系列并发症对人类的健康造成了一定的威胁,Ⅱ型糖尿病的病因主要是胰岛β细胞的功能出现障碍, 降低了靶细胞对胰岛素(insulin,INS)的敏感性,从而影响其对血糖的调节。高血糖状态会导致胰岛β细胞对血糖的感知能力和反应出现大幅度的降低。除此之外,总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)储存量高于正常值时, 会导致细胞出现脂性凋亡[1]。有研究表明,PI3K/AKT信号通路是胰岛素信号转导的重要通路,与血糖的调节息息相关[2]。
岩藻黄素(fucoxanthin),又称为岩藻黄质,其分子结构较为特殊,是一种含丙二烯类结构的叶黄素。岩藻黄素在有机溶剂中溶解度良好,不溶于水,主要存在于褐藻中[3]。研究表明,口服岩藻黄素对小鼠无毒性和致突变性,且具有抗氧化、抗肿瘤、抗炎和降血糖等多种生物活性,因此,备受学术界的关注[4]。Najme等[5]研究表明,岩藻黄素能够显著降低BALB/c小鼠血浆和肝脏中的TG和TC浓度,并能提高血浆胰岛素水平,对Ⅱ型糖尿病小鼠有显著的缓解作用。有学者发现,岩藻黄素不仅可减轻高脂饮食诱导的C57BL/6肥胖小鼠的胰岛素抵抗[6],同时还可降低糖尿病小鼠的体质量,并改变其肝脏胆固醇代谢、游离脂肪酸的生成和脂质吸收[7]。
铜藻(Sargassum horneri)隶属于褐藻门(Phaeophyta)马尾藻属(Sargassum),主要分布于西北太平洋沿岸,在中国的分布区从广东省东北至浙江省东南、山东半岛及辽东半岛沿海,其中,黄渤海地区的铜藻属于马尾藻属铜藻种[8]。海水富含养分且水温适合铜藻繁衍,导致铜藻产量不断增加。目前,铜藻多为野生种,对其研究主要集中在资源调查及其形态学、生活史和养殖技术等方面[9],而对其含有的生物活性物质的深入研究却鲜有报道。有研究表明,用超声辅助提取不同藻类中的岩藻黄素时,铜藻、海带和裙带菜中的岩藻黄素分别为1.46、0.35、1.362 mg/g [10],可见铜藻中的岩藻黄素含量较高,故具有较好的经济利用价值。本研究中,以辽宁省大连海域采集的野生铜藻为原料,提取分离岩藻黄素,研究了铜藻岩藻黄素体外对α-葡萄糖苷酶的抑制作用及其抑制作用类型,以及体内对Ⅱ型糖尿病小鼠的血糖调节作用,分析评价岩藻黄素调节血糖的能力,以期为铜藻岩藻黄素的综合利用提供科学参考。
1 材料与方法
1.1 材料
原料:SPF级C57BL/6雄性小鼠,体质量为(20±2)g,购自辽宁长生生物技术股份有限公司(许可证号SCXK(辽)2020-0001);基础饲料购自辽宁长生生物技术股份有限公司,高脂高糖饲料按猪油10%、蔗糖15%、蛋黄粉3%、胆固醇2%、猪胆盐0.5%和基础饲料69.5%(均为质量分数)的比例混合制备;铜藻于辽宁省大连市黑石礁周边海域采集。
试剂:对硝基苯基-β-D-吡喃半乳糖苷(P-nitrophenyl-β-D-galactopyranoside,PNPG)购自上海阿拉丁生化科技股份有限公司;链脲佐菌素购自美国Sigma-Aldrich公司;α-葡萄糖苷酶、二甲双胍购自北京索莱宝科技有限公司;胰岛素酶联免疫吸附测定(ELISA)试剂盒购自北京索莱宝科技有限公司;胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)ELISA试剂盒购自南京建成科技有限公司;RNA提取试剂盒(SteadyPure Universal RNA Extraction Kit)、反转录试剂盒(Evo M-MLV RT Premix for qPCR)、荧光定量PCR试剂盒(SYBR Green Premix Pro Taq HS qPCR Kit)购自湖南艾科瑞生物工程有限公司;其他试剂均为分析纯。
主要仪器设备:Synergy H1型全光谱吸收光酶标仪(Bio-Tek公司,美国)、DMI3000 B型光学倒置显微镜(Leica公司,德国)、TC-512型梯度PCR仪(Techne公司,英国)、Light Cycler 96型实时荧光定量PCR仪(Roche公司,瑞士)、Nano Drop 2000型超微量分光光度计(Thermo Fisher Scientific公司,美国)。
1.2 方法
1.2.1 铜藻中岩藻黄素的分离提取 将新鲜的铜藻洗净后捣碎,加入无水甲醇进行匀浆,暗处浸提2 h,抽滤后收集浸提液。在浸提液中加入无水硫酸钠进行脱水,30~40 ℃下减压浓缩,得到铜藻类胡萝卜素的粗提物。以层析硅胶柱对粗提物进行分离,分别用丙酮和石油醚(体积比为90∶10、80∶20、70∶30、60∶40)的混合洗脱液进行梯度洗脱,收集不同颜色的洗脱物,40 ℃下浓缩至干,用少量丙酮溶解,以薄层色谱确定岩藻黄素组分,于-18 ℃下避光保存。采用分光光度法测定铜藻中岩藻黄素含量,其提取率为(1.05±0.12)mg/g(干质量)。
利用高效液相色谱测定从铜藻中提取的岩藻黄素纯度。色谱条件:Agilent ZORBAX SB-C18色谱柱,粒径为5 μm,4.6 mm×150 mm;流动相A为甲醇和水(二者的体积比为90∶10),流动相B为乙酸乙酯。线性梯度洗脱条件:0 min,100%A+0%B,流速为0.5 mL/min;10 min,80%A+20%B,流速为0.5 mL/min;14 min,50%A+50%B,流速为0.5 mL/min;25 min,40%A+60%B,流速为0.5 mL/min。柱温为30 ℃,检测波长为450 nm,进样量为5 μL。经高效液相色谱分析,分离得到的铜藻岩藻黄素纯度为90.78%±2.43%。
1.2.2 岩藻黄素对α-葡萄糖苷酶活性的抑制作用
1)岩藻黄素对α-葡萄糖苷酶活性的抑制。将PNPG与α-葡萄糖苷酶分别溶于浓度为0.2 mol/L的磷酸盐缓冲液(pH 6.8)中,配制成5 mmol/L的PNPG和 1 U/mL 的α-葡萄糖苷酶,保存备用。分别配制浓度为20、40、60、80、100 μg/mL的岩藻黄素和二甲基亚砜,每个浓度取50 μL,加入100 μL α-葡萄糖苷酶溶液于96孔板中充分混合,25 ℃条件下孵育10 min后,再加入50 μL的PNPG溶液,25 ℃ 条件下继续反应5 min,终止反应。在405 nm处读取吸光值,计算α-葡萄糖苷酶的抑制率(%)[11],计算公式为
α-葡萄糖苷酶抑制率=[A0-(A1-A2)]/
A0×100%。
(1)
其中: A0为二甲基亚砜代替岩藻黄素样品溶液后的吸光度;A1为样品组的吸光度;A2为磷酸缓冲液代替α-葡萄糖苷酶溶液后的吸光度。
2)岩藻黄素对α-葡萄糖苷酶的抑制类型。按照上述方法,配制质量浓度为4、6、8、10 μg/mL的岩藻黄素,从每个浓度取50 μL,加入100 μL α-葡萄糖苷酶,25 ℃条件下孵育10 min后,分别加入50 μL浓度为1、3、5 mmol/mL的PNPG,继续反应5 min,测定405 nm处的吸光度。依据酶促反应动力学公式,以底物浓度倒数(1/[S])为横坐标, 反应速率倒数(1/v)为纵坐标, 用Lineweaver-Burk双倒数作图法判断岩藻黄素对α-葡萄糖苷酶的抑制类型。
1/v=(Km+[S])/(vm×[S])。
(2)
其中:v为反应速率;Km为米氏常数;[S]为底物浓度;vm为最大反应速率。
1.2.3 动物试验 60只C57BL/6小鼠在温度为23~28 ℃、相对湿度为40%~60%的条件下适应性喂养一周。随机选取10只小鼠作为空白组(NC),喂食普通饲料,其余小鼠随机分为阳性对照组(PC)、模型组(MC)、岩藻黄素低剂量组(LD)、岩藻黄素中剂量组(MD)和岩藻黄素高剂量组(HD),每组均为10只,喂食高脂饲料。两周后采用质量分数为1%的链脲佐菌素(streptozotocin,STZ)溶液(pH 4.2)对高脂饲料组小鼠进行腹腔注射,当空腹血糖值( fasting blood glucose,FBG)≥16.7 mmol/L时表示建模成功。
试验期间小鼠自由饮食和饮水,每天同一时间灌胃样品,其中,空白组和模型组灌胃质量分数为0.2%的甲基纤维素钠溶液,阳性对照组灌胃二甲双胍40 mg/kg体质量,根据预试验结果设置岩藻黄素低、中、高剂量组,分别灌胃岩藻黄素25、50、100 mg/kg体质量,每日一次,持续8周。试验结束后小鼠禁食12 h,摘眼球取血,采集的血样在4 ℃条件下过夜静置,取上层血清用于血清指标的测定。采血后牺牲小鼠,并迅速剥离其肝脏,部分用于病理学观察,部分用于RNA的提取。
1.2.4 空腹血糖和口服糖耐量试验 灌胃8周后,小鼠隔夜断食不断水12 h,用血糖仪测定小鼠空腹血糖值,并灌胃2 g/kg的葡萄糖溶液,分别在灌胃后的0、15、30、60、120 min时从小鼠尾部静脉采血,测定小鼠血糖值,绘制口服葡萄糖耐量曲线,并计算血糖浓度-时间曲线下面积(area under the cure,AUC,mmol·min/L),计算公式为
AUC=7.5×(C1+2C2+3C3+6C4+4C5)。
(3)
其中:C1、C2、C3、C4、C5分别为0、15、30、60、120 min时的血糖浓度(mmol/L)。
1.2.5 血清相关指标检测 用试剂盒检测血清中的胰岛素、胆固醇、甘油三酯、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇含量。
1.2.6 肝脏组织观察 取小鼠肝右叶组织,用体积分数为10%的中性甲醛溶液固定,乙醇脱水后进行石蜡包埋并切片,用苏木精-伊红(Hematoxylin-Eosin,HE)染色,在显微镜下进行病理学观察。
1.2.7 基因mRNA表达检测 称取10 mg小鼠肝脏样品置于液氮中研磨至粉末状,采用RNA试剂盒提取肝脏总RNA,采用超微量分光光度计测定RNA的纯度,通过反转录试剂盒对提取的总RNA进行反转录。荧光定量PCR引物序列如表1所示,以GAPDH为内参基因,将空白组定为1个单位,测定磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,AKT)、糖原合成酶(glycogen synthase,GS)和葡萄糖转运蛋白4(glucose transporter 4,GLUT4)基因的mRNA相对表达量。PCR反应体系(20 μL):2×SYBRGreen Pro Taq HS Premix 10 μL,上、下游引物各0.4 μL,ROX Reference Dye 0.4 μL,用ddH2O补足至20 μL。反应条件:95 ℃下预变性30 s;95 ℃下变性5 s,60 ℃下退火30 s,共进行40个循环。采用2-ΔΔCt法计算各组基因的相对表达量。
表1 试验引物
Tab.1 Primers used in the experiment

引物primer序列 (5'-3')sequence (5'-3')AktF:CTTCCTCCTCAAGAACGATGGR:TTGTGCCACTGAGAAGTTGTTPI3KF:AAGGCAGGAGTCATTGAGTTATR:AGAAGATGGCTTGGATGGAATGSF:AAGTCCAAGCCATGTATATCTGR:GTTCCACTCAGGTAACTCTTCGLUT4F:CTTCTTCATCTTCACCTTCCTAAR:GCCCTAAGTATTCAAGTTCTGTAGAPDHF:TGTGTCCGTCGTGGATCTGAR:TTGCTGTTGAAGTCGCAGGAG
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 22.0软件进行单因素方差分析,用Duncan法进行组间多重比较。显著性水平设为0.05。
2 结果与分析
2.1 岩藻黄素对α-葡萄糖苷酶活性的影响
2.1.1 岩藻黄素对α-葡萄糖苷酶活性的抑制 从图1可见:随着岩藻黄素质量浓度的逐渐升高,其对α-葡萄糖苷酶活性的抑制也逐渐增强;质量浓度高于60 μg/mL的各组与20、40 μg/mL低质量浓度组相比,具有显著性差异(P<0.05),但质量浓度高于60 μg/mL后抑制率趋于平稳(P>0.05);当岩藻黄素浓度为80 μg/mL时,抑制率达到最大值,为76.43%±0.83%。这表明,岩藻黄素浓度显著影响其对α-葡萄糖苷酶的抑制效果。
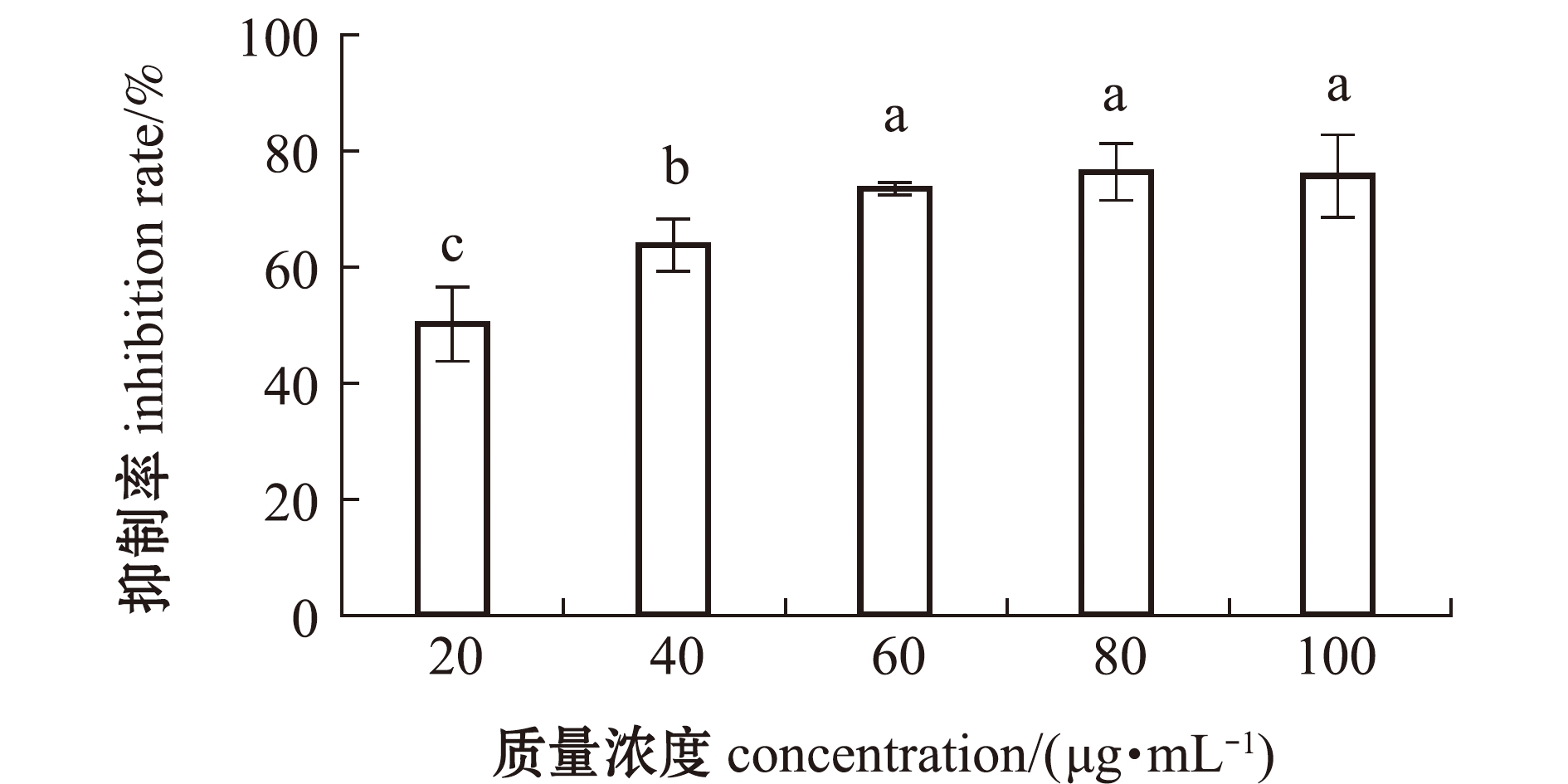
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences,et sequentia.
图1 岩藻黄素对α-葡萄糖苷酶活性的抑制作用
Fig.1 Inhibition of fucoxanthin on α-glucosidase activity
2.1.2 岩藻黄素对α-葡萄糖苷酶的抑制类型 从图2可见,随着岩藻黄素质量浓度的增加,横截距-1/Km基本不变,而纵截距1/vm逐渐变小,说明岩藻黄素是通过与α-葡萄糖苷酶的非活性部位结合来抑制其活性的。由此可知,岩藻黄素对α-葡萄糖苷酶的抑制类型属于非竞争性抑制。

图2 岩藻黄素对α-葡萄糖苷酶的双倒数曲线
Fig.2 Double reciprocal curve for α-glucosidase inhibition by fucoxanthin
2.2 岩藻黄素对糖尿病小鼠血糖和血脂代谢的影响
2.2.1 对血糖指标的影响 摄入葡萄糖后,各组血糖浓度在15 min或30 min时达到峰值,在60 min时出现显著下降,120 min后模型组的血糖浓度明显高于其他组(图3)。从表2和图4可见:模型组空腹血糖值和AUC较空白组均显著升高(P<0.05),说明糖尿病模型小鼠血糖代谢异常;经过8周的岩藻黄素喂养后,各岩藻黄素剂量组的空腹血糖值和AUC较模型组均有显著下降(P<0.05),且各剂量组的AUC与阳性对照组无显著性差异(P>0.05)。这表明,岩藻黄素可以提高糖尿病小鼠的糖耐受能力,具有良好的降血糖潜力。
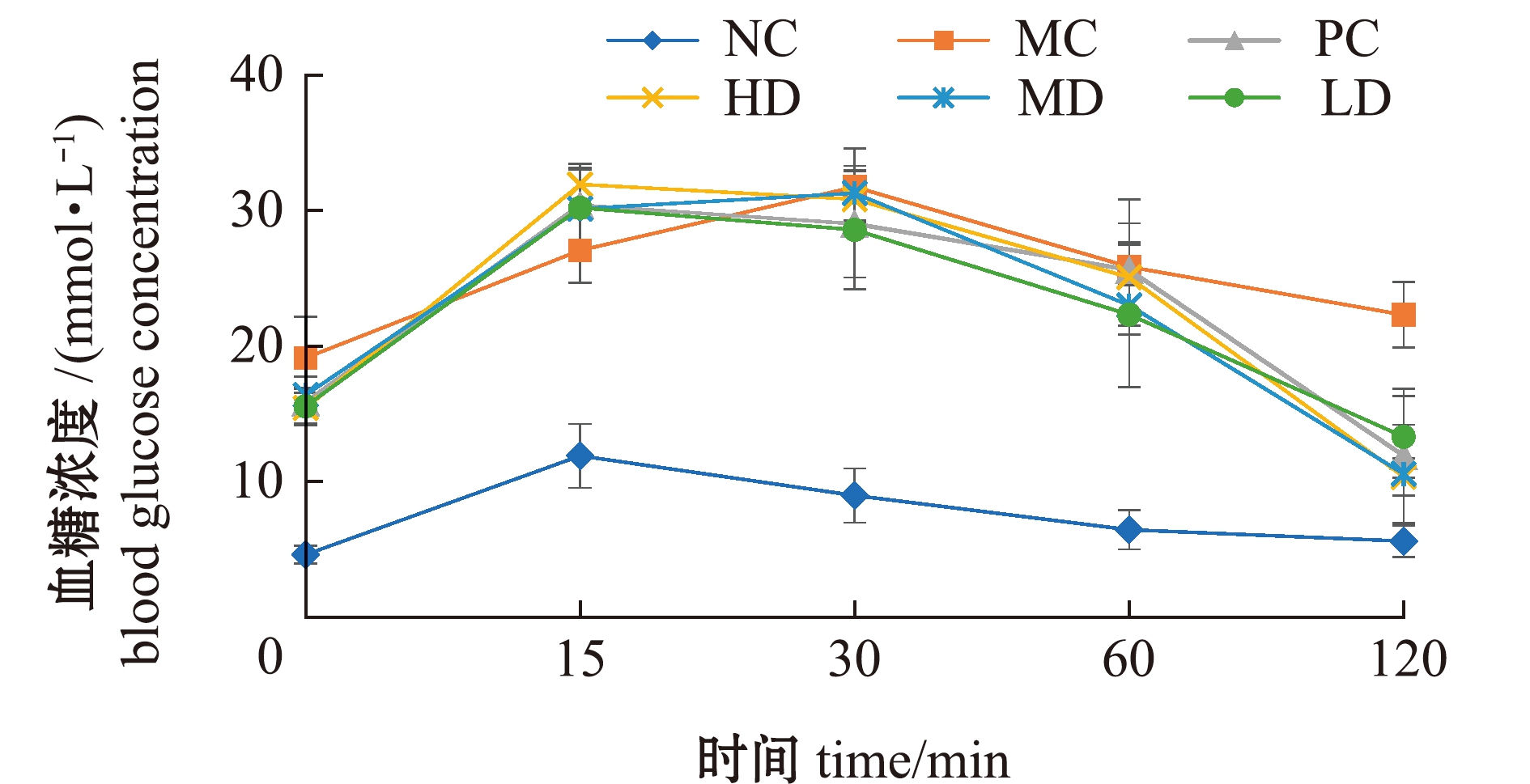
图3 岩藻黄素对糖尿病小鼠口服糖耐量的影响
Fig.3 Effects of fucoxanthin on oral glucose tolerance in diabetic mice
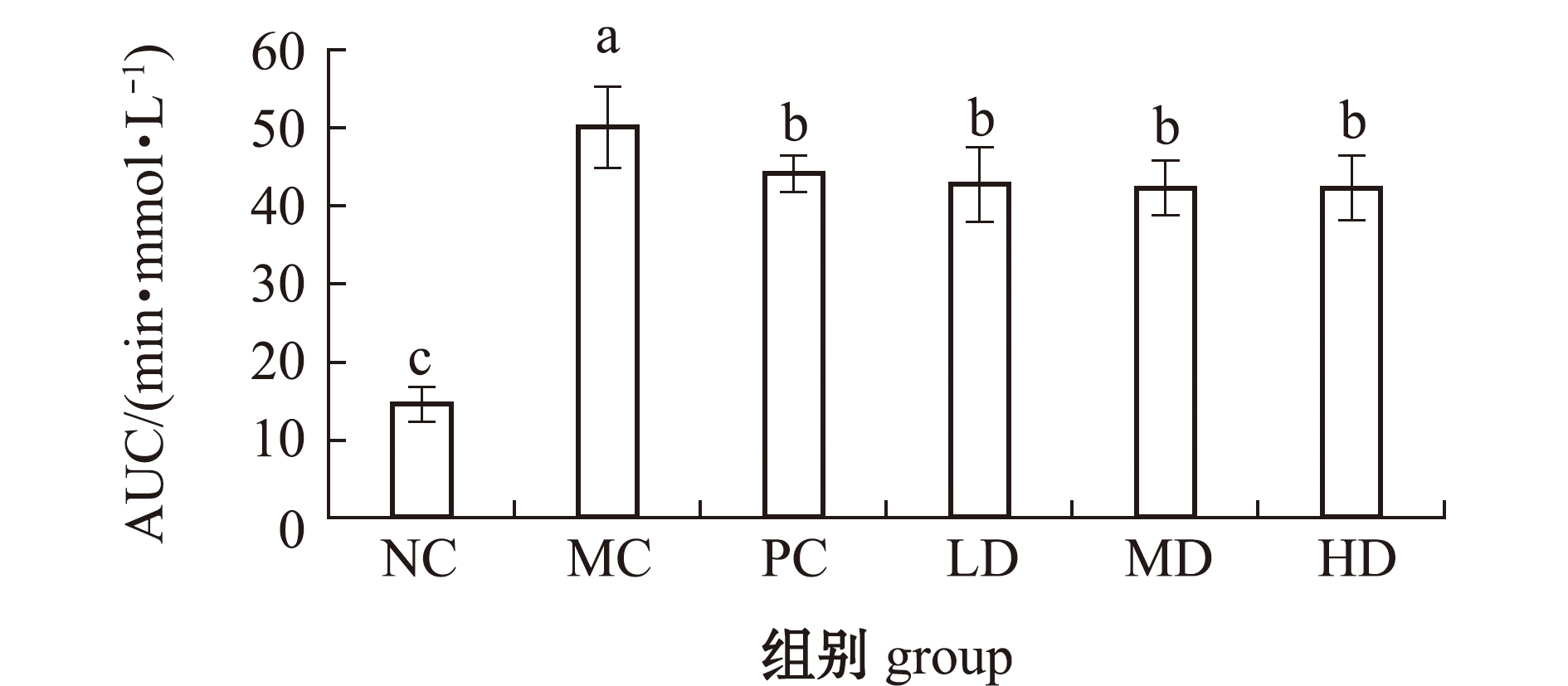
图4 小鼠血糖浓度-时间曲线下面积
Fig.4 AUC of blood glucose in mice
从表2可见:模型组小鼠的胰岛素水平显著高于空白组 (P<0.05),肝糖原水平显著低于空白组(P<0.05),说明糖尿病小鼠体内血糖调节异常;与模型组相比,阳性对照组显示出良好的降低胰岛素水平(P<0.05)及提升肝糖原含量(P<0.05)的作用;与模型组相比,各岩藻黄素剂量组的胰岛素水平显著下降(P<0.05),中、高剂量组肝糖原水平显著提升(P<0.05),且高剂量组效果优于阳性对照组。这表明,岩藻黄素可明显改善小鼠体内的糖代谢紊乱,且具有一定的剂量-效应关系。
表2 各组小鼠血糖类相关指标水平(n=10)
Tab.2 Blood glucose-related index levels of mice in each group(n=10)

注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note: The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences,et sequentia.
组别group剂量/(mg·kg-1)dose空腹血糖值/(mmol·L-1)fast blood glucose胰岛素/(mU·L-1)insulin肝糖原/(mg·g-1) hepatic glycogen空白NC—4.64±0.60c6.96±0.21b9.63±2.20ab模型组MC—22.28±2.43a9.80±0.69a4.71±0.13c阳性对照PC10011.88±4.97b6.68±1.09b8.79±0.07ab低剂量组LD2513.28±3.02ab7.89±1.38b3.18±0.02c中剂量组MD5010.54±3.64b7.24±1.61b9.62±1.51ab高剂量组HD10010.33±1.37b6.44±0.42b11.81±2.92a
2.2.2 对血脂代谢指标的影响 从表3可见:与空白组相比,模型组的HDL-C含量显著降低(P<0.05),LDL-C含量显著升高(P<0.05);经药物干预后,阳性对照组和岩藻黄素剂量组HDL-C含量均较模型组显著上调(P<0.05),LDL-C含量显著下降 (P<0.05),且高剂量组对血脂各指标的调节作用优于阳性对照组。这表明,岩藻黄素具有较好的调节脂质代谢的作用。
从表3还可见:模型组TC和TG含量较空白组显著增加(P<0.05),说明糖尿病小鼠体内发生脂代谢紊乱;经岩藻黄素干预后,岩藻黄素低、中、高剂量组的TC、TG含量较模型组逐渐降低,并趋近空白组,且中、高剂量岩藻黄素调节TC的能力优于阳性对照组。这表明,岩藻黄素对糖尿病小鼠的血脂代谢有着积极的影响且具有剂量效应关系。
表3 各组小鼠血脂类相关指标水平(n=10)
Tab.3 Blood lipid-related index levels of mice in each group(n=10)
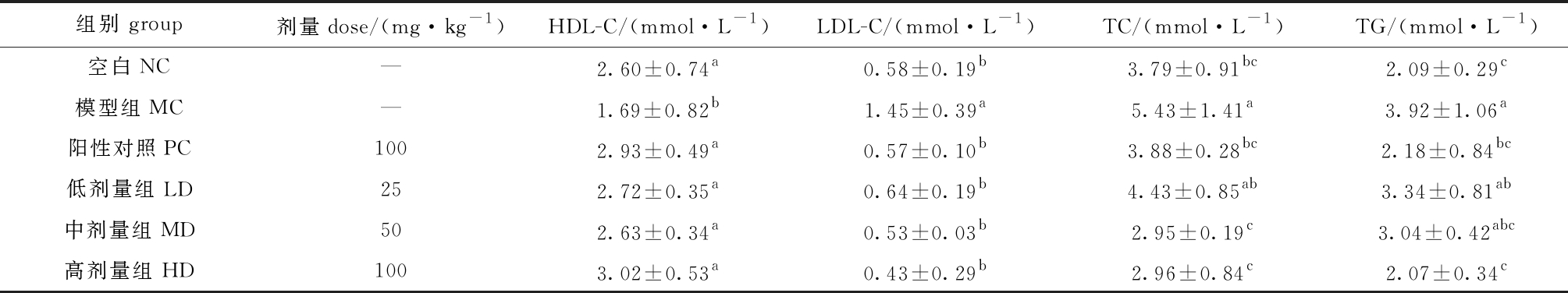
组别 group剂量dose/(mg·kg-1) HDL-C/(mmol·L-1)LDL-C/(mmol·L-1)TC/(mmol·L-1)TG/(mmol·L-1)空白NC—2.60±0.74a0.58±0.19b3.79±0.91bc2.09±0.29c模型组MC—1.69±0.82b1.45±0.39a5.43±1.41a 3.92±1.06a阳性对照PC1002.93±0.49a0.57±0.10b3.88±0.28bc2.18±0.84bc低剂量组LD252.72±0.35a0.64±0.19b4.43±0.85ab3.34±0.81ab中剂量组MD502.63±0.34a0.53±0.03b2.95±0.19c3.04±0.42abc高剂量组HD1003.02±0.53a0.43±0.29b2.96±0.84c2.07±0.34c
2.3 岩藻黄素对小鼠肝脏组织细胞形态的影响
从图5可见:空白组小鼠的肝脏组织细胞结构清晰,排列规整,大小均一,细胞核形态正常;模型组小鼠肝脏细胞排列松散,形态肿胀且细胞核颜色较浅,细胞内部出现无法染色的异常颗粒,肝窦不清晰,有出血坏死现象,细胞质间隙可见大小不等空泡,肝脏组织受损严重,出现脂肪变性和炎性细胞浸润,表明建模成功;阳性对照组和岩藻黄素高剂量组小鼠的肝脏组织细胞结构得到明显的改善,细胞排列较模型组整齐,细胞肿胀与炎性细胞浸润得到改善,异常颗粒和坏死细胞明显减少,接近正常肝脏细胞组织形态。

A—空白组NC;B—模型组MC;C—阳性对照PC;D—低剂量组LD;E—中剂量组MD;F—高剂量组HD。A—negative control; B—model control; C—positive control; D—low dose group; E—medium dose group; F—high dose group.
图5 岩藻黄素对小鼠肝脏组织病理学的影响
Fig.5 Effects of fucoxanthin on histopathological change that occurred in mice
2.4 岩藻黄素对小鼠肝脏糖代谢相关基因表达量的影响
从图6可见:模型组小鼠肝脏组织PI3K和AKT mRNA相对表达量较空白组显著下降(P<0.05),阳性对照组较模型组显著上调了PI3K和AKT mRNA的水平(P<0.05);经岩藻黄素干预8周后,低、中、高剂量岩藻黄素组小鼠PI3K和AKT mRNA表达水平较模型组小鼠均有不同程度的上调(P<0.05),其中低、中剂量PI3K的表达量显著高于阳性对照组(P<0.05)。
模型组小鼠肝脏GLUT4 mRNA相对表达量较空白组小鼠显著降低(P<0.05),阳性对照组和各岩藻黄素剂量组GLUT4 mRNA相对表达量均明显上升(P<0.05),且岩藻黄素低、高剂量组GLUT4 mRNA表达水平与阳性对照组无显著性差异(P>0.05)(图6)。这表明,岩藻黄素可在一定程度上提升糖尿病小鼠GLUT4 mRNA的相对表达量。
模型组小鼠肝脏GS mRNA相对表达量较空白组显著下降(P<0.05),阳性对照组显著上调了GS mRNA表达量(P<0.05);与模型组相比,岩藻黄素高剂量组能显著提升GS mRNA表达量(P<0.05),而岩藻黄素高剂量组GS mRNA相对表达量与阳性对照组无显著性差异(P>0.05)(图6)。这表明,岩藻黄素可上调GS mRNA的相对表达量。
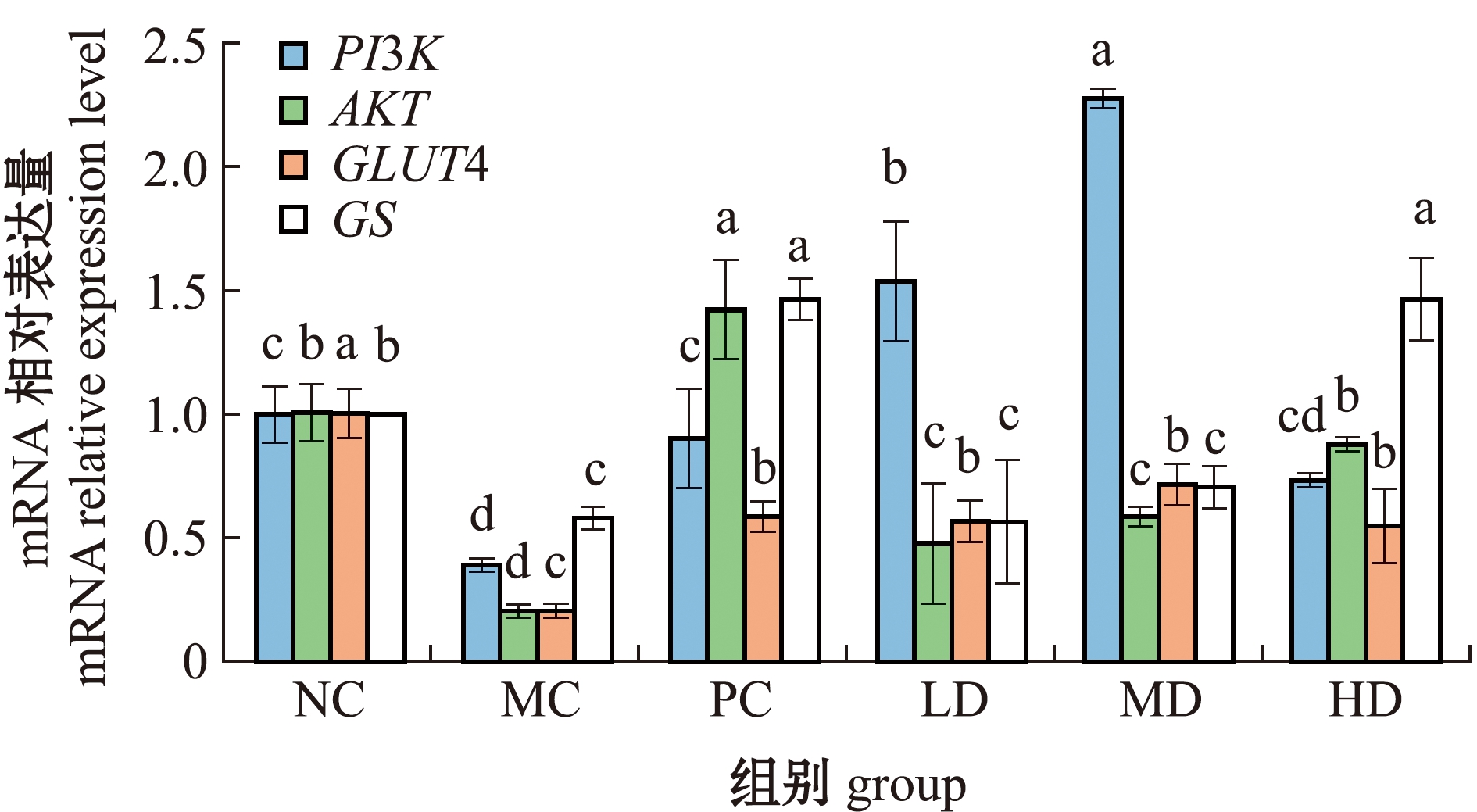
标有不同字母者表示同一基因不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。Note: The means with different letters in same gene are significant differences in different groups at the 0.05 probability level, and the means with the same letter are not significant differences.
图6 岩藻黄素对糖尿病小鼠肝脏糖代谢相关基因表达量的影响
Fig.6 Effects of fucoxanthin on the expression levels of glucose metabolism genes in liver of diabetic mice
3 讨论
3.1 岩藻黄素对α-葡萄糖苷酶的抑制作用
α-葡萄糖苷酶抑制剂可以潜在地抑制双糖和寡糖的分解及α-D葡萄糖的释放,导致小肠对葡萄糖的吸收延迟,有效减少餐后高血糖[12]。有研究表明,α-糖苷酶可将多糖和低聚糖水解成单糖并释放到血液中,提高机体的血糖值[13]。因此,Ⅱ型糖尿病的治疗方法之一是通过抑制α-糖苷酶来延迟碳水化合物的消化,以达到降低餐后血糖的效果。Zhu等[14]发现,迷迭香酸的羟基与α-糖苷酶的氨基酸相互作用,通过竞争性抑制降低α-糖苷酶与底物的结合,从而达到降低血糖的目的。Zaharudin等[15]发现,裙带菜中提取的岩藻黄素对α-葡萄糖苷酶的抑制率高达91.92%。本研究显示,岩藻黄素通过非竞争性对α-葡萄糖苷酶的抑制率可达76.43%。结果表明,岩藻黄素可通过降低α-葡萄糖苷酶催化效率的方式达到降低血糖的目的,且岩藻黄素的来源及纯度等因素也会影响其对α-葡萄糖苷酶的抑制效果。
3.2 岩藻黄素对糖尿病小鼠的降血糖作用
血糖值代表血清中的葡萄糖浓度,口服糖耐量反映胰岛β细胞功能及机体对血糖的调节能力。胰岛素是体内唯一有降血糖功效的蛋白质激素,因此,胰岛素的含量可直接影响小鼠体内血糖调节水平[16]。糖原是动物体内的葡萄糖储存体,其合成与分解能够为生物体提供能量,肝糖原的缺乏与胰岛素信号通路的紊乱有关[17],因此,肝脏组织内的肝糖原含量可以直观反映小鼠对胰岛素的敏感程度。研究表明,糖尿病是一种代谢紊乱,同时伴有不同程度的高血糖、脂质功能障碍和胰岛素抵抗。本试验中,高脂饮食结合STZ诱导的糖尿病模型小鼠表现出高血糖、糖耐量受损、INS含量增加及脂质代谢功能障碍。岩藻黄素干预8周后,与模型组相比,糖尿病小鼠空腹血糖值显著下降,肝糖原含量升高且糖耐受能力显著增加,这与仇菊等[18]研究的葡萄籽多酚对糖尿病大鼠的降血糖功效一致,进一步显示了岩藻黄素对血糖的调节能力。Muradian等[19]发现,硬脂酰辅酶A去饱和 酶-1(stearoyl-coenzyme A desaturase-1)可催化饱和脂肪酸生物合成单不饱和脂肪酸,岩藻黄素可降低其含量,从而增加糖尿病小鼠对胰岛素和瘦素的敏感性。本试验中发现,岩藻黄素各剂量组可有效降低小鼠的空腹血糖值、口服糖耐量和胰岛素水平,提升小鼠肝糖原水平,且具有一定的剂量-效应关系,其中,高剂量组效果优于阳性对照组。由此说明,岩藻黄素可以通过增加糖尿病小鼠体内肝糖原的合成和靶细胞对胰岛素的敏感性,来达到调节糖尿病小鼠血糖的效果。
3.3 岩藻黄素调节糖尿病小鼠血脂代谢及缓解其肝脏损伤的作用
HDL-C可运载组织中的胆固醇并将其转化为胆汁排出,其含量的增加可促进脂质代谢;而LDL-C主要是将胆固醇转运至肝外组织细胞[20],其含量升高将增加糖尿病的风险。TC和TG浓度的升高会导致脂代谢失调,是Ⅱ型糖尿病的并发症之一[21]。血脂水平异常是糖尿病的重要特征,脂质功能发生障碍尤其是脂肪细胞中TG的增加,可导致巨噬细胞分泌炎症细胞因子,炎症因子会干扰胰岛素受体信号通路,并进一步导致胰岛素抵抗[22]。肝脏合成的胆固醇分解为胆汁酸或以极低密度脂蛋白的形式分泌到血液中,然后转化为低密度脂蛋白[23]。本试验显示,灌胃岩藻黄素的糖尿病小鼠体内TC、LDL-C含量较模型组小鼠均有不同程度的降低,而HDL-C含量则增加,表明摄入岩藻黄素会促进胆固醇在肝脏分解代谢。有研究表明,B型Ⅰ类清道夫受体(scavenger receptor B type 1,SR-B1)和低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)可将低密度脂蛋白胆固醇转移到肝脏进行代谢,岩藻黄素以剂量依赖性的方式显著改善SR-B1的表达[24]。由此推测,岩藻黄素高剂量组中LDL-C含量低于空白组的原因,可能是由于高浓度岩藻黄素极大地增加了SR-B1或 LDLR 的含量所导致。有研究表明,磷脂酸磷酸水解酶是负责将磷脂酸转化为甘油三酯的主要酶,岩藻黄素可通过刺激β-氧化活性和抑制磷脂磷酸水解酶活性来减少肝脂滴的积累[5]。本试验显示,岩藻黄素各剂量组的TG水平较模型组降低且呈剂量效应,高剂量岩藻黄素调节TC的能力优于阳性对照组。因此,每天灌胃50~100 mg/kg的岩藻黄素可有效改善糖尿病小鼠的血脂代谢异常。
有研究发现,糖尿病会导致非酒精性脂肪肝的炎症、坏死或纤维化[25]。Rodriguez等[26]发现,STZ诱导的糖尿病大鼠肝脏结构广泛缺失,许多细胞内有凋亡细胞和脂滴,表明肝脏中有脂肪生成和细胞死亡增加及炎症浸润。本试验中得到了相同的结果,且有学者发现,岩藻黄素抗糖尿病与肝损伤的保护机制主要通过其抗氧化和抗炎特性实现[27]。
3.4 岩藻黄素调节PI3K/AKT信号通路及糖代谢相关蛋白的作用
PI3K/AKT信号通路能够增加胰岛素刺激下的葡萄糖摄取和储存[28]。GLUT4是一种葡萄糖转运蛋白,其分布与含量受胰岛素的调控,GLUT4表达量的增大可以提高生物体内葡萄糖耐量和胰岛素的敏感性[29]。GS是将葡萄糖的单个分子添加到糖原链中以备细胞储存,糖原合成酶是糖原合成的关键调控酶,在肝脏糖原的合成过程中具有重要作用[30]。有研究表明,PI3K/AKT通路是胰岛素信号传输通路,并与葡萄糖和脂质代谢有关,因此,对Ⅱ型糖尿病的研究具有重要意义[28]。胰岛素与靶细胞内的受体结合后,PI3K/AKT信号通路被触发进而激活下游GSK-3β和GLUT4酶活性,从而控制葡萄糖摄取、储存和糖原代谢[31]。Zhang等[32]试验表明,岩藻黄素能有效调节C57BL/KsJ-db/db 小鼠肝脏和骨骼肌中IRS-1/PI3K/AKT信号蛋白的表达,并通过增加GLUT4、GS蛋白的表达促进糖原的合成,从而降低血糖值。本试验结果显示,岩藻黄素可以上调糖尿病小鼠AKT、PI3K、GS和GLUT4基因的表达量,表明岩藻黄素激活了小鼠体内的PI3K/AKT信号通路。但高剂量组的PI3K表达量低于空白组,其原因可能是磷酸酶与张力蛋白同源物(phosphatase and tensin homologue,PTEN)可将磷脂酰肌醇-3,4,5-三磷酸(phosphatidylinositol-3,4,5-trisphosphate, PIP3)催化为磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5-bisphosphate, PIP2),从而抑制PI3K-AKT信号通路的转导,从而影响PI3K的表达[33-34]。除此之外,有研究发现,岩藻黄素在小鼠体内代谢为岩藻黄素醇(fucoxanthinol)和苋菜黄素A(amarouciaxanthin A),而苋菜黄素A是积聚在白色脂肪组织中岩藻黄素的主要代谢物,能抑制3T3-L1脂肪细胞的分化,并下调GLUT4的表达[35]。因此,本试验中各岩藻黄素剂量组的GLUT4表达量均无法恢复到正常水平。
4 结论
1)岩藻黄素可通过非竞争性抑制α-葡萄糖苷酶的活性来降低血糖。
2)岩藻黄素可以缓解由糖尿病引起的肝损伤,显著改善糖尿病小鼠的高血糖、血脂症状,增加糖尿病小鼠的葡萄糖耐受能力,其作用机制与PI3K/AKT信号通路有关。
[1] 孙志,马丽,邱玉芹,等.2型糖尿病发病机制及胰岛β细胞功能障碍的研究进展[J].医学综述,2008,14(9):1371-1373.
SUN Z,MA L,QIU Y Q,et al.Recent progress of islets beta-cells dysfunction in type 2 diabetes[J].Medical Recapitulate,2008,14(9):1371-1373.(in Chinese)
[2] 刘培,王鹏飞,王科,等.基于PI3K/Akt通路的中药治疗糖尿病研究进展[J].中国实验方剂学杂志,2019,25(5):220-228.
LIU P,WANG P F,WANG K,et al.Research progress of traditional Chinese medicine in treating diabetes mellitus based on PI3K/Akt pathway[J].Chinese Journal of Experimental Traditional Medical Formulae,2019,25(5):220-228.(in Chinese)
[3] 隋吉槺,汪辉,刘天中.硅藻岩藻黄素特性与其生物合成的研究进展[J].海洋科学,2019,43(12):130-138.
SUI J K,WANG H,LIU T Z.Research progress of the characteristics and biosynthesis of diatom fucoxanthin[J].Marine Sciences,2019,43(12):130-138.(in Chinese)
[4] ZHANG H,TANG Y B,ZHANG Y,et al.Fucoxanthin:a promising medicinal and nutritional ingredient[J].Evidence-Based Complementary and Alternative Medicine,2015:723515.
[5] NAJME O,MARZIEH M,MOHAMMAD T A,et al.Antidiabetic effect of fucoxanthin extracted from Sargassum angustifolium on streptozotocin-nicotinamide-induced type 2 diabetic mice[J].Food Science & Nutrition,2021,9(7):3521-3529.
[6] XIAO X H,SI X X,YUAN Z,et al.Isolation of fucoxanthin from edible brown algae by microwave-assisted extraction coupled with high-speed countercurrent chromatography[J].Journal of Separation Science,2012,35(17):2313-2317.
[7] JEON S M,KIM H J,WOO M N,et al.Fucoxanthin-rich seaweed extract suppresses body weight gain and improves lipid metabolism in high-fat-fed C57BL/6J mice[J].Biotechnology Journal,2010,5(9):961-969.
[8] 黄冰心,丁兰平,秦松,等.铜藻的分类地位、生物地理分布以及2016年底黄海漂浮铜藻源头的初步分析[J].海洋与湖沼,2018,49(1):214-223.
HUANG B X,DING L P,QIN S,et al.The taxonomical status and biogeographical distribution of Sargassum horneri with the origin analysis of its drifting population in the end of 2016 at the western Yellow Sea[J].Oceanologia et Limnologia Sinica,2018,49(1):214-223.(in Chinese)
[9] 彭雍博,汪秋宽,任丹丹,等.铜藻主要活性物质的提取及其功能[J].水产科学,2017,36(4):531-537.
PENG Y B,WANG Q K,REN D D,et al.A review:extracting technology and bioactivity of major bioactive substances in marine brown alga Sargassum horneri[J].Fisheries Science,2017,36(4):531-537.(in Chinese)
[10] 李敏兰,弓泽华,盛滟,等.岩藻黄素提取与分析方法研究进展[J].食品研究与开发,2021,42(3):202-206.
LI M L,GONG Z H,SHENG Y,et al.Advances in extraction and analysis methods of fucoxanthin[J].Food Research and Development,2021,42(3):202-206.(in Chinese)
[11] 王添娇.褐藻岩藻黄素对胆固醇代谢的调控作用研究[D].大连:大连海洋大学,2015.
WANG T J.Studies on the regulation to cholesterol metabolism by fucoxanthin from brown algae[D].Dalian:Dalian Ocean University,2015.(in Chinese)
[12] WAN C P,YUAN T,CIRELLO A L,et al.Antioxidant and α-glucosidase inhibitory phenolics isolated from highbush blueberry flowers[J].Food Chemistry,2012,135(3):1929-1937.
[13] LOLAK N,AKOCAK S,TÜRKE C,et al.Synthesis,characterization,inhibition effects,and molecular docking studies as acetylcholinesterase,α-glycosidase,and carbonic anhydrase inhibitors of novel benzenesulfonamides incorporating 1,3,5-triazine structural motifs[J].Bioorganic Chemistry,2020,100:103897.
[14] ZHU F X,WANG J,TAKANO H,et al.Rosmarinic acid and its ester derivatives for enhancing antibacterial,α-glucosidase inhibitory,and lipid accumulation suppression activities[J].Journal of Food Biochemistry,2019,43(2):e12719.
[15] ZAHARUDIN N,STAERK D,DRAGSTED L O.Inhibition of α-glucosidase activity by selected edible seaweeds and fucoxanthin[J].Food Chemistry,2019,270:481-486.
[16] BETHEL M A,FEINGLOS M N.Basal insulin therapy in type 2 diabetes[J].Journal of the American Board of Family Practice,2005,18(3):199-204.
[17] LI Q Q,ZHAO Q Y,ZHANG J Y,et al.The protein phosphatase 1 complex is a direct target of AKT that links insulin signaling to hepatic glycogen deposition[J].Cell Reports,2019,28(13):3406-3422.
[18] 仇菊,朱宏,卢林纲.葡萄籽多酚对糖尿病大鼠的降血糖作用及其机制[J].食品科学,2018,39(1):226-231.
QIU J,ZHU H,LU L G.Hypoglycemic effect of grape seed polyphenols in diabetic rats and its underlying mechanism[J].Food Science,2018,39(1):226-231.(in Chinese)
[19] MURADIAN K,VAISERMAN A,MIN K J,et al.Fucoxanthin and lipid metabolism:a minireview[J].Nutrition,Metabolism and Cardiovascular Diseases,2015,25(10):891-897.
[20] FORRESTER J S,MAKKAR R,SHAH P K.Increasing high-density lipoprotein cholesterol in dyslipidemia by cholesteryl ester transfer protein inhibition:an update for clinicians[J].Circulation,2005,111(14):1847-1854.
[21] MAO Z J,LIU S Y,YU T,et al.Yunpi Heluo decoction reduces ectopic deposition of lipids by regulating the SIRT1-FoxO1 autophagy pathway in diabetic rats[J].Pharmaceutical Biology,2022,60(1):579-588.
[22] SZPIGEL A,HAINAULT I,CARLIER A,et al.Lipid environment induces ER stress,TXNIP expression and inflammation in immune cells of individuals with type 2 diabetes[J].Diabetologia,2018,61(2):399-412.
[23] TOYODA T,KAMEI A,ISHIJIMA T,et al.A maple syrup extract alters lipid metabolism in obese type 2 diabetic model mice[J].Nutrition & Metabolism,2019,16(1):84.
[24] YANG Z X,LIU G J,WANG Y F,et al.Fucoidan A2 from the brown seaweed Ascophyllum nodosum lowers lipid by improving reverse cholesterol transport in C57BL/6J mice fed a high-fat diet[J].Journal of Agricultural and Food Chemistry,2019,67(20):5782-5791.
[25] AFRIN R,ARUMUGAM S,WAHED M I I,et al.Attenuation of endoplasmic reticulum stress-mediated liver damage by mulberry leaf diet in streptozotocin-induced diabetic rats[J].The American Journal of Chinese Medicine,2016,44(1):87-101.
[26] RODRíGUEZ V,PLAVNIK L,TOLOSA DE TALAMONI N.Naringin attenuates liver damage in streptozotocin-induced diabetic rats[J].Biomedicine & Pharmacotherapy,2018,105:95-102.
[27] LIN H T V,TSOU Y C,CHEN Y T,et al.Effects of low-molecular-weight fucoidan and high stability fucoxanthin on glucose homeostasis,lipid metabolism,and liver function in a mouse model of type II diabetes[J].Marine Drugs,2017,15(4):113.
[28] HUANG X J,LIU G H,GUO J,et al.The PI3K/AKT pathway in obesity and type 2 diabetes[J].International Journal of Biological Sciences,2018,14(11):1483-1496.
[29] RICHTER E A.Is GLUT4 translocation the answer to exercise-stimulated muscle glucose uptake?[J].American Journal of Physiology Endocrinology and Metabolism,2021,320(2):E240-E243.
[30] BECK-NIELSEN H.The role of glycogen synthase in the development of hyperglycemia in type 2 diabetes:‘To store or not to store glucose,that’s the question’[J].Diabetes/Metabolism Research and Reviews,2012,28(8):635-644.
[31] NIKOULINA S E,CIARALDI T P,MUDALIAR S,et al.Potential role of glycogen synthase kinase-3 in skeletal muscle insulin resistance of type 2 diabetes[J].Diabetes,2000,49(2):263-271.
[32] ZHANG Y P,XU W,HUANG X Q,et al.Fucoxanthin ameliorates hyperglycemia,hyperlipidemia and insulin resistance in diabetic mice partially through IRS-1/PI3K/Akt and AMPK pathways[J].Journal of Functional Foods,2018,48:515-524.
[33] LEE M S,JEONG M H,LEE H W,et al.PI3K/AKT activation induces PTEN ubiquitination and destabilization accelerating tumourigenesis[J].Nature Communications,2015,6:7769.
[34] MÉRESSE S,FODIL M,FLEURY F,et al.Fucoxanthin,a marine-derived carotenoid from brown seaweeds and microalgae:a promising bioactive compound for cancer therapy[J].International Journal of Molecular Sciences,2020,21(23):9273.
[35] YIM M J,HOSOKAWA M,MIZUSHINA Y,et al.Suppressive effects of amarouciaxanthin A on 3T3-L1 adipocyte differentiation through down-regulation of PPARγ and C/EBPα mRNA expression[J].Journal of Agricultural and Food Chemistry,2011,59(5):1646-1652.