HMG (high mobility group)蛋白是一种染色质结合蛋白,因其在聚丙烯酰胺凝胶电泳中有高迁移率特征,又称高迁移率基团[1]。HMG家族蛋白通常根据HMG结构域数量与DNA的结合特异性分为两个亚群,第一种能识别DNA的结构特征,但是却较少或无序列特异性,具有广泛的组织分布,通常包含两个或者更多的HMG-box基序,如BMGB1[2];第二种能以序列特异性的方式与DNA结合,包含一个HMG-box结构域,由胸腺细胞选择相关的高迁移率族蛋白盒(thymocyte selection-associated HMG box protein,TOX)[3]和性别决定基因(sexdetermining region Y,SRY)相关的高迁移率族蛋白盒(SRY related HMG box protein,SOX)[4]家族成员等多种蛋白组成。HMG家族蛋白具有的HMG-box基序会形成3个螺旋(典型的L型结构),可与DNA双螺旋的小沟结合,促进染色体解开[5]。HMG-box同时还可以结合转录因子和其他基于DNA活动所需要的调节因子,调节基因的复制、转录和DNA序列的修复[6-8]。
TOX4是一种高迁移率基团(HMG)盒转录调节因子,可与DNA结合,调控基因的转录,在免疫系统和癌症中发挥作用,作为PTW/PP1磷酸酶复合物的组成部分,在有丝分裂向间期过渡期间,对染色质结构和细胞周期进程起控制作用[9-10]。除此之外,TOX4还是一种新的调节细胞命运的因子,TOX4在重编程早期就参与其中[11]。Aliahmad 等[12]通过qRT-PCR、免疫荧光和细胞分选等技术研究发现,TOX是适应性免疫系统发育的调节因子,参与NK细胞(nature killer cell)和CD4+T细胞的发育。Morchikh等[13]通过共定位和过表达等方法研究发现,TOX4与剪接辅助因子NOVA1在DNA存在的情况下相互作用,可能涉及慢病毒整合、DNA修复和转录调控等过程。Sun等[14]通过RNA干扰和基因敲除技术发现,甲基-CpG-结合结构域蛋白2(methyl-CpG binding domain protein 2,MBD2)通过激活TOX4在横纹肌溶解综合征诱导的急性肾损伤(acute kidney injury,AKI)中诱导肾细胞凋亡。由此可见,TOX4在哺乳动物中广泛参与免疫应答,但其在鱼类免疫应答过程中的作用尚未见相关报道。
尼罗罗非鱼(Oreochromis niloticus)隶属于鲈形目(Percomorpha)丽鱼科(Cichlaidae)罗非鱼属(Oreochromis),原产于非洲大陆,又名非洲鲫。因其肉质细嫩、味道鲜美、营养价值高、繁殖能力强、生长速度快、适应能力强和易于养殖等特点,已成为中国南方重要的养殖品种[15]。近年来,无乳链球菌病的暴发,严重影响了中国罗非鱼养殖业的发展[16-17],因此,了解罗非鱼自身的免疫机制在抵抗无乳链球菌感染中的作用就显得尤为重要。本研究中,对TOX4基因的ORF序列进行克隆,并进行生物信息学及亚细胞定位分析,同时利用荧光定量PCR(qRT-PCR)技术,分析该基因在健康和无乳链球菌刺激后罗非鱼主要免疫组织中的表达模式,以期为TOX4在鱼类中的免疫功能研究提供数据参考。
1 材料与方法
1.1 材料
试验用健康尼罗罗非鱼购自湛江市某养殖场,体质量为(100±10)g;以20 ind./m3的密度驯养14 d用于后续试验,养殖水温为(30±1)℃,每日换水1/3,投喂3%鱼体质量的饵料。感受态细胞大肠杆菌(Escherichia coil) DH5α及无乳链球菌(Streptococcus agalctiae)ZQ0910菌种由广东省水产动物病害防控与健康养殖重点实验室提供。
RNA提取试剂盒(Trans Zol Up Plus RNA Kit)、qRT-PCR试剂盒(PerfectStart® II Probe qPCR SuperMix)均购自北京全式金公司;cDNA合成试剂盒(Prime ScriptTM RT reagent Kit with gDNA Eraser)、pMD19-T载体均购自TaKaRa大连公司;DNA纯化试剂盒(Gene JET Gel Extraction Kit)购自Thermo公司;去内毒素质粒提取试剂盒(E.Z.N.A.® Endo-Free Plasmid DNA Mini Kit I)购自上海远慕生物有限公司。PCR引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 总RNA提取及cDNA制备 取3尾健康罗非鱼用MS-222麻醉,采集血液后,解剖并分离其肌肉、胸腺、头肾、皮肤、鳃、脾脏、脑、肝脏和肠道组织。参照TransZol Up Plus RNA Kit说明书提取上述血液及各组织样品的总RNA。参照TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix说明书消化gDNA,并反转录为cDNA模板用于后续试验。
1.2.2 攻毒试验及RNA提取 随机选取100尾健康罗非鱼并随机分为空白对照组和试验组,每组50尾。试验组,每尾鱼腹腔注射0.1 mL无乳链球菌(1×107CFU/mL,溶于灭菌PBS中);对照组,每尾鱼腹腔注射0.1 mL PBS。于注射后0、3、6、12、24、48、72、96 h从各组随机取罗非鱼3尾,收集脾脏、头肾、肠道和脑4个组织样品,并参照上述方法提取RNA并制备cDNA,将cDNA按1∶50的比例,用单蒸水稀释,用于后续试验。
1.2.3 引物设计 根据NCBI上公布的尼罗罗非鱼TOX4基因序列,利用NCBI在线引物设计工具(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计TOX4基因克隆引物、真核表达质粒构建引物和荧光定量PCR引物,以β-actin为内参基因[18](表1)。
表1 试验引物序列
Tab.1 Primers used in present experiment

引物 primer序列 sequence(5'-3' )用途 purposeTOX4F:ATGGATCTGAATTTTTACTCGGATTR:CTATGTTACCGTGGTGGAGTTCTGT基因克隆TOX4-pEGFP-C1F:AAATATGCGGCCGCATGGATCTG-AATTTTTACTCGGATTR:CCGCTCGAGTGTTACCGTGGTGG-AGTTCTGT构建真核表达质粒q-TOX4F:GCTGGAGCACCTGACTCTTR:CCAATGGGATGACCGAGAqPCRβ-actinF:AACAACCACACACCACACATTTCR:TGTCTCCTTCATCGTTCCAGTTTqPCR
1.2.4 TOX4基因的克隆及序列分析 以罗非鱼头肾cDNA为模板,使用扩增引物TOX4-F和TOX4-R,通过聚合酶链式反应(PCR)扩增TOX4基因ORF序列。PCR产物经凝胶电泳检测、切胶回收,连接至pMD 19-T载体并转化至DH5α感受态细胞后,菌落经PCR验证,将阳性克隆送至公司测序。
采用ExPASy Proteomics Server软件(http://ca. expasy.org)分析推导的TOX4蛋白的分子量及等电点;采用TMHMM Server 2.0软件(http://www.cbs.dtu.dk/ services/TMHMM)预测蛋白的跨膜结构域;采用SMART(http://smart.embl-hedelberg.de/)预测蛋白的功能结构域;采用Softberry(http://linux1.softberry.com/berry.phtml?topic= psite&group=programs&subgroup=proloc)预测蛋白的功能位点;采用Euk-mPLoc 2.0软件(http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/)预测蛋白的亚细胞定位;采用SOPMA(https://npsa-prabi. ibcp.fr/cgibin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白的二级结构,通过SWISS-MODEL (http://www.expasy.org/)预测蛋白的三维结构;采用DNAMAN软件进行多重序列比对;通过MEGA 6.0软件,采用邻接法(Neighbor-Joining)构建系统进化树(bootstrap=1 000)。
1.2.5 TOX4蛋白在293T细胞中的亚细胞定位 使用带酶切位点引物TOX4-pEGFP-C1-F和TOX4-pEGFP-C1-R,以及“1.2.2节”中稀释好的cDNA为模板进行PCR扩增。
PCR产物经切胶回收后,使用相同的限制性核酸内切酶,对回收产物和pEGFP-C1进行双酶切。将酶切产物纯化后,采用T4连接酶对目的片段和载体进行连接,然后转入DH5α感受态细胞中,涂布于含卡那霉素(Kana+)的LB琼脂平板上,在37 ℃恒温培养箱中培养10~12 h。挑选单菌落置于含Kana+的LB液体培养基中,于37 ℃下以130 r/min振荡培养3~4 h。用通用引物pEGFP-C-5′和pEGFP-C-3′进行菌落PCR鉴定,将阳性克隆菌液送至生工生物工程(广州)股份有限公司进行测序。选取测序正确的菌液进行去内毒素质粒的提取,用于后续的细胞转染试验。
将293T细胞接种于12孔细胞培养板内,当细胞密度增殖到85%~90%时,根据Lip3000使用说明书,将构建好的质粒TOX4-pEGFP-C1和空载pEGFP-C1转染至细胞内。在12孔板中放入经灭菌处理的12孔细胞爬片,转染24 h后对细胞进行消化处理,加入10%(体积分数)的胎牛血清、1%(体积分数)的青霉素与链霉素混合液及M199培养基培养5 h,使细胞附着于细胞爬片,并设置3个复孔。然后用体积分数为4%的多聚甲醛固定细胞,固定40 min后吸取固定液,并用PBS洗涤,取出细胞爬片用含有DAPI的封片剂封片,于正置荧光显微镜下观察拍照[19]。
1.2.6 TOX4基因的组织表达模式(qRT-PCR) 以β-actin为内参基因,用QuantStudio 6 and 7 Flex Real-Time PCR Systems(Thermo Fisher Scientific,Waltham,USA)检测TOX4基因在尼罗罗非鱼各个健康组织,以及无乳链球菌感染过程中不同时间点的表达量,并用2-ΔΔCt法计算基因的相对表达量。
所有试验均设置3个生物学重复和3个技术重复。
1.2.7 TOX4基因在头肾淋巴细胞亚群中的表达量分析 本实验室前期对罗非鱼头肾源白细胞进行了单细胞转录组测序分析,相关成果已经发表[20]。依据测序结果和特定细胞的标志分子,将主要白细胞分为4大类,分别为B细胞、T细胞、巨噬细胞(macrophage,Mφ)和非特异性细胞毒性细胞(nonspecific cytotoxic cell,NCC),通过对原始数据在线分析,对TOX4基因在尼罗罗非鱼不同类群细胞中的表达量进行了初步研究。根据单细胞转录组测序结果,用不同亚群总的表达量除以不同亚群总的细胞数,得出在每个细胞中表达量的平均值,把最小的表达量设为1,本试验中以B细胞为基值,将数据归一化处理。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,采用SPSS 21软件进行单因素方差分析,用T检验进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 尼罗罗非鱼TOX4基因克隆及其序列分析
尼罗罗非鱼TOX4基因的ORF为2 004 bp,编码667个氨基酸。经ExPASy预测,该基因编码的蛋白相对分子质量为69 060,理论等电点为4.69,有70个带负电荷的氨基酸残基(Asp+Glu)和41个带正电荷的氨基酸残基(Arg+Lys),脂肪指数为69.91,总平均亲水性为-0.351,属于亲水蛋白,不稳定系数为59.38,归类为不稳定蛋白。经Euk-mPLoc 2.0预测,该蛋白为细胞核蛋白。采用Softberry预测发现,TOX4蛋白有N-糖基化位点2个,蛋白激酶C磷酸化位点4个,酪蛋白激酶Ⅱ磷酸化位点10个,酪氨酸激酶磷酸化位点1个,N-肉豆蔻酰基化位点19个,酰胺化位点3个,异戊二烯基结合位点1个,微体C端靶向信号4个(图1)。SMART在线软件预测发现,尼罗罗非鱼TOX4蛋白在第300位到第370位含有一个HMG保守结构域(图2)。

【】—N-糖基化位点; []—蛋白激酶C磷酸化位点; ![]() —酪蛋白激酶Ⅱ磷酸化位点;
—酪蛋白激酶Ⅱ磷酸化位点; ![]() —酪氨酸激酶磷酸化位点; ()—N-肉豆蔻酰基化位点; {}—酰胺化位点;
—酪氨酸激酶磷酸化位点; ()—N-肉豆蔻酰基化位点; {}—酰胺化位点; ![]() —异戊二烯基结合位点; —微体C端靶向信号; 加粗部分为保守结构域; *—终止密码子。【】—N-glycosylation site; []—protein kinase C phosphorylation site;
—异戊二烯基结合位点; —微体C端靶向信号; 加粗部分为保守结构域; *—终止密码子。【】—N-glycosylation site; []—protein kinase C phosphorylation site; ![]() —casein kinase Ⅱ phosphorylation site;
—casein kinase Ⅱ phosphorylation site; ![]() —tyrosine kinase phosphorylation site; ()—N-myristoylation site; {}—amidation site;
—tyrosine kinase phosphorylation site; ()—N-myristoylation site; {}—amidation site; ![]() —prenyl group binding site (CAAX box); —microbodies C-terminal targeting signal; bold parts are conserved domains; *—stop codon.
—prenyl group binding site (CAAX box); —microbodies C-terminal targeting signal; bold parts are conserved domains; *—stop codon.
图1 尼罗罗非鱼TOX4氨基酸序列和功能位点分析
Fig.1 Amino acid sequence and functional site of TOX4 in Oreochromis niloticus
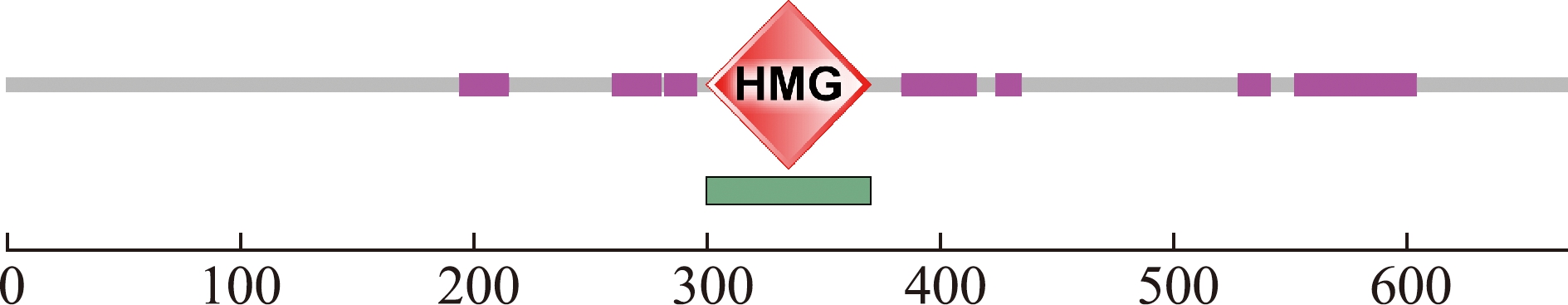
图2 尼罗罗非鱼TOX4蛋白的保守结构域预测
Fig.2 Prediction of the conserved domain of TOX4 protein in Oreochromis niloticus
2.2 TOX4蛋白的二级结构和三级结构分析
采用SOPMA软件预测TOX4蛋白二级结构,发现其由α螺旋、β折叠、延伸链和无规则卷曲构成,其中,130个氨基酸呈现α螺旋结构(占肽链氨基酸总数的19.49%),30个氨基酸呈现β折叠结构(占肽链氨基酸总数的4.50%),122个氨基酸为延伸链结构(占肽链氨基酸总数的18.29%),385个氨基酸为无规则卷曲结构(占肽链氨基酸总数的57.72%)(图3)。通过SWISS-MODEL 软件对尼罗罗非鱼TOX4蛋白进行同源建模,以2co9.1.A为模板,分别用尼罗罗非鱼和人类的TOX4氨基酸序列构建蛋白的三维结构(图4),佐证了二级结构的正确性。
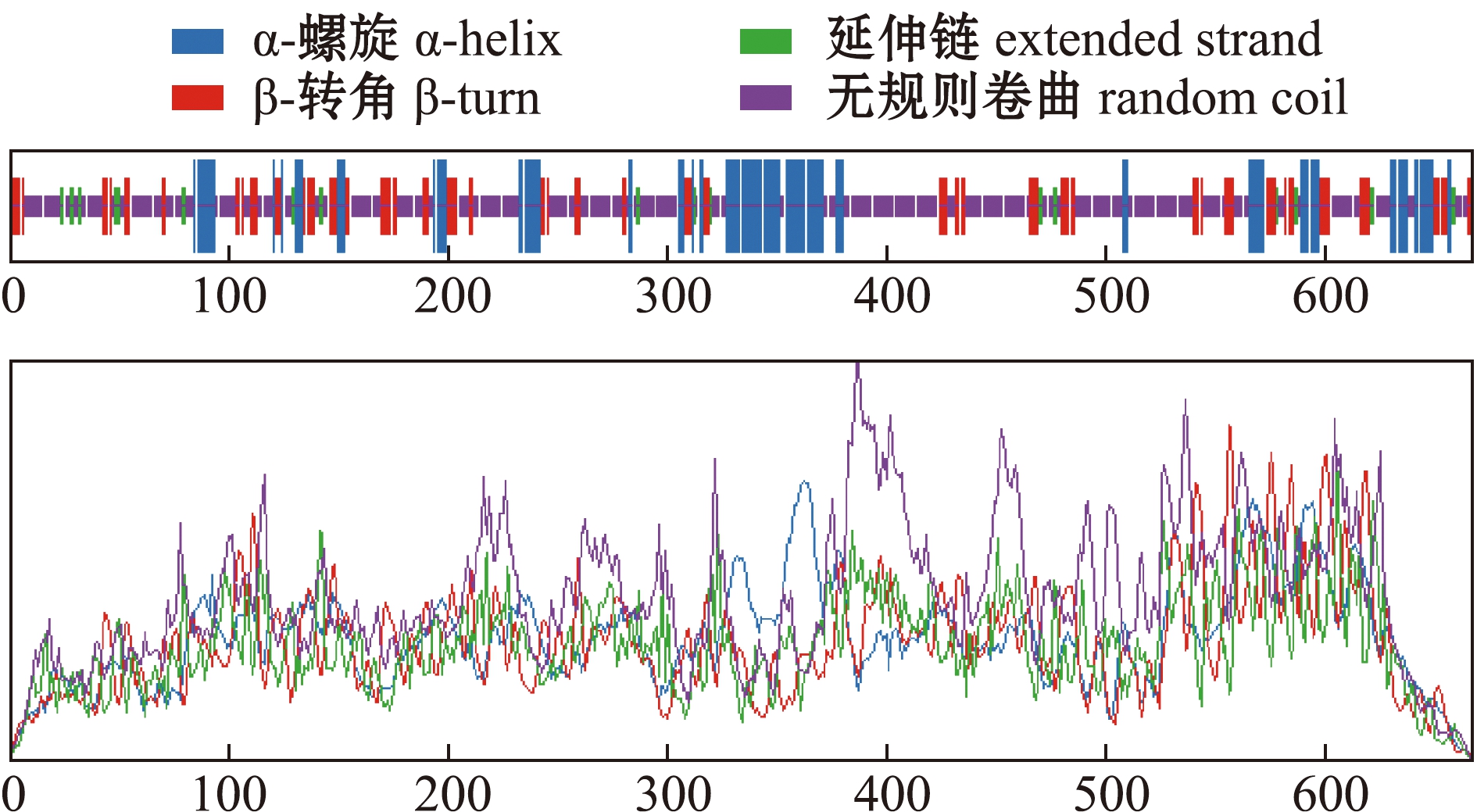
图3 尼罗罗非鱼TOX4蛋白的二级结构预测结果
Fig.3 Prediction of secondary structure of TOX4 protein analyzed in Oreochromis niloticus
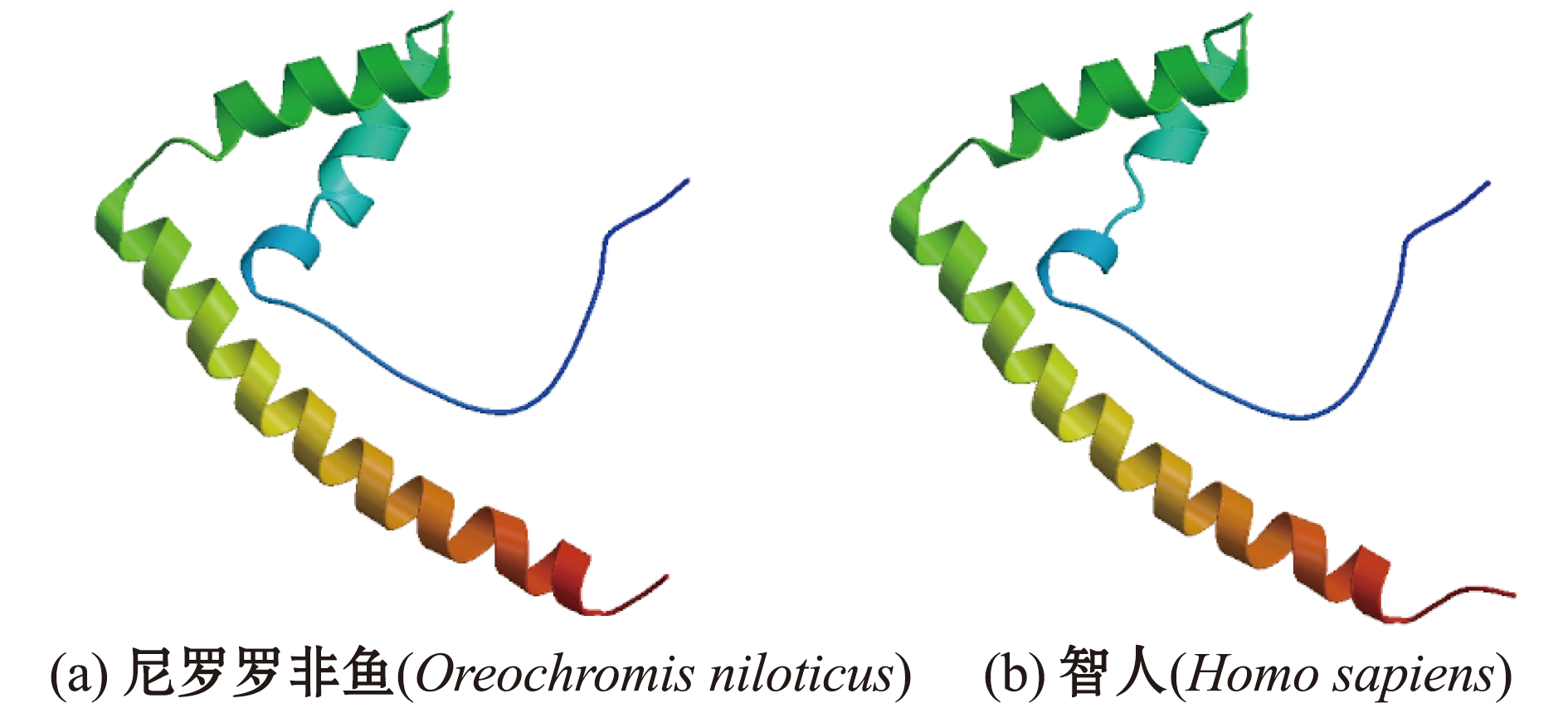
图4 尼罗罗非鱼和人类TOX4蛋白的三维结构
Fig.4 Three-dimensional structure of TOX4 protein in Oreochromis niloticus and Homo sapiens
2.3 同源性及系统进化分析
将克隆得到的尼罗罗非鱼TOX4氨基酸序列与智人(Homo sapiens) 、家鼠(Mus musculus)、非洲蟾蜍(Xenopus tropicalis,)、斑马拟丽鱼(Maylandia zebra)、斑马鱼(Danio rerio)、橙胸镖鲈(Etheostoma spectabile)和大刺鳅(Mastacembelus armatus)等7个物种的TOX4氨基酸序列进行同源性比对(图5),结果显示,与尼罗罗非鱼TOX4氨基酸序列一致性最高的是斑马拟丽鱼,为88.98%,其次是大刺鳅(77.55%)、橙胸镖鲈(73.06%)、斑马鱼(53.47%)、家鼠(37.28%)和智人(36.73%),一致性最低的是非洲蟾蜍(35.65%)。基于TOX4氨基酸序列,利用NJ法构建系统进化树,发现尼罗罗非鱼与斑马拟丽鱼首先聚为一支,表明两者的亲缘关系最近(图6)。

黑色框表示保守结构域。The black box represents the conserved domain.
图5 尼罗罗非鱼与其他物种 TOX4氨基酸的多重序列比对
Fig.5 Multiple alignments of TOX4 amino acid sequence of Oreochromis niloticus with other species

图6 基于邻接法构建的尼罗罗非鱼TOX4氨基酸序列系统进化树
Fig.6 Phylogenetic tree of TOX4 amino acid sequences in Oreochromis niloticus by Neighbour-Joining method
2.4 TOX4蛋白的亚细胞定位分析
将构建的绿色荧光标签载体TOX4-pEGFP-C1与空载pEGFP-C1分别转入293T细胞,经DAPI染色后结果如图7所示,pEGFP-C1全细胞分布,TOX4-pEGFP-C1主要分布于细胞核,与预测结果一致。
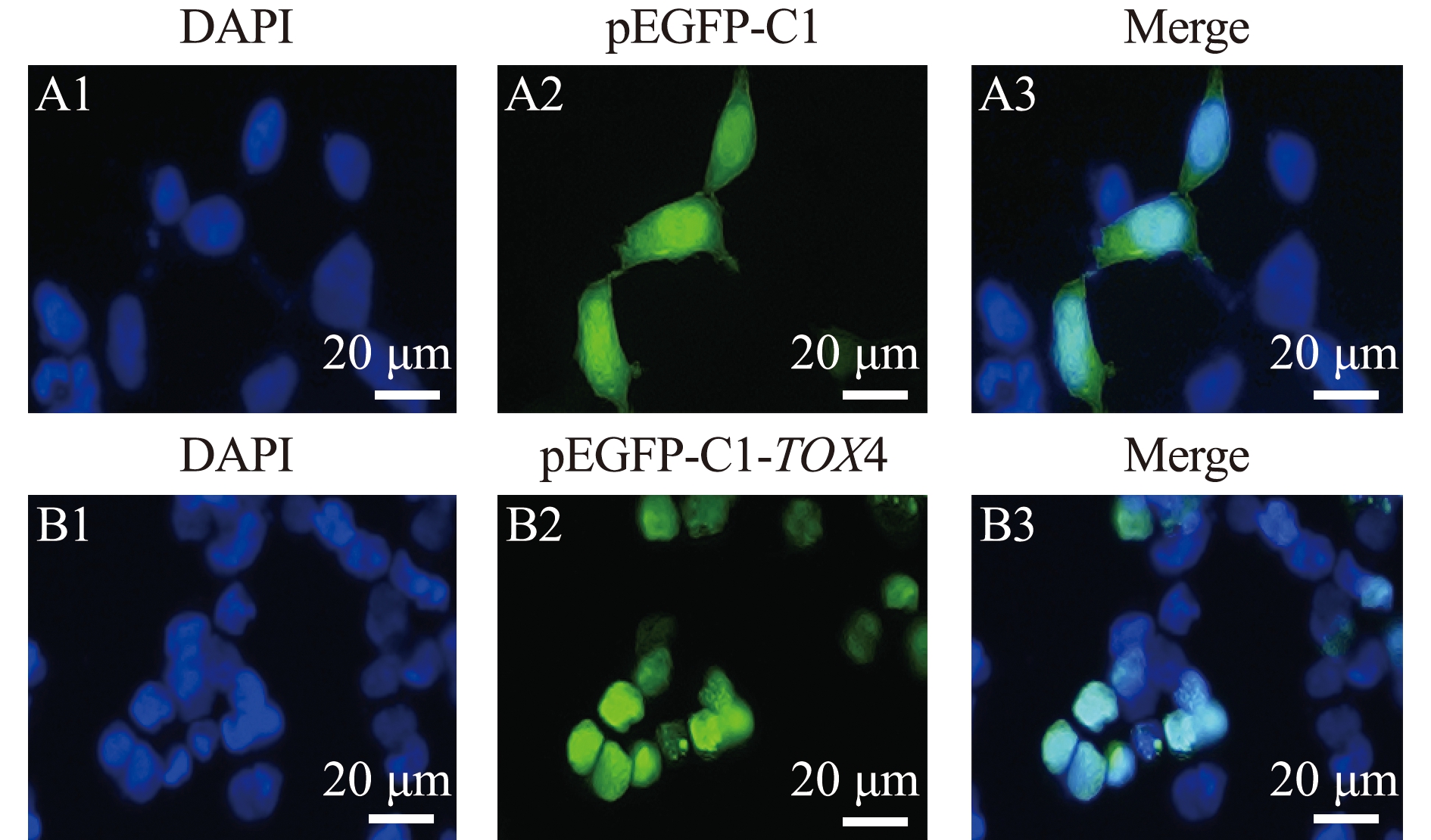
A1和B1分别为pEGFP-N1、TOX4-pEGFP-C1细胞核的DAPI染色; A2和B2分别为pEGFP-C1、TOX4-pEGFP-C1的绿色荧光蛋白; A3和B3为细胞核与绿色荧光蛋白的叠加。A1 and B1,the nuclei of pEGFP-N1 and TOX4-pEGFP-C1 are stained by DAPI; A2 and B2,green fluorescent protein of pEGFP-C1 and TOX4-pEGFP-C1; A3 and B3,merged images with green fluorescent protein.
图7 TOX4蛋白在293T细胞中的亚细胞定位
Fig.7 Subcellular localization of TOX4 protein in 293T cell
2.5 TOX4基因的组织表达分布
从图8可见,TOX4基因在健康尼罗罗非鱼的10个组织中均有表达,且在血液中表达量最高,其次是肝脏、肠道、脑、脾脏、鳃、皮肤、头肾和胸腺,在肌肉中表达量最低。
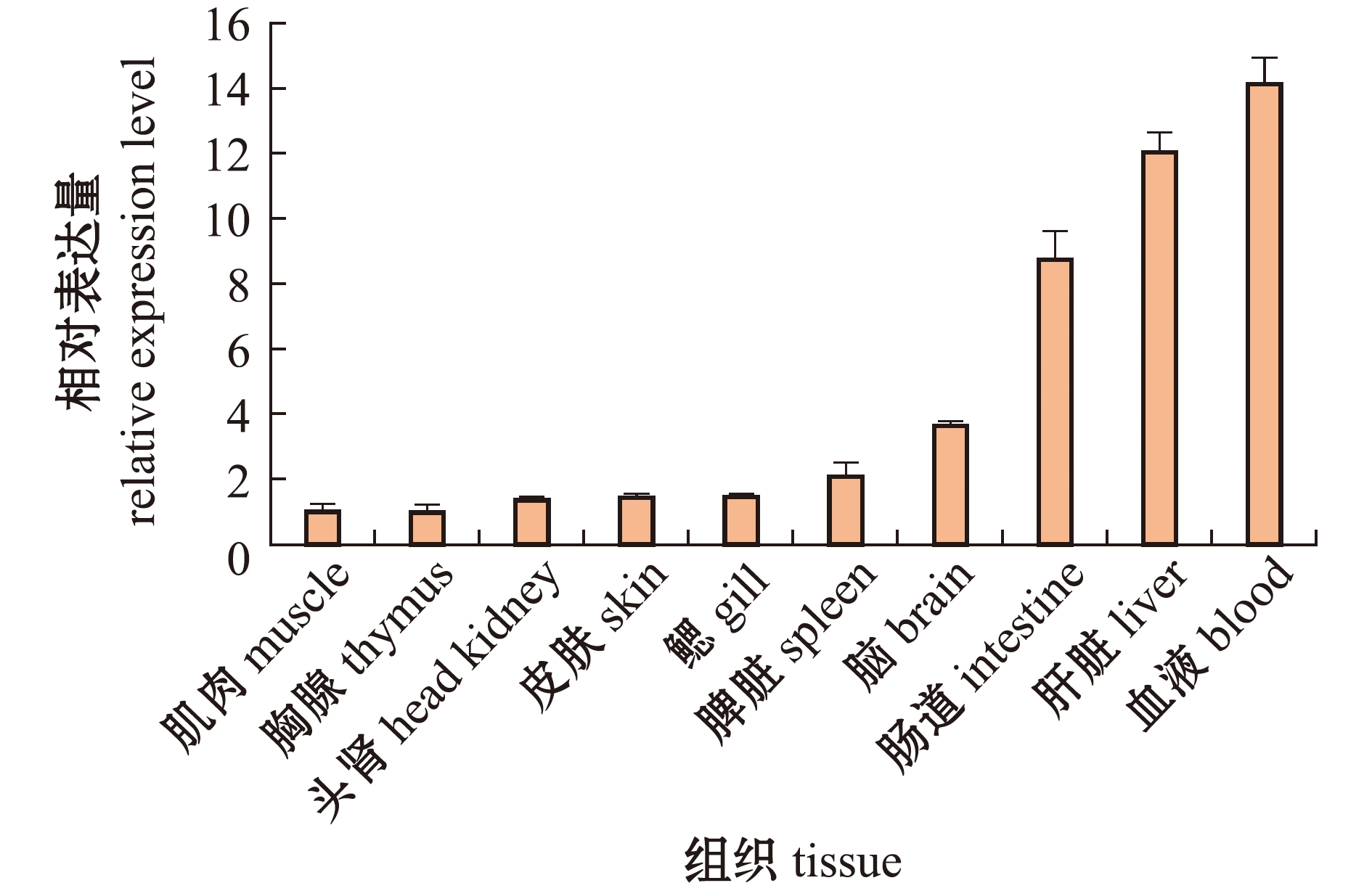
设定肌肉中的表达量为1。The expression level in muscle is set as 1.
图8 TOX4基因在不同组织中的相对表达量
Fig.8 Relative expression levels of TOX4 gene in different tissues
2.6 TOX4基因在头肾淋巴细胞亚群中的表达
通过对本实验室前期得到的头肾淋巴细胞单细胞转录组数据[20]分析发现,TOX4基因在尼罗罗非鱼头肾淋巴细胞亚群B细胞、T细胞、巨噬细胞和非特异性细胞毒性细胞均有表达,其中,在B细胞中表达量最低,在NCC中表达量最高(图9)。

Mφ—巨噬细胞;NCC—非特异性细胞毒性细胞。设B细胞的表达量为1。Mφ—macrophage; NCC—nonspecific cytotoxic cell. The expression level in B cell is set as 1.
图9 TOX4基因在头肾淋巴细胞亚群中的相对表达量
Fig.9 Relative expression levels of TOX4 gene in lymphocyte subsets of the head kidney
2.7 无乳链球菌刺激后TOX4基因在尼罗罗非鱼脑、头肾、肠道和脾脏中的表达
从图10可见:在无乳链球菌感染过程中,尼罗罗非鱼脑、头肾、肠道和脾脏组织中不同时间点TOX4基因的表达量差异较大,在脑、头肾和肠道中,12 h时表达量极显著上调(P<0.01),之后慢慢恢复到正常水平;在脾脏组织中,3、48 h时均极显著上调(P<0.01);总体上,无乳链球菌攻毒后TOX4基因在尼罗罗非鱼头肾、脑、肠道和脾脏组织中呈先升后降趋势,最后恢复到正常水平变化。
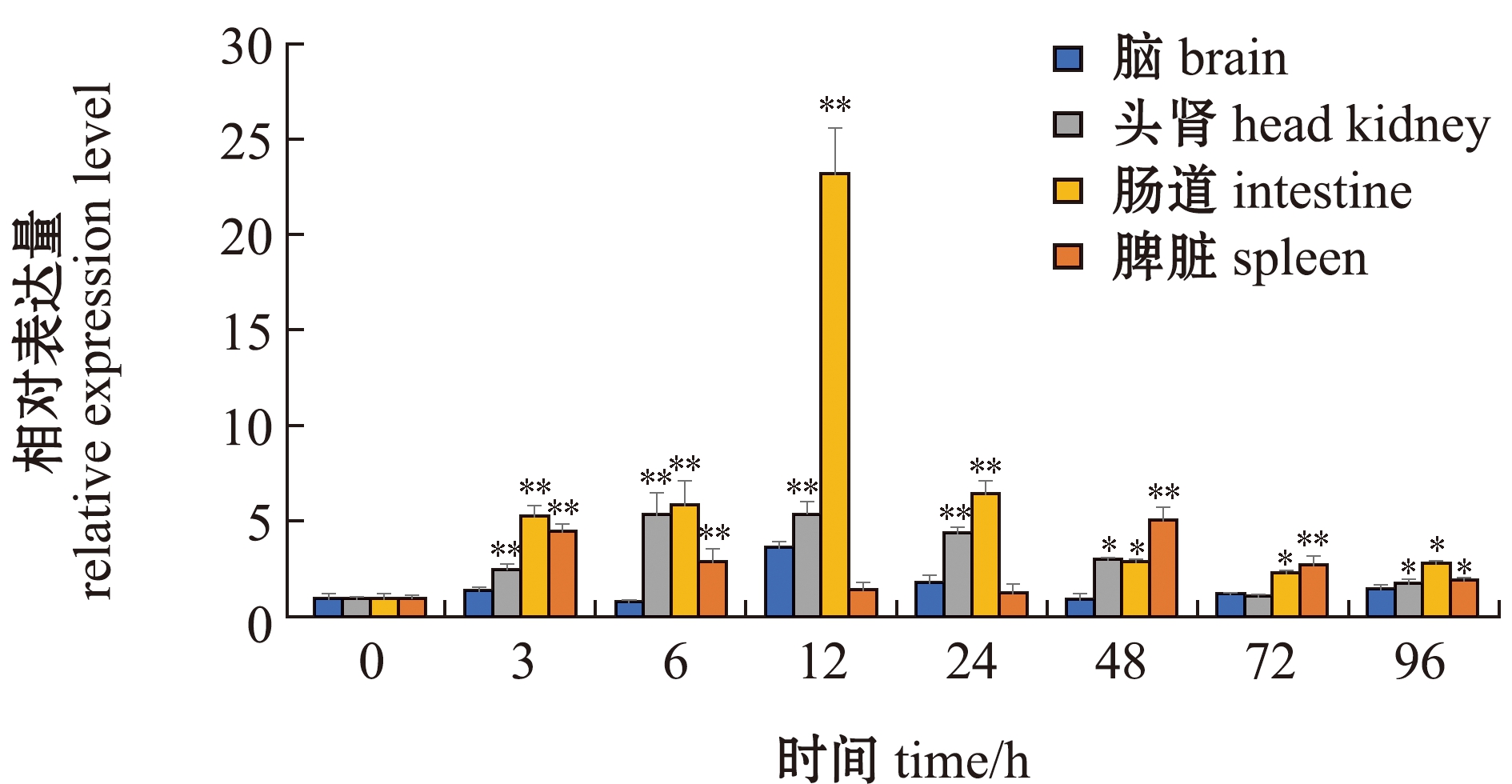
*表示与0 h(对照)有显著性差异(P<0.05);**表示与0 h(对照)有极显著性差异(P<0.01)。TOX-4基因在各个对照中的表达量均设为 1。*means significant difference compared with 0 h(control);**means very significant difference compared with 0 h(control). Expression level of TOX4 gene in each control is set as 1.
图10 无乳链球菌感染后尼罗罗非鱼组织中TOX4基因的表达变化
Fig.10 Change in the expression levels of TOX4 gene in 4 tissues of Oreochromis niloticus challenged by Streptococcus agalactiae
3 讨论
3.1 尼罗罗非鱼TOX4的生物信息学及亚细胞定位分析
目前,在人类及小鼠中,TOX4的同源物已被鉴定出来,其在糖类代谢及免疫调控等方面发挥重要作用[10,21],而在鱼类中的相关研究较少。本研究中,从尼罗罗非鱼中鉴定到了TOX4基因,获得其开放阅读框序列长度为2 004 bp,编码667个氨基酸,其中包含一个HMG保守结构域,推测可与DNA结合。TOX4蛋白的HMG保守结构域中包含N-肉豆蔻酰基化位点1个、N-糖基化位点1个、酪蛋白激酶Ⅱ磷酸化位点3个和微体C端靶向信号1个,这暗示该蛋白在细胞生长、增殖、分化及信息传递中具有重要作用。各物种的TOX4氨基酸序列比对发现,鱼类间TOX4氨基酸序列的一致性较高(>75%),但鱼类、哺乳动物及两栖类间的同源性较低,然而一些功能位点是保守的,如HMG结构域。系统进化分析表明,尼罗罗非鱼TOX4与其他鱼类的TOX4聚为一支,表明其亲缘关系较近,而两栖类和哺乳类分别聚为另一支。亚细胞定位结果显示,尼罗罗非鱼TOX4蛋白存在于细胞核中,与哺乳动物人和小鼠相同[13]。以上结果暗示,TOX4基因虽然在不同物种中具有序列差异,但其蛋白功能仍然具有一定保守性,均在细胞核中发挥功能。
3.2 TOX4基因的组织分布及单细胞转录组测序结果分析
根据已有的报道,TOX4基因在哺乳动物的各个组织中均有表达,且在淋巴组织中表达量较高,包括骨髓和胸腺[21],其中,主要在T细胞和NK细胞中表达,调控T细胞的分化[22-23]和NK细胞的发育[12]。另外,TOX4基因还有调节糖代谢过程的功能[10]。本研究中,在罗非鱼组织层面,TOX4基因在血液中表达量最高,在肝脏中的表达量也比较高,在脑、肾脏和脾脏等主要免疫器官均有表达,而在肌肉中表达量最低(图8);在细胞层面,对尼罗罗非鱼头肾白细胞单细胞转录组数据分析发现,TOX4基因在尼罗罗非鱼NCC中表达量最高,其次是巨噬细胞,在B、T淋巴细胞亚群也有表达(图9),这与哺乳动物相比存在一定差异。TOX4基因在尼罗罗非鱼血液和免疫器官及肝脏中的表达量较高,表明TOX4可能参与罗非鱼机体的免疫应答及肝脏代谢调节。在鱼类血液中存在许多先天免疫细胞包括NCC和巨噬细胞,而NCC被认为是NK细胞进化上的前体细胞[24],且在跟黏膜免疫相关的肠道中表达量也较高。这表明,TOX4有可能参与尼罗罗非鱼NCC的发育,参与先天免疫的调控。有趣的是,在哺乳动物胸腺中TOX4基因的表达量较高,而本研究中尼罗罗非鱼胸腺中TOX4基因的表达量却较低,这可能是因为鱼类在性成熟过程、鱼龄增长和环境胁迫等条件下胸腺会退化[25-26],B、T淋巴细胞会迁徙到肾脏和脾脏中[27],从而造成TOX4基因在胸腺中表达量较低而在肾脏和脾脏中表达量较高。这表明,TOX4可能参与尼罗罗非鱼B、T细胞的发育调节。
3.3 无乳链球菌刺激后TOX4基因的表达变化
本研究中,在无乳链球菌刺激下,TOX4基因在尼罗罗非鱼脑、头肾、肠道和脾脏等组织中的表达均显著上调,脑、头肾和肠道中的表达量在12 h达到最高峰,脾脏中的表达量在48 h达到最高峰。而无乳链球菌可通过血-脑屏障感染脑组织,头肾和脾脏是硬骨鱼类重要的免疫器官和组织[27],肠道主要跟黏膜免疫相关。在这4个不同组织中,经无乳链球菌刺激后,尼罗罗非鱼TOX4基因的表达均呈现时间依赖性上调,这暗示TOX4基因在这4个组织中发挥相似的功能,并参与罗非鱼机体的免疫调控,推测在免疫应答过程中需要TOX4的参与来增加免疫相关因子的表达。在罗非鱼的其他HMG蛋白如HMGB1[2]及HMG20A[28]中也出现相似的结果,这些均表明,TOX4参与了罗非鱼机体的抗细菌免疫反应。值得注意的是,TOX4基因表达量在尼罗罗非鱼脾脏组织中3 h时显著上调,在48 h时才达到峰值,晚于其他组织的达峰时间,可能是因为无乳链球菌引起的免疫反应在不同器官中的应答时间和持续时间不同,但具体的调控机制还有待进一步研究。
4 结论
1)本研究中,克隆并鉴定了尼罗罗非鱼TOX4基因,其生物信息分析和亚细胞定位分析结果表明,尼罗罗非鱼TOX4蛋白与其他物种的TOX4蛋白具有相似的结构特征和功能特征。
2)TOX4基因广泛分布于尼罗罗非鱼的不同组织中,其中,血液中的含量最高。单细胞转录组测序结果表明,TOX4基因主要在尼罗罗非鱼非特异性细胞毒性细胞中高表达,其次是巨噬细胞、T细胞和B细胞。这表明,尼罗罗非鱼TOX4在先天免疫应答中起作用,并参与B、T细胞的发育调节。
3)经无乳链球菌刺激后,尼罗罗非鱼组织中TOX4基因呈时间依赖性上调,这表明TOX4参与了尼罗罗非鱼抵抗无乳链球菌感染的免疫应答。
[1] TESSEMA M,YINGLING C M,GRIMES M J,et al.Differential epigenetic regulation of TOX subfamily high mobility group box genes in lung and breast cancers[J].PLoS One,2012,7(4):e34850.
[2] NIU J Z,WU F L,HUANG Y,et al.Identification and characterization of high-mobility group box 1 (HMGB1) from Nile tilapia (Oreochromis niloticus)[J].Aquaculture Reports,2021,19:100573.
[3] O’FLAHERTY E,KAYE J.TOX defines a conserved subfamily of HMG-box proteins[J].BMC Genomics,2003,4(1):13.
[4] SOULLIER S,JAY P,POULAT F,et al.Diversification pattern of the HMG and SOX family members during evolution[J].Journal of Molecular Evolution,1999,48(5):517-527.
[5] THOMAS J O,TRAVERS A A.HMG 1 and 2,and related ‘architectural’ DNA-binding proteins[J].Trends in Biochemical Sciences,2001,26(3):167-174.
[6] BEWLEY C A,GRONENBORN A M,CLORE G M.Minor groove-binding architectural proteins:structure,function,and DNA recognition[J].Annual Review of Biophysics and Biomolecular Structure,1998,27:105-131.
[7] TRAVERS A A.Priming the nucleosome:a role for HMGB proteins?[J].EMBO Reports,2003,4(2):131-136.
[8] YUAN F H,GU L Y,GUO S L,et al.Evidence for involvement of HMGB1 protein in human DNA mismatch repair[J].The Journal of Biological Chemistry,2004,279(20):20935-20940.
[9] LEE J H,YOU J,DOBROTA E,et al.Identification and characterization of a novel human PP1 phosphatase complex[J].The Journal of Biological Chemistry,2010,285(32):24466-24476.
[10] WANG L H,YU J J,ZHOU Q Z,et al.TOX4,an insulin receptor-independent regulator of hepatic glucose production,is activated in diabetic liver[J].Cell Metabolism,2022,34(1):158-170.
[11] VANHEER L,SONG J,DE GEEST N,et al.Tox4 modulates cell fate reprogramming[J].Journal of Cell Science,2019,132(20):jcs232223.
[12] ALIAHMAD P,DE LA TORRE B,KAYE J.Shared dependence on the DNA-binding factor TOX for the development of lymphoid tissue-inducer cell and NK cell lineages[J].Nature Immunology,2010,11(10):945-952.
[13] MORCHIKH M,NAUGHTIN M,DI NUNZIO F,et al.TOX4 and NOVA1 proteins are partners of the LEDGF PWWP domain and affect HIV-1 replication[J].PLoS One,2013,8(11):e81217.
[14] SUN T S,LIU Q,WANG Y F,et al.MBD2 mediates renal cell apoptosis via activation of Tox4 during rhabdomyolysis-induced acute kidney injury[J].Journal of Cellular and Molecular Medicine,2021,25(10):4562-4571.
[15] 黄家庆,徐田祥.小体积高密度网箱养殖尼罗罗非鱼技术[J].齐鲁渔业,2004,21(7):17-19.
HUANG J Q,XU T X.Small volume and high density cage culture of Nile tilapia(Oreochromis niloticus) [J].Shandong Fisheries,2004,21(7):17-19.(in Chinese)
[16] 苏友禄,刘婵,邓益琴,等.罗非鱼无乳链球菌病的研究进展[J].大连海洋大学学报,2019,34(5):757-766.
SU Y L,LIU C,DENG Y Q,et al.Research on Streptococcus agalactiae disease in tilapia:a review[J].Journal of Dalian Ocean University,2019,34(5):757-766.(in Chinese)
[17] 黄艳华,彭亚,刘杰,等.罗非鱼致病性无乳链球菌的分离鉴定及药敏试验[J].南方农业学报,2014,45(3):498-504.
HUANG Y H,PENG Y,LIU J,et al.Isolation,identification and drug susceptibility test of tilapia pathogen Streptococcus agalactiae[J].Journal of Southern Agriculture,2014,45(3):498-504.(in Chinese)
[18] 樊博琳,黎源,汪志文,等.尼罗罗非鱼CD247基因克隆及其组织表达分析[J].广东海洋大学学报,2018,38(6):6-12.
FAN B L,LI Y,WANG Z W,et al.Cloning and tissue expression analysis of gene CD247 in Nile tilapia (Oreochromis niloticus)[J].Journal of Guangdong Ocean University,2018,38(6):6-12.(in Chinese)
[19] 罗国玲,王孝谦,简纪常,等.尼罗罗非鱼CD209基因的克隆、表达及功能鉴定[J].大连海洋大学学报,2021,36(3):374-382.
LUO G L,WANG X Q,JIAN J C,et al.Cloning,expression and functional identification of CD209 gene in Nile tilapia (Oreochromis niloticus)[J].Journal of Dalian Ocean University,2021,36(3):374-382.(in Chinese)
[20] NIU J Z,HUANG Y,LIU X C,et al.Single-cell RNA-seq reveals different subsets of non-specific cytotoxic cells in teleost[J].Genomics,2020,112(6):5170-5179.
[21] ALIAHMAD P,SEKSENYAN A,KAYE J.The many roles of TOX in the immune system[J].Current Opinion in Immunology,2012,24(2):173-177.
[22] WILKINSON B,CHEN J Y F,HAN P,et al.TOX:an HMG box protein implicated in the regulation of thymocyte selection[J].Nature Immunology,2002,3(3):272-280.
[23] ALIAHMAD P,O’FLAHERTY E,HAN P,et al.TOX provides a link between calcineurin activation and CD8 lineage commitment[J].The Journal of Experimental Medicine,2004,199(8):1089-1099.
[24] 魏世娜,简纪常,吴灶和,等.鱼类非特异性细胞毒性细胞(NCC)的研究进展[J].中国水产科学,2010,17(2):374-380.
WEI S N,JIAN J C,WU Z H,et al.Research progress on nonspecific cytotoxic cell in teleostean fish[J].Journal of Fishery Sciences of China,2010,17(2):374-380.(in Chinese)
[25] CHILMONCZYK S.The thymus in fish:development and possible function in the immune response[J].Annual Review of Fish Diseases,1992,2:181-200.
[26] 谢海侠,聂品.鱼类胸腺研究进展[J].水产学报,2003,27(1):90-96.
XIE H X,NIE P.Fish thymus research:a review[J].Journal of Fisheries of China,2003,27(1):90-96.(in Chinese)
[27] 罗智文,董志祥,林连兵,等.鱼类重要免疫器官抗菌机制的研究进展[J].水产科学,2021,40(4):624-634.
LUO Z W,DONG Z X,LIN L B,et al.Advances on immunological mechanisms of important immune organs against pathogenic microorganisms in fish:a review[J].Fisheries Science,2021,40(4):624-634.(in Chinese)
[28] ZHANG Z Q,NIU J Z,LI Q,et al.HMG20A from Nile tilapia (Oreochromis niloticus) involved in the immune response to bacterial infection[J].Fish & Shellfish Immunology,2021,119:499-507.