Notch信号通路在胚胎血管形成中发挥了重要作用[1]。Delta-like 4 (Dll4)是Notch信号通路的一个重要配体,对正常的血管发育至关重要[2]。Smad(small mothers against decapentaplegic)蛋白家族在脊椎动物的早期发育、原肠形成、造血和背腹轴形成中发挥了重要作用[3],是转化生长因子β(transforming growth factor-β,TGF-β)家族信号传导的关键下游介质。其功能除调节TGF-β、骨形态发生蛋白 (bone morphogenic proteins,BMPs)、激活素或抑制素等直接靶基因的转录外,还参与Notch通路的调控,通常以细胞类型或发育阶段特异性的方式进行[4]。目前,已发现8种Smads蛋白家族成员,从功能角度分为3组:受体激活型Smad(R-Smads:Smad1、Smad2、Smad3、Smad5和Smad8);通用型Smad(Co-Smad:Smad4);抑制型Smads(I-Smads:Smad6和Smad7)[5]。TGF-β可通过不同的表面受体信号刺激或抑制血管生成[6],在胚胎内皮细胞中,激活素受体样激酶1(activin receptor like kinase 1,ALK1)信号通路由其高亲和力配体BMP-9或BMP-10激活,并由Smad1/Smad5介导,与Notch信号通路共同抑制血管生成[7]。研究表明,BMP/Smad通路可以调控动物心脏发育[8],小鼠中Smad1基因失活可导致胚胎早期死亡,主要原因是造成胚胎缺陷,包括心血管畸形[9]。此外,Notch介导的心内膜细胞间的侧抑制(lateral inhibition)可以将Dll4阳性的心内膜细胞单独表达出来[10]。Smad7的异位表达可有效抑制TGF-β/ALK1诱导的Smad1/Smad5磷酸化[11],说明BMP/Smad和Dll4/Notch通路对血管生成至关重要,而两者间是否具有直接调控关系值得研究。
在血管早期发育过程中,当血流触发由 Notch-Dll4信号介导的侧向抑制时会出现流体剪切应力。对血流产生的机械力敏感的Notch-Dll4信号通路和Klf2-Wnt9通路在调控斑马鱼(Danio rerio)心脏瓣膜发生中存在交互作用[10]。研究发现,用Morpholino敲降斑马鱼dll4基因,会导致节间血管(intersegment vessel,ISV)和背侧纵向吻合血管(dorsal longitudinal anastomotic vessel,DLAV)发生网状连接,破坏原有“T”型连接的表型,但具体机制尚不清楚[12]。本实验室利用CRISPR/Cas9技术得到的dll4基因纯合突变体斑马鱼有相同表型。最近研究发现,Epsin 15同源结构域(Epsin 15 homology domain containing 2,EHD2)在血管发育过程中可调节Dll4内吞作用,这对Dll4跨细胞增生和下游Notch激活是必要的,在斑马鱼中敲除EHD2基因,可导致斑马鱼间质血管中畸形芽显著增加及下游Notch信号减少[13]。而DLL4/Notch和BMP9/ALK1这两种关键通路可以协同信号转导,抑制超芽生长以维持适当的血管密度[7]。但对于Notch信号通路配体Dll4与Smad蛋白的直接调控关系目前尚未见报道,猜测斑马鱼dll4可能通过调控smad基因影响节间血管与背侧纵向吻合血管的生成模式。
本实验室前期研究发现,斑马鱼中Notch信号通路的配体基因deltaD可以通过调控血管内皮生长因子(vascular endothelial growth factor,VEGF)家族中的vegfaa配体和flt4受体基因影响血管发育[14]。在此基础上,本研究中对斑马鱼中Notch分子的另外一个配体基因dll4参与smad1和smad7基因的调控进行研究,探索其对内皮细胞和新生血管分支的影响,并通过双荧光素酶试验,检测dll4对smad1和smad7基因的调控活性,以期为Notch信号通路调控血管的生成机制研究提供参考。
1 材料与方法
1.1 材料
试验鱼:试验用AB品系野生型(wild type,WT)斑马鱼购自中国科学院生物化学与细胞生物学研究所斑马鱼平台,dll4纯合突变体(dll4-/-)斑马鱼由本实验室构建。斑马鱼养殖试验按照相关标准进行养殖与维护(www.zfin.org),并按照上海海洋大学动物伦理委员会的相关规定进行(SHOU-DW-2016-002)。
载体及细胞:哺乳动物表达载体p3×Flag-CMV、报告基因载体pGL3-Enhancer及内参质粒phRL-TK和人胚肾细胞(human embryonal kidney,HEK293T)均由海军军医大学医学免疫学国家重点实验室李楠教授惠赠。
试剂:反转录试剂盒、同源重组试剂2×ClonExpress Mix购自南京诺维赞生物科技股份(上海)有限公司;Pst Ⅰ、 BamH Ⅰ、Nhe Ⅰ和Xho I限制性内切酶购自NEB公司;DNA聚合酶、DNA Marker等购自TaKaRa 公司;Trizol试剂购自 Invitrogen 公司;PCR产物纯化试剂盒、海洋动物组织基因组DNA提取试剂盒、无内毒素质粒提取试剂盒和DH5α感受态细胞均购自天根生化科技有限公司;Dual-Luciferase® Reporter Assay System及FuGENE Hdjun购自普洛麦格(北京)公司;胰蛋白酶、转染试剂FuGENE HD Transfection Reagent、Peroxidase-Conjugated Goat Anti-Rabbit IgG(H+L)和培养基DMEM等均购自上海翌圣生物科技公司。重组质粒测序由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 斑马鱼dll4-/-中smad1和smad7基因表达量的检测 采用Trizol法提取受精后2 d(day post fertilization,dpf)斑马鱼野生型及dll4纯合突变体整胚的RNA,反转录获取cDNA。然后采用罗氏480仪器进行荧光定量PCR分析(qRT-PCR),并以斑马鱼的ef1a基因作为内参,采用2-△△Ct方法计算相对表达量。qRT-PCR引物设计见表1。
1.2.2 Dll4氨基酸序列生物信息学分析及smad1、smad7启动子特征序列分析 首先从NCBI获得12个物种配体Dll4的氨基酸序列,采用MEGA 7.0软件,通过邻接法(NJ)构建系统进化树,并通过iTOL网站(https://itol.embl.de/)和Adobe Illustrator软件进行进化树的美化。采用ClustalX软件(http://www.clustal.org/)对斑马鱼、人和小鼠配体氨基酸相似性进行比对。采用Methprimer-Design软件预测斑马鱼smad1和smad7启动子的CpG岛结构。利用AliBaba 2.1软件(http://gene-regulation.com/pub/programs/alibaba2/index. html)预测启动子的转录结合位点。
1.2.3 斑马鱼p3×Flag-CMV-dll4 真核表达载体的构建 在NCBI网站获得斑马鱼dll4基因(NM_001079835.1)的CDS序列,并设计引物(表1)。以受精后2 dpf的野生斑马鱼全长cDNA为模板,用高保真酶进行PCR扩增。扩增体系(共25 μL):Prime STAR® Max DNA Polymerase 12.5 μL,DNA Template 1 μL,Forward Primer 0.5 μL,Reverse Primer 0.5 μL,ddH2O 10.5 μL。扩增条件:98 ℃下预变性3 min;98 ℃下变性10 s,65 ℃下退火30 s,72 ℃下延伸1.5 min,共进行35个循环;最后在72 ℃下再延伸5 min。然后将 PCR 产物纯化,选择酶切位点Pst Ⅰ和BamH Ⅰ将载体p3×Flag-CMV进行双酶切并纯化。用同源重组连接酶2×ClonExpress Mix将PCR纯化产物和双酶切纯化产物相连接,转化至DH5α中,再涂布于氨苄抗性平板上,挑取菌落扩摇,送至生工生物工程(上海)股份有限公司进行测序,将测序结果与对比序列一致的菌液再进行扩摇后提取质粒。
1.2.4 斑马鱼smad1和smad7启动子报告基因的构建 在NCBI网站获得斑马鱼smad1和smad7基因的启动子序列,通过软件预测启动子序列中的转录因子结合位点,分别选择含有转录因子结合位点的1 000 bp和700 bp 左右序列进行扩增(表1),以基因组DNA为模板,扩增体系同“1.2.3节”。将 PCR产物纯化,选择酶切位点Pst Ⅰ和BamH Ⅰ 将载体pGL3-Enhancer进行双酶切,用T4酶连接酶切产物,转化至DH5α中,再涂布于氨苄抗性平板上,挑取菌落,送至生工生物工程(上海)股份有限公司进行测序,将测序结果与对比序列一致的菌液再进行扩摇后提取质粒。
表1 引物扩增序列
Tab.1 Amplification sequence of primers

长度/bplength引物primer引物序列(5'-3')primer sequence (5'-3')酶切位点选择selection of enzyme cutting site用途usage引物来源source of primer87ef1aF:CTGGAGGCCAGCTCAAACATR:ATCAAGAAGAGTAGTACCGCTAGCATTACqRT-PCR杜璇等[14]184smad1 RTF:AGATCCAGGCAGCCCTTTTCR:CCAGTGCTTGGGTTCCTGATqRT-PCR自行设计226smad7 RTF:CTGTGTGATGGTATCGCGGAR:TGAGTATGGAGGAGGGGGTGqRT-PCR自行设计2 052dll4F:GACAAGCTTGCATGCCTGCAGATAATCG-TGGGTGACACGGCR:CAGGGATGCCACCCGGGATCCACACAGA-CTGGTACACGGAGPstⅠ和BamH Ⅰ真核表达载体构建自行设计1 064smad1F:CGAGCTCTTACGCGTGCTAGCATTAGGA-CAATTATAGGGGAR:ACTTAGATCGCAGATCTCGAGGCACGCG-ATCTGTTTCATACNheⅠ和Xho Ⅰ报告基因构建自行设计678smad7F:CGAGCTCTTACGCGTGCTAGCCAAATAG-TACAAACACACGAR:ACTTAGATCGCAGATCTCGAGGCTCTCG-CCTGGCGTCAGTGNheⅠ和Xho Ⅰ报告基因构建自行设计
1.2.5 双荧光素酶报告基因活性的检测 在含10% FBS的DMEM培养基中培养人胚肾细胞HEK293T,培养条件为37 ℃、5% CO2,每隔2 d传代一次。将细胞接种于24孔板中,培养24 h,每个孔接种细胞数量控制在2.0×104 cells左右,当细胞汇合度达到70%~80%时即可转染。参照转染试剂Lipo2000的使用说明分别单转染两种启动子报告基因载体,以及共转染启动子报告基因载体与真核表达载体到HEK293T细胞(表2)。其中,单转对照组是指转染未经连接、转化的报告基因载体pGL3-Enhancer到HEK293T细胞;单转试验组是指分别转染重新构建成功的启动子报告基因载体pGL3-smad1-Luc、 pGL3-smad7-Luc到HEK293T细胞;共转对照组是指转染未经连接、转化的真核表达载体p3×Flag-CMV和构建成功的启动子报告基因载体到HEK293T细胞;共转试验组是指分别转染重新构建成功的p3×Flag-CMV-dll4和构建成功的启动子报告基因载体到HEK293T细胞。每组各设3个生物学重复和技术重复,置于培养箱中培养24 h。参照荧光素酶检测Promega Dual-Luciferase® Reporter Assay System使用说明,用酶标仪(BioTek,Synergy2)检测荧光素酶活性,并计算Firefly Luciferase与Renilla Luciferase的比值。
表2 smad1和smad7启动子报告基因活性转染体系
Tab.2 smad1 and smad7 promoter reporter gene activity transfection system ng

组别 group p3×Flag-CMVpCMV-dll4pGL3-Enhancersmad1-Luc/smad7-LucpRL-TK单转对照组 singletransfect control group00100010单转试验组 singletransfect experimental group00010010共转对照组 co-transfect control group1000010010共转试验组 co-transfect experimental group0100010010
1.3 数据处理
试验数据采用Prism 8软件进行方差分析,两组之间采用T检验进行显著性差异分析,显著性水平设为0.05,极显著性水平设为0.01、0.001和0.0001。
2 结果与分析
2.1 斑马鱼dll4纯合突变体中smad1和smad7表达量的变化
提取受精后2 dpf斑马鱼dll4-/-的RNA,通过qRT-PCR检测野生型WT和dll4-/-斑马鱼smad家族smad1和smad7基因表达量的变化。结果显示,与野生型斑马鱼相比,dll4-/-斑马鱼smad1和smad7表达量均极显著降低(P<0.000 1)(图1)。

****表示与对照组有极显著性差异(P<0.000 1)。****means very significant difference compared with the control(P<0.000 1).
图1 dll4-/-中smad1和smad7基因表达量的变化
Fig.1 Changes in expression levels of smad1 and smad7 genes in dll4-/-
2.2 Dll4氨基酸序列进化及Notch配体氨基酸序列同源性分析
生物信息学分析显示,斑马鱼dll4基因编码682个氨基酸。同源性分析显示,斑马鱼与人(Homo sapiens)、小鼠(Mus musculus) Notch配体Dll4氨基酸序列的一致性分别为56.87%、56.04%(表3)。系统进化分析显示,哺乳动物Dll4聚为一支,斑马鱼与大黄鱼(Larimichthys crocea)、大西洋鲑(Salmo salar)和青鳉(Oryzias latipes)等硬骨鱼类Dll4形成一个大分支(图2),且一致性分别为75.67%、76.89%和72.98%,亲缘关系相对于人类、小鼠和鸡(Gallus gallus)等更近。以上结果显示,不同物种中Notch配体Dll4氨基酸序列具有较高的一致性。

图2 基于NJ法构建的Dll4 氨基酸序列进化树
Fig.2 Phylogenetic tree of Dll4 amino acid sequence by NJ method
表3 斑马鱼、人和小鼠Notch配体氨基酸一致性分析
Tab.3 Amino acid identity analysis of Notch ligands in zebrafish,human and mouse %
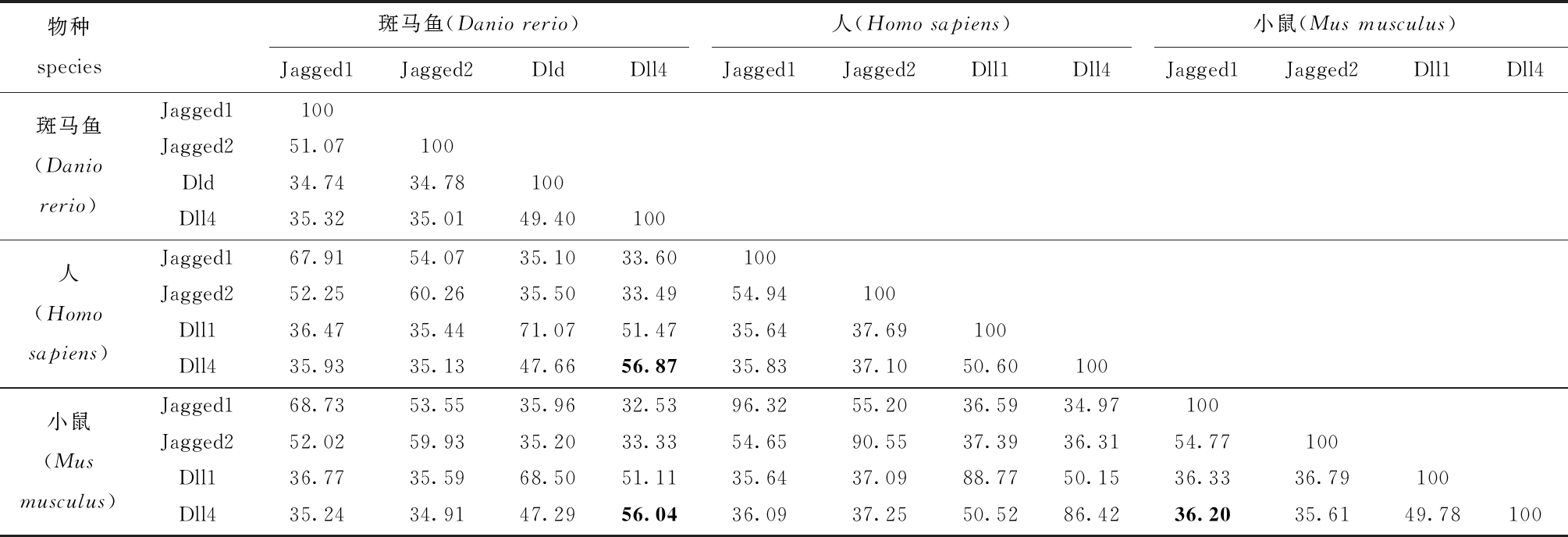
注:加粗标记为斑马鱼与人、小鼠之间的Dll4氨基酸一致性。
Note: the bold is identity of Dll4 amino acid among zebrafish,human and mouse.
物种species斑马鱼(Danio rerio)人(Homo sapiens)小鼠(Mus musculus)Jagged1Jagged2DldDll4Jagged1Jagged2Dll1Dll4Jagged1Jagged2Dll1Dll4斑马鱼(Danio rerio)Jagged1100Jagged251.07100Dld34.7434.78100Dll435.3235.0149.40100人(Homo sapiens)Jagged167.9154.0735.1033.60100Jagged252.2560.2635.5033.4954.94100Dll136.4735.4471.0751.4735.6437.69100Dll435.9335.1347.6656.8735.8337.1050.60100小鼠(Mus musculus)Jagged168.7353.5535.9632.5396.3255.2036.5934.97100Jagged252.0259.9335.2033.3354.6590.5537.3936.3154.77100Dll136.7735.5968.5051.1135.6437.0988.7750.1536.3336.79100Dll435.2434.9147.2956.0436.0937.2550.5286.4236.2035.6149.78100
2.3 smad1和smad7基因启动子转录结合位点及CpG岛预测
从NCBI网站获得斑马鱼smad1和smad7基因的启动子序列,通过Methprimer-Design预测,smad1基因启动子不存在与转录起始相关的CpG岛,smad7基因启动子在序列139~376 bp和457~616 bp处分别存在CG含量大于50%及长度为238 bp和160 bp的CpG岛(图3(a))。采用AliBaba 2.1预测,这两种基因启动子均包含HNF-3、GATA-1和Oct-1等重要转录因子结合位点 (图3(b)、(c))。

红色碱基为转录因子结合位点;蓝色碱基序列为TATA-box;单独碱基为转录起始位点;黑色下划线为上、下游引物。The red base is the transcription factor binding site; The blue base sequence is TATA-box; The individual base is the transcription start site; The black underline is the upstream and downstream primers.
图3 启动子区CpG岛及转录结合位点预测
Fig.3 Prediction of CpG island and transcriptional binding site in promoter region
2.4 斑马鱼dll4基因的扩增及真核表达载体构建
以2 dpf的野生斑马鱼cDNA为模板,用高保真酶进行PCR扩增,获得2 052 bp的单一条带(图4(a)),与预测目的条带位置一致。将其纯化产物连接至载体p3×Flag-CMV并进行菌液PCR,筛选阳性克隆,测序比对与目标序列一致(图4(b))。提取重组质粒p3×Flag-CMV-dll4进行Pst Ⅰ和BamH Ⅰ双酶切验证,得到大小为4 690 bp和2 052 bp的两个条带(图4(c)),证明构建成功。
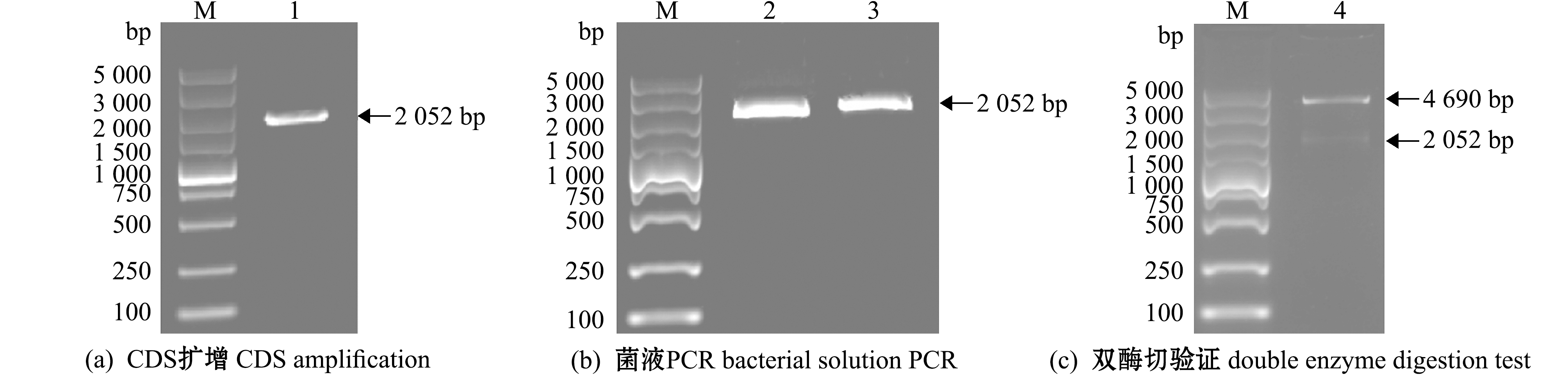
M—DL5000 DNA marker; 1—dll4 CDS片段扩增条带; 2、3—p3×Flag-CMV-dll4菌液PCR条带(3为目的条带); 4—双酶切得到p3×Flag-CMV和dll4条带。M—DL5000 DNA marker; 1—amplification band of dll4 CDS fragment; 2 and 3—p3×Flag-CMV-dll4 bacterial solution PCR band (3 is the target band); 4—p3×Flag-CMV and dll4 bands are obtained by double enzyme digestion fragment.
图4 真核表达载体构建的电泳检测
Fig.4 Electrophoretic detection of eukaryotic expression vector construction
2.5 smad1和smad7启动子报告基因构建及活性检测
以2 dpf的野生斑马鱼cDNA为模板,用高保真酶进行PCR扩增,连接至载体pGL3-Enhancer并进行菌液PCR,将测序结果比对成功的阳性克隆,用Nhe Ⅰ和Xho Ⅰ限制性内切酶进行双酶切验证,分别获得5 064、1 064 bp及5 064、678 bp(图5(a)、(c))的质粒片段和目的片段。双酶切结果显示,斑马鱼smad1和smad7启动子报告基因构建成功。将对照组质粒pGL3-Enhancer和试验组质粒pGL3-smad1-Luc、pGL3-smad7-Luc转染至HEK293T细胞中,并检测双荧光素酶报告基因的活性,结果表明,在HEK293T中,pGL3-smad1-Luc的活性强度为对照组的7.3倍,pGL3-smad7-Luc的活性强度为对照组的142.7倍(图5(b)、(d)),表明两种启动子均具有较好的表达活性。
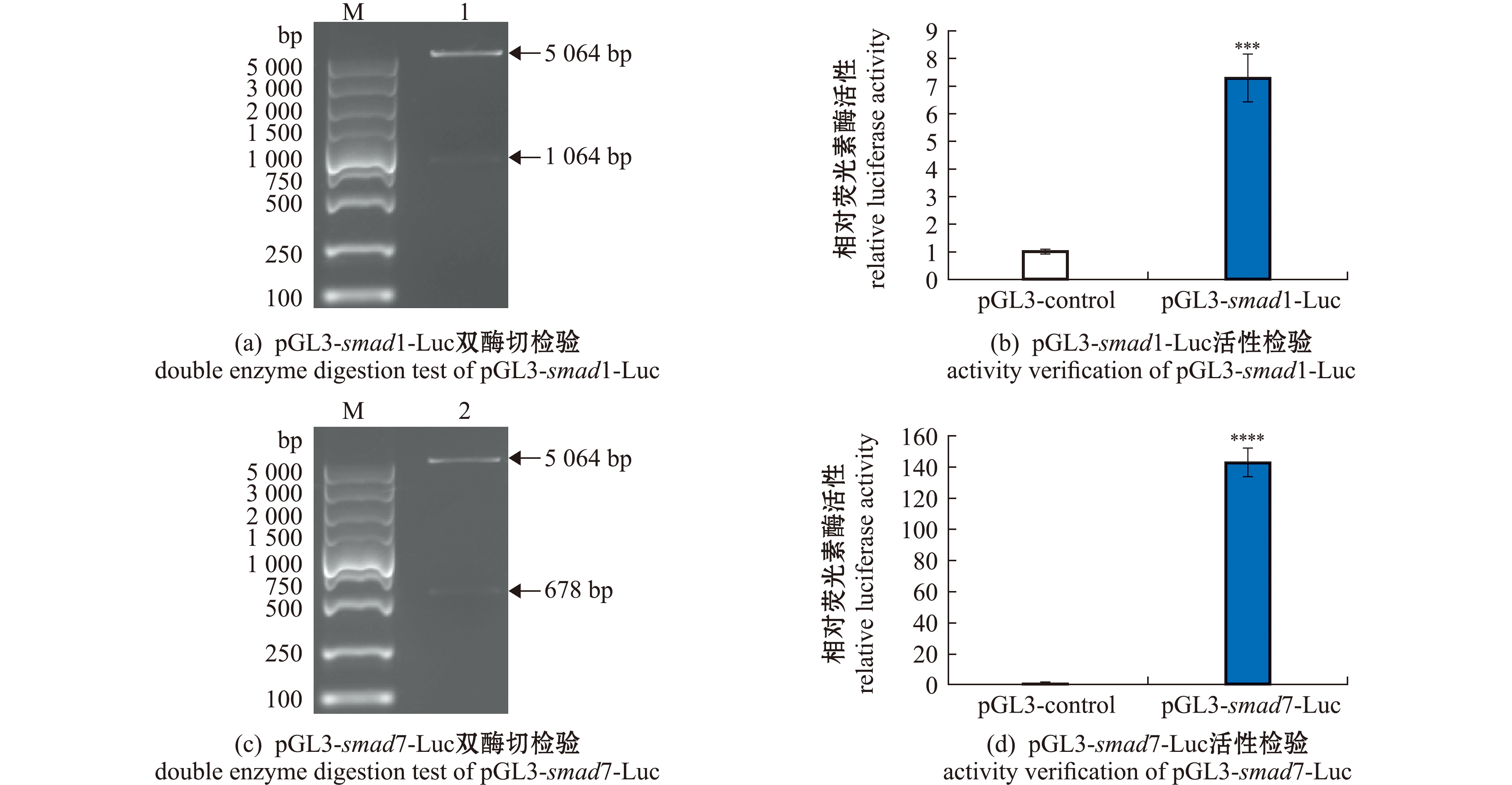
M—DL5000 DNA marker; 1—双酶切得到pGL3和smad1条带;2—双酶切得到pGL3和smad7条带。***表示与对照组有极显著性差异(P<0.001), ****表示与对照组有极显著性差异(P<0.000 1),下同。M—DL5000 DNA marker; 1—pGL3 and smad1 bands are obtained by double enzyme digestion; 2—pGL3 and smad7 bands are obtained by double enzyme digestion.***means very significant difference compared with the control(P<0.001), ****means very significant difference compared with the control(P<0.000 1),et sequentia.
图5 质粒载体pGL3-smad1-Luc和pGL3-smad7-Luc双酶切检验电泳图及活性验证
Fig.5 Double enzyme digestion test electrophoresis and activity verification of pGL3-smad1-Luc and pGL3-smad7-Luc
2.6 dll4对smad1和smad7启动子转录活性的影响
将构建成功的重组质粒p3×Flag-CMV-dll4分别与pGL3-smad1-Luc、pGL3-smad7-Luc启动子报告基因共同转染到 HEK293T细胞中,24 h后进行双荧光素酶报告基因活性检测。结果发现,共转试验组smad1和smad7活性强度明显升高,分别为对照组的2.8倍和2.2倍(图6)。这表明,dll4对smad1和smad7有正向调控作用,可以促进这两种基因的表达。
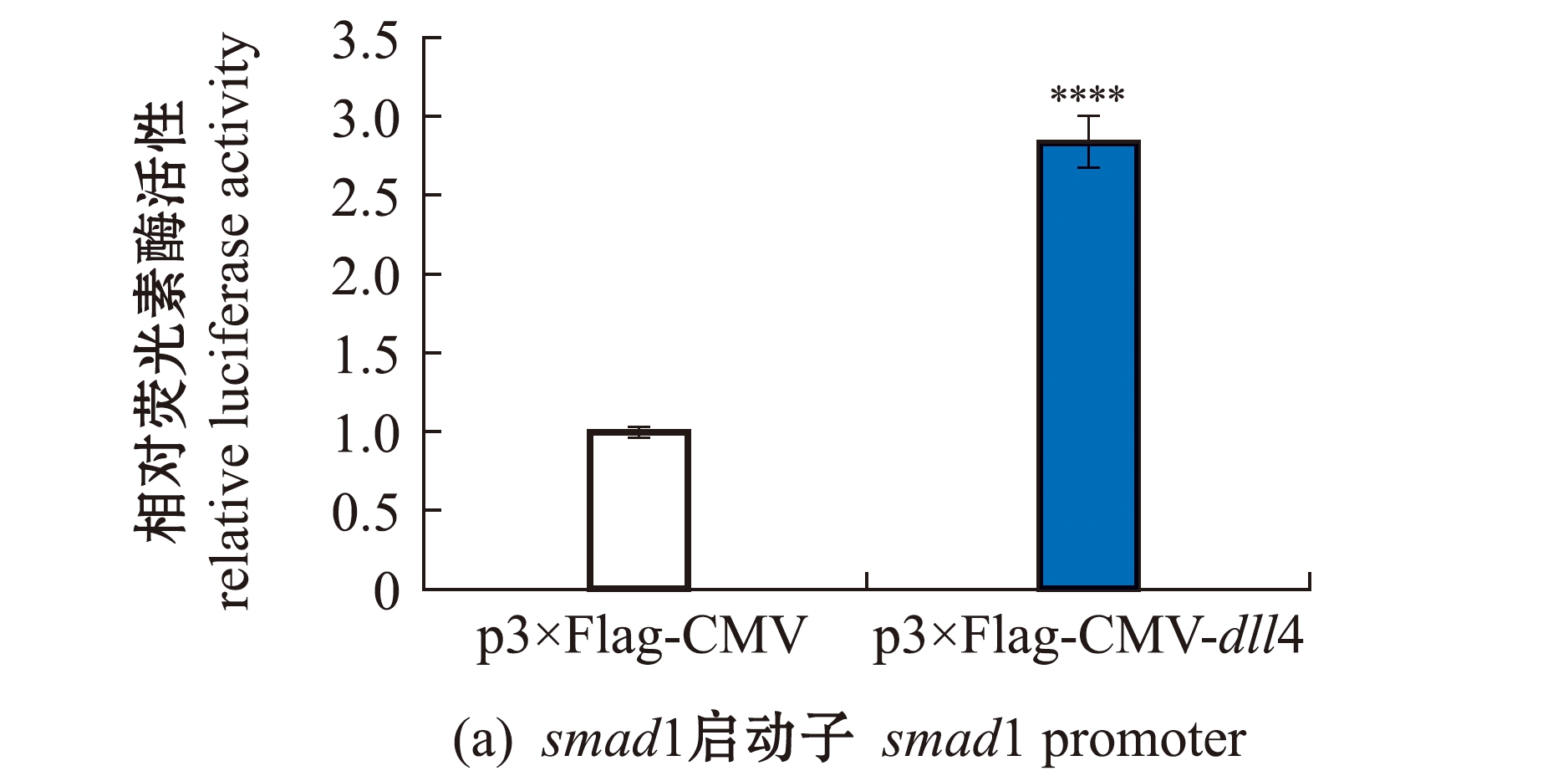
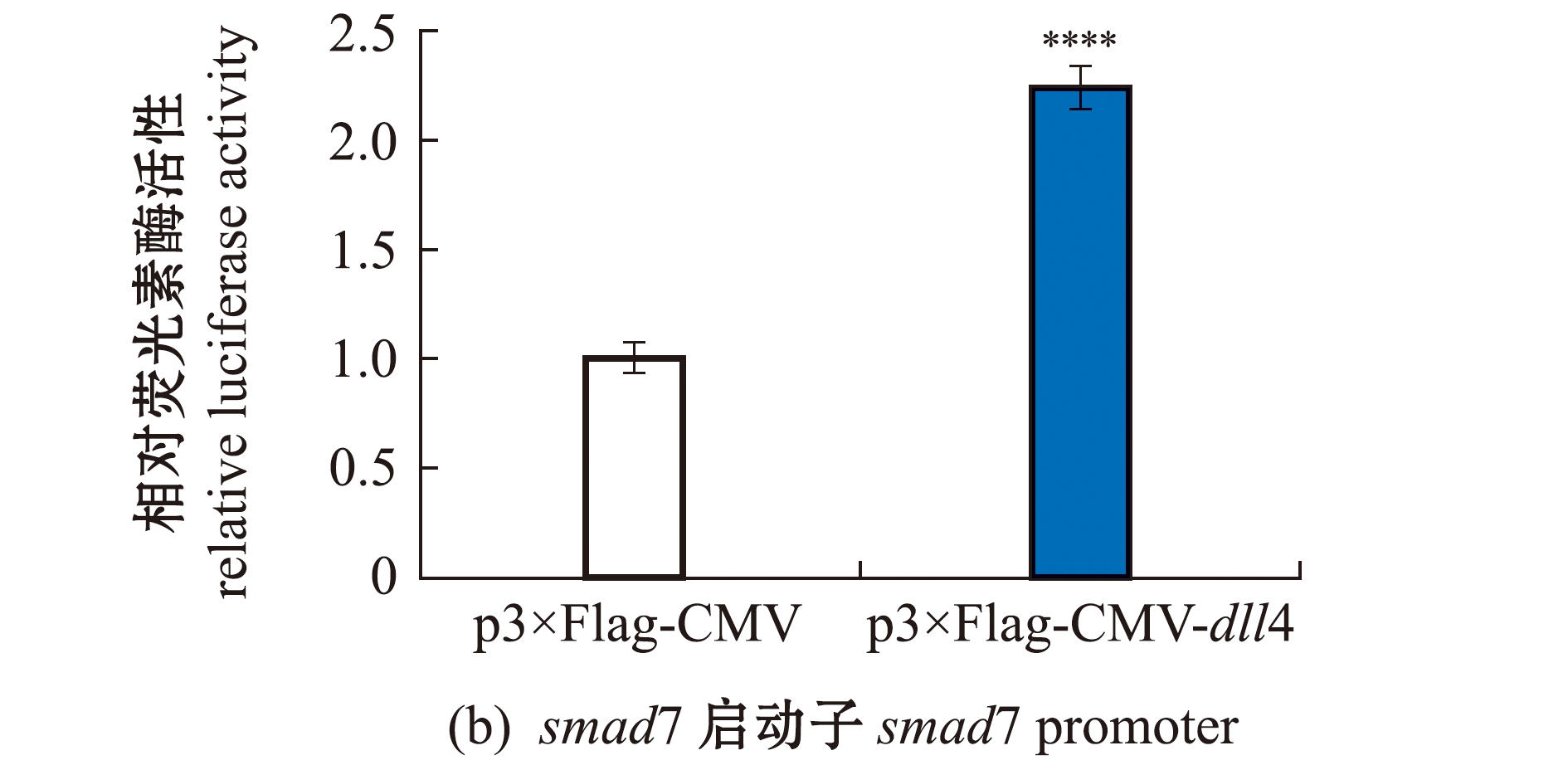
图6 HEK293T细胞中dll4对smad1和smad7启动子转录活性的影响
Fig.6 Effect of dll4 on the transcriptional activity of smad1 and smad7 promoters in HEK293T cell
3 讨论
3.1 Notch-Dll4信号通路的功能分析
Notch信号通路通过受体和配体间的相互作用在决定细胞命运中发挥了核心作用,在动物胚胎发育期间及出生后能够维持各种器官、组织的稳态[15]。血管新生与骨形成之间存在的紧密联系被称为“血管-成骨耦联”,说明血管内皮细胞和成骨细胞间存在分子串扰[16]。Notch受体的Dll4配体作为公认的促血管生成因子,在哺乳动物的血管和骨形成过程中与众多分子存在复杂的调控作用。由于Notch信号通路的受体和配体在不同物种间存在一定的保守性,因此,不同物种间的研究结果具有借鉴意义。血管系统是由动脉、毛细血管和静脉组成的分级网络,血管形成涉及顶端细胞的选择、迁移与增殖,壁细胞的补充,芽的吻合和管腔的形成与生长[17]。研究表明,新生血管参与心血管疾病和恶性肿瘤等重大疾病的发生发展,因此,促进或抑制血管新生对控制疾病发展十分关键[18]。斑马鱼胚胎因其透明易观察,提供了观察活体血管发育的独特机会。斑马鱼与人、小鼠Dll4氨基酸序列的一致性分别为56.87%和56.04%,说明Dll4具有较高的保守性。因此,斑马鱼是研究哺乳动物及硬骨鱼类血管发育的可靠模型。笔者在前期研究dll4 纯合突变体中发现了节间血管与背侧纵向吻合血管连接紊乱的表型,与deltaD突变体的表型类似,这为研究Notch信号通路在血管发育中的机制提供了可靠的试验材料。
3.2 Dll4对Smad家族的调控分析
Smad蛋白的命名来源于线虫蛋白Sma和果蝇蛋白Mad(mothers against decapentaplegic)的原始形式,因此,在蟾蜍、小鼠和人类中均发现了与Mad和Sma类似的基因,这些TGF-β信号转导基因被统一命名为smad。该蛋白介导由TGF-β超家族诱导的信号转导,调节目的基因的转录,参与调节细胞增殖、分化、迁移、创伤和创伤修复等多种生理反应[19]。Delta配体激活Notch信号, BMP激活ALK1来抑制血管内皮生长因子受体的表达,BMP配体磷酸化SMAD1/SMAD5/SMAD8与通用型SMAD4形成复合物,然后易位到细胞核,调节特定基因的表达,使血管按正常方向出芽。抑制型SMAD6/SMAD7作为负向调控信号,静息状态下其主要存在于细胞核内。SMAD7由TGF-β/SMAD信号转录激活后,从细胞核向细胞质穿梭,阻止R-SMAD的磷酸化[20]。Rostama等[21]报道,Notch配体Dll4在人类的动脉内皮细胞中表达,负责初级血管生成,Dll4在体内缺失会影响发育中的血管分支,导致BMP信号的持续改变。本研究中,通过双荧光素酶活性体外试验发现,dll4可以对smad1和smad7基因发挥正向调控作用,与突变体斑马鱼体内dll4基因下调smad1和smad7表达的试验结果一致,进一步验证了斑马鱼dll4可能通过调控smad基因,影响节间血管与背侧纵向吻合血管的生成模式。刘俊银等[22]研究发现,条件性敲除Smad4基因的突变小鼠,成骨细胞的数量明显减少,骨量降低效果十分显著,表明骨细胞中Smad4基因能够促进骨的生长,并调控骨形成。同时,该研究中意外发现,骨细胞中特异性敲除Smad4影响了Notch信号通路,Notch信号的靶基因Hey1、HeyL和Hes1表达降低,且Notch配体Jag1、Dll1和Dll4的表达也显著降低。在骨细胞中,过表达Dll4基因能够显著促进小鼠骨髓基质细胞(bone marrow stromal cells,BMSCs)的早期成骨分化。这些研究结果表明,在小鼠的骨细胞中,Smad4基因可以通过Notch-Dll4信号通路促进骨形成。小鼠中Smad5基因的整体缺失,导致胚胎发育过程中多种血管生成缺陷[23]。栉孔扇贝(Chlamys farreri)的smad5基因可能通过与Toll样受体信号通路相互作用,参与机体的免疫应答[24]。最近在虾夷扇贝(Patinopecten yessoensis)中鉴定出smad3、smad4、smad5和smad6共4个smad基因,因此,Smad家族在水生动物中的功能也引起了研究者的关注[19]。内皮细胞(EC)中固有的BMP响应度的大小是由Notch介导的BMP抑制剂Smad6来调节,当BMP配体水平增加时,Smad6对血管分支频率和角度产生影响,导致分枝化或“灌木状”血管网络[25]。另有研究报道,血管生长依赖血管内皮细胞生长因子信号转导,其配体Vegfa的内皮表达是控制 Notch 依赖性血管生长的关键基因[26]。
Notch-Dll4信号通路与Klf2-Wnt9通路也存在相互作用,决定了受到血流调节的心脏瓣膜瓣叶的形状[10]。Dll4与VEGF、Wnt信号通路基因的调控关系同样具有重要的研究价值(图7)。未来可通过单细胞测序技术,分析不同类型细胞中Dll4-Notch信号通路与其他信号通路之间的相互作用。以上结果表明,Smad分子不仅能通过Notch信号通路配体Dll4调控骨形成,也能调控血管发育。Notch信号调控许多发育过程,同时也与包括BMP在内的TGF-β家族、VEGF信号通路、Wnt信号通路相互作用,对血管生成产生影响。Notch信号通路配体Dll4与Smad家族其他成员(如Smad5、Smad6和Smad8)的调控关系有待进一步研究。

黑色箭头—促进;红色箭头—抑制;蓝色P—磷酸化;虚线—本研究成果;实线—文献已知。VEGF—血管内皮细胞生长因子;VEGFR—血管内皮细胞生长因子受体;NICD—Notch胞内结构域;CSL—转录因子;EHD2—Epsin 15同源结构域;BMP—骨形态发生蛋白;ALK1—激活素受体样激酶1。Black arrow—promote; Red arrow—suppress; Blue P—phosphorylation; Dotted line—the research results in this paper; Solid line—known in the literature.VEGF—vascular endothelial growth factor; VEGFR—vascular endothelial growth factor receptor; NICD—notch intracellular domain; CSL—CBF1/Suppressor of Hairless/Lag1; EHD2—Epsin 15 homology domain containing 2; BMP—bone morphogenic proteins; ALK1—activin receptor like kinase 1.
图7 Dll4对Smad分子的调控网络图
Fig.7 Network diagram of Dll4 regulation of Smad
3.3 smad1和smad7基因启动子重要转录结合位点的作用分析
本研究中,利用 AliBaba 2.1在线分析软件预测pGL3-smad1-Luc 和 pGL3-smad7-Luc含有多种转录结合位点,其中,两种启动子共有的HNF-3、GATA-1和Oct-1等转录结合位点对血管发育具有重要影响。研究显示,哺乳动物HNF-3能够抑制肺癌形成过程中的上皮-间充质转分化过程,有阻碍肺癌的形成、增殖和扩散的作用[27];GATA-1作为红系分化关键性调控因子对红细胞的生成是必需的[28];Oct-1在食管癌、胃癌、宫颈癌和前列腺癌等多种癌症中均出现过表达的现象[29]。由此可知,肿瘤微环境内的许多细胞类型(如内皮细胞)均有助于血管生成,3种转录结合位点与血管生成的关系密不可分。同时,软件预测smad7基因启动子存在CpG岛,癌症也与CpG岛息息相关,如果抑癌基因启动子区域的CpG岛被甲基化,抑癌基因就会被沉默,无法发挥功能。在癌症中,Dll4影响肿瘤生长、肿瘤血管系统和肿瘤免疫[30],能否通过Smad蛋白靶向抑制肿瘤细胞扩增和探求癌症发病机理仍需深入研究。至于dll4对smad1和smad7基因发挥调控作用的具体转录结合位点,后续可以通过寻找核心启动子进行确定。
4 结论
1)与野生型斑马鱼相比,dll4-/-基因型的斑马鱼 smad1和smad7基因表达量均显著性降低。
2)斑马鱼和哺乳动物Dll4氨基酸序列的一致性高达56%以上,表明Dll4具有较高的保守性。
3)smad1和smad7两种基因启动子都包含HNF-3、GATA-1和Oct-1等重要转录因子结合位点,表明这两种基因与血管生成密不可分。
4)dll4真核表达载体能够在HEK293T细胞中对smad基因家族的2个成员smad1和smad7启动子报告基因有正向调控作用,使其活性明显提高。
[1] YANG L,WANG X H,SUN J W,et al.Neuritin promotes angiogenesis through inhibition of DLL4/Notch signaling pathway[J].Acta Biochimica et Biophysica Sinica,2021,53(6):663-672.
[2] WIMMER R A,LEOPOLDI A,AICHINGER M,et al.Human blood vessel organoids as a model of diabetic vasculopathy[J].Nature,2019,565(7740):505-510.
[3] DE JONG J L O,ZON L I.Use of the zebrafish system to study primitive and definitive hematopoiesis[J].Annual Review of Genetics,2005,39:481-501.
[4] MARTIN M M,BUCKENBERGER J A,JIANG J M,et al.TGF-beta1 stimulates human AT1 receptor expression in lung fibroblasts by cross talk between the Smad,p38 MAPK,JNK,and PI3K signaling pathways[J].American Journal of Physiology Lung Cellular and Molecular Physiology,2007,293(3):L790-L799.
[5] LI S N,WU J F.TGF-β/SMAD signaling regulation of mesenchymal stem cells in adipocyte commitment[J].Cellular Signalling,2020,11(1):41-51.
[6] JARAD M,KUCZYNSKI E A,MORRISON J,et al.Release of endothelial cell associated VEGFR2 during TGF-β modulated angiogenesis in vitro[J].BMC Cell Biology,2017,18(1):10.
[7] LARRIV E B,PRAHST C,GORDON E,et al.ALK1 signaling inhibits angiogenesis by cooperating with the Notch pathway[J].Developmental Cell,2012,22(3):489-500.
E B,PRAHST C,GORDON E,et al.ALK1 signaling inhibits angiogenesis by cooperating with the Notch pathway[J].Developmental Cell,2012,22(3):489-500.
[8] 刘云,王丛丛,郭亚南,等.海七鳃鳗pma-miR-200c-3p对斑马鱼心脏发育的作用研究[J].大连海洋大学学报,2016,31(5):510-515.
LIU Y,WANG C C,GUO Y N,et al.Functional effects of pma-miR-200c-3p of sea lamprey on heart development of zebrafish[J].Journal of Dalian Ocean University,2016,31(5):510-515.(in Chinese)
[9] LIU L,ZENG P,YANG X,et al.Inhibition of vascular calcification[J].Arterioscler Thromb Vasc Biol,2018,38(10):2382-2395.
[10] PAOLINI A,FONTANA F,PHAM V C,et al.Mechanosensitive Notch-Dll4 and Klf2-Wnt9 signaling pathways intersect in guiding valvulogenesis in zebrafish[J].Cell Reports,2021,37(1):109782.
[11] ZHANG Y W,GU X F,LI D,et al.METTL3 regulates osteoblast differentiation and inflammatory response via smad signaling and MAPK signaling[J].International Journal of Molecular Sciences,2019,21(1):199.
[12] LESLIE J D,ARIZA-MCNAUGHTON L,BERMANGE A L,et al.Endothelial signalling by the Notch ligand delta-like 4 restricts angiogenesis[J].Development,2007,134(5): 839-844.
[13] WEBB A M,FRANCIS C R,JUDSON R J,et al.EHD2 modulates Dll4 endocytosis during blood vessel development[J].Microcirculation,2021,25:e12740.
[14] 杜璇,王子睿,包林珠,等.斑马鱼deltaD基因对血管内皮生长因子家族基因(vegfaa和flt4)的调控作用[J].基因组学与应用生物学,2022,41(4): 742-751.
DU X,WANG Z R,BAO L Z,et al.Regulation of deltaD gene on vascular endothelial growth factor family genes (vegfaa and flt4) in zebrafish[J].Genomics and Applied Biology,2022,41(4): 742-751.(in Chinese)
[15] MUGURUMA Y,HOZUMI K,WARITA H,et al.Maintenance of bone homeostasis by DLL1-mediated Notch signaling[J].Journal of Cellular Physiology,2017,232(9):2569-2580.
[16] RAMASAMY S K,KUSUMBE A P,WANG L,et al.Endothelial Notch activity promotes angiogenesis and osteogenesis in bone[J].Nature,2014,507(7492):376-380.
[17] HERBERT S P,STAINIER D Y R.Molecular control of endothelial cell behaviour during blood vessel morphogenesis[J].Nature Reviews Molecular Cell Biology,2011,12(9):551-564.
[18] 方子寒,漆仲文,谢盈彧,等.中药对斑马鱼血管新生干预作用的研究进展[J].中草药,2018,49(14):3441-3445.
FANG Z H,QI Z W,XIE Y Y,et al.Intervention of Chinese materia medica in angiogenesis of zebrafish[J].Chinese Traditional and Herbal Drugs,2018,49(14):3441-3445.(in Chinese)
[19] 潘好远,戴晓婷,胡乃娜,等.虾夷扇贝smad基因家族的鉴定及表达分析[J].中国海洋大学学报(自然科学版),2021,51(3):54-64.
PAN H Y,DAI X T,HU N N,et al.Genome-wide identification and expression profiling of the smad family genes in a bivalve mollusc Patinopecten yessoensis[J].Periodical of Ocean University of China(Natural Science Edition),2021,51(3):54-64.(in Chinese)
[20] NICKLAS D,SAIZ L.Computational modelling of Smad-mediated negative feedback and crosstalk in the TGF-β superfamily network[J].Journal of the Royal Society,Interface,2013,10(86):20130363.
[21] ROSTAMA B,TURNER J E,SEAVEY G T,et al.DLL4/Notch1 and BMP9 interdependent signaling induces human endothelial cell quiescence via P27KIP1 and thrombospondin-1[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2015,35(12):2626-2637.
[22] 刘俊银,冯玮,涂小林.Smad4促进成骨分化的机制研究[J].中国骨质疏松杂志,2019,25(5):600-605,655.
LIU J Y,FENG W,TU X L.Mechanism of the stimulation of osteoblast differentiation by Smad4[J].Chinese Journal of Osteoporosis,2019,25(5):600-605,655.(in Chinese)
[23] UMANS L,COX L,TJWA M,et al.Inactivation of Smad5 in endothelial cells and smooth muscle cells demonstrates that Smad5 is required for cardiac homeostasis[J].The American Journal of Pathology,2007,170(5):1460-1472.
[24] MOUILLESSEAUX K P,WILEY D S,SAUNDERS L M,et al.Notch regulates BMP responsiveness and lateral branching in vessel networks via SMAD6[J].Nature Communications,2016,7:13247.
[25] 董正,曾启繁,刘亮洁,等.栉孔扇贝smad基因家族的表达特征和对鳗弧菌侵染的免疫应答分析[J].海洋与湖沼,2021,52(5):1273-1283.
DONG Z,ZENG Q F,LIU L J,et al.Expression characteristics of smad gene family and its immune response to Vibrio anguillarum infection in Chlamys farreri[J].Oceanologia et Limnologia Sinica,2021,52(5):1273-1283.(in Chinese)
[26] PARAB S,QUICK R E,MATSUOKA R L.Endothelial cell-type-specific molecular requirements for angiogenesis drive fenestrated vessel development in the brain[J].eLife,2021,10:e64295.
[27] TANG Y N,SHU G W,YUAN X W,et al.FOXA2 functions as a suppressor of tumor metastasis by inhibition of epithelial-to-mesenchymal transition in human lung cancers[J].Cell Research,2011,21(2):316-326.
[28] 胡彩艳,张慧洁,付成冰,等.低氧下miR-451a对K562细胞向红系分化过程的影响[J].中国实验血液学杂志,2020,28(6):2071-2078.
HU C Y,ZHANG H J,FU C B,et al.Effect of miR-451a on erythroid differentiation of K562 cells under hypoxia[J].Journal of Experimental Hematology,2020,28(6):2071-2078.(in Chinese)
[29] WANG Z P,ZHU S J,SHEN M,et al.STAT3 is involved in esophageal carcinogenesis through regulation of Oct-1[J].Carcinogenesis,2013,34(3):678-688.
[30] XIU M X,LIU Y M,KUANG B H.The role of DLLs in cancer:a novel therapeutic target[J].Onco Targets and Therapy,2020,13:3881-3901.