谷氨酸是一种重要的兴奋性神经递质,能通过谷氨酸受体参与中枢神经系统突触传递等重要生理活动[1]。谷氨酸受体可分为两种,即代谢型谷氨酸受体和离子型谷氨酸受体[2]。其中,离子型谷氨酸受体包括N-甲基-D-天冬氨酸受体(NMDAR)、α-氨基-3-羟基-5-甲基-4-异恶唑烯丙酸受体(AMPAR)和海人藻酸受体(kainate receptor, KAR)[3]。海人藻酸受体在神经系统中广泛表达,在神经递质释放、突触传递及神经兴奋性传递等神经功能中发挥重要作用[4]。最近的一项研究发现了谷氨酸受体传递冷信号的新功能:线虫海人藻酸谷氨酸受体GLR3基因编码了一种冷感受受体,其功能在进化上保守,作为GLR3的小鼠同源基因Gluk2,也能在背根神经节感觉神经元中介导冷感知,从而触发小鼠躲避寒冷的行为[5],这使人们对谷氨酸受体基因有了新的认识。Grik1与Gluk2同属海人藻酸谷氨酸受体家族,对其研究主要集中在神经功能上,在低温胁迫响应功能方面鲜见报道,仍待进一步探究。本研究团队前期对生活在温/热带的鱼类与分布在南极圈内的南极鱼进行比较转录组分析时发现,谷氨酸受体基因在南极鱼大脑组织中特异高表达[6],这进一步暗示谷氨酸受体基因与鱼类低温胁迫响应机制间存在潜在联系。
水温是影响水生生物生理和行为的重要外在因素[7-8],低温会引发其强烈的生理和行为反应[9-10],如造成严重的组织损伤,甚至危及生命[11]。尼罗罗非鱼(Oreochromis niloticus)生长速度快、生产成本低,是世界范围内一种重要的养殖经济水产品,其长期生活在热带和亚热带地区,低温耐受能力较弱,由于无法应对寒潮来袭时温度的骤降,罗非鱼常因此大量死亡[12]。而南极独角雪冰鱼(Chionodmco hamatus)分布在寒冷的南极海域,能抵御南极圈极端的低温环境[13]。这两种不同温度分布范围的鱼类为研究温度响应的分子机制提供了绝佳的材料。
研究表明,低温胁迫与细胞凋亡通路息息相关,罗非鱼在8 ℃低温胁迫12 h后,鳃细胞凋亡率显著增高[14]。细胞凋亡是基因控制细胞的自我消亡过程,对于机体维持稳态和正常生理功能具有重要意义[15-16]。本研究中,克隆了南极独角雪冰鱼和尼罗罗非鱼的谷氨酸受体Grik1基因,并探究了其在低温胁迫下对细胞凋亡的影响,以期发现一种与鱼类低温胁迫响应能力相关的基因,为深入研究鱼类低温胁迫响应机制提供科学参考。
1 材料与方法
1.1 材料
南极独角雪冰鱼取自南极海域。取1尾体长约为35 cm、体质量约为500 g的南极独角雪冰鱼,立即采集其大脑和眼组织,置于RNAlater(Sigma-Aldrich,R0901)中,然后于-80 ℃超低温冰箱中保存备用。
尼罗罗非鱼取自广西水产科学院,并在实验室条件下养殖。取1尾6月龄、体质量约为500 g的罗非鱼进行解剖,采集眼组织,置于RNAlater(Sigma-Aldrich,R0901)中,于-80 ℃超低温冰箱保存备用。
1.2 方法
1.2.1 总RNA提取及cDNA合成 利用Trizol(Invitrogen,15596026)提取南极独角雪冰鱼脑和眼组织,以及尼罗罗非鱼眼组织的总RNA,用NanoDrop 2000c超微量分光光度计(Thermo Scientific)和琼脂糖凝胶电泳检测总RNA的浓度和质量,对质量合格的总RNA进行反转录(TaKaRa,RR047A),获得cDNA,于-20 ℃下保存备用。
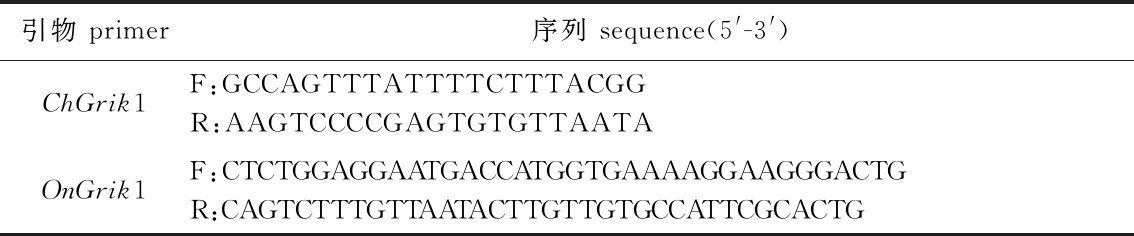
1.2.2 Grik1基因克隆 根据核苷酸序列设计包含蛋白编码序列(coding sequence, CDS)的引物(表1),以cDNA为模板,对其CDS进行PCR扩增。南极独角雪冰鱼扩增反应程序:95 ℃下预变性10 min;95 ℃下变性30 s,55 ℃下退火45 s,72 ℃下延伸3 min,共进行38个循环;最后在72 ℃下再延伸10 min。尼罗罗非鱼扩增反应程序中,除退火温度改为62.5 ℃外,其他条件同上。
表1 Grik1基因克隆引物
Tab.1 Primers of Grik1 gene cloning
注:Ch表示南极独角雪冰鱼;On表示尼罗罗非鱼。
Note: Ch represents Chionodmco hamatus; On represents Oreochromis niloticus.
引物 primer序列 sequence(5'-3')ChGrik1F:GCCAGTTTATTTTCTTTACGGR:AAGTCCCCGAGTGTGTTAATAOnGrik1F:CTCTGGAGGAATGACCATGGTGAAAAGGAAGGGACTGR:CAGTCTTTGTTAATACTTGTTGTGCCATTCGCACTG
PCR产物经琼脂糖凝胶电泳检测,并对目的条带进行纯化回收[天根生化科技(北京)有限公司,DP209],检测浓度与质量后于-20 ℃下保存备用。
1.2.3 Grik1过表达载体构建 使用同源重组[Seamless Cloning Master Mix,生工生物工程(上海)股份有限公司,B632219]的方法将南极独角雪冰鱼和尼罗罗非鱼的Grik1插入到真核表达载体pcDNA3.1(+)上,构建过表达载体。用无内毒素质粒小提中量试剂盒[天根生化科技(北京)有限公司,DP118]提取空载质粒pcDNA3.1-ctrl、南极独角雪冰鱼Grik1过表达质粒pcDNA3.1-ChGrik1和尼罗罗非鱼Grik1过表达质粒pcDNA3.1-OnGrik1,于-20 ℃下保存备用。
1.2.4 细胞凋亡检测 于12孔板各孔中接种20~30万个293T细胞(人类肾细胞),当细胞达到60%~70%汇合度时,利用Lipo293TM转染试剂(上海碧云天生物技术有限公司,C0521)分别将pcDNA3.1-ctrl、pcDNA3.1-ChGrik1和pcDNA3.1-OnGrik1对293T细胞进行转染。转染后置于37 ℃、5% CO2条件下培养24 h。然后将细胞置于对照组(37 ℃)和低温胁迫组(28、18、8 ℃)处理48 h,用Annexin V-PE/7-AAD Apoptosis Detection Kit(诺唯赞,A213)和流式细胞仪(BD Accuri C6)检测细胞凋亡情况。使用Prism 9软件的T检验对凋亡细胞比率进行统计检验分析。
1.2.5 转录组分析 由于8 ℃低温胁迫诱导的细胞凋亡最为显著,因此,与“1.2.4节”中处理方法相同,分别提取pcDNA3.1-ctrl、pcDNA3.1-ChGrik1和pcDNA3.1-OnGrik1转染后在对照组(37 ℃)与低温胁迫组(8 ℃)处理48 h的人源293T细胞的RNA,进行转录组文库构建及Illumina Hiseq X10平台测序。下机数据过滤得到clean data,使用Homo_sapiens.GRCh38.genome.fa (Ensemble)作为参考基因组,利用HISAT2软件进行序列比对,用StringTie进行定量,采用FPKM法(fragments per kilobase of exon model per million mapped fragments)计算基因表达水平。
本试验中以37 ℃为对照组,8 ℃低温胁迫为处理组,使用 R软件中的Edge R包进行样品组间的差异表达分析,得到差异表达基因集。在差异表达基因检测过程中,将log2(fold change)≥1且P<0.01作为筛选标准。
2 结果与分析
2.1 两种鱼Grik1基因的克隆及过表达载体构建
根据实验室前期数据对南极独角雪冰鱼Grik1核苷酸序列和氨基酸序列进行预测,发现其开放阅读框(open read frame, ORF)为2 568 bp,可编码855个氨基酸的蛋白(相对分子质量为96 585);根据NCBI数据库对尼罗罗非鱼Grik1的核苷酸和氨基酸序列进行分析,发现其ORF为2 616 bp,可编码871个氨基酸的蛋白(相对分子质量为98 607.58)。克隆得到南极独角雪冰鱼和尼罗罗非鱼的Grik1基因(图1、图2),起始密码子均为ATG,终止密码子均为TAA,并将其插入到真核表达载体pcDNA3.1(+)上,构建其过表达载体(图3)。

图1 南极独角雪冰鱼Grik1核苷酸序列及其编码的氨基酸序列
Fig.1 Nucleotides and coded amino acid sequences of Chionodmco hamatus Grik1

图2 尼罗罗非鱼Grik1核苷酸序列及其编码氨基酸序列
Fig.2 Nucleotides and encoded amino acid sequences of Oreochromis niloticus Grik1
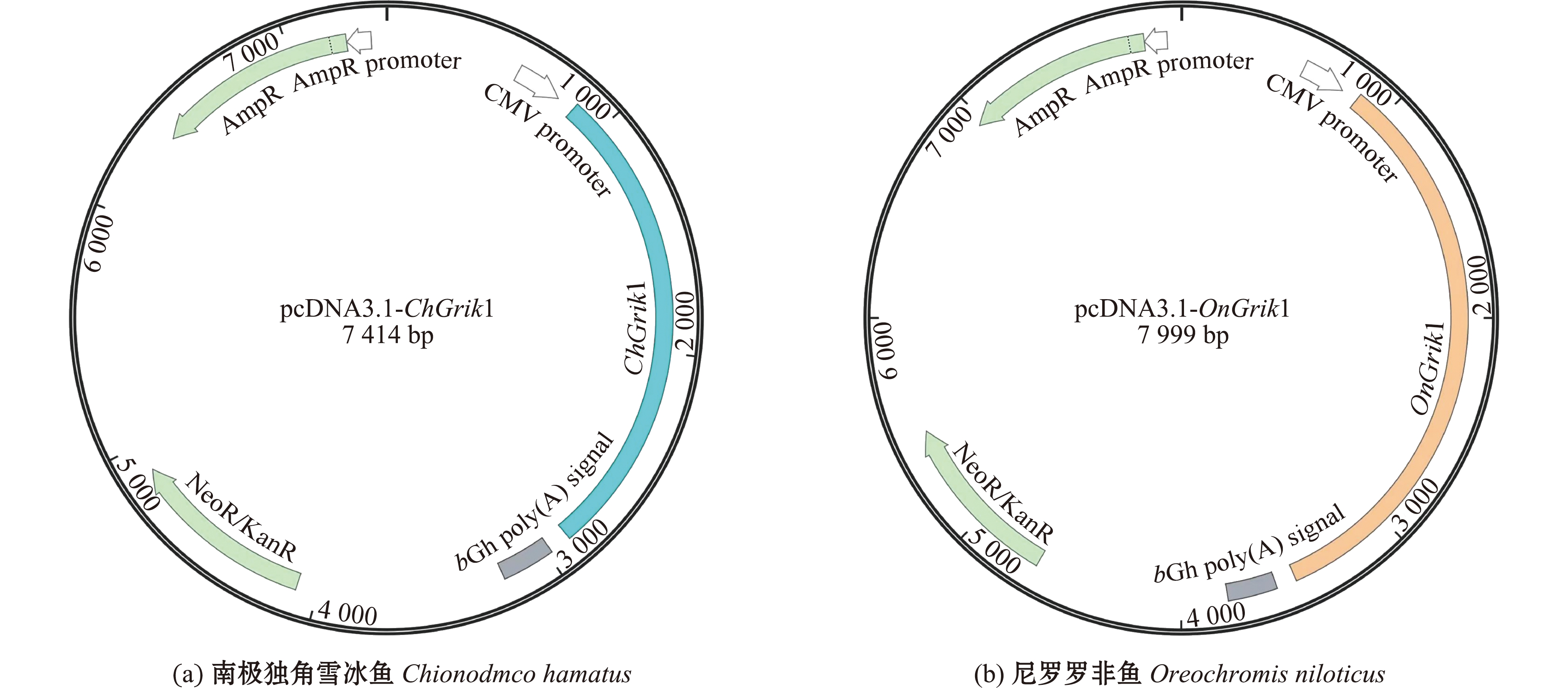
CMV—启动子;Ch—南极独角雪冰鱼;On—尼罗罗非鱼;AmpR—氨苄抗性。CMV—promoter; Ch—Chionodmco hamatus; On—Oreochromis niloticus; AmpR—ampicillin resistance.
图3 质粒结构示意图
Fig.3 Structure of plasmids
2.2 低温胁迫下两种鱼过表达Grik1对293T细胞凋亡的影响
从表2可见:在37 ℃正常培养温度下,空载质粒、过表达南极独角雪冰鱼Grik1和过表达尼罗罗非鱼Grik1 3组间的细胞凋亡率无显著性差异(P>0.05);低温胁迫诱导细胞凋亡,随着温度的降低,细胞凋亡率逐渐升高,并在8 ℃时达到最高(P<0.05);在28、18、8 ℃低温胁迫处理下,过表达南极独角雪冰鱼和尼罗罗非鱼Grik1相比空载组,均能显著降低细胞凋亡率2%~5%(P<0.05)。
表2 低温胁迫下不同处理组的细胞凋亡率
Tab.2 Cell apoptosis rate in different groups under cold stress

注:ctrl表示空载组;ChGrik1表示过表达南极独角雪冰鱼Grik1组;OnGrik1表示过表达尼罗罗非鱼Grik1组,下同。同列或同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note: ctrl represents pcDNA3.1(+) group; ChGrik1 represents Chionodmco hamatus Grik1 over expression group; OnGrik1 represents Oreochromis niloticus Grik1 over expression group,et sequentia. The means with different letters within the same column or line are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column or line are not significant differences.
组别group细胞凋亡率 cell apoptosis rate/%37 ℃28 ℃18 ℃8 ℃ctrl3.37±2.10a5.43±0.65b10.77±1.16d92.43±0.46fChGrik12.07±0.52a2.57±0.25 a7.43±0.87c88.23±1.03eOnGrik14.60±0.43a3.17±0.21a7.03±0.66 c87.67±1.35e
2.3 低温胁迫下两种鱼过表达Grik1对差异表达基因数目的影响
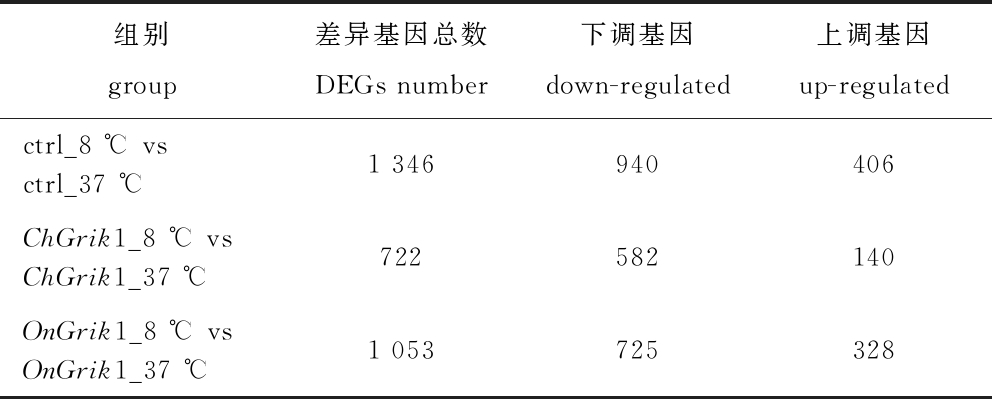
与正常培养温度37 ℃对照组相比,8 ℃低温胁迫下处理48 h的细胞差异表达基因数目如表3和图4所示。空载ctrl组共有1 346个差异表达基因,其中,下调940个,上调406个;过表达ChGrik1组共有722个差异表达基因,其中,下调582个,上调140个;过表达OnGrik1组共有1 053个差异表达基因,其中,下调725个,上调328个(表3)。这表明在8 ℃低温胁迫下,过表达OnGrik1减少受到低温胁迫的差异表达基因数目没有过表达ChGrik1显著。
表3 不同处理组差异表达基因的筛选
Tab.3 Screening of differentially expressed genes (DEGs) in different groups
组别group差异基因总数DEGs number下调基因down-regulated上调基因up-regulatedctrl_8 ℃ vs ctrl_37 ℃1 346940406ChGrik1_8 ℃ vs ChGrik1_37 ℃722582140OnGrik1_8 ℃ vs OnGrik1_37 ℃1 053725328
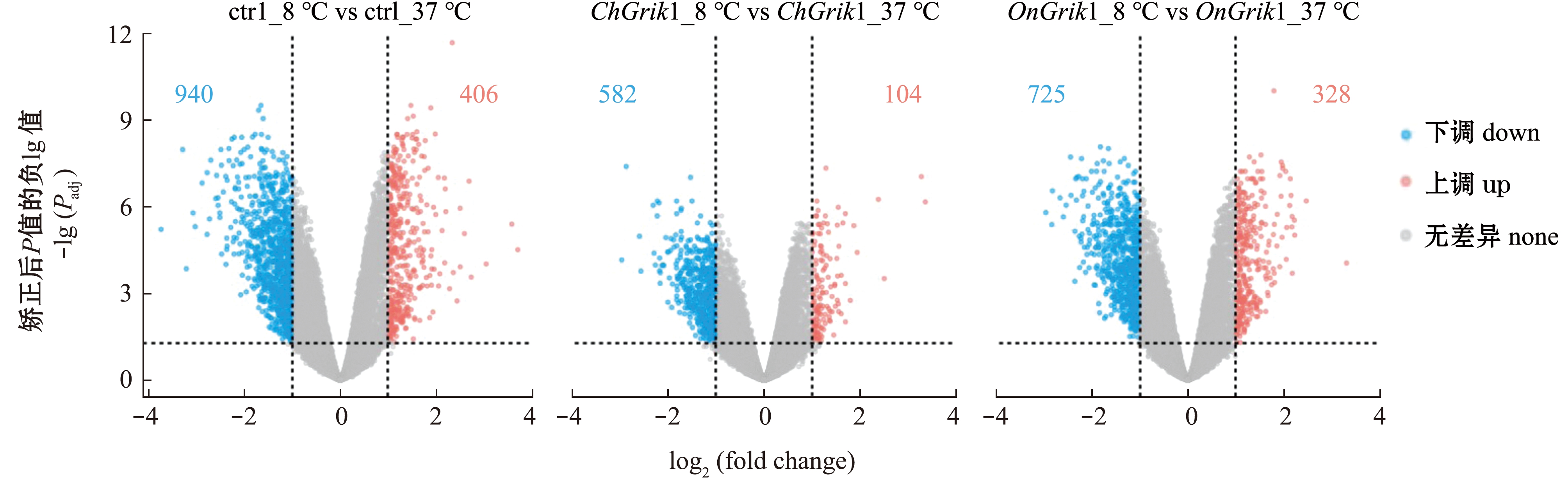
图4 8 ℃低温胁迫48 h后各组别差异表达基因火山图
Fig.4 Volcano plot of differentially expressed genes (DEGs) in every group under 8 ℃ cold stress for 48 h
2.4 低温胁迫下两种鱼过表达Grik1对细胞凋亡相关基因表达的影响
与正常培养温度37 ℃对照组相比,8 ℃低温胁迫处理48 h的细胞在过表达ChGrik1组和空载ctrl组有350个基因表达趋势均为下调,78个基因表达趋势均为上调;有587个基因在空载ctrl组表达下调,327基因表达上调,但这些基因在过表达ChGrik1组差异表达不显著;有231个基因在过表达ChGrik1组表达下调,59个基因表达上调,但这些基因在空载ctrl组差异表达不显著;有4个基因在空载ctrl组与过表达ChGrik1组表达趋势完全相反,即3个基因STC2(stanniocalcin 2)、CHAC1(glutathione specific gamma-glutamylcyclotransferase 1)和NUPR1(nuclear protein 1)在空载ctrl组表达下调,但在过表达ChGrik1组表达上调,1个基因HSPA1B(heat shock protein family A member 1B)在空载ctrl组表达上调,但在过表达ChGrik1组表达下调(图5(a)、(b))。
与正常培养温度37 ℃对照组相比,8 ℃低温胁迫处理48 h的细胞在过表达OnGrik1组和空载ctrl组有429个基因表达趋势均为下调,157个基因表达趋势均为上调;有509个基因在空载ctrl组表达下调,245基因表达上调,但这些基因在过表达OnGrik1组差异表达不显著;有292个基因在过表达OnGrik1组表达下调,169个基因表达上调,但这些基因在空载ctrl组差异表达不显著;有6个基因在空载ctrl组与过表达OnGrik1组表达趋势完全相反,即2个基因CHAC1和NUPR1在空载ctrl组表达下调,但在过表达OnGrik1组差异表达上调,4个基因H2AC11(H2A clustered histone 11)、H2BC21(H2B clustered histone 21)、H3C2(H3 clustered histone 2)和HSPA1A1(heat shock protein family A member 1A)在空载ctrl组表达上调,但在过表达OnGrik1组差异表达下调(图5(c)、(d))。
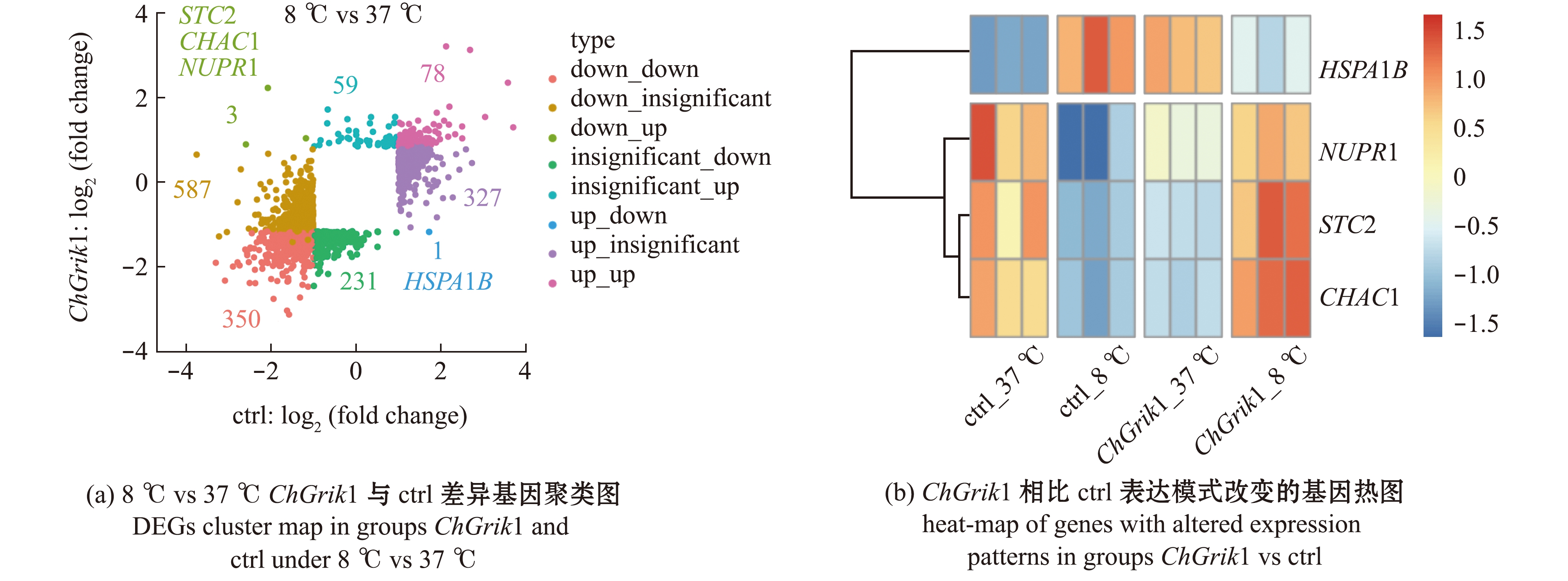
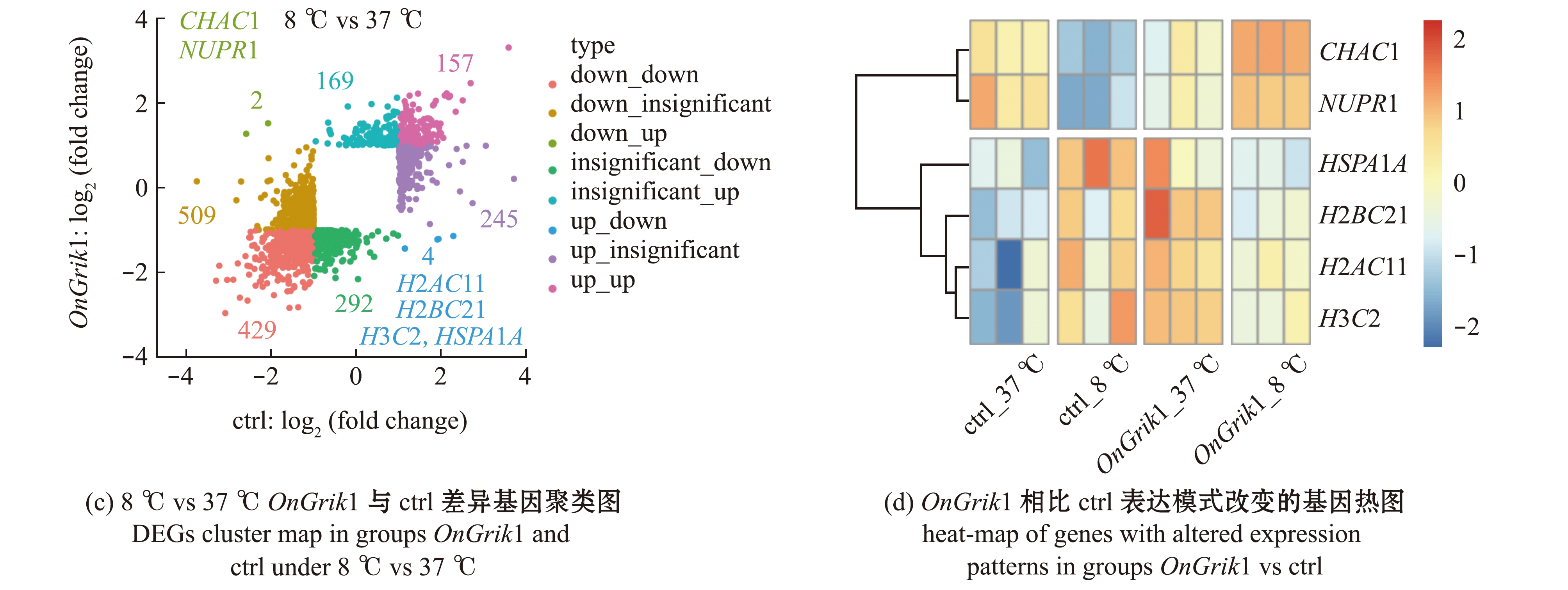
图5 8 ℃低温处理48 h后过表达基因Grik1组与空载组差异表达基因的聚类图和热图
Fig.5 Cluster map and heat-map of differentially expressed genes (DEGs) between Grik1 and pcDNA3.1(+) groups under 8 ℃ cold stress for 48 h
3 讨论
3.1 低温胁迫下Grik1对细胞凋亡的影响
Grik1作为一种离子型谷氨酸受体,在神经系统中的功能被广泛研究,如介导神经元间化学信号的传递和突触可塑性,但对其响应低温胁迫的功能研究较少[17-18]。本研究中发现,过表达鱼类的海人藻酸受体基因Grik1能显著降低低温胁迫诱导的细胞凋亡,暗示Grik1可以通过减少细胞凋亡对低温胁迫做出响应。
细胞凋亡是基因控制细胞的自我消亡过程,对于机体维持稳态和正常生理功能具有重要意义[16],NUPR1作为转录调节因子,能感知来自环境的压力信号,使细胞适应外在环境压力并抵抗细胞凋亡[19]。研究发现,在乳腺癌及胰腺癌细胞中,NUPR1可以通过转录因子RelB及早期应答基因等抑制凋亡从而帮助细胞抵御压力[20]。而STC2可以调节内质网应激反应促进细胞存活并阻止细胞凋亡[21]。研究发现,在前列腺癌细胞中,沉默STC2基因的表达,能下调抑凋亡基因Bcl2表达,上调促凋亡基因Bax表达,从而显著增加细胞凋亡[22]。CHAC1编码一种谷胱甘肽特异性γ-谷氨酰环转移酶,可能会诱导双重信号,造成细胞周期停滞,使细胞有时间适应压力[23]。通过对本研究中转录组分析发现,在低温胁迫下,过表达Grik1能诱导NUPR1、STC2和CHAC1等抑制凋亡重要转录因子的表达。但这些抑制凋亡的重要转录因子是否通过调节Bcl2和Bax等凋亡相关基因来调控凋亡,仍待进一步验证。
3.2 南极独角雪冰鱼与尼罗罗非鱼生存温度差异的可能原因分析
南极独角雪冰鱼是生活在南极深海0 ℃以下水域的底栖鱼类[24],而尼罗罗非鱼可以在16~38 ℃生长,最适生长温度为25~28 ℃,但无法在低于8 ℃的温度下生存[12],这两种鱼类的生存温度差异较大。本研究中,无论是南极独角雪冰鱼还是尼罗罗非鱼来源的基因Grik1,在低温胁迫下均能通过减少细胞凋亡来应对低温胁迫,发挥了类似的功能。有研究表明,与生活在南极圈外的南极亚目鱼类相比,在南极圈内的南极鱼体内拥有更多拷贝数的抗冻蛋白基因,以帮助其适应寒冷的水温[25]。此外,与温带鱼类相比,鳞头犬牙南极鱼有7种透明带蛋白的拷贝数表现出显著的扩增[6,26]。由此推测,南极独角雪冰鱼和尼罗罗非鱼两种鱼类Grik1基因发挥的作用类似,但其生存温度差异却较大,可能是由于Grik1在南极鱼中有更多的拷贝数或者表达量更高。这为深入研究鱼类低温胁迫响应机制奠定了基础。
4 结论
1)在低温胁迫下,过表达南极独角雪冰鱼和尼罗罗非鱼基因Grik1均能减少低温胁迫诱导的细胞凋亡,但是其具体调节机制需要进一步验证。
2)在低温胁迫下,过表达南极独角雪冰鱼和尼罗罗非鱼Grik1均能诱导一些抑制凋亡重要转录因子的表达,从而抑制细胞凋亡。表明Grik1可以通过调节细胞凋亡以响应低温胁迫。
3)南极独角雪冰鱼和尼罗罗非鱼两种鱼类的生存温度差异较大,但其Grik1基因在低温胁迫下却发挥了类似的功能,推测可能是由于Grik1在南极鱼中有更多的拷贝数或者表达量更高。
[1] VINCENT P,MULLE C.Kainate receptors in epilepsy and excitotoxicity[J].Neuroscience,2009,158(1):309-323.
[2] 朱恩妮,吴超然,廖红.代谢型谷氨酸受体5在中枢神经系统疾病中的研究进展[J].中国药科大学学报,2021,52(6):751-758.
ZHU E N,WU C R,LIAO H.Research progress of metabotropic glutamate receptor 5 in related central nervous system diseases[J].Journal of China Pharmaceutical University,2021,52(6):751-758.(in Chinese)
[3] 李春艳,赵洪庆,杨蕙,等.谷氨酸兴奋毒性及其调节剂的研究进展[J].中国药理学通报,2022,38(5):645-649.
LI C Y,ZHAO H Q,YANG H,et al.Research progress on excitotoxicity of glutamate and its modulators[J].Chinese Pharmacological Bulletin,2022,38(5):645-649.(in Chinese)
[4] LERMA J.Roles and rules of kainate receptors in synaptic transmission[J].Nature Reviews Neuroscience,2003,4(6):481-495.
[5] GONG J K,LIU J Z,RONAN E A,et al.A cold-sensing receptor encoded by a glutamate receptor gene[J].Cell,2019,178(6):1375-1386.
[6] CHEN Z,CHENG C H,ZHANG J,et al.Transcriptomic and genomic evolution under constant cold in Antarctic notothenioid fish[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(35):12944-12949.
[7] NIKOSKELAINEN S,BYLUND G,LILIUS E M.Effect of environmental temperature on rainbow trout (Oncorhynchus mykiss) innate immunity[J].Developmental and Comparative Immunology,2004,28(6):581-592.
[8] 魏亚丽,周艳,黄思婕,等.高温胁迫下尼罗罗非鱼肝脏组织的转录组分析[J].大连海洋大学学报,2021,36(2):222-228.
WEI Y L,ZHOU Y,HUANG S J,et al.Transcriptome analysis of liver tissue of Nile tilapia Oreochromis niloticus exposed to high temperature stress[J].Journal of Dalian Ocean University,2021,36(2):222-228.(in Chinese)
[9] BANDELL M,MACPHERSON L J,PATAPOUTIAN A.From chills to chilis:mechanisms for thermosensation and chemesthesis via thermo TRPs[J].Current Opinion in Neurobiology,2007,17(4):490-497.
[10] SCHEPERS R J,RINGKAMP M.Thermoreceptors and thermosensitive afferents[J].Neuroscience and Biobehavioral Reviews,2010,34(2):177-184.
[11] FOULKES T,WOOD J N.Mechanisms of cold pain[J].Channels,2007,1(3):154-160.
[12] ZHOU T,GUI L,LIU M L,et al.Transcriptomic responses to low temperature stress in the Nile tilapia,Oreochromis niloticus[J].Fish & Shellfish Immunology,2019,84:1145-1156.
[13] 许强华,陈良标.南极鱼类适应低温的分子进化研究进展[J].大连海洋大学学报,2021,36(2):177-186.
XU Q H,CHEN L B.Current progress on understanding of molecular evolution enabling cold adaptation in Antarctic fishes:a review[J].Journal of Dalian Ocean University,2021,36(2):177-186.(in Chinese)
[14] HU P,LIU M L,LIU Y M,et al.Transcriptome comparison reveals a genetic network regulating the lower temperature limit in fish[J].Scientific Reports,2016,6:28952.
[15] 胡玲红,王映,王化敏,等.不同温度胁迫对青鳉鳃凋亡的影响[J].大连海洋大学学报,2021,36(6):929-936.
HU L H,WANG Y,WANG H M,et al.Effects of different temperature stress on gill apoptosis of medaka Oryzias latipes[J].Journal of Dalian Ocean University,2021,36(6):929-936.(in Chinese)
[16] ANDREOLI T.The apoptotic syndromes-a basic biological phenomenon with wide ranging implications in tissue kinetics[J].American Journal of Medicine, 1999, 107(5):488.
[17] TRAYNELIS S F,WOLLMUTH L P,MCBAIN C J,et al.Glutamate receptor ion channels:structure,regulation,and function[J].Pharmacological Reviews,2010,62(3):405-496.
[18] BOWIE D.Ionotropic glutamate receptors & CNS disorders[J].CNS & Neurological Disorders Drug Targets,2008,7(2):129-143.
[19] VUJICIC M,VASIC B,NIKOLIC I,et al.The role of NUPR1 in lymphocyte proliferation and apoptosis[J].Archives of Biological Sciences,2017,69(2):261-267.
[20] HAMIDI T,ALGÜL H,CANO C E,et al.Nuclear protein 1 promotes pancreatic cancer development and protects cells from stress by inhibiting apoptosis[J].The Journal of Clinical Investigation,2012,122(6):2092-2103.
[21] QIE S,SANG N L.Stanniocalcin 2 (STC2):a universal tumour biomarker and a potential therapeutical target[J].Journal of Experimental & Clinical Cancer Research,2022,41(1):161.
[22] 王琼,李肖静,孙箫音.下调STC2基因表达对前列腺癌细胞增殖及凋亡的影响研究[J].临床和实验医学杂志,2017,16(23):2305-2308.
WANG Q,LI X J,SUN X Y.Effect of down regulation of STC2 gene expression on proliferation and apoptosis of prostate cancer cells[J].Journal of Clinical and Experimental Medicine,2017,16(23):2305-2308.(in Chinese)
[23] CRAWFORD R R,PRESCOTT E T,SYLVESTER C F,et al.Human CHAC1 protein degrades glutathione,and mRNA induction is regulated by the transcription factors ATF4 and ATF3 and a bipartite ATF/CRE regulatory element[J].The Journal of Biological Chemistry,2015,290(25):15878-15891.
[24] 刘秀荣,王丛丛,许强华.南极独角雪冰鱼HSP90β基因cDNA序列克隆及其原核表达[J].上海海洋大学学报,2015,24(5):668-677.
LIU X R,WANG C C,XU Q H.Cloning and prokaryotic expression of HSP90β cDNA sequence of an Antarctic iecfish Chionodraco hamatus[J].Journal of Shanghai Ocean University,2015,24(5):668-677.(in Chinese)
[25] CHENG C H C,CHEN L B,NEAR T J,et al.Functional antifreeze glycoprotein genes in temperate-water New Zealand nototheniid fish infer an Antarctic evolutionary origin[J].Molecular Biology and Evolution,2003,20(11):1897-1908.
[26] CAO L X,HUANG Q,WU Z C,et al.Neofunctionalization of zona Pellucida proteins enhances freeze-prevention in the eggs of Antarctic notothenioids[J].Nature Communications,2016,7:12987.