牙齿是鱼类重要的摄食器官,其发生是由上 皮-间充质相互作用,经细胞分化、形态发生、组织矿化和牙萌出等的复杂生物学过程[1-2]。其中,矿化是牙齿硬组织发育的重要事件,其主要为羟基磷灰石晶体形成的过程[3]。而许多矿化蛋白,如牙本质磷蛋白(dentin phosphoprotein,DPP)、牙本质基质蛋白(dentin matrix protein 1,DMP 1)、牙釉蛋白(enamelin)、细胞间隙连接蛋白43(connexin 43,Cx43)、钙结合蛋白-d28k(Calbindin-d28k,CaB)等在羟基磷灰石结晶的形成和生长中起重要作用[4-5]。
鳜(Siniperca chuatsi)是中国传统的淡水名贵经济鱼类[6],终生以活鱼、虾为饵,是典型的肉食性鱼类,牙齿尤其发达[7]。前期,作者对鳜口腔齿形态学特征进行了详细观察,发现鳜具有上颌齿、下颌齿、犁齿、腭齿和咽齿。其中,颌齿具3~4列,且有犬齿特化,犁齿、腭齿和咽齿均为绒毛状齿,牙齿呈圆锥状,朝口咽腔内弯曲[8]。鳜鱼苗一般在孵化后3~4日龄(混合营养期)开口,以活鱼鱼苗为食[9],因此,牙齿发育是仔鱼成功捕食的必要条件;同时,鳜在早期发育阶段,还会经历捕食方式的转变(从饵料鱼尾部捕食转向从头部捕食)[10-11]。田文斐[12]初步观察了鳜早期阶段颌齿、咽齿、腭齿和犁齿的出现次序,但未对其牙齿列数与数目变化、犬齿与绒毛状齿分化等进行全面观察;此外,对鳜牙齿矿化作用与相关矿化蛋白的研究尚未见报道。
本研究中,通过软骨-硬骨染色、组织切片等多种方法,全面描述了鳜仔稚鱼期齿列数与数目的变化特征、矿化发育过程、钙磷元素含量变化,以及碱性磷酸酶蛋白、Cx43、CaB基因表达量的变化特征,以期为鳜摄食适应研究提供基础资料。
1 材料与方法
1.1 材料
鳜仔稚鱼样本采集于上海市浦东新区孙农水产养殖场。鳜雌、雄亲鱼经人工催产、授精后,受精卵于孵化桶中自然孵化,水温为23~25 ℃。以团头鲂(Megalobrama amblycephala)鱼苗为开口饵料,后期投喂合适的草鱼(Ctenopharyngodon idellus)鱼苗。连续采集孵化后1~55日龄的鳜仔稚鱼,每天随机抽取50~100尾,分别保存于4%福尔马林、4%多聚甲醛(均为体积分数,下同)和Bouins液中,用于软骨-硬骨染色、免疫组化和组织切片等分析;每天另取30~50尾,放入液氮罐内速冻后置于-80 ℃超低温冰箱中保存,用于荧光定量PCR试验。为减少误差,本试验样品为同一批受精卵在同一孵化桶孵化的仔稚鱼。
1.2 方法
1.2.1 软骨-硬骨染色 取孵化后1~55 d的鳜仔稚鱼(每天取6尾),用4%福尔马林固定24 h,采用Dingerkus等[13]的软骨-硬骨(阿尔新兰-茜素红)双染色技术对鱼体进行染色,记录牙齿数目、列数变化和矿化时间。在Nikon解剖镜(SMZ1500)下观察并拍照, 采用Photoshop 6.0软件对拍摄的图片进行编辑处理。
1.2.2 组织切片 取孵化后1~55 d仔稚鱼牙齿(每天取6尾),用Bouins液固定24 h,其中1~15 d的仔鱼取整鱼作为样品,16~55 d的稚鱼取头部作为样品。常规石蜡包埋组织切片[14],用Leica RM 2016型切片机进行横切和纵切,厚度为7 μm,再用苏木精-伊红(HE)染色、中性树脂封片,在Nikon显微镜(ECLIPES 80i)下观察并拍照。
1.2.3 Von Kossa染色 取孵化后1~55 d仔稚鱼(每天取6尾),用4%多聚甲醛固定24 h,其中1~15 d的仔鱼取整鱼作为样品,16~55 d的稚鱼取头部作为样品。常规石蜡包埋组织切片[14],采用孙崇然等[15]的Von Kossa染色技术对鱼体进行染色,在Nikon显微镜(ECLIPES 80i)下观察并拍照。
1.2.4 钙、磷元素含量分析 取孵化后10、12、14 d的仔稚鱼牙齿(每天取3尾,每尾取3颗),37 ℃下干燥24 h,在牙齿表面镀金后,采用Aztec X-Max80型X射线能谱仪(上海交通大学分析测试中心),在牙齿表面随机取3个点测试,分析钙、磷元素含量。
1.2.5 免疫组化 取孵化后10、12、14 d的仔稚鱼全鱼(每天取3尾),用4%多聚甲醛固定24 h。常规石蜡包埋组织切片[14],采用碱性磷酸酶一抗和二抗试剂盒(均购自上海优宁维生物科技有限公司)测定牙齿中碱性磷酸酶蛋白的表达,对照组不加碱性磷酸酶一抗,其他步骤均相同,最后在Nikon显微镜(ECLIPES 80i)下观察并拍照。
1.2.6 荧光定量PCR 取-80 ℃冰箱中保存的2、10、12、14 d的仔稚鱼(每天取6尾),采用宋银都等[16]的荧光定量PCR技术测定仔稚鱼全鱼中Cx43和CaB基因的表达量。以2 d仔鱼为对照,采用2-△△Ct法计算目的基因的相对表达量。
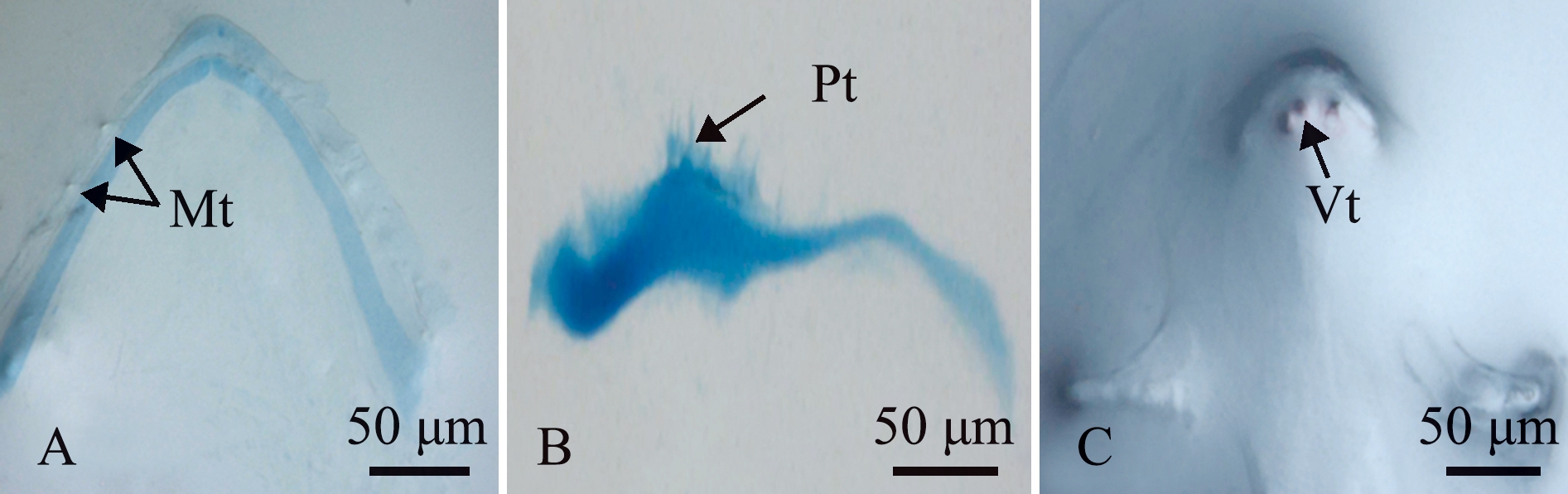
根据本实验室鳜转录组数据(未发表),采用PrimerExpress 5.0软件设计Cx43、CaB和β-actin基因的引物序列(表1),引物由金维智(苏州)生物科技有限公司合成。
表1 鳜牙齿矿化相关基因的引物序列
Tab.1 Primer sequence of tooth mineralization gene of Siniperca chuatsi
基因 gene引物序列 primer sequence(5'-3')Cx43F:AGCCCCACCCCTAAAGAACT R:TGCTCTGTGGAGTAGTTGGCCaBF:ATGGAAAGTTGGGCCTGTCAR:GGTAGAGCTTCCCTCCGTCAβ-actinF:ATCGCCGCACTGGTTGTTGACR:CCTGTTGGCTTTGGGGTTC
根据所设计的引物,以β-actin为内参基因进行荧光定量PCR。反应体系(20 μL):TB Green Premix Tap Ⅱ 10 μL,正、反引物各0.8 μL,cDNA模板1.6 μL,无菌水6.8 μL。反应程序:95 ℃下预变性30 s;95 ℃下变性5 s,58 ℃下退火30 s,共进行40个循环;95 ℃下变性10 s,65 ℃下退火5 s。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。采用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 仔稚鱼期牙齿发育时序
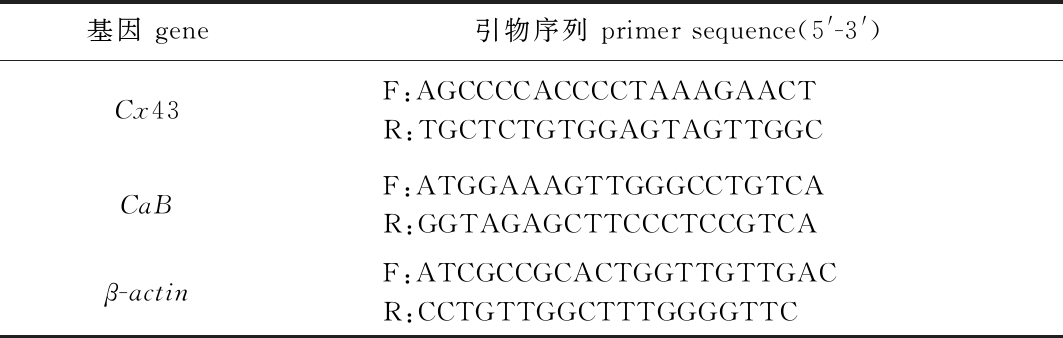
2.1.1 组织切片观察 孵化后3 d时颌齿出现(图1A),5 d时咽齿出现(图1B),8 d时腭齿出现(图1C),12 d时犁齿出现(图1D)。
A—孵出后3 d上颌齿;B—孵出后5 d咽齿;C—孵出后8 d腭齿;D—孵出后12 d犁齿。Mt—上颌齿;Pht—咽齿;Pt—腭齿;Vt—犁齿。A—maxillary tooth at 3 days post hatch(dph); B—pharyngeal tooth at 5 dph; C—palatal tooth at 8 dph; D—vomerine tooth at 12 dph. Mt—maxillary tooth; Pht—pharyngeal tooth; Pt—palatal tooth; Vt—vomerine tooth.
图1 仔稚鱼期鳜牙齿组织切片
Fig.1 Histological section of tooth of Siniperca chuatsi at the early stage
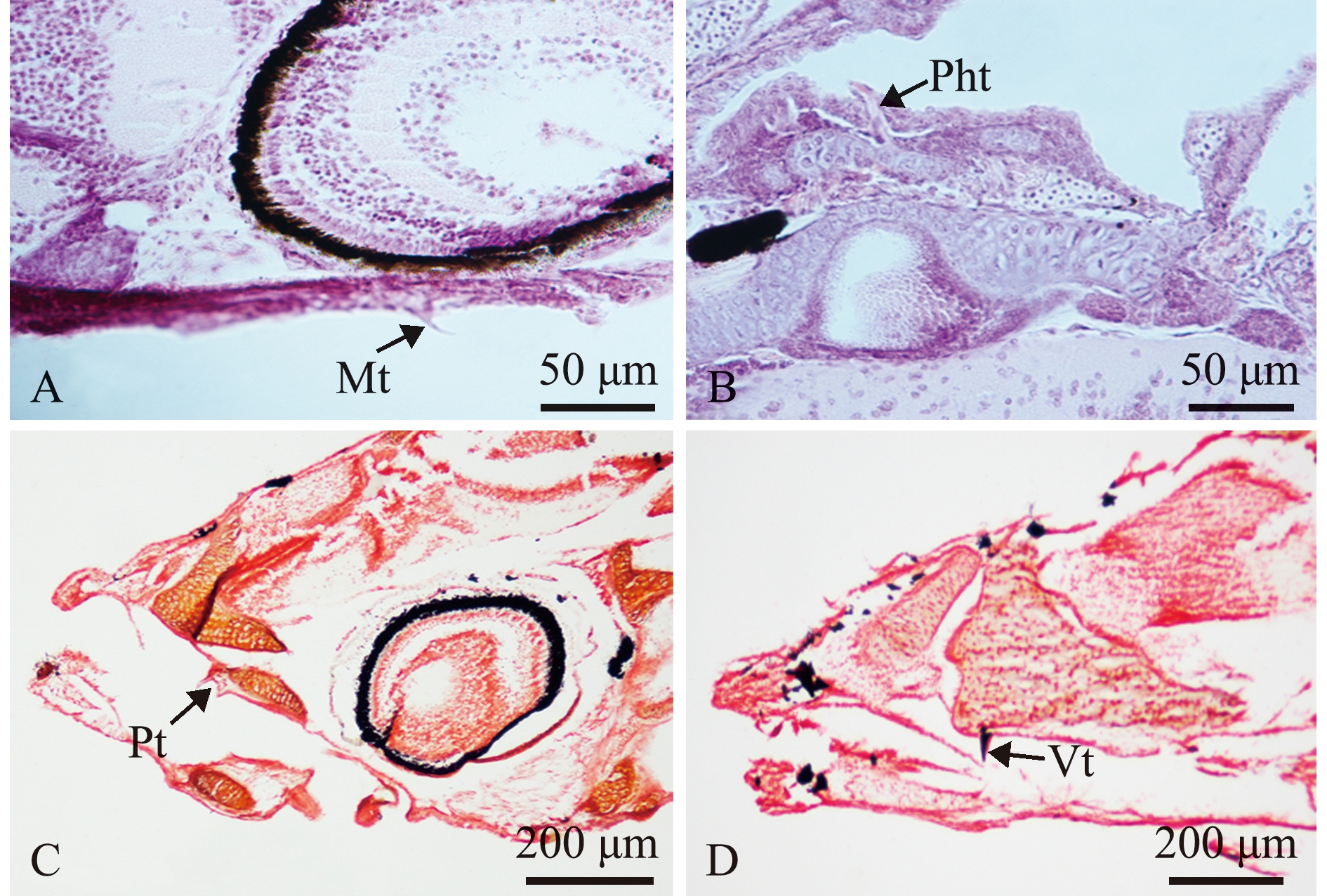
2.1.2 软骨-硬骨染色观察 孵化后3 d时颌齿出现(图2A),8 d时腭齿出现(图2B),12 d时犁齿出现(图2C)。
A—孵化后3 d下颌齿;B—孵化后8 d腭齿;C—孵化后 12 d犁齿。Mt—下颌齿;Pt—腭齿;Vt—犁齿。A—mandibular tooth at 3 days post hatch(dph); B—palatal tooth at 8 dph; C—vomerine tooth at 12 dph.Mt—mandibular tooth; Pt—palatal tooth; Vt—vomerine tooth.
图2 仔稚鱼期鳜牙齿软骨-硬骨染色
Fig.2 Cartilage-bone staining of tooth of Siniperca chuatsi at the early stage
2.2 仔稚鱼期牙齿列数与数目的变化
2.2.1 颌齿列数 颌齿列数由中间向内、外两侧发育。上颌齿:孵化后3 d时中间内列出现,4 d时中间外列出现,8 d时最外列出现,11 d时最内列出现。下颌齿:孵化后3 d时中间列出现,4 d时内列出现,8 d时外列出现(表2)。
表2 仔稚鱼期鳜颌齿列数的变化
Tab.2 Change in jaw tooth column number of Siniperca chuatsi at the early stage
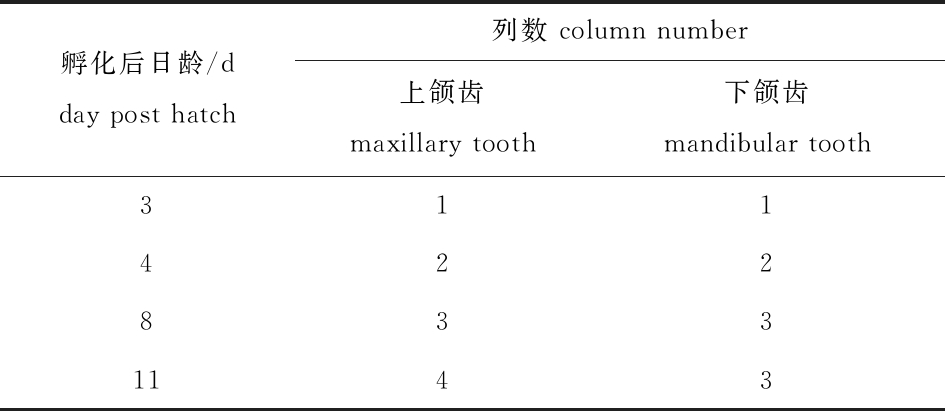
孵化后日龄/d day post hatch列数 column number 上颌齿 maxillary tooth下颌齿 mandibular tooth3114228331143
2.2.2 牙齿数目 颌齿发育过程中,前端先发育,后端晚发育;绒毛状齿先出现,在孵化后18 d时犬齿开始出现,刚出现的犬齿大小和绒毛状齿基本一致,孵化后30 d时二者有明显的区别(表3)。
表3 仔稚鱼期鳜颌齿数目的变化
Tab.3 Change in jaw tooth number of Siniperca chuatsi at the early stage

孵化后日龄/d day post hatch上颌齿 maxillary tooth下颌齿 mandibular tooth3中间内列绒毛状齿3^6枚中间列绒毛状齿6^8枚5中间外列绒毛状齿6^9枚;中间内列绒毛状齿8^12枚中间列绒毛状齿8^10枚;内列绒毛状齿5^8枚8最外列绒毛状齿5^8枚;中间外列绒毛状齿9^11枚;中间内列绒毛状齿15^17枚外列绒毛状齿10^12枚;中间列绒毛状齿12^14枚;内列绒毛状齿9^12枚11最外列绒毛状齿12^14枚;中间外列绒毛状齿12^14枚;中间内列绒毛状齿17^20枚,最内列绒毛状齿6^9枚外列绒毛状齿10^12枚;中间列绒毛状齿18^24枚;内列绒毛状齿12^14枚18最外列绒毛状齿16^20枚;中间外列绒毛状齿12^16枚;中间内列绒毛状齿20^24枚;最内列绒毛状齿6^10枚,犬齿0^1枚外列绒毛状齿11^13枚;中间列绒毛状齿19^23枚;内列绒毛状齿19^21枚,犬齿1^2枚30最外列绒毛状齿25^30枚;中间外列绒毛状齿23^27枚;中间内列绒毛状齿25^28枚,犬齿1^2枚;最内列绒毛状齿8^10枚,犬齿1^3枚外列绒毛状齿12^14枚;中间列绒毛状齿21^28枚;内列绒毛状齿9^12枚,犬齿5^8枚55最外列绒毛状齿36^42枚;中间外列绒毛状齿25^28枚,犬齿1^2枚;中间内列绒毛状齿21^30枚,犬齿1^3枚;最内列绒毛状齿16^18枚,犬齿2^3枚外列绒毛状齿13^15枚;中间绒毛状齿35^40枚;内列绒毛状齿17^20枚,犬齿8^12枚
腭齿先前端发育,逐渐往后端发育;犁齿、咽齿均从中间位置开始发育,再向两端发育;牙齿数目随发育时间逐渐增加(表4),孵化后55 d时基本与成鱼牙齿数目一致。
表4 仔稚鱼期鳜犁齿、腭齿和下咽齿数目的变化
Tab.4 Change in numbers of vomerine tooth, palatal tooth and pharyngeal tooth in Siniperca chuatsi at the early stage
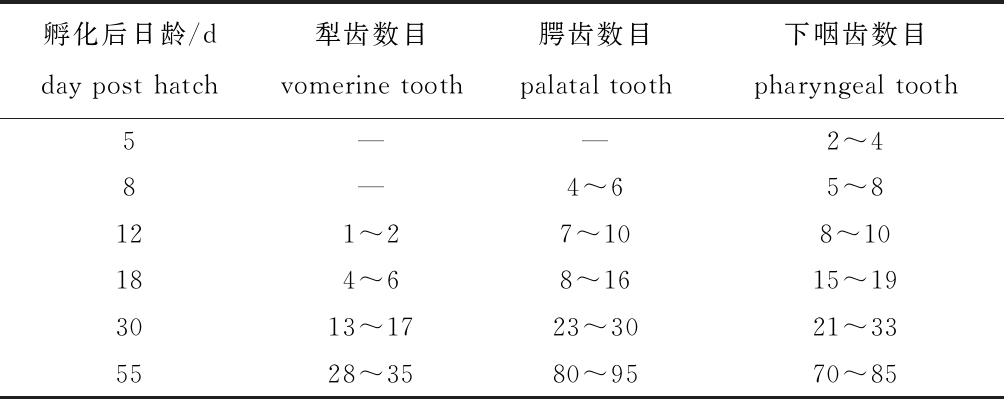
孵化后日龄/d day post hatch犁齿数目vomerine tooth腭齿数目 palatal tooth下咽齿数目 pharyngeal tooth5——2^48—4^65^8121^27^108^10184^68^1615^193013^1723^3021^335528^3580^9570^85
2.3 仔稚鱼期鳜牙齿矿化时序
2.3.1 软骨-硬骨染色 上颌齿、下颌齿、腭齿和下咽齿在孵化后11 d时呈淡红色(图3A、D、G、J),矿化开始,12 d时颜色加深(图3B、E、H、K),14 d时颜色呈红色,矿化完成(图3C、F、I、L)。犁齿在孵化后12 d时呈淡红色,矿化开始(图3M),14 d时颜色呈红色,矿化完成(图3N)。牙齿矿化从牙尖开始,逐渐往牙基发育,牙齿矿化与其附着骨骼同步。

A—孵化后11 d上颌齿;B—孵化后12 d上颌齿;C—孵化后14 d上颌齿;D—孵化后11 d下颌齿;E—孵化后12 d下颌齿;F—孵化后14 d下颌齿;G—孵化后11 d腭齿;H—孵化后12 d腭齿;I—孵化后14 d腭齿;J—孵化后11 d下咽齿;K—孵化后12 d下咽齿;L—孵化后14 d下咽齿;M—孵化后12 d犁齿;N—孵化后14 d犁齿。A—maxillary tooth at 11 dph; B—maxillary tooth at 12 dph; C—maxillary tooth at 14 dph; D—mandibular tooth at 11 dph; E—mandibular tooth at 12 dph; F—mandibular tooth at 14 dph; G—palatal tooth at 11 dph; H—palatal tooth at 12 dph; I—palatal tooth at 14 dph; J—pharyngeal tooth at 11 dph; K—pharyngeal tooth at 12 dph; L—pharyngeal tooth at 14 dph; M—vomerine tooth at 12 dph; N—vomerine tooth at 14 dph.
图3 仔稚鱼期鳜牙齿软骨-硬骨染色
Fig.3 Cartilage-bone staining of tooth of Siniperca chuatsi at the early stage
2.3.2 Von Kossa染色 孵化后4 d时,颌齿呈浅棕黄色(图4A),随着时间延长颜色逐渐加深,11 d时颌齿呈棕黄色(图4B),矿化开始,12 d时颌齿呈棕黑色(图4C),14 d时颌齿呈黑色(图4D),矿化完成。
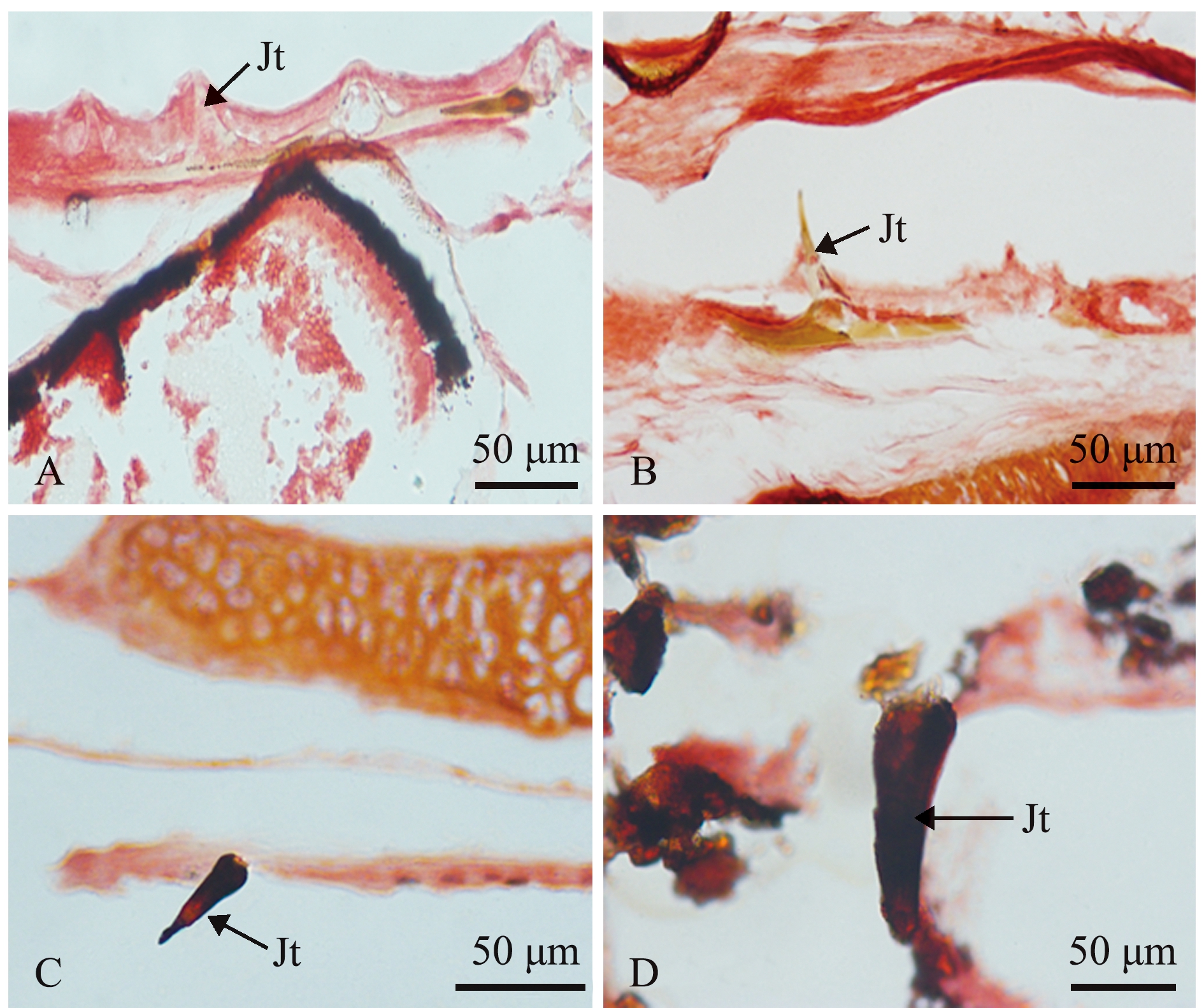
A—孵化后4 d;b—孵化后11 d;C—孵化后12 d;D—孵化后14 d。Jt—颌齿。A—4 dph; B—11 dph; C—12 dph; D—14 dph.Jt—jaw tooth.
图4 仔稚鱼期鳜颌齿Von Kossa染色
Fig.4 Von Kossa staining of jaw tooth of Siniperca chuatsi at the early stage
2.4 鳜牙齿矿化过程中钙、磷元素含量的变化
从表5可见,与孵化后10 d时相比,孵化后12 d时鳜牙齿钙、磷含量总体上显著增加(P<0.05),14 d时二者又显著降低(P<0.05),而钙/磷比值在此期间无明显变化(P>0.05)。
表5 鳜牙齿矿化过程中钙、磷元素的含量
Tab.5 Content of calcium and phosphorous in tooth of Siniperca chuatis during mineralization
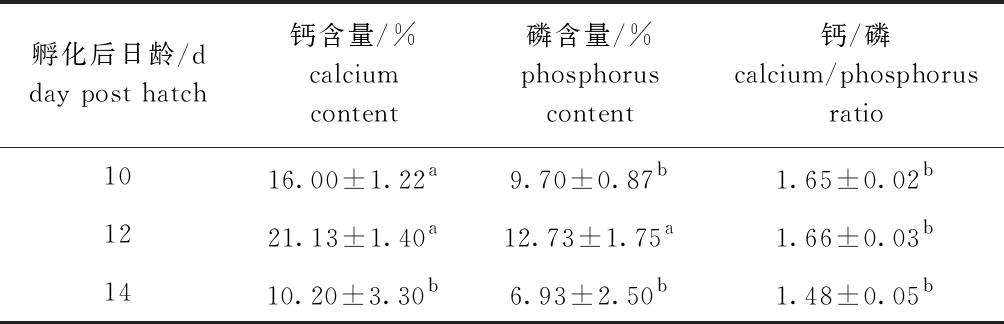
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note: The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences.
孵化后日龄/d day post hatch钙含量/%calciumcontent磷含量/%phosphorus content钙/磷calcium/phosphorusratio1016.00±1.22a9.70±0.87b1.65±0.02b1221.13±1.40a12.73±1.75a1.66±0.03b1410.20±3.30b6.93±2.50b1.48±0.05b
2.5 碱性磷酸酶蛋白、Cx43和CaB基因的表达变化
2.5.1 碱性磷酸酶蛋白 与对照组相比,碱性磷酸酶蛋白在孵化后10、12 d的牙釉质和牙本质中呈阳性反应,而在孵化后14 d的牙釉质、牙本质中则无阳性反应(图5)。
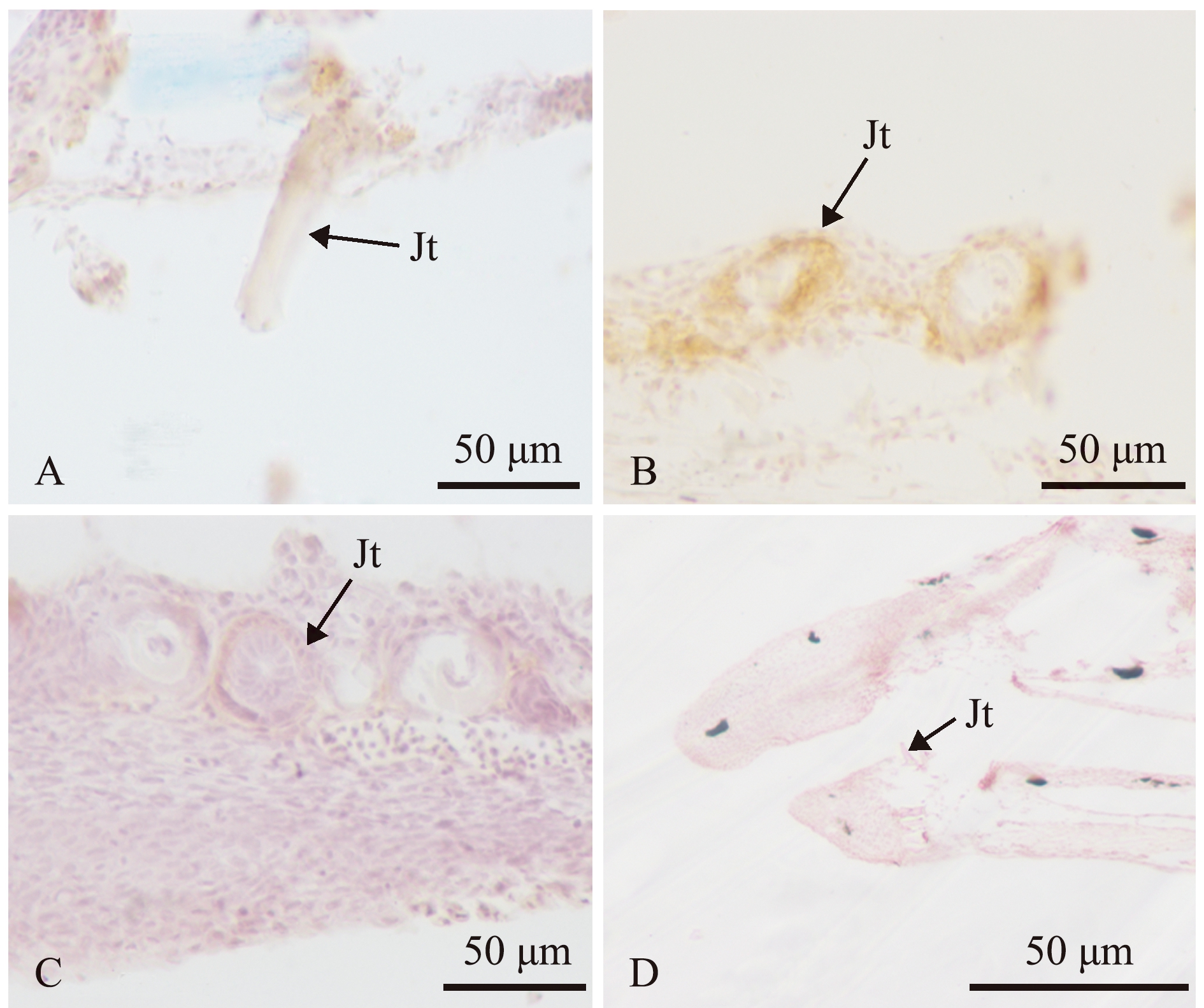
A—孵化后10 d;B—孵化后12 d;C—孵化后14 d;D—孵化后12 d的对照组(不加碱性磷酸酶一抗)。Jt—颌齿。A—10 dph; B—12 dph; C—14 dph; D—the control group at 12 dph (primary antibody without alkaline phosphatase).Jt—jaw tooth.
图5 仔稚鱼期鳜颌齿碱性磷酸酶的免疫组化
Fig.5 Immunohistochemistry of alkaline phosphatase in jaw tooth of Siniperca chuatsi at the early stage
2.5.2 Cx43和CaB基因 从图6可见:与孵化后8 d时相比,鳜全鱼中的Cx43基因表达量在孵化后10、12 d时有所上升,但差异不显著(P>0.05),而CaB基因表达量在孵化后10、12 d时显著上升(P<0.05);孵化后14 d时,Cx43和CaB基因表达量均显著下降(P<0.05)。
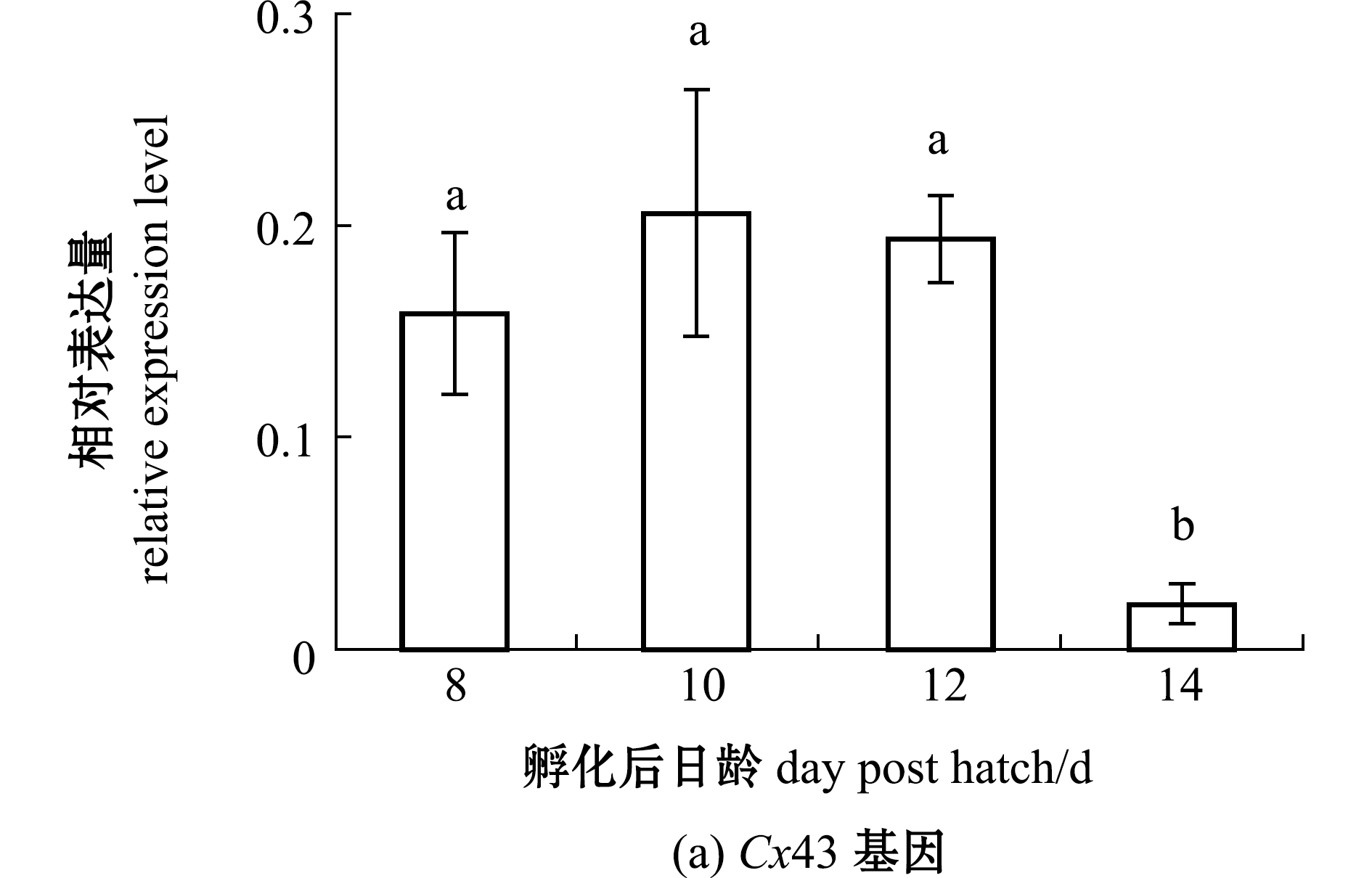
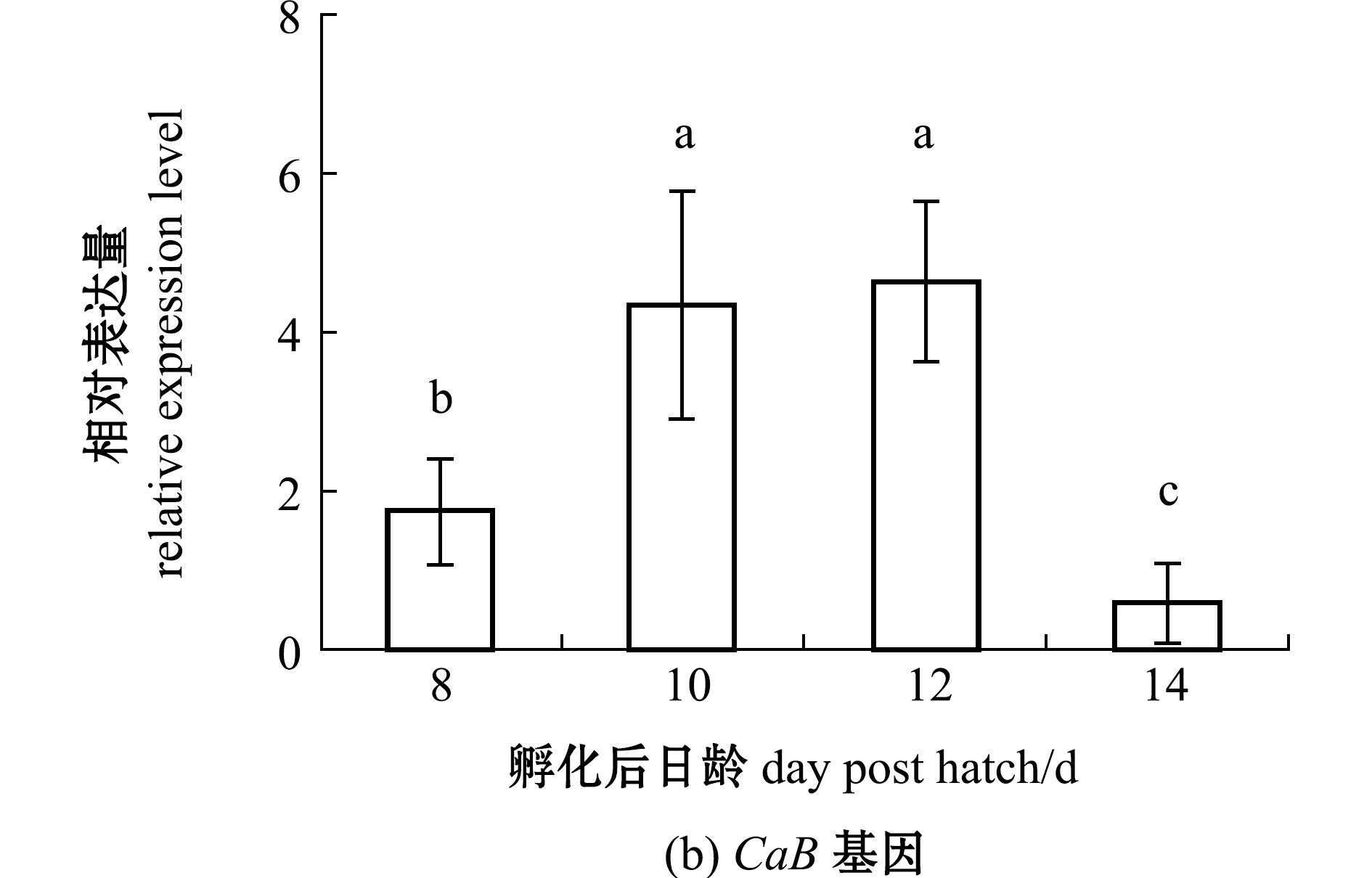
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.
图6 仔稚鱼期鳜Cx43、CaB基因相对表达量的变化
Fig.6 Change in relative expression levels of Cx43 and CaB genes of Siniperca chuatsi at the early stage
3 讨论
3.1 鳜牙齿发育对摄食的影响
牙齿是肉食性鱼类重要的摄食器官,主要作用是捕食和防止食物逃脱。牙齿发育是其个体发育的重要环节,也是其捕食的先决条件,直接决定着个体的存亡。本研究中观察到,孵化后3 d时鳜颌齿出现,开口摄食,5 d时咽齿出现,8 d时腭齿出现,12 d时犁齿出现,口腔齿的出现次序与田文斐[12]观察结果基本一致。鳜孵化后3 d时上、下颌齿均为1列,数目较少;4 d时上、下颌齿列数发育至2列;11 d时颌齿列数发育完全,牙齿数目持续增加;18 d时上、下颌齿均有犬齿出现,颌齿在牙齿发育过程最先出现,这表明颌齿是鳜最重要的捕食器官,早期颌齿的作用是直接咬住、固定(活动能力较弱)活饵鱼,防止其逃脱;随着齿列数和数目的增加,犬齿出现,此时能捕食规格大、活动能力强的饵料鱼,且提高了捕食成功率。紧随其后发育的是咽齿,咽齿的作用是辅助捕食后的食物吞咽;腭齿和犁齿最后发育,它们的作用是防止饵料鱼逃脱,并辅助吞咽。此外,颌齿、咽齿、腭齿和犁齿的着生方向全部向口腔内侧倾斜,大大提高了捕食效率。
随着鳜捕食器官牙齿的发育与完善,骨骼和肌肉也相应发育,运动能力增强,鳜摄食方式从咬住饵料鱼尾部转变为从头部吞食[17-18]。早期从尾部捕食时,常发生饵料鱼逃脱或只能吞食饵料鱼后半部的现象,捕食效率低[19-20];从头部捕食时,依靠发达的上、下颌齿,能有效防止饵料鱼逃脱,并完成吞咽,增加了捕食成功率。
通过Logistic模型分析表明,池塘养殖鳜体长和体高的生长拐点都在2月龄左右;通过Gompertz模型分析发现,2~3月龄鳜体长绝对生长率一直维持在较高水平[21]。本研究中观察到孵化后55 d的鳜牙齿发育接近成鱼,此时的鳜运动能力增强,捕食效率增加,消化器官发育完全[18],从而提高了生长率。
3.2 鳜牙齿矿化过程中钙、磷元素和矿化相关蛋白的作用
矿化是牙齿、硬骨组织发育的核心事件。本研究中观察发现,鳜颌齿、咽齿、腭齿和犁齿矿化时间均为孵化后11~14 d。研究表明,鳜前颌骨、下颌骨和犁骨矿化在孵化后14 d完成;咽骨、腭骨在孵化后14 d开始矿化,33 d完成矿化[12],牙齿矿化与咽颅骨骼硬化发育间存在密切联系。咽颅骨骼和牙齿的矿化作用,增强了仔鱼的捕食能力。
在牙齿矿化作用中,钙、磷元素含量不断变化,羟基磷灰石结晶化不断提高[22]。钙、磷是牙齿硬组织的主要组成元素[23]。本研究中观察发现,孵化后12 d的鳜牙齿中钙、磷元素含量显著增加,这表明在牙齿矿化过程中,钙、磷元素参与了羟基磷灰石结晶的大量形成[23]。
在羟磷灰石结晶的形成和生长中,许多矿化相关蛋白起着重要作用[24]。本研究中,碱性磷酸酶蛋白在孵化后10、12 d的牙本质和牙釉质中呈阳性反应,在14 d的牙齿中无阳性反应。在小鼠牙齿矿化过程中,碱性磷酸酶活性增强是牙本质形成和矿化的一种重要依据[25-26]。碱性磷酸酶可通过水解无机磷酸酯产生无机磷酸盐,产生局部过饱和,导致钙盐沉积从而启动生物矿化过程[27]。在斑马鱼牙齿矿化阶段,Cx43蛋白高表达,且主要在矿化晚期发挥关键调控作用[28]。本研究中,孵化后10、12 d时Cx43和CaB基因表达量均升高,14 d时基因表达量又显著降低。Cx43蛋白能够运输Ca2+,参与釉质的形成[29]和矿化过程[30];而CaB蛋白与细胞内游离Ca2+有高度亲和力,可介导Ca2+参与牙齿矿化[31],表明这两种蛋白均能通过Ca2+调节参与牙齿矿化过程。
4 结论
1)鳜是肉食性鱼类,鳜早期牙齿的出现能直接咬住、固定活饵鱼,防止其逃脱;随着齿列数和数目的增加,鳜能捕食规格大、活动能力强的饵料鱼,从而提高鳜早期捕食能力。
2)牙齿矿化过程(孵化后11~14 d)中,钙、磷元素含量,以及碱性磷酸酶蛋白、Cx43和CaB表达量均有升高,说明这些元素和蛋白均参与了牙齿的矿化过程。
[1] VAN DER HEYDEN C,HUYSSEUNE A.Dynamics of tooth formation and replacement in the zebrafish (Danio rerio) (Teleostei,Cyprinidae)[J].Developmental Dynamics,2000,219(4):486-496.
[2] HUYSSEUNE A,VAN DER HEYDEN C,SIRE J Y.Early development of the zebrafish (Danio rerio) pharyngeal dentition (Teleostei,Cyprinidae)[J].Anatomy and Embryology,1998,198(4):289-305.
[3] 程振江.蛋白调控骨、牙矿化的研究及模拟[D].北京:清华大学,2010.
CHENG Z J.Study on protein regulation on biomineralization of bone,teeth and simulation[D].Beijing:Tsinghua University,2010.(in Chinese)
[4] 张敬雷.牙本质磷蛋白在牙齿发育中表达及其调控的研究[D].西安:中国人民解放军第四军医大学,2003.
ZHANG J L.A study on dentin phosphoprotein expression and its regulatory mechanism on teeth development[D].Xi’an: Fourth Military Medical University of PLA,2003.(in Chinese)
[5] LINDE A.Dentin matrix proteins:composition and possible functions in calcification[J].The Anatomical Record,1989,224(2):154-166.
[6] 孟庆闻, 缪学祖, 俞泰济, 等.鱼类学:形态、分类[M].上海:上海科学技术出版社,1989.
MENG Q W,MIAO X Z,YU T J,et al.Ichthyology: morphology, taxonomy[M].Shanghai:Shanghai Scientific & Technical Publishers,1989.(in Chinese)
[7] 周才武,杨青,蔡德霖.鳜亚科Sinipercinae鱼类的分类整理和地理分布[J].动物学研究,1988,9(2):113-125.
ZHOU C W,YANG Q,CAI D L.On the classification and distribution of the Sinipercinae fishes (family Serranidae)[J].Zoological Research,1988,9(2):113-125.(in Chinese)
[8] 曹林军,赵金良.鳜牙齿形态结构及与不同种属间比较观察[J].动物学杂志,2021,56(5):707-715.
CAO L J,ZHAO J L.Tooth morphology and structure of Siniperca chuatsi:comparison with different species and genera[J].Chinese Journal of Zoology,2021,56(5):707-715.(in Chinese)
[9] 李松林,韩志豪,王小源,等.鳜养殖概况及摄食调控机制研究进展[J].水产学报,2021,45(10):1787-1795.
LI S L,HAN Z H,WANG X Y,et al.Research progress on aquaculture and feeding regulation mechanism of mandarin fish[J].Journal of Fisheries of China,2021,45(10):1787-1795.(in Chinese)
[10] 刘丹阳.兴凯湖翘嘴鲌和鳜的胚胎发育及仔、稚鱼生长研究[D].哈尔滨:东北农业大学,2011.
LIU D Y.Research on embryonic and fish larvae and juvenile development of Culter aalburnus of Xingkai Lake and Siniperca chuatsi[D].Harbin:Northeast Agricultural University,2011.(in Chinese)
[11] 郑闽泉,丁桂枝,黄涵生,等.鳜鱼苗生物学特性的观察[J].福建水产,1997,19(3):12-16.
ZHENG M Q,DING G Z,HUANG H S,et al.Observation on biological characteristics of juvenile Siniperca chuatsi[J].Journal of Fujian Fisheries,1997,19(3):12-16.(in Chinese)
[12] 田文斐.鳜鱼骨骼早期发育以及主要摄食器官发育与摄食行为的适应性研究[D].上海:上海海洋大学,2012.
TIAN W F.Study on the development of skeleton and feeding apparatus and their adaption to feeding in Siniperca chuatsi(Perciformes:Sinipercinae)[D].Shanghai:Shanghai Ocean University,2012.(in Chinese)
[13] DINGERKUS G,UHLER L D.Enzyme clearing of alcian blue stained whole small vertebrates for demonstration of cartilage[J].Stain Technology,1977,52(4):229-232.
[14] 张瑞祺,张炎,赵金良.鳜视觉转变期视网膜感光细胞层的发育[J].大连海洋大学学报,2021,36(1):110-117.
ZHANG R Q,ZHANG Y,ZHAO J L.Development of retinal photoreceptor cell layer during visual transition in mandarin fish Siniperca chuatsi[J].Journal of Dalian Ocean University,2021,36(1):110-117.(in Chinese)
[15] 孙崇然,刘恩重.Von Kossa染色的方法改进[J].哈尔滨医科大学学报,2006,40(1):70-71.
SUN C R,LIU E C.Improvement of Von Kossa staining method[J].Journal of Harbin Medical University,2006,40(1):70-71.(in Chinese)
[16] 宋银都,唐首杰,赵金良.鳜幼鱼窒息点、耗氧率的初步研究[J].水产养殖,2019,40(3):3-5.
SONG Y D,TANG S J,ZHAO J L.Preliminary study on asphyxiation point and oxygen consumption rate of juvenile mandarin fish [J].Journal of Aquaculture,2019,40(3):3-5.(in Chinese)
[17] 熊玉宇.鳜摄食行为发育[D].北京:中国科学院大学,2012.
XIONG Y Y.The development of foraging behavior in Siniperca chuatsi[D].Beijing:University of Chinese Academy of Sciences,2012.(in Chinese)
[18] 唐宇平,樊恩源.鳜鱼消化器官的发育和食性的研究[J].水生生物学报,1993,17(4):329-336.
TANG Y P,FAN E Y.A study on the development of digestive organs and feeding habit of Siniperca chuatsi (Basilewsky)[J].Acta Hydrobiologica Sinica,1993,17(4):329-336.(in Chinese)
[19] 陈育辉.鳜鱼幼鱼摄食习性的观察[J].水产养殖,1988,9(1):6-7.
CHEN Y H.Observation on feeding habits of juvenile Siniperca chuatsi[J].Journal of Aquaculture,1988,9(1):6-7.(in Chinese)
[20] 陈瑞明.鳜鱼苗的生物学与开口期培育技术[J].淡水渔业,1999,29(10):28-30.
CHEN R M.Biology of Siniperca chuatsi fry and cultivation technology in opening period [J].Freshwater Fisheries,1999,29(10):28-30.(in Chinese)
[21] 季索菲,侯冠军,赵秀侠,等.池养条件下翘嘴鳜早期生长性状研究[J].湖北师范大学学报(自然科学版),2021,41(1):10-16.
JI S F,HOU G J,ZHAO X X,et al.Study on the early growth characteristics of Siniperca chuatsi in pond culture[J].Journal of Hubei Normal University (Natural Science Edition),2021,41(1):10-16.(in Chinese)
[22] 苏吉梅.钙、磷与牙齿健康[J].国外医学(医学地理分册),1997,18(3):102-105.
SU J M.Calcium, phosphorus and dental health[J].Foreign Medical Sciences(Section of Medgeography),1997, 18(3):102-105.(in Chinese)
[23] 李谨.牙齿发育的信号调控机制及淫羊藿苷的干预研究[D].南京:南京中医药大学,2010.
LI J.Signal regulatory mechanisms and effect of icariin during tooth generation[D].Nanjing:Nanjing University of Chinese Medicine,2010.(in Chinese)
[24] 欧阳健明.生物矿物及其矿化过程[J].化学进展,2005,17(4):749-756.
OUYANG J M.Biominerals and their mineralization process[J].Progress in Chemistry,2005,17(4):749-756.(in Chinese)
[25] 卢桂霞,王雪婷,李晓红.Von Kossa染色法和碱性磷酸酶的免疫组化染色法在牙齿矿化研究中的应用[J].中国基层医药,2006,13(8):1352-1353.
LU G X,WANG X T,LI X H.Application of Von Kossa staining and alkaline phosphatase immunohistochemical staining in tooth mineralization[J].Chinese Journal of Primary Medicine and Pharmacy,2006,13(8):1352-1353.(in Chinese)
[26] 潘克清,杨丕山,李纾.矿化期小鼠牙胚中矿化相关因子的表达[J].上海口腔医学,2006,15(4):383-387.
PAN K Q,YANG P S,LI S.Expression of mineral-associated factors in the mineral stage tooth germ of mice[J].Shanghai Journal of Stomatology,2006,15(4):383-387.(in Chinese)
[27] 吕佳炜,殷红,李春风,等.碱性磷酸酶在骨矿化中的研究[J].黑龙江畜牧兽医,2013(1):32-34.
LÜ J W,YIN H,LI C F,et al.Study of alkaline phosphatase in bone mineralization [J].Heilongjiang Animal Science and Veterinary Medicine,2013(1):32-34.(in Chinese)
[28] 徐智云,刘鑫,黄兴,等.细胞间隙连接蛋白43基因在斑马鱼牙齿早期发育中的表达[J].华西口腔医学杂志,2015,33(4):347-351.
XU Z Y,LIU X,HUANG X,et al.Expression of connexin 43 gene during early dental development in zebrafish[J].West China Journal of Stomatology,2015,33(4):347-351.(in Chinese)
[29] JO O S M A,ARANA-CHAVEZ V E.Expression of connexin 43 and ZO-1 in differentiating ameloblasts and odontoblasts from rat molar tooth germs[J].Histochemistry and Cell Biology,2003,119(1):21-26.
O S M A,ARANA-CHAVEZ V E.Expression of connexin 43 and ZO-1 in differentiating ameloblasts and odontoblasts from rat molar tooth germs[J].Histochemistry and Cell Biology,2003,119(1):21-26.
[30] 李昊天,邱涛,陈超,等.细胞间隙连接蛋白43在骨质疏松领域研究进展[J].疑难病杂志,2021,20(8):850-854.
LI H T,QIU T,CHEN C,et al.Research progress of connexin 43 in the field of osteoporosis[J].Chinese Journal of Difficult and Complicated Cases,2021,20(8):850-854.(in Chinese)
[31] 王景杰,牛忠英,倪龙兴.钙结合蛋白Calbindin-D28K在人牙胚发育过程中的表达[J].牙体牙髓牙周病学杂志,2000,10(2):63-66.
WANG J J,NIU Z Y,NI L X.Immunolocalization of calbindin-D28K in human tooth germ development[J].Chinese Journal of Conservative Dentistry,2000,10(2):63-66.(in Chinese)