铅(Pb)是水体中常见的一种重金属污染物,随着电池制造、采矿和冶炼等工业活动而进入水环境中,被水生生物所吸收并在其组织中积累[1-2]。研究表明,铅中毒将造成鱼类肌肉萎缩、脊柱前侧凸、麻木和尾鳍变黑退化,甚至死亡[2]。
硒(Se)是硒蛋白的组成部分,是人体和动物必需的微量营养素之一。摄食硒能增强刺参(Apostichopus japonicus)幼参的抗氧化能力[3],缓解鲤(Cyprinus carpio)铅诱导的氧化应激[4]。核转录因子E2相关因子(Nrf2)是氧化应激反应的主要调节因子,研究表明,硒通过Nrf2通路缓解铅诱导的绵羊睾丸间质细胞的氧化应激和细胞凋亡[5]。许多研究已证明,硒对铅具有拮抗作用,各种形式的硒包含无机硒、有机硒、富硒酵母、富硒木耳和硒代蛋氨酸等均具有增加生物体内硒含量和降低组织中铅积累的能力[6]。硒和铅有较强的亲和力,当硒与铅在生物体中相遇时,会形成硒铅络合物,随后被肾脏代谢到体外[7]。
益生菌是对宿主有益的活微生物,补充益生菌可以有效调节鱼类肠道菌群,提高鱼类的生长性能、抗氧化能力和调节免疫稳态[8]。此外,植物乳杆菌(Lactobacillus plantarum)可以促进生物体内重金属的排泄,植物乳杆菌CCFM8661通过调节胆汁酸(BA)的肝肠循环来促进铅的排泄,减少组织中的铅积累[9]。目前,相关研究集中在单一硒或植物乳杆菌拮抗铅引起的神经毒性、肝肾毒性、氧化应激、免疫损伤和DNA损伤等方面[5],且对啮齿动物、家禽和哺乳动物的研究较多,但两者结合拮抗铅引起的鱼肾毒性的机制尚不清楚。
大鳞鲃(Luciobarbus capito)是近年来国内新培育的优质耐盐碱品种,具有抗逆性强、生长快速和肉质鲜美等特点[10]。关于大鳞鲃毒理学的研究主要集中在盐碱胁迫和鱼药等方面,而关于重金属的研究尚属空白。由于许多化工厂建在荒芜的盐碱地周边,养殖水体不可避免地被各种有害重金属污染,食品安全存在潜在危险。本研究中,以大鳞鲃为研究对象,利用植物乳杆菌将无机硒转化为有生物活性的纳米硒并添加到饲料中,通过检测鱼体组织的铅和硒含量,肾和鳃中的抗氧化酶活力,以及肾中抗氧化基因的表达,探讨富硒植物乳杆菌对铅胁迫下大鳞鲃组织氧化应激的影响,以期为盐碱水体的渔业利用和功能性人工饲料的开发提供基础数据。
1 材料与方法
1.1 材料
试验用植物乳杆菌分离自中国水产科学院黑龙江水产研究所水产养殖实验室。MRS肉汤液体培养基购自北京奥博星生物技术有限责任公司。
1.2 方法
1.2.1 培养基及培养条件 将植物乳杆菌划线接种于MRS固体培养基上,37 ℃有氧条件下培养 12 h。挑取单个优势菌落进行纯培养,接种于10 mL MRS肉汤液体培养基,有氧静置培养12 h。按2%接种量连续传代3次,于4 ℃冰箱中保存备用。
1.2.2 植物乳杆菌对硒的生物吸附及细菌计数 在含不同质量浓度亚硒酸钠(Na2SeO3)(0、100、150、200、300 μg/mL)的MRS液体培养基中接种200 μL初始密度为1.285×108 CFU/mL的植物乳杆菌,37 ℃下有氧静置培养24 h。富硒后的菌液以3 500 r/min离心10 min,去上清液,用无菌蒸馏水洗涤沉淀3次,然后放入恒温烘箱,37 ℃下烘干60 h。采用配备八级杆反应池系统(ORS)的Agilent 7500cx ICP-MS (美国安捷伦科技公司)测定培养液中的硒含量。
将各组富硒后的原液重悬,分别吸取100 μL于900 μL的MRS液体培养基中进行梯度稀释,取每个稀释度的菌悬液200 μL,用无菌涂布棒均匀涂在MRS固体培养基上,每个稀释度设置3个平行对照,37 ℃下培养24 h,待每个平板形成30~300的菌落时计数。
1.2.3 扫描电子显微镜(SEM)分析 将植物乳杆菌菌株在MRS培养基中37 ℃下培养12 h,将其转移到24孔板中,在含有200 μg/mL Na2SeO3的MRS培养基中37 ℃下培养24 h,然后将细菌用体积分数为2.5%的戊二醛固定,在室温下放置1 h,用PBS洗涤3次。该菌在系列梯度乙醇(体积分数为30%~100%)中脱水,用100%的叔丁醇置换乙醇,干燥后在真空冷冻干燥机中涂金,使用HITACHI SU8010发射场扫描电镜(日立航空航天公司)对样品进行扫描。
1.2.4 富硒饲料的制备 在含有亚硒酸钠200 μg/mL的MRS液体培养基(10 mL)中接种200 μL初始密度为1.285×108 CFU/mL的植物乳杆菌,37 ℃下有氧静置培养24 h。重悬富硒后的菌液,转入10 mL离心管中,以3 500 r/min离心10 min,去上清液,用无菌蒸馏水洗涤沉淀3次后,加入一定量的无菌蒸馏水,摇匀,转入喷壶内,再加入适量的无菌蒸馏水混匀,喷洒在基础饲料上,搅拌均匀,将饲料在37 ℃下烘干,于4 ℃冰箱中保存备用。制作完成的饲料中纳米硒含量为5 mg/kg,植物乳杆菌含量为3.125×108 CFU/kg。对照组饲料喷洒相同量的无菌蒸馏水,37 ℃下烘干备用。基础饲料购自中国天津傲农生物技术有限公司,粗蛋白质、粗脂肪和灰分含量分别为35%、4%和15%(均为质量分数)。
1.2.5 试验设计 大鳞鲃鱼种来自黑龙江水产研究所呼兰试验站,初始体质量为(75.4±0.9)g。试验鱼在钢化玻璃鱼缸(90 cm×55 cm×55 cm)中养殖。试验前,驯化14 d,使其充分适应试验环境。按体质量的1%~2%饲喂,每天2次(9:00和17:00)。养殖期间水体溶解氧质量浓度为(6.46±0.25)mg/L,pH为(7.53±0.15),水温为(23±2)℃,光暗比为13 h∶11 h。
将225尾鱼随机分配在9个钢化玻璃鱼缸内养殖,每缸25尾。设置对照组、铅组(Pb)和富硒铅组(SL+Pb)3组(表1),每组设3个重复,养殖试验共进行14 d。水中加铅0.2 mg/L[乙酸铅,分子式为Pb(CH3COO)2·3H2O,购自天津市天力化学试剂有限公司],铅浓度的设定依照先前的研究[11];饲料中添加富含硒的植物乳杆菌(纳米硒含量为5 mg/kg,植物乳杆菌含量为3.125×108 CFU/kg),所有饲料保存在4 ℃下直至使用。为了维持植物乳杆菌的活性,含富硒植物乳杆菌的饲料在2 d内喂食。每天换水一次,一次换水90 L,并根据试验浓度加入相对应的铅,以保持水中铅的浓度,水体实测铅浓度如表1所示。
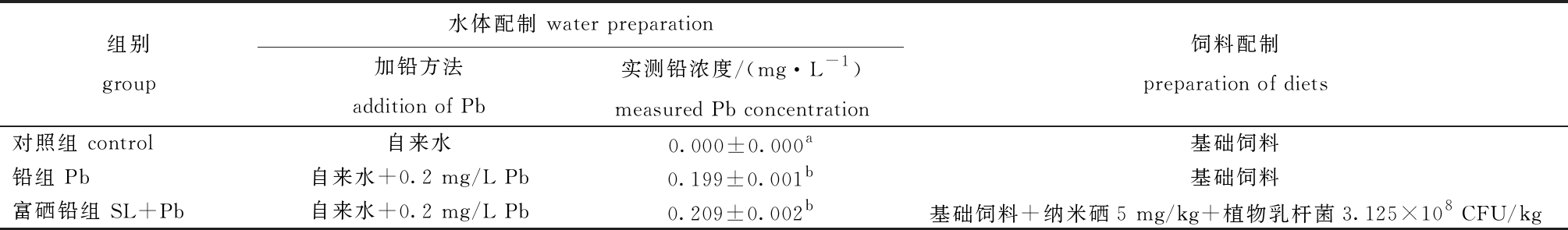
表1 各试验组水体和饲料的配制
Tab.1 Preparation of water and diets in each experimental group
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences, et sequentia.
组别group水体配制 water preparation加铅方法addition of Pb实测铅浓度/(mg·L-1)measured Pb concentration饲料配制preparation of diets对照组 control自来水0.000±0.000a基础饲料铅组 Pb自来水+0.2 mg/L Pb0.199±0.001b基础饲料富硒铅组 SL+Pb自来水+0.2 mg/L Pb0.209±0.002b基础饲料+纳米硒5 mg/kg+植物乳杆菌3.125×108 CFU/kg
1.2.6 样本采集 采集样本前将鱼禁食一天。采用质量浓度为300 mg/L的甲磺酸盐222(MS-222)对鱼麻醉后,从每个鱼缸中随机抽取12尾鱼,解剖分离其肾、肝、肠、鳃和肌肉组织,将样品在液氮中速冻后,置于-80 ℃超低温冰箱中保存至分析。
1.2.7 硒和铅含量测定 采用电感耦合等离子体质谱(ICP-MS)法测定水中铅含量和鱼体各组织中硒和铅的含量。采用MarXpress微波封闭系统进行消解,将0.5 g组织样品转移到聚四氟乙烯容器中,加入5 mL硝酸、3 mL超纯水,然后于10.5 min内将温度提升到185 ℃,并在此温度下保持14.5 min。将消解后的透明液体用超纯水稀释至25 mL。取10 mL稀释后的液体于10 mL离心管中,加入100 μL内标溶液(100 μg/L),摇匀。使用Agilent 7500cx ICP-MS测定硒和铅的含量。
1.2.8 抗氧化酶指标测定 采用试剂盒(南京建成生物工程研究所)测定大鳞鲃肾和鳃组织中的CAT、SOD、GPx活性和MDA含量。
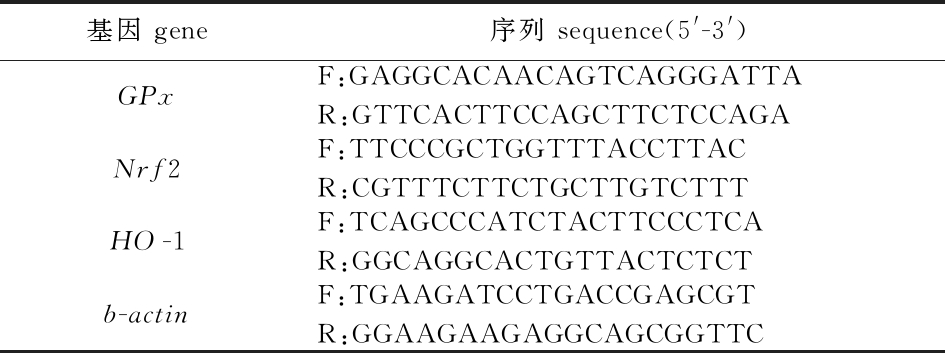
1.2.9 荧光定量PCR 使用Simply P总RNA提取试剂盒(杭州博日科技股份有限公司)从大鳞鲃肾脏中提取总RNA。根据PrimeScriptTM RT试剂盒和gDNA Eraser (北京宝日医生物技术有限公司)说明书,使用1 μL总RNA进行cDNA反转录,并进行实时荧光定量PCR,qRT-PCR反应在QuantStudio 6实时PCR系统上进行。用于抗氧化基因Nrf2、HO-1和GPx基因表达分析的引物序列见表2。根据2-ΔΔCt方法计算每个基因的相对表达量。
表2 荧光定量PCR引物序列
Tab.2 Primers used for qRT-PCR
基因 gene序列 sequence(5'-3')GPxF:GAGGCACAACAGTCAGGGATTAR:GTTCACTTCCAGCTTCTCCAGANrf2F:TTCCCGCTGGTTTACCTTACR:CGTTTCTTCTGCTTGTCTTTHO-1F:TCAGCCCATCTACTTCCCTCAR:GGCAGGCACTGTTACTCTCTb-actinF:TGAAGATCCTGACCGAGCGTR:GGAAGAAGAGGCAGCGGTTC
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。采用SPSS 20.0软件对试验数据进行单因素方差分析(one-way ANOVA),并用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 植物乳杆菌菌落数
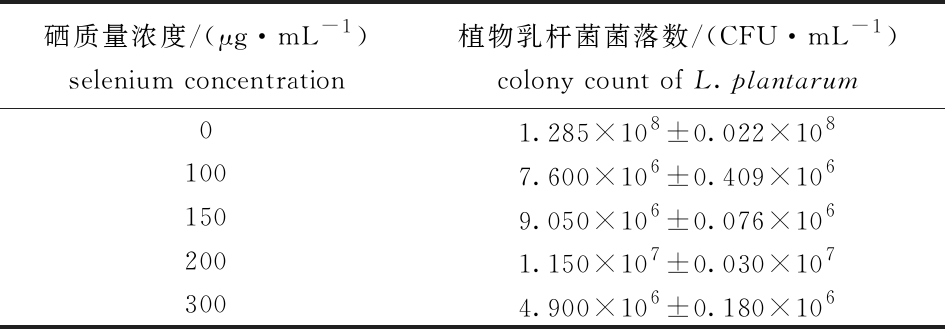
为了得到较高的活菌数,在不同浓度的亚硒酸钠中接种植物乳杆菌后,测定了不同硒浓度下植物乳杆菌的菌落数。从表3可见,硒质量浓度由 100 μg/mL增加到200 μg/mL时,菌落数逐渐上升,硒质量浓度继续增大到300 μg/mL时,菌落数下降,其中,200 μg/mL组菌落数最多,为1.150×107 CFU/mL,表明该组植物乳杆菌的活力最强。
表3 加硒后植物乳杆菌菌落数
Tab.3 Colony count of Lactobacillus plantarum with addition of selenium
硒质量浓度/(μg·mL-1)selenium concentration植物乳杆菌菌落数/(CFU·mL-1)colony count of L.plantarum01.285×108±0.022×1081007.600×106±0.409×1061509.050×106±0.076×1062001.150×107±0.030×1073004.900×106±0.180×106
2.2 生物吸附试验和扫描电镜分析
从表3可见,150、200 μg/mL硒质量浓度组乳杆菌活菌数相对较高,因此,挑选这两组测定纳米硒的含量。使用Agilent 7500cx ICP-MS测定植物乳杆菌将无机硒转化为纳米硒的含量。结果显示,150、200 μg/mL硒质量浓度组纳米硒含量分别为134、184 μg/mL。综合分析,200 μg/mL硒质量浓度组活菌数和纳米硒含量符合试验预期。使用扫描电镜观察对照组和200 μg/mL硒质量浓度组的植物乳杆菌,对照组植物乳杆菌表面光滑(图1(a)),200 μg/mL硒质量浓度组可清晰观察到球状纳米硒颗粒附着在植物乳杆菌表面,纳米硒直径为70~140 nm(图1(b),白色箭头)。

图1 扫描电镜下富硒植物乳杆菌的形态
Fig.1 Morphology of selenium-enriched Lactobacillus plantarum under scanning electron microscopy
2.3 大鳞鲃组织中的硒积累
从图2可见:富硒铅组大鳞鲃肝、肾、鳃、肠和肌肉组织中硒积累量均显著高于铅组和对照组(P<0.05);除肠道外,其他组织中的硒含量均为铅组显著低于对照组(P<0.05)。这表明,饲料中添加富硒植物乳杆菌后可显著提高鱼体的硒积累量。
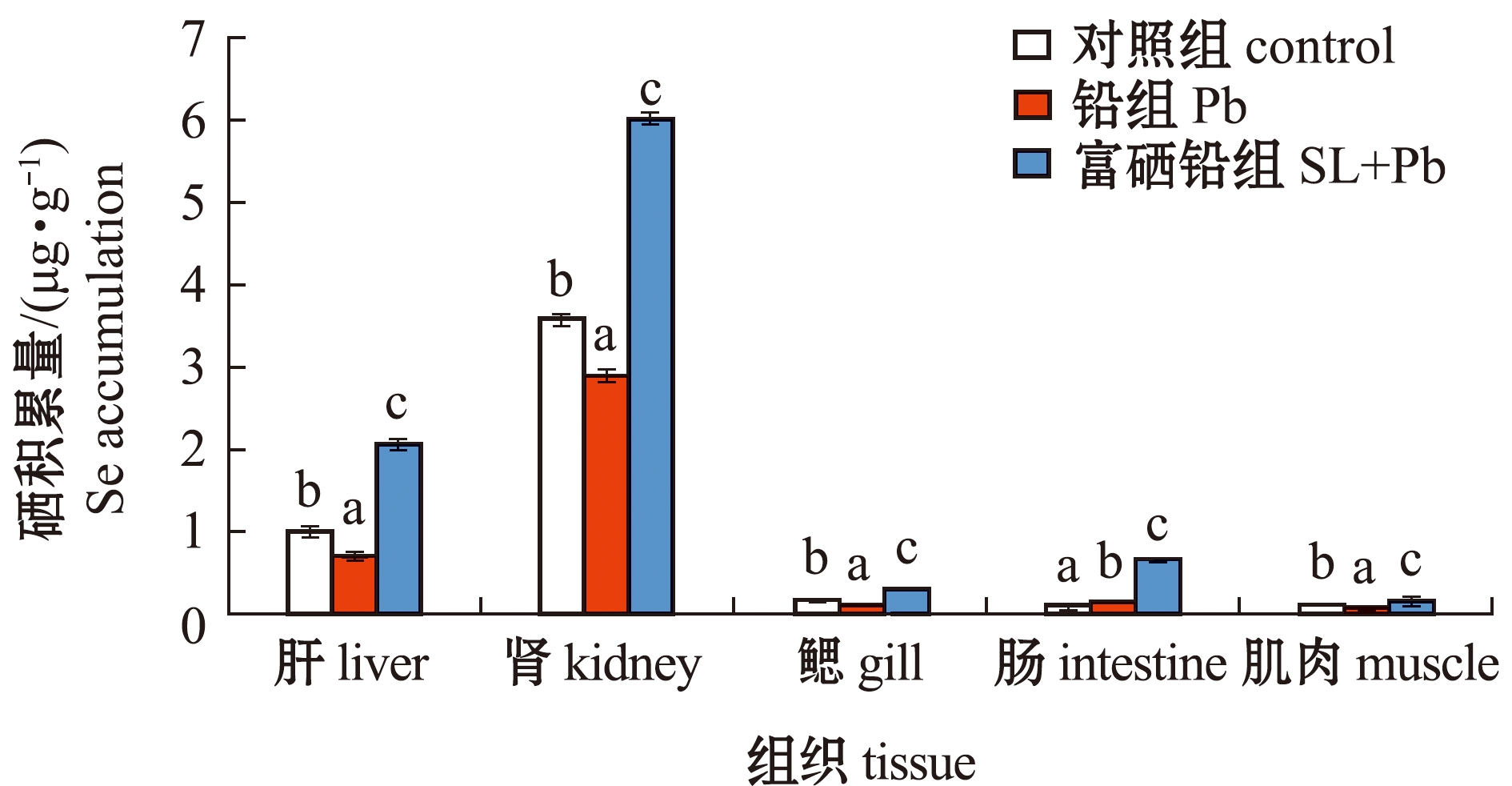
标有不同字母者表示同一组织中不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。The means with different letters within the same tissue are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same tissue are not significant differences, et sequentia.
图2 暴露于铅或/和富硒植物乳杆菌下大鳞鲃的硒积累
Fig.2 Se accumulation of Luciobarbus capito after exposure to Pb or/and selenium-enriched Lactobacillus plantarum
2.4 大鳞鲃组织中的铅积累
从图3可见:在0.2 mg/L含铅水体中,铅组和富硒铅组鱼体铅积累量均显著高于对照组(P<0.05),且鱼体不同组织中铅的积累量依次为鳃>肝>肾>肠>肌肉;富硒铅组鱼体铅积累量显著低于铅组(P<0.05)。这表明,饲料中添加富硒植物乳杆菌后,可显著降低鱼体各组织的铅积累量。
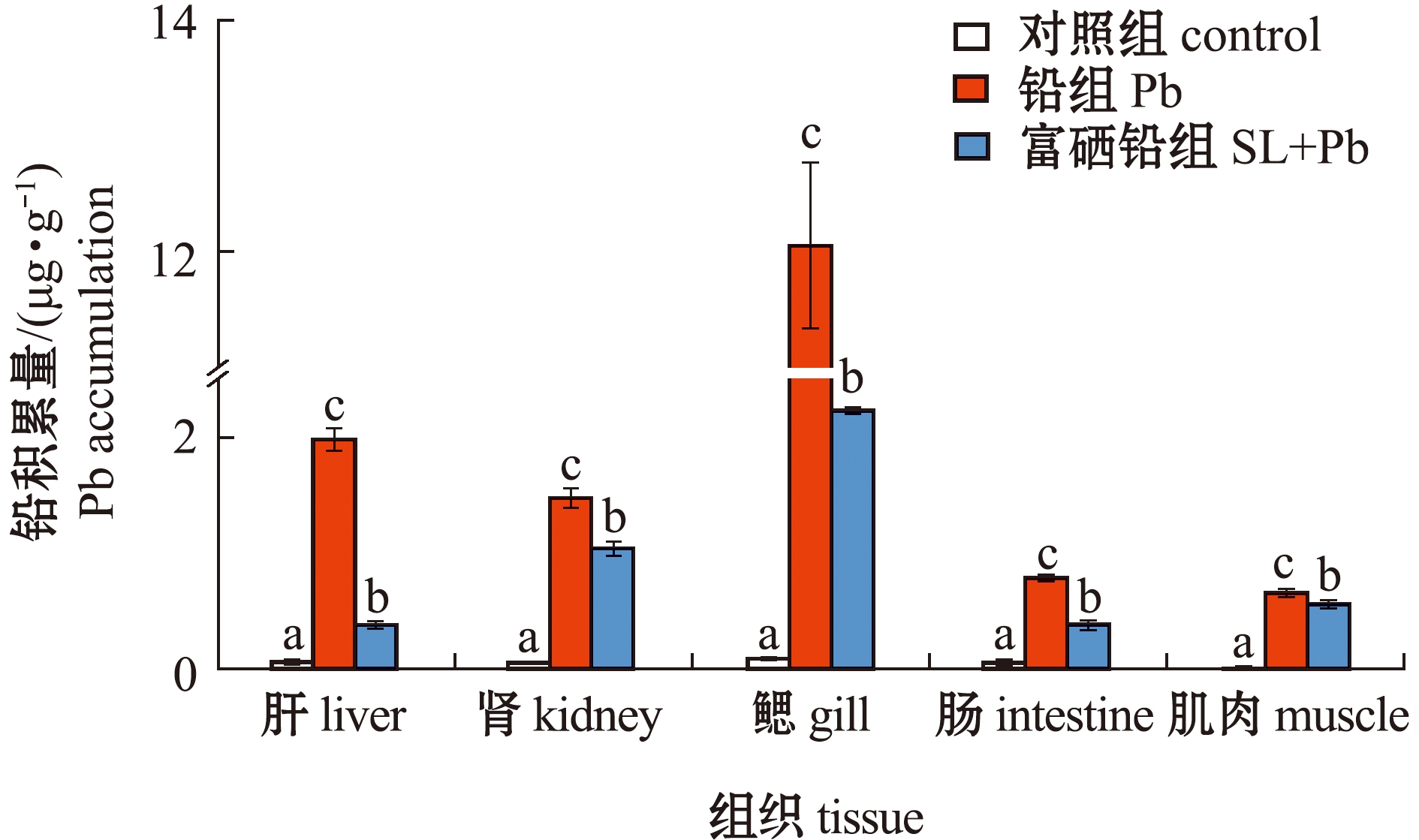
图3 暴露于铅或/和富硒植物乳杆菌下大鳞鲃的铅积累
Fig.3 Pb accumulation of Luciobarbus capito after exposure to Pb or/and selenium-enriched Lactobacillus plantarum
2.5 肾和鳃中CAT、SOD、GPx及MDA含量
从表4可见:水体中含有铅时,鱼体肾和鳃组织中的CAT、SOD和GPx活性受到了抑制,均为铅组和富硒铅组显著低于对照组(P<0.05);饲料中添加富硒植物乳杆菌后,能够显著提高铅胁迫下肾和鳃组织中CAT、SOD和GPx的活性(P<0.05),并显著降低MDA含量(P<0.05)。
表4 暴露于铅或/和富硒植物乳杆菌下大鳞鲃肾和鳃中CAT、SOD、GPx活性及MDA含量
Tab.4 Activities of CAT,SOD, and GPx and MDA content in kidneys and gills of Luciobarbus capito exposed to Pb or/and selenium-enriched Lactobacillus plantarum
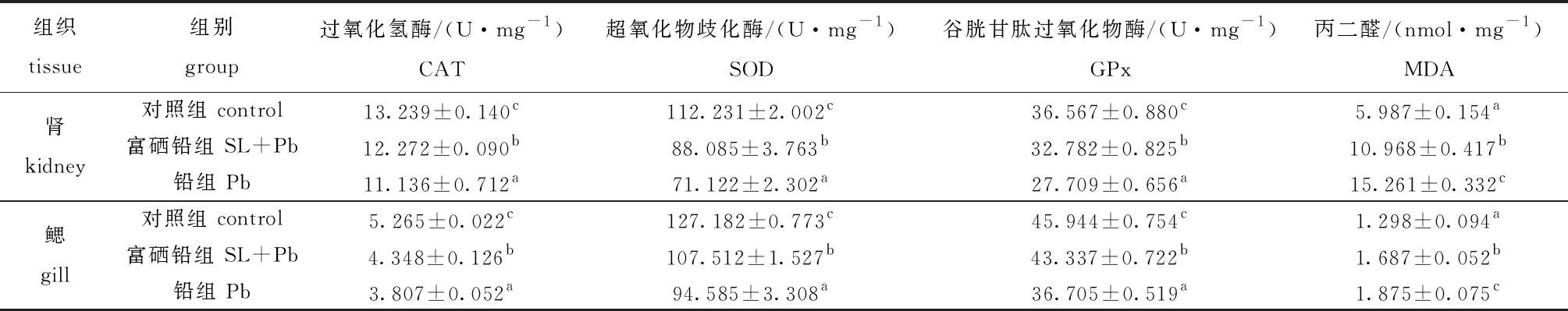
组织tissue组别group过氧化氢酶/(U·mg-1)CAT超氧化物歧化酶/(U·mg-1)SOD谷胱甘肽过氧化物酶/(U·mg-1)GPx丙二醛/(nmol·mg-1)MDA对照组 control13.239±0.140c112.231±2.002c36.567±0.880c5.987±0.154a肾kidney富硒铅组 SL+Pb12.272±0.090b88.085±3.763b32.782±0.825b10.968±0.417b铅组 Pb11.136±0.712a71.122±2.302a27.709±0.656a15.261±0.332c对照组 control5.265±0.022c127.182±0.773c45.944±0.754c1.298±0.094a鳃gill富硒铅组 SL+Pb4.348±0.126b107.512±1.527b43.337±0.722b1.687±0.052b铅组 Pb3.807±0.052a94.585±3.308a36.705±0.519a1.875±0.075c
2.6 Nrf2、HO-1和GPx基因的表达
为确定铅对大鳞鲃肾的氧化应激及富硒植物乳杆菌对铅中毒的保护作用,检测了抗氧化基因Nrf2、HO-1和GPx基因的相对表达量。从图4可见,与对照组相比,铅组和富硒铅组Nrf2、HO-1和GPx表达量均显著降低(P<0.05);与铅组相比,富硒铅组上述指标均显著增加(P<0.05)。这表明,富硒植物乳杆菌可减轻铅对肾的氧化应激。
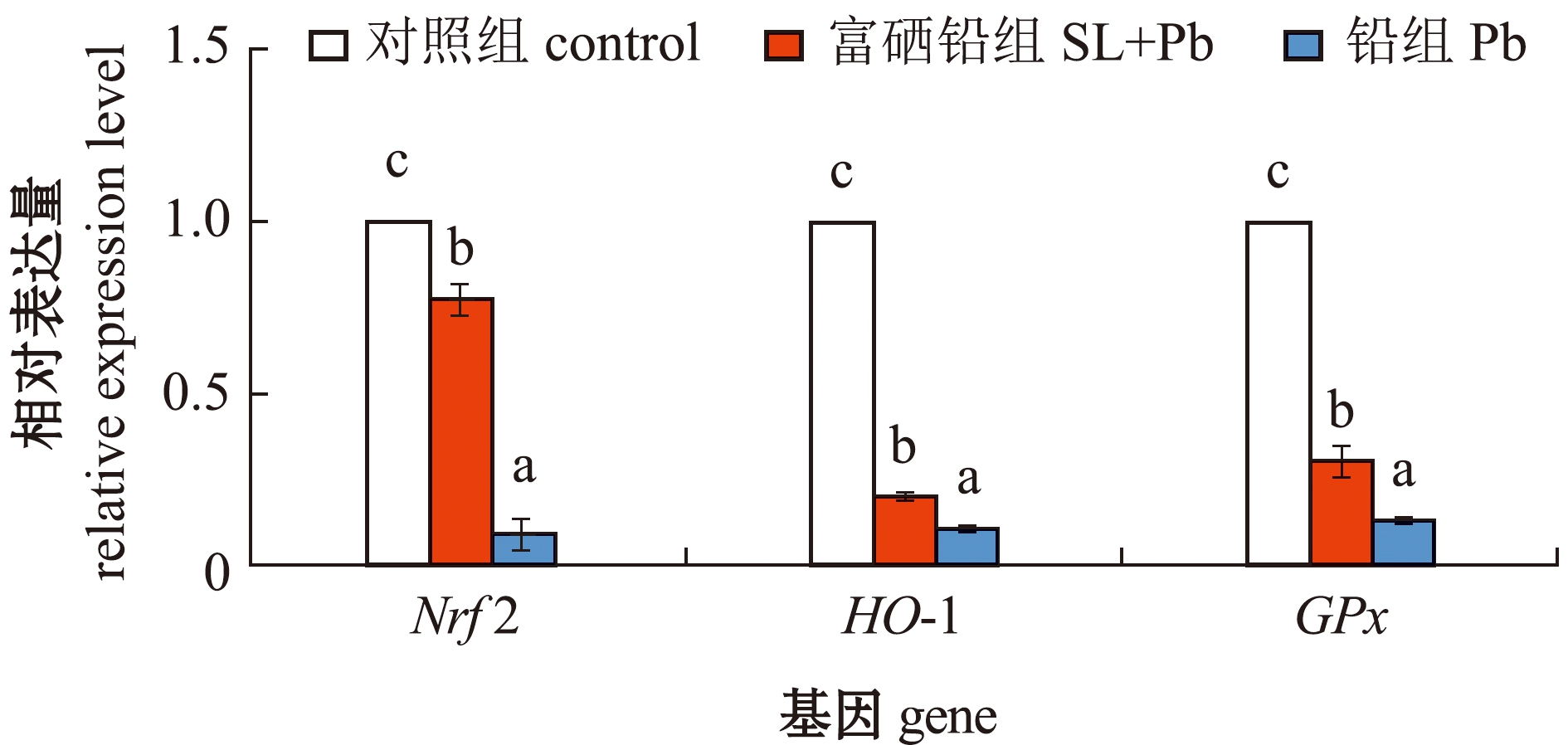
图4 暴露于铅或/和富硒植物乳杆菌下大鳞鲃肾中Nrf2、HO-1和GPx基因的相对表达量
Fig.4 Relative expression levels of Nrf2, HO-1 and GPx mRNA in kidneys of Luciobarbus capito exposed to Pb or/and selenium-enriched Lactobacillus plantarum
3 讨论
3.1 无机硒对植物乳杆菌的影响
在富硒益生菌制备过程中,硒的类型(Na2SeO3和Na2SeO4)和外部培养环境中的硒浓度,会影响硒的富集过程和纳米硒的转化率[12]。研究发现,高浓度的硒对细菌的生长具有一定的抑制作用,并引起氧化应激反应[13-15]。但也有研究发现,植物乳杆菌在任何浓度的Na2SeO3中其生长均受到抑制[16]。本研究中,测定了各硒浓度下的植物乳杆菌菌落数,结果显示,富硒后的植物乳杆菌菌落数均显著低于无硒的对照组,且不同硒质量浓度组间相比,200 μg/mL硒质量浓度组中菌落数最多,为1.150×107 CFU/mL,说明在硒存在的条件下乳杆菌生长受到了明显抑制,这与Palomo-siguero等[14]和Zhang等[15]的研究结果相似。
3.2 富硒植物乳杆菌对硒和铅积累的影响
研究发现,异育银鲫(Carassius auratus gibelio)在铅胁迫下,鳃、肝、肾、肌肉和肠道中会有显著的铅积累[17]。在暴露于含铅水体中的乌鳢(Channa argus)组织中,发现了大量的铅积累,各组织中铅积累量依次为鳃>肠>肝>肌肉[11]。本研究中,铅在大鳞鲃鳃组织中积累量最多,肌肉中最少。鳃是鱼类呼吸和渗透压调节的重要器官,最先与含有金属离子的水体接触,因此,在鳃组织中会测定到较高的生物积累[18]。而对吉利慈鲷(Tilapia zillii)和条纹鲮脂鲤(Prochilodus lineatus)的研究也发现,肌肉中铅积累量最少[19-20],这与本研究结果类似。
研究表明,在日粮中添加植物乳杆菌LP33和植物乳杆菌CCFM8661,均能缓解小鼠铅诱导的氧化应激,调节胆汁酸的肝肠循环,诱导粪便中铅的排泄,降低血液和组织中的铅水平,植物乳杆菌对铅中毒具有显著的保护作用[9,21]。乳酸杆菌属具有吸附重金属的能力,主要方式为离子交换、络合和螯合等[22]。近期研究表明,在日粮中添加富硒枯草芽孢杆菌可显著降低鲤体内汞(Hg)的积累,原因可能是当富硒枯草芽孢杆菌进入鱼肠道时,其释放硒,同时该菌又吸附汞[23]。在小鼠的日粮中添加富硒鼠李糖乳杆菌(Lacticaseibacillus rhamnosus),能显著降低铅胁迫下血液和肝脏中的铅积累量,增加粪便中的铅排泄[24]。这可能是进入体内的硒能与铅形成硒铅络合物,或者与铅竞争性结合生物配体,促进铅的排泄,从而减少体内铅积累,降低铅毒性[7]。本研究中,与铅组相比,富硒铅组鱼体不同组织中的铅积累显著降低,硒积累显著增加。推测富硒铅组进入组织中的铅与硒一部分以络合物的形式结合,并通过肝、肾代谢到体外,或者一部分铅在进入或被重吸收之前与植物乳杆菌结合,从而增加鱼粪便中铅的排泄,抑制肠道吸收,减少各组织铅的积累。
与大多数研究相似,投喂富硒植物乳杆菌能增加大鳞鲃各组织中的硒含量。但本研究中铅组肠道的硒含量显著高于对照组,推测原因可能有两方面:一是在饲喂过程中,水中的铅随饲料进入肠道,由于基础饲料中本身含有约0.5 mg/kg的硒,基础饲料中的硒和铅通过吸收进入肠壁后,在肠道中形成硒铅络合物[7],未被及时完全代谢到体外;二是肠壁中的硒还能被硒蛋白(如GPx)利用,铅与GPx有较高的亲和力并能紧密结合[25],故出现铅组肠道硒含量较高的现象。
3.3 富硒植物乳杆菌对铅胁迫下抗氧化酶的影响
有研究报道,铅中毒可通过产生活性氧、降低抗氧化能力和消耗抗氧化剂而导致氧化应激[11]。铅胁迫引起异育银鲫肝脏和鳃中SOD、CAT和GSH活力降低[17]。本研究中,大鳞鲃被铅胁迫14 d后,肾和鳃中SOD、CAT和GPx活性显著降低。铅具有电子共享的能力,进入鱼体内的铅以共价键的形式与抗氧化酶中存在的巯基间形成连接,而抗氧化酶是铅最敏感的目标,最终会失活;同时,铅还可以取代作为这些抗氧化酶(SOD、CAT)的重要辅助因子锌离子并使它们失活[26]。此外,铅与谷胱甘肽过氧化物酶(GPx3)具有较高的结合亲和力,并以3∶1的比例与GPx3的结构域紧密结合,从而导致GPx失活[25]。最近的研究表明,富硒鼠李糖乳杆菌能减少铅诱导的SOD和GPx活性降低,缓解小鼠体内氧化应激和组织损伤[24]。本研究中,在饲喂富硒植物乳杆菌后,能显著增加大鳞鲃SOD、CAT和GPx活性,提高鱼体抗氧化水平,缓解铅胁迫的氧化应激,这表明富硒植物乳杆菌对铅毒性引起的氧化损伤具有保护作用。分析其原因,硒是硒蛋白活性中心的关键组成成分,投喂富硒植物乳杆菌后,在组织中发现较高的硒含量,增强了硒酶(如GPx等)的活性,提升了鱼体抗氧化的水平,从而缓解了铅胁迫下的氧化应激[27]。植物乳杆菌也能增强机体抗氧化酶活力[8],同时,硒能与铅形成螯合物被代谢到体外,进一步减少体内铅的含量,从而缓解抗氧化酶的消耗。
MDA是脂质过氧化(LPO)的主要产物,是反映机体受到氧化损伤的重要指标。本研究中,铅胁迫导致肾和鳃中MDA水平增加,这与Zhao等[11]报道的结果一致,较高的LPO含量表明,肾和鳃可能受到氧化损伤。当饲喂富硒植物乳杆菌后,MDA水平显著降低,这表明富硒植物乳杆菌能够缓解铅诱导的氧化应激。综上,纳米硒拮抗铅毒性的机制可能归因于硒能增强抗氧化酶的活性或硒与铅形成螯合物被代谢到体外。
3.4 富硒植物乳杆菌对抗氧化基因表达的影响
氧化应激是铅中毒的主要机制[26]。Nrf2是氧化应激反应的主要调节因子,可抑制ROS的产生,调节下游靶基因的转录[28]。在稳态条件下,Nrf2水平及其激活主要由Kelch样ECH 相关蛋白1(Keap1)控制。一些有毒金属能将Nrf2和Keap1解偶联,Nrf2从核孔复合体转移到细胞核,通过其bZip结构域与小Maf蛋白(MafF、MafG和MafK)形成二聚体,并与抗氧化反应元件(ARE)序列结合,诱导其转录激活,并调控下游与解毒和抗氧化相关的细胞保护基因的转录[29-30]。血红素氧合酶1基因(HO-1)是Nrf2的靶基因,其通过启动促氧化剂血红素的氧化裂解,形成抗氧化剂一氧化碳和胆绿素来对抗细胞应激,由于这些抗氧化剂的产生,故HO-1蛋白被认为是一种细胞保护酶[31]。研究表明,铅胁迫导致大鼠肾细胞核和细胞质中Nrf2及其下游靶基因HO-1、醌氧化还原酶1基因(NQO1)水平降低[32]。本研究中也发现类似的结果,铅胁迫抑制大鳞鲃肾脏Nrf2及其下游靶基因HO-1和GPx的表达,降低SOD、CAT和GPx的活力。当Nrf2介导的防御反应不足以承受重金属的毒性,这可能导致机体产生氧化应激、细胞凋亡和Nrf2积累减少[21]。本研究中,饲喂富硒植物乳杆菌治疗后,缓解了Nrf2及其下游靶基因HO-1和GPx表达的降低。研究表明,植物乳杆菌FC225能显著提高小鼠肝Nrf2基因的表达[33],而植物乳杆菌LP33能恢复铅抑制大鼠肝脏中的AMPK/AKT/Nrf2信号通路[21]。硒和铅触发了绵羊睾丸间质细胞Nrf2通路,增加Nrf2及其下游靶基因HO-1、NQO1的表达[5]。硒的生物学功能主要通过参与维持细胞氧化还原平衡的硒蛋白发挥作用,补充硒能显著增加GPx基因表达及其酶活力[34]。富硒植物乳杆菌拮抗铅毒性的机制,可能是通过调节硒蛋白的表达激活Nrf2通路,减少抗氧化酶水平的消耗来实现的。
4 结论
1)植物乳杆菌可将无机硒转化为有机硒和纳米硒。
2)富硒植物乳杆菌能增加大鳞鲃体内硒含量,减少铅胁迫下大鳞鲃组织中铅的生物积累。
3)富硒植物乳杆菌通过增强抗氧化酶的活性,减少抗氧化基因Nrf2及其靶基因HO-1和GPx的消耗,从而缓解铅胁迫下大鳞鲃肾脏的氧化应激。
[1] KIM J H,KANG J C.The immune responses in juvenile rockfish,Sebastes schlegelii for the stress by the exposure to the dietary lead (Ⅱ)[J].Environmental Toxicology and Pharmacology,2016,46:211-216.
[2] KIM J H,KANG J C.The lead accumulation and hematological findings in juvenile rock fish Sebastes schlegelii exposed to the dietary lead (Ⅱ) concentrations[J].Ecotoxicology and Environmental Safety,2015,115:33-39.
[3] 王吉桥,王志香,张凯,等.饲料中添加蛋氨酸硒对仿刺参幼参存活、生长及免疫指标的影响[J].大连海洋大学学报,2012,27(2):110-115.
WANG J Q,WANG Z X,ZHANG K,et al.Effects of dietary selenomethionine levels on growth and some immune indices in juvenile sea cucumber Apostichopus japonicus[J].Journal of Dalian Ocean University,2012,27(2):110-115.(in Chinese)
[4] ÖZKAN-YILMAZ F,ÖZLÜER-HUNT A,GÜNDÜZ S G,et al.Effects of dietary selenium of organic form against lead toxicity on the antioxidant system in Cyprinus carpio[J].Fish Physiology and Biochemistry,2014,40(2):355-363.
[5] SHI L,WANG X L,DUAN Y L,et al.Antagonistic effects of selenium on lead-induced oxidative stress and apoptosis of Leydig cells in sheep[J].Theriogenology,2022,185:43-49.
[6] 杨永存,李浩,杨冬燕,等.硒对铅毒性拮抗作用的研究进展[J].食品安全质量检测学报,2018,9(1):1-6.
YANG Y C,LI H,YANG D Y,et al.Advances in antagonistic effects of selenium on lead toxicity[J].Journal of Food Safety & Quality,2018,9(1):1-6.(in Chinese)
[7] 李敏,高俊全,李筱薇.硒对铅毒性的拮抗作用[J].卫生研究,2005,34(3):375-377.
LI M,GAO J Q,LI X W.Antagonistic action of selenium against the toxicity of lead[J].Journal of Hygiene Research,2005,34(3):375-377.(in Chinese)
[8] 任雪.植物乳杆菌和复合益生菌对凡纳滨对虾生长、抗氧化及抗病力等的影响[D].大连:大连海洋大学,2022.
REN X.Effects of Lactobacillus plantarum and compound probiotics on the growth performance,antioxidation capacity and disease resistance of Litopenaeus vannamei[D].Dalian:Dalian Ocean University,2022.(in Chinese)
[9] ZHAI Q X,LIU Y,WANG C,et al.Lactobacillus plantarum CCFM8661 modulates bile acid enterohepatic circulation and increases lead excretion in mice[J].Food & Function,2019,10(3):1455-1464.
[10] 张宇婷,杨建,耿龙武,等.NaHCO3碱度胁迫对大鳞鲃氧化应激水平的影响[J].中国海洋大学学报(自然科学版),2021,51(11):32-39.
ZHANG Y T,YANG J,GENG L W,et al.Effect of NaHCO3 alkalinity on oxidative stress of Luciobarbus capito[J].Periodical of Ocean University of China(Natural Science Edition ),2021,51(11):32-39.(in Chinese)
[11] ZHAO L,ZHENG Y G,FENG Y H,et al.Toxic effects of waterborne lead (Pb) on bioaccumulation,serum biochemistry,oxidative stress and heat shock protein-related genes expression in Channa argus[J].Chemosphere,2020,261:127714.
[12] YANG J,YANG H.Recent development in Se-enriched yeast,lactic acid bacteria and bifidobacteria[J].Critical Reviews in Food Science and Nutrition,2021,63(3):411-425.
[13] KIELISZEK ![]() S,BZDUCHA-WR
S,BZDUCHA-WR BEL A,et al.Effect of selenium on growth and antioxidative system of yeast cells[J].Molecular Biology Reports,2019,46(2):1797-1808.
BEL A,et al.Effect of selenium on growth and antioxidative system of yeast cells[J].Molecular Biology Reports,2019,46(2):1797-1808.
[14] PALOMO-SIGUERO M,GUTI RREZ A M,P
RREZ A M,P REZ-CONDE C,et al.Effect of selenite and selenium nanoparticles on lactic bacteria:a multi-analytical study[J].Microchemical Journal,2016,126:488-495.
REZ-CONDE C,et al.Effect of selenite and selenium nanoparticles on lactic bacteria:a multi-analytical study[J].Microchemical Journal,2016,126:488-495.
[15] ZHANG B W,ZHOU K,ZHANG J L,et al.Accumulation and species distribution of selenium in Se-enriched bacterial cells of the Bifidobacterium animalis 01[J].Food Chemistry,2009,115(2):727-734.
[16] XU X X,BAO Y J,WU B B,et al.Chemical analysis and flavor properties of blended orange,carrot,apple and Chinese jujube juice fermented by selenium-enriched probiotics[J].Food Chemistry,2019,289:250-258.
[17] YIN Y W,ZHANG P J,YUE X Y,et al.Effect of sub-chronic exposure to lead (Pb) and Bacillus subtilis on Carassius auratus gibelio:bioaccumulation,antioxidant responses and immune responses[J].Ecotoxicology and Environmental Safety,2018,161:755-762.
[18] ALVES L C,WOOD C M.The chronic effects of dietary lead in freshwater juvenile rainbow trout (Oncorhynchus mykiss) fed elevated calcium diets[J].Aquatic Toxicology,2006,78(3): 217-232.
[19] AY O,KALAY M,TAMER L,et al.Copper and lead accumulation in tissues of a freshwater fish Tilapia zillii and its effects on the branchial Na,K-ATPase activity[J].Bulletin of Environmental Contamination and Toxicology,1999,62(2):160-168.
[20] RIBEIRO A M,RISSO W E,FERNANDES M N,et al.Lead accumulation and its effects on the branchial physiology of Prochilodus lineatus[J].Fish Physiology and Biochemistry,2014,40(3):645-657.
[21] HU T,SONG J J,ZENG W Y,et al.Lactobacillus plantarum LP33 attenuates Pb-induced hepatic injury in rats by reducing oxidative stress and inflammation and promoting Pb excretion[J].Food and Chemical Toxicology,2020,143:111533.
[22] MICHALAK M,GUSTAW K,WASKO A,et al.Biosorption of cadmium ions by cell surface structures of bacteria from Lactobacillus species[J].Postepy Mikrobiologii,2016,55(4):381-391.
[23] SHANG X C,SUN Q S,YIN Y W,et al.Reducing mercury accumulation in common carp using selenium-enriched Bacillus subtilis[J].Aquaculture Reports,2021,19:100609.
[24] JIN H,RIAZ RAJOKA M S,XU X G,et al.Potentials of orally supplemented selenium-enriched Lacticaseibacillus rhamnosus to mitigate the lead induced liver and intestinal tract injury[J].Environmental Pollution,2022,302:119062.
[25] ZHANG H,LUAN L Y,BI M J,et al.In vivo and in vitro studies on inactivation of selenium containing protein- glutathione peroxidase 3 in mice nephrocytes caused by lead[J].Ecotoxicology and Environmental Safety,2020,203:111008.
[26] FLORA G,GUPTA D,TIWARI A.Toxicity of lead:a review with recent updates[J].Interdisciplinary Toxicology,2012,5(2):47-58.
[27] ZWOLAK I,ZAPOROWSKA H.Selenium interactions and toxicity:a review.selenium interactions and toxicity[J].Cell Biology and Toxicology,2012,28(1):31-46.
[28] MA Q.Role of nrf2 in oxidative stress and toxicity[J].Annual Review of Pharmacology and Toxicology,2013,53:401-426.
[29] SILVA-ISLAS C A,MALDONADO P D.Canonical and non-canonical mechanisms of Nrf2 activation[J].Pharmacological Research,2018,134:92-99.
[30] BATAILLE A M,MANAUTOU J E.Nrf2:a potential target for new therapeutics in liver disease[J].Clinical Pharmacology and Therapeutics,2012,92(3):340-348.
[31] LOBODA A,DAMULEWICZ M,PYZA E,et al.Role of Nrf2/HO-1 system in development,oxidative stress response and diseases:an evolutionarily conserved mechanism[J].Cellular and Molecular Life Sciences,2016,73(17):3221-3247.
[32] LU J J,JIANG H J,LIU B Y,et al.Grape seed procyanidin extract protects against Pb-induced lung toxicity by activating the AMPK/Nrf2/p62 signaling axis[J].Food and Chemical Toxicology,2018,116:59-69.
[33] GAO D W,GAO Z R,ZHU G H.Antioxidant effects of Lactobacillus plantarum via activation of transcription factor Nrf2[J].Food & Function,2013,4(6):982-989.
[34] WANG X Y,BAO R K,FU J.The antagonistic effect of selenium on cadmium-induced damage and mRNA levels of selenoprotein genes and inflammatory factors in chicken kidney tissue[J].Biological Trace Element Research,2018,181(2):331-339.