鸭绿沙塘鳢(Odontobutis yaluensis)隶属于鲈形目(Perciformes)虾虎鱼亚目(Gobioidei)沙塘鳢科(Odontobutidae)沙塘鳢属(Odontobutis)[1-2],仅分布于中国辽宁省东部山区的辽河支流太子河、鸭绿江中下游及其支流、大洋河和辽东半岛的碧流河,为中国特有经济鱼类[3]。鸭绿沙塘鳢肉质细嫩,味道鲜美,深受消费者喜爱。由于酷渔滥捕和环境改变,其自然资源日趋衰退,2016年被评估为《中国脊椎动物红色名录》易危(vulnerable, VU)鱼类[4]。鸭绿沙塘鳢开发前景较好,两年养殖周期即可达到商品规格,其价格在160元/kg以上,市场供不应求 [5],但苗种来源主要靠野外捕捞,量少且不确定的因素众多,养殖户往往一苗难求,因此,其规模化人工繁殖和苗种生产迫在眉睫。关于鸭绿沙塘鳢的研究主要集中在人工繁殖试验、种群繁殖力、初次性成熟和开口饵料等方面[6-8]。王吉桥等[9]观察了鸭绿沙塘鳢胚胎及仔稚鱼发育特点,并将仔稚鱼划分到胚胎期内。目前,该鱼的规模化苗种生产效率仍然低下,其原因是对鸭绿沙塘鳢繁育生物学了解较少。
饥饿是影响仔鱼成活的重要原因之一,Blaxter等[10]首次提出不可逆点(point of no return, PNR)的概念,饥饿仔鱼抵达该时间点时,尽管还能生存较长一段时间,但50%个体已虚弱到不可能再恢复摄食能力,进入生态死亡阶段。利用饥饿试验确定仔鱼开口率及不可逆点,对于早期仔鱼培育极其重要,类似的研究已在多种鱼类中开展[11-13],但鸭绿沙塘鳢的不可逆点未见报道。本研究中,通过对仔稚鱼的发育观察和饥饿胁迫试验,观察鸭绿沙塘鳢仔稚鱼的发育特点,确定仔鱼最佳投饵时间及PNR,以期为鸭绿沙塘鳢苗种培育提供基础资料。
1 材料与方法
1.1 材料
于2020年10月—2021年3月,在辽宁省新宾满族自治县太子河、碧流河水库上游和丹东凤城叆河用地笼采捕鸭绿沙塘鳢亲本600尾,在大连昌盛源水产有限公司水泥池(圆柱形,直径5 m,水深0.6 m)中流水培育,投喂适口鲜活泥鳅(Misgurnus anguillicaudatus)、麦穗鱼(Pseudorasbora parva)和彩石鳑鲏(Rhodeus lighti)等。2021年4月进行人工繁殖获得受精卵,在13.0~19.4 ℃自然水温下,经38.5 d破膜获得仔鱼9 893尾。
1.2 方法
1.2.1 仔鱼培育条件 于2021年6月将初孵仔鱼放入60 L玻璃水族箱(0.5 m×0.3 m×0.4 m)中培育,试验用水为充分曝气且经孔径为48 μm的筛绢网过滤的七道房水库水,水温为19.7~26.7 ℃,微充气,溶解氧为7.9~10.8 mg/L,pH为7.1~7.5。每天吸污换水1次,注换水1/3,记录水温和仔鱼死亡情况。
1.2.2 饵料 试验前期即孵化后0~6日龄仔鱼,投喂饵料主要为经孔径为180 μm的筛绢网过滤的枝角类、桡足类等;试验后期即7日龄以上仔鱼,投喂水丝蚓(Limnodrilus),每1 kg水丝蚓加入0.5~1.0 g盐酸恩诺沙星,用豆浆机绞碎后(长度约5 mm)均匀泼洒投喂。
1.2.3 仔稚鱼发育观察及饥饿试验 将刚破膜仔鱼分为3组,A组为正常投喂组(对照),B、C组为饥饿组,每组仔鱼1 000尾,分别放于60 L的水族箱内。每天定时向A组投喂饵料,B、C组不投喂。A组用于仔稚鱼发育观察,B组用于统计累计死亡率,C组用于测定开口率。孵化后0~18日龄仔鱼,水温为19.7~23.2 ℃;19~44日龄仔鱼,水温为23.4~26.7 ℃。
每天从A、B组中各取30尾仔鱼,经100 mg/L MS222麻醉后,在带有目测微尺的Olympus CX21显微镜下拍照测量全长、眼径和尾柄高,以及卵黄囊和鳔的长径、短径,详细记录各个时期的主要形态特征。卵黄囊和鳔的体积(V)计算公式为
V=(4/3)π(R/2)2L1/2。
(1)
其中,R和L1分别为卵黄囊和鳔的短径和长径(mm)。
1.2.4 开口率和不可逆点的测定 每天定时从C组取出鸭绿沙塘鳢仔鱼20尾,放入1 L烧杯中,微充气,投喂足量的枝角类、桡足类等,3 h后将仔鱼取出,在显微镜下解剖观察仔鱼摄食情况,并计算开口率,计算公式为
开口率=肠道中含有食物的开口摄食仔鱼数/样本仔鱼总数×100%。
(2)
饥饿不可逆点的测定采用殷名称[14]的方法,以鸭绿沙塘鳢仔鱼孵化后的日龄(day post hatch,dph)表示,初孵仔鱼为0日龄,当所测定的仔鱼开口率低于最高开口率的50%时,即为仔鱼的PNR。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用Origin 2018软件作图,对饥饿组和投喂组生长指标采用SPSS 23.0软件进行独立样本T检验,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 鸭绿沙塘鳢仔稚鱼发育观察及生长情况
2.1.1 仔鱼期 孵化后0~14日龄,从孵化出膜至鳞片即将出现,全长为7.72~13.50 mm(图1A~H)。

A—初孵仔鱼;B—1日龄仔鱼;C—2日龄仔鱼;D—3日龄仔鱼;E—4日龄仔鱼;F—5日龄仔鱼;G—7日龄仔鱼;H—9日龄仔鱼;I—15日龄稚鱼;J—25日龄稚鱼;K—44日龄幼鱼;A~J标尺1 mm;K标尺3 mm。A—newly hatched larva; B—1 dph larva; C—2 dph larva; D— 3 dph larva;E—4 dph larva;F—5 dph larva;G—7 dph larva;H—9 dph larva;I—15 dph juvenile;J—25 dph juvenile;K—44 dph young;L—54 dph young;scale bar from A to J=1 mm; scale bar in K=3 mm.
图1 鸭绿沙塘鳢仔稚鱼发育
Fig.1 larval and juvenile development of Odontobutis yaluensis
初孵仔鱼(0日龄),全长为(7.72±0.09)mm,卵黄囊体积为(0.74±0.04)mm3。黑色素明显,主要集中在头部、卵黄囊两侧,已具与成鱼相似的3道纵列斑纹。卵黄囊经胚胎期吸收,由球形变为椭圆形,表面可见油球,大小不一。各系统发育较完善:口和消化道发育完全,口与肛门贯通;上下颌具齿,鼻孔形成,听囊内微耳石、矢耳石明显,鳃耙、鳃弓和鳃丝可见,少数鳃丝呈芽泡状突起,多数鳃丝上具鳃小片2~4个,鳃盖及鳃盖膜形成,鳔充气;血液呈红色,流动急速;头顶部隆起,尾骨上翘,第一、第二背鳍分离,各鳍已具鳍条且分节,可摆动,游动迅速。各鳍条数与成鱼相近,其中胸鳍15条,分1~4节;腹鳍5条,分1~3节;第一背鳍6条,分1节;第二背鳍10条,分1~2节;臀鳍7条,分1~2节;尾鳍15条,分1~5节。
1日龄仔鱼,全长为(7.96±0.19)mm,鳔前端持续膨大,并可开口摄食。仔鱼静卧水底,待饵料游至嘴边迅速捕食,与成鱼一样为典型的伏击型,发育积温为658.5 ℃·d。
2日龄仔鱼,全长为(8.29±0.02)mm,鳔膨大呈棒状。
4日龄仔鱼,全长为(8.94±0.65)mm,卵黄囊体积已消耗50%。
5日龄仔鱼,全长为(9.32±0.69)mm,点状及星芒状色素点进一步覆盖仔鱼体表,除臀鳍外,各鳍条基部覆盖色素点。鳍条分节逐渐增加,第一背鳍条分1节,第二背鳍条分2~4节,臀鳍条分2~3节,胸鳍条分2~6节,腹鳍条分2~4节,尾鳍条分1~6节。
6日龄仔鱼,全长为(9.85±0.45)mm,鼻孔呈椭圆形。
11日龄仔鱼,全长为(12.16±0.40)mm,第一背鳍条分1~2节,第二背鳍条分2~5节,臀鳍条分2~4节,胸鳍条分2~7节,腹鳍条分2~7节,尾鳍18条,分1~8节。
14日龄仔鱼,全长为(13.50±0.46)mm,体表色素进一步覆盖,臀鳍基部覆盖色素点。
2.1.2 稚鱼期 孵化后15~44日龄,从鳞片出现到鳞被完全,全长为13.97~27.87 mm(图1I~K)。
15日龄稚鱼,全长为(13.97±0.71)mm,尾柄部中轴线出现1枚初始鳞片,只具2道鳞嵴,发育积温为960.4 ℃·d。
18日龄稚鱼,全长为(16.32±0.75)mm,尾柄部覆满初始鳞片,具2~3道鳞嵴。卵黄囊体积已消耗90%。鼻孔外凸。各鳍条上均见色素点,色素点覆盖到尾鳍、第一背鳍、第二背鳍、臀鳍、胸鳍和腹鳍中部。
21日龄稚鱼,全长为(16.86±0.06)mm,尾柄部中轴线附近的初始鳞片出现栉齿,栉齿1个。
25日龄稚鱼,全长为(18.95±0.06)mm,尾柄部鳞片表面结构(鳞嵴、鳞焦、鳞沟和栉齿)已基本形成。栉齿1~4个。
30日龄稚鱼,全长为(21.61±1.44)mm,卵黄囊及油球消失,发育积温为1 314.7 ℃·d。
34日龄稚鱼,全长为(23.88±1.88)mm,尾鳍条分支。
44日龄稚鱼,全长为(29.66±2.19)mm,体质量为(0.293 8±0.020 2)g,头顶部及鳃盖处的鳞片覆盖形成,鳞被完全,尾柄部栉齿8~10个,部分圆鳞覆盖至尾鳍基部,色素点覆盖到各鳍全部,体特征与成鱼基本一致,胸鳍16条,分6~13节;腹鳍5条,分8~16节;第一背鳍6条,分3~6节;第二背鳍10条,分3~9节;臀鳍8条,分5~10节;尾鳍18条,分4~16节,发育进入幼鱼期,发育积温为1 667.5 ℃·d。
2.1.3 仔稚鱼的生长 从图2和图3可见,卵黄囊体积(V)与孵化后日龄(t)呈对数函数关系,拟合方程为
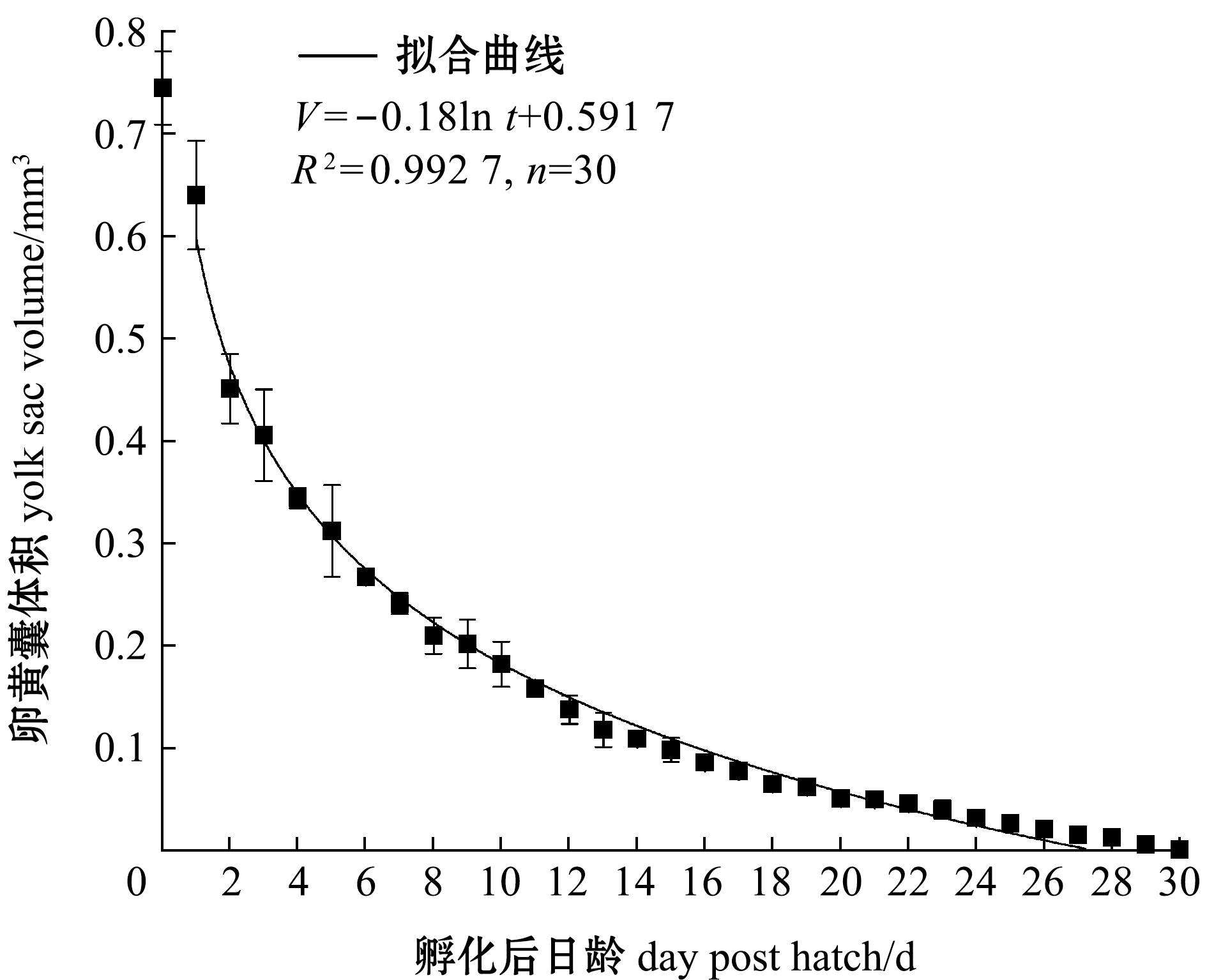
图2 鸭绿沙塘鳢卵黄囊体积与日龄的关系
Fig.2 Changes in yolk sac volume of Odontobutis yaluensis with dph
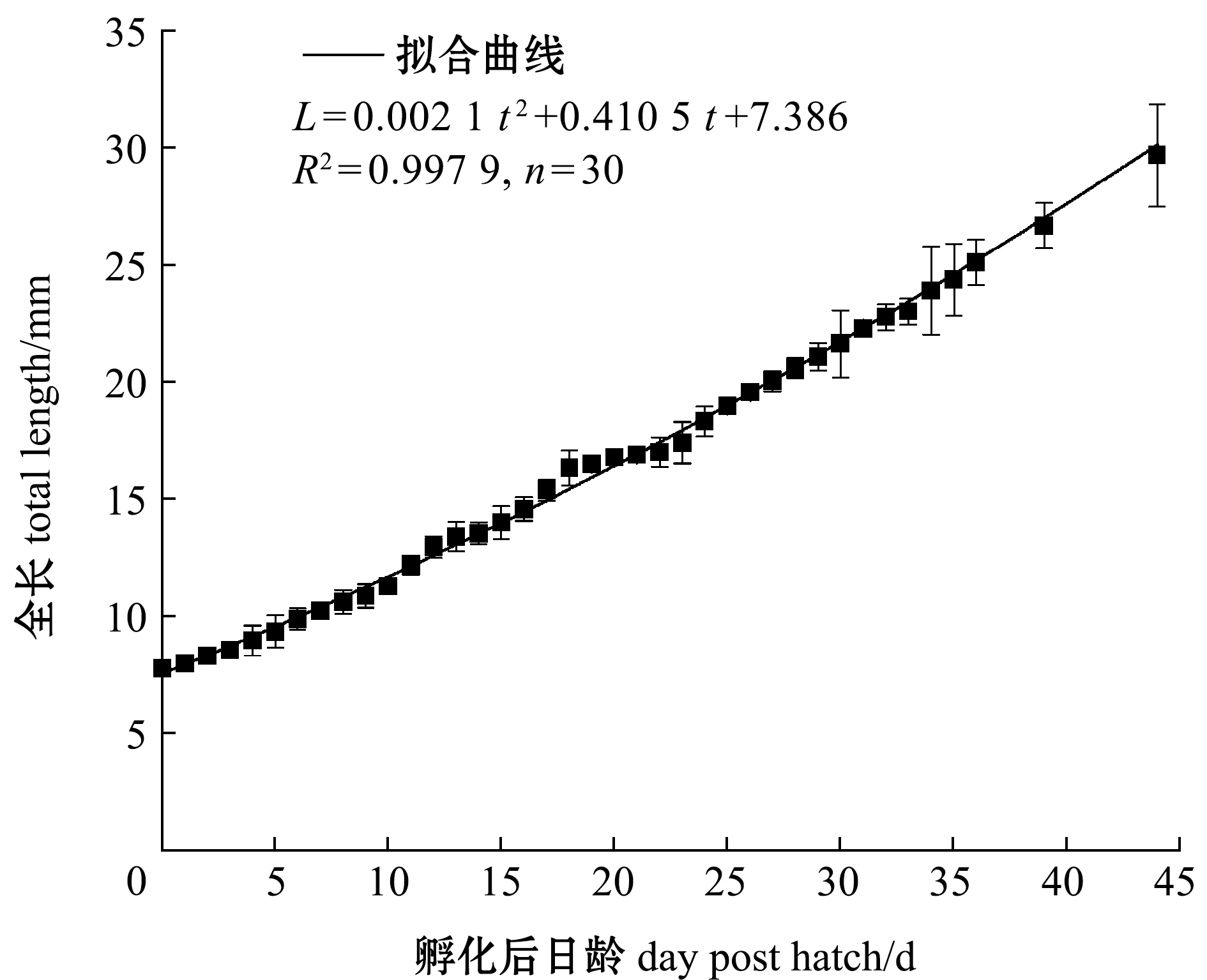
图3 鸭绿沙塘鳢全长与日龄的关系
Fig.3 Changes in total length of Odontobutis yaluensis with dph
V=-0.18 ln t+0.591 7,
R2=0.992 7,t=1~30 d。
(3)
鸭绿沙塘鳢全长(L)与孵化后日龄(t)呈二次多项式函数关系,拟合方程为
L=0.002 1 t2+0.410 5 t+7.386,
R2=0.997 9,t=0~44 d。
(4)
2.2 饥饿对仔鱼形态发育及行为的影响
饥饿对鸭绿沙塘鳢仔鱼形态发育及行为的影响见表1。初孵仔鱼(图4A),饥饿下18日龄全部死亡,饥饿仔鱼体表色素点形状大部分呈点状,覆盖缓慢,头大、顶部塌陷,体细、腹部扁平,鼻孔呈椭圆形无外凸,生长发育缓慢,体易弯曲,第一背鳍前缘的脊柱处易折(图4B)。正常投喂下,仔鱼体表色素形状大部分呈星芒状展开,逐渐覆盖鱼体表;鱼体粗,体高增大,腹部膨大,鼻孔外凸,鳍条数及分节逐渐增加。

A—初孵仔鱼;B—18日龄饥饿仔鱼;C—12日龄饥饿仔鱼摄食后;D—18日龄饥饿仔鱼头、腹部;E—15日龄摄食仔鱼腹部;F—15日龄摄食仔鱼尾部;G—18日龄摄食仔鱼尾部;H—21日龄摄食仔鱼尾部。In—肠;OG—油球;YS—卵黄囊;VF—腹鳍;AT—脂肪组织;Ri—鳞嵴;CF—尾鳍; CT—栉齿。A—newly hatched larva; B—18 dph starved larva; C—12 dph starved larvae refeed; D—head and abdomen of 18 dph starved larva; E—abdomen of 15 dph feeding larva; F—tail of 15 dph feeding larva; G—tail of 18 dph feeding larva; H—tail of 21 dph feeding larva. In—intestine; OG—oil globule; YS—yolk sac; VF—ventral fin; AT—adipose tissue; Ri—ridges of a scale; CF—caudal fin; CT—ctenoid teeth.
图4 饥饿对鸭绿沙塘鳢仔鱼形态发育的影响
Fig.4 Effect of starvation on morphological development of Odontobutis yaluensis larvae
表1 饥饿对仔鱼形态发育及行为的影响
Tab.1 Effects of starvation on larval morphological development and behavior

孵化后日龄/dday post hatch饥饿组starved group投喂组feeding group0初孵仔鱼全长为(7.72±0.09)mm(图4A),黑色素明显,主要集中在头部、卵黄囊两侧,已具与成鱼相似的3道斑纹。卵黄囊经胚胎期吸收,由球形变为椭圆形,表面可见油球,大小不一。各系统发育较完善:口和消化道发育完全,口打开、肛门打通;口具齿,鼻孔形成,微耳石、矢耳石明显,鳃耙、鳃弓、鳃丝可见,鳃盖及鳃盖膜形成,鳔充气;血液呈红色,流动急速;头顶部隆起,尾骨上翘,第一、第二背鳍分离,各鳍已具鳍条且分节,可摆动,游动迅速1仔鱼开口率为40%,肛门处肠道可见蠕动,肉眼可见摄食仔鱼开始摄食,进入混合营养期。全长为(7.96±0.19)mm2^82日龄仔鱼开口率为100%,大部分仔鱼卧在水底,待饵料(枝角类、桡足类)游到口周围,迅速捕食,部分鱼主动捕食,可连续吞咽饵料3^7个。2^8日龄仔鱼开口率100%。8日龄仔鱼摄食动作缓慢,部分鱼游动缓慢仔鱼的全长、眼径、尾柄高、卵黄囊体积和鳔体积,分别从6、8、5、1、5日龄起显著高于饥饿组(P<0.05)。8日龄仔鱼全长为(10.58±0.50)mm9^179日龄仔鱼静卧水底,不再上浮游动,经刺激后游动缓慢,少数仔鱼口不能正常闭合。10日龄部分仔鱼经刺激后在水底痉挛、旋转游动。11日龄仔鱼大量体色变黑。12日龄仔鱼卵黄囊大部分消耗,摄食后肠部明显膨大(图4C)。13日龄仔鱼体不平衡、弯曲。14日龄仔鱼经刺激后泳动无力,胸鳍、尾鳍微摆动。15日龄开口仔鱼摄食量下降,肠胃膨胀不明显15日龄仔鱼大量脂肪组织黏附在靠近肛门处肠道上,随肠道蠕动,部分黏附在卵黄囊后端(图4E);尾柄部中轴线出现1枚初始鳞片,只具2道鳞嵴(图4F),进入稚鱼期。17日龄全长为(15.35±0.45)mm18^4418日龄仔鱼全部死亡,但仍有部分卵黄囊及1^2个小油球未吸收完毕,油球靠近卵黄囊前端心脏或卵黄囊后端(图4D)。未见鳞片,卵黄囊基本消耗完毕,仔鱼全长、眼径、尾柄高和鳔体积出现负增长,并显著低于投喂组(P<0.05)18日龄仔鱼尾柄处覆满初始鳞片,具2^3道鳞嵴(图4G)。21日龄仔鱼尾部中轴线附近的初始鳞出现栉齿(图4H)。25日龄仔鱼尾柄部鳞片表面结构(鳞嵴、鳞焦、鳞沟和栉齿)已基本形成。30日龄仔鱼,卵黄囊消失。44日龄仔鱼,鳞被完全,进入幼鱼期, 尾柄部栉齿8^10个,部分圆鳞覆盖至尾鳍基部,幼鱼全长为(29.66±2.19)mm
2.3 饥饿对仔鱼生长的影响
2.3.1 仔鱼全长 初孵仔鱼全长为(7.72±0.09)mm,正常饲喂下,仔鱼全长随着日龄的增加而增加,而饥饿条件下,仔鱼全长基本不变(图5)。在0~5日龄时,饥饿组和投喂组仔鱼全长间无显著性差异(P>0.05),从6日龄起投喂组全长极显著高于饥饿组(P<0.01);饥饿组14日龄时全长出现负增长,从17日龄起全长低于初孵仔鱼 (0日龄)。
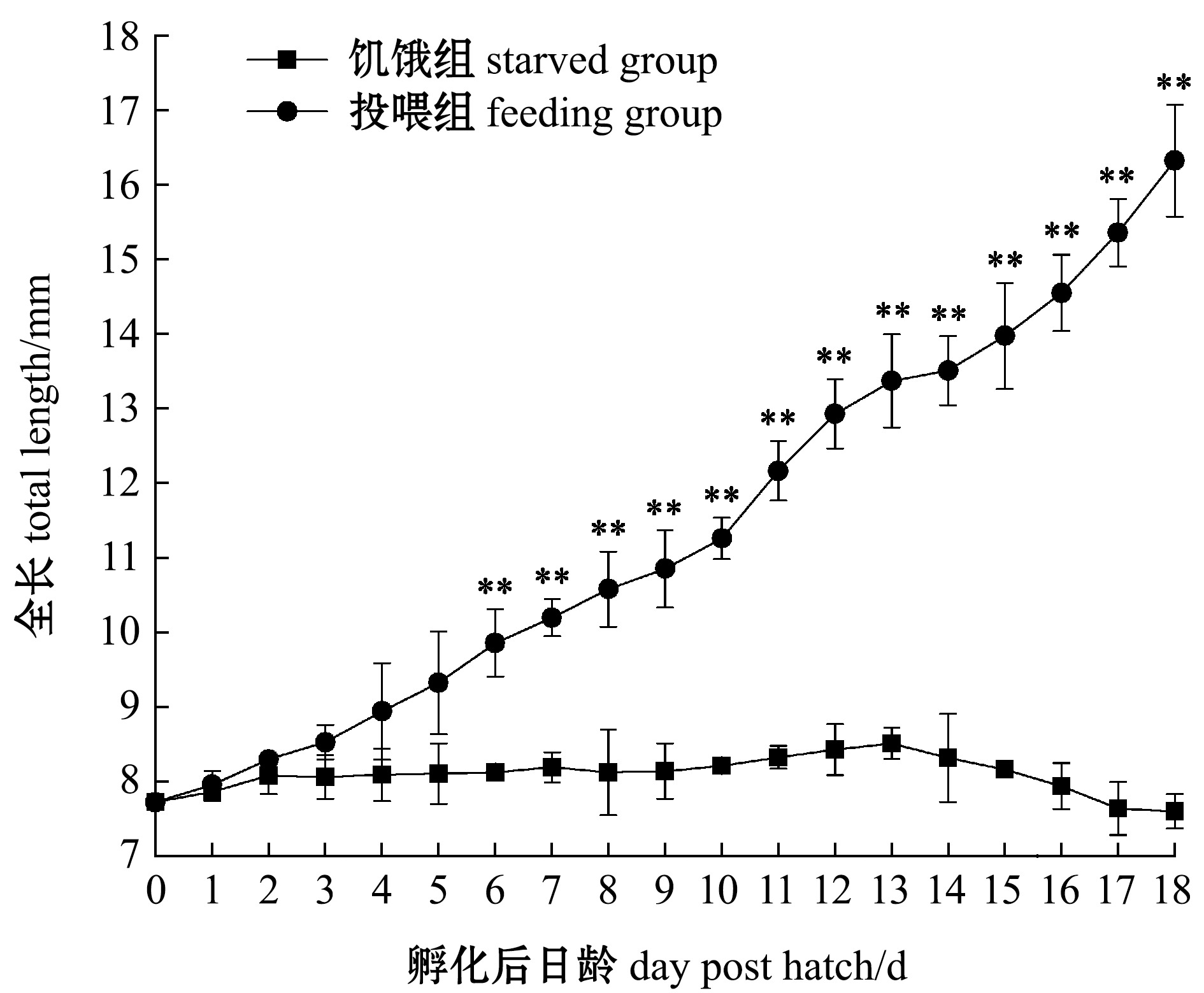
*表示同一日龄下组间有显著性差异(P<0.05);**表示组间有极显著性差异(P<0.01),下同。* indicates significant difference between groups at the same dph (P<0.05); ** indicates very significant difference (P<0.01),et sequentia.
图5 饥饿组和投喂组仔鱼全长随日龄的变化
Fig.5 Changes in total length of larvae in starved group and feeding group with dph
2.3.2 仔鱼眼径 初孵仔鱼眼径为(0.64±0.01)mm,正常饲喂下,仔鱼眼径随着日龄的增加而增加,而饥饿条件下,仔鱼眼径基本不变(图6)。在0~7日龄时,饥饿组和投喂组仔鱼眼径间无显著性差异(P>0.05),从8日龄起投喂组眼径显著高于饥饿组(P<0.05),从12日龄起投喂组眼径极显著高于饥饿组(P<0.01);饥饿组13日龄时眼径出现负增长,之后眼径低于0日龄。
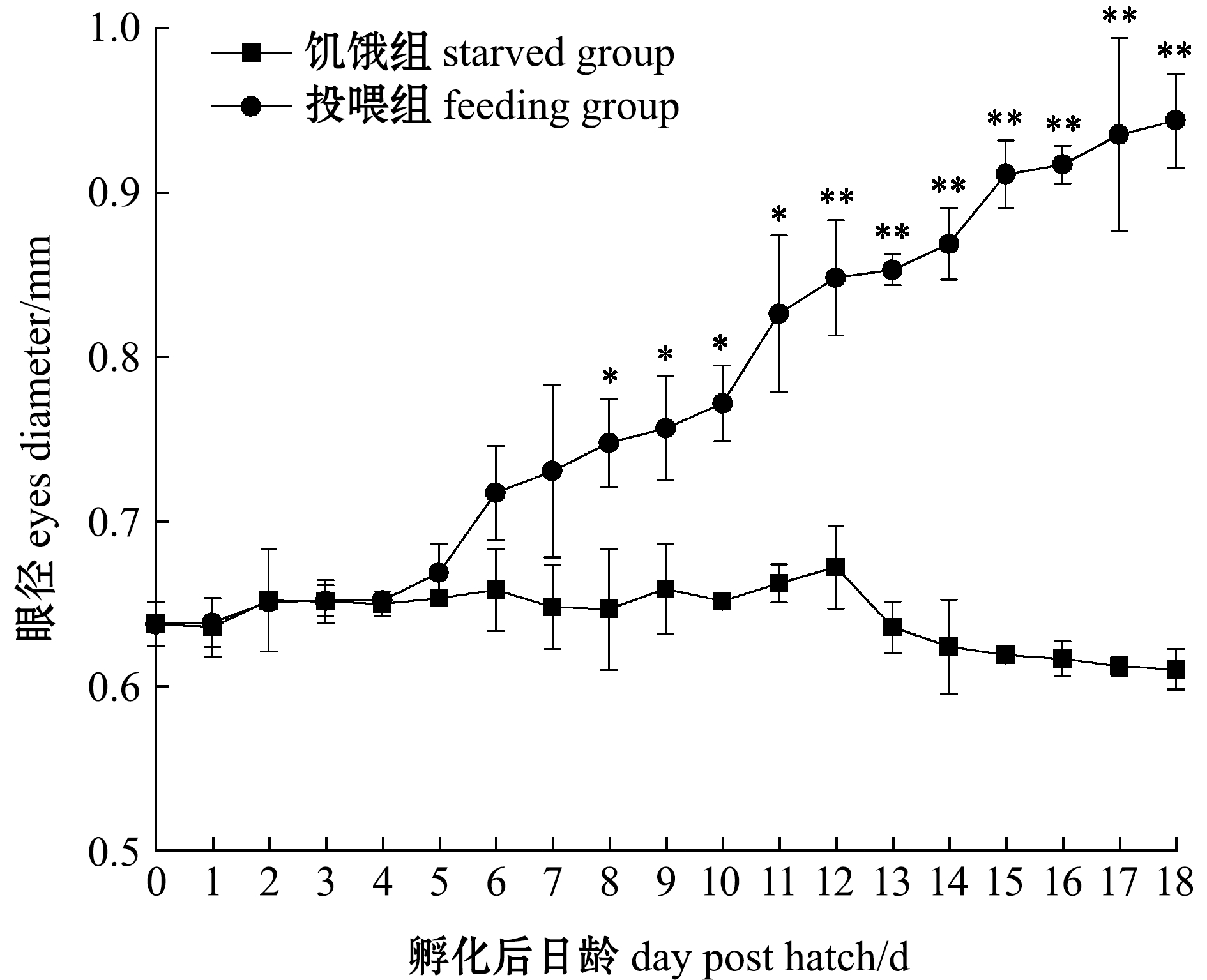
图6 饥饿组和投喂组仔鱼眼径随日龄的变化
Fig.6 Changes in eyes diameter of larvae in starved group and feeding group with dph
2.3.3 仔鱼尾柄高 初孵仔鱼尾柄高为(0.60±0.06)mm,正常饲喂下,仔鱼尾柄高随着日龄的增加而增加,而饥饿条件下,仔鱼尾柄高基本不变(图7)。在0~4日龄时,饥饿组和投喂组仔鱼尾柄高间无显著性差异(P>0.05),从5日龄起投喂组尾柄高显著高于饥饿组(P<0.05),从7日龄起投喂组尾柄高极显著高于饥饿组(P<0.01);饥饿组13日龄时尾柄高出现负增长,之后低于0日龄。
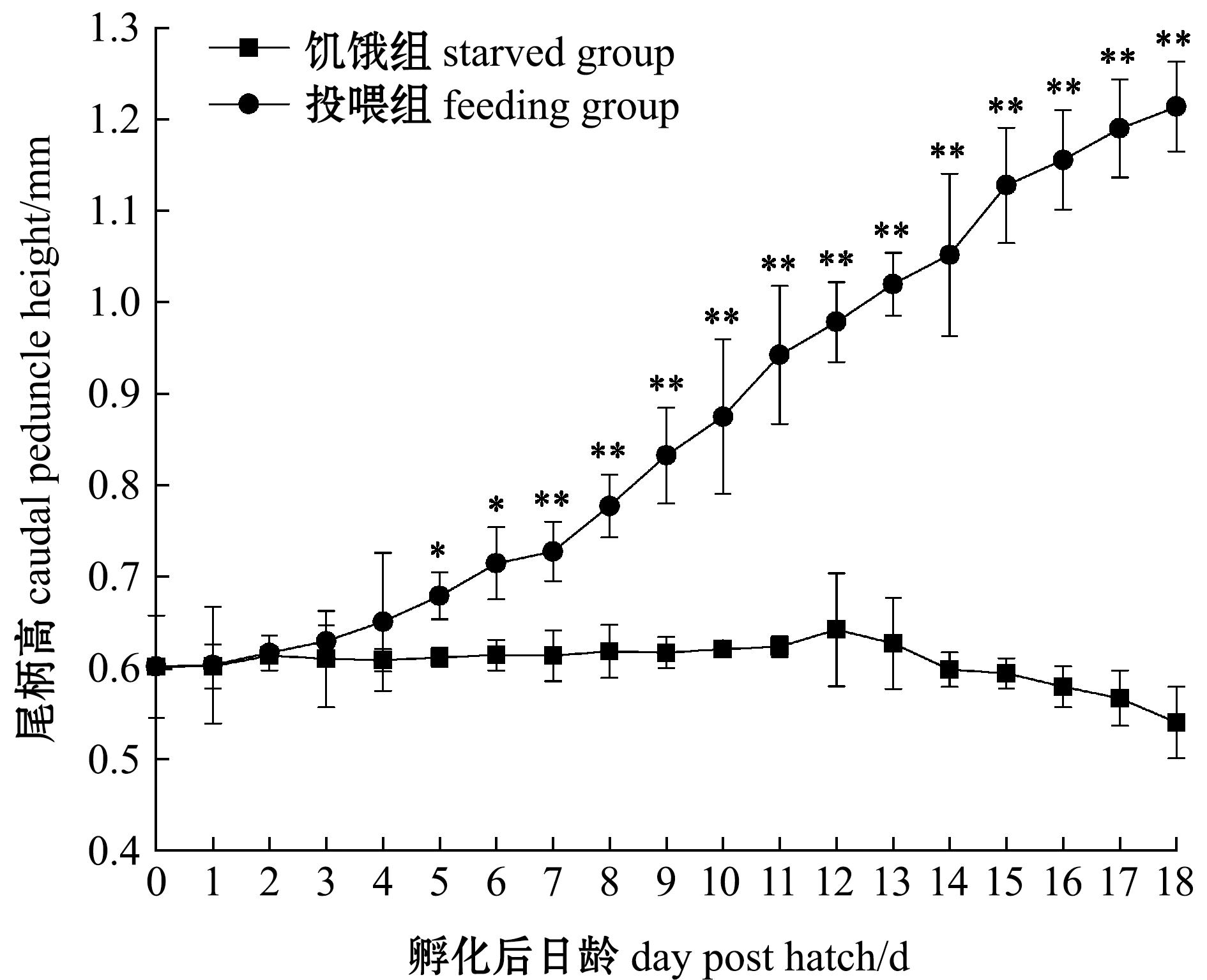
图7 饥饿组和投喂组仔鱼尾柄高随日龄的变化
Fig.7 Changes in caudal peduncle height of larvae in starved group and feeding group with dph
2.3.4 仔鱼卵黄囊 初孵仔鱼卵黄囊长径为(2.03±0.09)mm,短径为(0.84±0.03)mm,体积为(0.74±0.04)mm3,卵黄囊体积随日龄的增加而不断减小(图8)。从1日龄起投喂组卵黄囊体积显著高于饥饿组(P<0.05),从3日龄起投喂组卵黄囊体积极显著高于饥饿组(P<0.01);饥饿组18日龄时卵黄囊基本消耗殆尽,投喂组30日龄时卵黄囊消失,这说明投喂有延迟卵黄囊消失的作用。
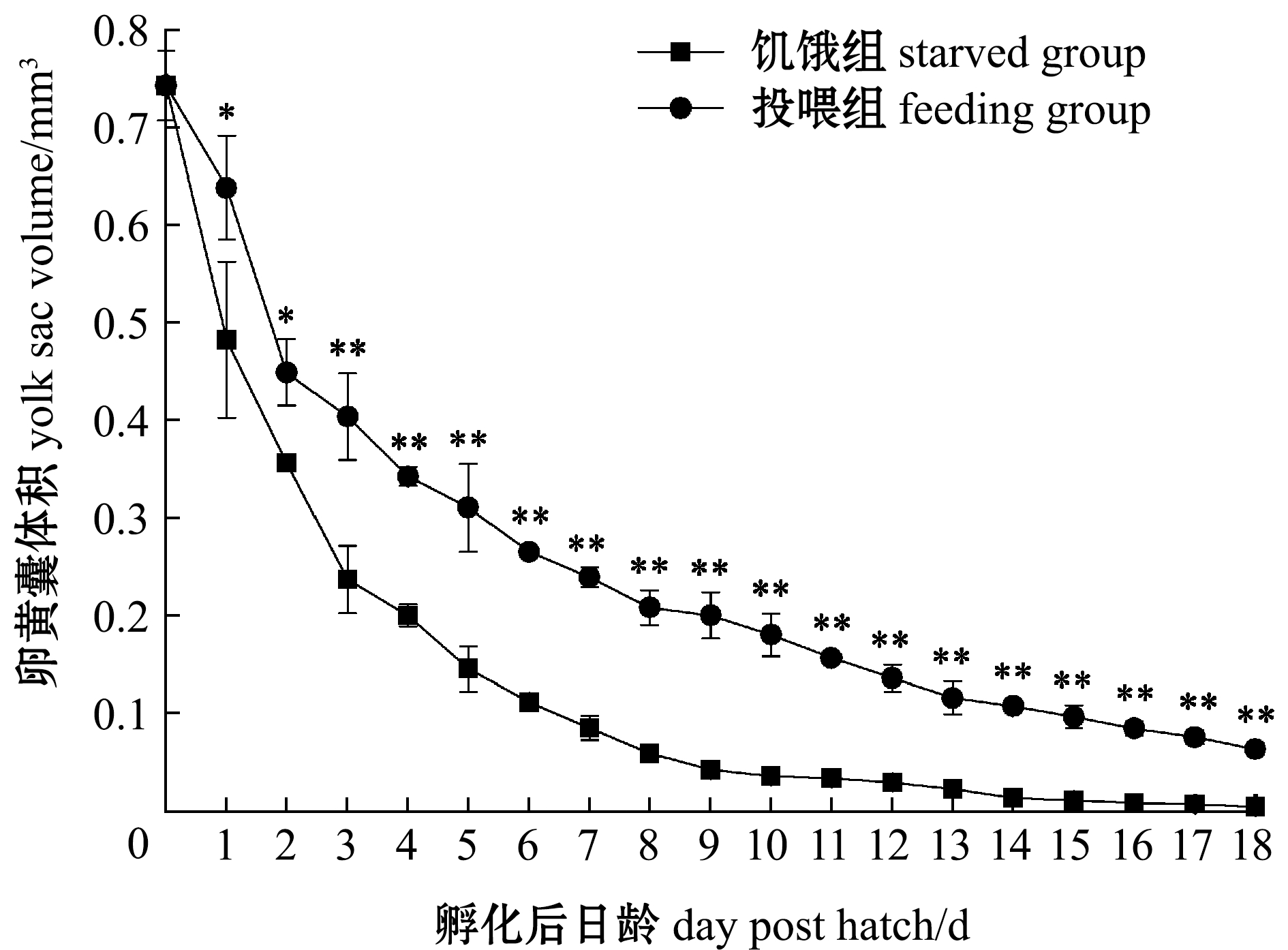
图8 饥饿组和投喂组仔鱼卵黄囊体积随日龄的变化
Fig.8 Changes in yolk sac volume of larvae in starved group and feeding group with dph
2.3.5 仔鱼鳔 初孵仔鱼鳔长径为(0.65±0.05)mm,短径为(0.21±0.02)mm,体积为(0.02±0.00)mm3,正常饲喂下,仔鱼鳔体积随着日龄的增加而增加,而饥饿条件下,仔鱼鳔体积在0~9日龄时基本不变,10~18日龄时逐渐减小(图9)。在 0~4日龄时,饥饿组和投喂组仔鱼鳔体积间无显著性差异(P>0.05),从5日龄起投喂组仔鱼鳔体积显著高于饥饿组(P<0.05),从10日龄起投喂组鳔体积极显著高于饥饿组(P<0.01);饥饿组10日龄时鳔体积出现负增长,13日龄之后鳔体积低于0日龄。

图9 饥饿组和投喂组仔鱼鳔体积随日龄的变化
Fig.9 Changes in swim bladder volume of larvae in starved group and feeding group with dph
2.4 开口率和PNR的确定
从图10可见:在水温19.7~23.2 ℃下,仔鱼1日龄开口摄食,开口率为40%,2日龄时开口率达100%,并可维持到8日龄;随后开口率开始下降,在13日龄时下降至40%,至18日龄时仔鱼全部死亡。根据不可逆点定义,不可逆点出现在12~13日龄。饥饿组、投喂组仔鱼0~7日龄累计死亡率基本相同(约为8%);从9日龄起,饥饿组仔鱼累计死亡率随着开口率下降而上升,14日龄时,仔鱼累计死亡率为54%,18日龄仔鱼累计死亡率为100%;投喂组仔鱼7日龄后无死亡。
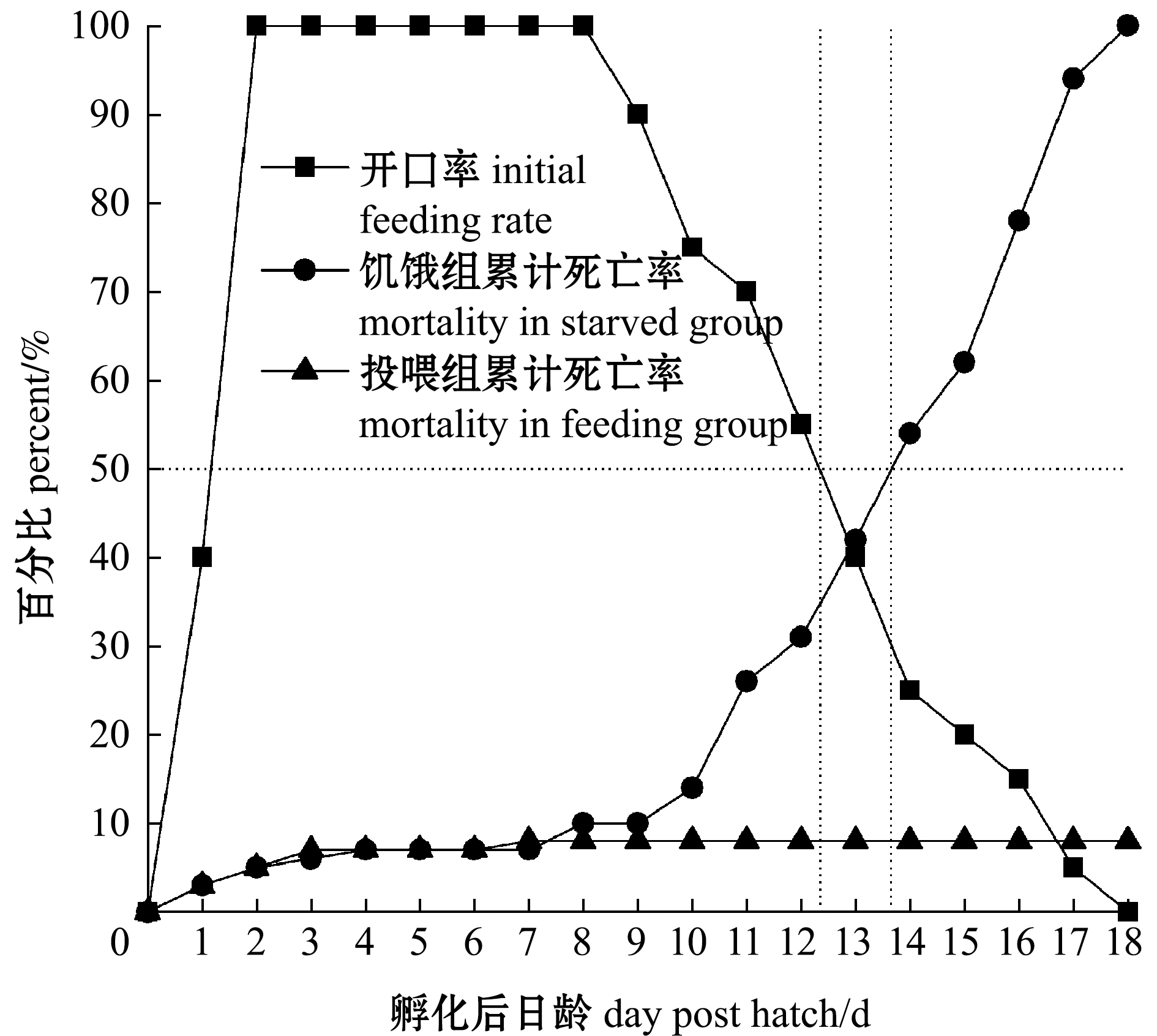
图10 仔鱼开口率变化及饥饿、投喂组仔鱼累计死亡率
Fig.10 Initial feeding rate of larvae and the cumulative mortality of larvae in starved group and feeding group
3 讨论
3.1 鸭绿沙塘鳢仔稚鱼期的划分及其发育过程
多数研究者将鱼类仔稚鱼发育阶段划分为仔鱼前期(从孵出至卵黄囊消失)、仔鱼后期(从卵黄囊消失至鳍条发育完全)和稚鱼期(从各鳍条初步形成或鳞片出现至鳞被覆盖完全)[14]。也有学者对少鳞或无鳞鱼的仔稚鱼发育以其他明显特征作为划分标准,如匙吻鲟(Polyodon spathula)划分为仔鱼前期(从孵出至卵黄囊消失)、仔鱼后期(从卵黄囊消失至吻端透明突起,体透明消失,鳍条开始发育)和稚鱼期(从鳍条分化完成至尾鳍分叉)[15];叶尔羌高原鳅(Triplophysa yarkandensis)划分为仔鱼前期(从孵出至卵黄囊消失)、仔鱼后期(从卵黄囊消失至背鳍条原基出现,臀鳍原基出现,尾鳍色素增多)和稚鱼期(仔鱼鳃盖后缘鼓鳔明显长出,须清晰可辨,体色加深,心脏红色素明显,从体色与成体相似至尾鳍分叉、鳃盖张合明显、身体透明特征消失,外部特征与成鱼相似)[16]。本研究中发现,鸭绿沙塘鳢胚胎期较长,在13.0~19.4 ℃的自然水温中,历经38.5 d破膜,在胚胎期各器官系统发育均较完善,这与王吉桥等[9]对鸭绿沙塘鳢和谢仰杰等[17]对河川沙塘鳢(O.potamophila)胚胎发育观察结果相似,出膜前期就具有一般鱼类仔稚鱼阶段的特征,如体不透明,各鳍已具鳍条,口张开,肛门打通等。
常规淡水鱼类如四大家鱼、鲤(Cyprinus carpio)、鲫(Carassius auratus)和鲂(Megalobrama skolkovii)等,生理适时下塘时间为仔鱼能平游、肠道贯通、鳔充气及卵黄囊吸收一半以上[18]。鸭绿沙塘鳢仔稚鱼发育阶段划分再按照上述分类标准显然不妥。王吉桥等[9]曾以卵黄囊大小、颌、口的形成及鳍的出现为特征,将鸭绿沙塘鳢仔稚鱼期划分到胚胎期内,即仔鱼期(从眼囊形成至鳍褶出现)和稚鱼期(从鳃盖初步形成至鳍条、鳞片出现、鳃盖形成、第一背鳍出现)。谢仰杰等[17]以卵黄囊消失和鳞片形成为特征,将河川沙塘鳢仔稚鱼发育阶段划分为仔鱼期(从出膜至卵黄囊消失)和稚鱼期(从卵黄囊消失至鳞被完全)。本研究中,在13.0~19.4 ℃自然水温下经过38.5 d孵化获得初孵仔鱼(发育积温为635.1 ℃·d),并在19.7~26.7 ℃下培育(0~44日龄),结果显示,鸭绿沙塘鳢15日龄尾部中轴线出现鳞片(发育积温为960.4 ℃·d),30日龄卵黄囊消失(发育积温为1 314.7 ℃·d),44日龄鳞被完全(发育积温为1 667.5 ℃·d)。 王吉桥等[9]报道的鸭绿少塘鳢受精卵在18.0~21.0 ℃水温下经20 d孵化出膜(发育积温为400.0 ℃·d),在出膜期鳞片首先出现在头部皮肤中,为细小的颗粒状鳞,待出膜后7日龄鱼卵黄囊消失(发育积温为540.0 ℃·d)。本研究结果与此结果有较大差异,这可能是试验条件(如亲体营养、孵化温度和孵化密度)的差异导致的。 谢仰杰等[17]报道的河川沙塘鳢受精卵在11.6~25.5 ℃自然水温下经21 d孵化出膜,并在常温下培育,河川沙塘鳢19日龄尾部出现鳞片,44日龄鳞被完全。本研究结果与此结果较为接近。卵黄囊消失、鳞片的形成和鳞被完全,常被作为仔稚鱼发育阶段划分的重要依据。本研究中,根据鳞片的形成及鳞被完全的特征,将鸭绿沙塘鳢仔稚鱼发育划分为2个时期:仔鱼期,0~14日龄,从出膜至鳞片即将出现,全长为7.72~13.50 mm;稚鱼期,15~44日龄,从鳞片出现至头顶部及鳃盖处的鳞片全部覆盖形成,鳞被完全,体特征与成鱼基本一致,全长为13.97~29.66 mm。
3.2 鸭绿沙塘鳢混合营养期
鱼类仔鱼一般经过内源性营养期、混合营养期和外源性营养期3个阶段,而混合营养期的长短与种类和发育积温有关。如巨须裂腹鱼(Schizothorax macropogon)7日龄开口(发育积温为261.9 ℃·d),30日龄卵黄囊消失(发育积温为491.9 ℃·d),混合营养期23 d[19];双须叶须鱼(Ptychobarbus dipogon)7日龄开口(发育积温为210.0 ℃·d),21日龄卵黄囊消失(发育积温为350.0 ℃·d),混合营养期14 d[20];四川华鳊(Sinibrama taeniatus)3日龄开口(发育积温为121.7 ℃·d),8日龄卵黄囊消失(发育积温为238.7 ℃·d),混合营养期5 d[21];扁吻鱼(Aspiorhynchus laticeps) 7日龄开口(发育积温为270.8 ℃·d),9日龄卵黄囊消失(发育积温为303.3 ℃·d),混合营养期2 d[22]。本研究中,鸭绿沙塘鳢仔鱼1日龄即可开口(发育积温为658.5 ℃·d),进入混合营养期,30日龄卵黄囊消失(发育积温为1 314.7 ℃·d),混合营养期长达29 d,这比多数淡水鱼混合营养期3~4 d要长很多,与多数淡水鱼在仔鱼期阶段卵黄囊消失不同,鸭绿沙塘鳢稚鱼期还残存部分卵黄囊,即使饥饿处理下的仔鱼,18日龄仍可见残存油球及卵黄囊。这与海洋鱼类半滑舌鳎(Cynoglossus semilaevis) 21日龄稚鱼中仍有40%个体还存在残余油球[23]的结果类似,这可能是鸭绿沙塘鳢仔稚鱼对辽宁东部山区河流环境的一种适应性,其卵黄可持久储存内源性营养物质,避免仔稚鱼因找不到外源性饵料导致过早饥饿死亡。
3.3 饥饿对鸭绿沙塘鳢仔鱼生长发育和存活的影响
在鱼类生活史中,仔鱼更易受到饥饿的影响,由于饵料的缺乏,营养是仔鱼生长发育和存活的重要因素之一。仔鱼开口后若不能正常摄食而处于饥饿状态,生长发育将会停滞并逐渐死亡。本研究中,饥饿后鸭绿沙塘鳢仔鱼头大、顶部塌陷,体细、腹部扁平,生长发育缓慢,仔鱼的全长、眼径、尾柄高、卵黄囊体积和鳔体积,分别从6、8、5、1、5日龄起显著低于投喂组,且饥饿仔鱼的全长、眼径、尾柄高和鳔体积,分别从14、13、13、10日龄起出现负增长,于18日龄时全部死亡,这与河川沙塘鳢[24]、黄颡鱼(Pelteobrus fulvidraco)[25]和齐口裂腹鱼[26]等仔鱼饥饿时卵黄囊消耗速度加快、发育缓慢甚至停滞或死亡等特点基本相同。
肉食性鱼类早期培育阶段,同类相残现象往往发生在规格差异较大、饵料不足和放养密度过大等情况下,如杂交鳢(Channa maculata♀×C.argus♂)[27]、斑鳜(Siniperca scherzeri)[28]、南方鲇(Silurus meridionalis)[29]、哲罗鲑(Hucho taimen)[30]、白斑狗鱼(Esox lucius)[31]和鸭绿沙塘鳢[6]等。本研究中,亲鱼培育期普遍存在互相残食现象,患病、活力差的鱼为主要的被蚕食对象,经残食后往往仅剩头部和脊椎骨。适当的放养密度及饱食投喂可有效减少鱼类因饥饿相残现象的发生,这在很多肉食性鱼类上得以证实[31]。本研究中,饥饿仔鱼口裂发育停滞,口裂大小的限制致使其无法相残,投喂组仔鱼规格随日龄增加差异明显,44日龄稚鱼全长最大相差1/3,也未见相残,这可能是试验密度较小所致。
鱼类的开口时间主要与种类、卵黄囊大小、水温和开口饵料种类有关[32]。鸭绿沙塘鳢孵化后1日龄开始摄食,这与河川沙塘鳢[24]相同,比大多数淡水鱼类开口早,如斑鳜孵化后2日龄开口[28],云斑尖塘鳢(Oxyeleotris marmorata)[33]、鲇(Silurus asotus)[34]、泥鳅[35]、奥尼罗非鱼(Oreochromis niloticus♀×O.aureus♂)[36]和黄颡鱼[25]孵化后3日龄开口,唇![]() (Hemibarbus labeo)[32]、异育银鲫(Carassius auratus gibelio)[37]孵化后5日龄开口,鲢(Hypophthalmichthys molitrix)[37]、鳙(Aristichthys nobilis)[37]、草鱼(Ctenopharyngodon idellus)[37]和齐口裂腹鱼[26]孵化后6日龄开口等(表2),原因是鸭绿沙塘鳢、河川沙塘鳢受精卵孵化期长,各器官和系统在孵化期发育较完善,所以可较早开口摄食[24]。开口率的高低和最高开口率持续的时间长短可以用来判断仔鱼的摄食能力,而PNR的长短可以判断仔鱼耐饥饿能力。本研究中,鸭绿沙塘鳢2日龄时开口率即达到100%,并可持续7 d,PNR为12~13日龄,相比大多数淡水鱼类开口早,摄食能力强,这与唇
(Hemibarbus labeo)[32]、异育银鲫(Carassius auratus gibelio)[37]孵化后5日龄开口,鲢(Hypophthalmichthys molitrix)[37]、鳙(Aristichthys nobilis)[37]、草鱼(Ctenopharyngodon idellus)[37]和齐口裂腹鱼[26]孵化后6日龄开口等(表2),原因是鸭绿沙塘鳢、河川沙塘鳢受精卵孵化期长,各器官和系统在孵化期发育较完善,所以可较早开口摄食[24]。开口率的高低和最高开口率持续的时间长短可以用来判断仔鱼的摄食能力,而PNR的长短可以判断仔鱼耐饥饿能力。本研究中,鸭绿沙塘鳢2日龄时开口率即达到100%,并可持续7 d,PNR为12~13日龄,相比大多数淡水鱼类开口早,摄食能力强,这与唇![]() [32]、哲罗鲑[30]和黄颡鱼[25]等基本相同,生产上可充分利用这一特点,对鸭绿沙塘鳢及时进行人工投喂。
[32]、哲罗鲑[30]和黄颡鱼[25]等基本相同,生产上可充分利用这一特点,对鸭绿沙塘鳢及时进行人工投喂。
表2 部分淡水鱼类仔鱼的开口日龄及饥饿不可逆点
Tab.2 Days old at initial feeding and PNR in larvae of some freshwater fish species
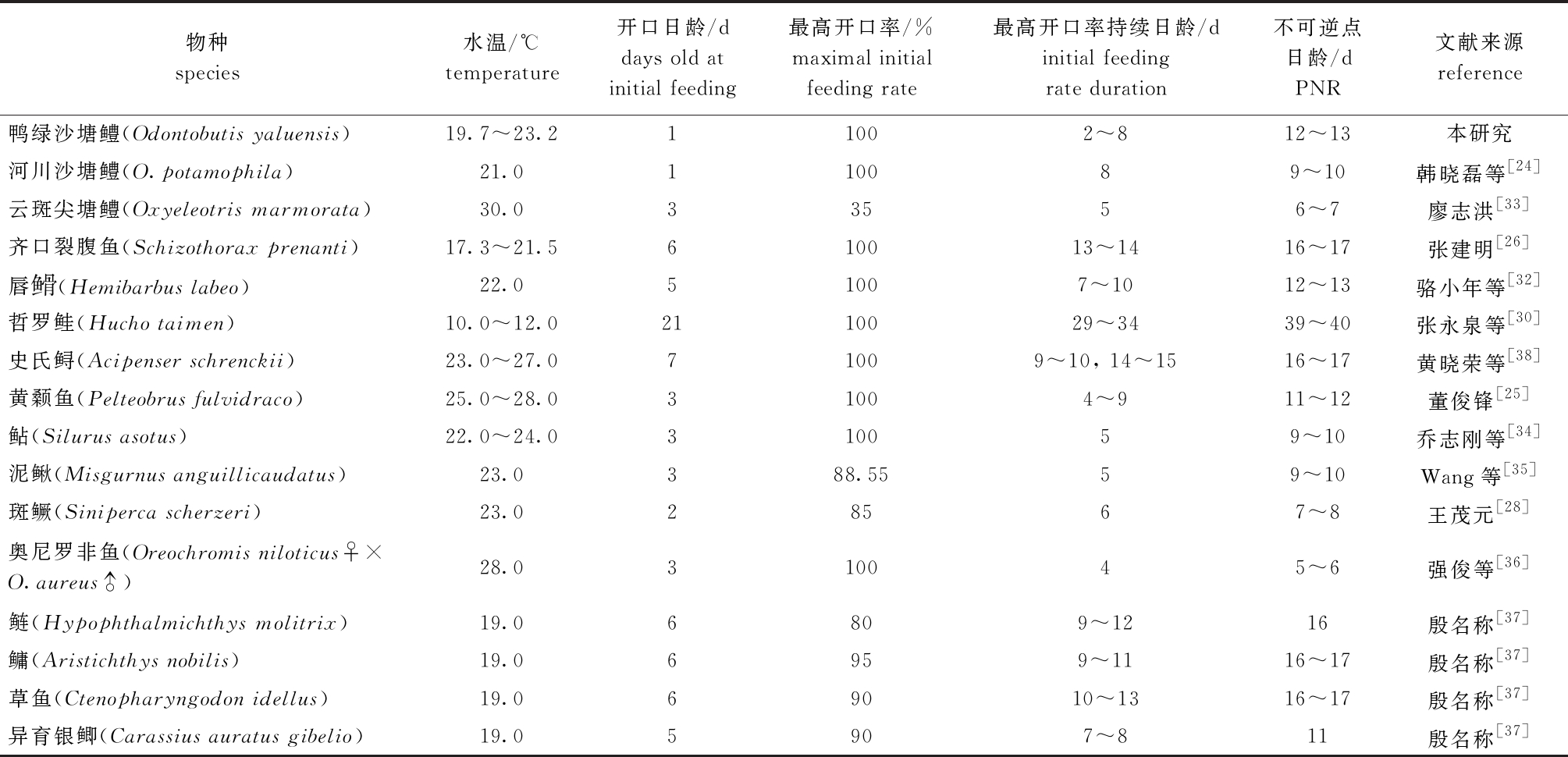
物种species水温/℃temperature开口日龄/ddays old at initial feeding最高开口率/%maximal initial feeding rate最高开口率持续日龄/dinitial feeding rate duration不可逆点日龄/dPNR文献来源reference鸭绿沙塘鳢(Odontobutis yaluensis)19.7^23.211002^812^13本研究河川沙塘鳢(O.potamophila)21.0110089^10韩晓磊等[24]云斑尖塘鳢(Oxyeleotris marmorata)30.033556^7廖志洪[33]齐口裂腹鱼(Schizothorax prenanti)17.3^21.5610013^1416^17张建明[26]唇(Hemibarbus labeo)22.051007^1012^13骆小年等[32]哲罗鲑(Hucho taimen)10.0^12.02110029^3439^40张永泉等[30]史氏鲟(Acipenser schrenckii)23.0^27.071009^10, 14^1516^17黄晓荣等[38]黄颡鱼(Pelteobrus fulvidraco)25.0^28.031004^911^12董俊锋[25]鲇(Silurus asotus)22.0^24.0310059^10乔志刚等[34]泥鳅(Misgurnus anguillicaudatus)23.0388.5559^10Wang等[35]斑鳜(Siniperca scherzeri)23.028567^8王茂元[28]奥尼罗非鱼(Oreochromis niloticus♀×O.aureus♂)28.0310045^6强俊等[36]鲢(Hypophthalmichthys molitrix)19.06809^1216殷名称[37]鳙(Aristichthys nobilis)19.06959^1116^17殷名称[37]草鱼(Ctenopharyngodon idellus)19.069010^1316^17殷名称[37]异育银鲫(Carassius auratus gibelio)19.05907^811殷名称[37]
3.4 初孵仔鱼最佳投喂时间
在仔鱼的人工培育过程中,过早、过量和过晚投喂适口饵料都会增加仔鱼死亡率[38]。鸭绿沙塘鳢仔鱼具有较强的开口摄食能力和耐饥饿能力,在水温19.7~23.2 ℃下,孵化后1日龄仔鱼即可摄食,2~8日龄开口率达到100%,建议最佳投喂时间为孵化后1~2日龄。鸭绿沙塘鳢仔鱼喜摄食活饵,这与河川沙塘鳢仔鱼的摄食习性相同[24]。因此,在鸭绿沙塘鳢仔鱼培育过程中,初孵仔鱼1日龄时可适量投喂枝角类、桡足类幼体,2日龄时可加入少量绞碎后的水丝蚓(长度约3 mm),6日龄时可直接投喂绞碎后的水丝蚓(长度约5 mm),水丝蚓可喂养至44日龄,但人工驯化投喂配合饵料还有待于进一步研究。
4 结论
1)水温19.7~26.7 ℃下,依鳞片形成的特点,可将鸭绿沙塘鳢仔稚鱼发育划分为仔鱼期(0~14日龄)和稚鱼期(15~44日龄)。
2)鸭绿沙塘鳢混合营养期长达29 d,比一般鱼类仔鱼要长,有较强的耐饥饿能力,这是鸭绿沙塘鳢仔稚鱼对辽宁东部山区河流环境的一种生态适应性,应避免仔稚鱼因找不到外源性饵料而饥饿死亡。
3)鸭绿沙塘鳢仔鱼最佳开口时间为孵化后1~2日龄,PNR为12~13日龄。
4)相比大多数淡水鱼类,鸭绿沙塘鳢在仔鱼期器官发育较完善,开口早,摄食能力强,初孵仔鱼1日龄时可适量投喂枝角类、桡足类幼体,2日龄时可加入少量绞碎后的水丝蚓(长度约3 mm),6日龄时可直接投喂绞碎后的水丝蚓(长度约 5 mm)。
[1] 伍汉霖,钟俊生.中国动物志 硬骨鱼纲 鲈形目(五) 虾虎鱼亚目[M].北京:科学出版社,2008.
WU H L,ZHONG J S.Fauna of China,Osteichthyes,Perciformes(V),Gobioidei[M].Beijing:China Science Press,2008.(in Chinese)
[2] ZHAO Y H,WU H L,ZHANG C G.Threatened fishes of the world:Odontobutis yaluensis Wu,Wu & Xie,1993 (Odontobutidae)[J].Environmental Biology of Fishes,2010,88(3):261-262.
[3] 解玉浩.东北地区淡水鱼类[M].沈阳:辽宁科学技术出版社,2007.
XIE Y H.Freshwater fishes in northeast region of China[M].Shenyang:China Liaoning Science and Technology Press,2007.(in Chinese)
[4] 蒋志刚,江建平,王跃招,等.中国脊椎动物红色名录[J].生物多样性,2016,24(5):501-551,615.
JIANG Z G,JIANG J P,WANG Y Z,et al.Red list of China’s vertebrates[J].Biodiversity Science,2016,24(5):501-551,615.(in Chinese)
[5] 骆小年,赵兴文,段友健.辽宁省淡水土著鱼类开发利用研究进展[J].大连海洋大学学报,2020,35(2):155-160.
LUO X N,ZHAO X W,DUAN Y J.Exploitation and utilization of freshwater indigenous fishes in Liaoning Province:a review[J].Journal of Dalian Ocean University,2020,35(2):155-160.(in Chinese)
[6] 王新荣,徐忠源,骆小年,等.鸭绿沙塘鳢人工繁殖和苗种培育试验[J].水产科学,2013,32(11):662-667.
WANG X R,XU Z Y,LUO X N,et al.Artificial propagation and fry rearing of sleeper Odontobutis yalunensis[J].Fisheries Science,2013,32(11):662-667.(in Chinese)
[7] 徐忠源,王新荣,骆小年,等.不同开口饵料对鸭绿沙塘鳢仔鱼生长性能的影响[J].水产学杂志,2010,23(1):28-31.
XU Z Y,WANG X R,LUO X N,et al.Effects of different initial feeds on the growth performance of Odontobutis yaluensis larva[J].Chinese Journal of Fisheries,2010,23(1):28-31.(in Chinese)
[8] 段友健,骆小年,李文康,等.鸭绿沙塘鳢种群繁殖力和初次性成熟研究[J].水产科学,2022,41(4):652-657.
DUAN Y J,LUO X N,LI W K,et al.Population fecundity and first maturity of Yalu River sleeper Odontobutis yaluensis[J].Fisheries Science,2022,41(4):652-657.(in Chinese)
[9] 王吉桥,许重,程骏驰,等.鸭绿沙塘鳢仔鱼、稚鱼和幼鱼的形态观察[J].吉林农业大学学报,2007,29(2):207-212.
WANG J Q,XU C,CHENG J C,et al.Morphological observation of sleeper larvae,juveniles and prelarvae[J].Journal of Jilin Agricultural University,2007,29(2):207-212.(in Chinese)
[10] BLAXTER J H S,HEMPEL G.The influence of egg size on herring larvae (Clupea harengus L.)[J].ICES Journal of Marine Science,1963,28(2):211-240.
[11] XU Z C,LI C J,LING Q F,et al.Early development and the point of no return in pikeperch (Sander lucioperca L.) larvae[J].Chinese Journal of Oceanology and Limnology,2017,35(6):1493-1500.
[12] YOKOTA T,NAKAGAWA T,MURAKAMI N,et al.Effects of starvation at the first feeding stage on the survival and growth of walleye pollock Gadus chalcogrammus larvae[J].Fisheries Science,2016,82(1):73-83.
[13] 谢晓晖,黄国光,梁伟峰,等.虎斑乌贼幼体的摄食、排泄及不可逆点的研究[J].大连海洋大学学报,2011,26(4):352-355.
XIE X H,HUANG G G,LIANG W F,et al.The feeding,excretion and point of no-return in larval cuttlefish Sepia pharaonis[J].Journal of Dalian Ocean University,2011,26(4):352-355.(in Chinese)
[14] 殷名称.鱼类早期生活史研究与其进展[J].水产学报,1991,15(4):348-358.
YIN M C.Advances and studies on early life history of fish[J].Journal of Fisheries of China,1991,15(4):348-358.(in Chinese)
[15] 陈静.匙吻鲟早期发育与鱼体成分分析[D].武汉:华中农业大学,2008.
CHEN J.Studies on the early development and body composition of Polydon spathula[D].Wuhan:Huazhong Agricultural University,2008.(in Chinese)
[16] 陈生熬,宋勇,牛玉娟,等.叶尔羌高原鳅胚胎发育与胚后发育观察[J].中国水产科学,2015,22(4):597-607.
CHEN S A,SONG Y,NIU Y J,et al.Embryonic and post-embryonic development of Triplophysa(Hedinichthys) yarkandensis(Day)[J].Journal of Fishery Sciences of China,2015,22(4):597-607.(in Chinese)
[17] 谢仰杰,孙帼英.河川沙塘鳢的胚胎和胚后发育以及温度对胚胎发育的影响[J].厦门水产学院学报,1996,18(1):55-62.
XIE Y J,SUN G Y.Embryonic and post-embryonic development of Odontobutis potamophila(Gunther)and the effect of temperature on the embryonic development[J].Journal of Jimei College,1996,18(1):52-62.(in Chinese)
[18] 骆小年.中国主要经济鱼类鱼苗适时下塘研究进展[J].大连海洋大学学报,2021,36(1):1-9.
LUO X N.Research progress on the optimal stocking time of main commercially important fish fry in China:a review[J].Journal of Dalian Ocean University,2021,36(1):1-9.(in Chinese)
[19] 刘海平,刘孟君,刘艳超.西藏巨须裂腹鱼早期发育特征[J].水生生物学报,2019,43(2):367-378.
LIU H P,LIU M J,LIU Y C.Characteristics of early development of Schizothorax macropogon in Xizang Autonomous Region,China[J].Acta Hydrobiologica Sinica,2019,43(2):367-378.(in Chinese)
[20] 刘海平,刘孟君,牟振波,等.西藏双须叶须鱼早期发育特征[J].水生生物学报,2019,43(5):1041-1055.
LIU H P,LIU M J,MOU Z B,et al.Characteristics of early development of Ptychobarbus dipogon in Xizang Autonomous Region[J].Acta Hydrobiologica Sinica,2019,43(5):1041-1055.(in Chinese)
[21] 王亚利.四川华鳊早期发育及温度影响研究[D].重庆:西南大学,2021.
WANG Y L.The early development and temperature effect on Sinibrama taeniatus[D].Chongqing:Southwest University,2021.(in Chinese)
[22] 韩军军,贺疆滔,陈朋,等.扁吻鱼胚胎发育及仔稚鱼形态与生长观察研究[J].南方水产科学,2021,17(1):59-66.
HAN J J,HE J T,CHEN P,et al.Observation on embryonic development,morphology and growth of larvae and juveniles of Aspiorhynchus laticeps[J].South China Fisheries Science,2021,17(1):59-66.(in Chinese)
[23] 庄志猛.半滑舌鳎早期发育生物学与种质资源研究[D].青岛:中国海洋大学,2006.
ZHUANG Z M.Developmental biology in the early life stages and genetic diversity of the tonguefish (Cynoglossus semilaevis)[D].Qingdao:Ocean University of China,2006.(in Chinese)
[24] 韩晓磊,梁廷明,薛凯,等.河川沙塘鳢胚后发育及仔鱼饥饿试验研究[J].江苏农业科学,2016,44(10):314-317.
HAN X L,LIANG T M,XUE K,et al. Research on postembryonic development of Odontobutis potamophila and starvation test of larvae [J].Jiangsu Agricultural Sciences,2016,44(10):314-317.(in Chinese)
[25] 董俊锋.养殖策略对黄颡鱼摄食、生长及成活的影响[D].武汉:华中农业大学,2008.
DONG J F.Effect of rearing strategy on feeding,growth and survival of Pelteobagrus fulvidraco[D].Wuhan:Huazhong Agricultural University,2008.(in Chinese)
[26] 张建明.齐口裂腹鱼仔鱼饥饿试验及不可逆生长点的确定[J].水产科学,2020,39(4):532-538.
ZHANG J M.Starvation and determination of point of no return in Schizothorax prenanti larvae[J].Fisheries Science,2020,39(4):532-538.(in Chinese)
[27] 马建波,茅沈丽,梁桂洪,等.杂交鳢仔鱼饥饿试验及不可逆点的确定[J].水生态学杂志,2012,33(3):90-95.
MA J B,MAO S L,LIANG G H,et al.Starvation and point of no return in hybrid snakehead larvae[J].Journal of Hydroecology,2012,33(3):90-95.(in Chinese)
[28] 王茂元.斑鳜仔鱼饥饿试验及不可逆点的确定[J].广东海洋大学学报,2015,35(4):99-103.
WANG M Y.Starvation test on Siniperca scherzeri larvae and acertaining the point of no return[J].Journal of Guangdong Ocean University,2015,35(4):99-103.(in Chinese)
[29] 杨凯,樊启学,周华,等.饵料密度对南方鲇仔稚鱼生长、成活、残食的影响[J].应用与环境生物学报,2010,16(2):235-239.
YANG K,FAN Q X,ZHOU H,et al.Effects of prey density on growth,survival and cannibalism of Silurus meridionalis (Chen) larvae and juveniles[J].Chinese Journal of Applied & Environmental Biology,2010,16(2):235-239.(in Chinese)
[30] 张永泉,尹家胜,杜佳,等.哲罗鱼仔鱼饥饿实验及不可逆生长点的确定[J].水生生物学报,2009,33(5):945-950.
ZHANG Y Q,YIN J S,DU J,et al.Experimental starvation on Hucho taimen and definition of the point of no return[J].Acta Hydrobiologica Sinica,2009,33(5):945-950.(in Chinese)
[31] 刘洪军,官曙光,于道德,等.鱼类自残行为研究进展[J].海洋通报,2010,29(5):594-599.
LIU H J,GUAN S G,YU D D,et al.Research on the cannibalism in teleost fish[J].Marine Science Bulletin,2010,29(5):594-599.(in Chinese)
[32] 骆小年,李军,刘刚,等.鸭绿江水系唇![]() 胚胎发育、仔鱼饥饿及其不可逆点[J].中国水产科学,2011,18(6):1278-1285.
胚胎发育、仔鱼饥饿及其不可逆点[J].中国水产科学,2011,18(6):1278-1285.
LUO X N,LI J,LIU G,et al.Embryonic development,experimental starvation,and the point of no return of Hemibarbus labeo(Pallas) in YaLu River[J].Journal of Fishery Sciences of China,2011,18(6):1278-1285.(in Chinese)
[33] 廖志洪.云斑尖塘鳢仔鱼的摄食研究[D].广州:暨南大学,2005.
LIAO Z H.Studies on feeding of Oxyeleotris marmoratus (Bleeker) larvae[D].Guangzhou:Jinan University,2005.(in Chinese)
[34] 乔志刚,常国亮,张建平,等.延迟投饵对鲇仔鱼摄食、存活和生长的影响[J].上海水产大学学报,2007,16(2):130-134.
QIAO Z G,CHANG G L,ZHANG J P,et al.Effect of delayed feeding on feeding ability,survival and growth of Silurus asotus larvae[J].Journal of Shanghai Fisheries University,2007,16(2):130-134.(in Chinese)
[35] WANG Y J,HU M H,WANG W M,et al.Effects of the timing of initial feeding on growth and survival of loach(Misgurnus anguillicaudatus) larvae[J].Aquaculture International,2010,18(2):135-148.
[36] 强俊,李瑞伟,王辉.延迟投饵对奥尼罗非鱼仔鱼摄食、生长和存活的影响[J].淡水渔业,2008,38(5):60-64.
QIANG J,LI R W,WANG H.Effects of delayed initial feeding on foraging,growth and survival of hybrid tilapia larvae[J].Freshwater Fisheries,2008,38(5):60-64.(in Chinese)
[37] 殷名称.鲢、鳙、草鱼、银鲫卵黄囊期仔鱼的摄食、生长和耐饥饿能力[M].北京:科学出版社,1997:69-79.
YIN M C. Feeding,growth and starvation tolerance of the yolk-sac larvae of Hypophthalmichthys molitrix,Aristichthys nobilis,Ctenopharyngodon idellus and Carassius auratus gibelio[M].Beijing:Science Press,1997:69-79.(in Chinese)
[38] 黄晓荣,庄平,章龙珍,等.延迟投饵对史氏鲟仔鱼摄食、存活及生长的影响[J].生态学杂志,2007,26(1):73-77.
HUANG X R,ZHUANG P,ZHANG L Z,et al.Effects of delayed feeding on foraging,growth and survival of Acipenser schrenckii larvae[J].Chinese Journal of Ecology,2007,26(1):73-77.(in Chinese)