生态浮床技术是一项造价成本较为低廉、管理便捷且无能源消耗的环境友好型水质调控修复技术[1],该技术被广泛应用于富营养化河湖水体和黑臭水体的生态修复和造景中[2-3]。水生植物是生态浮床最主要的组成成分之一。生态浮床可以利用水生植物根系主动吸收水体中的一部分氮、磷等营养物质以满足自身生长所需;同时,其根系在水中分散面积较大,可为微生物生长提供附着位点,并逐渐形成生物膜。水生植物根系分泌的氧气促使植物根系生物膜持续生长,并在胞外聚合物的作用下形成了“好氧-兼氧-缺氧”的微生物共生体环境,为水生植物根际氮循环过程和氮素转化提供了良好的场所,从而加速了大分子污染物的降解和转化,并达到水质净化的目的[4]。因此,深入了解浮床水生植物根际微生物群落结构及其功能对养殖池塘水质调控至关重要。
中国是内陆水产养殖第一大国,渔业产业关系到民生和社会稳定,处理好养殖尾水环境污染问题是当前渔业发展面临的重要问题。实践证明,生态浮床是当前水产养殖生态沟渠、生态塘和潜流湿地等尾水处理设施升级改造的重要组成部分。目前,关于生态浮床的研究多集中在浮床水生植物的筛选[5]及生态浮床对水体污染物的吸收和净化效果[6]等方面,而对浮床水生植物的根际生态调控过程研究不够深入,缺乏浮床水生植物根际氮循环功能微生物群落生态特征与作用研究。
宏基因组学为探究环境与微生物生态功能间的相互作用开辟了新的研究途径。宏基因组高通量测序技术在植物修复[7]、重金属生物修复[8]、污染区域有毒物质降解[9]和河流健康生态系统评估[10]等生态学研究方面显示出巨大的潜力,能够揭示生态系统中微生物群落的动态、功能潜力和生物地球化学过程。本研究中,以养殖尾水生态塘系统内浮床水生植物黄花鸢尾(Iris wilsonii C.H.Wright)根际细菌为研究对象,通过宏基因组高通量测序技术分析植物根际细菌类群、多样性及氮循环功能基因富集特征,同时确定在养殖尾水脱氮处理中发挥关键作用的功能细菌类群,以期为养殖尾水浮床生态修复实践应用提供科学参考。
1 材料与方法
1.1 材料
本试验于2020 年在北京市农林科学院水产科学研究所示范基地养殖尾水生态浮床系统(长×宽×深为60 m×50 m×2 m)中进行,所选池塘以大口黑鲈(Micropterus salmoides)为主要养殖鱼类,搭配少量花白鲢。生态浮床及黄花鸢尾均购自河北廊坊莲韵苑水环境景观有限公司。在生态塘中铺设总面积为250 m2 的生态浮床,并在浮床上栽种黄花鸢尾(16株/m2)(图1)。待水生植物栽种生长稳定后,在养殖高峰期的5—8月进行试验。

图1 生态浮床养殖尾水处理系统
Fig.1 Ecological floating-bed systems for aquaculture tailwater treatment
1.2 方法
1.2.1 样本采集 试验期间,每月分别在生态浮床的前、中、后部采集黄花鸢尾各1株,用灭菌剪刀截取水生植物根部装入无菌密封袋中;同时,在相同位点分别采集水生植物周围水体样本各 500 mL。将上述样本装入冷藏箱中带回实验室进行前处理。参考陈嗣威等[11]的研究方法,从每组黄花鸢尾样本随机截取根部10 g,用去离子无菌水冲洗后,置于装有10 mL浓度为0.1 mol/L的磷酸钾缓冲液(pH 8.0)离心管中振荡重复洗涤2 次,然后将根部取出放入装有50 mL磷酸盐缓冲液离心管中超声波洗涤10 min,最后将3次洗涤液混合后用孔径为0.22 μm的已灭菌水系微孔滤膜过滤,将滤膜折叠存放于冻存管中,于-80 ℃超低温冰箱中保存,标记为水生植物根际细菌样本R组。水体样本经无菌滤纸除杂后,同样通过滤膜抽滤方式获取水体细菌样本,标记为FW组。试验期间,共采集24个样本用于16S rRNA高通量测序和宏基因组高通量测序分析。
1.2.2 细菌16S rRNA基因扩增子高通量测序分析 使用 FastDNATM Spin Kit for Soil(MP Biomedicals 美国)提取根际和水体样本细菌DNA,待所有样本DNA浓度和纯度检验合格后,用干冰保存寄送至上海美吉生物医药科技有限公司进行16S rRNA基因扩增子高通量测序和宏基因组测序。以细菌特异性引物338F和806R(338F:5′ACTCCTACGGGAGGCAGCAG 3′,806R:5′GGACTACHVGGGTWTCTAAT 3′)扩增16S rRNA基因V3~V4高变区,构建测序文库后,基于illumina Miseq PE300高通量测序技术对浮床水生植物根际细菌群落结构和多样性特征进行研究。
1.2.3 宏基因组测序分析 将DNA片段化,筛选约400 bp的片段,利用NEXT flexTM Rapid DNA-Seq(Bio Scientific)构建PE文库。采用Hiseq Xten(Illumina)测序平台进行宏基因组测序,保证每个样本要达到6G以上数据。使用Fastp 0.20.0(https://github.com/OpenGene/fastp)对原始数据reads进行质量剪切,去除剪切后长度小于50 bp、平均碱基质量值低于20及含N碱基的reads,保留高质量的pair-end reads和single-end reads,并对优化序列进行拼接组装。采用Meta Gene(http://metagene.cb.k.u-tokyo.ac.jp/)对拼接结果中的contigs进行开放阅读框ORF预测,利用CD-HIT 4.6.1在线软件(http://www. bioinformatics.org/cd-hit/)构建非冗余基因集。最后使用SOAP Align 2.21软件(http://soap.genomics. org.cn/)分别将每个样品的高质量reads与非冗余基因集进行比对(95% identity),统计基因在对应样品中的丰度信息,对得到的基因进行NR(amino acid sequence of non-redundant protein)物种注释和KEGG(kyoto encyclopedia of genes and genomes)功能注释,筛选得到与氮循环代谢相关的基因类群及其相对丰度信息。
1.2.4 多样性指数的计算 使用Mothur 软件在同一分类单元OTUs 水平上计算Shannon(H′)、Simpson(D)和Chao1(S)等α多样指数,并绘制细菌组成图。
(1)
(2)
S=Sobs+n1(n1-1)/[2(n2+1)]。
(3)
其中: Sobs为实际观测到的OTUs数目;ni为第i个OTUs所含的序列数;N为所有序列数;n1为只含有一条序列的OTU数目;n2为只含有两条序列的OTU数目。Shannon指数和Simpson指数是估算样本中微生物多样性的重要指数,Shannon值越大或Simpson值越小,说明群落多样性越高;而Chao1指数是用来衡量微生物群落丰富度的指数,指数越大,说明群落丰富度越高。
1.3 数据处理
使用Excel 2007软件和上海美吉生物云平台对试验数据进行处理和作图。采用SPSS 20软件对不同组间的KEGG 代谢功能、氮循环功能基因和关键酶等进行单因素方差分析(one-way ANOVA),用T检验进行组间差异分析,显著性水平设为0.05,极显著性水平设为0.01和0.001。
2 结果与分析
2.1 细菌多样性及群落结构差异特征
通过16S rRNA扩增子高通量测序共获得970 172条有效16S rRNA基因序列,基于97%一致性将序列划分为2 631个OTUs。从表1可见,浮床植物根际组(R)的细菌群落Shannon指数和Chao1指数均显著高于水体组(FW)(P<0.05),说明浮床水生植物根际细菌多样性高,群落组成更为丰富。
表1 生态浮床植物根际及水体细菌α多样性指数特征
Tab.1 Microbial alpha diversity index in plant rhizosphere and water in the ecological floating bed
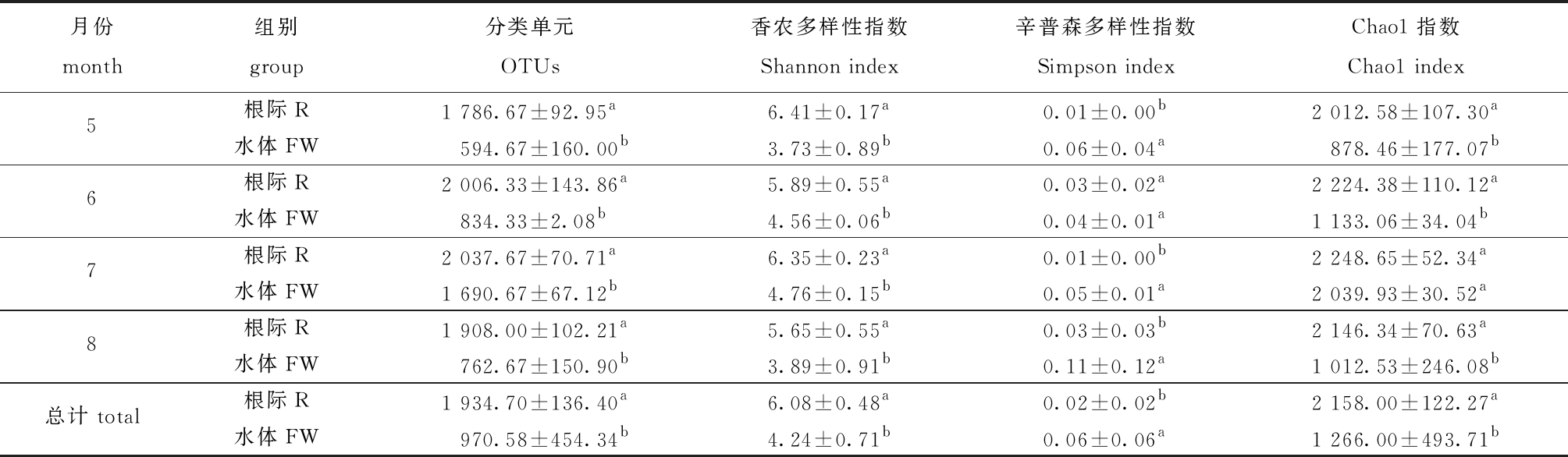
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences.
月份month组别group分类单元OTUs香农多样性指数Shannon index辛普森多样性指数Simpson indexChao1指数Chao1 index5根际R1 786.67±92.95a6.41±0.17a0.01±0.00b2 012.58±107.30a水体FW594.67±160.00b3.73±0.89b0.06±0.04a878.46±177.07 b6根际R2 006.33±143.86a5.89±0.55a0.03±0.02a2 224.38±110.12a水体FW834.33±2.08b4.56±0.06b0.04±0.01a1 133.06±34.04b7根际R2 037.67±70.71a6.35±0.23a0.01±0.00b2 248.65±52.34a水体FW1 690.67±67.12b4.76±0.15b0.05±0.01a2 039.93±30.52a8根际R1 908.00±102.21a5.65±0.55a0.03±0.03b2 146.34±70.63a水体FW762.67±150.90b3.89±0.91b0.11±0.12a1 012.53±246.08 b总计 total根际R1 934.70±136.40a6.08±0.48a0.02±0.02b2 158.00±122.27a水体FW970.58±454.34b4.24±0.71 b0.06±0.06a1 266.00±493.71b
在门水平上,应用主成分分析(principal component analysis,PCA)对细菌群落间的物种β多样性进行比较分析,结果显示,浮床植物根际组与水体组在细菌群落组成上存在明显差异(P<0.001)(图2(a))。利用物种网络关联分析法,进一步探究浮床植物根际与水体细菌群落组成差异,发现有7个门类的细菌主要富集在浮床水生植物根际周围,包括Latescibacterota门、硝化菌门(Nitrospirota)、芽单胞菌门(Gemmatimonadota)、螺旋菌门(Spirochaetota)、Dependentiae门、河床菌门(Zixibacteria)和WS2等门类细菌(图2(b))。通过物种组成与样点关系圈型Circos图分析两组优势菌组成分布特征,结果显示,浮床植物根际中,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、Patescibacteria门和拟杆菌门(Bacteroidota)等为主要优势门类;而浮床水体中,变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)和蓝细菌门(Cyanobacteria)等门类占优势(图2(c))。
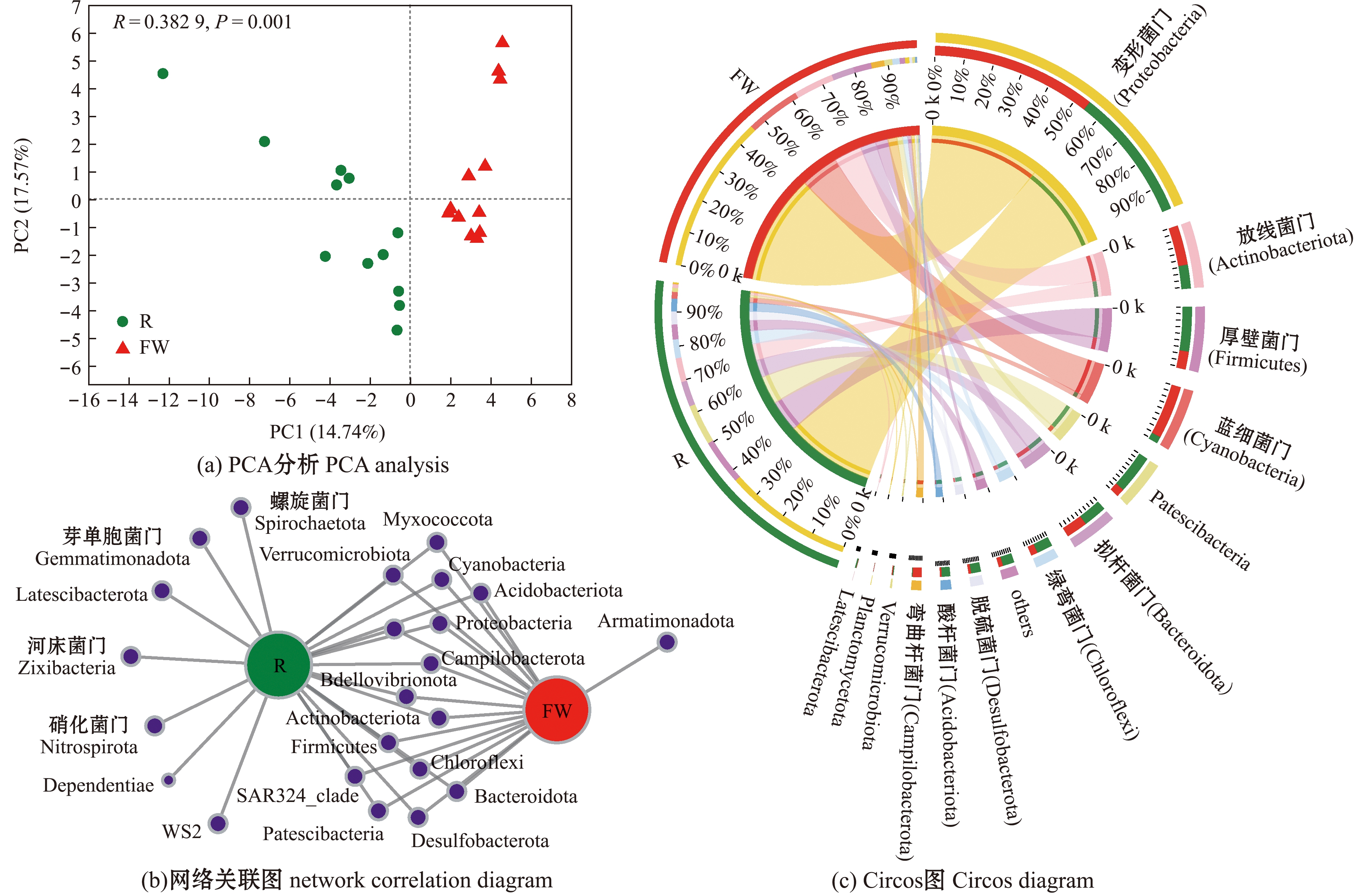
图2 生态浮床植物根际与水体细菌群落结构及β多样性特征
Fig.2 Bacterial community structure and beta diversity in plant rhizoshpere and water in the ecological floating bed
2.2 细菌代谢途径差异特征
为探究细菌组成变化对代谢途径的影响,基于宏基因组数据KEGG level 3层级对相对丰度>1%的主要代谢功能通路进行差异性分析。从图3可见,试验期间浮床水生植物根际细菌分别在碳代谢、转运蛋白、细菌双组分调节系统、群体感应、原核生物的碳固定途径、甲烷代谢、淀粉与蔗糖的代谢、氮代谢和细菌趋药性等主要代谢途径上发生了明显变化,这些代谢途径及功能所占相对丰度明显高于水体(P<0.05)。由此可见,生态浮床植物根际可能是微生物碳、氮代谢活动最主要的场所,对生态浮床养殖尾水处理系统中氮循环过程产生显著影响。
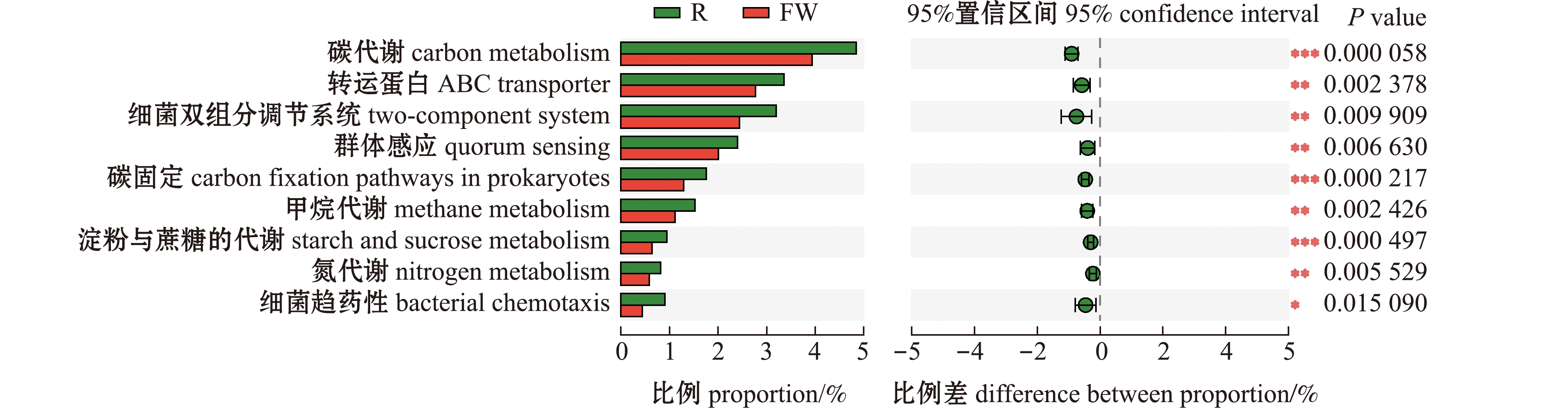
*表示两组间有差异(P<0.05);**表示两组间有显著性差异(P<0.01);***表示两组间有极显著性差异(P<0.001),下同。* means difference between groups(P<0.05);** means significant difference between groups(P<0.01);*** means very significant difference between groups(P<0.001),et sequentia.
图3 生态浮床植物根际与水体间细菌代谢功能的差异特征
Fig.3 Major microbial metabolic and functional difference between plant rhizosphere and water in the ecological floating bed
2.3 氮循环功能基因和关键酶响应变化
从图4 可见:浮床植物根际和水体细菌主要参与氮循环生物固氮过程(nitrogen fixation),以及生物脱氮过程中的硝化作用(nitrification)、反硝化作用(denitrification)、异化硝酸盐作用(dissimilatory nitrogen reduction,DNRA)和同化硝酸盐还原作用(assimilatory nitrogen reduction,ANRA)等5 个主要途径;有11 个参与氮循环的功能基因丰度发生明显变化(P<0.05),包括固氮功能基因nifH、nifD和nifK(合称nifHDK),硝化作用功能基因hao,反硝化作用功能基因nirS、norB和nosZ,异化硝酸盐还原功能基因napA、nrfA和nirB,以及同化硝酸盐还原功能基因nasA。
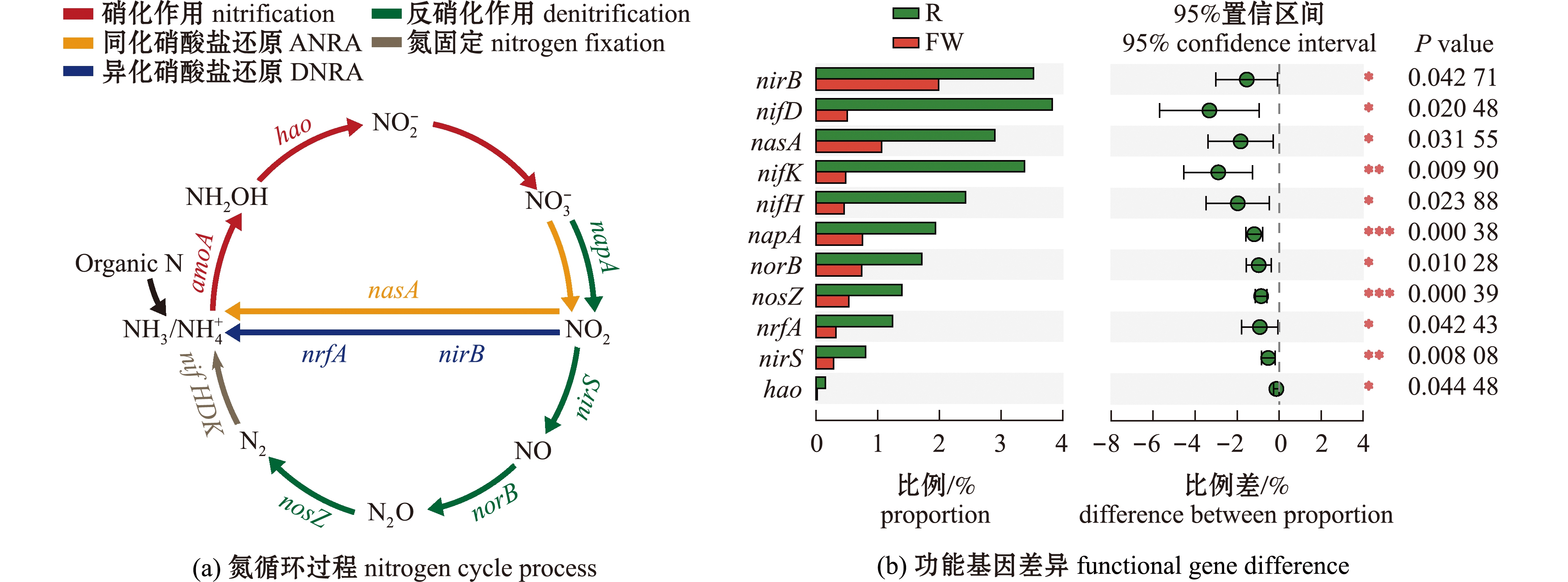
图4 浮床植物根际与水体间氮循环主要功能基因的差异特征
Fig.4 Difference characteristics of principal microbial N related functional genes between plant rhizosphere and water in the ecological floating bed
从图5可见,在氮循环中,有6 个关键酶的相对丰度发生了显著变化,包括固氮酶、一氧化氮还原酶、亚硝酸盐还原酶、氧化亚氮还原酶、周质细胞色素C亚硝酸还原酶和羟胺脱氢酶,这些关键酶主要催化氮循环中的固氮反应、硝化反应、反硝化反应和DNRA过程。具体作用过程如下:生物固氮过程是N2被还原成为![]() 和其他含氮化合物的过程,主要在固氮酶的电子转移蛋白(由nifH编码)、α亚单位(由nifD编码)和β亚单位(由nifK编码)催化作用下完成;硝化作用中,羟胺脱氢酶将NH2OH氧化成
和其他含氮化合物的过程,主要在固氮酶的电子转移蛋白(由nifH编码)、α亚单位(由nifD编码)和β亚单位(由nifK编码)催化作用下完成;硝化作用中,羟胺脱氢酶将NH2OH氧化成![]() 反硝化作用中,亚硝酸盐还原酶将
反硝化作用中,亚硝酸盐还原酶将![]() 还原为NO,然后分别在一氧化氮还原酶和氧化亚氮还原酶作用下,NO将N2O还原为
还原为NO,然后分别在一氧化氮还原酶和氧化亚氮还原酶作用下,NO将N2O还原为![]() 也可以通过DNRA过程在周质细胞色素C亚硝酸还原酶作用下还原为
也可以通过DNRA过程在周质细胞色素C亚硝酸还原酶作用下还原为![]() 最终完成生物脱氮过程。这表明,上述氮循环中功能基因和关键酶相对丰度均在浮床水生植物根际中所占比例较高(P<0.05),显著影响了水体氮循环过程。由此推测,浮床植物根际是养殖尾水处理系统内生物固氮和生物脱氮过程的主要场所。
最终完成生物脱氮过程。这表明,上述氮循环中功能基因和关键酶相对丰度均在浮床水生植物根际中所占比例较高(P<0.05),显著影响了水体氮循环过程。由此推测,浮床植物根际是养殖尾水处理系统内生物固氮和生物脱氮过程的主要场所。
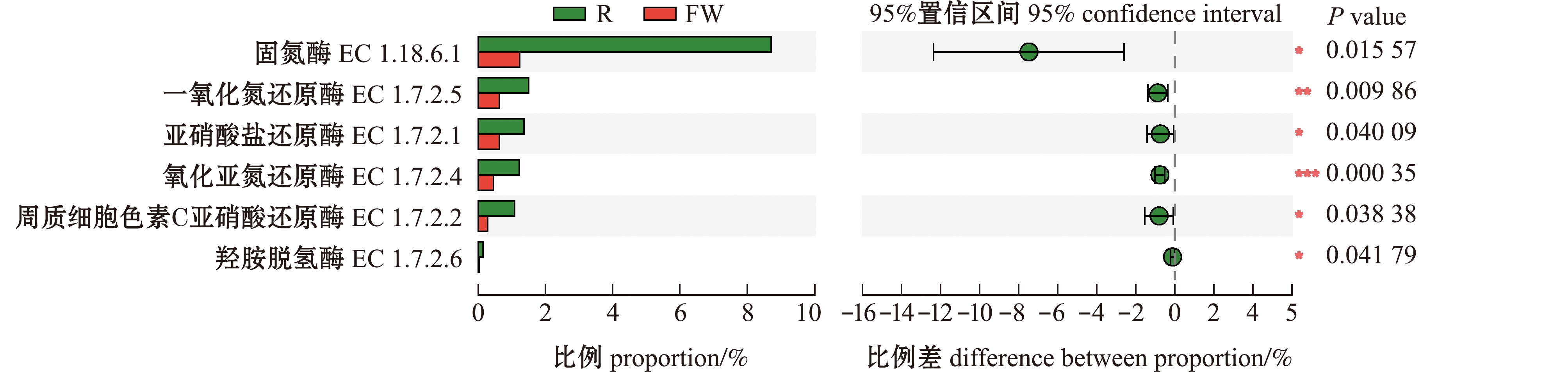
图5 浮床植物根际和水体间氮循环主要关键酶的差异特征
Fig.5 Difference characteristics of principal microbial N related key enzymes between plant rhizosphere and water in the ecological floating bed
2.4 与氮循环相关的关键细菌物种组成
物种与氮循环功能贡献度分析结果显示,在属水平上共筛选出10种主要功能细菌,分别在根际氮固定、硝化作用、反硝化作用、异化硝酸盐和同化硝酸盐还原作用途径贡献比例最高(图6(a))。其中,红薇菌属(Rhodomicrobium)完全参与固氮作用;甲基孢囊菌属(Methylocystis)不但与固氮作用相关,而且也主要参与硝化作用反应;雷氏菌属(Reyranella)、分枝杆菌属(Mycobacterium)和硫针菌属(Sulfuritalea)等同时参与反硝化和异化硝酸盐还原作用;丰佑菌属(Opitutus)和甲基养菌属(Methylibium)也参与了同化硝酸盐还原作用。基于16S rRNA高通量测序结果显示,上述10种与氮循环相关的关键细菌中,除分枝杆菌属和丰佑菌属外,其他关键功能细菌均显著富集在浮床植物根际上(P<0.05)(图6(b))。由此可见,这些细菌在植物根际的生物固氮和脱氮过程中发挥了重要作用。
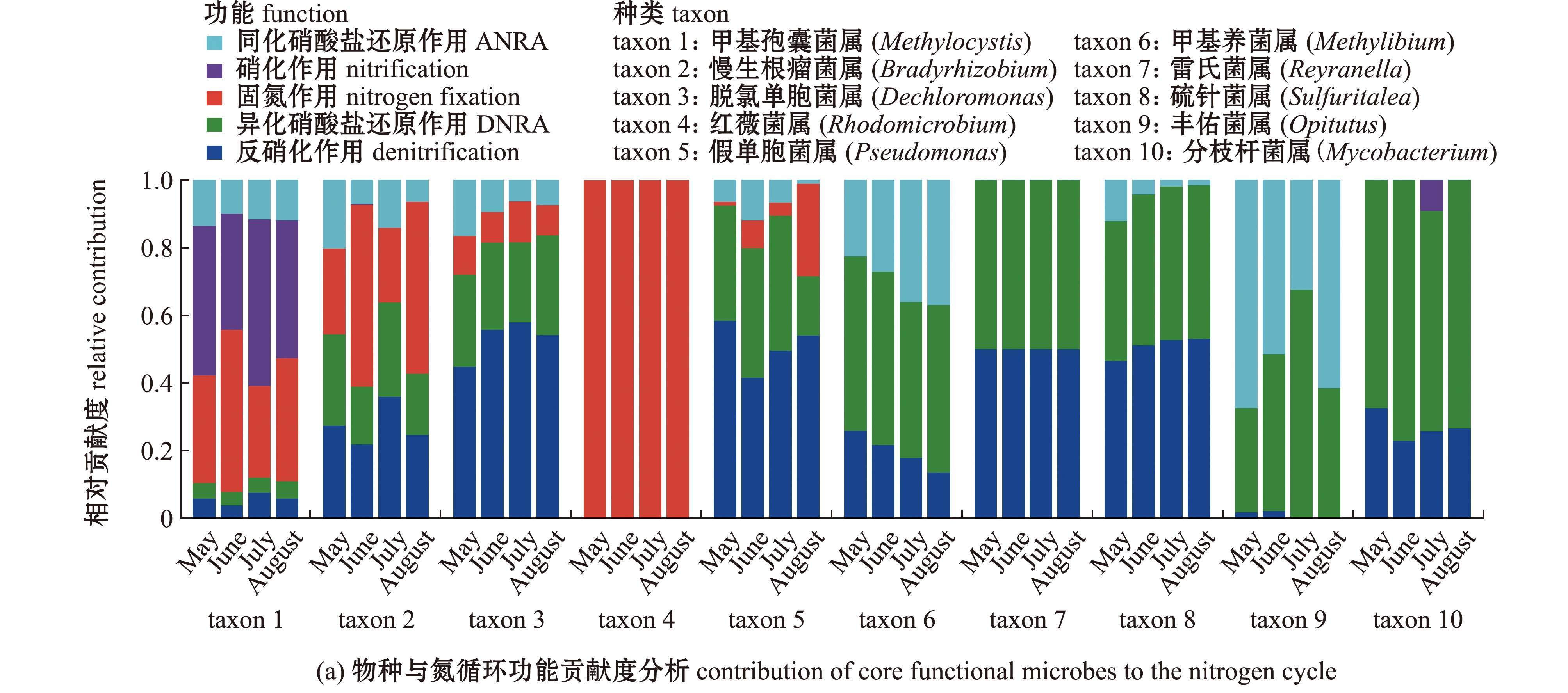
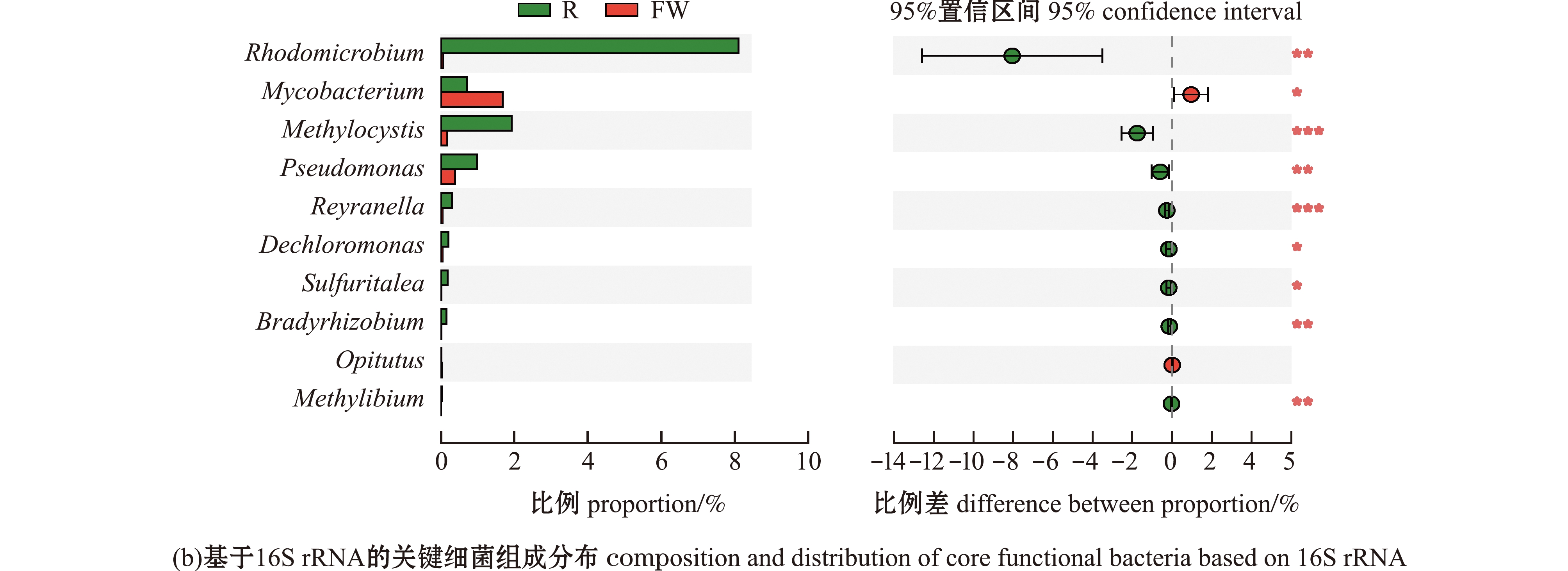
图6 浮床植物根际与氮循环相关的关键功能细菌
Fig.6 Core functional microbes related to nitrogen cycle in plant rhizosphere in the floating bed
2.5 植物根际细菌参与氮素转化的潜在作用机制
浮床植物根际细菌参与氮素转化的潜在作用机制如图7 所示。一方面,浮床水生植物根际周围吸附了高固氮能力的红薇菌属,并在固氮功能基因nifH介导下提升了根际的固氮能力,与此同时,甲基孢囊菌属不但协同参与了固氮过程,而且通过硝化作用去除了水中的氨氮;另一方面,根际细菌通过参与碳代谢过程促进了有机污染物的分解,也为根际的反硝化过程提供了易于利用的碳源和能源。因此,植物根际周围富集了大量的反硝化菌群,它们在关键酶催化下显著增强了相应功能基因的表达,并通过反硝化和DNRA途径促进了水体中硝态氮和亚硝态氮的去除。但有关植物根际细菌群落中种间的异质相互作用是非常复杂的,其参与氮素转化机制的过程仍需进一步通过试验加以证实。
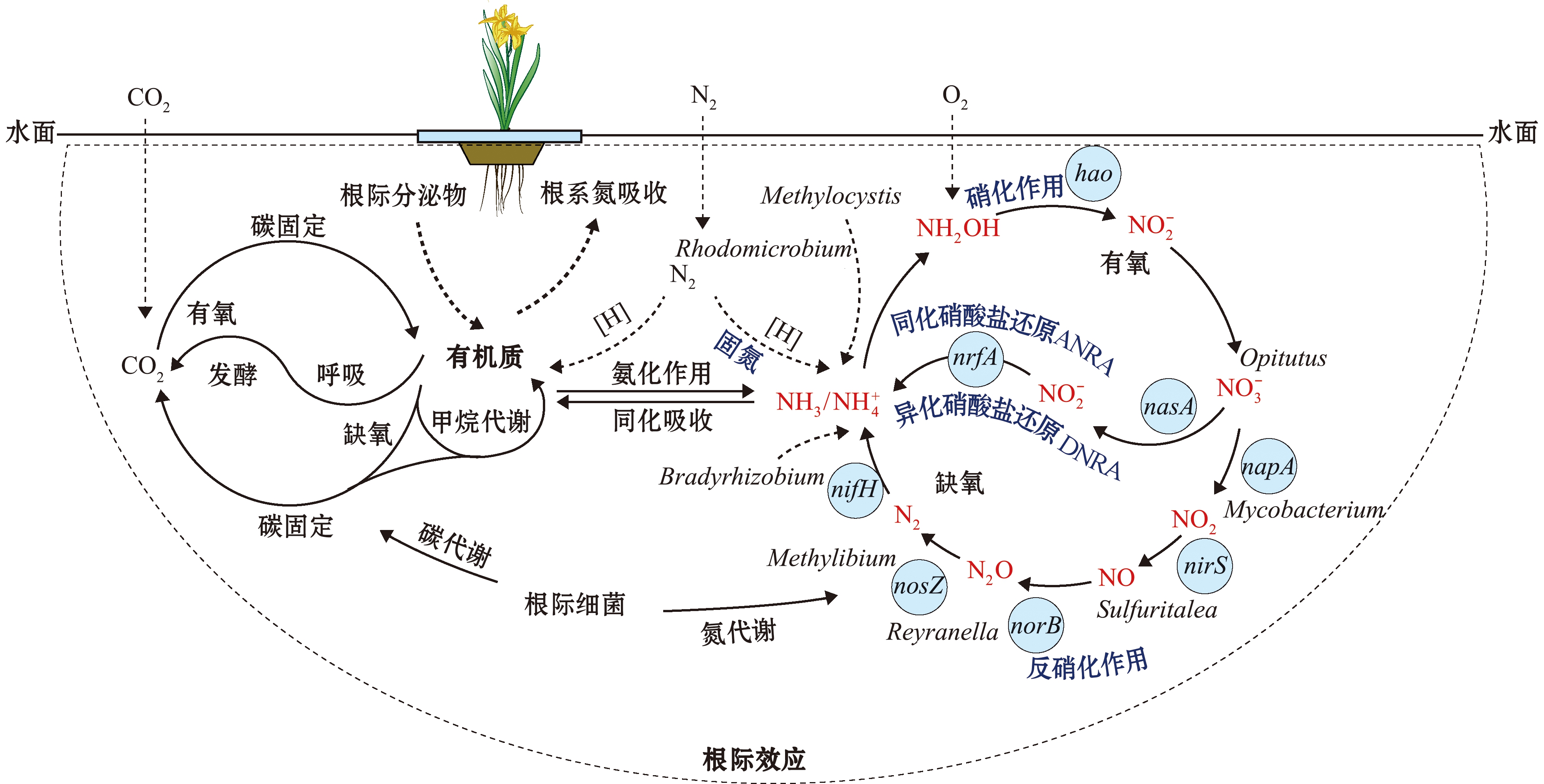
图7 生态浮床植物根际细菌氮素迁移转化途径
Fig.7 Bacterial nitrogen migration and transformation pathway of plant rhizosphere in the ecological floating bed
3 讨论
3.1 浮床植物根际细菌组成对水体环境的影响
根际是水生植物根系与水体细菌间相互作用所形成的独特圈带[12]。本研究结果显示,硝化菌门、芽单胞菌门、Latescibacterota门、螺旋菌门、Dependentiae门和河床菌门等是浮床水生植物根际周围的独特菌群(图2(c))。硝化菌门是亚硝态氮氧化菌NOB 重要菌属之一,具有较强的代谢活性和对基质的亲和力,是污水处理厂主要的硝化微生物群落和脱氮关键微生物[13];Latescibacterota门是植物根际主要类群之一,与氮、磷等营养物质浓度呈正相关关系[14];芽单胞菌门具有好氧甲烷能力,主要参与微生物的硫酸盐还原作用[15];螺旋菌门具有完全参与反硝化过程的能力,能够利用反硝化去除一氧化氮[16];Dependentiae门能够与植物根系分泌的次生代谢物原花青素相互作用,对反硝化细菌群生物量及其反硝化具有调节作用[17];河床菌门是一种厌氧氨化菌,能够在厌氧环境下参与生物脱氮过程,是污水生物脱氮中的一种重要厌氧氨化菌[18]。由此可以看出,富集在浮床植物根际周围的独特菌群均与氮代谢和氮循环相关,主要在污水含氮污染物去除方面发挥重要作用。
3.2 浮床植物根际细菌代谢活动对水体环境的影响
本研究结果显示,浮床植物根际细菌在碳固定、甲烷代谢、淀粉与蔗糖的代谢等方面可能具有比周围水环境更加强烈的碳周转能力的潜力(图3)。研究发现,植物根际周围的根系分泌物会给根际贡献大量的碳,根系分泌物作为根际的化学信号,富含丰富的糖类、氨基酸、有机酸和酰胺等物质,并通过与微生物互作固定生物地球化学循环中不易分解利用的碳[19],同时也可为反硝化过程补充充足的有机碳以提高脱氮效果。本研究中,浮床植物根际细菌的多样性和丰富度均显著高于周围水体环境(表1)。这可能是由于植物根际分泌物为根际细菌的生长和繁殖提供了充足的营养,使得根际细菌丰度和多样性增加,同时也会增强细菌活性和植物生物量[20]。此外,细菌双组分系统是细菌适应选择压力的一种重要生命机制,是存在于细菌内的一种信号传导系统,其通过参与和调控多个生理代谢过程维持自身细胞碳氮平衡[21]。本研究中,浮床植物根际细菌双组分系统和群体感应功能信号强度均显著高于周围水体环境,推测植物根际主要是通过细菌双组分系统响应外界复杂环境刺激和调控蛋白磷酸化进行信号传递[22],从而相互交换细菌群体感应信号分子,并介导水生植物根系细菌膜与水环境间的相互作用[23]。
3.3 浮床植物根际细菌对水体氮循环功能的影响
3.3.1 对固氮和硝化作用的影响 氮代谢途径显著变化主要是由微生物体内存在一系列氮代谢相关的酶及其编码这些酶的活性亚基功能基因所决定的。本研究中,浮床水生植物根际细菌群落氮循环过程主要包括氮固定、硝化作用、反硝化作用及同化/异化硝酸盐还原作用(图4、图5)。在固氮途径上固氮酶起到了关键作用,浮床水生植物根际细菌固氮酶及其编码标志物基因nif (包括nifH、nifD和nifK)丰度较高(图4),这说明根际上富集了大量的固氮细菌,其中,红薇菌属完全参与固氮作用(图6)。红薇菌属是一种具有产氢功能的光合细菌[24],不但能够高效降解污废水中的有机物从而净化水质,而且也为硝化反应提供氢根离子,并在氨氮和氧化催化下使氨氮形成中间体羟胺(NH2OH)从而促进硝化反应[25]。本研究结果显示,水生植物根际周围的硝化反应关键功能基因hao信号强度显著高于周围水环境(图4),说明生态浮床水生植物根际具有显著提高水体硝化能力的潜力。浮床水生植物根际周围聚集了大量的硝化细菌门细菌(图2),其中,甲基孢囊菌属是硝化作用的主要贡献者(图6)。由于高浓度的氨氮不仅会严重影响水产养殖动物机体组织、酶活性、代谢及摄食活动,甚至会造成死亡[26],而且也是水体富营养化形成的重要因子,因此,生态浮床系统的硝化作用对于养殖水体水质调控和水生动物健康至关重要。
3.3.2 对反硝化、异化/同化硝酸盐还原作用的影响 反硝化作用和异化硝酸盐还原反应是处理废水过程中生物脱氮的关键途径。本研究结果表明,反硝化菌群功能基因napA、nirS、norB和nosZ的信号强度均显著高于周围水环境(图4),并通过增强硝酸盐还原酶、氧化亚氮还原酶和一氧化氮还原酶的活性(图5),将养殖尾水中的硝态氮还原至氮气,从而完成生物脱氮过程。此外,功能基因nrfA是造成异化硝酸盐还原途径差异的关键生物因子[27],也是废水处理中维持厌氧氨氧化过程强化脱氮的关键步骤[28]。本研究中,浮床水生植物根际细菌nrfA功能基因丰度较高,说明浮床根际周围富集了大量DNRA的群落,其中,雷氏菌属、慢生根瘤菌属(Bradyrhizobium)、分枝杆菌属和硫针菌属等同时参与了反硝化和异化硝酸盐还原作用(图6)。Feng等[29]研究发现,雷氏菌属富含编码反硝化作用的功能基因narH、narJ和narI,而慢生根瘤菌属是唯一含有最多类型反硝化基因(14个)的菌属种类。Shi等[30]研究表明,分枝杆菌属是一种富含编码反硝化功能基因nirS、nosZ,以及具有强反硝化作用和降解芳烃物质功能的关键细菌。彭虎[31]研究发现,曝气生物滤池中的Sulfuritalea hydrogenivorans菌株在污水处理过程中主要发挥反硝化作用。由此推测,生态浮床水生植物根际可能是主要通过富集上述这些同时具有反硝化和DNRA 功能的菌群,在缺氧环境下以有机碳为电子供体,并利用硝化反应的产物硝态氮或亚硝态氮作为电子受体,将硝酸氮转化为氮气或气态氮氧化物。
与DNRA不同,ANRA途径可在有氧环境下通过同化型硝酸盐还原酶将硝态氮还原成亚硝态氮和氨,并转化为氨基酸供自身利用[32]。其中,nasA基因为表征ANRA过程的关键功能基因。本研究中,根际细菌甲基养菌属和丰佑菌属为多功能性细菌,同时参与DNRA和ANRA代谢途径。研究表明,Methylibium是一种革兰氏阴性杆菌,在有氧条件下通过ANRA途径将硝态氮还原为亚硝态氮[33]。而丰佑菌属拥有编码反硝化和异化硝酸盐还原途径的完整功能基因[34],也是封闭式工厂化水产养殖系统中下挂式海绵生物反应器中最主要的反硝化细菌类群[35]。综上可知,浮床水生植物根际具有更强的氮素周转能力的潜力,可能是通过介导浮床水生植物根际上关键菌群的反硝化和异化硝酸盐还原作用,从而驱动水体含氮污染物的去除和氮素迁移转化过程。
4 结论
1)生态浮床水生植物根际细菌主要由变形菌门、厚壁菌门、Patescibacteria门和拟杆菌门等组成。与周围水体相比,根际细菌群落多样性和丰富度指数较高,群落组成结构差异较大。
2)宏基因组数据揭示了浮床植物根际细菌在水处理过程中的脱氮途径,发现浮床水生植物根际细菌具有更强的氮循环能力和潜力,关键功能细菌群促进了浮床系统水体固氮、硝化、反硝化和异化/同化硝酸盐还原作用过程,有利于浮床系统内养殖尾水氮素迁移转化和含氮污染物的去除。
[1] 胥丁文,陈玲娜,马前.生态浮床技术的应用及研究新进展[J].中国给水排水,2010,26(14):11-15.
XU D W,CHEN L N,MA Q.Application and new research process of ecological floating bed technology[J].China Water & Wastewater,2010,26(14):11-15.(in Chinese)
[2] 张莹琦,贺菊花,程刚.生态浮岛技术用于河湖污染修复进展研究[J].环境科学与管理,2015,40(6):138-142.
ZHANG Y Q,HE J H,CHENG G.Application of ecological floating island technology in lake systems remediation[J].Environmental Science and Management,2015,40(6):138-142.(in Chinese)
[3] 张玲玲,刘立早,张玉平,等.不同增氧条件下强化生态浮床净化养殖水体的效果[J].中国给水排水,2020,36(17):69-74.
ZHANG L L,LIU L Z,ZHANG Y P,et al.Purification efficiencies of aquaculture water by enhanced floating treatment wetlands under different aeration conditions[J].China Water & Wastewater,2020,36(17):69-74.(in Chinese)
[4] 崔贺,张欣,董磊.生态浮床技术流域水环境治理中的研究与应用进展[J].净水技术,2021,40(sup 1):343-350.
CUI H,ZHANG X,DONG L.Research and application progress of ecological floating bed technology in river basin water environment treatment[J].Water Purification Technology,2021,40(sup 1):343-350.(in Chinese)
[5] 董怡华,张新月,陈峰,等.生态浮岛的构建及其修复校园富营养化人工湖水试验[J].环境工程,2021,39(3):90-96.
DONG Y H,ZHANG X Y,CHEN F,et al.Construction of ecological floating island and restoration of campus artificial lake eutrophicaiton[J].Environmental Engineering,2021,39(3):90-96.(in Chinese)
[6] 许国晶,段登选,杜兴华,等.基于生物协同作用的强化生态浮床对养殖水体的净化效果[J].大连海洋大学学报,2015,30(1):62-67.
XU G J,DUAN D X,DU X H,et al.Aquaculture waste water treatment by an enhanced ecological floating bed based on synergistic effect[J].Journal of Dalian Ocean University,2015,30(1):62-67.(in Chinese)
[7] CARY T J,RYLOTT E L,ZHANG L,et al.Field trial demonstrating phytoremediation of the military explosive RDX by XplA/XplB-expressing switchgrass[J].Nature Biotechnology,2021,39(10):1216-1219.
[8] WANG X,HU K,XU Q,et al.Immobilization of Cd using mixed Enterobacter and Comamonas bacterial reagents in pot experiments with Brassica rapa L.[J].Environmental Science & Technology,2020,54(24):15731-15741.
[9] UFART L,LAVILLE
L,LAVILLE  ,DUQUESNE S,et al.Metagenomics for the discovery of pollutant degrading enzymes[J].Biotechnology Advances,2015,33(8):1845-1854.
,DUQUESNE S,et al.Metagenomics for the discovery of pollutant degrading enzymes[J].Biotechnology Advances,2015,33(8):1845-1854.
[10] TRAN P Q,BACHAND S C,MCINTYRE P B,et al.Depth-discrete metagenomics reveals the roles of microbes in biogeochemical cycling in the tropical freshwater Lake Tanganyika[J].The ISME Journal,2021,15(7):1971-1986.
[11] 陈嗣威,郑海粟,张晟曼,等.不同植物组合对模拟污水厂尾水的净化效果及对根系微生物群落的影响[J].应用与环境生物学报,2022,28(2):387-393.
CHEN S W,ZHENG H S,ZHANG S M,et al.Effects of different plant combinations on purification effect of simulated wastewater treatment plant tail water and root microbial community[J].Chinese Journal of Applied and Environmental Biology,2022,28(2):387-393.(in Chinese)
[12] 赵婉婉,郭丽芸,吴伟.水生植物根系生态化学特性及其生态响应研究进展[J].江苏农业科学,2017,45(3):231-236.
ZHAO W W,GUO L Y,WU W.Research progress of aquatic plant roots ecochemical characteristics and their ecological responses[J].Jiangsu Agricultural Sciences,2017,45(3):231-236.(in Chinese)
[13] 王彤,汪涵,周明达,等.污水脱氮功能微生物的组学研究进展[J].微生物学通报,2021,48(12):4844-4870.
WANG T,WANG H,ZHOU M D,et al.Advances in omics of functional microorganisms for nitrogen removal in wastewater[J].Microbiology China,2021,48(12):4844-4870.(in Chinese)
[14] WU T,QIN Y,LI M.Intercropping of tea (Camellia sinensis L.) and Chinese chestnut:variation in the structure of rhizosphere bacterial communities[J].Journal of Soil Science and Plant Nutrition,2021,21(3):2178-2190.
[15] RAVEN M R,KEIL R G,WEBB S M.Microbial sulfate reduction and organic sulfur formation in sinking marine particles[J].Science,2021,371(6525):178-181.
[16] RAZAVIARANI V,RUIZ-URIGÜEN M,JAFF P R.Denitrification of nitric oxide using hollow fiber membrane bioreactor;effect of nitrate and nitric oxide loadings on the reactor performance and microbiology[J].Waste and Biomass Valorization,2019,10(7):1989-2000.
P R.Denitrification of nitric oxide using hollow fiber membrane bioreactor;effect of nitrate and nitric oxide loadings on the reactor performance and microbiology[J].Waste and Biomass Valorization,2019,10(7):1989-2000.
[17] HUGONI M,GALLAND W,LECOMTE S,et al.Effects of the denitrification inhibitor procyanidins on the diversity,interactions,and potential functions of rhizosphere-associated microbiome[J].Microorganisms,2021,9(7):1406.
[18] CASTELLE C J,HUG L A,WRIGHTON K C,et al.Extraordinary phylogenetic diversity and metabolic versatility in aquifer sediment[J].Nature Communications,2013,4:2120.
[19] WEN T,YU G H,HONG W D,et al.Root exudate chemistry affects soil carbon mobilization via microbial community reassembly[J].Fundamental Research,2022,6:59.
[20] SALEEM M,HU J,JOUSSET A.More than the sum of its parts:microbiome biodiversity as a driver of plant growth and soil health[J].Annual Review of Ecology,Evolution,and Systematics,2019,50:145-168.
[21] LI W,LU C D.Regulation of carbon and nitrogen utilization by CbrAB and NtrBC two-component systems in Pseudomonas aeruginosa[J].Journal of Bacteriology,2007,189(15):5413-5420.
[22] 李雷,卫科科,姜卫红,等.细菌双组分系统应答调控蛋白调控策略的多样性[J].中国科学:生命科学,2017,47(5):462-469.
LI L,WEI K K,JIANG W H,et al.Diversity of regulatory strategies for two-component system response regulators in bacteria[J].Scientia Sinica (Vitae),2017,47(5):462-469.(in Chinese)
[23] 王朋, 孔垂华.微生物群体感应信号物质及其在植物-微生物相互关系中的作用[C]//中国第四届植物化感作用学术研讨会论文摘要集.青岛:中国植物保护学会植物化感作用专业委员会,2009:44.
WANG P,KONG C H. Role of quorum-sensing signals in plant-microbe interaction[C]//Abstracts of the 4th symposium on plant allelopathy in China.Qingdao:Professional Committee on Allelopathy of Plants of China Plant Protection Society,2009:44.(in Chinese)
[24] 张明,史家梁.光合细菌光合产氢机理研究进展[J].应用与环境生物学报,1999,5(sup 1):25-29.
ZHANG M,SHI J L.Mechanism of hydrogen photoproduction by photosynthetic bacteria[J].Chinese Journal of Applied and Environmental Biology,1999,5(sup 1):25-29.(in Chinese)
[25] WANG X Z,WANG Y,CHENG X,et al.Formation characteristics of an anoxygenic photosynthetic bacterial biofilm in a photorotating biological contactor for azo dye wastewater treatment[J].Journal of Chemical Technology & Biotechnology,2015,90(1):176-184.
[26] 王梦杰,陈建华,王海华.氨氮对水产动物的毒性效应研究进展[J].江西水产科技,2019(2):38-43.
WANG M J,CHEN J H,WANG H H. Research progress in the toxicological effects of ammonia nitrogen on aquatic animals[J].Jiangxi Fishery Science and Technology,2019(2):38-43.(in Chinese)
[27] WANG Q K,DING C,TAO G H,et al.Analysis of enhanced nitrogen removal mechanisms in a validation wastewater treatment plant containing anammox bacteria[J].Applied Microbiology and Biotechnology,2019,103(3):1255-1265.
[28] 曾涛涛,李冬,谢水波,等.厌氧氨氧化菌微生物特性研究进展[J].应用与环境生物学报,2014,20(6):1111-1116.
ZENG T T,LI D,XIE S B,et al.A review on microbial properties of anaerobic ammonium oxidation (ANAMMOX) bacteria[J].Chinese Journal of Applied and Environmental Biology,2014,20(6):1111-1116.(in Chinese)
[29] FENG L J,YANG J Y,YU H,et al.Response of denitrifying community,denitrification genes and antibiotic resistance genes to oxytetracycline stress in polycaprolactone supported solid-phase denitrification reactor[J].Bioresource Technology,2020,308:123274.
[30] SHI M Z,ZHAO X Y,ZHU L J,et al.Elucidating the negative effect of denitrification on aromatic humic substance formation during sludge aerobic fermentation[J].Journal of Hazardous Materials,2020,388:122086.
[31] 彭虎.富铁填料和锰砂强化BAF处理低温水的效能及微生物特性研究[D].兰州:兰州交通大学,2018.
PENG H.Study on performance and microbial properties of biological aerated filter for low-temperature sewage treatment by using iron-rich media and manganese sand[D].Lanzhou:Lanzhou Jiatong University,2018.(in Chinese)
[32] 陶怡乐,温东辉.细菌硝酸盐异化还原成铵过程及其在河口生态系统中的潜在地位与影响[J].微生物学通报,2016,43(1):172-181.
TAO Y L,WEN D H.Dissimilatory nitrate reduction to ammonium:the potential and impacts in estuarine regions[J].Microbiology China,2016,43(1):172-181.(in Chinese)
[33] YOON M H,TEN L N,IM W T,et al.Methylibium fulvum sp.nov.,a member of the Betaproteobacteria isolated from ginseng field soil,and emended description of the genus Methylibium[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(Pt 9):2062-2066.
[34] SANFORD R A,WAGNER D D,WU Q Z,et al.Unexpected nondenitrifier nitrous oxide reductase gene diversity and abundance in soils[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(48):19709-19714.
[35] TANIKAWA D,NAKAMURA Y,TOKUZAWA H,et al.Effluent treatment in an aquaponics-based closed aquaculture system with single-stage nitrification-denitrification using a down-flow hanging sponge reactor[J].International Biodeterioration & Biodegradation,2018,132:268-273.