温台渔场位于东海中部近海水域, 西接瓯江口,北连乐清湾与温州湾,受浙江沿岸水、黑潮次表层水和台湾暖流等海流水团的共同影响,浮游生物饵料丰富,是众多海洋游泳生物的产卵场和索饵场,也是多种捕捞网具作业的良好渔场[1-2]。近年来,随着大型围填海工程、航道疏浚等活动的开展,海洋生态环境日益恶化,导致该海域渔业资源衰退严重[3]。因此,在温台渔场产卵场保护区开展渔业资源调查,可为今后游泳动物的繁殖保护和管理提供科学依据。
冗余分析(redundancy analysis,RDA)是回归分析与主成分分析相结合的一种排序方法,广泛用于探究渔业资源群落与环境因子间的关系,并发现溶解氧[4]、温度[5]和水深[6]均为影响渔业资源群落结构的重要因素。然而,RDA受空值影响较大[7],基于距离的冗余分析(distance-based redundancy analysis,db-RDA)可在一定程度上消除零值对结果的影响[8],其在海洋生物的研究中应用更为广泛。Shivarudrappa等[9]采用db-RDA法评估了溶解氧对墨西哥湾北部大陆架大型底栖生物群落的影响。Kodama等[10]通过分析连续15年的调查数据,揭示了日本沿海暖水性浮游动物可作为对马暖流的指示生物。王亮根等[11]研究表明,大亚湾鱼卵、仔稚鱼的空间分布分别受桡足类和水动力学因子驱动。
目前,有关温台渔场产卵场保护区游泳动物的资源现状、群落结构及与环境因子间的关系未见报道。本研究中,采用系统聚类分析和冗余分析等方法对温台渔场产卵场保护区的游泳动物群落进行研究,以期为温台渔场产卵场保护区及其附近海域制定生态保护策略和科学管理措施提供基础数据,为促进该海域渔业资源的可持续利用提供科学依据。
1 材料与方法
1.1 研究区域及站位设置
于2019年春季(4月)和秋季(10月)在温台渔场产卵场保护区及其附近海域(120°57′E~121°59′E,27°39′N~28°01′N)进行游泳动物底拖网调查(图1),调查海域总面积约为2 528 km2。调查站位范围涵盖瓯江入海口、洞头列岛近岸海域与开放海域,其中,D01~D08站位位于温台渔场产卵场保护区内。底拖网网口宽度为15 m,高度为3 m,网囊网目为20 mm。调查海域共设置20个调查站位,每个站位拖网时长约0.5 h,拖速控制在3 kn左右。各站位所得样品均以1 h时间和3 kn拖速进行标准化处理。
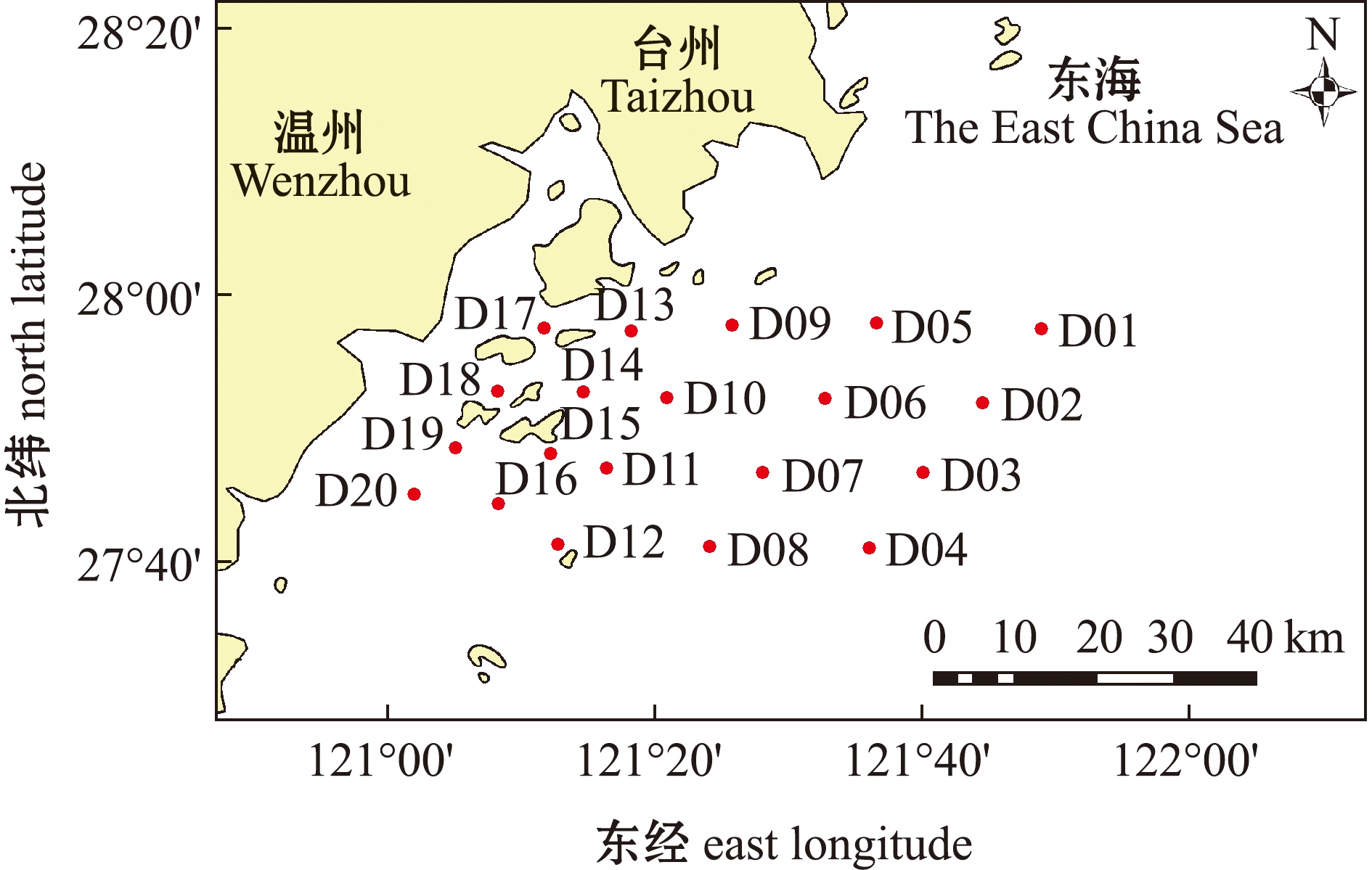
本图基于自然资源部标准地图服务网站GS(2020)4615号标准地图为底图制作,底图边界无修改。
The figure is based on the standard map GS(2020)4615 in the standard map service website of Ministry of Natural Resources of the People’s Republic of China, with no modifications of the boundaries in the standard map.
图1 温台渔场产卵场保护区调查站位图
Fig.1 Survey station location of spawning ground reserve in Wentai fishing ground
1.2 方法
1.2.1 相对资源密度 游泳动物的相对资源密度采用扫海面积法进行计算,其计算公式为
Di=Ci/(aiq)。
(1)
其中: Di为第i站位的相对资源密度(kg/km2或ind./km2);Ci为第i站位的每小时拖网渔获量(kg/h或ind./h);ai为第i站位的单位时间拖网扫海面积(km2/h);q为网具捕获率,其中,虾类、蟹类和虾蛄类q值取0.8,中上层鱼类q值取0.3,底层鱼类和头足类q值取0.5[12]。
1.2.2 优势种确定 利用Pianka[13]提出的相对重要性指数(IRI)确定各物种的相对重要性。分别计算各季节的IRI值,计算公式为
IRI=(N+W)×F×10 000。
(2)
其中: N为某物种数量占总数量的比例(%);W为某物种生物量占总生物量的比例(%);F为某物种在各站位中出现的频率(%)。
当IRI≥1 000时,表示该物种为优势种;当100≤IRI<1 000时为重要种;当10≤IRI<100时为常见种;当1≤IRI<10时为一般种;当IRI<1时为少见种。
1.2.3 群落相似性分析 采用系统聚类分析(CLUSTER)方法评估各调查站位间的相似性;利用非度量多维尺度分析(non-metric multidimensional scaling,NMDS)方法研究游泳动物群落结构的变化,并对站位进行排序。同时用胁迫系数(stress)评价NMDS二维点阵分布图效果,一般认为stress<0.05时,结果具有较好的代表性;0.05≤stress<0.1时,分析结果基本可信;0.1≤stress<0.2时,结果具有一定解释意义。
1.2.4 基于距离的冗余分析 在进行冗余分析前,先进行除趋势对应分析(DCA),并计算各轴梯度长度(LGA)。本研究中,LGA为3.85,且各站位的物种数据中存在大量零值,故采用基于Bray-Curtis距离的冗余分析。
Bray-Curtis距离(D)计算公式为
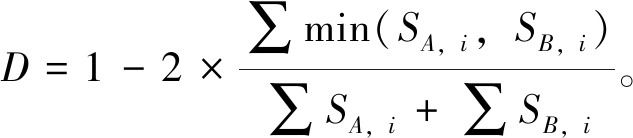
(3)
其中: SA,i和SB,i为第i个物种分别在A站位和B站位中的丰度;min表示取两者最小值。D值越小,表示两个站位游泳动物群落结构的差异就越小。
本研究中使用的环境因子包括底层盐度(BS)、表层盐度(SS)、底层温度(BT)和水深(DP)。DCA分析、db-RDA和层次分割(Hierarchical Partitioning,HP)计算过程及检验在R统计软件中的Vegan包和Rdacca.hp包中进行。
2 结果与分析
2.1 物种组成
两个季次调查共捕获游泳动物66种,其中鱼类34种,虾类14种,蟹类13种,虾蛄类2种,头足类3种。春季,龙头鱼Harpodon nehereus出现频率最高,为100%,占总渔获量的47.64%;秋季,高频次种类数量增加,龙头鱼、三疣梭子蟹Portunus trituberculatus、口虾蛄Oratosquilla oratoria和棘头梅童鱼Collichthys lucidus出现频率均为100%,共占总渔获量的78.03%。
IRI指数分析表明,春季和秋季优势种和重要种均为10种。其中,龙头鱼、三疣梭子蟹在春、秋两次调查中均为优势种;口虾蛄春季为重要种,秋季则为优势种;棘头梅童鱼和日本蟳Charybdis japonica在春、秋两次调查中均为重要种(表1)。
表1 游泳动物优势种和重要种及其IRI值
Tab.1 IRI Values of dominant and important species of nekton
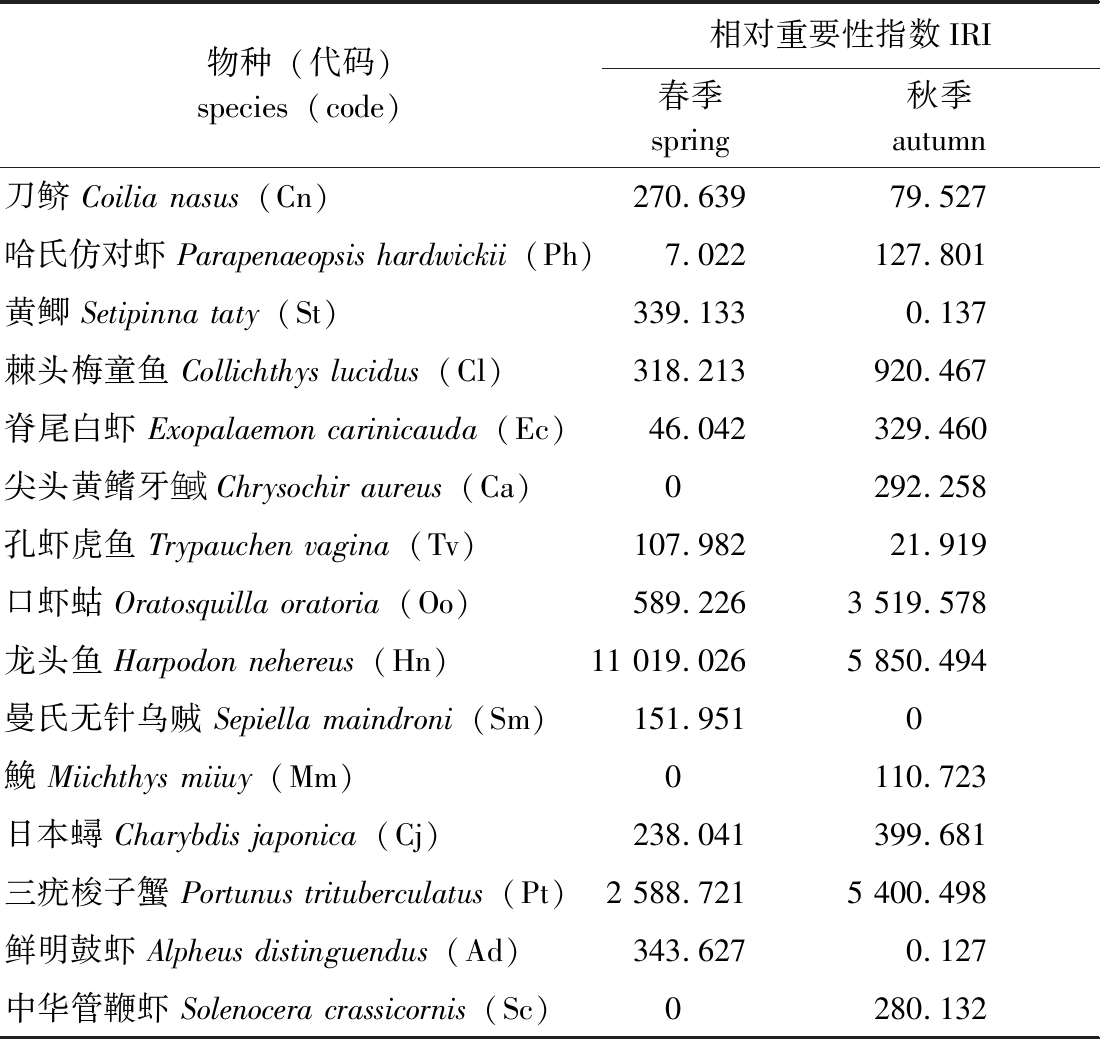
物种(代码) species(code)相对重要性指数IRI 春季spring秋季autumn刀鲚 Coilia nasus(Cn)270.63979.527哈氏仿对虾 Parapenaeopsis hardwickii(Ph)7.022127.801黄鲫 Setipinna taty(St)339.1330.137棘头梅童鱼 Collichthys lucidus(Cl)318.213920.467脊尾白虾 Exopalaemon carinicauda(Ec)46.042329.460尖头黄鳍牙鱼或Chrysochir aureus(Ca)0292.258孔虾虎鱼 Trypauchen vagina(Tv)107.98221.919口虾蛄 Oratosquilla oratoria(Oo)589.2263 519.578龙头鱼 Harpodon nehereus(Hn)11 019.0265 850.494曼氏无针乌贼 Sepiella maindroni(Sm)151.9510鮸 Miichthys miiuy(Mm)0110.723日本蟳 Charybdis japonica(Cj)238.041399.681三疣梭子蟹 Portunus trituberculatus(Pt)2 588.7215 400.498鲜明鼓虾 Alpheus distinguendus(Ad)343.6270.127中华管鞭虾 Solenocera crassicornis(Sc)0280.132
2.2 游泳动物的时空分布
两个季次的调查中,春、秋季游泳动物渔获量总丰度为6 758 ind.,总生物量为99.30 kg。其中,春季游泳动物总丰度为2 460 ind.,总生物量为24.57 kg;秋季游泳动物总丰度为4 298 ind.,总生物量为74.73 kg。春季调查海域平均生物量密度为 75.41 kg/km2,其中,D06站位生物量密度最高,为221.70 kg/km2,D03站位最低,仅为 17.66 kg/km2;尾数密度的平均值为 7 481.40 ind./km2,D06站位尾数密度最高,为 19 078.47 ind./km2,D03站位最低,仅为 1 679.87 ind./km2。秋季调查海域平均生物量密度为225.62 kg/km2,其中,D09站位生物量密度最高,为317.92 kg/km2,D08站位生物量密度最低,仅为98.70 kg/km2;尾数密度的平均值为12 992 ind./km2,其中,D14站位尾数密度最高,为20 458.36 ind./km2,D13站位尾数密度最低,仅为3 299.74 ind./km2(图2)。秋季的生物量密度和尾数密度明显高于春季,且两个季节最大值和最小值出现的站位也不相同。
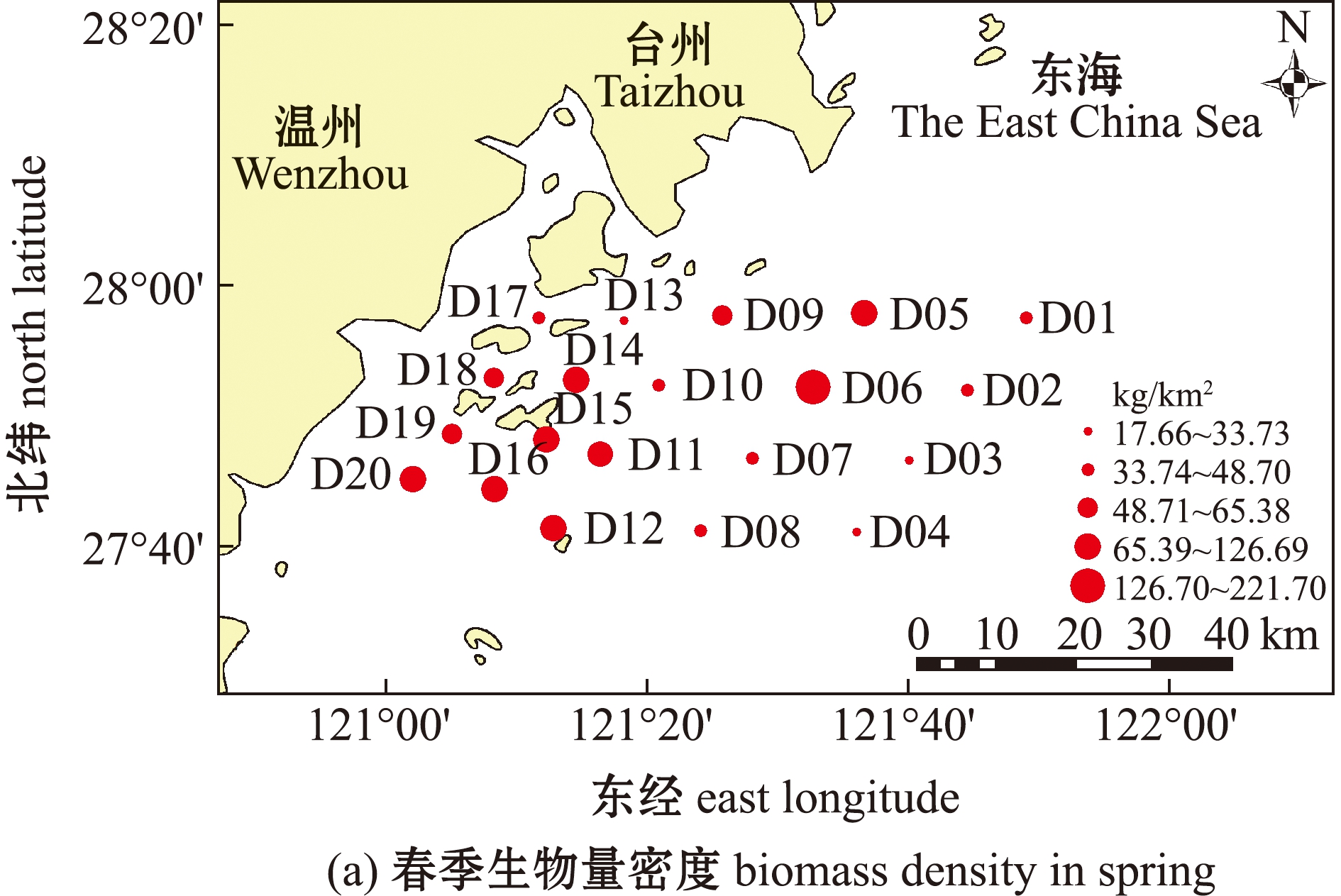
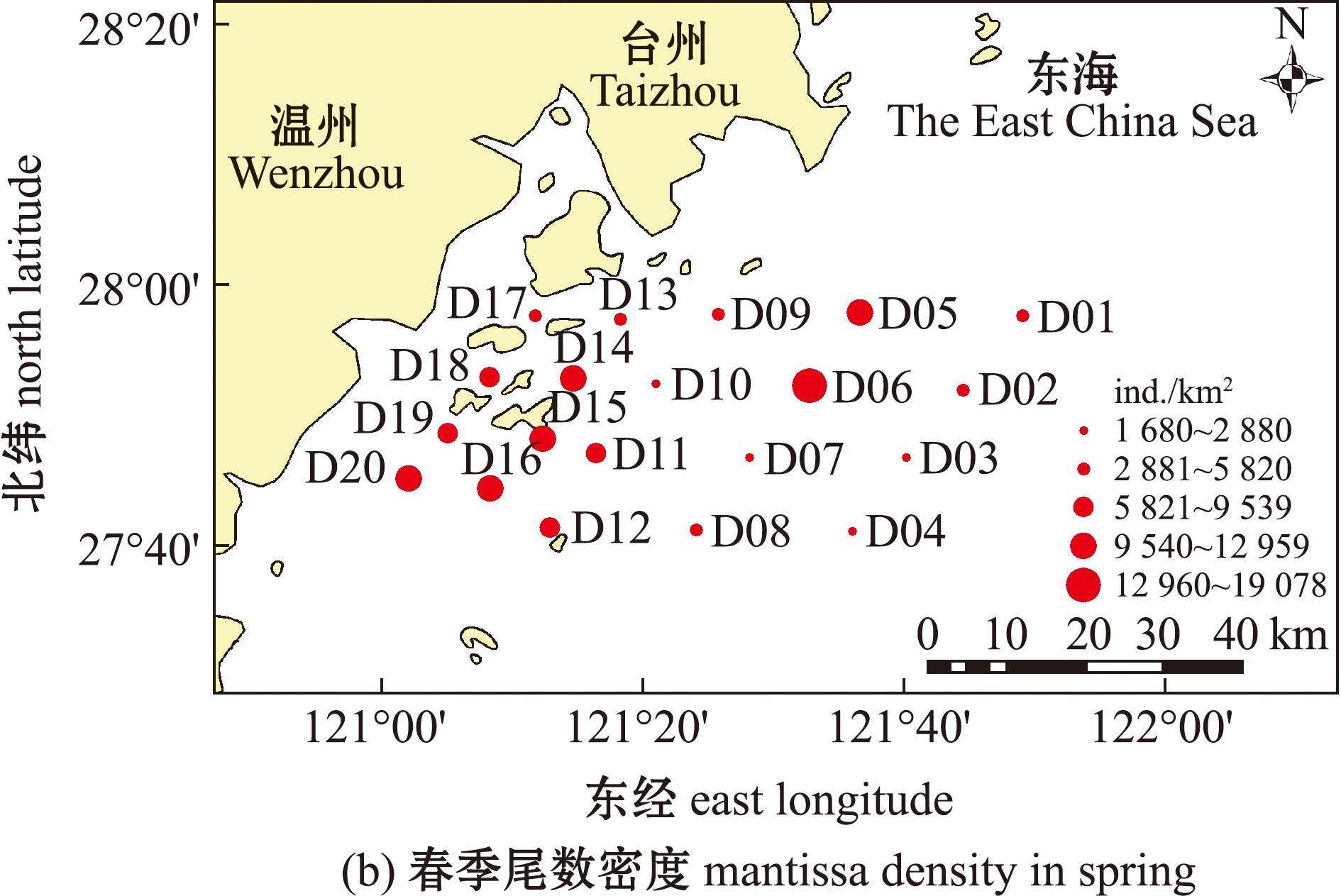
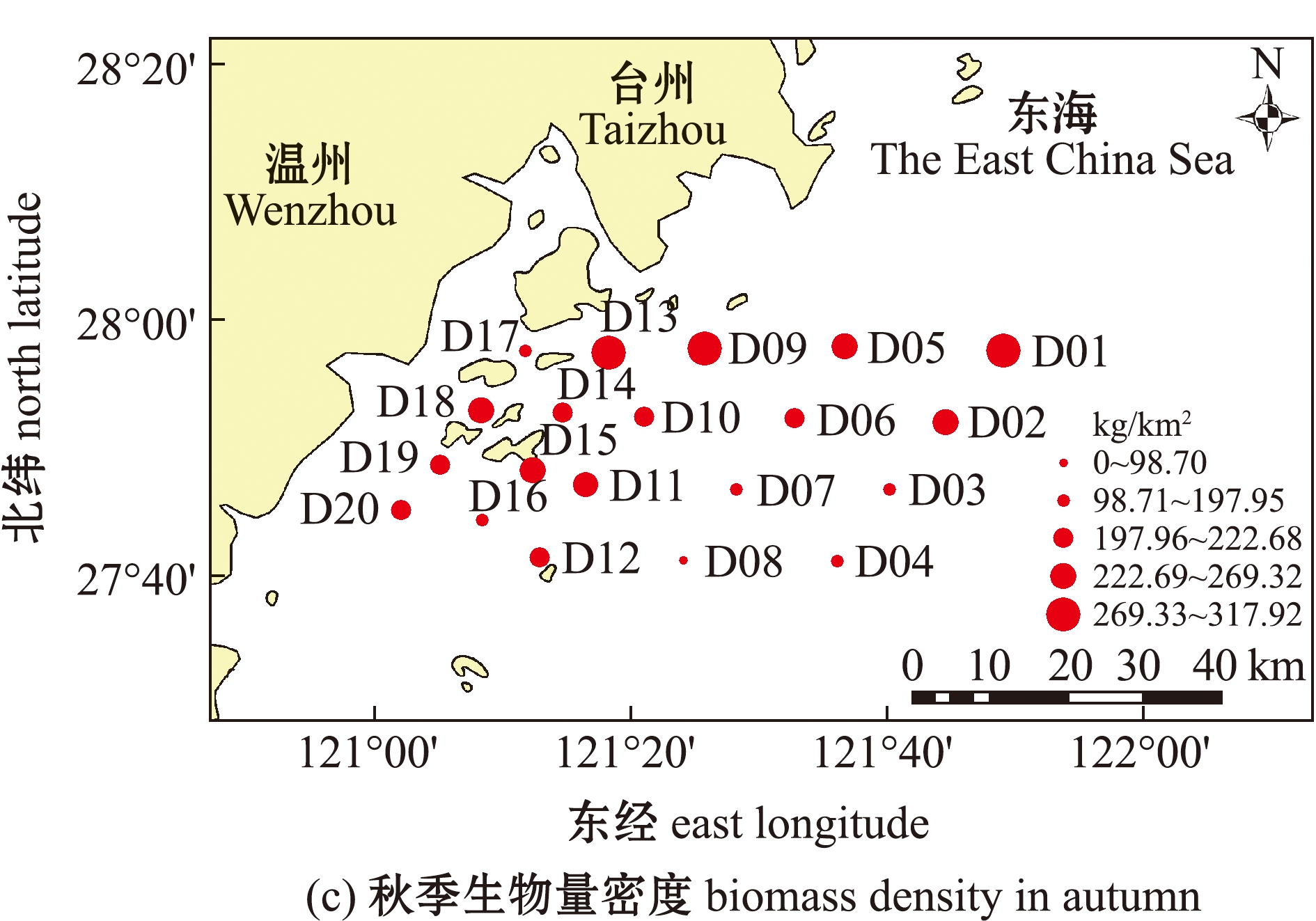
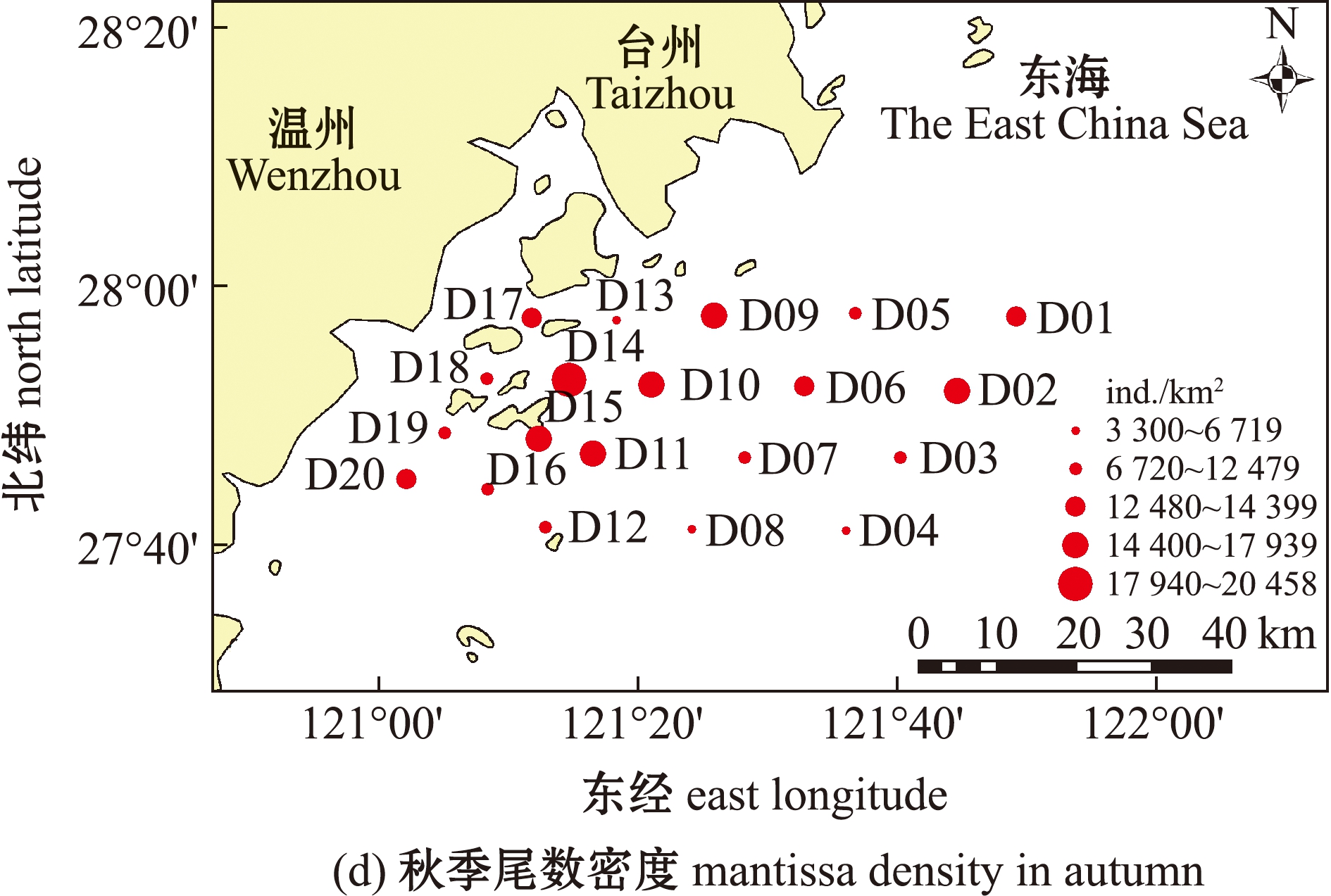
图2 调查海域春季、秋季生物量密度和尾数密度的空间分布
Fig.2 Spatial distribution of biomass density and mantissa density in the investigated sea area in spring and autumn
2.3 群落结构分析
根据ANOSIM检验结果,春季、秋季游泳动物群落结构差异极显著(P<0.01)。游泳动物群落的聚类谱系图和NMDS排序图见图3,二者的结果一致。春季,在30%相似性水平下,调查站位可分为3组:A组共2个站位(D03、D04),位于调查海域的东南部,组内平均相似性为65.29%;C组共2个站位(D13和D17),位于调查海域的西北部,组内平均相似性为67.73%;其余16个站位为B组,组内平均相似性为49.64%。秋季,在50%的相似性水平下,调查站位可分为3组:A组1个站位(D13),位于调查海域西北部稍远离海岸线的区域;C组共4个站位(D17、D18、D10和D14),位于调查海域的西北部,临近洞头列岛,组内平均相似性为63.52%;其余15个站位为B组,组内平均相似性为63.96%。春季NMDS的胁迫系数为0.07,属于0.05~0.1范围,表明分析结果基本可信;秋季NMDS的胁迫系数为0.11,秋季胁迫系数属于0.1~0.2范围,表明分析结果具有一定的解释意义。

图3 游泳动物群落的聚类谱系图和NMDS排序图
Fig.3 Cluster pedigree and NMDS ranking of nekton community
通过SIMPER分析可知:春季A组和B组的平均相异性为77.91%,主要分歧种为鳀、刀鲚和三疣梭子蟹等10种;A组和C组的平均相异性为82.54%,主要分歧种为龙头鱼、三疣梭子蟹和鳀等9种;B组和C组的平均相异性为71.01%,主要分歧种为龙头鱼、三疣梭子蟹和刀鲚等11种。秋季A组和B组的平均相异性为71.1%,主要分歧种为鮸、三疣梭子和棘头梅童鱼等7种;A组和C组的平均相异性为75.8%,主要分歧种为鮸、龙头鱼和三疣梭子蟹等5种;B组和C组的平均相异性为53.89%,主要分歧种为龙头鱼、三疣梭子蟹和棘头梅童鱼等11种(表2)。
2.4 群落结构与环境因子的关系
db-RDA分析结果如表3所示,4个环境因子共解释21.87%的物种信息,第1、2排序轴的特征值为0.068 3、0.031 5。全模型检验具有显著性(P=0.001),表明db-RDA分析结果具有参考价值。
温台渔场产卵场保护区游泳动物15种优势种和重要种与环境因子间的db-RDA分析发现,环境因子对龙头鱼(Hn)、三疣梭子蟹(Pt)、口虾蛄(Oo)、日本蟳(Cj)、鮸(Mm)和棘头梅童鱼(Cl)的分布有较强的影响(图4)。其中,龙头鱼、口虾蛄和三疣梭子蟹的空间分布与4个环境因子均密切相关,日本蟳、鮸和棘头梅童鱼与底层盐度、表层盐度和水深密切相关。
db-RDA的层次分割结果显示,底层温度对游泳动物时空分布变异的解释率最高,占总解释率的58.05%,其次为水深和底层盐度,分别占19.28%和15.05%,最低为表层盐度,仅占7.61%。
表2 调查海域春秋季组间分歧种对组间平均相异性的贡献
Tab.2 Contribution of different species between groups to the average phase difference between groups in the investigated sea area in spring and autumn
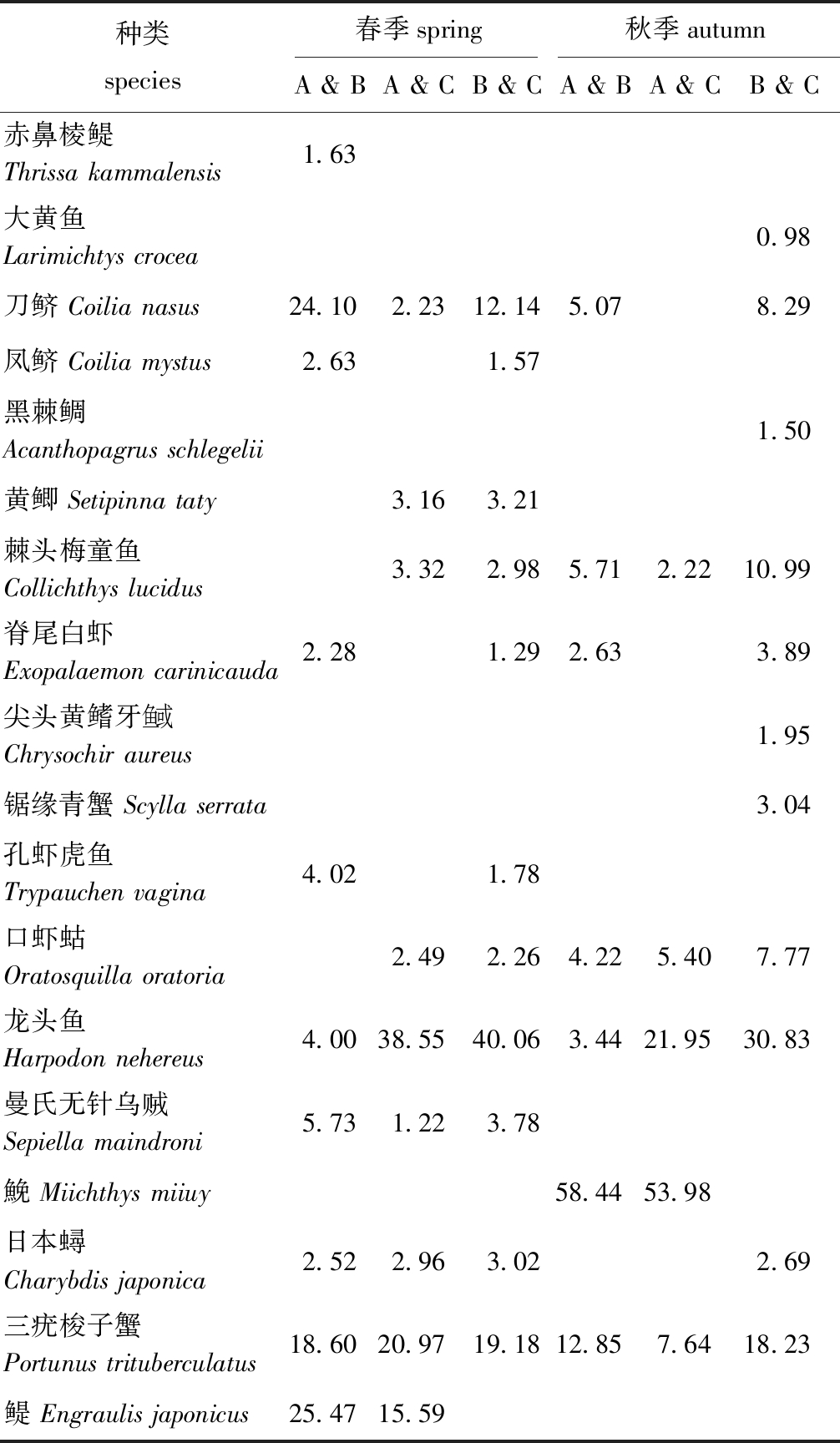
种类species春季spring秋季autumnA & BA & CB & CA & BA & CB & C赤鼻棱鳀 Thrissa kammalensis1.63大黄鱼 Larimichtys crocea0.98刀鲚 Coilia nasus24.102.2312.145.078.29凤鲚 Coilia mystus2.631.57黑棘鲷 Acanthopagrus schlegelii1.50黄鲫 Setipinna taty3.163.21棘头梅童鱼 Collichthys lucidus3.322.985.712.2210.99脊尾白虾 Exopalaemon carinicauda2.281.292.633.89尖头黄鳍牙鱼或Chrysochir aureus1.95锯缘青蟹 Scylla serrata3.04孔虾虎鱼 Trypauchen vagina4.021.78口虾蛄 Oratosquilla oratoria2.492.264.225.407.77龙头鱼 Harpodon nehereus4.0038.5540.063.4421.9530.83曼氏无针乌贼 Sepiella maindroni5.731.223.78鮸 Miichthys miiuy58.4453.98日本蟳 Charybdis japonica2.522.963.022.69三疣梭子蟹 Portunus trituberculatus18.6020.9719.1812.857.6418.23鳀 Engraulis japonicus25.4715.59
表3 游泳动物群落db-RDA分析结果
Tab.3 Biomass db-RDA analysis results of nekton
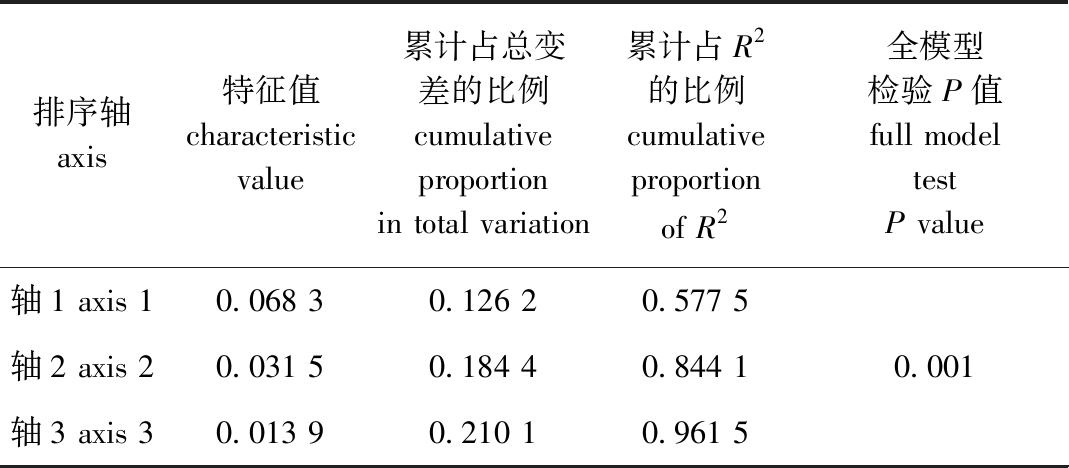
排序轴 axis特征值 characteristic value累计占总变差的比例 cumulative proportion in total variation累计占R2的比例 cumulative proportion of R2全模型检验P值 full model test P value轴1 axis 10.068 30.126 20.577 5轴2 axis 20.031 50.184 40.844 10.001轴3 axis 30.013 90.210 10.961 5
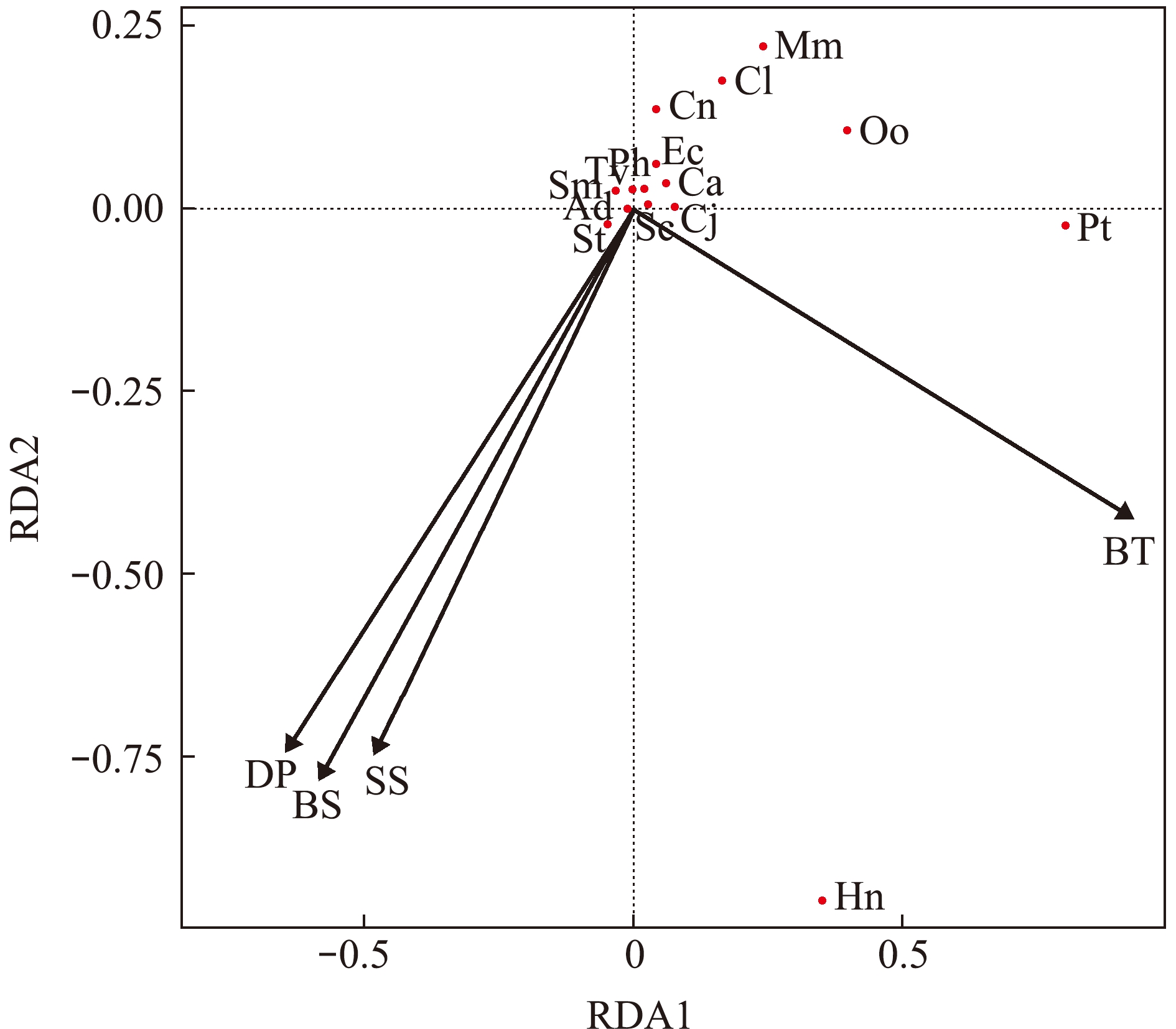
DP—水深;BS—底层盐度;SS—表层盐度;BT—底层温度;其他字母代码含义见表1。
DP—water depth;BS—bottom salinity;SS—surface salinity;BT—bottom temperature; other letter codes are shown in Table 1.
图4 调查海域重要种和优势种与环境因子间的db-RDA排序图
Fig.4 db-RDA ranking of important and dominant species and environmental factors in the investigated sea area
3 讨论
3.1 游泳动物种类组成和时空分布特征
温台渔场产卵场保护区作为温台渔场的重要组成部分,是众多学者关注的热点区域。2013年的瓯飞滩及邻近海域的底拖网调查中,共捕获游泳动物87种[14],而2007年瓯江口夏、秋两季鱼类共64种[15]。本研究中调查共发现游泳动物66种,种类数少于以往调查结果,呈现下降趋势。这表明,调查海域存在资源衰退的现象,群落的种类组成处于变化中。近年来,人为扰动频繁,地方性污染和水体富营养化等使得自然生态环境越来越恶劣[16];同时对海域的过度开发利用也是引起资源衰退、物种减少的主要原因[17]。
本研究中显示,龙头鱼和三疣梭子蟹在数量、质量和出现频率上均处于明显优势地位,其分布特征在一定程度上决定了调查海域的群落结构特征,是温台渔场产卵场保护区海域的特征种类。20世纪70年代,该海域特征种以凤鲚、香鱼和锯缘青蟹等为主[18-19];2000年左右,特征物种更替为白姑鱼、日本蟳、三疣梭子蟹和哈氏仿对虾等[20];而本研究显示,龙头鱼和三疣梭子蟹的IRI值远高于其他种类,成为优势物种。这表明,游泳动物群落结构在变化的同时,其渔获质量也在不断下降,高营养水平物种的选择性捕捞及低营养水平物种的抗干扰能力是物种格局发生变化的核心因素[21]。
本研究中,秋季的平均生物量密度和尾数密度高于春季,季节间的变化趋势与2018年在该海域的调查结果一致[22]。伏季休渔时,游泳动物在饵料生物充足和未受捕捞压力的情况下,快速生长,生物量迅速积累,资源密度达到峰值[23],秋季调查正好在伏季休渔刚刚结束时开展,故秋季资源密度大于春季。秋季生物量密度最高的站位(D09)出现在洞头列岛海域附近,同时该海域虾类数量占该区域渔获物的56.01%,其中,哈氏仿对虾Parapenaeopsis hardwickii和中华管鞭虾Solenocera crassicornis出现频率分别为75%和95%,且多为性成熟个体。洞头列岛及附近海域位于瓯江入海口,同时受高温高盐的台湾暖流、浙江沿岸流和瓯江冲淡水的影响[15],水流环境复杂多样(涡流、紊流和上升流等);同时该海域岛礁分布密集,海底地形(浅滩、礁石和深槽等)与底质(沙质和淤泥质等)丰富多样,多样化的海底地形为游泳动物提供了合适的栖息地和充足的饵料来源[20]。因此,该区域资源密度高于其他区域。历史资料[24]同样表明,洞头列岛及其附近海域是哈氏仿对虾和中华管鞭虾的重要产卵场,与本研究结果一致。
3.2 游泳动物群落结构特征
游泳动物群落结构稳定性对于维持生态系统结构与功能的稳定至关重要。本研究中,从聚类谱系图和NMDS排序分析结果可以看出,秋季游泳动物群落结构相似性较高,春季相似性较低,两个季节分组并无明显规律。龙头鱼不仅是两个季节的优势种,同时也是主要分歧种,这表明组间的分歧种在一定程度上也是群落的优势种,游泳动物群落结构的特征变化可能是由各站位的优势种组成和数量变化造成的,这与芮银等[3]的研究结果相似。龙头鱼在群落中占绝对优势,这与龙头鱼广温广盐的生态类型和较强的捕食能力有关。在扰动的生境中,优势种往往只由一种或者几种数量极大的物种组成,而在未受干扰或者较为稳定的生境中,优势种往往由多种比例比较接近的物种组成[25]。这表明,温台渔场产卵场保护区受人为扰动影响较大,群落的稳定性降低。单一优势种会使群落结构的不稳定性加剧,其余种类所占比例减小或者消失,导致群落多样性和均匀度降低。
相关研究发现,水深、温度和盐度等对游泳动物空间分布的影响显著,且在不同海域主要影响因子不同[26]。本研究显示,温台渔场产卵场保护区及其附近海域游泳动物的时空分布与表层温度、表层盐度、底层盐度及水深密切相关。在近岸海域,海水的理化特征受到冲淡水、沿岸流和海流影响,温度和盐度通常是影响游泳动物空间分布的主要环境因子。本研究中,底层温度具有更高的解释能力,主要与刀鲚、鮸和棘头梅童鱼等暖水性鱼类的生活习性有关,这些鱼类在繁殖季节洄游至调查海域进行产卵,而在秋冬季节水温下降时向外海深水区洄游越冬,从而导致游泳动物在调查海域的种类组成和数量分布在春季及秋季呈现较大差异。底层盐度是影响游泳动物时空分布的重要环境因子[27],但在本研究中,底层盐度解释率并不高。由于受浙江沿岸流、台湾暖流和瓯江冲淡水的季节性周期影响[15],调查海域盐度变化范围较大,而河口性鱼类对盐度的适应范围较广,因此,盐度对群落结构时空分布影响不明显。本研究中,水深的解释比例较低,水深是综合性的环境因子,不直接影响游泳动物的时空分布,而是通过影响温度、压强、溶解氧和光照度等一系列因素,进而对鱼类的生活习性和分布情况造成影响[28]。
综上,温台渔场产卵场保护区及其附近海域游泳动物仍存在资源衰退、种类减少的现象。落实“伏季休渔”政策、减少工业污水排放和治理水体富营养化对恢复游泳动物资源及改善水体环境具有重要意义。
4 结论
1)凤鲚、锯缘青蟹、白姑鱼等经济种出现频率明显下降,这反映了温台渔场产卵场保护区及其附近海域的游泳动物群落仍呈现种类减少、资源量下降的趋势。
2)离岸较近站位的游泳动物尾数密度和生物量密度总体上比离岸较远的站位高,季节间也存在较明显的差异,秋季游泳动物尾数密度和生物量密度总体上高于春季。
3)尖头黄鳍牙鱼或、鮸、中华管鞭虾在春季未捕获,仅在秋季出现,且为秋季的重要种,这表明游泳动物群落结构在季节间存在的显著差异是由春、秋季环境因子的季节性变化和群落物种的生物学特性共同作用所致。
[1] 韩晓凤.温台渔场产卵场保护区及附近海域游泳动物群落结构及多样性研究[D].舟山:浙江海洋大学,2020.
HAN X F.Study on community structure and biodiversity of nekton in the conservation zone of spawning ground for Wen-Tai fishing ground and nearby waters[D].Zhoushan:Zhejiang Ocean University,2020.(in Chinese)
[2] 李鹏,杨世伦,陈沈良.浙南近岸海流季节变化特征[J].海洋学报,2014,36(3):19-29.
LI P,YANG S L,CHEN S L.Primary analysis of current condition and seasonal variation in southern Zhejiang[J].Acta Oceanologica Sinica,2014,36(3):19-29.(in Chinese)
[3] 芮银,蒋日进,王好学,等.大陈洋产卵场保护区鱼类群落结构特征及其与环境因子的关系[J].水产学报, 2022,46(6):995-1007.
RUI Y,JIANG R J,WANG H X,et al.Characteristics of fish community structure and its relationship with environmental factors in Dachenyang spawning ground reserve[J].Journal of Fisheries of China,2022,46(6):995-1007.(in Chinese)
[4] 曾嘉维,林坤,王学锋,等.雷州湾附近海域鱼类群落结构及其与环境因子的关系[J].中国水产科学,2019,26(1):108-117.
ZENG J W,LIN K,WANG X F,et al.Fish community structure and its relationship with environmental factors in Leizhou Bay[J].Journal of Fishery Sciences of China,2019,26(1):108-117.(in Chinese)
[5] 蒋日进,张琳琳,徐开达,等.浙江中南部近岸海域游泳动物功能群特征与多样性[J].生物多样性,2019,27(12):1330-1338.
JIANG R J,ZHANG L L,XU K D,et al.Characteristics and diversity of nekton functional groups in the coastal waters of south-central Zhejiang Province[J].Biodiversity Science,2019,27(12):1330-1338.(in Chinese)
[6] FARR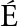 M,TUSET V M,CARTES J E,et al.Depth-related trends in morphological and functional diversity of demersal fish assemblages in the western Mediterranean Sea[J].Progress in Oceanography,2016,147:22-37.
M,TUSET V M,CARTES J E,et al.Depth-related trends in morphological and functional diversity of demersal fish assemblages in the western Mediterranean Sea[J].Progress in Oceanography,2016,147:22-37.
[7] JUPKE J F,SCH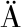 FER R B.Should ecologists prefer model- over distance-based multivariate methods?[J].Ecology and Evolution,2020,10(5):2417-2435.
FER R B.Should ecologists prefer model- over distance-based multivariate methods?[J].Ecology and Evolution,2020,10(5):2417-2435.
[8] ROBERTS D W.Comparison of multidimensional fuzzy set ordination with CCA and db-RDA[J].Ecology,2009,90(9):2622-2634.
[9] SHIVARUDRAPPA S,BRIGGS K.Macrobenthos community succession in the northern Gulf of Mexico hypoxic regions:testing the Pearson-Rosenberg model[J].Journal of Marine Research,2017,75(1):18-46.
[10] KODAMA T,WAGAWA T,IGUCHI N,et al.Spatial variations in zooplankton community structure along the Japanese coastline in the Japan Sea:influence of the coastal current[J].Ocean Science,2018,14(3):355-369.
[11] 王亮根,李亚芳,杜飞雁,等.大亚湾人工鱼礁区和岛礁区浮游动物群落特征及对仔稚鱼的影响[J].南方水产科学,2018,14(2):41-50.
WANG L G,LI Y F,DU F Y,et al.Zooplankton community characteristics and impact on ichthyoplankton in artificial reefs and island reefs of Daya Bay[J].South China Fisheries Science,2018,14(2):41-50.(in Chinese)
[12] 林龙山,赵贵根,李渊,等.东山湾及其邻近海域游泳动物多样性的分析[J].水生生物学报,2012,36(6):1119-1127.
LIN L S,ZHAO G G,LI Y,et al.Diversity of nekton in Dongshan Bay and adjacent areas[J].Acta Hydrobiologica Sinica,2012,36(6):1119-1127.(in Chinese)
[13] PIANKA E R.Ecology of the agamid lizard Amphibolurus lsolepis in western Australia[J].Copeia,1971,1971(3):527.
[14] 胡成业,徐衡,水柏年,等.温州瓯飞滩邻近海域春季游泳动物群落结构及多样性[J].南方水产科学,2015,11(3):7-15.
HU C Y,XU H,SHUI B N,et al.Community structure and biodiversity of nekton near Oufei beach of Wenzhou[J].South China Fisheries Science,2015,11(3):7-15.(in Chinese)
[15] 徐兆礼.夏秋季瓯江口海域鱼类数量的时空分布[J].动物学报,2008,54(6):981-987.
XU Z L.Spatial-temporal distribution of fish density in the Oujiang Estuary during summer and autumn[J].Acta Zoologica Sinica,2008,54(6):981-987.(in Chinese)
[16] 杜飞雁,王雪辉,贾晓平,等.大亚湾海域大型底栖生物种类组成及特征种[J].中国水产科学,2011,18(4):877-892.
DU F Y,WANG X H,JIA X P,et al.Species composition and characteristics of macrobenthic fauna in Daya Bay,South China Sea[J].Journal of Fishery Sciences of China,2011,18(4):877-892.(in Chinese)
[17] 郭建忠,陈作志,许友伟,等.人类活动对大亚湾海域鱼类群落多样性及其演替的影响[J].中国水产科学,2018,25(3):595-607.
GUO J Z,CHEN Z Z,XU Y W,et al.The effects of anthropogenic activities on the diversity and succession of fish community in Daya Bay[J].Journal of Fishery Sciences of China,2018,25(3):595-607.(in Chinese)
[18] 吴奕.瓯江水产资源保护亟待重视[J].科学养鱼,1997(9):5,8.
WU Y.The protection of Oujiang River aquatic resources needs urgent attention[J].Scientific Fish Farming,1997(9):5,8.(in Chinese)
[19] 仇林根.浙江南部沿海蟹类调查报告[J].现代渔业信息,1990,5(10):16-25,12.
QIU L G.Investigation report on crabs in the South Coast of Zhejiang Province[J].Modern Fisheries Information,1990,5(10):16-25,12.(in Chinese)
[20] 徐兆礼.瓯江口海域夏秋季鱼类多样性[J].生态学报,2008,28(12):5948-5956.
XU Z L.Analysis of fish diversity in the waters off the Oujiang Estuary in summer and autumn[J].Acta Ecologica Sinica,2008,28(12):5948-5956.(in Chinese)
[21] 单秀娟,金显仕.长江口近海春季鱼类群落结构的多样性研究[J].海洋与湖沼,2011,42(1):32-40.
SHAN X J,JIN X S.Diversity of fish community structure in the spring-time offshore waters at the Yangtze River Estuary[J].Oceanologia et Limnologia Sinica,2011,42(1):32-40.(in Chinese)
[22] 梁海.洞头外侧海域鱼类群落结构及物种多样性研究[D].舟山:浙江海洋大学,2019.
LIANG H.Study on community structure and species diversity of fish in Dongtou outside sea area[D].Zhoushan:Zhejiang Ocean University,2019.(in Chinese)
[23] 许思思.人为影响下渤海渔业资源的衰退机制[D].青岛:中国科学院大学(中国科学院海洋研究所),2011.
XU S S.Decline mechanisms of fishery resources in the Bohai Sea under anthropogenic activities[D].Qingdao: University of Chinese Academy of Sciences(Institute of Oceanology,Chinese Academy of Sciences),2011.(in Chinese)
[24] 张秋华,程家骅,徐汉祥,等.东海区渔业资源及其可持续利用[M].上海:复旦大学出版社,2007: 385-388.
ZHANG Q H,CHENG J H,XU H X,et al. The fishery resources and its sustainable utilization in the East China Sea Region[M].Shanghai:Fudan University Press,2007: 385-388.(in Chinese)
[25] 沈新强,史赟荣,晁敏,等.夏、秋季长江口鱼类群落结构[J].水产学报,2011,35(5):700-710.
SHEN X Q,SHI Y R,CHAO M,et al.Fish community structure of the Yangtze River Estuary in summer and autumn[J].Journal of Fisheries of China,2011,35(5):700-710.(in Chinese)
[26] 董静瑞,胡成业,水玉跃,等.温州南部沿岸海域鱼类群落特征及其与环境因子的关系[J].中国水产科学,2017,24(2):209-219.
DONG J R,HU C Y,SHUI Y Y,et al.Fish community structure and its relationships with environmental factors in the southern inshore waters of Wenzhou[J].Journal of Fishery Sciences of China,2017,24(2):209-219.(in Chinese)
[27] 徐茂真,张崇良,薛莹,等.山东近海渔业物种多样性与环境因子关系[J].水产学报,2022,46(6):1008-1017.
XU M Z,ZHANG C L,XUE Y,et al.Relationship between species diversity and environmental factors in the fishery community of Shandong coastal waters[J].Journal of Fisheries of China,2022,46(6):1008-1017.(in Chinese)
[28] 李迎冬,张崇良,纪毓鹏,等.山东半岛南部海域小黄鱼时空分布及其与环境因子的关系[J].中国水产科学,2021,28(4):442-450.
LI Y D,ZHANG C L,JI Y P,et al.Spatio-temporal distribution of Larimichthys polyactis in southern waters off the Shandong Peninsula and its relationship with environmental factors[J].Journal of Fishery Sciences of China,2021,28(4):442-450.(in Chinese)