淡水渔业是中国水产业的重要组成部分,轮虫等优质的生物活饵规模化生产是保障其产业健康发展的重要因素。然而,生产中普遍使用的萼花臂尾轮虫Brachionus calyciflorus等淡水轮虫在培养过程中存在养殖密度低、高峰期持续时间短、敌害生物多及规范化培育难度大等问题,难以满足渔业生产的实际需求。褶皱臂尾轮虫Brachionus plicatilis是一种典型的内陆盐水种轮虫,体形小,已成为海水鱼幼鱼广泛使用的优质活体开口饵料[1],其具有适应力强、繁殖与生长速度快、营养丰富、易于培养及适口性较好等特点[2],同时褶皱臂尾轮虫作为一种海水轮虫,还具有广盐性。
温度和盐度均为影响褶皱臂尾轮虫生理活动的重要生态因子[3-4]。孙迪杰等[5]和董婧等[6]研究了温度对褶皱臂尾轮虫寿命和繁殖的影响,徐海龙等[7]研究了盐度对褶皱臂尾轮虫生长繁殖的影响,在温度、盐度双因子影响研究中,陈云波等[8]和王珊等[9]研究了温度和盐度作用下,褶皱臂尾轮虫休眠卵体积和孵化的变化,Fielder等[10]还研究了温度和盐度突变对褶皱臂尾轮虫可用性的改变。上述研究均是针对不同温度环境对轮虫的作用,或是探讨盐度突变对轮虫的影响,而对于海水轮虫经过人工长期低盐驯化后,在不同温度下轮虫生命表统计学参数的研究尚未见报道。
本研究中,以盐度23条件下和经长期低盐驯化至盐度6条件下的褶皱臂尾轮虫为受试生物,采用动态生命表试验,研究了不同温度对其种群生活史参数的影响,探究低盐驯化轮虫最适的生长繁殖温度范围,以期为低盐驯化褶皱臂尾轮虫的培养提供基础数据资料,进而实现其规模化培育,为淡水鱼苗提供更多的优质开口生物活饵。
1 材料与方法
1.1 材料
试验在青海湖裸鲤救护中心进行,所用褶皱臂尾轮虫引自辽宁盘锦光合蟹业有限公司,原始培养液盐度为23,使用NaCl和纯净水调节盐度,其中,部分轮虫采用盐度23的培养液进行培养,另一部分轮虫进行低盐度驯化培养,培养液盐度逐级降低,月均降低盐度1.2,经过一年多后盐度降至6。培养箱温度为(25±1) ℃,定期用活体小球藻Chlorella vulgaris投喂轮虫。
1.2 方法
1.2.1 轮虫预培养 分别将盐度6和盐度23条件下培养的褶皱臂尾轮虫在光照培养箱(光照度为130 lx,光暗比为12∶12)中进行“克隆”培养,培养温度为(25±1) ℃。
试验前,先在两个直径为1 cm、长度为10 cm 的玻璃试管中对轮虫进行预培养,吸取两种盐度的培养液5 mL,用于培养携带非混交卵的雌性轮虫(与盐度6和23条件下培养的轮虫盐度保持一致),待培养出试验需要的小于4 h有活力的轮虫幼虫数量时,吸取幼虫用于后续正式试验。
1.2.2 单个体培养试验 本研究目标是实现青海湖裸鲤Gymnocypris przewalskii仔稚鱼开口的轮虫规模化培育,水温过低时轮虫繁殖率较低,水温过高时需要添加供热系统加温,均无法满足实际生产需要。因此,本试验中设置了两个盐度组(盐度6和盐度23),每组盐度各设置6个温度(18、20、22、24、26、28 ℃),共计12个试验组。按照试验组个数取12个24孔板进行试验,每板设有12个平行样本(12孔),每孔吸入培养液1.5 mL,然后放入一个轮虫幼虫,每间隔6 h在光学显微镜下观察轮虫的抱卵及孵化数量,记录轮虫的产幼数、带卵数及存活的母体数,并在每次观察计数后及时移出所产幼虫,每天更换培养液一次并投喂小球藻饵料,使培养液中的小球藻密度维持在1×106 cells/mL,直至所有母体全部死亡时试验结束。
1.2.3 生活史参数计算方法 根据动态生命表试验数据计算轮虫主要生活史参数[11]。
特定年龄存活率(lx,%):x年龄组开始时存活个体的百分比。
特定年龄繁殖率(mx):x年龄组平均每个个体所产雌性后代数,即mx=后代数/母体数。
平均寿命(h):所有个体平均存活时长的观察平均值。
产卵量(ind.):所有个体产卵总数的观察平均值。
生命期望(e0,h):每个个体出生后存活时长的估计值。
净生殖率(R0,ind.):种群经过一个世代后的净增长率,即R0=∑lxmx,其中,lx为特定年龄存活率,mx为特定年龄繁殖率。
世代时间(T,h):完成一个世代所需要的时间,即T=∑lxmxx/R0,其中,x为试验时间(h),R0为净生殖率。
种群内禀增长率(rm,ind./h):种群在特定试验条件下的最大增长率。在rm=lnR0/T粗略计算的基础上,再根据方程![]() 用Excel软件求得种群内禀增长率的精确值。
用Excel软件求得种群内禀增长率的精确值。
1.3 数据处理
试验数据采用平均值±标准差(mean±S.D.)表示,采用单因素方差分析法(one-way ANOVA)分析温度对各生命表参数的影响, 对样本平均数间的差异显著性进行LSD多重比较,显著性水平均设为0.05,回归方程显著性水平设为0.01。所有的数据统计处理和分析均在SPSS 22软件中进行。
2 结果与分析
2.1 褶皱臂尾轮虫的存活率与繁殖率
从图1可见:盐度6组,156 h内各温度下轮虫的存活率均为100%,但不同温度下轮虫存活率保持100%的时间不同;总体上随温度的升高,其100%存活率的时间延长,18、20、22、24、26、28 ℃下,轮虫的存活率分别在150、156、138、180、186、174 h时开始下降,并依次在186、192、186、216、222、216 h时降为0;温度对轮虫的繁殖率也产生一定的影响,盐度6组轮虫的初次繁殖高峰期均自24 h开始出现,26、28 ℃时轮虫繁殖率的峰值明显高于其他温度组;轮虫的繁殖时间也随温度上升整体呈现增加的趋势,26 ℃时繁殖时间最长,达到180 h,但当温度升高至28 ℃时,轮虫的繁殖时间开始缩短。
从图2可见:盐度23组,150 h内各温度条件下轮虫的存活率均为100%,而不同温度条件下轮虫存活率保持100%的时间也不同;总体上随温度的升高,其100%存活率的时间延长,18、20、22、24、26、28 ℃下,轮虫的存活率分别从144、162、150、168、186、186 h时开始下降,并依次在198、198、204、210、216、222 h时降为0;轮虫的繁殖率峰值基本出现在72~120 h,仅在26 ℃时峰值出现的时间较早,且在28 ℃时繁殖率最高;温度的升高总体延长了轮虫的繁殖时间,28 ℃时轮虫繁殖时间最长,为204 h。
从图1和图2 的比较可以看出:随温度升高,两个盐度组轮虫的存活率均出现了初始死亡时间延后的现象,但盐度6组轮虫的100%存活率时间相对较短,同时,两个盐度组轮虫的生存时间均随温度升高出现一定程度的延长;两个盐度组轮虫的繁殖率均随时间的延长呈现出先上升后下降的趋势,与盐度23组相比,盐度6组轮虫繁殖率的峰值受温度影响较为明显,26、28 ℃的繁殖率峰值明显高于其他较低温度,而盐度23组轮虫繁殖率峰值大小的变化受温度影响相对较小。
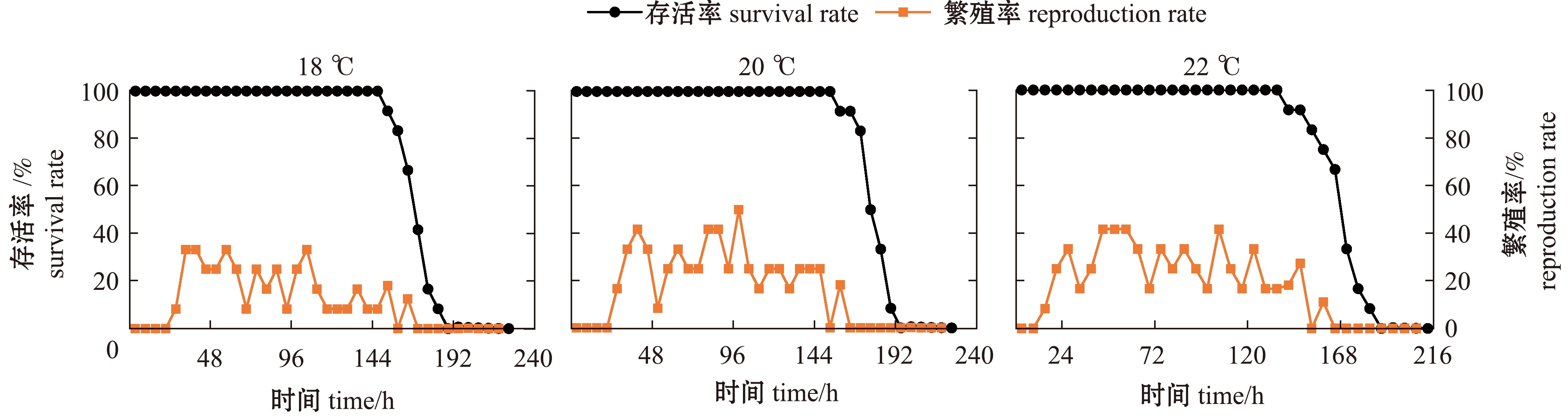

图1 盐度6条件下褶皱臂尾轮虫的存活率和繁殖率
Fig.1 Survival and reproduction rate of the rotifer Brachionus plicatilis at salinity of 6
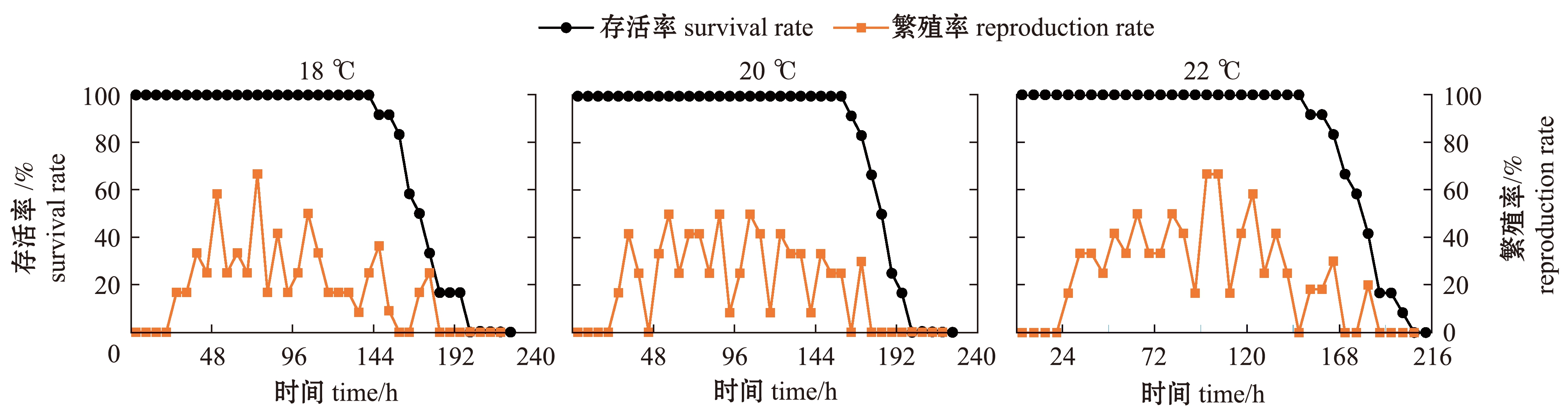

图2 盐度23条件下褶皱臂尾轮虫的存活率和繁殖率
Fig.2 Survival and reproduction rate of the rotifer Brachionus plicatilis at salinity of 23
2.2 褶皱臂尾轮虫的主要生命参数
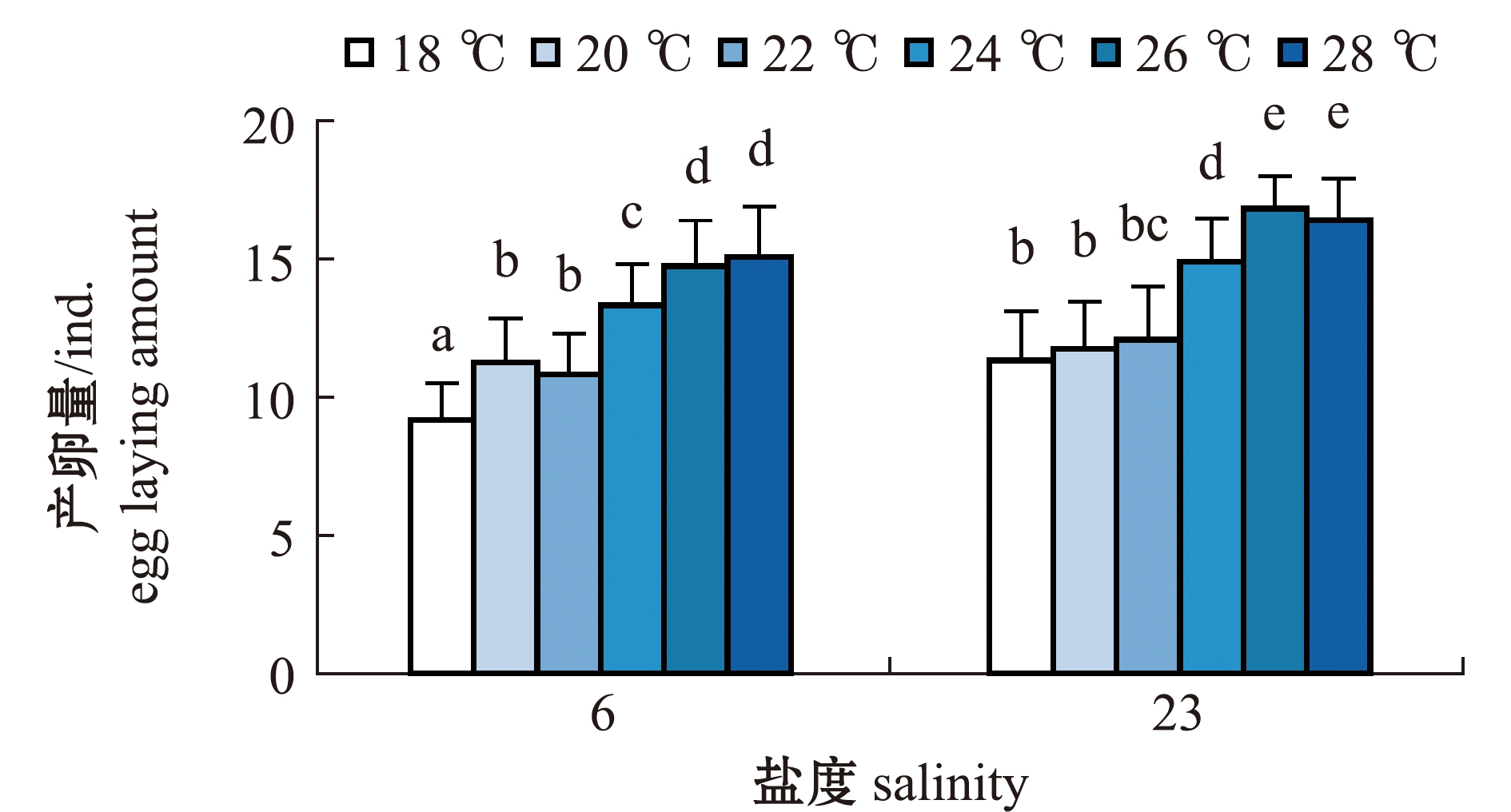
2.2.1 轮虫的产卵量 从图3可见:两个盐度组每只轮虫的产卵量基本上均随温度的上升而增大;盐度6组轮虫在18 ℃时产卵量最低,每只轮虫的平均产卵量为(9.17±1.34)ind.,在28 ℃时产卵量最高,每只轮虫的平均产卵量为(15.08±1.83)ind.,且与26 ℃时无显著性差异(P>0.05),但这两个温度组轮虫的产卵量显著高于其他温度组(P<0.05);盐度23组轮虫也在18 ℃时产卵量最低,每只轮虫的平均产卵量为(11.33±1.78)ind.,在26 ℃时产卵量最高,每只轮虫的平均产卵量为(16.83±1.19)ind.,且与28 ℃时无显著性差异(P>0.05),但这两个温度组轮虫的产卵量显著高于其他温度组(P<0.05)。
相同温度下,两个盐度组轮虫的产卵量比较显示,盐度6组轮虫在20、22 ℃时的产卵量与盐度23组轮虫在18、20、22 ℃时的产卵量无显著性差异(P>0.05),盐度6组轮虫在26、28 ℃时的产卵量显著低于盐度23组(P<0.05)。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图3 两个盐度组褶皱臂尾轮虫在不同温度下产卵量的变化
Fig.3 Changes in the amount of eggs laid by the rotifer Brachionus plicatilis in 2 salinity groups at different temperatures
2.2.2 轮虫的生命期望 从图4可见:两个盐度组轮虫的生命期望随温度的增加均呈先升高后降低的趋势;盐度6组轮虫在18、20、22 ℃时的生命期望较小,在26 ℃时生命期望最大,为(205.00±4.58)h,且与其他温度组有显著性差异(P<0.05);盐度23组轮虫在18 ℃时的生命期望最小,为(168.5±6.06)h,在26 ℃时生命期望最大,为(199.50±3.97)h,且与28 ℃时无显著性差异(P>0.05),但这两个温度组的轮虫生命期望显著大于其他温度组(P<0.05)。
相同温度下,两个盐度组轮虫的生命期望比较显示,盐度6组轮虫在26 ℃时的生命期望在所有试验组中最大,但与盐度23组轮虫在26、28 ℃时的生命期望均无显著性差异(P>0.05)。

图4 两个盐度组褶皱臂尾轮虫在不同温度下生命期望的变化
Fig.4 Changes in life expectancy of the rotifer Brachionus plicatilis in 2 salinity groups at different temperatures
2.2.3 轮虫的平均寿命 从图5可见:两个盐度组轮虫的平均寿命在18、20、22 ℃ 时均较短;盐度6组轮虫的平均寿命在24 ℃时出现明显增长,并在26 ℃时达到峰值(208.00 h±10.34 h),随后在28 ℃时出现下降,且26 ℃时轮虫的平均寿命均显著长于其他温度组(P<0.05);盐度23组轮虫的平均寿命总体随温度的上升而增加,在26 ℃时轮虫平均寿命最长,为(202.50±7.73)h,且与28 ℃时无显著性差异(P>0.05)。
相同温度下,两个盐度组轮虫的平均寿命比较显示,在每个相同温度下,两个盐度组轮虫的平均寿命总体上无显著性差异(P>0.05),在所有试验组中平均寿命最长的为26 ℃时盐度6组。

图5 两个盐度组褶皱臂尾轮虫在不同温度下平均寿命的变化
Fig.5 Changes in the average lifespan of the rotifer Brachionus plicatilis in 2 salinity groups at different temperatures
2.2.4 轮虫的净生殖率 从图6可见:两个盐度组轮虫的净生殖率随温度升高均呈增大的趋势;盐度6组轮虫的净生殖率在18 ℃时最小,为(4.25±0.97)ind.,显著小于其他温度组(P<0.05),在28 ℃时轮虫的净生殖率最大,为(10.58±1.44)ind.,且与26 ℃时无显著性差异(P>0.05),但这两个温度组均显著大于其他温度组(P<0.05);盐度23组轮虫的净生殖率也在18 ℃时最小,为(6.00±1.76)ind.,在28 ℃时净生殖率最大,为(12.83±1.40)ind.,且与26 ℃时无显著性差异(P>0.05),但这两个温度组轮虫的净生殖率显著大于其他温度组(P<0.05)。
相同温度下,两个盐度组轮虫的净生殖率比较显示,除20 ℃时两个盐度组轮虫净生殖率无显著性差异外(P>0.05),其余相同温度下,盐度6组轮虫的净生殖率均显著小于盐度23组(P<0.05)。
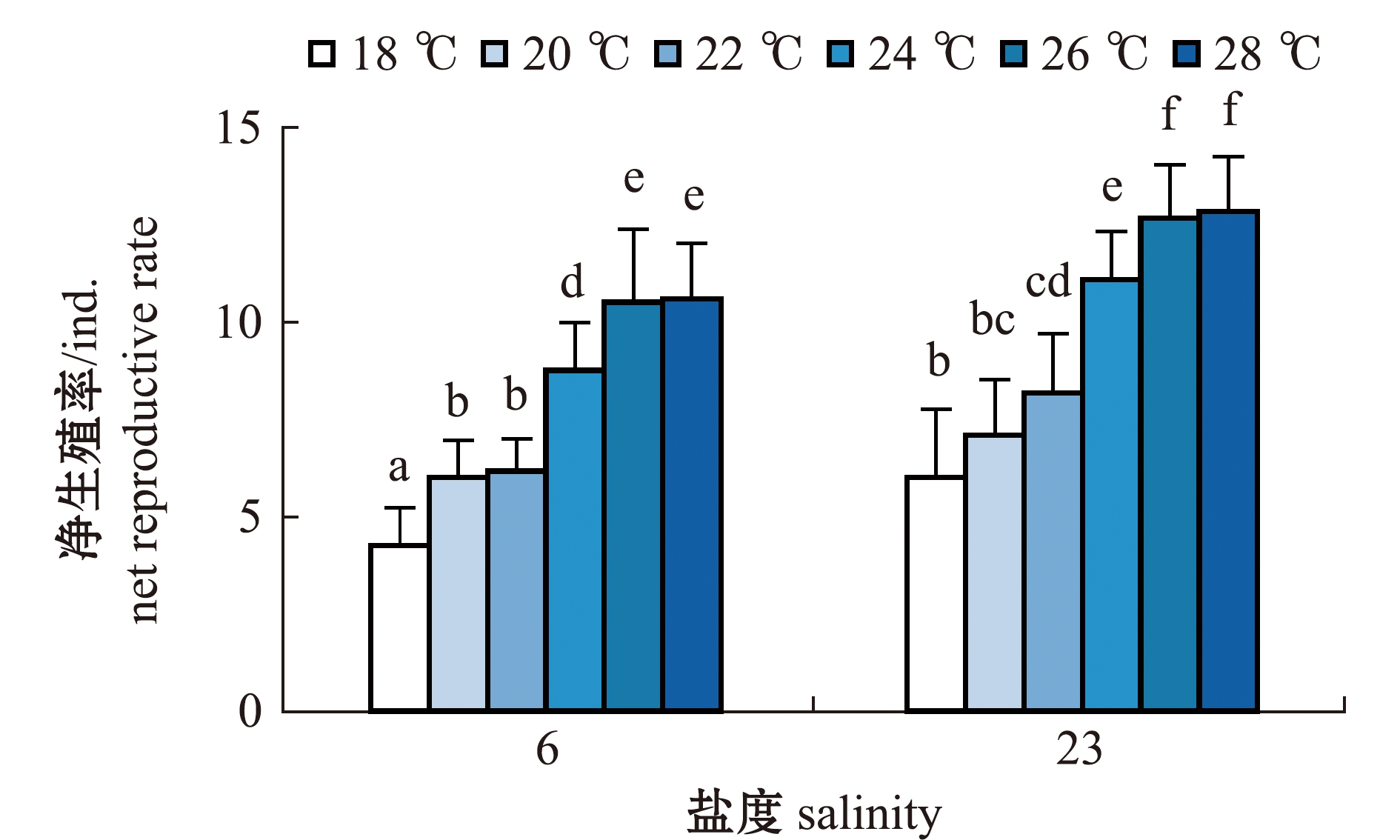
图6 两个盐度组褶皱臂尾轮虫在不同温度下净生殖率的变化
Fig.6 Changes in net reproductive rate of the rotifer Brachionus plicatilis in 2 salinity groups at different temperatures
2.2.5 轮虫的世代时间 从图7可见:两个盐度组轮虫的世代时间总体上随温度的升高呈增大趋势;盐度6组轮虫的世代时间在18 ℃时最短,为(84.64±6.33)h,在26 ℃时最长,为(103.67±5.77)h,但与24、28 ℃时无显著性差异(P>0.05);盐度23组轮虫的世代时间在18 ℃时最短,为(88.64±11.92)h,在26 ℃时最长,为(103.73±5.72)h,整体变化趋势较为平缓。
相同温度下,两个盐度组轮虫的世代时间比较显示,除了20 ℃时盐度23组轮虫的世代时间显著长于盐度6组(P<0.05)外,其余温度下,盐度23组轮虫的世代时间与盐度6组均无显著性差异(P>0.05)。
2.2.6 轮虫的种群内禀增长率 从图8可见:两个盐度组轮虫的种群内禀增长率基本上均随温度的升高而增大;盐度6组轮虫的内禀增长率在18 ℃时最低,为(0.019 6±0.004 2)ind./h,在28 ℃时最高,为(0.029 2±0.001 8)ind./h,且与24、26 ℃时无显著性差异(P>0.05);盐度23组轮虫的内禀增长率在18 ℃时也最低,为(0.022 5±0.004 4)ind./h,在26、28 ℃时较高,分别为(0.032 9±0.003 4)、(0.032 5±0.002)ind./h。
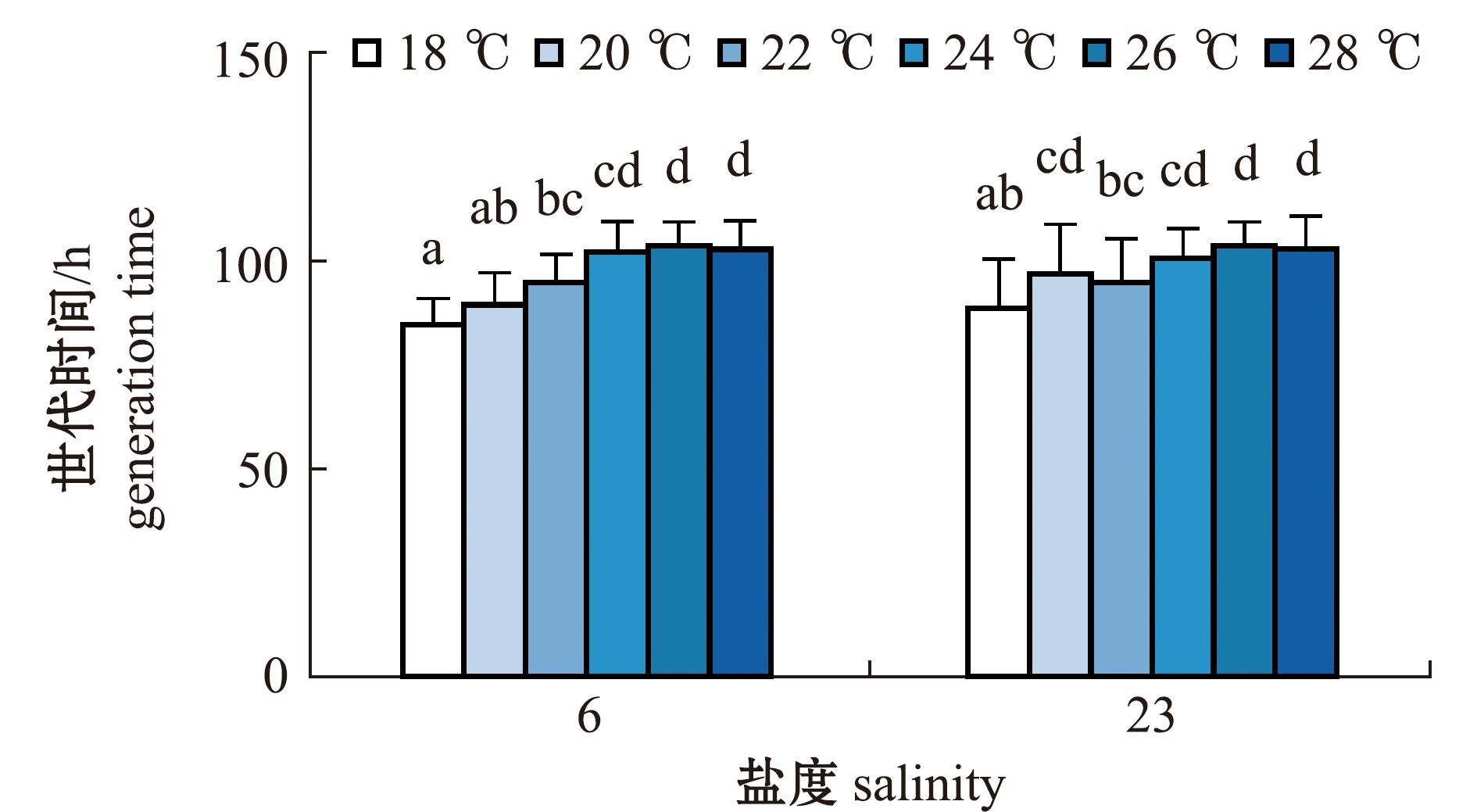
图7 两个盐度组褶皱臂尾轮虫在不同温度下世代时间的变化
Fig.7 Changes in generation time of the rotifer Brachionus plicatilis in 2 salinity groups at different temperatures
相同温度下,两个盐度组轮虫的种群内禀增长率比较显示,在22、24、26、28 ℃时,盐度6组轮虫的内禀增长率均显著低于盐度23组(P<0.05)。
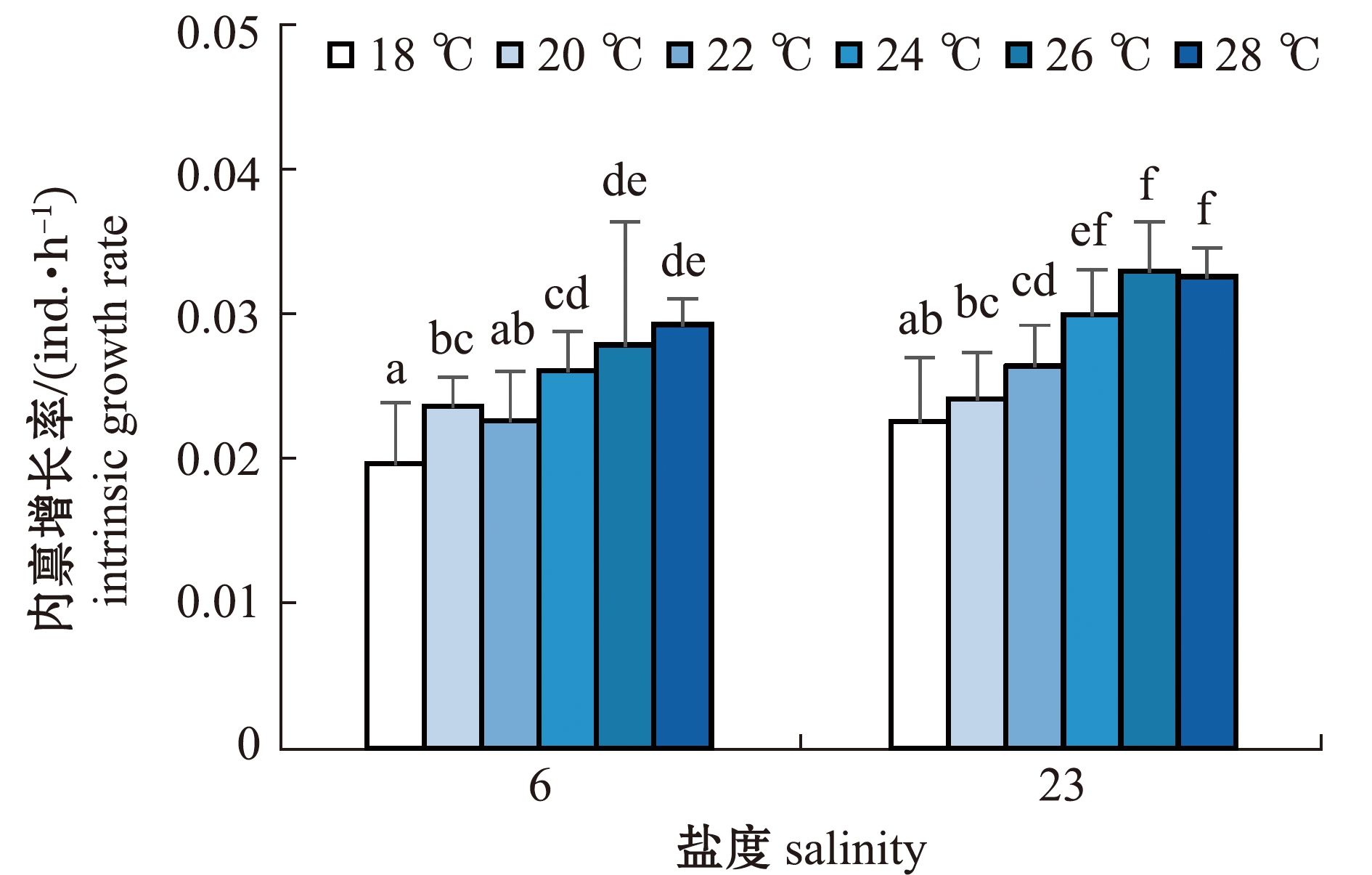
图8 两个盐度组褶皱臂尾轮虫在不同温度下种群内禀增长率的变化
Fig.8 Changes in the intrinsic growth rate of the rotifer Brachionus plicatilis in 2 salinity groups at different temperatures
2.3 主要生命参数与温度的回归曲线
回归分析显示, 在本试验中设置的温度范围内,两个盐度组褶皱臂尾轮虫的生命期望、净生殖率、世代时间、种群内禀增长率和平均寿命均与温度(t)间呈显著相关(表1)。
表1 两个盐度组褶皱臂尾轮虫在不同温度下主要生命参数的回归方程
Tab.1 Regression equations of main life parameters of the rotifer Brachionus plicatilis in 2 salinity groups at different temperatures
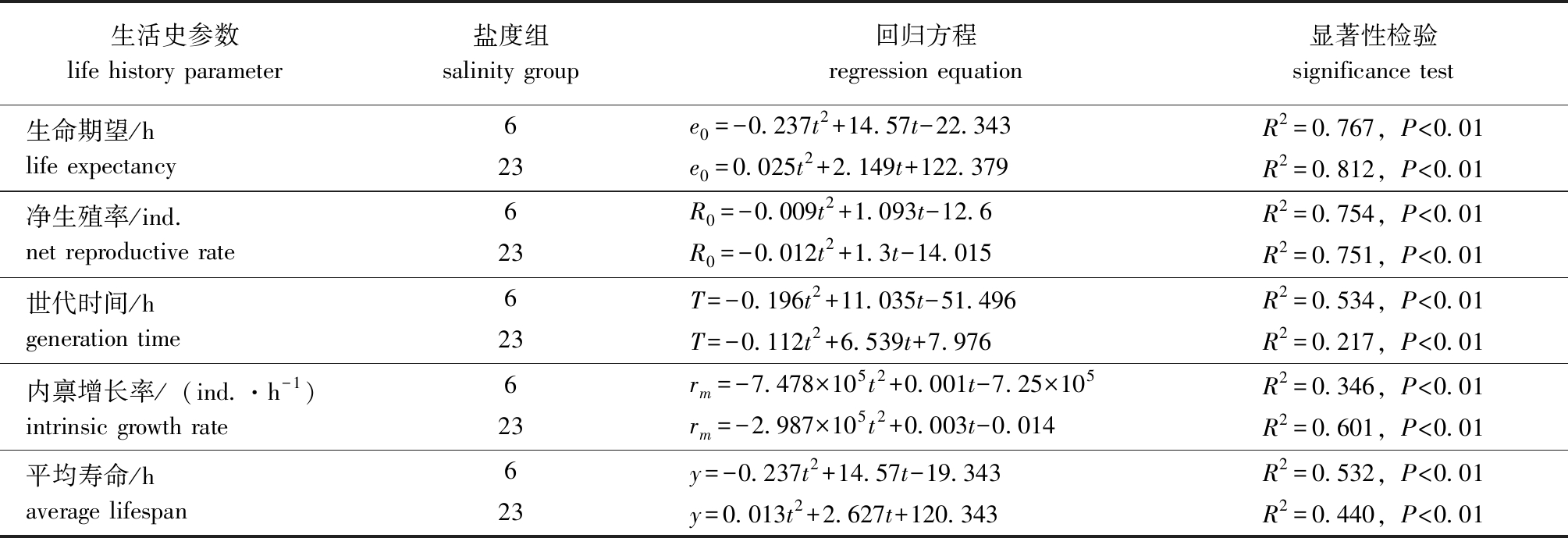
生活史参数life history parameter盐度组salinity group回归方程regression equation显著性检验significance test生命期望/hlife expectancy6e0=-0.237t2+14.57t-22.343R2=0.767,P<0.0123e0=0.025t2+2.149t+122.379R2=0.812,P<0.01净生殖率/ind.net reproductive rate6R0=-0.009t2+1.093t-12.6R2=0.754,P<0.0123R0=-0.012t2+1.3t-14.015R2=0.751,P<0.01世代时间/hgeneration time6T=-0.196t2+11.035t-51.496R2=0.534,P<0.0123T=-0.112t2+6.539t+7.976R2=0.217,P<0.01内禀增长率/(ind.·h-1)intrinsic growth rate6rm=-7.478×105t2+0.001t-7.25×105R2=0.346,P<0.0123rm=-2.987×105t2+0.003t-0.014R2=0.601,P<0.01平均寿命/haverage lifespan6y=-0.237t2+14.57t-19.343R2=0.532,P<0.0123y=0.013t2+2.627t+120.343R2=0.440,P<0.01
3 讨论
3.1 温度和盐度对褶皱臂尾轮虫存活的影响
温度变化会影响水生无脊椎动物的基础代谢率与能量平衡,从而改变其存活状态[12]。而平均寿命、世代时间和生命期望可以体现轮虫的存活情况。已有研究发现,朝鲜臂尾轮虫B.koreanus[13]、褶皱臂尾轮虫[14]和萼花臂尾轮虫[15]的平均寿命均随温度的升高而降低;两种形态的裂足臂尾轮虫B.diversicornis[16]和方形臂尾轮虫B.quadridenta- tus[17]的世代时间在一定温度范围内随温度升高而减小;萼花臂尾轮虫[18]、镰形臂尾轮虫B.forcatu和尾突臂尾轮虫B.caudatus[19]的生命期望也在一定温度范围内随温度上升而减少。以上研究报道均表明,随着温度的升高,轮虫的世代时间、平均寿命和生命期望皆下降,而本研究结果则与之相反,两个盐度组褶皱臂尾轮虫的世代时间、生命期望和平均寿命在18~26 ℃时均随温度升高呈总体上升趋势。出现这种差异的原因可能是前者温度较低延长了轮虫幼年期,导致更多物质被分配给生长阶段,高温下代谢活动速率高,导致轮虫寿命缩短[14],从而进一步影响世代时间和生命期望。而本试验中的相关工作在青海省西宁市完成,高原低气压条件对轮虫生理的影响可能是造成这种截然不同结果的主要原因之一,但更深层次原因尚需进一步研究。
褶皱臂尾轮虫对盐度变化适应能力强,具有广盐性的特点[20]。本试验中,在盐度23和盐度6组褶皱臂尾轮虫的平均寿命均在150 h以上。而根据徐海龙等[7]的研究,褶皱臂尾轮虫由盐度32突降至盐度5以下(含盐度5)时,轮虫在12 h内全部死亡。造成以上差异的原因可能是后者盐度突变后轮虫没有充足的适应时间,从而导致轮虫死亡较快。而本试验中轮虫经过了一年多逐级降低盐度的驯化培养过程,轮虫有较久的适应时间,因此,寿命较长。已有研究认为,在盐度5和盐度25条件下的两组褶皱臂尾轮虫的世代时间、平均寿命及生命期望均无显著性差异[16];一种海水疣毛轮虫Synchaeta littoralis在盐度25和盐度30条件下的世代时间也不具显著性差异[21]。本研究结果与上述研究报道基本一致。由此可见,褶皱臂尾轮虫经过长期低盐(盐度6)驯化,可以与盐度23条件下的轮虫具有相似的存活状态,能够适应低盐环境存活。
3.2 温度和盐度对褶皱臂尾轮虫生殖的影响
产卵量和净生殖率是两个紧密相关的重要参数,其值的大小直接反映轮虫生殖活动的状态。席贻龙等[22]认为,25 ℃时壶状臂尾轮虫B.urcealaris的产卵量比15 ℃时增加了37.96%。孙迪杰等[5]研究发现,褶皱臂尾轮虫在16~31 ℃时温度与繁殖能力呈正相关,31 ℃时轮虫产卵量比16 ℃时高3倍。本研究结果也表明,两个盐度组(盐度6和23)褶皱臂尾轮虫的产卵量总体均随温度升高而增加。由此可见,较高温度时轮虫能量摄入更高,足以满足代谢活动和繁殖的需要[14]。一定范围内的温度升高也能促进轮虫净生殖率增加。鲍蕾等[17]报道,方形臂尾轮虫在30 ℃时的净生殖率比20 ℃时增加了146.72%。Zhang等[15]发现,以小球藻为食的萼花臂尾轮虫在25 ℃时净生殖率高于15 ℃。Li等[23]研究表明,大肚须足轮虫Euchlanis dilatata的净生殖率在14、20、26 ℃时逐级递增。上述相关研究结果与本研究中盐度6和盐度23条件下的褶皱臂尾轮虫净生殖率在18~28 ℃时均呈上升趋势的结果一致。
盐度对轮虫生殖(净生殖率)影响同样显著。Yin等[24]发现,褶皱臂尾轮虫的净生殖率受到盐度变化的显著影响。Nandini等[25]认为,褶皱臂尾轮虫的净生殖率在盐度5~25时随盐度升高逐渐降低。这是因为褶皱臂尾轮虫是从墨西哥Pátzcuaro湖里分离的淡水种类,轮虫在低盐度下用于调节渗透压的能量少于高盐度,有更多的能量用于生殖,所以会出现低盐度下的生殖率相对较高的现象[26]。然而,本研究中除20 ℃组外,其余温度下,盐度23组褶皱臂尾轮虫的净生殖率均显著高于盐度6组。出现这种截然相反趋势的原因,可能是本试验中的褶皱臂尾轮虫是由高盐度(盐度23)驯化到低盐度(盐度6)的,在高盐度时轮虫用于调节渗透压的能量少于低盐度,所以在高盐度下轮虫有更多的能量用于生殖,使其生殖率相对较高。因此,当盐度超出轮虫长期生长繁殖的盐度范围越大,轮虫生理活动受到的影响就会越大,盐度适应过程中消耗了用于生殖的能量,进而影响轮虫的生殖[21]。
3.3 温度和盐度对褶皱臂尾轮虫种群增长的影响
内禀增长率能展示轮虫在理想环境中的最大种群增长率,体现轮虫种群增长潜能和扩繁能力,其综合了轮虫特定年龄存活率与繁殖率、首次生殖年龄和生殖间隔等[27],是反映轮虫种群增长的重要指标。本研究结果显示,盐度23和盐度6条件下,褶皱臂尾轮虫的种群内禀增长率均随温度的升高而增大。大量研究也表明,一定温度范围内轮虫的内禀增长率随温度升高而增加,但轮虫的种群内禀增长率所需的最适温度因轮虫种类不同而异[23,28-30],即使同一种类不同品系轮虫种群的内禀增长率受温度变化的影响差异也会较大[31]。
盐度对轮虫种群增长的影响也十分显著。Moha-león等[32]发现,褶皱臂尾轮虫在盐度7.5~30.0时内禀增长率随盐度升高而逐渐减小,盐度30时轮虫相较于盐度7.5时内禀增长率减少了18.8%。Bosque等[21]研究表明,原生存盐度22条件下的海水疣毛轮虫在盐度突增至25、30和35时,轮虫的内种群内禀增长率随盐度的升高而降低,死亡率上升。由此可见,大幅度盐度突变可以抑制轮虫的种群增长。也有研究认为,褶皱臂尾轮虫在盐度骤降至低盐(盐度5)时的种群内禀增长率普遍较低,低盐度种群增长受抑制,与高盐度组轮虫(盐度30)差异十分明显[33]。本研究中,虽然盐度23时褶皱臂尾轮虫的种群内禀增长率高于盐度6时,但在18 ℃和20 ℃时两个盐度组轮虫的内禀增长率差异并不显著。由此可见,褶皱臂尾轮虫在盐度骤降情况下出现应激反应,还未完全具备低盐耐受性,故内禀增长率较低,当他们经过长期逐步降低盐度的驯化过程后,其低盐耐受性更为良好,能较好地适应其所处盐度环境,表现出较高的内禀增长率。因此,长期低盐驯化褶皱臂尾轮虫实现规模化培养是可行的。
4 结论
1)盐度6和盐度23条件下培养的褶皱臂尾轮虫,其产卵量、净生殖率和内禀增长率总体上均随温度上升而增大,这表明,在18~28 ℃范围内,温度上升利于轮虫增殖,26~28 ℃是轮虫生长的适宜温度环境。
2)与盐度23条件下培养的轮虫相比,在24、26 ℃时,盐度6条件下的轮虫生命期望、平均寿命相对更高,世代时间接近;盐度6组轮虫的平均寿命和生命期望均在26 ℃时最高,且最大值均高于盐度23组。这表明,相较于盐度23组的轮虫,盐度6组轮虫的生存能力更强。
3)将低盐(盐度6)驯化的褶皱臂尾轮虫培养温度控制在26~28 ℃,能够实现人工低盐驯化的褶皱臂尾轮虫规模化培育的目标。目前,低盐驯化的褶皱臂尾轮虫已作为开口饵料用于青海湖裸鲤的扩繁工作中,该轮虫有望成为多种淡水鱼类仔稚鱼的优质开口饵料。
[1] LUBZENS E,ZMORA O,BARR Y.Biotechnology and aquaculture of rotifers[J].Hydrobiologia,2001,446/447:337-353.
[2] 成永旭.生物饵料培养学[M].2版.北京:中国农业出版社,2005.
CHENG Y X.Biological bait culture[M].2 edition.Beijing:China Agriculture Press,2005.(in Chinese)
[3] LUBZENS E.Raising rotifers for use in aquaculture[M]//Rotifer Symposium IV.Dordrecht:Springer Netherlands,1987:245-255.
[4] MIRACLE M R,SERRA M.Salinity and temperature influence in rotifer life history characteristics[J].Hydrobiologia,1989,186/187(1):81-102.
[5] 孙迪杰,刘娟然.温度对褶皱臂尾轮虫寿命和繁殖的影响[J].水产科学,1993,12(6):14-17.
SUN D J,LIU J R.Effects of temperature on the lifespan and reproduction of Brachiocephalus folds[J].Fisheries Science,1993,12(6):14-17.(in Chinese)
[6] 董婧,于业辉,赵莹莹,等.温度和食物对褶皱臂尾轮虫种群增长及繁殖的影响[J].现代畜牧兽医,2014(4):35-39.
DONG J,YU Y H,ZHAO Y Y,et al.Effects of temperature and food on population growth and reproduction of rotifer,Brachionus plicatilis[J].Modern Journal of Animal Husbandry and Veterinary Medicine,2014(4):35-39.(in Chinese)
[7] 徐海龙,马志华,郭立,等.光照、pH及盐度对褶皱臂尾轮虫培养效果的影响[J].水产科学,2013,32(2):85-88.
XU H L,MA Z H,GUO L,et al.Effects of light,pH and salinity on growth in rotifer Brachionus plicatilis[J].Fisheries Science,2013,32(2):85-88.(in Chinese)
[8] 陈云波,禹爱民.盐度对褶皱臂尾轮虫存活及其休眠卵孵化的影响[J].水产科学,1997,16(5):12-16.
CHEN Y B,YU A M.The effects of salinity on survival and hatching of resting eggs of the rotifer (Brachinonus plicatilis)[J].Fisheries Science,1997,16(5):12-16.(in Chinese)
[9] 王珊,赵文,焉鸿启.温度和盐度对褶皱臂尾轮虫复合类群休眠卵体积的影响[J].大连海洋大学学报,2012,27(3):236-239.
WANG S,ZHAO W,YAN H Q.The effect of temperature and salinity on volume of rotifer Brachionus plicatilis complex resting eggs[J].Journal of Dalian Ocean University,2012,27(3):236-239.(in Chinese)
[10] FIELDER D S,PURSER G J,BATTAGLENE S C.Effect of rapid changes in temperature and salinity on availability of the rotifers Brachionus rotundiformis and Brachionus plicatilis[J].Aquaculture,2000,189(1/2):85-99.
[11] LIANG Y,OUYANG K,CHEN X L,et al.Life strategy and grazing intensity responses of Brachionus calyciflorus fed on different concentrations of microcystin-producing and microcystin-free Microcystis aeruginosa[J].Scientific Reports,2017,7:43127.
[12] SWEENEY B W.Factors influencing life history patterns of aquatic insects[J].Ecology of Aquatic Insects,1984(1):56-100.
[13] LEE M C,YOON D S,LEE Y,et al.Effects of low temperature on longevity and lipid metabolism in the marine rotifer Brachionus koreanus[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2020,250:110803.
[14] YONA G.Effect of culture temperature on rotifers (Brachionus plicatilis sensu strictu) size and reproduction activities[J].Tanzania Journal of Agricultural Sciences,2018,17 (1):23-30.
[15] ZHANG X,GENG H.Effect of Microcystis aeruginosa on the rotifer Brachionus calyciflorus at different temperatures[J].Bulletin of Environmental Contamination and Toxicology,2012,88(1):20-24.
[16] 马杰,席贻龙,许丹丹,等.温度和食物密度对两种形态型裂足臂尾轮虫(Brachionus diversicornis)生活史特征和后代形态型的影响[J].湖泊科学,2011,23(4):597-604.
MA J,XI Y L,XU D D,et al.Effects of temperature and algal density on life history characteristics and morphotype in offspring of two Brachionus diversicornis morphotypes[J].Journal of Lake Sciences,2011,23(4):597-604.(in Chinese)
[17] 鲍蕾,马蕊,牛翠娟,等.温度对方形臂尾轮虫(Brachionus quadridentatus)种群增长与生活史参数的影响[J].北京师范大学学报(自然科学版),2006,42(5):518-521.
BAO L,MA R,NIU C J,et al.Effects of temperature on life history and population growth of the rotifer Brachionus quadridentatus[J].Journal of Beijing Normal University (Natural Science Edition),2006,42(5):518-521.(in Chinese)
[18] 王爱民,席贻龙,牛翔翔,等.汀棠湖冬季出现的萼花臂尾轮虫对水温的适应[J].生态学报,2014,34(16):4588-4595.
WANG A M,XI Y L,NIU X X,et al.Adaptation of Brachionus calyciflorus (Rotifera) occurred in winter in Lake Tingtang to water temperature:a life table demography study[J].Acta Ecologica Sinica,2014,34(16):4588-4595.(in Chinese)
[19] 陶李祥,席贻龙,胡存兵.镰形臂尾轮虫和尾突臂尾轮虫的生活史特征比较[J].应用生态学报,2008,19(5):1104-1109.
TAO L X,XI Y L,HU C B.Characteristics in life history of Brachionus forcatus and B.caudatus:a comparative study[J].Chinese Journal of Applied Ecology,2008,19(5):1104-1109.(in Chinese)
[20] 邹京京,赵文.褶皱臂尾轮虫抗逆性作用机制研究进展[J].大连海洋大学学报,2020,35(5):768-774.
ZOU J J,ZHAO W.Mechanism of stress resistance of rotifer Brachionus plicatilis:a review[J].Journal of Dalian Ocean University,2020,35(5):768-774.(in Chinese)
[21] BOSQUE T,HERN NDEZ R,P
NDEZ R,P REZ R,et al.Effects of salinity,temperature and food level on the demographic characteristics of the seawater rotifer Synchaeta littoralis Rousselet[J].Journal of Experimental Marine Biology and Ecology,2001,258(1):55-64.
REZ R,et al.Effects of salinity,temperature and food level on the demographic characteristics of the seawater rotifer Synchaeta littoralis Rousselet[J].Journal of Experimental Marine Biology and Ecology,2001,258(1):55-64.
[22] 席贻龙,黄祥飞.温度对壶状臂尾轮虫实验种群动态的影响[J].海洋与湖沼,2000,31(1):23-28.
XI Y L,HUANG X F.Effect of temperature on the experimental population dynamics of Brachionus urceolaris[J].Oceanologia et Limnologia Sinica,2000,31(1):23-28.(in Chinese)
[23] LI W J,LIAN B X,NIU C J.Effects of temperature on life history strategy of the rotifer Euchlanis dilatata[J].Zoological Science,2019,36(1):52-57.
[24] YIN X W,ZHAO W.Studies on life history characteristics of Brachionus plicatilis O.F.Müller (Rotifera) in relation to temperature,salinity and food algae[J].Aquatic Ecology,2008,42(1):165-176.
[25] NANDINI S,PE A-AGUADO F,ARREGUIN REBOLLEDO U,et al.Molecular identity and demographic responses to salinity of a freshwater strain of Brachionus plicatilis from the shallow Lake Pátzcuaro,Mexico[J].Fundamental and Applied Limnology,2019,192(4):319-329.
A-AGUADO F,ARREGUIN REBOLLEDO U,et al.Molecular identity and demographic responses to salinity of a freshwater strain of Brachionus plicatilis from the shallow Lake Pátzcuaro,Mexico[J].Fundamental and Applied Limnology,2019,192(4):319-329.
[26] 赵文,殷旭旺,王珊.盐水轮虫的生物学及海水培养利用[M].北京:科学出版社,2015.
ZHAO W,YIN X W,WANG S.Biology and technology of culture and utilization in marine water for rotifer in inland saline waters[M].Beijing:Science Press,2015.(in Chinese)
[27] 宁乐锋,席贻龙,孙强,等.温度和食物密度对裂足臂尾轮虫(Brachionus diversicornis)生命表统计学参数的影响[J].湖泊科学,2013,25(2):295-301.
NING L F,XI Y L,SUN Q,et al.Combined effects of temperature and algal food density on life table demography of Brachionus diversicornis (Rotifera)[J].Journal of Lake Sciences,2013,25(2):295-301.(in Chinese)
[28] 董丽丽,谢力慧.不同温度下新安江水域(屯溪段)轮虫种群动态研究[J].生态科学,2012,31(2):187-191.
DONG L L,XIE L H.Population dynamics of Brachionus calyciflorus (Rotifera) from Tunxi section of Xin’an River under different temperatures[J].Ecological Science,2012,31(2):187-191.(in Chinese)
[29] 姚慧,张欢,王松波,等.温度和铜绿微囊藻毒性对萼花臂尾轮虫生活史参数的影响[J].水生生物学报,2020,44(1):206-212.
YAO H,ZHANG H,WANG S B,et al.Effects of temperatures and Microcystis aeruginosa toxicity on life-table parameters of Brachionus calyciflorus[J].Acta Hydrobiologica Sinica,2020,44(1):206-212.(in Chinese)
[30] 胡存兵,席贻龙,陶李祥.红臂尾轮虫和壶状臂尾轮虫生活史特征比较[J].生态学报,2008,28(12):5957-5963.
HU C B,XI Y L,TAO L X.Comparative on the life history characteristics of Brachionus rubens and B.urceolaris[J].Acta Ecologica Sinica,2008,28(12):5957-5963.(in Chinese)
[31] PARASKEVOPOULOU S,DENNIS A B,WEITHOFF G,et al.Temperature-dependent life history and transcriptomic responses in heat-tolerant versus heat-sensitive Brachionus rotifers[J].Scientific Reports,2020,10(1):13281.
[32] MOHA-LE N J D,P
N J D,P REZ-LEGASPI I A,HERN
REZ-LEGASPI I A,HERN NDEZ-VERGARA M P,et al.Study of the effects of photoperiod and salinity in the Alvarado strain of the Brachionus plicatilis species complex (Rotifera:Monogononta)[J].Annales De Limnologie-International Journal of Limnology,2015,51(4):335-342.
NDEZ-VERGARA M P,et al.Study of the effects of photoperiod and salinity in the Alvarado strain of the Brachionus plicatilis species complex (Rotifera:Monogononta)[J].Annales De Limnologie-International Journal of Limnology,2015,51(4):335-342.
[33] MALEKZADEH VIAYEH R,MOHAMMADI H,SHAFIEI A B.Population growth of six Iranian Brachionus rotifer strains in response to salinity and food type[J].International Review of Hydrobiology,2010,95(6):461-470.