自2007年起,中国黄海海域浒苔绿潮连年大量暴发,江苏省如东海区鉴定出附着和漂浮的浒苔属优势种为浒苔Ulva prolifera、扁浒苔Ulva compressa、缘管浒苔Ulva linza和曲浒苔Ulva flexuosa[1-2]。其中,缘管浒苔作为绿潮暴发早期的重要物种,广泛分布于中国渤海、黄海和东海海域[3]。光合作用对藻类的生长和繁殖至关重要,其反应过程复杂[4],与温度、pH及营养盐等环境因素密切相关[5-6],其中,温度和光照是最主要的制约因素[7]。由于每种绿潮藻的最适温度和光照不同[8],黄海漂浮绿潮藻会随季节出现演替现象,优势种由扁浒苔、缘管浒苔和曲浒苔逐渐演变为浒苔[1-2]。
在不同温度下,藻类通过调整色素含量和光合色素/光保护色素的比例[9]等一系列机制来调整光合作用。汤文仲等[10]研究发现,缘管浒苔光合作用和生长的适宜温度为 15~25 ℃,当温度达到5、35 ℃时,缘管浒苔的光化学效率(Fv/Fm)最小。藻体对光照变化也有不同的响应,低光照下藻体光合作用变弱,净光合效率降低[11],而高光照时容易造成藻体光抑制[12],且随高光照处理时间延长,缘管浒苔的Fv/Fm值逐渐降低[13]。当缘管浒苔短期处于低光照下,其叶绿素含量显著高于高、中光照下的含量,但净光合作用速率在低光照下显著降低[14]。6、7月黄海地区雨天光照低于30 μmol/(m2·s),晴天时高于300 μmol/(m2·s),当光照度为18 μmol/(m2·s)时缘管浒苔的Fv/Fm值更小[10]。
应用组学技术研究藻体,可以了解浒苔属对环境的响应。Liu等[15]证明了浒苔的碳固定途径,除了典型的C3循环外,还涉及C4循环及CO2浓缩机制。许建方等[16]研究发现, 丙酮酸磷酸双激酶活性的升高会使C4代谢途径功能加强,提升了缘管浒苔耐受高盐度、低盐度胁迫的能力。Fan等[17]通过分析养分转运蛋白在不同温度和营养物浓度下的基因表达情况,对缘管浒苔的环境广适应性进行了解释。利用转录组学研究基因表达量随环境条件的改变,短期效应更明显。Guan等[18]通过强光和干旱的急性胁迫研究发现,缘管浒苔的光捕获复合体蛋白基因ElipL1、ElipL2、Cbrx和OHP具有一定的光保护作用,LHCSR、Elip-like1和Elip-like2等蛋白基因也参与缘管浒苔的光保护机制[19-20]。因此,研究缘管浒苔不同光照和温度作用下光合作用的基因表达情况,对于进一步了解光合作用机制具有重要意义。本研究中,利用转录组学测序技术,从光合作用的角度分析了缘管浒苔对环境光照和温度变化的短期响应,以期为分析绿潮藻演替机制提供科学参考。
1 材料与方法
1.1 材料
试验用缘管浒苔于2008 年7月采自山东青岛胶州湾海区。鉴种后, 在实验室内20 ℃、100 μmol/(m2·s)最适条件[1]下进行纯种传代培养, 光照周期(D∶L)为 12∶12,采用VSE培养液,每隔7 d更换一次培养液。在该条件下长期培养理论上不会对藻体的生理响应产生驯化。
1.2 方法
1.2.1 试验设计 试验设置30 ℃(高温)、20 ℃(最适温度,对照)和4 ℃(低温)3个温度组,在每个温度下设置400 μmol/(m2·s)(高光照)、100 μmol/(m2·s)(最适光照,对照)和20 μmol/(m2·s)(低光照)3个光照度(表1)。将藻体分为9组,每组设置3个生物学重复,每个重复组取10根同一批放散后生长的缘管浒苔藻体(长度为5 cm,鲜质量为0.02 g),光照周期不变,同时处理24 h。
表1 缘管浒苔温度、光照试验设计
Tab.1 Experimental design of effects of temperature and light intensity on green alga Ulva linza

温度/℃temperature光照度 light intensity/(μmol·m-2·s-1)4001002030Y1Y2Y320Y4Y5(control)Y64Y7Y8Y9
1.2.2 光合作用参数测定 采用PHYTO-PAM荧光分析仪(Walz,德国)测定叶绿素荧光参数。以最适温度和最适光照为对照组,每组设置3个平行试验,处理24 h后取样,暗适应20 min后测定光合诱导曲线,并记录最大光化学效率等参数。
1.2.3 总RNA提取及转录组测序 取不同光照和温度处理24 h后的藻体,经液氮处理后,于-80 ℃超低温冰箱中保存备用。采用生工生物工程(上海)股份有限公司的RNA提取试剂盒提取总RNA。采用紫外分光光度法检测其浓度和含量,采用琼脂糖凝胶电泳检测RNA的纯度和完整性。检测合格的藻体总RNA送至华大基因公司进行文库构建和测序。采用磁珠法富集样品mRNA,经反转录后合成双链cDNA,纯化后进行末端修复、接头连接,经过产物纯化和片段大小分选,最终PCR扩增获得文库,并在Illumina HiSeqTM 2000平台上完成RNA-Seq测序分析。
1.2.4 组装及功能注释 通过Trinity软件对筛选后的clean reads进行组装得到Unigene序列。随后将Unigene序列与外源蛋白数据库NR、GO、SwissProt、KEGG和InterPro进行Blastx比对(E-value<0.000 01),根据比对结果获得Unigene的蛋白功能注释信息。
1.2.5 生物信息学分析 采用FPKM法计算Unigene表达量。根据P<0.05且|log2(FoldChange)| ≥1筛选得到显著表达的Unigene。通过基因注释进一步筛选得到光合作用不同阶段起重要作用的Unigene基因,使用NCBI Blast+(http://bioinformatics. psb.ugent.be/blast/moderated/?project=orcae_Ulvmu)将每条基因与易变石莼Ulva mutabilis基因组进行比对[21],总体认为比对率为70%以上的基因与浒苔具有同源性。
1.3 数据处理
试验数据均以平均数±标准差(mean±S.D.)表示,采用SPSS 16.0软件进行单因素方差分析(one-way ANOVA)和Tukey多重比较,使用GraphPad Prism等软件绘制图表。显著性水平设为0.05。
2 结果与分析
2.1 藻体的光合特征
从图1可见:在不同光照下,缘管浒苔受低温(4 ℃)影响时,Fv/Fm值均显著降低(P<0.05);在最适温度(20 ℃)下,光照对藻体Fv/Fm的影响不显著(P>0.05),仅高光照下略有影响;在高温/低温与光照的协同作用下,高光照下藻体Fv/Fm值均显著低于低光照(P<0.05),且低温低光照下藻体Fv/Fm值显著高于单一低温。由此推测,温度和光照对缘管浒苔的交互作用影响大于单一因素,低光照缓解了低温对藻体的胁迫。
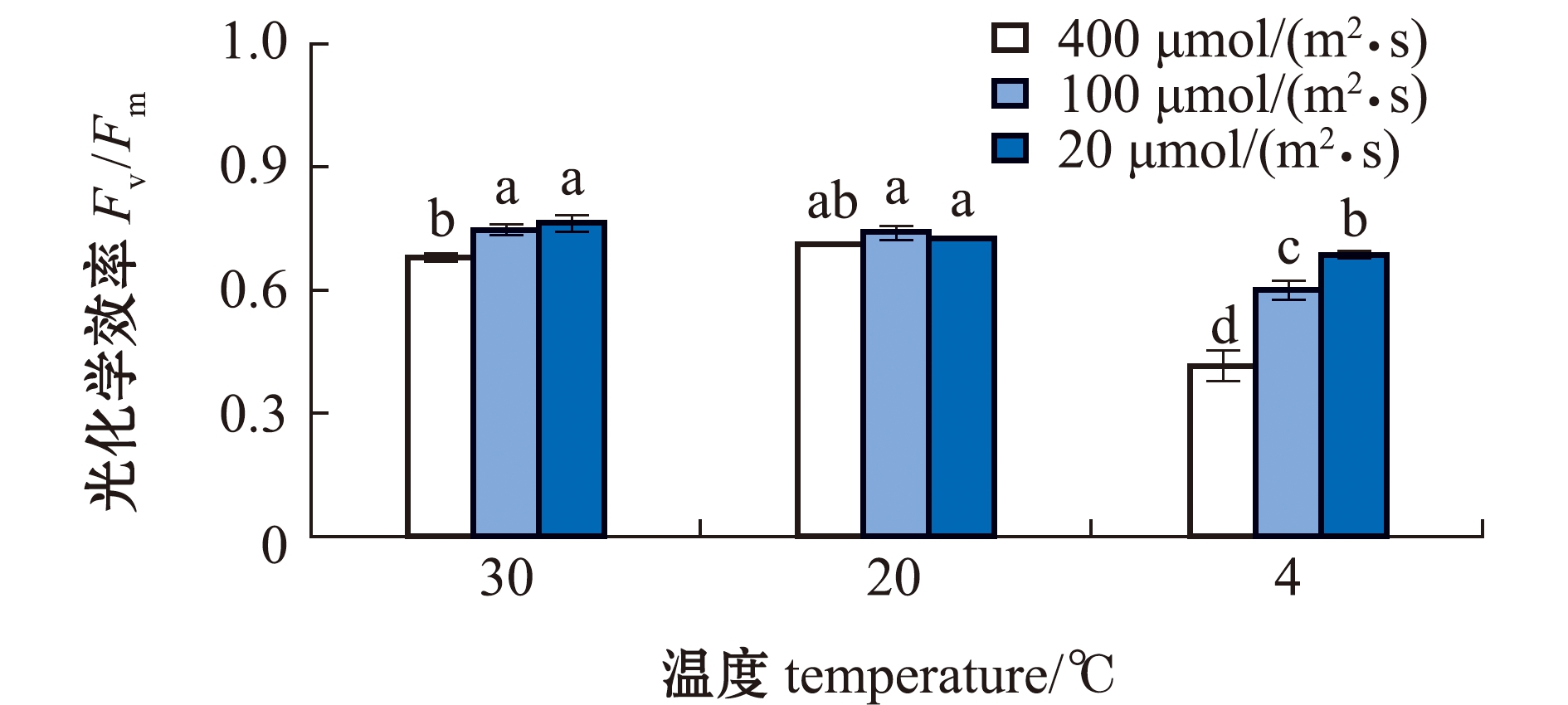
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.
图1 不同处理下缘管浒苔的光化学效率
Fig.1 Photochemical efficiency of green alga Ulva linza under different treatments
2.2 差异表达基因分析
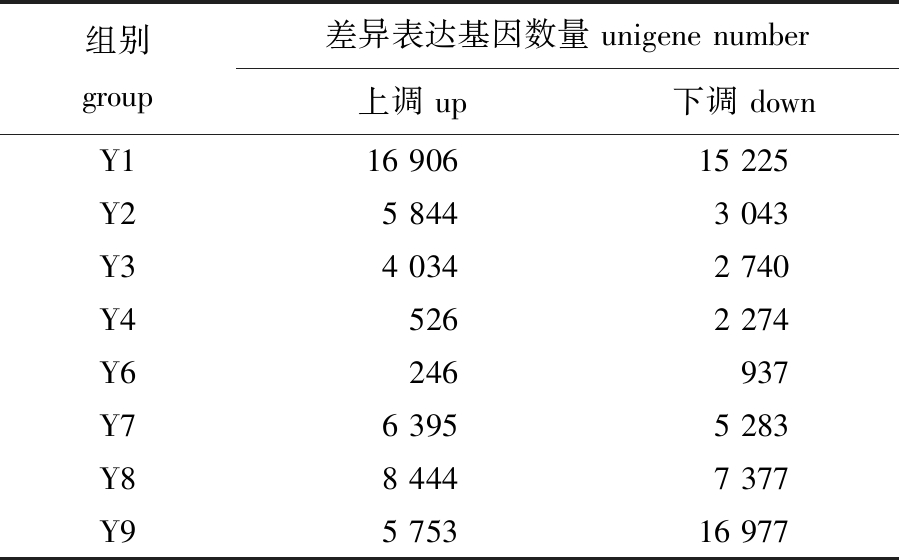
通过Illumina HiSeqTM 2000平台测序,总计产出42 984 321 300 nt数据。组装的总Unigene有101 056个,总长209 052 506 nt,平均长度2 069 nt,N50达到3 489 nt。Unigene功能注释得到NR、NT、Swiss-Prot、KEGG、COG和GO库的Unigene数量分别为60 840、11 036、42 042、45 915、 9 915 和26 451,去除重复后总计为61 580个。根据差异表达分析,不同处理下差异表达的基因数量如表2所示,缘管浒苔在单一的温度处理(Y2、Y8)后产生的差异表达基因数量大于单一光照(Y4、Y6)处理后。在温度和光照的交互影响下,高温高光照(Y1)和低温低光照(Y9)处理组显著差异表达的基因数量较多。
表2 所有基因表达差异比较结果
Tab.2 Comparison of all differentially expressed genes
组别group差异表达基因数量 unigene number上调 up下调 downY116 90615 225Y25 8443 043Y34 0342 740Y45262 274Y6246937Y76 3955 283Y88 4447 377Y95 75316 977
注: 差异表达基因筛选条件为P<0.05且|log2(FoldChange)|≥1。
Note:screening criterium for differentially expressed genes is P<0.05 and |log2(FoldChange)|≥1.
2.3 低温低光照(Y9)处理下特异表达的基因
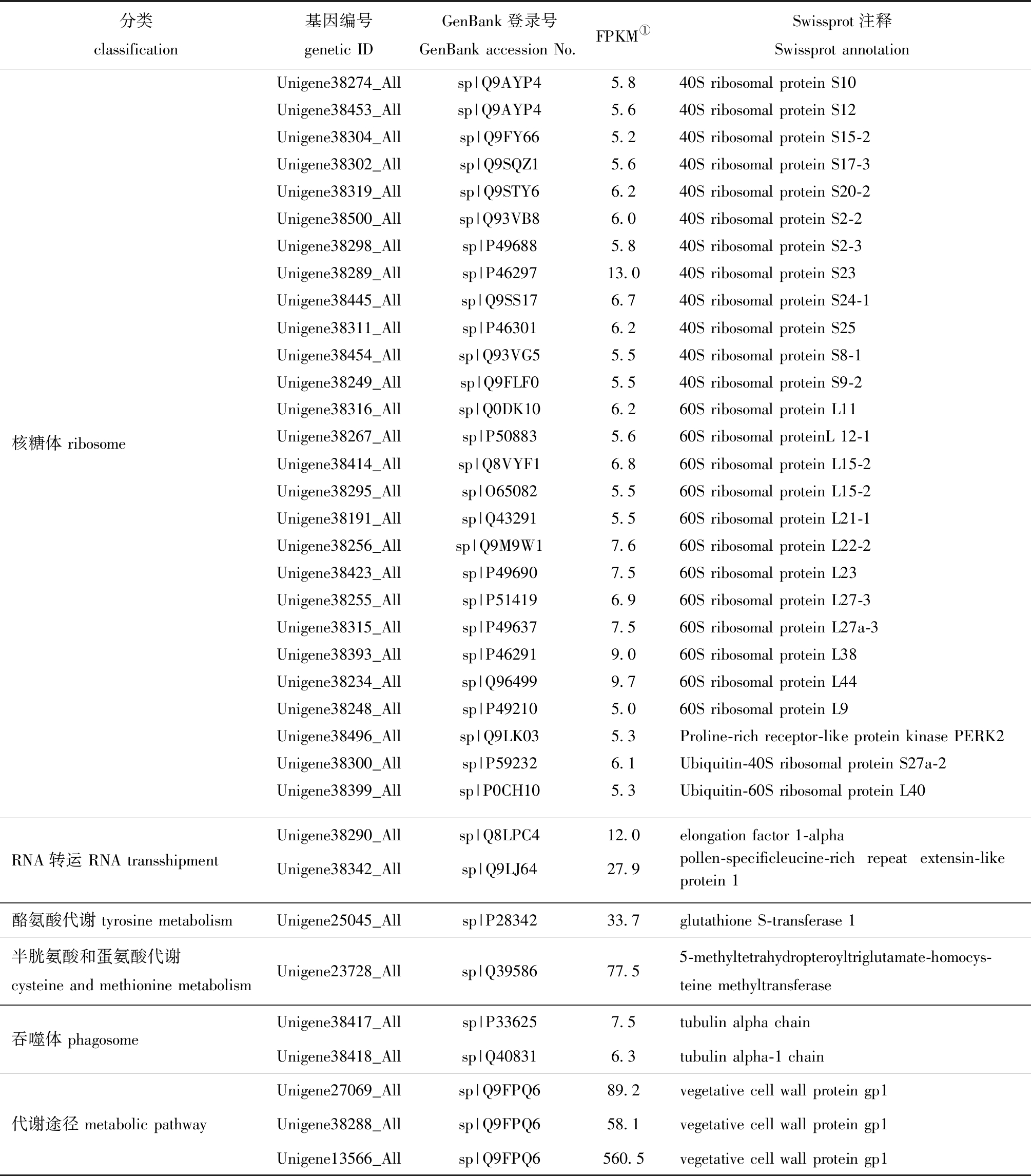
相比其他处理条件,缘管浒苔在响应低温与低光照的短期作用时有104个Unigene特异高表达(其他情况下这些Unigene的FPKM几乎为0),其中,有36个Unigene特异基因可以注释到KEGG图上(表3),这些基因在应对温度或光照的单一胁迫时其表达量无显著性变化,且涉及翻译过程的核糖体、RNA转运、氨基酸代谢、运输过程的吞噬体及有防御功能的细胞壁蛋白。通过Uniport对这36个特异表达基因进行定位查询,发现40S核糖体蛋白S24-1、S8-1及60S核糖体蛋白L12-1这3个基因位于叶绿体中。
2.4 捕光色素蛋白基因
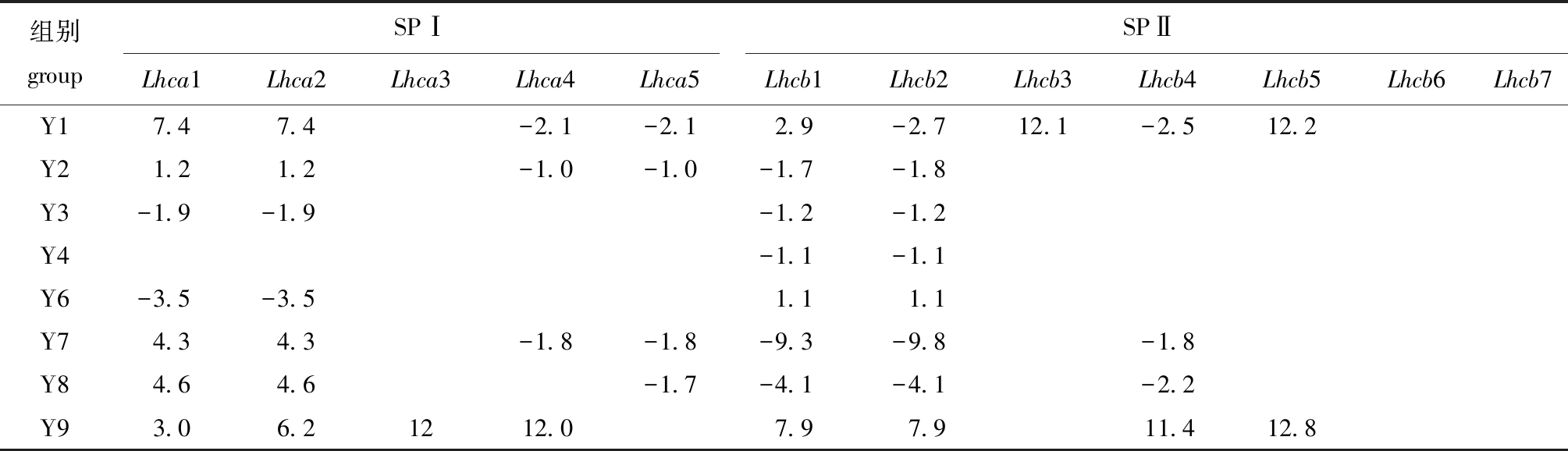
光合作用初期,天线色素分子吸收和传递光能。本研究中,捕光色素蛋白复合物基因表达量在不同温度和光照条件下表现出较大差异,结果如表4所示。与光系统 Ⅰ(SPⅠ)相比,光系统 Ⅱ(SPⅡ)的捕光色素蛋白受外界影响较小,捕光色素蛋白基因Lhcb6和Lhcb7在各处理条件下均未发生显著变化。捕光色素蛋白对单一温度处理(Y2/Y8)的响应大于单一光照处理(Y4/Y6)的响应;在低温条件下(Y7/Y8/Y9),捕光色素蛋白受低光照影响,低光照(Y9)处理组差异基因除Lhca1和Lhca2外,其他基因的变化趋势与低光照(Y7)和中光照(Y8)处理组相反,藻体受低温和低光照协同作用时,上调捕光色素蛋白可能用来抵御胁迫。
2.5 电子传递链相关基因
电子传递链是光合作用形成同化力的核心环节。本研究中,缘管浒苔的电子传递链相关基因响应较小,结果如表5所示。低温中光照(Y8)和低温低光照(Y9)处理组部分基因呈现上调趋势,其中,低温低光照(Y9)处理组差异表达基因的表达趋势与捕光色素一致,捕获的光能需要更多的载体进行传递。除此之外,还发现D1蛋白基因的表达量在高温高光照(Y1)、低温中光照(Y8)和低温低光照(Y9)处理组发生显著上调(P<0.05)。由此推测,在高温高光照条件下,缘管浒苔启动了SPⅡ中D1蛋白的可逆失活来耗散多余的能量,而在低温中光照和低温低光照条件下D1蛋白上调,可能是由于较低温度下酶活性不高,藻体通过提高表达量来应对低温环境。
表3 低温低光照处理下特异表达的Unigenes
Tab.3 Unigenes specifically expressed under low temperature and low light interactions
分类classification基因编号genetic IDGenBank登录号GenBank accession No.FPKM①Swissprot注释Swissprot annotation核糖体 ribosomeUnigene38274_Allsp|Q9AYP45.840S ribosomal protein S10Unigene38453_Allsp|Q9AYP45.640S ribosomal protein S12Unigene38304_Allsp|Q9FY665.240S ribosomal protein S15-2Unigene38302_Allsp|Q9SQZ15.640S ribosomal protein S17-3Unigene38319_Allsp|Q9STY66.240S ribosomal protein S20-2Unigene38500_Allsp|Q93VB86.040S ribosomal protein S2-2Unigene38298_Allsp|P496885.840S ribosomal protein S2-3Unigene38289_Allsp|P4629713.040S ribosomal protein S23Unigene38445_Allsp|Q9SS176.740S ribosomal protein S24-1Unigene38311_Allsp|P463016.240S ribosomal protein S25Unigene38454_Allsp|Q93VG55.540S ribosomal protein S8-1Unigene38249_Allsp|Q9FLF05.540S ribosomal protein S9-2Unigene38316_Allsp|Q0DK106.260S ribosomal protein L11Unigene38267_Allsp|P508835.660S ribosomal proteinL 12-1Unigene38414_Allsp|Q8VYF16.860S ribosomal protein L15-2Unigene38295_Allsp|O650825.560S ribosomal protein L15-2Unigene38191_Allsp|Q432915.560S ribosomal protein L21-1Unigene38256_Allsp|Q9M9W17.660S ribosomal protein L22-2Unigene38423_Allsp|P496907.560S ribosomal protein L23Unigene38255_Allsp|P514196.960S ribosomal protein L27-3Unigene38315_Allsp|P496377.560S ribosomal protein L27a-3Unigene38393_Allsp|P462919.060S ribosomal protein L38Unigene38234_Allsp|Q964999.760S ribosomal protein L44Unigene38248_Allsp|P492105.060S ribosomal protein L9Unigene38496_Allsp|Q9LK035.3Proline-rich receptor-like protein kinase PERK2Unigene38300_Allsp|P592326.1Ubiquitin-40S ribosomal protein S27a-2Unigene38399_Allsp|P0CH105.3Ubiquitin-60S ribosomal protein L40RNA转运 RNA transshipmentUnigene38290_Allsp|Q8LPC412.0elongation factor 1-alphaUnigene38342_Allsp|Q9LJ6427.9pollen-specificleucine-rich repeat extensin-like protein 1酪氨酸代谢 tyrosine metabolismUnigene25045_Allsp|P2834233.7glutathione S-transferase 1半胱氨酸和蛋氨酸代谢 cysteine and methionine metabolismUnigene23728_Allsp|Q3958677.55-methyltetrahydropteroyltriglutamate-homocys-teine methyltransferase吞噬体 phagosomeUnigene38417_Allsp|P336257.5tubulin alpha chainUnigene38418_Allsp|Q408316.3tubulin alpha-1 chain代谢途径 metabolic pathwayUnigene27069_Allsp|Q9FPQ689.2vegetative cell wall protein gp1Unigene38288_Allsp|Q9FPQ658.1vegetative cell wall protein gp1Unigene13566_Allsp|Q9FPQ6560.5vegetative cell wall protein gp1
注:① FPKM代表每千个碱基的转录每百万映射读取的片段数,反映基因的表达水平。
Note:① FPKM represents the number of fragments read per million map per thousand base transcription and reflects the gene expression level.
2.6 光合碳同化相关酶基因
光合固碳C3和C4途径的相关基因检测结果如表6所示。不同处理条件下藻体的碳同化能力受到不同程度的影响,适温(Y4/Y6)条件下,碳同化相关酶基因表达情况受光照影响较小,缘管浒苔固碳反应受温度的影响大于光照;高温高光照(Y1)处理下,C3和C4途径差异表达基因均显著下调(P<0.05);低温(Y7/Y8/Y9)条件下,藻体C3和C4途径的CO2受体再生阶段酶的基因均显著下调(P<0.05)。
表4 不同温度和光照条件下捕光色素蛋白基因相对表达量的变化
Tab.4 Relative expression level of genes related to light harvesting pigment protein under different temperature and light intensities
组别groupSPⅠSPⅡLhca1Lhca2Lhca3Lhca4Lhca5Lhcb1Lhcb2Lhcb3Lhcb4Lhcb5Lhcb6Lhcb7Y17.47.4-2.1-2.12.9-2.712.1-2.512.2Y21.21.2-1.0-1.0-1.7-1.8Y3-1.9-1.9-1.2-1.2Y4-1.1-1.1Y6-3.5-3.51.11.1Y74.34.3-1.8-1.8-9.3-9.8-1.8Y84.64.6-1.7-4.1-4.1-2.2Y93.06.21212.07.97.911.412.8
注:相对基因表达量均为以Y5组为基准的倍数;log2(FoldChange)≥1表示上调,log2(FoldChange)≤-1表示下调,均满足P<0.05,下同。
Note:Relative expression level is described as times based on Y5 conditions;log2(FoldChange)≥1 indicates up-regulation and log2(FoldChange)≤-1 indicates down-regulation, meeting the P<0.05, et sequentia.
表5 不同温度和光照条件下电子传递链相关基因相对表达量的变化
Tab.5 Relative expression level of genes related to electron transport chain under different temperature and light intensities
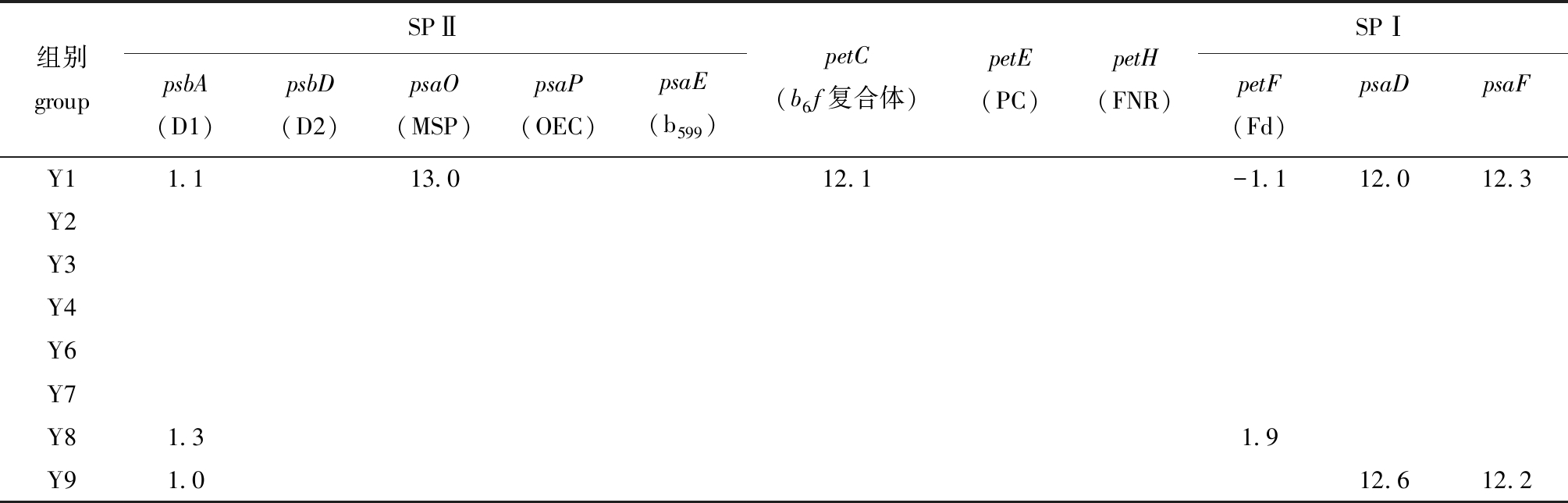
组别groupSPⅡpsbA(D1)psbD(D2)psaO(MSP)psaP(OEC)psaE(b599)petC(b6f复合体)petE(PC)petH(FNR)SPⅠpetF(Fd)psaDpsaFY11.113.012.1-1.112.012.3Y2Y3Y4Y6Y7Y81.31.9Y91.012.612.2
表6 不同温度和光照条件下光合碳同化相关酶基因相对表达量的变化
Tab.6 Relative expression level of genes related to photosynthetic carbon assimilation under different temperature and light intensities

途径 pathway反应阶段 stage酶 enzymeY1Y2Y3Y4Y6Y7Y8Y9C3羧化 carboxylation核酮-1,5-二磷酸羧化酶1.82.01.5还原 reduction磷酸甘油酸激酶-6.3-1.0-2.3甘油醛-3-磷酸脱氢酶-2.21.3-1.62.21.8再生 regeneration磷酸丙糖异构酶-1.6果糖-1,6-二磷酸酶-2.7-1.1-2.8-4.4-5.7-4.8转酮酶-3.5-1.3C4四碳酸合成tetracarbonic acid synthesis磷酸烯醇丙酮酸羧化酶-2.3-2.5-2.11.6-3.6苹果酸脱氢酶-2.21.82.31.41.31.8碳水化合物合成carbohydrate synthesisNADP-苹果酸酶-1.51.31.1-1.6-5.7谷草转氨酶-1.11.42.62.31.4CO2受体再生CO2 receptor regeneration磷酸烯醇丙酮酸羧激酶-1.4-2.1-3.3-1.1-2.4-2.2-5.3谷丙转氨酶-4.1-1.1-3.7-4.5磷酸丙酮酸二激酶-7.7-5.7-5.7-6.2
3 讨论
3.1 缘管浒苔的演替
大量微观繁殖体在春末海区温度回升时迅速萌发,在漂移过程中,随着温度和光照升高缘管浒苔逐渐消失[22]。王艺等[22]通过对绿潮发生过程进行全程监视,于2015年3—6月在江苏如东海区发现了缘管浒苔繁殖体。宋伟[23]通过对苏北浅滩紫菜养殖筏架上的定生绿藻进行连续跟踪,于2012年7月在青岛海域漂浮藻中发现缘管浒苔,而华梁等[24]于2012和2013年的8月在江苏紫菜筏架区绿潮藻中并未鉴定到缘管浒苔,这表明随着海水温度升高和绿潮藻群逐渐向北漂移,缘管浒苔逐渐消失,优势种逐渐由扁浒苔、缘管浒苔和浒苔演替成主要由浒苔构成的漂浮绿潮藻种群[25]。本研究中,通过24 h短期温度与光照处理,分析了缘管浒苔在适应环境变化时对光合作用的响应,根据结果推测,冬季温度较低时,藻体上调部分捕光色素蛋白基因和电子传递链基因的表达,但光合固碳反应的CO2受体再生阶段受到抑制,生长缓慢;夏季随着温度升高,藻体下调C3和C4途径的基因表达,抑制光合固碳反应来适应白天高光照环境。
3.2 藻体光合特性
光化学效率是研究环境对藻体光合作用效应的重要指标,常被用来表征植物被胁迫下的光系统变化。短期的高光照条件会引起浒苔光合能力下降。付倩倩等[14]在短期高光照(400 μmol/(m2·s))处理缘管浒苔后,其Fv/Fm值低于中光照(200 μmol/(m2·s))、低光照(90 μmol/(m2·s))处理。张珺等[26]用高光照(400 μmol/(m2·s))处理浒苔第3天后,其Fv/Fm值和实际光化学量子效率显著低于其他光照(40~160 μmol/(m2·s))处理。本研究中发现,缘管浒苔在单一高光照 (400 μmol/(m2·s))短期(24 h)处理后,其Fv/Fm值略有下降,但在高温(30 ℃)或低温(4 ℃)的协同作用下,Fv/Fm值显著下降,且藻体的差异表达基因数量也增多;在高温与高光照协同作用下,藻体光合固碳、电子传递和补光色素蛋白相关基因大量差异表达,其中光合固碳基因的表达均显著下调,这表明,缘管浒苔对温度和光照的协同作用响应更大。Jiang等[27]研究发现,高光照 (400 μmol/(m2·s))处理5 d,可以缓解高温(30 ℃)对浒苔生理参数的抑制作用,但本研究结果与之相反,这可能是本研究中缘管浒苔高光照下未能在短期内缓解受到的高温胁迫,而在较高光照下长期培养后,对温度的耐受性会增加,表现出一定的适应性。
3.3 低温低光照下缘管浒苔的响应分析
低温低光照条件是藻类越冬及复苏经历的极端环境条件。刘峰[28]研究发现,绿潮藻显微繁殖体在低温环境中可以存活3~4个月;同时Schories[29]研究认为,越冬孢子是绿潮藻显微繁殖体的重要来源,其能在黑暗条件下存活至少10个月。在大型海藻的液体保存法中,低温低光照也是一种实用的种质保存方法[30]。本研究中发现,缘管浒苔在短期(24 h)的低温低光照处理下已经产生了较强的适应性。相较于单一低温条件,低温低光照处理下的藻体Fv/Fm值反而显著增加(图1),低光照提高了缘管浒苔对低温的耐受性。此外,差异表达的捕光色素蛋白和电子传递链相关基因在低温低光照下表达量均显著上调,这可能是由于低光照诱导植物产生了更多的光合色素[11,31],捕获更多的光能,低温和低光照协同作用时藻体通过储藏更多的能量抵御胁迫。值得注意的是,藻体在低温低光照下特异高表达大量基因(表3),其中,S24-1、S8-1和L12-1 3种位于叶绿体上的核糖体蛋白基因表达极显著上调(P<0.01且|log2(FoldChange)|>2),推测这些蛋白可能参与修饰光合作用中大量上调的基因,从而使低温低光照条件下的光合作用参数Fv/Fm值高于低温高光照和低温中光照处理。由此可见,低温和低光照协同作用下,缘管浒苔存在特殊的适应机制。
4 结论
1)低温低光照下,缘管浒苔上调捕光色素蛋白和电子传递链相关基因,并特异表达部分叶绿体基因,说明藻体在冬季极端环境下具有特殊适应机制。
2)高温高光照下,藻体光合固碳作用被全面抑制,推测缘管浒苔不适应夏季极端环境。
3)温度和光照的交互影响下,藻体的光合作用参数和基因表达情况均异于单一条件下,说明温度和光照对藻体具有协同作用。
[1] HAN W,CHEN L P,ZHANG J H,et al.Seasonal variation of dominant free-floating and attached Ulva species in Rudong coastal area,China[J].Harmful Algae,2013,28:46-54.
[2] CUI J J,ZHANG J H,HUO Y Z,et al.Adaptability of free-floating green tide algae in the Yellow Sea to variable temperature and light intensity[J].Marine Pollution Bulletin,2015,101(2):660-666.
[3] 刘正一.渤海、南海六种浒苔的调查及分析[D].南京:南京农业大学,2010.
LIU Z Y.Study and analysis of six species of Enteromorpha in Bohai Sea and South China Sea[D].Nanjing:Nanjing Agricultural University,2010.(in Chinese)
[4] 林荣呈,杨文强,王柏臣,等.光合作用研究若干前沿进展与展望[J].中国科学:生命科学,2021,51(10):1376-1384.
LIN R C,YANG W Q,WANG B C,et al.Advances and perspectives in several areas of photosynthesis research[J].Scientia Sinica Vitae,2021,51(10):1376-1384.(in Chinese)
[5] ZOU D H,GAO K S.The photosynthetic and respiratory responses to temperature and nitrogen supply in the marine green macroalga Ulva conglobata (Chlorophyta)[J].Phycologia,2014,53(1):86-94.
[6] LI G,QIN Z,ZHANG J J,et al.Algal density mediates the photosynthetic responses of a marine macroalga Ulva conglobata (Chlorophyta) to temperature and pH changes[J].Algal Research,2020,46:101797.
[7] NELSON T A,HABERLIN K,NELSON A V,et al.Ecological and physiological controls of species composition in green macroalgal blooms[J].Ecology,2008,89(5):1287-1298.
[8] KIM J H,KANG E J,PARK M G,et al.Effects of temperature and irradiance on photosynthesis and growth of a green-tide-forming species (Ulva linza) in the Yellow Sea[J].Journal of Applied Phycology,2011,23(3):421-432.
[9] FALKOWSKI P,LAROCHE J.Acclimation to spectral irradiance in algae[J].Journal of Phycology,2004,27(1):8-14.
[10] 汤文仲,李信书,黄海燕,等.不同光强和温度对长石莼(缘管浒苔)光合作用和叶绿素荧光参数的影响[J].水产学报,2009,33(5):762-769.
TANG W Z,LI X S,HUANG H Y,et al.Effects of different light intensity and temperature treatment on photosynthesis and chlorophyll fluorescence in Ulva linza[J].Journal of Fisheries of China,2009,33(5):762-769.(in Chinese)
[11] MEYER F W,VOGEL N,TEICHBERG M,et al.The physiological response of two green calcifying algae from the Great Barrier Reef towards high dissolved inorganic and organic carbon (DIC and DOC) availability[J].PLoS One,2015,10(8):e0133596.
[12] OQUIST G,CHOW W S,ANDERSON J M.Photoinhibition of photosynthesis represents a mechanism for the long-term regulation of photosystem II[J].Planta,1992,186(3):450-460.
[13] 管正.缘管浒苔NPQ光保护机制及其四个基因的功能研究[D].上海:上海海洋大学,2015.
GUAN Z.Study on the non-photochemical quenching and the function of four light harvesting complex-like encoding genes in Ulva linza[D].Shanghai:Shanghai Ocean University,2015.(in Chinese)
[14] 付倩倩,李航霄,吴海龙,等.光强对缘管浒苔(Ulva linza)光合生理特性和短期温度效应的影响[J].海洋与湖沼,2018,49(5):967-974.
FU Q Q,LI H X,WU H L,et al.Effects of light intensity on photosynthetic physiology characteristic and short-time temperature reaction of Ulva linza[J].Oceanologia et Limnologia Sinica,2018,49(5):967-974.(in Chinese)
[15] LIU D Y,MA Q,VALIELA I,et al.Role of C4 carbon fixation in Ulva prolifera,the macroalga responsible for the world’s largest green tides[J].Communications Biology,2020,3(1):494.
[16] 许建方,张晓雯,叶乃好,等.缘管浒苔C4途径主要光合作用酶活性[J].中国科学:生命科学,2013,43(7):596-605.
XU J F,ZHANG X W,YE N H,et al.Activities of principal photosynthetic enzymes in C4 pathway of Ulva linza[J].Scientia Sinica (Vitae),2013,43(7):596-605.(in Chinese)
[17] FAN X,XU D,WANG D S,et al.Nutrient uptake and transporter gene expression of ammonium,nitrate,and phosphorus in Ulva linza:adaption to variable concentrations and temperatures[J].Journal of Applied Phycology,2020,32(2):1311-1322.
[18] GUAN Z,MOU S L,ZHANG X W,et al.Identification and expression analysis of four light harvesting-like (Lhc) genes associated with light and desiccation stress in Ulva linza[J].Journal of Experimental Marine Biology and Ecology,2016,478:10-15.
[19] DONG M T,ZHANG X W,ZHUANG Z M,et al.Characterization of the LhcSR gene under light and temperature stress in the green alga Ulva linza[J].Plant Molecular Biology Reporter,2012,30(1):10-16.
[20] ZHANG X W,CAO S N,LI Y X,et al.Expression of three putative early light-induced genes under different stress conditions in the green alga Ulva linza[J].Plant Molecular Biology Reporter,2012,30(4):940-948.
[21] ALTSCHUL S F,MADDEN T L,SCH FFER A A,et al.Gapped BLAST and PSI-BLAST:a new generation of protein database search programs[J].Nucleic Acids Research,1997,25(17):3389-3402.
FFER A A,et al.Gapped BLAST and PSI-BLAST:a new generation of protein database search programs[J].Nucleic Acids Research,1997,25(17):3389-3402.
[22] 王艺,张建恒,霍元子,等.黄海绿潮发生过程监测[J].海洋湖沼通报,2019(1):135-145.
WANG Y,ZHANG J H,HUO Y Z,et al.Monitoring the development of green tides in Yellow Sea[J].Transactions of Oceanology and Limnology,2019(1):135-145.(in Chinese)
[23] 宋伟.苏北浅滩定生绿藻的鉴定、生理特征及群落演替研究[D].长沙:湖南农业大学,2014.
SONG W.Studies on species identification,physiological characteristics and community succession of attached green algae on Subei shoal[D].Changsha:Hunan Agricultural University,2014.(in Chinese)
[24] 华梁,霍元子,张建恒,等.南黄海绿潮暴发早期与末期显微繁殖体分布及种类组成研究[J].上海海洋大学学报,2015,24(2):256-264.
HUA L,HUO Y Z,ZHANG J H,et al.Quantitative distribution properties and species composition of Ulva microscopic propagules in the South Yellow Sea[J].Journal of Shanghai Ocean University,2015,24(2):256-264.(in Chinese)
[25] 霍元子,张建恒,陈丽平,等.南黄海绿潮早期形成过程监测及漂浮源头分析[C]//中国藻类学会第八次会员代表大会暨第十六次学术讨论会论文摘要集.上海:中国藻类学会,2011:272.
HUO Y Z,ZHANG J H,CHEN L P,et al.Monitoring the early formation process and floating source analysis of green tide in the South Yellow Sea[C]//Abstracts of the 8th Member Congress of the Chinese Algae Society and the 16th Symposium.Shanghai: Chinese Society of Phycology,2011:272.(in Chinese)
[26] 张珺,周瑞佳,赵升,等.不同盐度、温度及光照对漂浮浒苔生理生态的影响[J].海洋开发与管理,2021,38(3):55-60.
ZHANG J,ZHOU R J,ZHAO S,et al.Research on the effects of different salinity,temperature and illumination for Eenteromorpha prolifera physiological ecology[J].Ocean Development and Management,2021,38(3):55-60.(in Chinese)
[27] JIANG J N,YU Y Y,ZHENG M,et al.High light might alleviate inhibitory effects of high temperature on growth and physiological parameters of Ulva prolifera[J].Aquaculture Research,2020,51(5):2062-70.
[28] 刘峰.黄海绿潮的成因以及绿潮浒苔的生理生态学和分子系统学研究[D].青岛:中国科学院研究生院(海洋研究所),2010.
LIU F.The causes of green tides in the Yellow Sea,and ecophysiological and phylogenetic analysis of the bloom-forming alga,Ulva prolifera[D].Qingdao:Graduate School of Chinese Academy of Sciences (Institute of Oceanology),2010.(in Chinese)
[29] SCHORIES D.Sporulation of Enteromorpha spp.(Chlorophyta) and overwintering of spores in sediments of the Wadden Sea,Island sylt,north sea[J].Netherland Journal of Aquatic Ecology,1995,29(3/4):341-347.
[30] 郭金耀,杨晓玲.条斑紫菜自由丝状体保存研究[J].食品科学,2010,31(7):117-122.
GUO J Y,YANG X L.Preservation of free-living conchocelis of Porphyra yezoensis[J].Food Science,2010,31(7):117-122.(in Chinese)
[31] 马汶菲,李景玉.从藻类生理生态学角度解析绿潮暴发的内在机制[J]应用生态学报,2022,33(5):1420-1428.
MA W F,LI J Y.Analysis of the internal mechanisms of green tide from the perspective of algae ecophysiology[J].Chinese Journal of Applied Ecology,2022,33(5):1420-1428.(in Chinese)