随着人们生活习惯的改变和环境恶化,不孕不育问题日益凸显。目前,全球8%~12%的育龄夫妻正面临着生殖健康问题,其中,约有一半的病例由男性引发,涵盖至少3 000万名男性,并以年平均0.37%的速度逐年增加[1-4]。造成男性不育的病因非常复杂,遗传因素、泌尿系统疾病、环境毒素、高温、不良生活习惯和过度肥胖等因素均可导致[5]。下丘脑-垂体-性腺轴激素分泌正常和睾丸组织完整对促进精子发生具有至关重要的作用[6-7],有研究报道,外源毒素可通过作用于性腺轴,导致激素分泌紊乱[8],通过氧化应激导致睾丸组织损伤,且精子发生极易受到活性氧(ROS)的影响,从而导致生殖细胞DNA损伤、畸形和凋亡,所幸由氧化应激引起的生殖损伤并非不可逆[9-10]。
雷公藤甲素(TP)是中药雷公藤的主要活性物质之一,临床上被用于治疗类风湿、炎症和肿瘤等疾病[11-13]。然而,TP对人体具有强烈的生殖毒性,服用过量会出现睾丸萎缩、激素分泌紊乱和无精少精等不良反应[14-15]。TP诱导氧化应激和细胞凋亡是其发挥生殖毒性的主要机理。王昊等[16]研究发现,TP通过上调细胞内活性氧水平诱导TM4细胞凋亡。TP诱导睾丸组织内ROS积累进而导致血睾屏障破坏,最终导致睾丸损伤,睾丸支持细胞凋亡[17]。然而,由TP诱导氧化应激导致的男性生精障碍,可能通过激活细胞内抗氧化水平而得以恢复。
香港牡蛎Crassostrea hongkongensis俗称生蚝,隶属于软体动物门Mollusca双壳纲Bivalvia珍珠贝目Pterioida牡蛎科Ostreidae,主要分布于中国广东、广西地区[18],2020年养殖量达到542.5 万t,产量居四大经济贝类之首[19]。牡蛎味道鲜美、营养丰富,具有“海洋牛奶”的美称[20],同时还具备抗氧化[21]、抗皮肤光老化[22]、促进创伤愈合[23]、改善睡眠[24]和提高学习记忆[25]等生物活性。此外,牡蛎酶解产物(oyster enzymatic hydrolysate, OEH)还可以显著提高睾丸间质细胞增殖活性并促进睾酮分泌[26]。张雪妍等[27]发现,牡蛎酶解产物对TP诱导的TM4小鼠睾丸支持细胞的氧化损伤具有显著保护作用。可见,牡蛎酶解产物对男性生殖损伤和生精障碍具有潜在的保护效果,但牡蛎酶解产物改善雄性精子发生的作用效果和作用机理尚不明确。本研究中,以香港牡蛎酶解产物为研究对象,通过腹腔注射TP构建雄性小鼠生精障碍模型,探讨了牡蛎酶解产物对改善小鼠生精功能的作用效果和可能机制,以期为牡蛎产品的开发利用提供科学依据。
1 材料与方法
1.1 材料
试验用香港牡蛎购于湛江霞山东风水产品市场,购回后立即开壳取肉,洗净沥干后于-80 ℃超低温冰箱中保存。
试验动物:健康SPF级5周龄雄性ICR小鼠,购于珠海百试通生物科技有限公司,动物许可证号SYXK(粤)2019-0204,饲养温度为22~26 ℃,湿度为50%~60%,光周期为12 h明暗交替,投喂C60辐照试验鼠维持饲料和蒸馏水。
药品与试剂:动物蛋白酶(酶活力为8.6×104 U/g)(广西南宁庞博生物工程有限公司);雷公藤甲素(上海源叶生物科技有限公司);维生素E(广州星群药业);BCA蛋白浓度测定试剂盒(增强型)(上海碧云天生物技术有限公司);小鼠睾酮(T)、小鼠促黄体生成素(LH)和小鼠促卵泡生长激素(FSH)ELISA试剂盒(均为江苏酶免实业有限公司产品);丙二醛(MDA)(TBA法)、总超氧化物歧化酶(SOD)(WST-1 法)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化氢酶(CAT)(紫外法)、乳酸脱氢酶(LDH)测定试剂盒及精子快速染色液(快速改良巴氏法)(均为南京建成生物工程研究所产品);二甲苯、无水乙醇和中性树胶(分析纯,国药集团化学试剂有限公司);伊红(HE)染液套装(Servicebio);扇贝GBW10024(GSB-15扇贝)(中国地质科学院地球物理地球化学勘查研究所);其他试剂均为分析纯。
仪器设备:FE28型pH计(瑞士Mettler Toledo公司);FD-551大型立式冷冻干燥机(东京理化器械公司);Lynx6000高速落地离心机、Varioskan Flash全自动酶标仪(美国Thermo公司);VAPODEST-450全自动凯氏定氮仪(德国格哈特分析仪器有限公司);ICP-MS(安捷伦 Agilent 7500cx);微波消解仪(Anton PaarMultiwave PRO 41HVT56);CKX41型倒置显微镜(日本Olympus公司);正置光学显微镜(日本尼康公司)。
1.2 方法
1.2.1 牡蛎酶解产物制备 将牡蛎肉按料液比1∶3(质量比)加入蒸馏水匀浆,调节pH至7.0,按酶活和底物比1 000∶1(U∶g)加入动物蛋白酶,53 ℃下保温酶解5 h后,在沸水浴中灭酶15 min,离心取上清液,浓缩上清液后冷冻干燥制成牡蛎酶解粉,置于-20 ℃下保存。
1.2.2 基本成分测定 分别采用凯氏定氮法(GB 5009.5—2016)、苯酚-硫酸法(GB/T 9695.31—2008)、索氏抽提法(GB 5009.6—2016)、常压干燥法(GB 5009.3—2016)和高温灼烧法(GB 5009.4—2016)测定粗蛋白质、总糖、粗脂肪、水分和灰分含量。
1.2.3 氨基酸组成测定 采用GB 5009.124—2016测定牡蛎酶解产物中氨基酸含量。
1.2.4 微量元素测定 采用电感耦合等离子体质谱法(ICP-MS)(GB/T 5009.268—2016)测定牡蛎酶解产物微量元素铜(Cu)、锌(Zn)、铁(Fe)、锰(Mn)和硒(Se)的含量。
1.2.5 动物试验
1)动物分组。将健康雄性ICR小鼠随机分为6组,每组8只,分别为空白组(C)、模型组(M)、阳性组(P),以及牡蛎酶解产物低、中、高剂量组(OEH-L、OEH-M、OEH-H),经适应性喂养7 d后开始正式试验。
2)剂量确定。TP注射剂量参考Ma等[17]的方法,按120 μg/kg(体质量)进行腹腔注射;维生素E(VE)按6.5 mg/kg(体质量)进行灌胃;OEH低、中、高剂量分别按250、500、1 000 mg/kg(体质量)进行灌胃,每天一次腹腔注射和灌胃,连续进行21 d。各组动物腹腔注射和灌胃情况如表1所示。
3)试验过程。每只小鼠的灌胃量及腹腔注射量为0.1 mL/10 g(体质量),试验开始后每天记录小鼠体质量,在末次灌胃和腹腔注射后开始禁食不禁水12 h,各组小鼠称量体质量后摘除眼球取血,牺牲小鼠后取出小鼠两侧睾丸及附睾,左右睾丸分别称重后,将左侧睾丸立即浸泡于多聚甲醛中,右侧睾丸使用液氮冻存,用于生化指标测定。
表1 不同组小鼠灌胃及腹腔注射情况
Tab.1 Intraperitoneal injection and gavage of mice in different groups
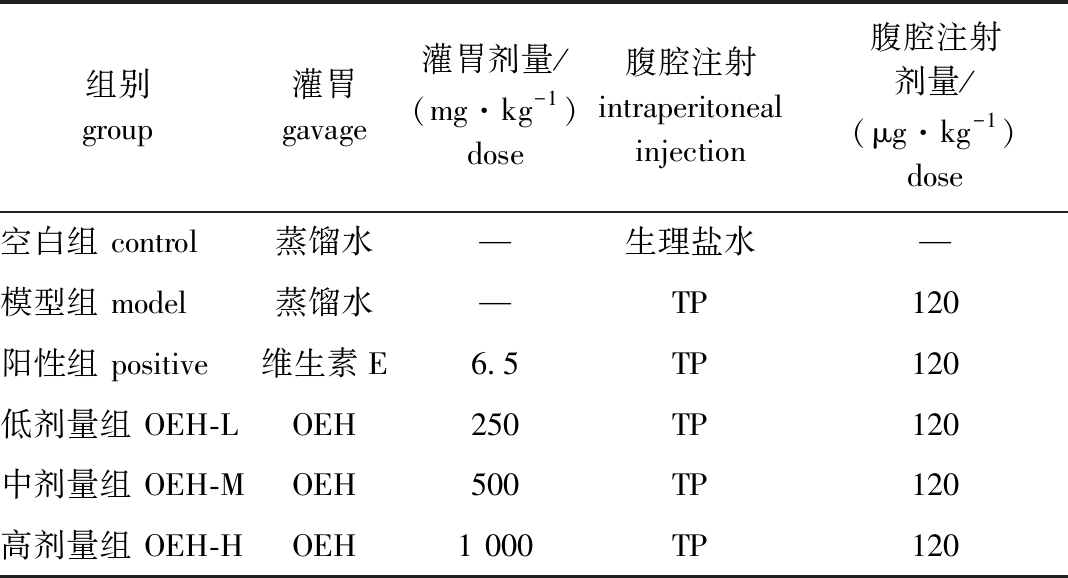
组别group灌胃gavage灌胃剂量/(mg·kg-1)dose腹腔注射intraperitoneal injection腹腔注射剂量/(μg·kg-1)dose空白组 control蒸馏水—生理盐水—模型组 model蒸馏水—TP120阳性组 positive维生素E6.5TP120低剂量组 OEH-LOEH250TP120中剂量组 OEH-MOEH500TP120高剂量组 OEH-HOEH1 000TP120
1.2.6 相关指标测定
1)脏器系数。取出小鼠左、右睾丸后使用电子天平称重,计算全睾丸脏器系数,计算公式
全睾丸脏器系数=(左侧睾丸质量+右侧睾丸
质量)/小鼠质量×100%。
2)精子参数。取出小鼠左、右附睾,纵向切3刀后浸入37 ℃预热生理盐水中,并在37 ℃下孵育10 min,浸出精子后使用血球观察并计数总精子数和活动精子数。取游离精子于载玻片上,使用精子快速染色液对精子进行染色,随后在显微镜下拍照并计数200个精子并计算畸形率,计算公式为
精子畸形率=缺陷精子数/200×100%。
3)睾丸组织切片观察。将新鲜小鼠左侧睾丸用固定液固定48 h后,在脱水机内依次用梯度乙醇进行脱水而后浸蜡,将浸蜡后的组织于包埋机内进行包埋,包埋后的蜡块置于石蜡切片机切片,最大面切片,厚度为4 μm。切片脱蜡复水后用苏木素和伊红染色,封片后采用显微镜镜检并采集图像分析。
4)睾丸组织生化指标。将小鼠右侧睾丸和9倍体积的生理盐水使用匀浆器匀浆,制成质量分数为10%的睾丸组织匀浆液。采用南京建成生物工程研究所试剂盒分别测定睾丸组织酶活性(LDH、CAT、SOD、GSH-PX)和MDA含量。
5)血清激素水平。将小鼠血液在室温下自然凝固20 min,4 ℃下以8 000 r/min离心20 min,取上清液,使用ELISA试剂盒测定血清中T、FSH和LH含量。
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示。试验数据采用SPSS 25.0软件进行统计分析,采用T检验法进行差异显著性分析,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 牡蛎酶解产物基本组成成分
从表2可知,OEH基本组成成分中含量最高的是蛋白质,按干基质量计算达到46.89%,其次为总糖,含量为35.79%,而脂肪仅占8.93%。因此,OEH具有高蛋白、低脂肪的特征。
表2 牡蛎酶解产物的基本组成成分含量(n=3)
Tab.2 Content of the proximate compositions of the OEH (n=3) w/%
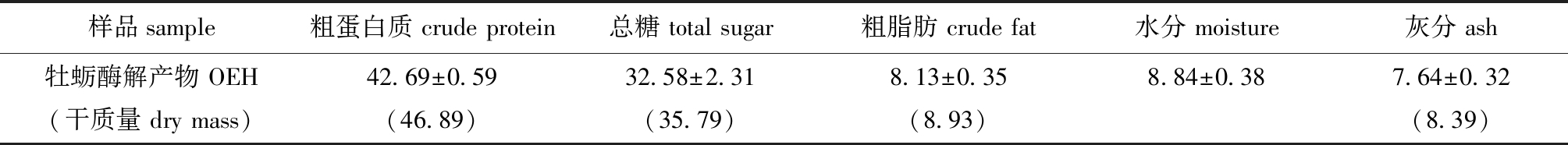
样品sample粗蛋白质 crude protein总糖 total sugar粗脂肪 crude fat水分 moisture灰分 ash牡蛎酶解产物 OEH(干质量 dry mass)42.69±0.59(46.89)32.58±2.31(35.79)8.13±0.35(8.93)8.84±0.387.64±0.32(8.39)
2.2 牡蛎酶解产物氨基酸组成
从表3可见:OEH的游离氨基酸和水解氨基酸均含有7种必需氨基酸,且必需氨基酸与总氨基酸的比值分别为48.42%和36.04%,均高于联合国粮农组织(FAO)和世界卫生组织(WHO)推荐的理想蛋白模式;OEH中支链氨基酸(异亮氨酸、亮氨酸、缬氨酸)占水解总氨基酸的18.50%。这表明,OEH氨基酸含量丰富、种类齐全、构成比例均衡。
2.3 牡蛎酶解产物微量元素含量
经测定,OEH中Zn含量最高,为(1 879.9±15.11) μg/g,其他微量元素含量依次为Cu>Fe>Mn>Se,分别为(759.9±15.1)、 (91.2±6.1)、(23.1±0.8)、(1.8±0.1) μg/g。
2.4 牡蛎酶解产物对小鼠睾丸组织的影响
本试验中从宏观和微观两个水平验证牡蛎酶解产物对小鼠睾丸组织结构的影响。从表4可见,TP和OEH对小鼠体质量无显著性影响(P>0.05);与空白组相比,模型组小鼠睾丸系数极显著降低(P<0.01),与模型组相比,阳性组和OEH-L组小鼠睾丸系数略有提高(P>0.05),而OEH-M组和OEH-H组睾丸系数均有显著提高(P<0.05)。这表明,中、高剂量牡蛎酶解产物可能通过改善睾丸萎缩提高了小鼠睾丸系数。
表3 牡蛎酶解产物的氨基酸组成
Tab.3 Amino acid composition of OEH g/100 g OEH

氨基酸amino acid游离氨基酸 free amino acid水解氨基酸 hydrolysis amino acid门冬氨酸 Asp0.763.92苏氨酸 Thr∗1.201.65丝氨酸 Ser0.901.65谷氨酸 Glu1.895.74脯氨酸 Pro#0.711.58甘氨酸 Gly0.682.66丙氨酸 Ala#1.542.21缬氨酸 Val∗#1.272.10蛋氨酸 Met∗#1.030.83异亮氨酸 Ile∗#1.381.77亮氨酸 Leu∗#2.222.70酪氨酸 Tyr2.461.33苯丙氨酸 Phe∗#1.971.39赖氨酸 Lys∗0.742.36组氨酸 His0.230.94精氨酸 Arg1.282.69氨基酸总量TAA20.2635.52必需氨基酸EAA 9.8112.80疏水性氨基酸HAA 10.1212.58支链氨基酸BCAA4.876.57EAA/TAA/%48.4236.04
注:*—必需氨基酸;#—疏水性氨基酸。
Note: *—essential amino acid; #—hydrophobic amino acid.
表4 牡蛎酶解产物对小鼠体质量和睾丸系数的影响
Tab.4 Effects of OEH on body weight and testicular coefficient in mice

组别group小鼠体质量/gbody weight睾丸系数/%testicular coefficient空白组control37.9±2.70.85±0.11模型组model36.6±2.60.65±0.07##阳性组positive38.8±2.00.72±0.10低剂量组OEH-L38.5±1.40.71±0.06中剂量组OEH-M38.0±0.70.73±0.07∗高剂量组OEH-H37.9±0.80.74±0.03∗∗
注:与空白组相比,#表示有显著性差异(P<0.05),##表示有极显著性差异(P<0.01);与模型组相比,*表示有显著性差异(P<0.05),**表示有极显著性差异(P<0.01),下同。
Note:# means significant difference compared with the control group(P<0.05),## means very significant difference compared with the control(P<0.01);* means significant difference compared with the model group(P<0.05),** means very significant difference compared with the model group(P<0.01), et sequentia.
从睾丸组织HE染色可以清晰观察到,空白组睾丸生精小管排列紧密整齐,精管内生精细胞数量密集、分布均匀、形态良好;模型组睾丸精管内生精细胞明显减少,细胞分布紊乱,出现大量空泡;与模型组相比,阳性组、OEH-L组、OEH-M组和OEH-H组精管内生精细胞数量明显提高,细胞形态显著改善,阳性组与OEH组对睾丸组织的改善效果相近,且随着OEH剂量的提高,OEH对睾丸组织损伤的改善效果更佳(图1)。这表明,OEH具有提高生精细胞数量、减少精管空泡化并维持睾丸组织结构的作用,且具有一定的剂量依赖性。
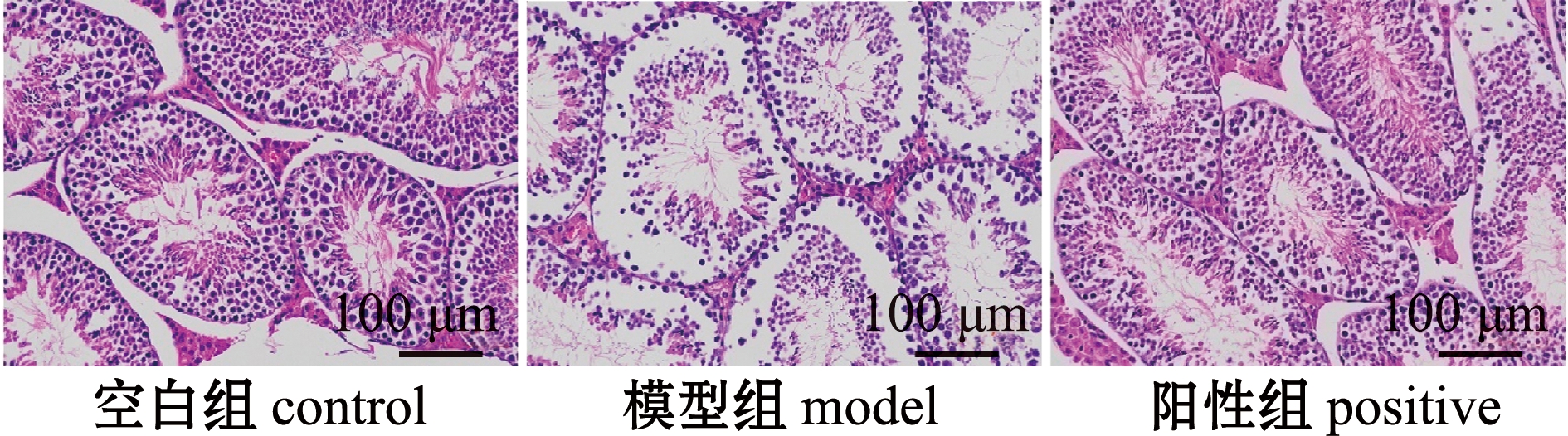

图1 牡蛎酶解产物对小鼠睾丸组织结构的影响(HE染色,200×)
Fig.1 Effects of OEH on testicular histological structure in mice(HE staining, 200×)
2.5 牡蛎酶解产物对小鼠精子质量的影响
从表5可见:模型组小鼠精子数量极显著低于空白组(P<0.01);阳性组和OEH-L组小鼠精子数量虽有增加但与模型组相近(P>0.05);与模型组相比,OEH-M组和OEH-H组精子数量极显著提高(P<0.01),精子数量水平与空白组相近。这表明,中、高剂量OEH能通过改善精子发生,提高小鼠精子数量。从表5还可见:模型组小鼠精子活动率极显著下降(P<0.01),经过阳性药物和OEH治疗后小鼠精子活动率明显提高,中、高剂量OEH能极显著提高精子活动率(P<0.01),且高剂量OEH对精子活动率的改善效果优于中剂量OEH;与空白组相比,模型组精子畸形率明显升高(P<0.01),阳性组和OEH组精子畸形率极显著降低(P<0.01),改善了精子形态。这表明,OEH具有改善小鼠精子质量的作用。
通过染色观察精子形态发现,空白组精子形态完整,而模型组精子出现大量头部缺陷和短尾等畸形精子(图2)。
表5 牡蛎酶解产物对小鼠精子参数的影响
Tab.5 Effects of OEH on sperm parameters in mice
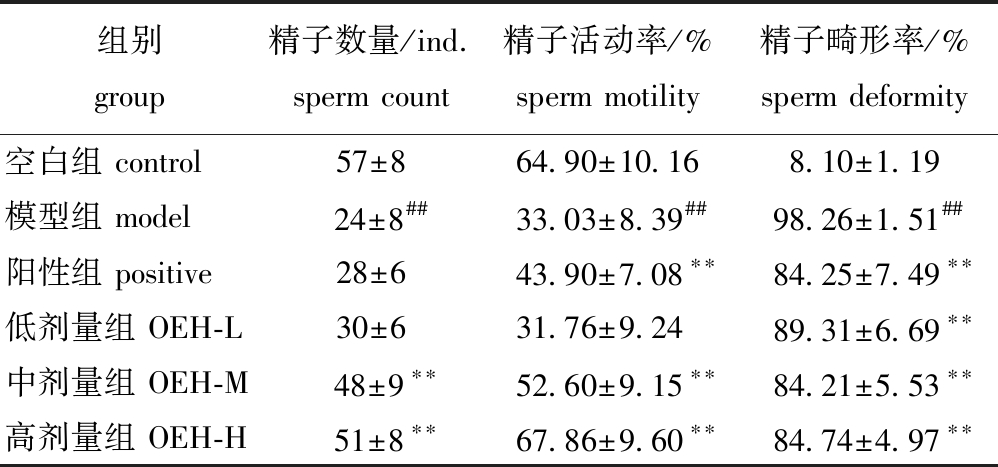
组别 group精子数量/ind. sperm count精子活动率/% sperm motility精子畸形率/% sperm deformity空白组 control57±864.90±10.168.10±1.19模型组 model24±8##33.03±8.39##98.26±1.51##阳性组 positive28±643.90±7.08∗∗84.25±7.49∗∗低剂量组 OEH-L30±631.76±9.2489.31±6.69∗∗中剂量组 OEH-M48±9∗∗52.60±9.15∗∗84.21±5.53∗∗高剂量组 OEH-H51±8∗∗67.86±9.60∗∗84.74±4.97∗∗


图2 牡蛎酶解产物对小鼠精子形态的影响(200×)
Fig.2 Effects of OEH on sperm morphology in mice (200×)
2.6 牡蛎酶解产物对小鼠睾丸组织酶活性的影响
模型组小鼠睾丸中LDH活力极显著降低(P<0.01),阳性组和OEH组LDH活性均极显著提高(P<0.01),且OEH对提高睾丸LDH活性的作用具有剂量依赖性(表6)。模型组小鼠睾丸组织中SOD、CAT、GSH-PX活性极显著降低(P<0.01),MDA含量极显著提高(P<0.01);阳性组CAT活性与模型组相近,而OEH组CAT活性极显著提高(P<0.01);阳性组和OEH组SOD活性均有明显改善(P<0.05),然而低剂量OEH组提高SOD活性的效果优于中、高剂量OEH组;阳性组和OEH组GSH-PX活性均极显著提高(P<0.01);与模型组相比,阳性组和OEH组睾丸组织中MDA含量均极显著降低(P<0.01)(表6)。
2.7 牡蛎酶解产物对小鼠血清激素水平的影响
从表7可见:与空白组相比,模型组小鼠血清中T水平极显著降低(P<0.01),而FSH和LH水平则极显著升高(P<0.01);与模型组相比,阳性组及OEH组小鼠血清T水平极显著提高(P<0.01),而FSH和LH水平极显著降低(P<0.01)。这表明,经过阳性药物和OEH治疗后,均可有效改善TP药物诱导的激素异常现象,使各组小鼠血清中T、FSH和LH水平恢复至与空白组相近。
表6 牡蛎酶解产物对小鼠睾丸组织酶活性的影响
Tab.6 Effects of OEH on enzyme activity in testicular tissue in mice
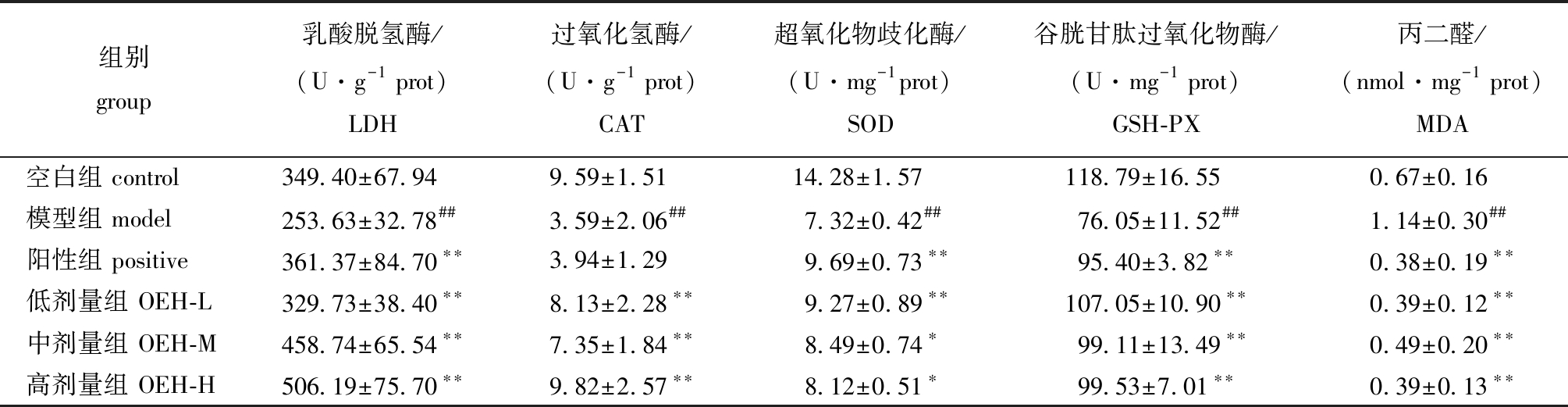
组别group乳酸脱氢酶/(U·g-1 prot)LDH过氧化氢酶/(U·g-1 prot)CAT超氧化物歧化酶/(U·mg-1prot)SOD谷胱甘肽过氧化物酶/(U·mg-1 prot)GSH-PX丙二醛/(nmol·mg-1 prot)MDA空白组 control349.40±67.94 9.59±1.51 14.28±1.57 118.79±16.55 0.67±0.16 模型组 model253.63±32.78##3.59±2.06##7.32±0.42##76.05±11.52##1.14±0.30##阳性组 positive361.37±84.70∗∗3.94±1.299.69±0.73∗∗95.40±3.82∗∗0.38±0.19∗∗低剂量组 OEH-L329.73±38.40∗∗8.13±2.28∗∗9.27±0.89∗∗107.05±10.90∗∗0.39±0.12∗∗中剂量组 OEH-M458.74±65.54∗∗7.35±1.84∗∗8.49±0.74∗99.11±13.49∗∗0.49±0.20∗∗高剂量组 OEH-H506.19±75.70∗∗9.82±2.57∗∗8.12±0.51∗99.53±7.01∗∗0.39±0.13∗∗
表7 牡蛎酶解产物对小鼠血清激素的影响
Tab.7 Effects of OEH on serum hormone concentrations in mice
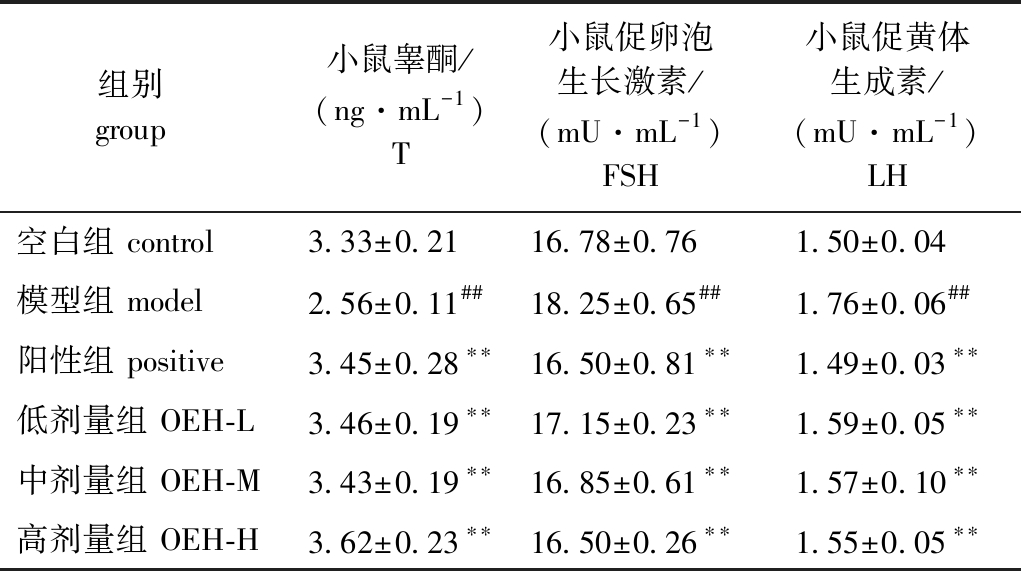
组别 group 小鼠睾酮/(ng·mL-1)T小鼠促卵泡生长激素/(mU·mL-1)FSH小鼠促黄体生成素/(mU·mL-1)LH空白组 control3.33±0.21 16.78±0.76 1.50±0.04 模型组 model2.56±0.11##18.25±0.65##1.76±0.06##阳性组 positive3.45±0.28∗∗16.50±0.81∗∗1.49±0.03∗∗低剂量组 OEH-L3.46±0.19∗∗17.15±0.23∗∗1.59±0.05∗∗中剂量组 OEH-M3.43±0.19∗∗16.85±0.61∗∗1.57±0.10∗∗高剂量组 OEH-H3.62±0.23∗∗16.50±0.26∗∗1.55±0.05∗∗
3 讨论
3.1 牡蛎酶解产物营养组成对改善小鼠生精障碍的作用
有研究表明,补充适量支链氨基酸可能具有维持小鼠精子功能和促进睾酮分泌的作用[28],补充精氨酸可改善小鼠精子质量并提高睾酮水平,进而对生殖毒性起到拮抗作用[29]。本试验表明,OEH总氨基酸中含有较高比例的支链氨基酸(18.5%)和精氨酸(7.57%),OEH中高含量的支链氨基酸和精氨酸有利于提高小鼠睾酮水平,从而起到生精的作用。此外,OEH中还具有较高含量的疏水氨基酸,其游离氨基酸中疏水氨基酸占总氨基酸的49.95%,水解氨基酸中疏水氨基酸占总氨基酸的35.41%,高比例的疏水氨基酸有利于与脂类物质相结合,因此,可能促进了OEH与靶器官和靶细胞的相互作用。
锌在人体中含量丰富,同时对维持正常生理生化功能起着重要作用,尤其对男性生殖系统发挥着改善精子形态和调节内分泌系统的重要生理学作用[30]。有研究发现,精液和前列腺中含有高浓度的Zn,其参与多种调控,从精子发生到受精各阶段相关蛋白的构成,发挥着控制精子获能、顶体胞外分泌和提供抗氧化活性等作用[31],而睾丸的发育和雄性激素生成也有赖于一定水平的Zn,可见Zn对男性生殖具有重要作用。本试验测得OEH中Zn含量较高,为(1 879.9±11.11) μg/g,Cu含量同样丰富,为(759.9±15.11) μg/g,Cu是人体必需微量元素,补充足量的Cu可以预防人体多种疾病。因此,OEH中Zn、Cu等微量元素可能是改善小鼠生精功能的功效成分之一。
3.2 牡蛎酶解产物对雄性小鼠睾丸氧化应激的影响
乳酸脱氢酶是一种糖代谢酶,大量存在于生精细胞中并为精子发生、精子活动提供能量[32]。本试验中,OEH能极显著提高睾丸组织中LDH活性,OEH可能通过提高LDH活性改善睾丸能量代谢的途径,促进精子发生提高精子活力。
氧化应激通过诱导睾丸间质细胞、睾丸支持细胞和生精细胞凋亡进而导致生精障碍,是男性不育的重要原因之一[10]。本试验中,通过测定小鼠睾丸组织中与清除氧化自由基密切相关的SOD、CAT、GSH-PX活性和氧化应激产生的脂质过氧化物MDA含量,以评估OEH对小鼠睾丸氧化应激的影响,结果表明,雷公藤甲素药物可能通过降低小鼠睾丸组织抗氧化能力导致氧化应激水平升高,从而造成睾丸氧化损伤。而OEH可能通过提高SOD、CAT和GSH-PX活性,提高了小鼠睾丸组织内清除氧化自由基的能力,并抑制睾丸内MDA生成,从而缓解雷公藤甲素药物造成的氧化应激损伤。
3.3 牡蛎酶解产物对雄性小鼠血清激素水平的影响
雄激素属于类固醇物质,具有促进雄性性器官发育、精子发生和维持性欲等作用,是调节雄性生育能力的关键物质,因此,通过衡量雄激素水平可以评估雄性的生育能力[33]。性激素分泌主要由下丘脑分泌GnRH作用于垂体,并刺激垂体分泌FSH和LH,它们分别刺激睾丸支持细胞和睾丸间质细胞分泌T,从而形成完整的“下丘脑-垂体-性腺”的雄性激素分泌过程[6]。本试验表明,雷公藤甲素药物可能通过损伤“下丘脑-垂体-睾丸轴”减少小鼠T分泌,而低T水平经负反馈调节机制刺激下丘脑分泌更多促性腺激素释放激素,并作用于垂体前叶导致小鼠血清中LH和FSH水平升高。而OEH通过保护睾丸组织,维持睾丸正常激素分泌功能,促进小鼠T分泌,进而恢复小鼠血清中LH和FSH水平。这表明,OEH可能通过介导“下丘脑-垂体-性腺轴”调节TP诱导的雄性生精障碍小鼠血清雄激素水平恢复至正常。
4 结论
1)OEH可有效改善由雷公藤甲素药物引起的小鼠睾丸损伤,提高睾丸系数和精管内生精细胞数量;显著提高小鼠精子数量、精子活动率,并显著降低精子畸形率。
2)OEH可提高小鼠睾丸组织酶活性(LDH、CAT、SOD、GSH-PX),降低MDA含量,提高生精细胞能量代谢功能和抗氧化能力,同时恢复小鼠血清激素水平,改善雄性小鼠的生精功能。
3)OEH改善雄性小鼠生精功能障碍的作用效果显著,可为开发牡蛎资源相关功能的保健产品提供科学依据。此外,本研究结果可为中药材雷公藤的临床运用提供新的方案。但OEH成分复杂,仍需对其活性成分进一步分离纯化和深入研究。
[1] VANDER BORGHT M,WYNS C.Fertility and infertility:definition and epidemiology[J].Clinical Biochemistry,2018,62:2-10.
[2] SHARLIP I D,JAROW J P,BELKER A M,et al.Best practice policies for male infertility[J].Fertility and Sterility,2002,77(5):873-882.
[3] AGARWAL A,MULGUND A,HAMADA A,et al.A unique view on male infertility around the globe[J].Reproductive Biology and Endocrinology,2015,13:37.
[4] SUN H,GONG T T,JIANG Y T,et al.Global,regional,and national prevalence and disability-adjusted life-years for infertility in 195 countries and territories,1990-2017:results from a global burden of disease study,2017[J].Aging,2019,11(23):10952-10991.
[5] BISHT S,FAIQ M,TOLAHUNASE M,et al.Oxidative stress and male infertility[J].Nature Reviews Urology,2017,14(8):470-485.
[6] 施长春,白文俊.睾丸生精功能障碍的促生精治疗[J].中国男科学杂志,2020,34(3):59-62.
SHI C C,BAI W J.Treatment of testicular spermatogenic dysfunction by promoting spermatogenesis[J].Chinese Journal of Andrology,2020,34(3):59-62.(in Chinese)
[7] NETO F T L,BACH P V,NAJARI B B,et al.Spermatogenesis in humans and its affecting factors[J].Seminars in Cell & Developmental Biology,2016,59:10-26.
[8] LAFUENTE A.The hypothalamic-pituitary-gonadal axis is target of cadmium toxicity.An update of recent studies and potential therapeutic approaches[J].Food and Chemical Toxicology,2013,59:395-404.
[9] AITKEN R J,SMITH T B,JOBLING M S,et al.Oxidative stress and male reproductive health[J].Asian Journal of Andrology,2014,16(1):31-38.
[10] BARATI E,NIKZAD H,KARIMIAN M.Oxidative stress and male infertility:current knowledge of pathophysiology and role of antioxidant therapy in disease management[J].Cellular and Molecular Life Sciences,2020,77(1):93-113.
[11] WANG B,MA L,TAO X,et al.Triptolide,an active component of the Chinese herbal remedy Tripterygium wilfordii Hook F,inhibits production of nitric oxide by decreasing inducible nitric oxide synthase gene transcription[J].Arthritis and Rheumatism,2004,50(9):2995-2303.
[12] 李波,金伶佳,吴美兰.雷公藤临床应用、毒性及减毒增效研究进展[J].中华中医药杂志,2020,35(7):3539-3541.
LI B,JIN L J,WU M L.Research progress on clinical application,toxicity,attenuation and synergy of Tripterygium wilfordii Hook.F[J].China Journal of Traditional Chinese Medicine and Pharmacy,2020,35(7):3539-3541.(in Chinese)
[13] 宋岏,刘琰,方冰倩,等.雷公藤甲素抗肿瘤作用及其配伍减毒机制的研究进展[J].南京中医药大学学报,2021,37(3):457-464.
SONG Y,LIU Y,FANG B Q,et al.Research progress in antineoplastic mechanism of triptolide and toxicity attenuation by compatibility[J].Journal of Nanjing University of Traditional Chinese Medicine,2021,37(3):457-464.(in Chinese)
[14] 徐颖,樊媛芳,赵元,等.近40年雷公藤生殖毒性研究概述[J].中国中药杂志,2019,44(16):3406-3414.
XU Y,FAN Y F,ZHAO Y,et al.Overview of reproductive toxicity studies on Tripterygium wilfordii in recent 40 years[J].China Journal of Chinese Materia Medica,2019,44(16):3406-3414.(in Chinese)
[15] 薛璟,贾晓斌,谭晓斌,等.雷公藤化学成分及其毒性研究进展[J].中华中医药杂志,2010,25(5):726-733.
XUE J,JIA X B,TAN X B,et al.Chemical constituents of Triptergium wilfordii Hook F and its toxicity[J].China Journal of Traditional Chinese Medicine and Pharmacy,2010,25(5):726-733.(in Chinese)
[16] 王昊,陈亮,叶小云.雷公藤甲素对TM4细胞氧化应激及PI3K/AKT通路的影响[J].北京大学学报(医学版),2018,50(4):607-612.
WANG H,CHEN L,YE X Y.Triptolide induces oxidative stress and apoptosis and activates PI3K/AKT signaling pathway in TM4 Sertoli cells[J].Journal of Peking University (Health Sciences Edition),2018,50(4):607-612.(in Chinese)
[17] MA B,ZHANG J,ZHU Z M,et al.Aucubin,a natural iridoidglucoside,attenuates oxidative stress-induced testis injury by inhibiting JNK and CHOP activation via Nrf2 up-regulation[J].Phytomedicine,2019,64:153057.
[18] 张跃环,王昭萍,喻子牛,等.养殖牡蛎种间杂交的研究概况与最新进展[J].水产学报,2014,38(4):612-623.
ZHANG Y H,WANG Z P,YU Z N,et al.A recent review of interspecific hybridization among cultivated oysters[J].Journal of Fisheries of China,2014,38(4):612-623.(in Chinese)
[19] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2021中国渔业统计年鉴 [M].北京:中国农业出版社,2021.
Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2021 China fisheries statistical yearbook[M].Beijing:China Agriculture Press,2021.(in Chinese)
[20] 林海生,秦小明,章超桦,等.中国沿海主要牡蛎养殖品种的营养品质和风味特征比较分析[J].南方水产科学,2019,15(2):110-120.
LIN H S,QIN X M,ZHANG C H,et al.Comparative analysis of nutritional components and flavor characteristics of cultivated oyster from different coastal areas of China[J].South China Fisheries Science,2019,15(2):110-120.(in Chinese)
[21] WANG Q K,LI W,HE Y H,et al.Novelantioxidative peptides from the protein hydrolysate of oysters (Crassostrea talienwhanensis)[J].Food Chemistry,2014,145:991-996.
[22] PENG Z L,CHEN B B,ZHENG Q S,et al.Ameliorative effects of peptides from the oyster (Crassostrea hongkongensis) protein hydrolysates against UVB-induced skin photodamage in mice[J].Marine Drugs,2020,18(6):288.
[23] 杨发明,林海生,秦小明,等.牡蛎酶解产物促进小鼠皮肤创伤愈合效果研究[J].大连海洋大学学报,2019,34(5):649-655.
YANG F M,LIN H S,QIN X M,et al.Effects of oyster enzymatic hydrolysate on wound healing of mouse skin[J].Journal of Dalian Ocean University,2019,34(5):649-655.(in Chinese)
[24] 张婷,秦小明,章超桦,等.牡蛎酶解产物改善睡眠作用效果研究[J].大连海洋大学学报,2021,36(3):430-436.
ZHANG T,QIN X M,ZHANG C H,et al.Effects of enzymatic hydrolysis products of oyster on sleeping improving[J].Journal of Dalian Ocean University,2021,36(3):430-436.(in Chinese)
[25] 朱国萍,章超桦,曹文红,等.牡蛎酶解产物对小鼠学习记忆的影响[J].广东海洋大学学报,2021,41(4):84-92.
ZHU G P,ZHANG C H,CAO W H,et al.Effect of oyster hydrolysates on ameliorating learning and memory in mice[J].Journal of Guangdong Ocean University,2021,41(4):84-92.(in Chinese)
[26] 张雪妍,秦小明,高加龙,等.牡蛎酶解工艺优化及其酶解产物对小鼠睾酮分泌的影响[J].广东海洋大学学报,2019,39(3):96-102.
ZHANG X Y,QIN X M,GAO J L,et al.Optimization of enzymatic hydrolysis from Crassostrea gigas and effects of its enzymatic hydrolysate on TM3 leydig cells[J].Journal of Guangdong Ocean University,2019,39(3):96-102.(in Chinese)
[27] 张雪妍,秦小明,林海生,等.牡蛎酶解超滤组分对TM4小鼠睾丸支持细胞的氧化损伤保护作用[J].南方水产科学,2021,17(5):118-125.
ZHANG X Y,QIN X M,LIN H S,et al.Protective effect of hydrolyzed ultrafiltration fractions from oyster(Crassostrea hongkongensis) on oxidative damage of TM4 Sertoli cells[J].South China Fisheries Science,2021,17(5):118-125.(in Chinese)
[28] BAHADORANI M,TAVALAEE M,ABEDPOOR N,et al.Effects of branched-chain amino acid supplementation and/or aerobic exercise on mouse sperm quality and testosterone production[J].Andrologia,2019,51(2):e13183.
[29] ZHANG Y F,YANG J Y,MENG X P,et al.L-arginine protects against T-2 toxin-induced male reproductive impairments in mice[J].Theriogenology,2019,126:249-253.
[30] SANTOS H O,TEIXEIRA F J.Use of medicinal doses of zinc as a safe and efficient coadjutant in the treatment of male hypogonadism[J].The Aging Male,2020,23(5):669-678.
[31] KERNS K,ZIGO M,SUTOVSKY P.Zinc:a necessary ion for mammalian sperm fertilization competency[J].International Journal of Molecular Sciences,2018,19(12):4097.
[32] JIANG X W,ZHU C J,LI X S,et al.Cyanidin-3- O-glucoside at low doses protected against 3-chloro-1,2-propanediol induced testis injury and improved spermatogenesis in male rats[J].Journal of Agricultural and Food Chemistry,2018,66(48):12675-12684.
[33] RING J D,LWIN A A,KÖHLER T S.Current medical management of endocrine-related male infertility[J].Asian Journal of Andrology,2016,18(3):357-363.