虾夷扇贝Patinopecten yessoensis属冷水性双壳贝类,原产于日本本州北部与北海道、朝鲜半岛及俄罗斯千岛群岛南部海域[1],自20世纪80年代初引入中国,已成为中国北方海域主要的养殖贝类之一[2-3]。近年来,贝类的细菌性疾病频发,在中国[4]、加拿大[5]和日本[6]等地均有报道。2009年7月,大连广鹿岛养殖虾夷扇贝发生脓疱病(也称脓胞病)并出现大规模死亡,超过80%死亡扇贝闭壳肌上出现脓疱样病变[4]。虾夷扇贝脓疱病的发病特征主要包括闭壳肌有橘色脓疱、壳内侧边缘有褐色沉积、外套膜萎缩和闭壳肌收缩无力等,该病具有病程短、范围广和死亡率高等特点。有学者对虾夷扇贝脓疱病病原菌进行了分离研究:滕炜鸣等[4]在虾夷扇贝闭壳肌脓疱中分离出一株具有致病性的细菌,经鉴定为查氏弧菌Vibrio chagasii;Miku等[5]发现, 弗朗西斯氏菌Francisella halioticida参与了虾夷扇贝脓疱病的形成;Liu等[6]自虾夷扇贝闭壳肌脓疱中分离出灿烂弧菌V.splendidus,并认为其具有一定致病性。然而,仅一种致病菌无法单独诱发脓疱病,虾夷扇贝脓疱病往往是由多种条件致病菌共同作用产生的。目前,对于该病具体的发病机制了解非常有限。
希瓦氏菌属Shewanella隶属于希瓦氏菌科Shewanellaceae,该菌属的细菌多具有产H2S和耐低温等特点,可在不同盐度、温度和大气压强等环境条件中生存和繁殖[7],是人类[8-9]和许多其他生物的潜在病原,在水生动物中也有大量关于希瓦氏菌感染致病的报道,如中华绒螯蟹Eriocheir sinensis[10]、东风螺Babylonia[11]、锦鲤Cyprinus carpio var.Koi[12]和草鱼Ctenopharyngodon idellus[13]等。目前,尚未见关于希瓦氏菌感染虾夷扇贝的报道,其对虾夷扇贝的致病性尚不清楚。
本研究团队于北黄海虾夷扇贝养殖海区采集到患脓疱病的虾夷扇贝个体[14],通过对患病扇贝病灶组织进行细菌分离和培养,发现主要优势菌为科氏希瓦氏菌Shewanella colwelliana,推测其可能为虾夷扇贝脓疱病的主要病原菌之一。本研究中,通过对该菌分离纯化、生理生化试验、药敏试验、溶血试验、人工感染试验和组织病理检验等分析验证了该菌的致病性,以期为虾夷扇贝脓疱病的防控提供科学参考。
1 材料与方法
1.1 材料
试验用患脓疱病虾夷扇贝于2020年9月采集自大连市长海县小长山岛扇贝养殖区,2龄,壳长为(7.0±0.5)cm,体质量为(30.0±5.0)g,于4 ℃下4 h内带回实验室,立即进行优势菌分离和培养。试验用健康虾夷扇贝也采自小长山岛扇贝养殖区,贝龄、壳长及体质量与用于病原菌研究的扇贝个体一致,带回实验室后于9 ℃水温条件下暂养7 d,再升温至16 ℃用于人工感染试验。
1.2 方法
1.2.1 细菌分离与培养 取闭壳肌上有粉橘色脓疱的虾夷扇贝,用无菌海水冲洗3次,取病灶部位充分研磨,使用灭菌2216E液体培养基稀释后划线接种于EA(Eugon Agar)培养基上,16 ℃下恒温倒置培养48 h后,根据菌落形态挑取优势单菌落,经3次以上纯化培养后再次接种于2216E液体培养基中,16 ℃下恒温摇床振荡培养24 h后,将菌液与体积分数为30%的甘油等比混合,于-80 ℃超低温冰箱中保存备用。
1.2.2 细菌鉴定
1)分子测序及比对。选用细菌通用引物扩增菌株的16S rDNA序列,正向引物为27F: 5′AGAGTTTGATCCTGGCTCAG 3′,反向引物为1492R: 5′GGTTACCTTGTTACGACTT 3′。PCR反应体系(共50 μL):基因组DNA(50 ng)2 μL,PCR Mastermix(天根生化科技,北京)25 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 21 μL。PCR反应条件:94 ℃下预变性5 min;94 ℃下变性60 s,55 ℃下退火60 s,72 ℃下延伸2 min,共进行30个循环;最后在72 ℃下再延伸10 min。引物合成及PCR扩增产物由生工生物工程(上海)股份有限公司完成。在EZ BioCloud(https://www. ezbiocloud.net/identify)及GenBank(http://www. ncbi.nlm.nih.gov)中进行多序列比对,应用Blastn对获得的基因片段进行同源性检索,采用MEGA 7.0 软件构建系统进化树。根据分子测序比对结果,选取分离株中同源性最高的菌株(YD-1)用于后续形态特征检查及生理生化鉴定等试验。
2)形态特征观察。取纯化培养的菌落观察并记录单菌落的形状、大小、边缘、表面、隆起形状和透明度等表型特征,挑取新鲜单菌落均匀涂布于滴加了一滴蒸馏水的盖玻片上,待干燥固定后,滴加结晶紫染色1~2 min,水洗;用碘液冲去残水,并用碘液覆盖1 min;滴加体积分数为95%的乙醇,脱色30 s,立即水洗;用番红液复染1~2 min;干燥后在油镜下观察菌株的革兰氏染色结果。取菌株YD-1的保种菌液200 μL加入2216E液体培养基中,于16 ℃恒温摇床上以140 r/min振荡培养24 h,将菌液进行负染,于电镜下观察其外部形态。
3)生理生化鉴定。取菌株YD-1单菌落制成菌悬液,接种至3个API 20NE细菌鉴定试剂条(编号:2106070002)中,为3个平行试验,恒温培养24~48 h,按鉴定操作说明显色并记录结果,根据广州一盒API结果查询系统和《伯杰氏细菌鉴定手册》进行鉴定。
1.2.3 菌株药敏试验 采用K-B药敏纸片扩散法检测菌株YD-1对19种抗菌药物的敏感性。取50 μL浓度约为1×108 CFU/mL的菌悬液,均匀涂布于M-H培养基表面,静置10 min后,在无菌条件下将药敏纸片平铺于培养基表面,28 ℃下倒置培养24 h后观察并测量抑菌圈直径,根据药敏纸片的抑菌范围标准对菌株YD-1药物的敏感性进行判定。每种药物设置3个平行,最终结果取3个平行组抑菌圈直径的平均值。
1.2.4 溶血试验 LB固体培养基经高温灭菌后,待温度降至45~50 ℃时加入体积分数为5%的脱纤维羊血并充分摇匀,迅速倒入透明平板中制成血琼脂培养基,待其凝固后置于4 ℃冰箱中备用。取50 μL活化后的菌液,垂直滴于血琼脂培养基中央,静置10 min后,于16、28、37 ℃恒温培养箱中倒置培养,观察是否有草绿色溶血环出现并测量溶血环直径。每个温度设置3个平行,测量3个平行组溶血环的直径并取其平均值。
1.2.5 人工感染试验 将分离纯化的菌株YD-1接种于2216E液体培养基中,16 ℃下培养24 h,以13 000 r/min离心30 min,去除上清液,用无菌海水重悬并再次离心,重复3次后除去上清液,加入5 mL无菌海水充分混匀,使用无菌海水将细菌原液按1×10-6 、1×10-7 、1×10-8 CFU/mL的浓度进行梯度稀释后,各取0.1 mL稀释菌液涂布于2216E固体培养基上。每个浓度的菌液设置3个平行,28 ℃下培养24 h后,根据活菌计数法计算菌液浓度。
挑选180只活力较好的扇贝个体,9 ℃水温下暂养7 d后,每日升温1 ℃,升至16 ℃后再次暂养7 d,将健康个体随机分为6组,每组30只,养殖于70 L水箱中,期间每日换水50%,每日投喂螺旋藻粉一次。基于前期预试验结果,在正式人工感染试验中,将试验扇贝共分为6组,包括1个空白组、1个对照组和4个注射经无菌海水稀释的不同浓度菌液的试验组。其中,空白组扇贝(B组)为正常养殖无人工注射,对照组扇贝(C组)于闭壳肌注射0.1 mL无菌海水,试验组扇贝分别于闭壳肌注射浓度为3.8×108 CFU/mL(T1组)、3.8×107 CFU/mL(T2组)、3.8×106 CFU/mL(T3组)、3.8×104 CFU/mL(T4组)的菌液各0.1 mL,试验以组内扇贝为重复单元,同一组不再设置重复。试验期间,保持水温16 ℃,每天定时换水、投饵,记录扇贝死亡数量,及时捞出死亡个体并解剖,试验持续7 d。按“1.2.1节”及“1.2.2节”的方法对患病扇贝进行病原菌二次分离和鉴定。采用改良寇氏法[15]计算菌株对扇贝的半数致死浓度(LD50),即
lg(LD50)=Xm-i(∑p-0.5)。
其中: Xm为死亡率为 100% 组的浓度对数值;i为相邻两组对数剂量之差;∑p为各组死亡率之和。
1.2.6 组织病理分析 取人工感染患病的虾夷扇贝闭壳肌、鳃丝及外套膜组织,用Bouin氏液固定 24 h,用梯度乙醇脱水,二甲苯透明,石蜡包埋,使用切片机进行切片,厚度约为5 μm,采用苏木精-伊红染色法(Hematoxylin-Eosinstaining)进行染色。利用光学显微镜观察分析组织病理切片。
2 结果与分析
2.1 扇贝发病症状及细菌分离鉴定
本研究中,用于细菌分离的患脓疱病虾夷扇贝具有外套膜萎缩和脱落、闭壳肌收缩无力、闭壳肌内有粉橘色脓疱、对外界刺激反应迟缓及壳边缘褐色沉积的病征(图1)。

图1 患病虾夷扇贝外观
Fig.1 Appearance of sick Yesso scallop Patinopecten yessoensis
试验共挑取了12个单菌落,经过纯化后分别保种,并命名为YD-1~YD-12。在EA琼脂培养皿上12株分离菌形态相似,菌落呈乳黄色,黏稠状,外表圆润光滑,表面微微隆起,直径为1.0~1.5 mm。在光学显微镜(1 000×)下观察发现,菌体在革兰氏染色后呈红色杆状,为革兰氏阴性菌(图2)。电镜下观察发现,菌体呈杆状,一端具有单生鞭毛(图3)。
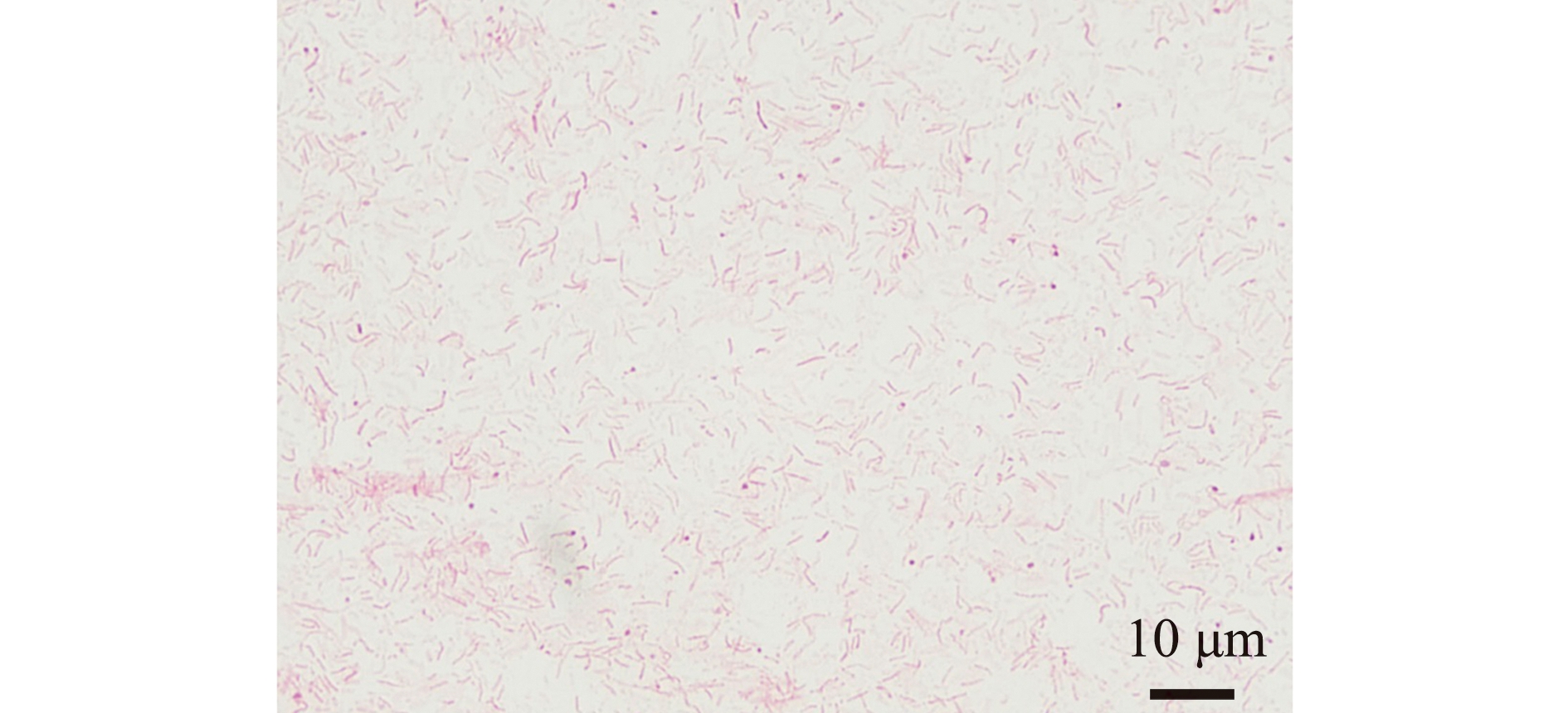
图2 菌株YD-1革兰氏染色
Fig.2 Gram staining results of YD-1 strain
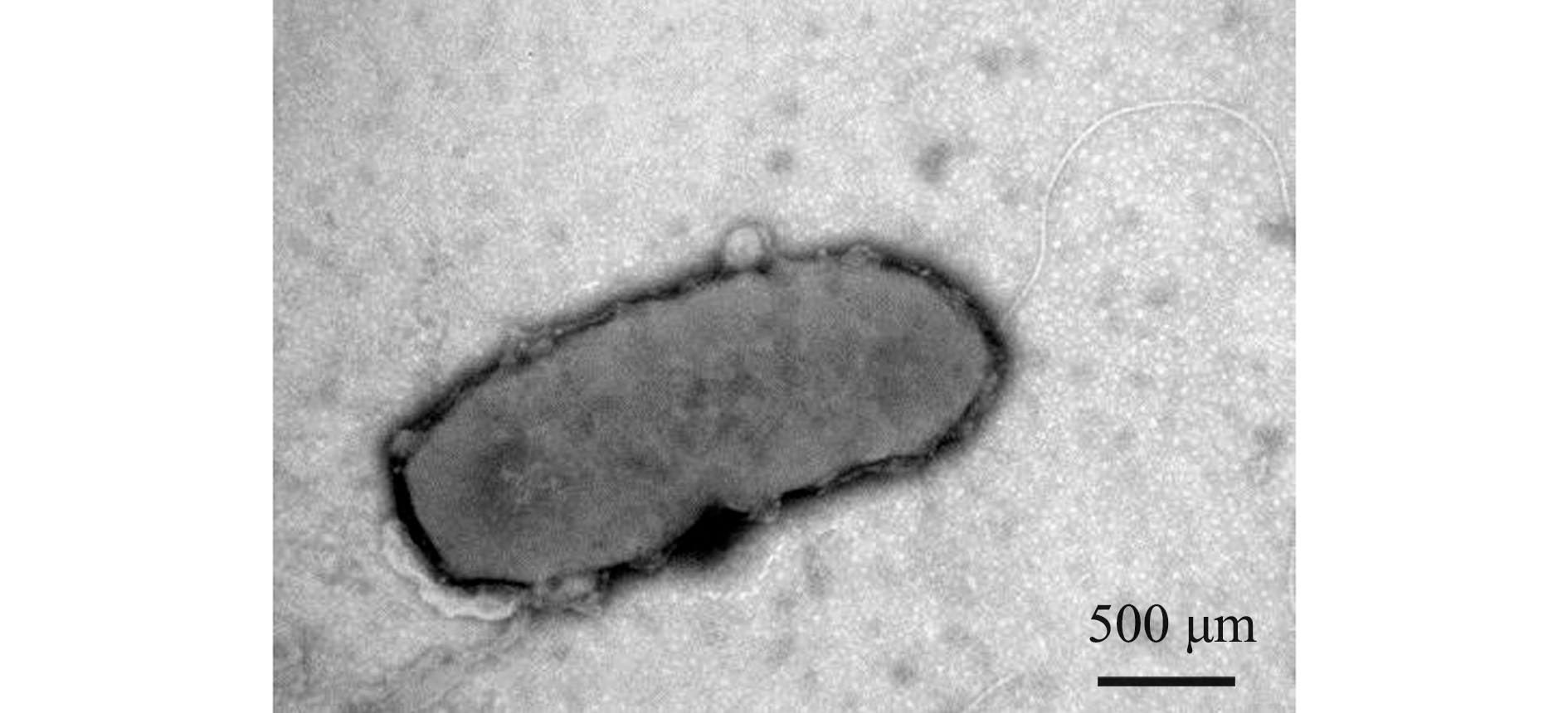
图3 菌株YD-1电镜观察图
Fig.3 Scanning electronic microscope photograph of YD-1 strain
16S rDNA测序及序列比对结果发现,12株优势菌与科氏希瓦氏菌一致性均达95%以上,其中,菌株YD-1的16S rDNA序列与科氏希瓦氏菌一致性达99.86%。选取与科氏希瓦氏菌同源性最高且进化最为清晰的菌株YD-1用于后续研究。系统进化分析显示,菌株YD-1与科氏希瓦氏菌(ATCC 39565)为同一分支,与嗜冷希瓦氏菌Shewanella algidipiscicola NBRC 102032亲缘关系较近(图4)。
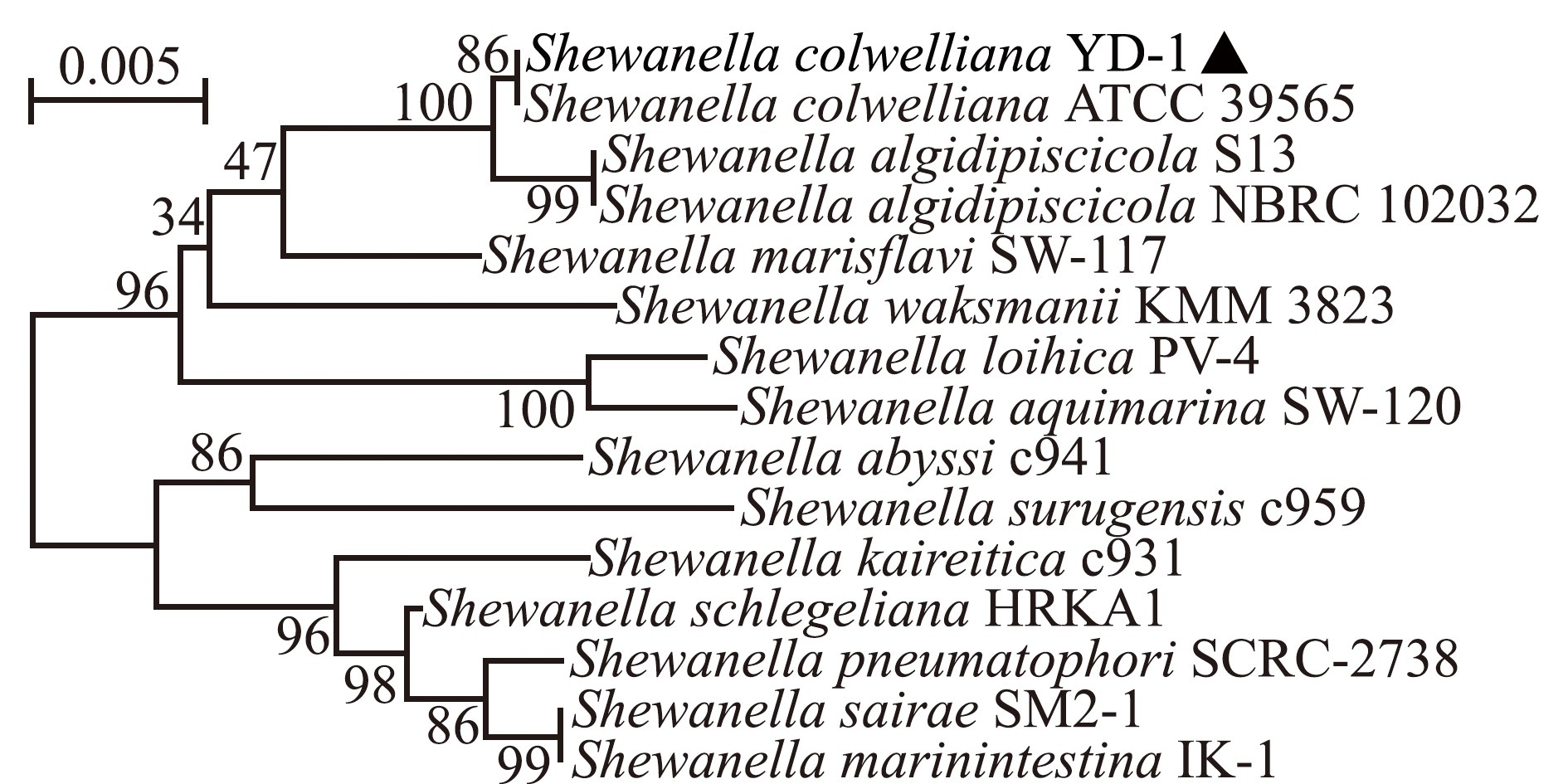
图4 基于菌株YD-1 16S rDNA序列构建的系统进化树
Fig.4 Phylogenetic tree based on 16S rDNA sequence of YD-1 strain
细菌生理生化试验显示,硝酸钾、尿素、明胶、麦芽糖、苹果酸和N-乙酰葡萄糖胺试验为阳性,氧化酶、色氨酸和葡萄糖等试验为阴性(表1)。综合生理生化试验和分子生物学试验结果,判定菌株YD-1为科氏希瓦氏菌。
表1 菌株YD-1的生理生化特性
Tab.1 Physiological and biochemical characteristices indices of YD-1 strain

项目 item菌株 YD-1 strain氧化酶 oxidase—硝酸钾 KNO3+色氨酸 tryptophan—葡萄糖(产气) glucose(gas)—精氨酸 arginine—尿素 urea +七叶灵 esculin—明胶 gelatin+对硝基-β-D-半乳糖 P-nitrophenyl-β-D-galactopyranoside—葡萄糖 glucose—苯乙酸 phenylacetic acid—阿拉伯糖 arabinose—甘露糖 mannose—甘露醇 mannito—麦芽糖 maltose+葡萄糖酸盐 gluconate—癸酸 capricacid—己二酸 adipate—苹果酸 malic acid+N-乙酰葡萄糖胺 N-acetylglucosamine+柠檬酸 citric acid—
注:+,阳性;—,阴性。
Note: +,positive; —,negative.
2.2 菌株药敏试验结果
采用19种常用抗菌类药物进行药敏试验,结果显示,菌株YD-1对青霉素及磺胺异恶唑等耐药,对阿莫西林、氟苯尼考及强力霉素低敏感,对红霉素、四环素和利福平等中度敏感,对氯霉素、阿奇霉素和头孢噻肟等高度敏感(表2)。
表2 菌株YD-1的药物敏感性
Tab.2 Drug sensitivity of YD-1 strain
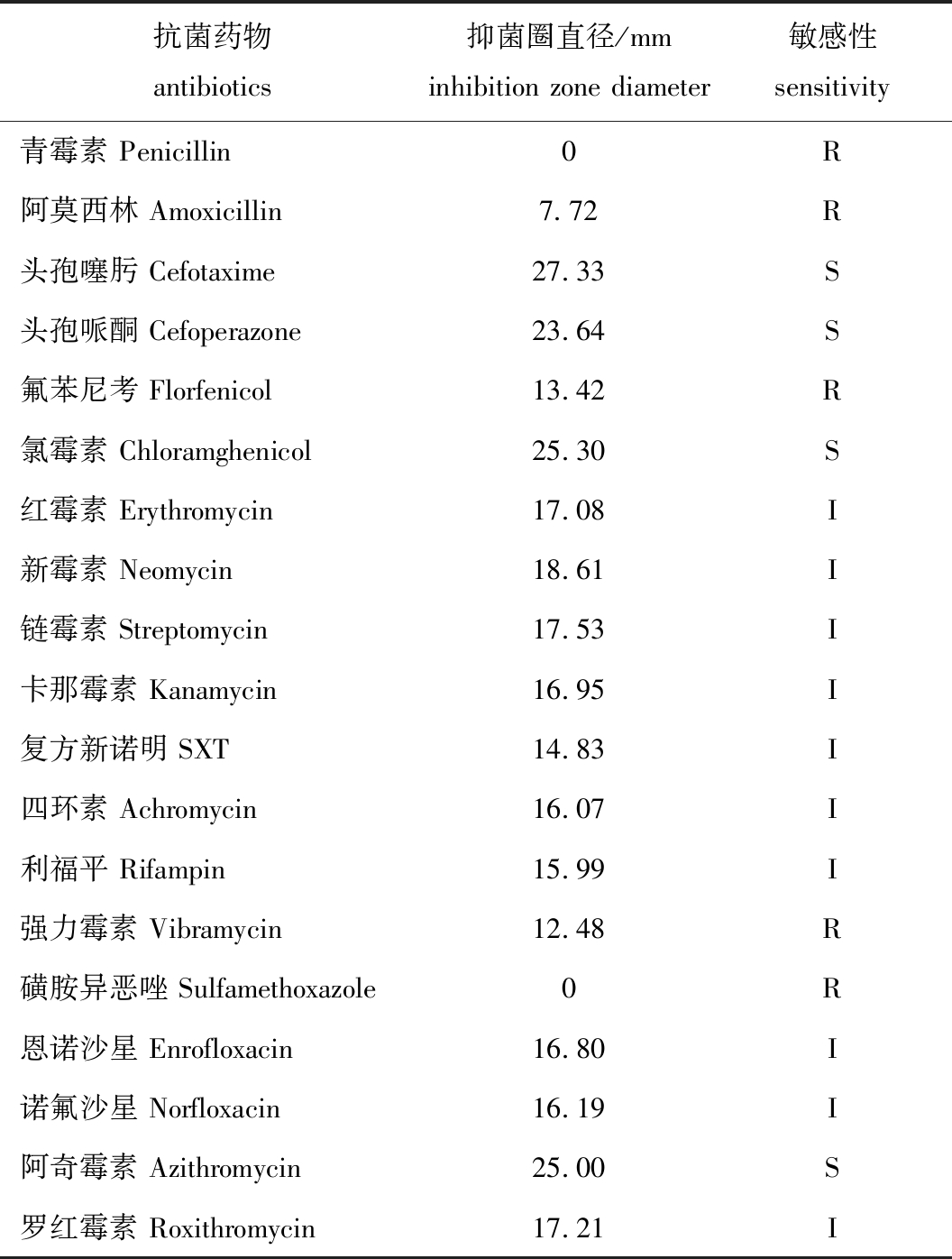
抗菌药物antibiotics抑菌圈直径/mminhibition zone diameter敏感性sensitivity青霉素 Penicillin0R阿莫西林 Amoxicillin7.72R头孢噻肟 Cefotaxime27.33S头孢哌酮 Cefoperazone23.64S氟苯尼考 Florfenicol13.42R氯霉素 Chloramghenicol25.30S红霉素 Erythromycin17.08I新霉素 Neomycin18.61I链霉素 Streptomycin17.53I卡那霉素 Kanamycin16.95I复方新诺明 SXT14.83I四环素 Achromycin16.07I利福平 Rifampin15.99I强力霉素 Vibramycin12.48R磺胺异恶唑 Sulfamethoxazole0R恩诺沙星 Enrofloxacin16.80I诺氟沙星 Norfloxacin16.19I阿奇霉素 Azithromycin25.00S罗红霉素 Roxithromycin17.21I
注:R—低敏感或不敏感;I—中度敏感;S—高度敏感。
Note: R—weak sensitive or resistant; I—moderate sensitive; S—sensitive.
2.3 温度对菌株生长及溶血性的影响
在16 ℃培养条件下,菌株YD-1于4 h后进入对数生长期,于22 h后进入平稳期;在28 ℃培养条件下,菌株YD-1于2 h后进入对数生长期,于24 h后进入平稳期;在37 ℃培养条件下,菌株YD-1于14 h后进入对数生长期,于22 h后进入平稳期。菌株YD-1在28 ℃培养条件下进入对数生长期的时间最短,在37 ℃培养条件下进入对数生长期的时间比16 ℃和28 ℃下明显延长(图5)。
菌株YD-1于16 ℃条件下培养72 h后无溶血现象(图6A),于28 ℃和37 ℃条件下培养72 h后出现溶血现象(图6B,6C),其中,28 ℃培养条件下的溶血现象最为明显。菌液在血琼脂培养基上形成1~2 mm的半透明草绿色溶血环,为α溶血型,也称为部分溶血。
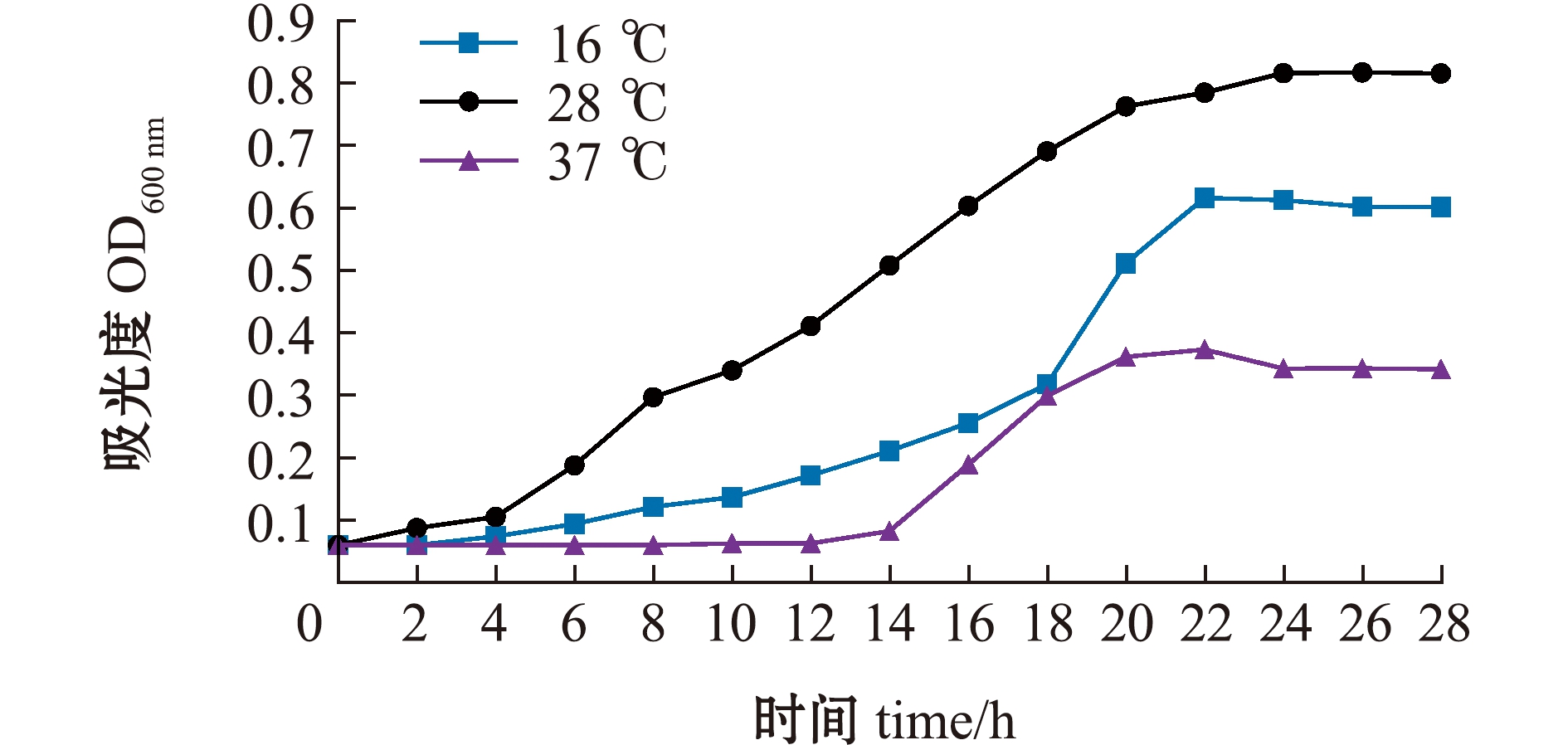
图5 菌株YD-1在16、28、37 ℃培养条件下的生长曲线
Fig.5 Growth curves of YD-1 strain at 16, 28 and 37 ℃
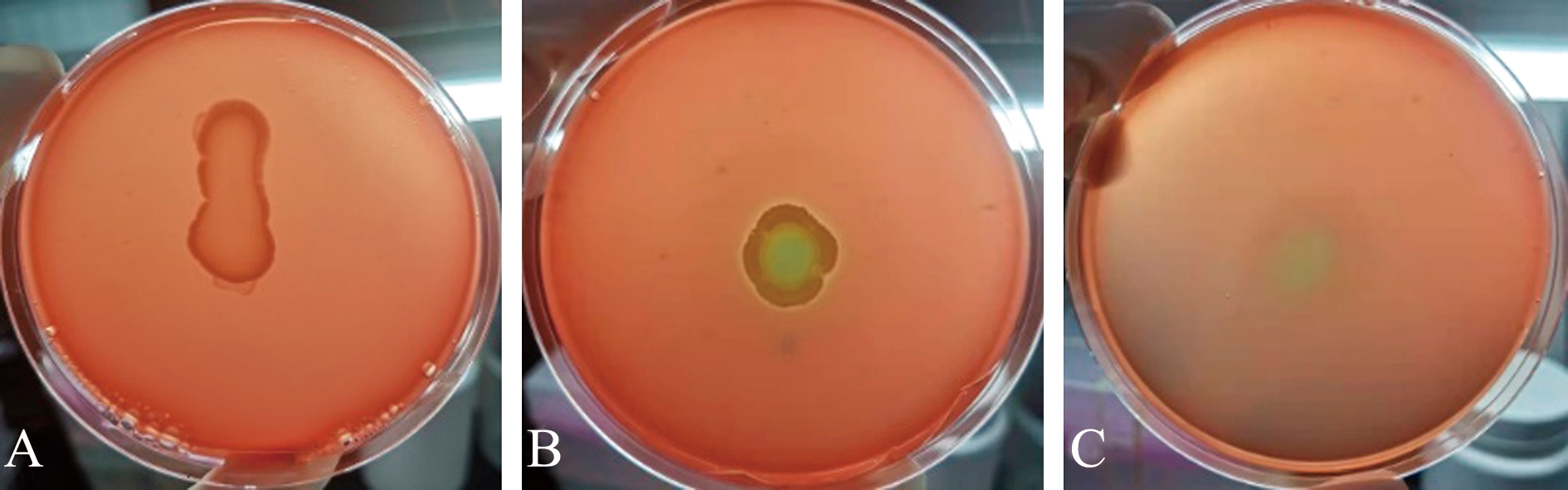
A~C—16、28、37 ℃培养条件下细菌的溶血环。
A-C—the hemolysis results at 16, 28 and 37 ℃, respectively.
图6 菌株YD-1培养72 h后的溶血结果
Fig.6 Hemolysis results of YD-1 strain cultured for 72 h
2.4 人工感染试验结果
注射人工感染试验中,对照组与空白组虾夷扇贝未出现死亡个体,4个试验组扇贝出现死亡个体且平均死亡率为66%。其中,高浓度T1组(3.8×108 CFU/mL)扇贝于24 h内全部急性死亡,无特殊病征;在T2、 T3 和T4试验组中,随着注射浓度的降低,扇贝死亡率逐渐降低(表3)。经改良寇氏法计算,科氏希瓦氏菌对试验组扇贝的半数致死浓度(LD50)为2.08×106 CFU/mL。
解剖人工感染患病虾夷扇贝发现,T2 、T3和T4组扇贝体内均未出现粉橘色的脓疱,但出现了外套膜萎缩脱落、闭壳肌收缩微弱、对外界刺激反应迟缓和壳缘有褐色沉积等病征,这说明,菌株YD-1可引起虾夷扇贝死亡(图7)。对人工感染试验组濒死扇贝进行细菌分离,结果发现,分离菌株具有与菌株YD-1一致的形态特征及生理生化特性。

图7 人工感染虾夷扇贝解剖图
Fig.7 Appearance of Yesso scallop Patinopecten yessoensis exposed to the artificial infection
表3 人工感染试验结果
Tab.3 Results of artificial infection
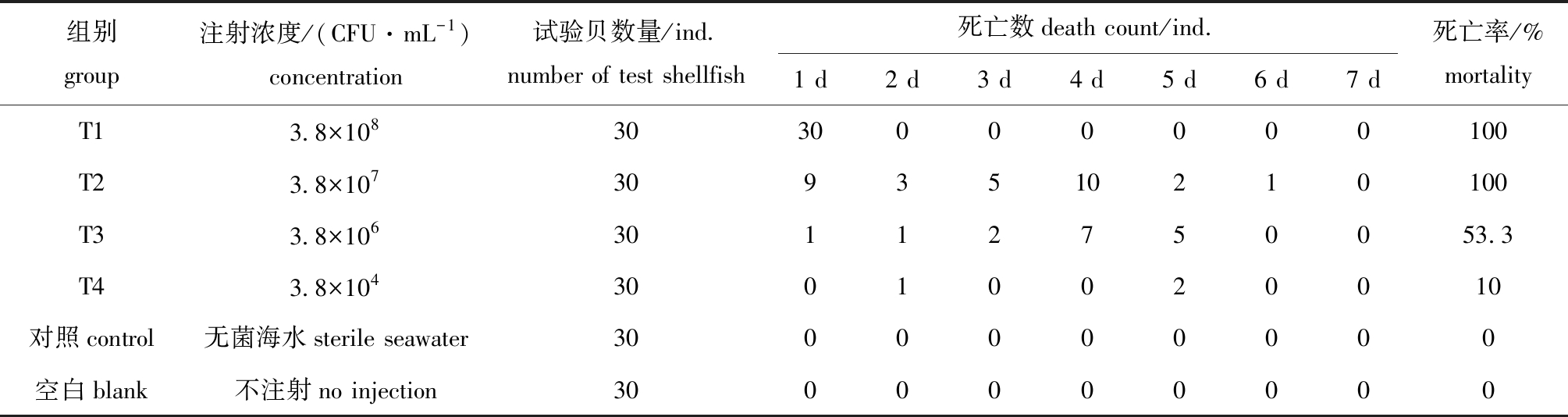
组别group注射浓度/(CFU·mL-1)concentration试验贝数量/ind.number of test shellfish 死亡数death count/ind.1 d2 d3 d4 d5 d6 d7 d死亡率/%mortalityT13.8×1083030000000100T23.8×1073093510210100T33.8×10630112750053.3T43.8×10430010020010对照control无菌海水sterile seawater3000000000空白blank不注射no injection3000000000
2.5 组织病理学特征
组织病理学观察显示,患病扇贝闭壳肌的肌细胞萎缩变形,细胞质浓缩聚集成团块(图8A和8B);外套膜上皮细胞的胞质内发现有大量黄褐色色素颗粒,结缔组织断裂,巨噬细胞萎缩(图8C和8D);病变鳃组织鳃丝变宽,组织内巨噬细胞数量增多(图8E和8F)。
3 讨论
3.1 科氏希瓦氏菌YD-1的生理特性
科氏希瓦氏菌于1986年从美洲牡蛎Crassostrea virginica中被分离发现[16]。在2003—2007年法国大西洋沿岸21个养殖场的长牡蛎C.gigas大规模死亡期间,从死亡长牡蛎体内多次分离到科氏希瓦氏菌,检出率为20%,其参与长牡蛎幼体的致病率达17%[17]。本研究中,从虾夷扇贝脓疱病中分离并确定科氏希瓦氏菌为致病菌,在国内外属首次。
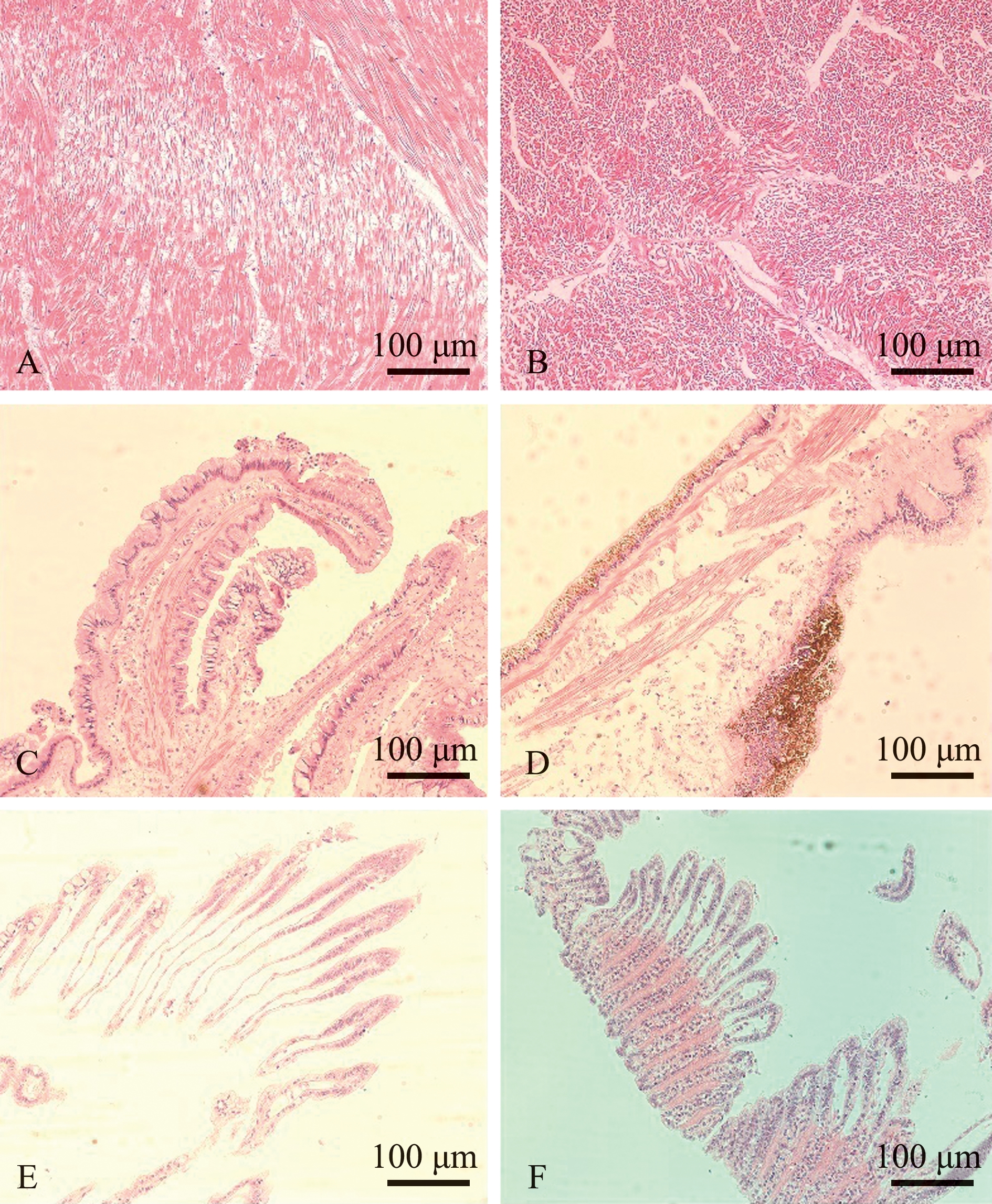
A—对照组闭壳肌(横切);B—试验组闭壳肌(横切);C—对照组外套膜(纵切);D—试验组外套膜(纵切);E—对照组鳃丝(纵切);F—试验组鳃丝(纵切)。
A—adductor muscle in the control group(cross section);B—adductor muscle in the experimental group(cross section); C—the mantle in the control group(longitudinal section); D—the mantle in the experimental group (longitudinal section); E—the gill filaments in the control group (longitudinal section); F—the gill filaments in the experimental group (longitudinal section).
图8 病变组织切片的伊红染色结果
Fig.8 Histological sections of diseased Yesso scallop Patinopecten yessoensis stained with Hematoxylin-Eosinstaining
本研究中药敏试验结果显示,菌株YD-1对氯霉素、头孢噻肟等敏感,对青霉素、氟苯尼考等存在耐药性。已有研究报道显示,不同种类希瓦氏菌的药敏特性不同,如腐败希瓦氏菌S.putrefaciens对美罗培南、链霉素和诺氟沙星等药物敏感,对氨苄西林、复方新诺明等耐药[13];厦门希瓦氏菌S.xiamenensis对阿莫西林、美罗培南和氟苯尼考等药物敏感,对利福平、链霉素和甲氧嘧啶等具有耐药性[11]。耐药性差异的产生可能与希瓦氏菌的种类、分离环境有关,水环境抗生素的违规使用也可能导致病原菌产生耐药性[18]。本研究中的药敏试验结果可为科氏希瓦氏菌防控方法开发提供数据支撑。
溶血活性是辨别细菌溶血素毒性的主要途径之一[19],溶血活性能够导致红细胞溶解,引起局部组织损伤和细菌感染,并产生一系列继发性反应[20]。作为脓疱病潜在致病菌之一的灿烂弧菌于10 ℃时溶血现象最为明显,且该现象随着温度升高逐渐降低[21]。本研究中,菌株YD-1在28 ℃时溶血现象最为明显,且细菌在28 ℃培养条件下进入对数生长期的时间比16 ℃和37 ℃培养条件下短。由此推测,在本研究中所分析的3个温度中,菌株YD-1的最适生长和致病温度均为28 ℃,此时可能对宿主产生较大危害。
3.2 科氏希瓦氏菌YD-1对虾夷扇贝的致病性
本研究中,人工感染患病扇贝的闭壳肌、鳃、外套膜出现了不同程度的组织损伤,与脓疱病部分病征相似,死亡率随感染菌量的增加逐渐升高,4个试验组扇贝7 d内的平均死亡率达66%,而对照组和空白组无死亡,说明科氏希瓦氏菌是参与虾夷扇贝脓疱病发生的重要病原菌。在高浓度菌液(3.8×108 CFU/mL)刺激下,试验扇贝未出现明显症状就于24 h内全部死亡,推测是由于过量刺激所引发的急性应激反应导致的。经改良寇氏法计算,试验组的LD50为2.08×106 CFU/mL,而据以往虾夷扇贝脓疱病病原菌的人工感染试验报道,对健康虾夷扇贝闭壳肌注射0.1 mL浓度为1.05×104 CFU/mL 的灿烂弧菌,7 d后扇贝死亡率接近50%[22];而使用0.1 mL浓度为1.09×105 CFU/mL的查氏弧菌注射虾夷扇贝后,脓疱症状发生率为40%[4]。由此推测,希瓦氏菌对虾夷扇贝的致病能力较灿烂弧菌稍弱,但比查氏弧菌稍强。
本研究中,人工感染患病的虾夷扇贝出现外套膜萎缩脱落、闭壳肌收缩无力、对外界刺激反应迟缓及壳边缘有褐色沉积等症状,与脓疱病部分病征相似,但并不完全一致。在已报道的虾夷扇贝脓疱病致病菌中,人工感染的致病能力及脓疱病的发生率会随温度等条件发生变化,甚至无脓疱病症状。学者通常根据科赫法则(Koch’s postulations)进行病原菌研究,包括从病灶中分离可疑病原体、接种(再次感染试验动物)和再分离3个步骤[22],而接种是验证菌株是否为病原菌及其致病性的重要步骤,但随着对微生物感染的理解日益加深,越来越多的人意识到科赫法则的局限性[23]。疾病的形成归功于复杂的相互作用,即位置因素、宿主因素及毒力基因相结合对生物产生的病理性影响。除去这些复杂的因素外,还需考虑生物体内的正常菌群通过其定植抗性直接或间接阻止病原进入的能力[24]。细菌的致病性取决于宿主的健康状况、环境条件、海水中的细菌数量与理化物质等因素[25]。而人工干预感染过程中无法将这些因素全部重现,这也可能是造成本研究中人工感染后扇贝病征与初次分离时病征不完全吻合的原因之一。据报道,在健康虾夷扇贝幼虫发育至稚贝W5期时,体内希瓦氏菌属占总菌属的比例高达25.95%[26]。由此推测,希瓦氏菌存在于正常虾夷扇贝体内菌群中并长期处于动态平衡状态,当环境改变或细菌入侵导致机体平衡状态被打破时,希瓦氏菌就可参与致病并引起脓疱病的发生。
4 结论
1)本研究从患脓疱病的虾夷扇贝病灶部位分离得到一株科氏希瓦氏菌,该菌株为具有α溶血性的革兰氏阴性杆状菌。
2)科氏希瓦氏菌对虾夷扇贝具有致病性,是虾夷扇贝脓疱病的潜在致病菌。
3)科氏希瓦氏菌对头孢类及大环内酯类抗生素表现较为敏感,此结果可为科氏希瓦氏菌的防控方法的开发提供理论依据。
[1] 孙秀俊,杨爱国,刘志鸿,等.两种壳色虾夷扇贝的RAPD分析[J].渔业科学进展,2009,30(6):110-117.
SUN X J,YANG A G,LIU Z H,et al.RAPD analysis of genetic diversity of Patinopecten yessoensis with different shell colours[J].Progress in Fishery Sciences,2009,30(6):110-117.(in Chinese)
[2] 李大成,刘项峰,李华琳,等.虾夷扇贝生长性状选育的研究现状[J].河北渔业,2019(4):52-53,59.
LI D C,LIU X F,LI H L,et al.An introduction to current research of selection and breeding of Patinopecten yesoensis focus on growth characteristics[J].Hebei Fisheries,2019(4):52-53,59.(in Chinese)
[3] 李文姬,谭克非.日本解决虾夷扇贝大规模死亡的启示[J].水产科学,2009,28(10):609-612.
LI W J,TAN K F.The inspiration on massive mortality of scallop Patinopecten yessoensis resolved by Japan[J].Fisheries Science,2009,28(10):609-612.(in Chinese)
[4] 滕炜鸣,李文姬,张明,等.虾夷扇贝脓疱病病原的分离、鉴定与致病性[J].水产学报,2012,36(6):937-943.
TENG W M,LI W J,ZHANG M,et al.Isolation,identification and pathogenicity of Vibrio chagasii from Patinopecten yessoensis[J].Journal of Fisheries of China,2012,36(6):937-943.(in Chinese)
[5] MIKU K,MAKOTO K,GARY R,et al.Francisella halioticida,identified as the most probable cause of adductor muscle lesions in Yesso scallop Patinopecten yessoensis cultured in southern Hokkaido,Japan [J].Fish Pathology,2018,53(2):78-85.
[6] LIU R,QIU L M,YU Z A,et al.Identification and characterisation of pathogenic Vibrio splendidus from Yesso scallop (Patinopecten yessoensis) cultured in a low temperature environment[J].Journal of Invertebrate Pathology,2013,114(2):144-150.
[7] 商宝娣,杨星,李正友,等.希瓦氏菌的研究进展[J].福建农业,2015(7):152-154.
SHANG B D,YANG X,LI Z Y,et al.Research progress of Shewanella[J].FuJian Agriculture,2015(7):152-154.(in Chinese)
[8] ZONG Z Y.Nosocomial peripancreatic infection associated with Shewanella xiamenensis[J].Journal of Medical Microbiology,2011,60(Pt 9):1387-1390.
[9] OTSUKA T,NODA T,NOGUCHI A,et al.Shewanella infection in decompensated liver disease:a septic case[J].Journal of Gastroenterology,2007,42(1):87-90.
[10] 尹晓静,周静华,王杰.一种中华绒螯蟹病原:腐败希瓦氏菌[J].水产养殖,2019,40(8):45-47.
YIN X J,ZHOU J H,WANG J.A pathogen of Eriocheir sinensis:Shewanella putrefaction[J].Journal of Aquaculture,2019,40(8):45-47.(in Chinese)
[11] LI S F,ZHANG J D,QIU D Q,et al.Biological characteristics and pathogenicities of Shewanella algae and Shewanella abalone from Babylonia[J].Agricultural Science & Technology,2015,16(9):1845-1850,1859.
[12] 苗淼,吕爱军,胡秀彩,等.锦鲤厦门希瓦氏菌的分离鉴定及药敏试验[J].南方农业学报,2018,49(1):172-177.
MIAO M,LÜ A J,HU X C,et al.Isolation,identification and antibiotic susceptibility analysis of Shewanella xiamenensis from Cyprinus carpio var.Koi[J].Journal of Southern Agriculture,2018,49(1):172-177.(in Chinese)
[13] 叶明皓,胡秀彩,吕爱军,等.草鱼致病性腐败希瓦氏菌的分离鉴定及药敏特性研究[J].天津农学院学报,2018,25(4):52-57.
YE M H,HU X C,LÜ A J,et al.Isolation,identification and antibiotic sensitivity of the pathogenic Shewanella putrefaciens from the grass carp Ctenopharyngodon idellus[J].Journal of Tianjin Agricultural University,2018,25(4):52-57.(in Chinese)
[14] YU Z C,LIU C,FU Q,et al.The differences of bacterial communities in the tissues between healthy and diseased Yesso scallop (Patinopecten yessoensis)[J].AMB Express,2019,9(1):148.
[15] 罗明刚.小鼠喹乙醇急性与蓄积性中毒试验研究[D].雅安:四川农业大学,2010.
LUO M G.Researches on olaquindox acute and cumulation toxicological analysis in mice[D].Ya’an:Sichuan Agricultural University,2010.(in Chinese)
[16] WEINER R M,SEGALL A M,COLWELL R R.Characterization of a marine bacterium associated with Crassostrea virginica (the eastern oyster)[J].Applied and Environmental Microbiology,1985,49(1):83-90.
[17] SAULNIER D,DE D S,HAFFNER P,et al.A large-scale epidemiological study to identify bacteria pathogenic to Pacific oyster Crassostrea gigas and correlation between virulence and metalloprotease-like activity[J].Microbial Ecology,2010,59(4):787-798.
[18] LI K,LIU L P,CLAUSEN J H,et al.Management measures to control diseases reported by tilapia (Oreochromis spp.) and whiteleg shrimp (Litopenaeus vannamei) farmers in Guangdong,China[J].Aquaculture,2016,457:91-99.
[19] 陈希,索占伟,许剑琴,等.细菌溶血素的分类及代表性溶血素研究进展[J].中国农学通报,2008,24(8):16-22.
CHEN X,SUO Z W,XU J Q,et al.Review on classification and representative species of hemolysin[J].Chinese Agricultural Science Bulletin,2008,24(8):16-22.(in Chinese)
[20] GADEBERG O V,ORSKOV I,RHODES J M.Cytotoxic effect of an alpha-hemolytic Escherichia coli strain on human blood monocytes and granulocytes in vitro[J].Infection and Immunity,1983,41(1):358-364.
[21] LIU R,QIU L M,YU Z A,et al.Identification and characterisation of pathogenic Vibrio splendidus from Yesso scallop (Patinopecten yessoensis) cultured in a low temperature environment[J].Journal of Invertebrate Pathology,2013,114(2):144-150.
[22] GRADMANN C.A spirit of scientific rigour:Koch’s postulates in twentieth-century medicine[J].Microbes and Infection,2014,16(11):885-892.
[23] MOULTON F R.A Symposium on relapsing fever in the Americas [C].American Association for the Advancement of Science,1942:7-9.
[24] ANTONELLI G,CUTLER S.Evolution of the Koch postulates:towards a 21st-century understanding of microbial infection[J].Clinical Microbiology and Infection,2016,22(7):583-584.
[25] 马悦欣,徐高蓉,常亚青,等.大连地区刺参幼参溃烂病细菌性病原的初步研究[J].大连水产学院学报,2006,21(1):13-18.
MA Y X,XU G R,CHANG Y Q,et al.Bacterial pathogens of skin ulceration disease in cultured sea cucumber Apostichopus japonicus(Selenka)juveniles[J].Journal of Dalian Fisheries University,2006,21(1):13-18.(in Chinese)
[26] SUN X Y,LIU J C,LI M,et al.Characterization of bacterial communities associating with larval development of Yesso scallop (Patinopecten yessoensisis Jay,1857) by high-throughput sequencing[J].Journal of Ocean University of China,2016,15(6):1067-1072.