金枪鱼隶属于辐鳍鱼纲Actinopterygll鲭亚目Scombroidei鲭科Scombridae金枪鱼属Thunnus,金枪鱼属共有长鳍金枪鱼T.alalunga、黄鳍金枪鱼T.albacares、黑鳍金枪鱼T.atlanticus、蓝鳍金枪鱼T.maccoyii、大眼金枪鱼T.obesus、大西洋蓝鳍金枪鱼T.thynnus、太平洋蓝鳍金枪鱼T.orientalis和青干金枪鱼T.tonggol 8种[1-2]。金枪鱼作为远洋渔业捕捞的重要组成,是最具商业价值的鱼类之一[3-6]。近年来,金枪鱼的捕捞量持续增加,在2018年达到历史最高,约790万t。这主要是由于西太平洋和中太平洋的金枪鱼捕鱼量增加(2005年为260万t,2018年为350万t),其中,黄鳍金枪鱼约占捕获量的30%[7]。
金枪鱼作为一种快速、连续游泳的大型中上层远洋硬骨鱼类,其游泳习性需要大量氧用于有氧氧化和线粒体ATP生成。鳃作为金枪鱼气体交换的场所,血液在此获得溶解氧并通过血液循环系统输送到全身组织。为获得更多的氧,金枪鱼的鳃进化出诸多特性以促进鳃内的气体交换并进行高效充分的氧吸收,进而满足大量的代谢能量需求[8-10]。一是,金枪鱼的鳃表面积较大,增加了气体交换的面积,使更多的氧能够在鳃器官进行气体交换,以促进后续的新陈代谢。研究表明,金枪鱼的鳃表面积比其他远洋硬骨鱼(如条纹四鳍旗鱼Tetrapturus audax)大一个数量级[11-12]。二是,金枪鱼鳃斜向的血流模式增加了血流通过鳃片层的时间,使气体交换更加充分,同时降低血管阻力,促进对氧的吸收[13-14]。三是,金枪鱼鳃较薄的水-血屏障厚度减少了气体交换的周期,优化了气体转移效率[15-17]。四是,金枪鱼的鳃肌已退化,无法像一般鱼类一样通过开合鳃盖来呼吸,必须靠不停地游动,使新鲜水流通过冲压呼吸(ram ventilate)的方式迅速进入鳃小片,这是金枪鱼进行呼吸的强制性方式。但是,冲压呼吸需要鳃承受高速水流的冲击,为了应对高速水流的冲击和满足金枪鱼对氧的需求,金枪鱼的鳃发生了适应性变化。如金枪鱼鳃中存在鳃丝融合和片层融合,这两种独特的融合使得鳃更加坚硬,支撑着金枪鱼快速游泳时鳃结构的完整[8,13,18]。金枪鱼鳃弓上的鳃丝钙化,进一步增加鳃的硬度,这也是金枪鱼鳃为抵抗高速水流冲击而发生的适应性进化[19-20]。密集的片层结构不仅分散了水流,减少水流对鳃的冲击影响,同时提高了鳃的氧转移效率[21]。此外,鳃水流的方向和鳃小片毛细血管内血液流动的方向相反,这种逆流交换作用保证了接触鳃的水总是在更新,从而提高了金枪鱼鳃的氧交换效率[22]。因此,归纳整理金枪鱼鳃的形态结构和氧供给特征,对进一步认识高速游泳鱼类鳃组织学与高速游泳习性之间的关系具有重要的指导意义。本文中,主要围绕金枪鱼鳃的结构特性与氧供给、冲压呼吸的结构适应和鳃的逆流交换作用等方面,综述了金枪鱼鳃为适应快速游泳的结构适应性,并提出了未来研究发展建议,以期为金枪鱼鳃结构与功能的深入研究提供科学参考。
1 金枪鱼鳃的结构特性和氧供给
金枪鱼是一种快速游泳的中上层硬骨鱼类,一般生活在热带、亚热带及温带约200 m以内的海域[23]。金枪鱼大多数时间都在快速、持续不断地游动,这个过程需要大量的能量供给。因此,获得大量的氧可以促进金枪鱼体内能量的生成并为运动供能。鳃是金枪鱼进行气体交换和获得氧气的场所,金枪鱼在游动时,水流从鳃进入,水中溶解氧在鳃小片间扩散,并通过鳃上皮细胞进入毛细血管中,随血液运输到全身[24-25]。金枪鱼为增强鳃的气体交换进而获得大量的氧气作为代谢能量原料,进化形成了一些独特的结构和功能特性,如鳃的形态、较大的鳃表面积、较高的片层密度、斜向的血流模式和较薄的水-血屏障厚度等,鳃的这些特性相互协作,提高了金枪鱼鳃对水中溶解氧的吸收效率[9-10,26]。
1.1 鳃形态
与大多数硬骨鱼类的鳃一样,金枪鱼的鳃由位于咽部后端两侧的4对全鳃组成,每对全鳃包含鳃丝、鳃弓和鳃耙3部分[27](图1)。每个鳃弓支持两排鳃丝,鳃丝从鳃弓基部向外延伸,一对鳃弓上的两排鳃丝形成一个全息分支。每个单独的鳃丝称为半分支,两个半分支通过延伸每根鳃丝的支撑部分在基部紧密相连。金枪鱼鳃丝存在融合现象,该现象通过增加鳃的硬度来抵抗高速水流的冲击[13,24]。此外,鳃丝两侧依次紧密排列着许多薄片状组织结构,该结构被称为鳃小片,鳃小片作为鳃最基本的结构和功能单位,其表面布满了小坑、间隙、缝隙和小沟等结构,这些结构扩展了鳃的表面积,使氧气扩散距离缩小,最终使血液和水流间的气体交换有效而迅速地进行[8,14]。
1.2 鳃表面积
鳃表面积指的是鱼类鳃呼吸上皮的面积,由鳃丝和鳃小片面积构成,可通过测量计算出鳃表面积,较大的鳃表面积能提供较大的呼吸表面,并使足够的水流流经呼吸表面,从而促进鳃的气体交换。鳃表面积主要与鳃丝结构、鱼体质量和能量代谢等密切相关。
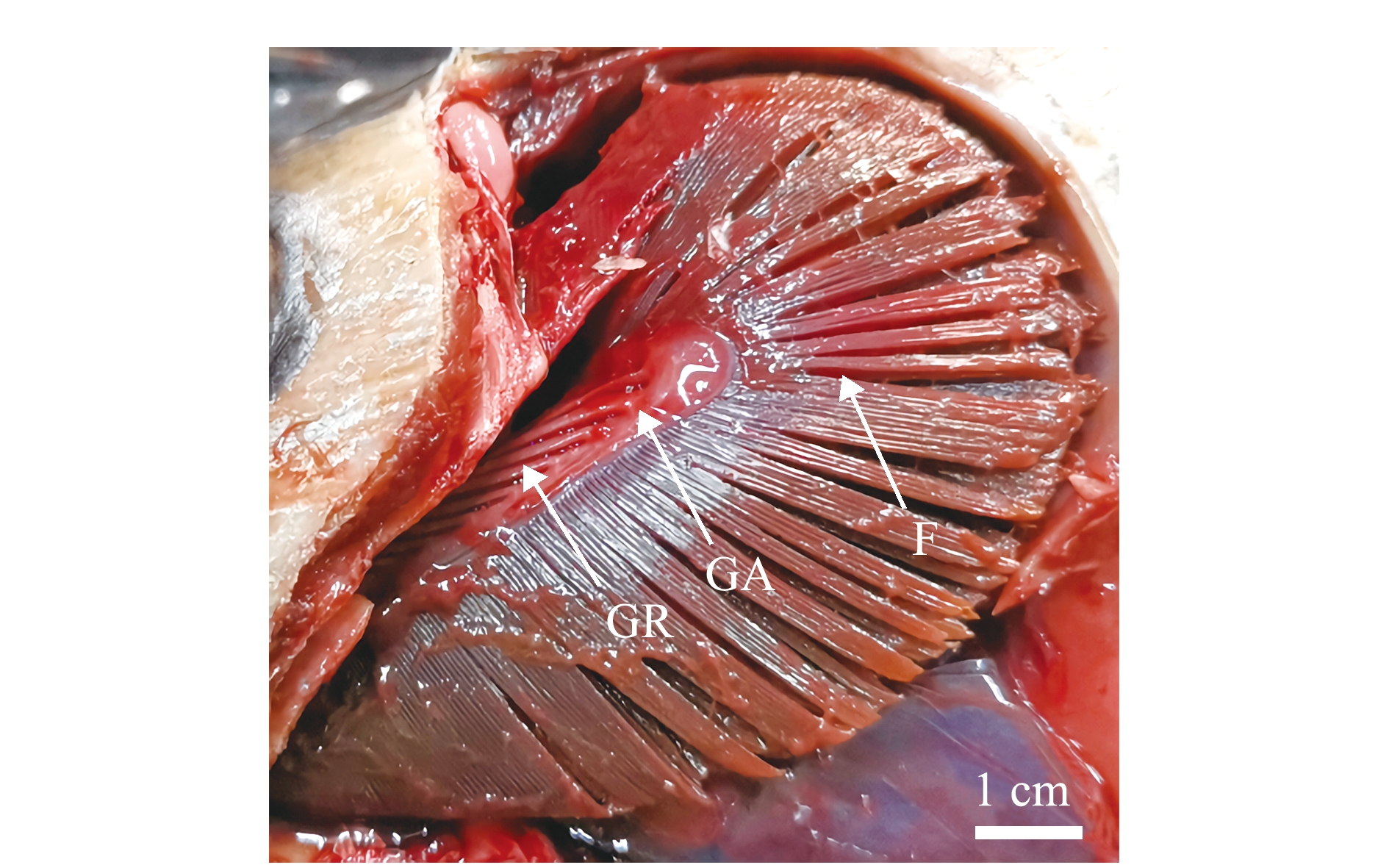
F—鳃丝;GA—鳃弓;GR—鳃耙。
F—filament; GA—gill arch; GR—gill raker.
图1 青干金枪鱼的鳃
Fig.1 Gills of Longtail tuna Thunnus tonggol
1)鳃表面积与鳃丝、片层的关系。对于金枪鱼和其他多数快速游泳的硬骨鱼类来说,鳃的表面积通常由大量的长鳃丝和较高的片层密度决定。金枪鱼的鳃通常具有较高的片层密度(>30片/mm),而中等活动的鱼类如大青鲨Prionace glauca等的片层密度为15~25片/mm,长鳃丝和较高片层密度相互协作,使金枪鱼鳃的表面积大大增加[14]。
Muir等[11]1969年建立了鳃表面积(A,mm2)的计算公式A=Lfil×2nlam×Alam。其中,Lfil为所有鳃丝的总长度(mm);nlam为片层密度,即鳃丝一侧每单位长度的平均片层数量(片/mm);Alam为片层的平均两侧表面积(mm2)。由此可见,鳃的表面积主要与鳃丝长度、片层密度和片层平均两侧的表面积有关。
相对于剑鱼Xiphias gladius等其他快速游泳海水鱼类,金枪鱼和鲣Katsuwonus pelamis的鳃表面积较大(表1)。金枪鱼鳃表面积较大,主要由较长的鳃丝总长度和较高的片层密度所决定。
2)鳃表面积与体质量的关系。鳃的表面积与体质量呈正相关,Muir等[11]研究得出,黄鳍金枪鱼、蓝鳍金枪鱼鳃表面积(A,mm2)和体质量(W,g)之间的线性回归方程为A=31.5W0.86。该方程的回归系数为0.86,而大多数硬骨鱼类耗氧量与体质量之间的回归系数为0.81,这间接地说明金枪鱼的鳃表面积与氧消耗有关,较大表面积的鳃有助于获得更多的氧,有利于能量的生成[28]。
3) 鳃表面积与能量代谢的关系。硬骨鱼类鳃表面积与代谢需求间存在相关性。如黄鳍金枪鱼鳃表面积为1 327 mm2/g时,标准代谢率(standard metabolic rate,SMR)为286 mg O2/(kg·h)[13];东太平洋狐鲣Sarda chiliensis鳃表面积为 933 mm2/g时,SMR仅为161 mg O2/(kg·h)[30];日本鲐Scomber japonicus与东太平洋狐鲣的SMR相似,也为161 mg O2/(kg·h)[31],这说明鳃表面积与SMR呈正相关关系,金枪鱼鳃表面积越大,其SMR就越大。因此,可以利用鳃表面积来估计SMR,并获取相关数据参数。此外,SMR与鳃表面积间的相关性会受到一些其他环境因素的影响。如大眼金枪鱼经常进入低氧环境中捕食和生活,对低氧环境中氧气的利用使得其鳃表面积比其他金枪鱼大,但大眼金枪鱼的SMR与其他金枪鱼相似[10,26]。此外,SMR与鳃表面积的关系也会随着体质量的变化而变化[32-33]。如黄鳍金枪鱼鳃表面积与体质量的回归系数为0.86,而SMR与鳃表面积的回归系数为0.57(回归方程为SMR=286.8W0.573)[32-34]。因此,Hughes等[35]提出,鳃表面积的大小与常规代谢率或活跃代谢率更相关,该估算适用于快速且连续不断游泳的金枪鱼。
表1 金枪鱼与其他快速游泳鱼类的鳃表面积比较
Tab.1 Comparison of gill surface area between tuna Thunnus and other fast swimming fishes
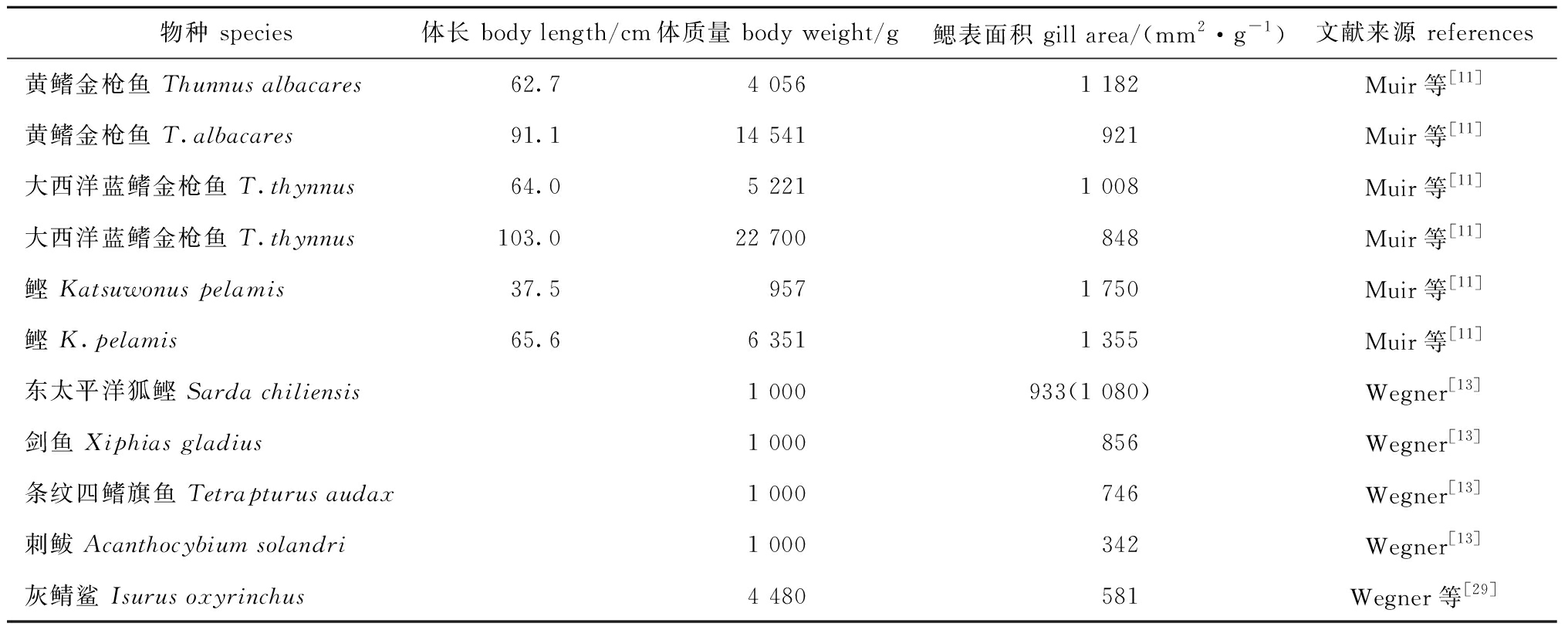
物种 species体长 body length/cm体质量 body weight/g鳃表面积 gill area/(mm2·g-1)文献来源 references黄鳍金枪鱼 Thunnus albacares62.74 0561 182Muir等[11]黄鳍金枪鱼 T.albacares91.114 541921Muir等[11]大西洋蓝鳍金枪鱼 T.thynnus64.05 2211 008Muir等[11]大西洋蓝鳍金枪鱼 T.thynnus103.022 700848Muir等[11]鲣 Katsuwonus pelamis37.59571 750Muir等[11]鲣 K.pelamis65.66 3511 355Muir等[11]东太平洋狐鲣 Sarda chiliensis1 000933(1 080)Wegner[13]剑鱼 Xiphias gladius1 000856Wegner[13]条纹四鳍旗鱼 Tetrapturus audax1 000746Wegner[13]刺鲅 Acanthocybium solandri1 000342Wegner[13]灰鲭鲨 Isurus oxyrinchus4 480581Wegner等[29]
1.3 鳃小片
鳃小片是鳃丝两侧的横向褶皱,其在鳃丝上规则排列,褶皱形态使鳃表面积最大化,矩形状的鳃小片使扩散距离最小化,允许血液和水流间有效且快速地进行气体交换。此外,鳃小片还是鳃抵御水流冲击的主要部位。硬骨鱼类的鳃小片形状大致可以分为两类:大多数硬骨鱼类具有典型的半圆形或三角形的鳃小片结构;少数快速游泳的海洋硬骨鱼(如金枪鱼)具有矩形的鳃小片结构[14,24](图2)。其中,矩形片层结构可显著地减小鳃小片的厚度,有助于形成极薄的片层,如金枪鱼鳃小片的厚度只有5~6 μm,较薄的片层可以增加片层密度、增大鳃表面积和减小片层通道间的生理死角,极大地降低气体交换过程中的阻力[13-14]。此外,金枪鱼的鳃小片具有较高的横纵比(鳃小片的长是高的7倍左右),这样的结构能更好地抵御水流的冲击,也使鳃丝之间紧密相连[25]。
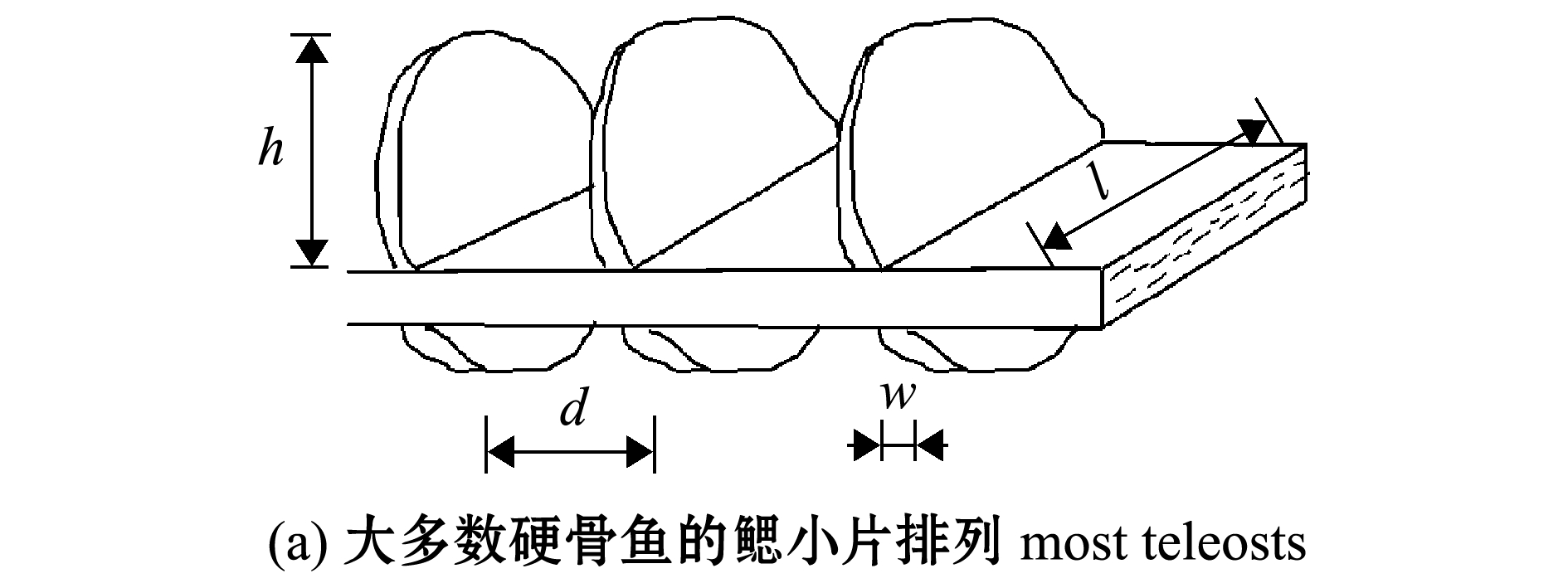
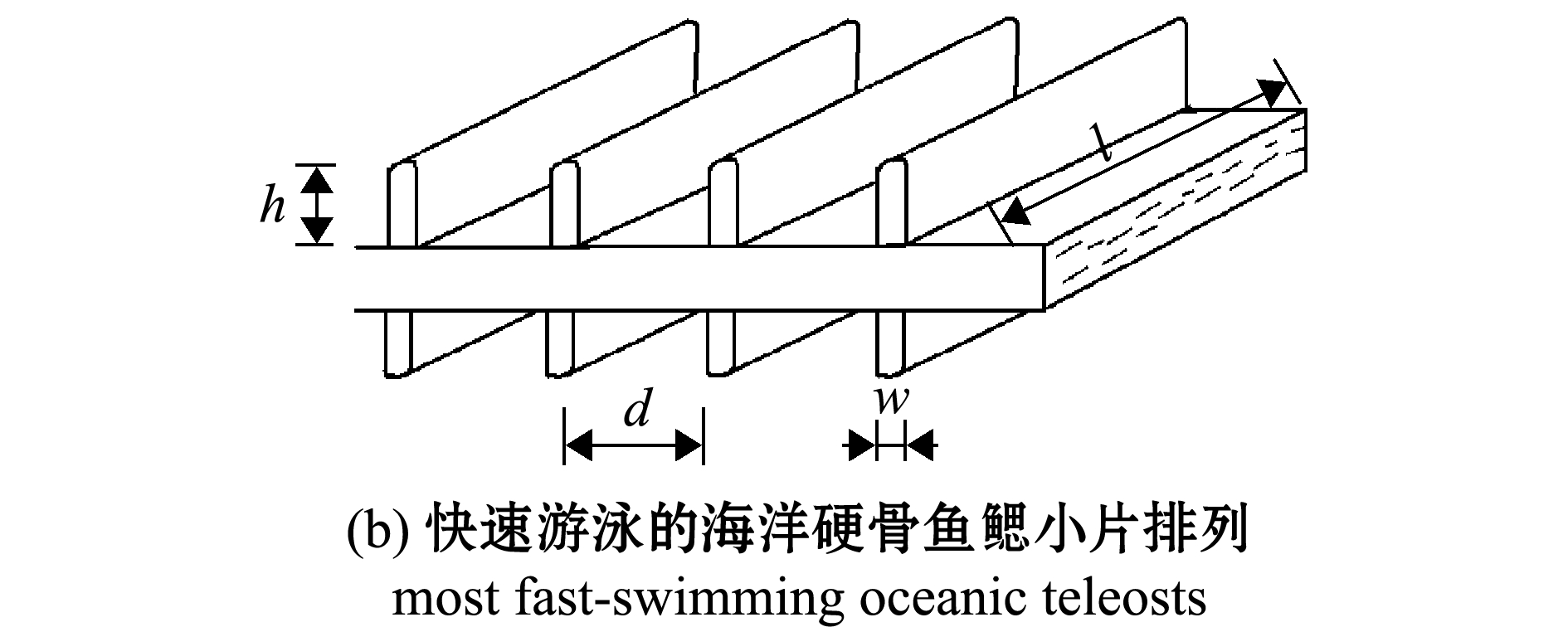
h—鳃小片高度; l—层间通道长度;d—通道直径/宽度;w—鳃小片厚度。
h—lamellar height; l—lamellar length; d—interlamellar channel diameter/width; w—lamellar thickness.
图2 鳃小片的典型排列和形状
Fig.2 Typical arrangement and shape of the gill lamellae
1.4 血流模式
金枪鱼和其他一些快速游泳的海洋硬骨鱼类(东太平洋狐鲣)具有的层状斜向血流模式(图3),明显不同于其他硬骨鱼类(较慢游泳鱼类)的层状血流模式[15]。金枪鱼和这些快速游泳海洋硬骨鱼类的鳃小片的片层斜向血流角与血液在交换表面的停留时间、气体转移所需的时间之间紧密匹配,使血管内的阻力最小化,以促进气体交换,增强鳃的呼吸功能[15-16]。
黄鳍金枪鱼的血流模式如图3A所示,首先进入黄鳍金枪鱼片层的血液沿着片层侧面延伸的外缘通道(outer marginal channels,OMCs)进入片层,然后以相对于片层长轴40~60°的角度斜穿过片层,穿出片层的血液由内缘通道(inner marginal channel,IMC)汇集,输送到传出片层小动脉,最后由血液输送到背主动脉进行全身循环,完成一次血液输送和气体交换[13]。体质量为4.3 kg的黄鳍金枪鱼的斜向血流角为(48.5±10.3)°,体质量为0.2~1.9 kg的东太平洋狐鲣的斜向血流角为(31.9±6.7)°,体质量为8.0~56.8 kg的条纹四鳍旗鱼的斜向血流角为(36.3±6.7)°[13]。Wegner等[29]通过试验研究了灰鲸鲨Isurus oxyrinchus和大青鲨的鳃结构与功能,发现二者具有类似于黄鳍金枪鱼的斜向层状血流模式,但斜向血流角度要比金枪鱼小许多,21.2 kg的灰鲸鲨斜向血流角为(38.4±6.7)°,大青鲨的斜向血流角度为(28.1±7.2)°。与金枪鱼一样,该血流模式增加了红细胞在片层血管中的停留时间和血红蛋白扩散所需的时间。以上分析均表明,金枪鱼和其他快速游泳的硬骨鱼鳃血液的斜行方向降低了片层血管阻力,使气体交换更加充分。
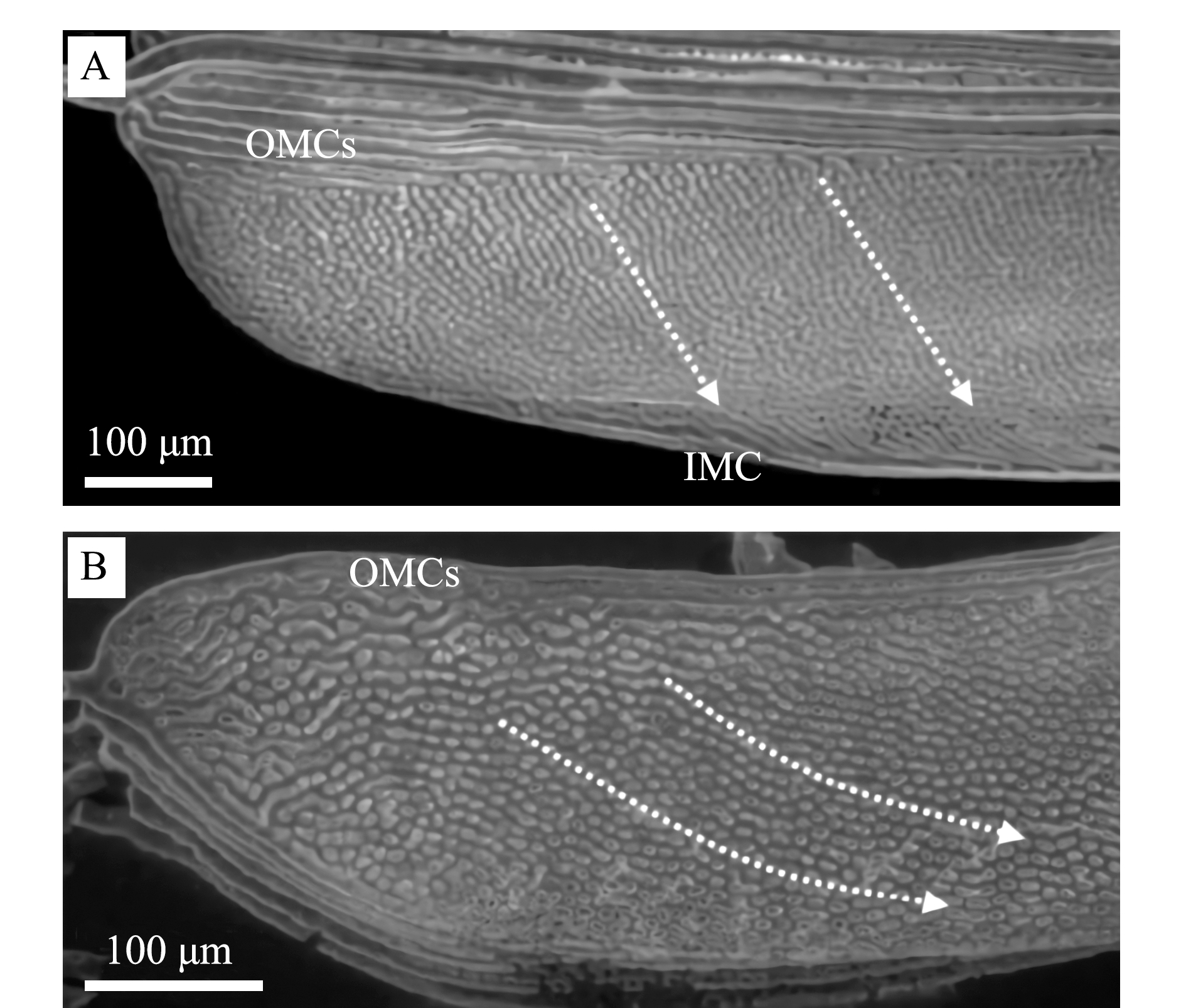
A—黄鳍金枪鱼;B—东太平洋狐鲣;OMCs—外边缘通道; IMC—内边缘通道;虚线箭头表示血流途径。
A—yellowfin tuna Thunnus albacares; B—eastern Pacific bonito Sarda chiliensis;OMCs—outer marginal channels; IMC—inner marginal channel; dotted arrows indicate the pathway of blood flow.
图3 4.2 kg黄鳍金枪鱼和1.87 kg东太平洋狐鲣鳃小片的血流模式图[13]
Fig.3 Microvascular-cast gill lamellae from a 4.2 kg yellowfin tuna Thunnus albacares and a 1.87 kg eastern Pacific bonito Sarda chiliensis[13]
1.5 水-血屏障
金枪鱼的氧交换效率与鳃小片上水-血屏障厚度有关,矩形的片层结构缩短了鳃小片上皮与血管通道间的距离,形成了较薄的水-血屏障,进而增加了氧交换的频率。鳃对氧的吸收需要通过层间水流、水-血屏障和血液进行扩散,然后通过红细胞膜与血红蛋白结合,在这个过程中,从水中到血液的扩散距离是决定氧吸收速率的一个关键因素[24-25]。扩散距离又主要取决于沿片层上皮发展的边界层厚度及其他与水流有关的条件,因此,一般情况下扩散距离主要指水-血屏障的厚度。
水-血屏障主要包括鳃小片上皮细胞、基底膜和柱状细胞的凸缘部分,水-血屏障厚度可通过光学显微镜或者扫描、透射电子显微镜观察测量来确定[14,35]。黄鳍金枪鱼的水-血屏障厚度为0.17~1.13 μm,而其他海洋硬骨鱼类,如鲣的水-血屏障厚度为0.24~1.91 μm,大西洋鲐Scomber scombrus的水-血屏障厚度为0.60~3.63 μm;对于中等活跃的海洋鱼类,如大青鲨、大黄鱼Larimichthys crocea,其水-血屏障厚度一般为1.50~6.00 μm;而生活在深海处的鱼类,如鼬鳚科Ophidiidae、巨口鱼科Stomiidae等的水-血屏障较厚,一般为5.00~6.00 μm[25,35]。由此可见,金枪鱼的水-血屏障厚度较薄。综上所述,金枪鱼鳃相对较薄的水-血屏障厚度极大地缩短了氧的扩散距离,使得水流中的氧能更快地与血红蛋白结合,并通过血红蛋白将氧输送至全身,维持金枪鱼的高代谢需求。
2 冲压呼吸的结构适应
对于快速游泳的金枪鱼来说,失去了主动换气的鳃肌肉组织,而形成冲压呼吸这一强制性的呼吸模式,即在水流的高速冲击下,金枪鱼向前游动迫使水流流入口腔并通过鳃进行气体交换[9,36-37]。冲压呼吸模式将换气部位由需要消耗能量的肌肉组织转移到鳃,并通过鱼体的快速游动来进行呼吸,使鳃部肌肉的运动最小化[38-40]。在这种情况下,持续的冲压呼吸对鳃有较强的冲击作用,故鳃结构需要适应性改变以保持其空间和结构完整性,即金枪鱼鳃通过片层融合、鳃丝融合、鳃的钙化和最佳片层排列维持鳃结构的完整性[18-19,41]。
2.1 鳃的融合
金枪鱼的鳃小片间存在片层融合(lamellar fusion,LF),即一根鳃丝的鳃小片连接到相邻鳃丝紧密定位的鳃小片上(图4)。融合的鳃小片附近通常伴随着大量的结缔组织,使鳃丝和片层在持续的冲压呼吸水流冲击下不至于散开,并维持鳃结构的完整性[11,14,17,19]。Muir等[19]研究发现,在黄鳍金枪鱼、长鳍金枪鱼、大眼金枪鱼、蓝鳍金枪鱼、鲣和鲔Euthynnus affinis的鳃中均存在片层融合现象,而其他海洋硬骨鱼类,包括刺鲅Acanthocybium solandri、条纹四鳍旗鱼、剑鱼、鲯鳅Coryphaena hippurus和日本鲐则未发现片层融合现象,该研究者认为,片层融合现象似乎仅限于金枪鱼和金枪鱼的近缘物种。Wegner等[17]进一步观察了刺鲅和条纹四鳍旗鱼的鳃小片结构,发现虽然鳃小片未与相邻鳃丝上的鳃小片结合,但鳃丝上并列的鳃小片会结合在一起,这种融合现象称为层间融合(interlamellar fusion,IF)。Wegner[13]在黄鳍金枪鱼中也发现了层间融合现象(图4),鳃丝顶端附近的并列鳃小片绝大部分都发生了融合。进一步研究发现,金枪鱼鳃的融合并非在鳃丝和鳃小片形成时就存在,鳃的片层融合有一个逐渐发育的过程。对黄鳍金枪鱼仔鱼生长发育的研究发现,体长生长到3.3 mm时鳃小片出现,但未发现片层融合;体长生长到24.5 mm时,在鳃丝顶端观察到层间融合,融合部分向鳃丝顶端弯曲,且缓慢接近相邻的鳃丝;体长生长到30 mm左右时,层间融合生长紧密靠近,出现片层融合现象,一旦融合形成,直至成鱼也不会发生太大的变化[13,42]。金枪鱼鳃的片层融合和层间融合相互支撑,使鳃小片质地变得坚硬,以防止快速游泳时片层变形。
此外,金枪鱼的鳃具有由丝状黏膜上皮延伸形成的鳃丝融合,片层融合和鳃丝融合支撑了金枪鱼快速游泳时鳃的结构完整性[19]。目前,在黄鳍金枪鱼、黑鳍金枪鱼、大眼金枪鱼、大西洋蓝鳍金枪鱼、太平洋蓝鳍金枪鱼、长鳍金枪鱼和青干金枪鱼7种金枪鱼中均发现了鳃丝融合现象[13,19]。一般来说,当鳃丝发生融合以后,随着个体的发育,鳃丝融合现象不会发生大的变化。鳃丝传出边缘(efferent edge,Ef.E)的鳃丝融合可以覆盖整个鳃丝,而鳃丝传入边缘(afferent edge,Af.E)的鳃丝融合则少数出现在鳃丝尖端附近[18],这可能是由于传入边缘冲击力过强,鳃丝之间较难靠近,而传出边缘需要足够大的缓冲流来进行气体交换。总之,片层融合和鳃丝融合的出现为金枪鱼快速游泳时鳃丝的结构完整提供了必要的支撑。

A—鳃丝顶端附近存在层间融合,两鳃丝层间融合处存在片层融合,而鳃丝底部未出现融合;B—图A中虚线框的放大;C—鳃丝顶端附近存在层间融合,但无片层融合。F—鳃丝,IF—层间融合,LF—片层融合。
A—gill filaments showing interlamellar fusions near the tips that grow together to form complete lamellar fusions,while no fusions are present near the base of the filaments; B—magnified image of dashed box in A; C—gill filaments showing interlamellar fusions near the tips but no lamellar fusions. F—filament, IF—inter-lamellar fusion, LF—lamellar fusion.
图4 3.2 cm体长的黄鳍金枪鱼鳃扫描电镜图片[13]
Fig.4 SEM images of the gill filaments and lamellae of yellowfin tuna Thunnus albacares with body length of 3.2 cm [13]
2.2 鳃的钙化
鳃的钙化也是金枪鱼对冲压呼吸所产生的强对流冲击的适应性进化。金枪鱼鳃丝发生钙化,鳃丝与相邻鳃丝间钙化变硬,以便在高速水流中保持结构的坚固和稳定,避免鳃在高速水流冲击下发生变形[19-20]。在其他物种中也有类似现象,如在刺鱼科Gasterosteidae和鲤Cyprinus carpio中,也有报道称软骨鳃丝基部周围有钙化的“鞘”[43],其中,钙化的鳃丝明显比未钙化的部分坚硬。这种刚性钙化的具体作用尚不十分清楚。对此,Turko等[41]提出两种假说来解释鳃的刚性钙化,一种假说认为,鱼体在进行呼吸活动时,鳃的钙化作用使一根鳃丝顶端和另一根鳃丝顶端相互交错,形成鳃筛,有选择性地使水流从鳃筛的鳃小片间穿过,进行氧的输送;另一种假说认为,鳃丝钙化是一种结构性适应,这种结构支持两栖鱼类离开水面,而鳃丝不会出现崩塌变形。此前Livingston等[44]发现,水陆两栖的鳉Kryptolebias marmoratus鳃丝存在钙化现象,可能是因为鳉占据广泛的生态位,所以需要不同形式的鳃来支持其结构与功能[45-46]。而且两栖鱼类生活的环境极其缺氧,钙化的鳃丝可能促进两栖鱼类获得足够的氧[47]。
为了验证所提出的假说,Turko等[41]用系统发育比较的方法研究了106种鳉形目Cyprinodontiformes鱼类的鳃结构,结果表明,鳉形目中鳃丝钙化情况普遍存在,且在两栖动物和水生动物间无明显差异。此外,他们还证明鳃丝钙化可以增强鳃获得氧的能力。在低氧、高温等环境下,鳉对氧的需求增加,生长在这种环境下的鳉鳃丝有钙沉淀产生;采用温和的方法对鳉钙化的鳃丝进行脱钙,结果表明,鳃对水流的阻力减小,水流不从鳃小片间穿过,减少了鳃对氧的吸收。同鳉一样,金枪鱼钙化的鳃丝可能在抵抗高水流冲击的同时,也增强了鳃对氧的获取。
2.3 最佳片层排列
鱼类的鳃在水生环境中获得水体中的氧。与陆地动物的肺呼吸相比,鳃从水体中获取氧相对困难,一般来说,空气中的含氧量大约为21%,而水体中的含氧量小于0.6%[48-50]。由于氧在水中的溶解度和扩散率均较低,所以,氧转移效率对于鱼体的呼吸器官来说至关重要[51-52]。
1)最佳片层排列对氧转移效率的影响。研究表明,金枪鱼的鳃小片已进化出最佳的片层排列,致密的片层排列为氧转移提供了较大的接触表面积,有利于扩大鳃的氧转移效率,促进鳃对氧的吸收和利用[8,25,53]。在金枪鱼的鳃中,富氧的水通过由鳃小片形成的狭窄通道,水中的氧扩散到毛细血管,故鳃小片的排列对于氧的扩散具有重要作用。当水通过狭窄的片层通道时,在冲压呼吸的一定泵送压力下黏性阻力会增加,增加的阻力会阻碍水体在通道间的流动,而泵送压力会受肌肉力量和游泳速度的限制,泵送压力过高或者过低都会影响水体在片层通道中的流速,进而影响氧转移速率。如何在一定的泵送压力下提高氧转移效率,使鳃更好地抵抗外部压力并发挥功能作用非常重要。Park等[21]研究发现,片层通道中水较高的流速和横纵比所扩展的表面积对氧转移速率起着重要的作用,而扩展的表面积和片层通道的大小由鳃丝单位长度上的片层数量决定。所以,鳃的片层排列对于金枪鱼鳃抵抗压力进而提高氧转移效率十分重要。
2)高片层密度对氧转移效率的影响。对于金枪鱼和其他快速游泳的海洋硬骨鱼类来说,它们通常具有较高的片层密度,可达到30片/mm,金枪鱼的片层密度甚至大于30片/mm,较高的片层密度能够降低鳃对水流的阻力并减少气体交换所需的能量。对于其他鱼类,如中等游泳速度的海洋鱼类的片层密度为15~25片/mm,而深海鱼类鳃的片层密度为7~20片/mm。此外,片层密度通常与鳃表面积成正比,游动活跃的鱼种比不大活跃的鱼种具有更密集的片层排列,也就是说,他们具有更大的鳃表面积[14]。对于片层排列来说,密度太高,层间距离太窄,需要很大的机械动力才能克服阻力使水流通过鳃;如果密度太低,血液通过单个片层的流速加快,血液循环通过片层血管床的机械动力成本会成倍增加,且过宽的层间通道又会使水流快速通过片层,而没有足够的时间使氧与血红蛋白结合。这是因为氧向片层表面扩散相关的区域(扩散边界层)在物理上仅限于与表面相邻的某个区域,如果水流快速且直接流过该区域,则无法实现气体交换[54]。因此,层间距离适中可降低鳃呼吸机械动力成本。Park等[21]在2014年研究发现,不同体质量(6~100 kg)的鱼类,其鳃的片层距离变化不大,片层距离一般为20~100 μm,通过建立模型和样本数据支持,他们发现,鱼类的鳃已经进化出最佳的片层距离,可高效地转移氧。这表明不管是生活在远洋或近海的海水鱼和淡水鱼,鳃的片层距离都不会随着物种的变化有较大的差异。
Kamiya等[55]通过建立成本函数(cost function,CF)来评估鱼鳃片层排列从水体中吸收氧的效率,并推导出最小成本函数处的片层宽度。以虹鳟Oncorhynchus mykiss为例,研究发现,在不同的游泳速度下,鳃对氧的吸收率都超过理论最大值的95%,这说明在不同的游泳速度下,片层通道的吸氧性能几乎是最佳的。此外,对鳃的多维层次结构的研究,有助于更好地理解鳃作为天然最优的气体/溶质分离器官的理由。为此,Kumar等[56]研究了形态参数(片层距离、片层排列、水-血屏障等)和参数比(水-血屏障比、片层距离与血液流速比等)对鱼鳃气体/溶质交换能力的影响,发现这些参数比在0.33时有一个最佳值,以最大化片层间的气体交换,并且这些参数比基本不随鱼体大小的变化而变化。同样地,Park等[21]通过测量也发现,氧转移效率与物种的大小无关。
此外,研究发现,在气体交换过程中水流量对流体力学阻力影响较大。在低流量下,流体阻力保持相对恒定,随流量的增大流体阻力显著减小,这种减少可能是由于压力增加时鳃周围的水分流所致[57-60]。对于快速游泳的金枪鱼来说,致密的片层排列会产生较大的黏性阻力,降低气体交换的效率,但在冲压呼吸的呼吸机制下流体阻力减小,金枪鱼游泳时产生的动态压力驱动水流流入鳃中[61-62]。综上所述,金枪鱼在通过致密的片层排列扩大气体转移效率的同时,利用冲压呼吸所形成的动态压力来减少水体流动的阻力,使金枪鱼能更好地进行呼吸和快速地游动。
3 鳃的逆流交换作用
逆流交换作用体现了金枪鱼鳃器官的气体交换机制,水流经鳃的方向与鳃小片中血流方向相反,最大限度地提高了气体交换效率,也有效地减缓了血液流经鳃时的热量损失。首先,鳃吸收水中的氧,随后氧在鱼鳃中沿着大量有序排列的鳃小片扩散,最后被吸收。每个鳃小片上都覆盖一层薄薄的上皮细胞,片层上包含致密的毛细血管网[15]。当金枪鱼在进行气体交换时,富氧的水在鳃小片间的狭窄通道流动,水中的溶解氧通过鳃小片上皮扩散到毛细血管中,毛细血管内血液流动的方向和水流的方向相反,即水流和血流进行逆流的气体交换,这种氧扩散方式称为逆流交换作用[63-65]。进一步的试验发现,这种逆流交换作用可使水中80%以上的氧扩散到血液中[22]。由于水流与血流方向相反,这种逆流模式极大地提高了气体交换的效率[66]。如在逆流交换作用下,金枪鱼鳃的摄氧量较高,通过间接测定发现,它可以占金枪鱼总代谢率的50%~60%,而其他鱼鳃的摄氧量一般为27%~50%[67]。
早期的研究通过模拟鳃水流方向发现,鳃的平均逆流摄氧量为平均顺流摄氧量的5倍之多[49,68-69]。然而,研究人员发现,逆流吸收并非在所有条件下都存在显著优势。如在富氧水条件下,斑点猫鲨Scyliorhinus stellaris中逆流交换的优势就较小[25]。有研究者间接测定了头带冰鱼Chaenocephalus aceratus、虹鳟两种鱼的吸氧量,结果与斑点猫鲨基本一致,逆流吸氧量和顺流吸氧量差别不大[70-71]。虽然逆流交换作用在富氧水条件下的优势不显著,但是逆流交换作用可以大大降低能量消耗,减少鳃的热量损失,将能量更多地用于代谢消耗[71]。对于金枪鱼这种高耗能的硬骨鱼来说,逆流交换作用极大地促进了金枪鱼鳃的气体交换,为金枪鱼的快速游泳提供了充足的氧供给。
4 存在问题与展望
4.1 金枪鱼鳃形态与结构研究中存在的问题
金枪鱼鳃在形态和结构上的独特特性可以满足金枪鱼从水中获取大量氧的需求,从而为金枪鱼快速游泳所需能量的生成提供了原料,对金枪鱼的鳃进行深入的研究,能让人们更好地理解金枪鱼的呼吸机制及适应性进化机制。自20世纪60年代Hughes[8]开始研究金枪鱼的鳃以来,金枪鱼鳃结构的形态学研究取得了一定进展,但还存在以下几方面的问题。
1)缺乏对金枪鱼鳃的早期组织发育时期形态学研究。目前,虽然已经开展了一些对金枪鱼鳃的形态学研究,如鳃表面积、鳃斜向血流模式和较薄的水-血屏障厚度等,但这些研究所选取的金枪鱼均为成年金枪鱼,尚未见有关金枪鱼鳃在早期组织发育时期的研究,且不同金枪鱼物种鳃组织间的差异也未有研究,鳃的生长发育规律还未被阐明。
2)缺乏对金枪鱼鳃功能的研究。由于金枪鱼主要生活在远海,取样困难,不能较好地进行分子层面的深入研究,这在一定程度上影响了金枪鱼鳃结构和功能的深入研究。目前,对于金枪鱼鳃功能的相关研究很少,仅对黄鳍金枪鱼仔鱼鳃上的离子细胞进行了初步的阐述[42],这在一定程度上限制了对鳃的深入认识。
3)金枪鱼鳃适应性进化机制未被揭示。鳃的融合、钙化、鳃部片层排列等结构性适应使得金枪鱼能够应对高速水流冲击并持续游动。但目前只是通过形态学来观察鳃的适应性变化,并未深入到分子水平。而探索鳃基因水平因果关系,明确其进化机制,能帮助人们更全面地理解金枪鱼鳃的适应性进化,并进一步指导实践。
4)金枪鱼鳃生理过程与环境因子间的关系未被探究。海洋环境对金枪鱼的活动、分布、繁殖与生长具有重大影响,鳃在不同生存环境下具有不同的形态特征。在探究金枪鱼鳃的生理过程时,除自身因素外,目前缺乏对环境因子(光照、水温和溶解氧等)在鳃生理过程中发挥的作用研究,即未探究环境因子影响鳃生理过程的机理。
4.2 未来重点研究方向
针对目前金枪鱼鳃研究中存在的问题,今后的工作可从以下几方面展开。
1)开展金枪鱼早期组织发育时期的鳃组织研究。针对不同金枪鱼鳃组织的发育情况、不同金枪鱼鳃组织的种间差异进行清楚地研究与界定,以便更加系统地解释金枪鱼鳃的形态、结构及其分子机制。
2)加强基于分子层面对金枪鱼鳃细胞功能研究。鳃除了呼吸功能之外,还兼具滤食、渗透压调节和酸碱平衡等功能,尝试对鳃细胞进行离体培养,进而对鳃细胞的功能开展深入研究,如细胞的合成代谢和生长增殖等。进一步明确鳃在不同物种间及鳃不同细胞间的功能作用,了解鳃的生长与发育情况,为深入了解金枪鱼的运动机制提供基础数据。
3)基于组学方法揭示鳃的适应性进化机制。结合现代分子生物学手段和多组学联合方法,研究金枪鱼鳃不同细胞间的相互作用和鳃的分子适应性机制,这对探索金枪鱼适应快速持续的游泳具有重要的指导意义,可推动金枪鱼鳃的分子机制理论迈向一个新台阶。
4)探索金枪鱼鳃生理过程与环境因子间的关系。在金枪鱼鳃的生理过程和生物学研究中,对不同海域栖息地的金枪鱼鳃分别进行分析,并根据不同环境因子进行试验,以探究海洋环境与金枪鱼鳃生物过程的相互作用和耦合,解释环境对金枪鱼鳃生理过程的影响机制。
[1] GIBBS R H,COLLETTE B B.Comparative anatomy and systematics of the tunas,genus Thunnus[J].Fishery Bulletin,1967,66(1):65-130.
[2] CIEZAREK A G,OSBORNE O G,SHIPLEY O N,et al.Phylotranscriptomic insights into the diversification of endothermic Thunnus tunas[J].Molecular Biology and Evolution,2018,36(1):84-96.
[3] MATSUDA H,TAKENAKA Y,YAHARA T,et al.Extinction risk assessment of declining wild populations:the case of the southern bluefin Tuna[J].Researches on Population Ecology,1998,40(3):271-278.
[4] SAFINA C,KLINGER D H.Collapse of bluefin tuna in the western Atlantic[J].Conservation Biology,2008,22(2):243-246.
[5] MACKENZIE B R,MOSEGAARD H,ROSENBERG A A.Impending collapse of bluefin tuna in the northeast Atlantic and Mediterranean[J].Conservation Letters,2009,2(1):26-35.
[6] ISC.Report of the Pacific bluefin tuna working group workshop[R].La Jolla,CA:International Scientific Committee for Tuna and Tuna-Like Species in the North Pacific Ocean,2016.
[7] FAO.The state of world fisheries and aquaculture 2020[R].Rome:FAO,2020.
[8] HUGHES G M.The dimensions of fish gills in relation to their function[J].The Journal of Experimental Biology,1966,45(1):177-195.
[9] EVANS D H,CLAIBORNE J B.The physiology of fishes[M].Boca Raton:the Chemical Rubber Company Press,1957.
[10] MANDIC M,TODGHAM A E,RICHARDS J G.Mechanisms and evolution of hypoxia tolerance in fish[J].Proceedings of the Royal Society B:Biological Sciences,2009,276(1657):735-744.
[11] MUIR B S,HUGHES G M.Gill dimensions for three species of tunny[J].Journal of Experimental Biology,1969,51(2):271-285.
[12] PALZENBERGER M,POHLA H.Gill surface area of water-breathing freshwater fish[J].Reviews in Fish Biology and Fisheries,1992,2(3):187-216.
[13] WEGNER N.Morphology,function,and evolution of the gills of high-performance fishes[D].San Diego:University of California,2009.
[14] WEGNER N C.Ventilation and animal respiration gill respiratory morphometrics[M]//Encyclopedia of fish physiology.Amsterdam:Elsevier,2011:803-811.
[15] MUIR B S,BROWN C E.Effects of blood pathway on the blood-pressure drop in fish gills,with special reference to tunas[J].Journal of the Fisheries Research Board of Canada,1971,28(7):947-955.
[16] OLSON K R,DEWAR H,GRAHAM J B,et al.Vascular anatomy of the gills in a high energy demand teleost,the skipjack tuna (Katsuwonus pelamis)[J].Journal of Experimental Zoology Part A,Comparative Experimental Biology,2003,297(1):17-31.
[17] WEGNER ![]() A,GRAHAM J.Gill specializations in high-performance pelagic teleosts,with reference to striped marlin (Tetrapturus audax) and wahoo (Acanthocybium solandri)[J].Bulletin of Marine Science,2006,79(3):747-759.
A,GRAHAM J.Gill specializations in high-performance pelagic teleosts,with reference to striped marlin (Tetrapturus audax) and wahoo (Acanthocybium solandri)[J].Bulletin of Marine Science,2006,79(3):747-759.
[18] DAVID J G.Scombroid phylogeny:an alternative hypothesis[J].Bulletin of Marine Science,1986,39(1):1-41.
[19] MUIR B S,KENDALL J I.Structural modifications in the gills of tunas and some other oceanic fishes[J].Copeia,1968(2):388.
[20] WEGNER N C,SEPULVEDA C A,AALBERS S A,et al.Structural adaptations for ram ventilation:gill fusions in scombrids and billfishes[J].Journal of Morphology,2013,274(1):108-120.
[21] PARK K,KIM W,KIM H Y.Optimal lamellar arrangement in fish gills[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(22):8067-8070.
[22] 杨安峰,程红,姚锦仙.脊椎动物比较解剖学[M].2版.北京:北京大学出版社,2008.
YANG A F,CHENG H,YAO J X.Comparative anatomy of vertebrates[M].2nd ed.Beijing:Peking University Press,2008.(in Chinese)
[23] MIYA M,FRIEDMAN M,SATOH T P,et al.Evolutionary origin of the Scombridae (tunas and mackerels):members of a Paleogene adaptive radiation with 14 other pelagic fish families[J].PLoS One,2013,8(9):e73535.
[24] HUGHES G M.Morphological measurements on the gills of fishes in relation to their respiratory function[J].Folia Morphologica,1970,18(2):78-95.
[25] HUGHES G M,MORGAN M.The structure of fish gills in relation to their respiratory function[J].Biological Reviews,1973,48(3):419-475.
[26] DE JAGER S,DEKKERS W J.Relations between gill structure and activity in fish[J].Netherlands Journal of Zoology,1974,25(3):276-308.
[27] WILSON J M,LAURENT P.Fish gill morphology:inside out[J].The Journal of Experimental Zoology,2002,293(3):192-213.
[28] BRILL R W.Effect of body size on the standard metabolic rate of skipjack tuna,Katsuwonus pelamis[J].Fishery Bulletin,1979,77:494-498.
[29] WEGNER N C,SEPULVEDA C A,OLSON K R,et al.Functional morphology of the gills of the shortfin mako,Isurus oxyrinchus,a lamnid shark[J].Journal of Morphology,2010,271(8):937-948.
[30] SEPULVEDA C,DICKSON K A.Maximum sustainable speeds and cost of swimming in juvenile kawakawa tuna (Euthynnus affinis) and chub mackerel (Scomber japonicus)[J].The Journal of Experimental Biology,2000,203(Pt 20):3089-3101.
[31] SEPULVEDA C A,DICKSON K A,GRAHAM J B.Swimming performance studies on the eastern Pacific bonito Sarda chiliensis,a close relative of the tunas (family Scombridae) I.Energetics[J].The Journal of Experimental Biology,2003,206(Pt 16):2739-2748.
[32] BRILL R W.On the standard metabolic rates of tropical tunas,including the effect of body size and acute temperature change[J].Fishery Bulletin,1987,85(1):25-35.
[33] DEWAR H,GRAHAM J.Studies of tropical tuna swimming performance in a large water tunnel-energetics[J].The Journal of Experimental Biology,1994,192(1):13-31.
[34] BROWN C E,MUIR B S.Analysis of ram ventilation of fish gills with application to skipjack tuna (Katsuwonus pelamis)[J].Journal of the Fisheries Research Board of Canada,1970,27(9):1637-1652.
[35] HUGHES G M.1 general anatomy of the gills[J].Fish Physiology,1984,10:1-72.
[36] STEVENS E D.Some aspects of gas exchange in tuna[J].Journal of Experimental Biology,1972,56(3):809-823.
[37] ROBERTS J L.Active branchial and ram gill ventilation in fishes[J].The Biological Bulletin,1975,148(1):85-105.
[38] FREADMAN M A.Swimming energetics of striped bass (Morone saxatilis) and bluefish (Pomatomus saltatrix):gill ventilation and swimming metabolism[J].Journal of Experimental Biology,1979,83(1):217-230.
[39] FREADMAN M A.Swimming energetics of striped bass (Morone saxatilis) and bluefish (Pomatomus saltatrix):hydrodynamic correlates of locomotion and gill ventilation[J].Journal of Experimental Biology,1981,90(1):253-265.
[40] STEFFENSEN J F.The transition between branchial pumping and ram ventilation in fishes:energetic consequences and dependence on water oxygen tension[J].Journal of Experimental Biology,1985,114(1):141-150.
[41] TURKO A J,CISTERNINO B,WRIGHT P A.Calcified gill filaments increase respiratory function in fishes[J].Proceedings Biological Sciences,2020,287(1920):20192796.
[42] KWAN G T,WEXLER J B,WEGNER N C,et al.Ontogenetic changes in cutaneous and branchial ionocytes and morphology in yellowfin tuna (Thunnus albacares) larvae[J].Journal of Comparative Physiology B:Biochemical,Systemic,and Environmental Physiology,2019,189(1):81-95.
[43] CONWAY K W,MAYDEN R L.Gill-filament ossifications:a possible morphological synapomorphy uniting the families Balitoridae and Cobitidae (Ostariophysi:Cypriniformes)[J].Journal of Fish Biology,2009,75(10):2839-2844.
[44] LIVINGSTON M D,BHARGAV V V,TURKO A J,et al.Widespread use of emersion and cutaneous ammonia excretion in Aplocheiloid killifishes[J].Proceedings Biological Sciences,2018,285(1884):20181496.
[45] EVANS J P,PILASTRO A,SCHLUPP I[M]//EVANS J,PILASTRO A,SCHLUPP I.Ecology and evolution of poeciliid fishes.Chicago:University of Chicago Press,2011.
[46] TURKO A J,WRIGHT P A.Evolution,ecology and physiology of Amphibious killifishes(Cyprinodontiformes)[J].Journal of Fish Biology,2015,87(4):815-835.
[47] WRIGHT P A,TURKO A J.Amphibious fishes:evolution and phenotypic plasticity[J].The Journal of Experimental Biology,2016,219(Pt 15):2245-2259.
[48] ECKERT R,RANDALL D J.Animal physiology:mechanisms and adaptations[M].3rd ed.New York:W.H.Freeman,1988.
[49] SCHMIDT-NIELSEN K.Animal physiology[M].Cambridge:Cambridge University Press,1997.
[50] HILL R W,WYSE G A,ANDERSON M.Animal physiology[M].4th ed.Sunderland,Massachusetts:Sinauer Associates Inc.,2016.
[51] RANDALL D J.7 gas exchange in fish[J].Fish Physiology,1970,4:253-292.
[52] CECH J J JR,BRAUNER C J.GAS EXCHANGE | respiration:an introduction[M]//Encyclopedia of fish physiology.Amsterdam:Elsevier,2011:791-795.
[53] HUGHES G M.Morphometrics of fish gills[J].Respiration Physiology,1972,14(1):1-25.
[54] CARO C G,NEREM R M.Transport of 14 C-4-cholesterol between serum and wall in the perfused dog common carotid artery[J].Circulation Research,1973,32(2):187-205.
[55] KAMIYA A,YAMAMOTO K.A biomechanically derived minimum work model of the fish gill lamellar system exhibits its exquisite morphological arrangement and perfusate regulation for oxygen uptake from water[J].Journal of Biomechanics,2019,88:155-163.
[56] KUMAR P,GANDHI P S,MAJUMDER M.Optimal morphometric factors responsible for enhanced gas exchange in fish gills[J].arXiv preprint arXiv:1805.07744,2018.
[57] HUGHES G M.The mechanism of gill ventilation in three freshwater teleosts[J].Journal of Experimental Biology,1958,35(4):807-823.
[58] HUGHES G M,SAUNDERS R L.Responses of the respiratory pumps to hypoxia in the rainbow trout (Salmo gairdneri)[J].The Journal of Experimental Biology,1970,53(3):529-545.
[59] STROTHER J A.A computational model of flow between the microscale respiratory structures of fish gills[J].Journal of Theoretical Biology,2013,338:23-40.
[60] STROTHER J A.Hydrodynamic resistance and flow patterns in the gills of a tilapine fish[J].The Journal of Experimental Biology,2013,216(Pt 14):2595-2606.
[61] HUGHES G M,UMEZAWA S I.On respiration in the dragonet Callionymus lyra L.[J].Journal of Experimental Biology,1968,49(3):565-582.
[62] EVANS D H,CLAIBORNE J B.The physiology of fishes[M].3rd ed.Boca Raton:CRC Press,2005.
[63] HILLS B A,HUGHES G M.A dimensional analysis of oxygen transfer in the fish gill[J].Respiration Physiology,1970,9(2):126-140.
[64] HANSON D,JOHANSEN K.Relationship of gill ventilation and perfusion in Pacific dogfish,Squalus suckleyi[J].Journal of the Fisheries Research Board of Canada,1970,27(3):551-564.
[65] LAYTON H E.Energy advantage of counter-current oxygen transfer in fish gills[J].Journal of Theoretical Biology,1987,125(3):307-316.
[66] PIIPER J,SCHEID P.Gas transport efficacy of gills,lungs and skin:theory and experimental data[J].Respiration Physiology,1975,23(2):209-221.
[67] BUSHNELL P G,BRILL R W.Oxygen transport and cardiovascular responses in skipjack tuna (Katsuwonus pelamis) and yellowfin tuna (Thunnus albacares) exposed to acute hypoxia[J].Journal of Comparative Physiology B:Biochemical,Systemic,and Environmental Physiology,1992,162(2):131-143.
[68] HAZELHOFF E H,EVENHUIS H H.Importance of the ‘counter current principle’ for the oxygen uptake in fishes[J].Nature,1952,169(4289):77.
[69] GORDON M S.Animal physiology[M].New York:Macmillan,1979.
[70] LOWENSTEIN O.Research resume:book reviews:advances in comparative physiology and biochemistry[J].Science,1962,138:503-504.
[71] HOULIHAN D F,RANKIN J C,SHUTTLEWORTH T J.Gills[M].New York:Cambridge University Press,1982.