胶原蛋白是由3条α-肽链组成的三螺旋结构,分子量较大,约占动物体内蛋白质含量的1/3[1],主要存在于动物的结缔组织、骨骼和皮肤中。胶原蛋白富含甘氨酸、脯氨酸和羟脯氨酸,营养价值较高。目前,已知的胶原蛋白种类繁多,常见类型为Ⅰ、Ⅱ、Ⅲ、Ⅴ、Ⅺ型。水产动物源胶原蛋白主要为Ⅰ型和Ⅴ型,其中,Ⅰ型含量最多, 其相对分子质量一般在100 000级范围内, 大部分相对分子质量约为300 000[2]。与陆生动物相比,水产动物源胶原蛋白含量较高,且具有低抗原性、低过敏性等特性,因此,水产动物作为新的胶原蛋白提取源备受国内外学者的关注。
目前,有关水生生物源胶原蛋白的研究,主要集中在鱼类、蛙类和海洋无脊椎动物(软体动物、海参和腔肠动物)等。水生生物源胶原蛋白的氨基酸组成特性差异较大,且其酶解产物具有生物活性多样性特点。Song等[3]通过发酵预处理,从尼罗罗非鱼Oreochromis niloticus鱼皮中提取胶原蛋白,证明其为Ⅰ型胶原蛋白,并能较好地保留其三螺旋结构;赵媛媛等[4]从林蛙Rana chensinensis皮中提取胶原蛋白,证明其胶原蛋白具有较强的羟基自由基清除能力;Dai等[5]在鱿鱼软骨中分离出新型Ⅱ型胶原蛋白,并证明其能减少患炎症大鼠的促炎细胞因子;郑志鸿等[6]证明了方格星虫Sipunculus nudus酶解物具有促进伤口愈合功效。对比鱼类胶原蛋白,现阶段对贝类胶原蛋白的研究仍较少。
马婷等[7]研究发现,贝类外套膜胶原蛋白含量较高,本研究团队前期采用酶法降解贝类外套膜组织,并证实其酶解产物具有创伤修复等生物活性[8]。然而,对贝类胶原蛋白的理化性质和生物学功能的系统研究却鲜有报道。
据2021年中国渔业年鉴统计,贝类作为一种重要的经济渔业资源,年产量约为1 500万t,约占水产养殖产量的30%。目前,中国海洋贝类的加工产品主要是一些传统食品,如冷冻品、干制品、罐头和腌制品等。贝类外套膜富含胶原蛋白,通常作为主要的副产物被加工成低值产品或当作废弃物处理,不仅造成资源的浪费,还对环境产生生态污染。因此,为进一步提高贝类资源加工的附加值,外套膜胶原蛋白的提取及应用显得尤为重要。
华贵栉孔扇贝Chlamys nobilis是中国南海地区主要的扇贝养殖种类之一[9]。近年来,其产量一直处于世界前列。华贵栉孔扇贝可食部分主要为闭壳肌,除鲜食外,其加工方式主要为冷冻和干制,加工过程中产生了大量的外套膜组织,却缺少高值化加工利用[10]。本研究中,以华贵栉孔扇贝为原料,采用酸-酶处理法和热水浸提法,从外套膜组织中提取胶原蛋白,并对其氨基酸组成、分子量分布、微观结构、二级结构和热变性温度等理化特性进行比较分析,以期为其高值化利用提供科学依据。
1 材料与方法
1.1 材料
试验用鲜活华贵栉孔扇贝于2020年11月购自广东省湛江市东风市场(产地湛江雷州流沙湾)。
试剂:胃蛋白酶(猪胃黏膜)(10 000 U/g,上海源叶有限公司)、L-羟脯氨酸标准品、 对二甲氨基苯甲醛、冰乙酸、氯胺T、溴化钾和氯化钠等试剂均为国产分析纯(西陇科学股份有限公司);SDS-PAGE凝胶配制试剂盒、BCA试剂盒、SDS-PAGE蛋白上样缓冲液、SDS-PAGE电泳液、R-250考马斯亮蓝和BeyoColorTM彩色预染蛋白(相对分子质量为6 500~270 000)均购自碧云天生物技术公司。试验用水为纯水。
仪器和设备:UMVERSAL 320R台式高速冷冻离心机(Hettich公司)、FD-551冷冻干燥机(EYELA公司)、HH-6数显恒温水浴锅(常州澳华仪器有限公司)、835-50氨基酸自动分析仪(日立公司)、UV-756MC紫外分光光度计(尤尼柯(上海)仪器有限公司)、Spectrum 100傅里叶变换红外光谱仪(Bruker公司)、PHS-2F pH计(上海仪电科学仪器股份有限公司)、Pyris1 DSC-7全自动热分析仪(TA 沃特斯公司)。
1.2 方法
1.2.1 胶原蛋白的提取
1)酸-酶法。按料液比1∶20(g∶mL)将扇贝外套膜加入 0.5 mol/L乙酸中,并加入外套膜质量2%[11]的猪胃蛋白酶,用磁力搅拌器搅拌24 h,离心取上清,缓慢加入氯化钠溶液并搅拌至终浓度为0.9 mol/L,静置过夜(胶原蛋白盐析),以8 000 r/min离心15 min,取出沉淀加入0.1 mol/L乙酸溶液复溶,透析12 h,每4 h更换一次透析液,至透析液中性[12],得胶原蛋白提取液,冷冻干燥得到酸-酶溶性胶原蛋白冻干粉,记为A-PSC(Cn)(acid-pepsin soluble collagen Chlamys nobilis)(以上所有操作均在4 ℃下进行)。
2)热水浸提法。参照温慧芳等[13]方法,略做修改。加碱除杂蛋白后,按料液比1∶20将扇贝外套膜加入蒸馏水中,并置于95 ℃ 恒温水浴中搅拌提取4 h, 取出用纱布过滤, 收集滤液, 旋蒸浓缩后冷冻干燥得到其胶原蛋白冻干粉,记为HSC(Cn)(hot water soluble collagen Chlamys nobilis)。
1.2.2 胶原蛋白冻干粉得率测定 胶原蛋白得率(%)计算公式为
胶原蛋白得率=胶原蛋白冻干粉质量(g)/外套膜质量(g)×100%。
1.2.3 胶原蛋白含量测定 参照 GB/T 9695.23—2008测定羟脯氨酸含量,胶原蛋白含量(%)计算公式为
胶原蛋白含量=羟脯氨酸含量×11.1。
1.2.4 胶原蛋白理化性质测定
1)氨基酸组成分析。参照 GB5009.124—2016测定胶原蛋白的氨基酸组成。
2)紫外全波长扫描分析。取适量胶原蛋白冻干粉样品溶于0.1 mol/L乙酸溶液中,配制成质量浓度为0.1 mg/mL的胶原蛋白溶液,以 0.1 mol/L乙酸溶液作空白对照。在190~400 nm处以2 nm/s的速度对不同样品的胶原蛋白溶液进行扫描,采集速率为0.5 nm/s[14]。
3)傅里叶变换红外光谱分析。参照杨慧等[15]的方法,略做修改。取适量胶原蛋白冻干粉样品,以质量比1∶20将冻干粉与溴化钾(溴化钾使用前于120 ℃烘箱烘干4 h以上备用)加入玛瑙钵体中研磨后进行压片。使用红外光谱扫描测定4 000~400 cm-1处样品的透过率,分辨率为4 cm-1。
4)SDS-PAGE分析。聚丙烯酰胺凝胶由质量分数5%的浓缩胶和质量分数8%的分离胶组成[16],电泳仪电压120 V。取0.1 mg/mL的胶原蛋白溶液,按照每4 μL胶原蛋白溶液加入1 μL上样缓冲液的比例,加入5×SDS缓冲液混合均匀,于100 ℃下煮沸3 min,冷却备用。取10 μL混合液进行凝胶电泳。电泳结束后,在考马斯亮蓝G-250超快速染色液中染色0.5 h,用蒸馏水冲洗表面染色剂,小心将胶条泡在蒸馏水中,于脱色摇床上反复脱色至条带清晰可见,取出后用凝胶成像系统拍照。
5)扫描电子显微镜观察。取适量胶原蛋白冻干粉固定在导电胶上,喷金时间为400 s,加速电压为10.00 kV,真空喷金处理后,在不同倍数扫描电子显微镜下观察不同样品的胶原蛋白微观结构。
6)热变性温度。使用差示扫描量热仪测定样品的热变性温度,取适量胶原蛋白冻干粉样品溶于0.5 mol/L乙酸溶液中,配制成0.1 mg/mL的胶原蛋白溶液,测定时用移液枪准确移取8 μL样品溶液置入铝坩埚后密封,以空的铝坩埚作为空白对照。扫描温度为30~100 ℃,升温速率为3 ℃/min,样品室氮气流量为30 mL/min[17]。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,数据用SPSS 22软件进行组间差异性分析(F检验),采用Origin软件进行数据绘图。
2 结果与分析
2.1 胶原蛋白提取效果
从表1可见:热水法提取的外套膜胶原蛋白冻干粉得率显著高于酸-酶法(P<0.05);HSC(Cn)和A-PSC(Cn)冻干粉中胶原蛋白的平均含量分别为61.94%和37.41%,HSC(Cn)的胶原蛋白含量显著高于A-PSC(Cn)(P<0.05)。这说明提取方法对胶原蛋白含量有显著性影响。
2.2 胶原蛋白的氨基酸组成
从表2可见,HSC(Cn)和A-PSC(Cn)均具有胶原蛋白特征性氨基酸,即甘氨酸、脯氨酸和羟脯氨酸,HSC(Cn)和A-PSC(Cn)胶原蛋白的谷氨酸、甘氨酸、天冬氨酸、精氨酸含量均较高,组氨酸、蛋氨酸、酪氨酸、苯丙氨酸、异亮氨酸含量相对较低,胱氨酸则均未检出。这说明提取方法对胶原蛋白的氨基酸组成并无显著性影响。
表1 外套膜胶原蛋白得率及胶原蛋白含量
Tab.1 Yield and contents of collagens extracted from mantle of scallop Chlamys nobilis%

样品 sample得率 yield胶原蛋白含量 content of collagensA-PSC(Cn)1.61±0.05b37.41±0.02bHSC(Cn)2.78±0.04a61.94±0.07a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05)。
Note:the means with different letters within the same column are significantly different in the groups at the 0.05 probability level.
表2 不同方法提取的胶原蛋白氨基酸组成
Tab.2 Amino acid composition of collagens extracted by different methods
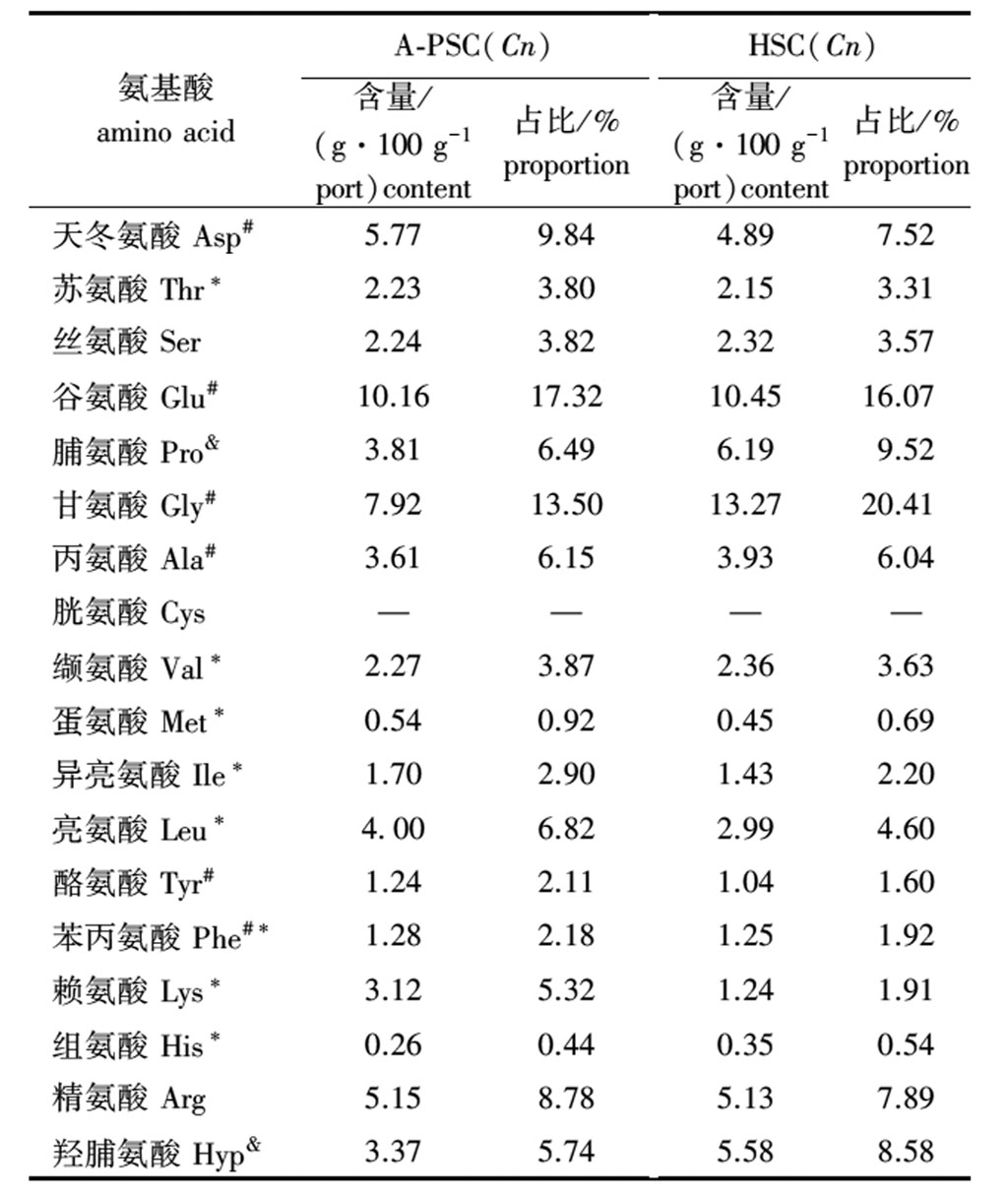
氨基酸 amino acidA-PSC(Cn) 含量/(g·100 g-1port)content占比/%proportionHSC(Cn)含量/(g·100 g-1port)content占比/%proportion天冬氨酸 Asp#5.779.844.897.52苏氨酸 Thr*2.233.802.153.31丝氨酸 Ser2.243.822.323.57谷氨酸 Glu#10.1617.3210.4516.07脯氨酸 Pro&3.816.496.199.52甘氨酸 Gly#7.9213.5013.2720.41丙氨酸 Ala#3.616.153.936.04胱氨酸 Cys————缬氨酸 Val*2.273.872.363.63蛋氨酸 Met*0.540.920.450.69异亮氨酸 Ile*1.702.901.432.20亮氨酸 Leu*4.006.822.994.60酪氨酸 Tyr#1.242.111.041.60苯丙氨酸 Phe#*1.282.181.251.92赖氨酸 Lys*3.125.321.241.91组氨酸 His*0.260.440.350.54精氨酸 Arg5.158.785.137.89羟脯氨酸 Hyp&3.375.745.588.58
注:—表示未检出;#为呈味氨基酸;*为必需氨基酸;&为亚氨基酸。
Note:—,means not detected; #,represents flavor amino acid; *,denotes essential amino acid; &,stands for sub-amino acid.
2.3 胶原蛋白的紫外分析
从图1可见:两种胶原蛋白均在220 nm附近有最大特征吸收,这主要由—C![]() O基团中n→π*跃迁导致,与Ⅰ型胶原蛋白的紫外吸收一致;两种胶原蛋白在280 nm附近处均有弱吸收峰,这表明其含有一定比例的芳香族氨基酸,如苯丙氨酸和酪氨酸(表2)。
O基团中n→π*跃迁导致,与Ⅰ型胶原蛋白的紫外吸收一致;两种胶原蛋白在280 nm附近处均有弱吸收峰,这表明其含有一定比例的芳香族氨基酸,如苯丙氨酸和酪氨酸(表2)。
2.4 胶原蛋白的红外分析
从图2可见,HSC(Cn)和A-PSC(Cn)的红外吸收光谱均具有胶原蛋白红外光谱的特征吸收峰,包括酰胺A、B、Ⅰ、Ⅱ和Ⅲ带。这说明HSC(Cn)和A-PSC(Cn)均存在三股螺旋结构,可初步判断两者均为Ⅰ型胶原蛋白。
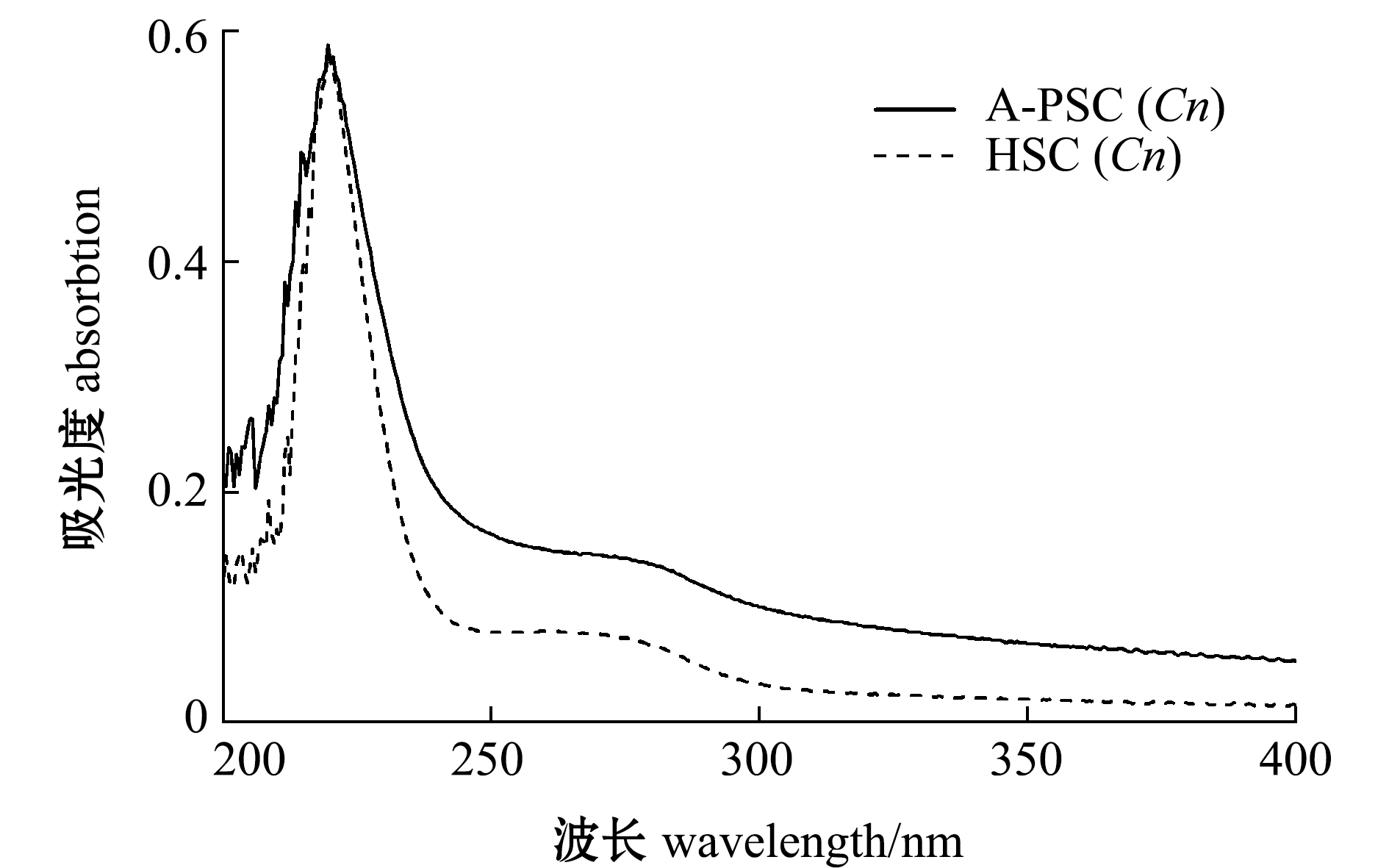
图1 外套膜胶原蛋白的紫外吸收光谱图
Fig.1 Ultraviolet absorption spectrogram of collagens extracted from mantle of scallop Chlamys nobilis
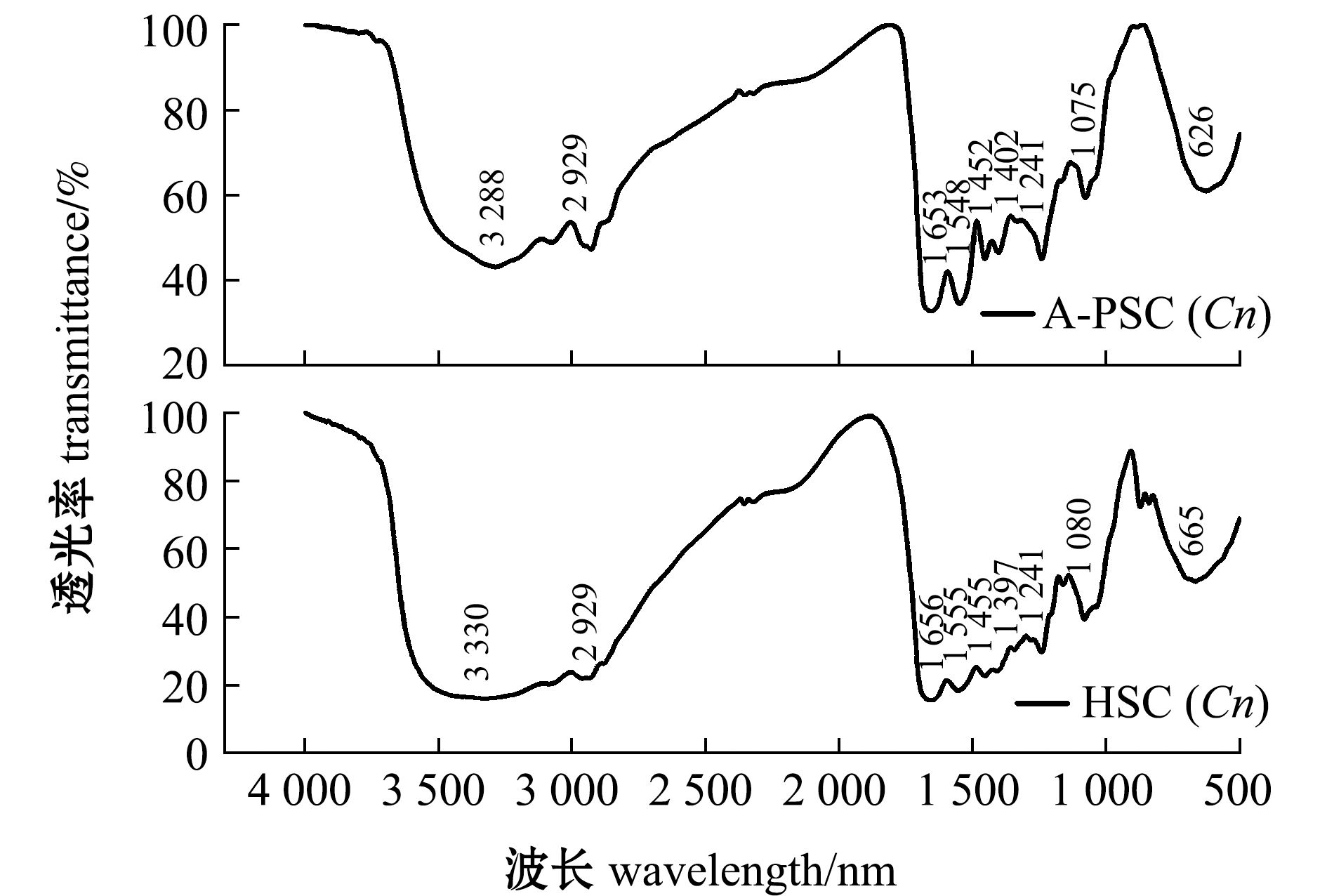
图2 外套膜胶原蛋白的红外光谱图
Fig.2 Infrared spectrogram of collagens extracted from mantle of scallop Chlamys nobilis
从表3可知,A-PSC(Cn)和HSC(Cn)的酰胺A产生的吸收峰分别出现在3 288 cm-1和 3 330 cm-1附近,提示A-PSC(Cn)相较HSC(Cn)有更多N—H基团参与了氢键缔合。这是因为酰胺A产生的吸收峰通常在3 400~3 440 cm-1,是由N—H基团的伸缩振动产生。当多肽中的N—H基团参与氢键的形成时,会使吸收峰波数降低100 cm-1左右[13]。两种胶原蛋白的酰胺B均出现在2 930 cm-1附近,主要是由CH2的不对称伸缩振动产生,说明两种胶原蛋白的CH2结构未被破坏。
2.5 SDS-PAGE分析
从图3可见:两种胶原蛋白的图谱相似,均含有γ、β、α1和α2链,由此可推测,所得两种胶原蛋白均为Ⅰ型胶原蛋白,但其相对分子质量不完全相同;两种胶原蛋白在相对分子质量180 000附近均有一条α链的二聚体β链,在相对分子质量110 000附近有一条α1链,在相对分子质量95 000附近有一条α2链。与A-PSC(Cn)相比,HSC(Cn)在相对分子质量66 000以下含有较多的蛋白条带,表明HSC(Cn)含有的杂蛋白较多。
表3 外套膜胶原蛋白的红外光谱特征峰值及位置特征基团
Tab.3 Infrared spectrogram characteristic peaks and position characteristic groups of collagens extracted from mantle of scallop Chlamys nobilis
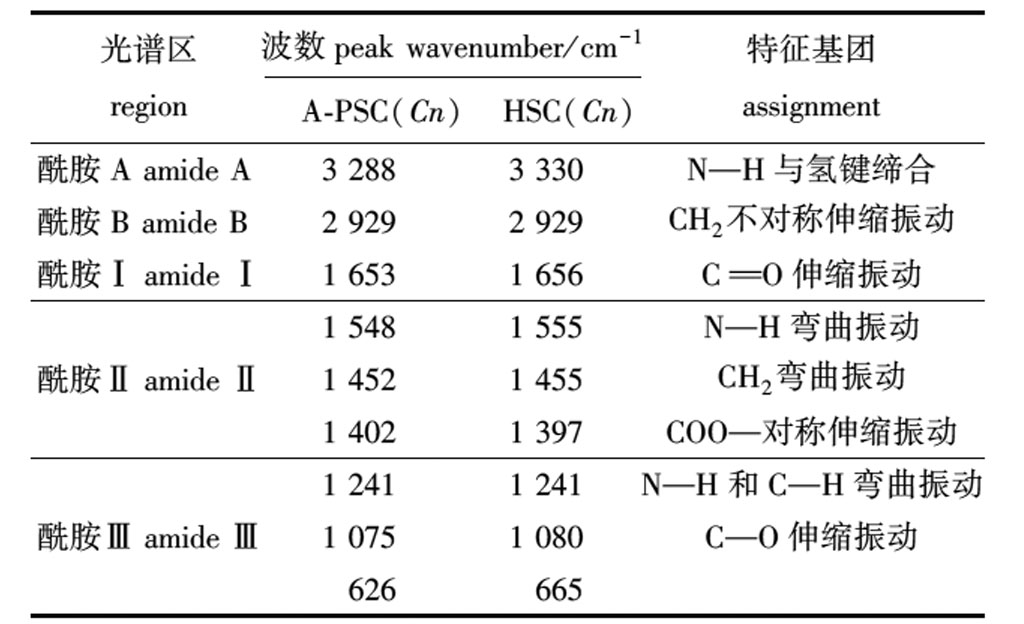
光谱区region波数peak wavenumber/cm-1A-PSC(Cn)HSC(Cn)特征基团assignment酰胺A amide A3 2883 330N—H与氢键缔合酰胺B amide B2 9292 929CH2不对称伸缩振动酰胺Ⅰ amide Ⅰ1 6531 656CO伸缩振动1 5481 555N—H弯曲振动酰胺Ⅱ amide Ⅱ1 4521 455CH2弯曲振动1 4021 397COO—对称伸缩振动1 2411 241N—H和C—H弯曲振动酰胺Ⅲ amide Ⅲ1 0751 080C—O伸缩振动626665
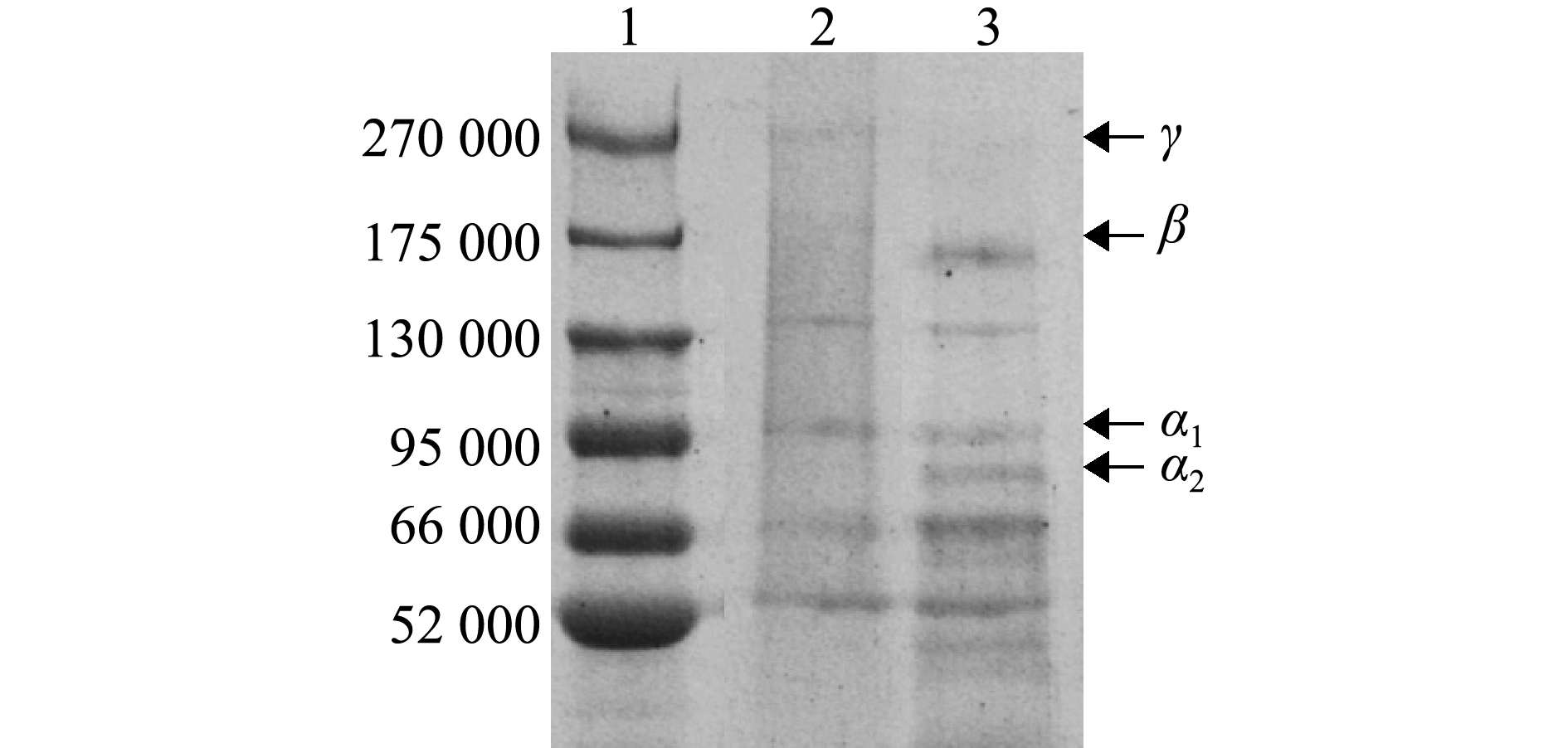
1—标准蛋白;2—A-PSC(Cn);3—HSC(Cn)。
1—marker; 2—A-PSC(Cn); 3—HSC(Cn).
图3 外套膜胶原蛋白的SDS-PAGE电泳图谱
Fig.3 SDS-PAGE electrophoresis patterns of collagens extracted from mantle of scallop Chlamys nobilis
2.6 扫描电子显微镜分析
将HSC(Cn)和A-PSC(Cn)胶原蛋白分别在不同倍数的扫描电镜下观察,结果显示,两种胶原蛋白的微观结构均存在明显差异,但均保留了较为完整的纤维结构(图4)。HSC(Cn)结构更加有序,呈层状排列且较为紧密,基本形成薄片状结构;A-PSC(Cn)则不显示层状,网状结构分布不均匀,胶原蛋白的薄片部分断裂。
2.7 胶原蛋白的热变性温度
从图5可见,HSC(Cn)的热变性温度明显高于A-PSC(Cn),二者分别为95、88 ℃,这与HSC(Cn)中的羟脯氨酸含量明显高于A-PSC(Cn)的结果一致(表2)。这表明胶原蛋白的热变性温度与胶原蛋白中的亚氨基酸(如羟脯氨酸)含量呈正相关。

图4 外套膜胶原蛋白的扫描电镜图
Fig.4 Scanning electron microscope images of collagens extracted from mantle of scallop Chlamys nobilis
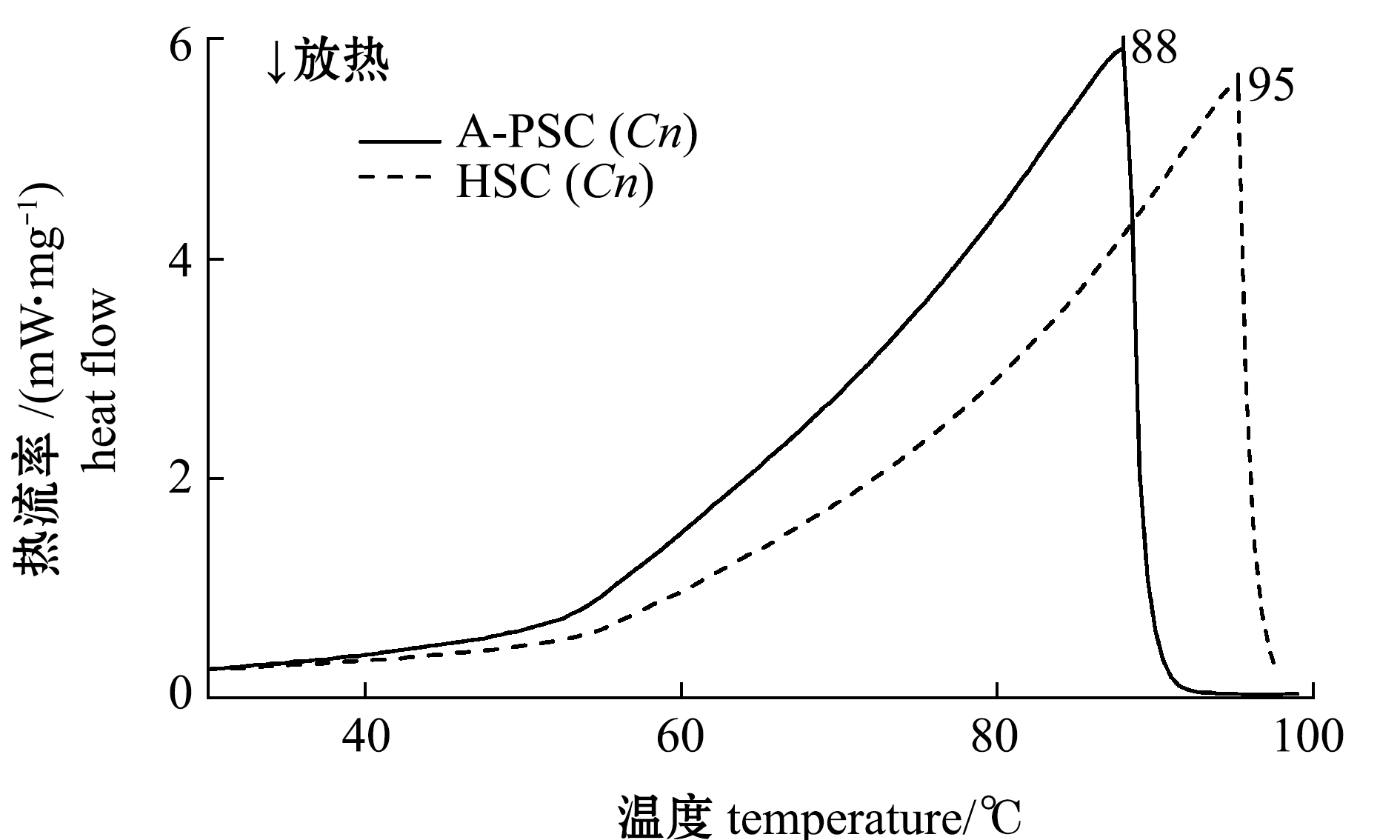
图5 外套膜胶原蛋白的热变性温度
Fig.5 Thermal denaturation temperature of collagens extracted from mantle of scallop Chlamys nobilis
3 讨论
3.1 华贵栉孔扇贝胶原蛋白的氨基酸组成特性
氨基酸的组成比例决定了蛋白质的结构、性质和品质[18]。本研究表明,两种提取方法对华贵栉孔扇贝外套胶原蛋白的含量影响较大,但对其氨基酸组成影响不大。不同提取方法对胶原蛋白结构的影响程度不同。热水法提取的胶原蛋白,其三股螺旋结构发生解旋,形成无规则的单条多肽链,但对其氨基酸组成影响较小[19]。而采用酸-酶解法提取的胶原蛋白,在酶解过程中,醋酸溶液对组织的肿胀机制使胃蛋白酶容易在端肽区域切割交联分子,导致其脯氨酸含量降低[20]。同时,酶解能够有效降解酸提取物中的杂蛋白,从而导致两种胶原蛋白HSC(Cn)和A-PSC(Cn)中的氨基酸相对含量存在差异,如HSC(Cn)中的亚氨基酸含量高于A-PSC(Cn)。研究表明,胶原蛋白中亚氨基酸的含量与胶原的热变性温度有关,亚氨基酸含量越高,胶原蛋白中的氢键热稳定性就越高[21]。本研究中,HSC(Cn)的羟脯氨酸含量高于A-PSC(Cn)(表2),进一步验证了该结论。相对鮟鱇Lophius litulon鱼骨[22]、养殖花鳗鲡Anguilla marmorata鱼皮[23]和鲢Hypophthalmicthys molitrix鱼皮[24]等其他水产鱼类来源的胶原蛋白,华贵栉孔扇贝外套膜胶原蛋白HSC(Cn)和A-PSC(Cn)的甘氨酸含量较低,而水产动物来源的胶原蛋白甘氨酸含量一般均低于哺乳动物[25],这种差异可能是生长环境不同造成的。本试验中,不同方法提取的栉孔扇贝外套膜两种胶原蛋白的氨基酸组成与杨凤影等[26]对该物种的研究结果略有不同,原因可能是不同地理位置的扇贝种群,所食饵料及气候条件均存在显著差异,这表明栉孔扇贝的氨基酸组成具有地域差异性。两种胶原蛋白中呈味氨基酸的含量均较高,HSC(Cn)还含有较多的羟脯氨酸,羟脯氨酸具有运输血浆中钙的重要功能,可通过促进钙在体内的消化吸收来补充骨骼中的胶原蛋白[27]。因此,可针对特殊人群如老人和儿童,将该种胶原蛋白作为一种功能性食品应用于医疗保健方面等[28]。A-PSC(Cn)含人体所必需的氨基酸量较高,营养价值高于HSC(Cn),A-PSC(Cn)的支链氨基酸与芳香族氨基酸的总量比值也较HSC(Cn)高,支链氨基酸与芳香族氨基酸的总量比值较低是患肝病的典型依据,高支链氨基酸和低芳香族氨基酸混合物具有保肝作用[29],由此推测,A-PSC(Cn)在保肝作用方面具有较优的应用价值。
3.2 华贵栉孔扇贝胶原蛋白的结构特征
水产动物Ⅰ型胶原蛋白肽链中含有—C![]() O、—COOH和CO—NH2等生色基团,且其富含的羟脯氨酸和脯氨酸均具有苯环结构,使得其在225 nm处呈现最大特征吸收[30]。本研究中,紫外和红外光谱显示,两种胶原蛋白均在220 nm左右有强吸收峰,且均具有典型的胶原蛋白特征带(酰胺A、B、Ⅰ、Ⅱ和Ⅲ带),酰胺Ⅰ带的特征吸收峰一般位于1 600~1 700 cm-1,主要是由C
O、—COOH和CO—NH2等生色基团,且其富含的羟脯氨酸和脯氨酸均具有苯环结构,使得其在225 nm处呈现最大特征吸收[30]。本研究中,紫外和红外光谱显示,两种胶原蛋白均在220 nm左右有强吸收峰,且均具有典型的胶原蛋白特征带(酰胺A、B、Ⅰ、Ⅱ和Ⅲ带),酰胺Ⅰ带的特征吸收峰一般位于1 600~1 700 cm-1,主要是由C![]() O基团的伸缩振动产生,且其与胶原蛋白分子的有序结构呈正相关[31]。HSC(Cn)的酰胺Ⅰ带吸收峰较高,说明其分子有序程度较高。SDS-PAGE结果显示,两种胶原蛋白均含有γ链、β链、α1链和α2链,由此可见,两种胶原蛋白主要为Ⅰ型胶原蛋白。
O基团的伸缩振动产生,且其与胶原蛋白分子的有序结构呈正相关[31]。HSC(Cn)的酰胺Ⅰ带吸收峰较高,说明其分子有序程度较高。SDS-PAGE结果显示,两种胶原蛋白均含有γ链、β链、α1链和α2链,由此可见,两种胶原蛋白主要为Ⅰ型胶原蛋白。
从微观结构上看,A-PSC(Cn)的紫外光谱在280 nm处的吸收峰高于HSC(Cn),这表明其含有更多的芳香族氨基酸。HSC(Cn)在热处理条件下三螺旋结构域内的氢键断裂,导致3条肽链彼此分开[32],但SDS-PAGE结果显示,其具有α链的二聚体β链,提示其胶原蛋白的结构保存较完整。结合热变性温度分析,推测HSC(Cn)可能有部分三螺旋结构未解旋,且在较高温度条件下,胶原蛋白可能与其他物质结合,对蛋白进行修饰或降解,进而形成更多杂带[14]。
从表面形貌结构上看,两种胶原蛋白差异明显。HSC(Cn)为紧密层状,基本呈片状结构,提示热水处理能使胶原蛋白发生变性与交联[33],这些分子间与分子内的交联键对稳定胶原纤维的有序结构与胶原蛋白的三螺旋结构具有重要作用[19],使得交联后胶原蛋白的热稳定性得到显著提高,后续研究可结合原子力显微镜探索其热稳定性的变化[34]。对比HSC(Cn),A-PSC(Cn)的杂质蛋白经胃蛋白酶水解后,微观结构改变,胶原蛋白的纤维网状结构保留较完整,在结构上具有疏松多孔的特性,推测A-PSC(Cn)应具有较好的保湿性,较适合作为止血生物材料等[35]。本试验中,A-PSC(Cn)具有多层聚集且以纤维为主的无规则网状结构,结合其高于其他水产动物胶原蛋白的热变性温度,如鲽Pleuronichthys coconuts鱼皮(70.5、78.6 ℃)[36]等,推测A-PSC(Cn)较HSC(Cn)更适用于作为生物医学材料基料,如胶原蛋白止血海绵等[24]。此研究结果可为华贵栉孔扇贝外套膜的高值化利用和贝类外套膜胶原蛋白的进一步应用提供参考。
4 结论
1)采用酸-酶法和热水法从华贵栉孔扇贝外套膜提取得到的胶原蛋白A-PSC(Cn)和HSC(Cn)均为Ⅰ型胶原蛋白,其结构特征及其理化性质均存在差异。A-PSC(Cn)三螺旋结构完整且纯度较高,具有疏松多孔的特性;HSC(Cn)亚氨基酸含量较高。可根据研究需要选用不同提取方法开发胶原蛋白产品。
2)针对A-PSC(Cn)疏松多孔的特性,推测其在胶原蛋白海绵方面具有更广泛的应用,可通过进一步的试验,如采用扫描电镜、透射电镜和圆二色谱法等测定其孔径、观察其构象和分析其二级结构,研究A-PSC(Cn)是否适用于各种损伤创面的止血修复。
[1] BELLA J.Collagen structure:new tricks from a very old dog[J].Biochemical Journal,2016,473(8):1001-1025.
[2] DAVISON-KOTLER E,MARSHALL W S,GARC A-GARETA E.Sources of collagen for biomaterials in skin wound healing[J].Bioengineering (Basel),2019,6(3):56.
A-GARETA E.Sources of collagen for biomaterials in skin wound healing[J].Bioengineering (Basel),2019,6(3):56.
[3] SONG Z L,LIU H M,CHEN L W,et al.Characterization and comparison of collagen extracted from the skin of the Nile tilapia by fermentation and chemical pretreatment[J].Food Chemistry,2021,340:128139.
[4] 赵媛媛,王战勇,张晶,等.中国林蛙皮肤胶原蛋白的提取及体外抗氧化活性研究[J].应用化工,2017,46(4):685-688.
ZHAO Y Y,WANG Z Y,ZHANG J,et al.Extraction of collagen from skin of Rana chensinensis and its antioxidant capacity in vitro[J].Applied Chemical Industry,2017,46(4):685-688.(in Chinese)
[5] DAI M L,LIU X,WANG N P,et al.Squid type Ⅱ collagen as a novel biomaterial:isolation,characterization,immunogenicity and relieving effect on degenerative osteoarthritis via inhibiting STAT1 signaling in pro-inflammatory macrophages[J].Materials Science and Engineering:C,2018,89:283-294.
[6] 郑志鸿,章超桦,林海生,等.方格星虫酶解物对小鼠皮肤创伤修复的作用[J].广东海洋大学学报,2020,40(1):97-103.
ZHENG Z H,ZHANG C H,LIN H S,et al.Promoting the skin wound healing in mice using Sipunculus nudus hydrolysate[J].Journal of Guangdong Ocean University,2020,40(1):97-103.(in Chinese)
[7] 马婷,吴谦,申铉日.珍珠贝外套膜胶原蛋白肽及其锌螯合物的体外抑制骨质疏松作用[J].肉类研究,2018,32(2):8-14.
MA T,WU Q,SHEN X R.Antiosteoporotic effects of collagen peptides and zinc-chelating complex from pearl oyster mantle[J].Meat Research,2018,32(2):8-14.(in Chinese)
[8] 杨发明,林海生,秦小明,等.珍珠贝外套膜酶解产物促进皮肤创伤愈合效果研究[J].南方水产科学,2019,15(5):92-98.
YANG F M,LIN H S,QIN X M,et al.Effect of enzymatic hydrolysis from mantle of pearl oyster on skin wound healing[J].South China Fisheries Science,2019,15(5):92-98.(in Chinese)
[9] 郑环宇,高加龙,章超桦,等.华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠生殖能力的影响[J].南方水产科学,2021,17(3):94-101.
ZHENG H Y,GAO J L,ZHANG C H,et al.Effects of Chlamys nobilis and its enzymatic hydrolysates on reproductive capacity of hemi-castrated male rats[J].South China Fisheries Science,2021,17(3):94-101.(in Chinese)
[10] 林海生,廖津,章超桦,等.华贵栉孔扇贝酶法制备α-葡萄糖苷酶抑制肽工艺优化[J].广东海洋大学学报,2020,40(5):97-104.
LIN H S,LIAO J,ZHANG C H,et al.Optimization of enzymatic preparation of α-glucosidase inhibitory peptides from Chlamys nobilis[J].Journal of Guangdong Ocean University,2020,40(5):97-104.(in Chinese)
[11] 包玉龙,陈孙福,罗永康.酸法和酶法提取鳄鱼皮胶原蛋白及性质研究[J].肉类研究,2012,26(7):1-4.
BAO Y L,CHEN S F,LUO Y K.Comparative studies on enzymatic and acidic extraction and properties of collagen from crocodile skin[J].Meat Research,2012,26(7):1-4.(in Chinese)
[12] 吴忠,刘俊荣,田元勇,等.虾夷扇贝外套膜胶原蛋白的提取与表征[J].大连海洋大学学报,2016,31(6):678-684.
WU Z,LIU J R,TIAN Y Y,et al.Extraction and characterization of collagen from Pationpecten yessoensis mantle[J].Journal of Dalian Ocean University,2016,31(6):678-684.(in Chinese)
[13] 温慧芳,陈丽丽,白春清,等.基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J].食品科学,2016,37(1):74-81.
WEN H F,CHEN L L,BAI C Q,et al.Comparative study on physical and chemical properties of collagens obtained by different extraction methods from the skin of the Chinese longsnout catfifish Leiocassis longirostris[J].Food Science,2016,37(1):74-81.(in Chinese)
[14] 周瑞,李若男,周丽莎,等.暗纹东方鲀鱼皮胶原蛋白的提取及其特性[J].水产学报,2020,44(8):1349-1359.
ZHOU R,LI R N,ZHOU L S,et al.Extraction and characteristics of collagens from the skin of puffer fish (Tetrodontiformes fasciatus)[J].Journal of Fisheries of China,2020,44(8):1349-1359.(in Chinese)
[15] 杨慧,陈德经,夏冬辉,等.大鲵皮肤色素提取工艺及抗氧化研究[J].天然产物研究与开发,2019,31(5):887-894.
YANG H,CHEN D J,XIA D H,et al.Extraction process and antioxidant activity of melanin from giant salamander skin[J].Natural Product Research and Development,2019,31(5):887-894.(in Chinese)
[16] 冯玲玲,冯进,李春阳.海蜇Ⅰ型胶原蛋白的提取及结构特性研究[J].食品工业科技,2021,42(7):15-21.
FENG L L,FENG J,LI C Y.Extraction and structural characteristics of typeⅠcollagen from Rhopilema esculenta[J].Science and Technology of Food Industry,2021,42(7):15-21.(in Chinese)
[17] 张强,黄鑫,符安卫,等.中华鳖裙边胶原蛋白的提取、鉴定及其理化性质[J].食品与发酵工业,2019,45(12):176-182.
ZHANG Q,HUAGN X,FU A W,et al.Extraction and characterization of collagens in Chinese sturgeon calipash[J].Food and Fermentation Industries,2019,45(12):176-182.(in Chinese)
[18] 迟淑艳,周歧存,周健斌,等.华南沿海5种养殖贝类营养成分的比较分析[J].水产科学,2007,26(2):79-83.
CHI S Y,ZHOU Q C,ZHOU J B,et al.Comparative nutrition components in five cultured molluscs in coastal South China[J].Fisheries Science,2007,26(2):79-83.(in Chinese)
[19] 高玲玲,侯成立,高远,等.胶原蛋白热稳定性研究进展[J].中国食品学报,2018,18(5):195-207.
GAO L L,HOU C L,GAO Y,et al.Research advances of thermal stability of collagen[J].Journal of Chinese Institute of Food Science and Technology,2018,18(5):195-207.(in Chinese)
[20] VEERURAJ A,ARUMUGAM M,AJITHKUMAR T,et al.Isolation and characterization of collagen from the outer skin of squid (Doryteuthis singhalensis)[J].Food Hydrocolloids,2015,43:708-716.
[21] SIKORSKI Z E,SCOTT D N,BUISSON D H,et al.The role of collagen in the quality and processing of fish[J].Critical Reviews in Food Science and Nutrition,1984,20(4):301-343.
[22] 刘良禹,朱慧颖,赵雪,等.鮟鱇鱼加工下脚料中胶原蛋白和硫酸软骨素综合提取及结构分析[J].食品科技,2018,43(12):143-148.
LIU L Y,ZHU H Y,ZHAO X,et al.Comprehensive extraction and structural analysis of collagen and chondroitin sulfate of Lophius litulon processing waste[J].Food Science and Technology,2018,43(12):143-148.(in Chinese)
[23] 卢珍华,郭彩华,叶鹏,等.养殖花鳗鲡鱼皮胶原蛋白的特性分析[J].淡水渔业,2019,49(6):100-106,87.
LU Z H,GUO C H,YE P,et al.Characterisation of fish skin collagen of cultured Anguilla marmorata[J].Freshwater Fisheries,2019,49(6):100-106,87.(in Chinese)
[24] 张强,王倩倩,陆剑锋,等.不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J].现代食品科技,2014,30(5):104-110.
ZHANG Q,WANG Q Q,LU J F,et al.Comparison of physical and chemical characteristics of collagen from silver carp skin using different extraction methods[J].Modern Food Science and Technology,2014,30(5):104-110.(in Chinese)
[25] 刘振锋,吕卫金,戴圣佳,等.胶原蛋白的提取、改性及应用研究进展[J].食品与药品,2014,16(6):443-447.
LIU Z F,LÜ W J,DAI S J,et al.Recent advances in extraction,modification and application of collagen protein[J].Food and Drug,2014,16(6):443-447.(in Chinese)
[26] 杨凤影,张弼.不同地理种群栉孔扇贝营养成分的比较分析[J].安徽农业科学,2009,37(9):4073-4075.
YANG F Y,ZHANG B.Comparative nutrition components in various populations of Chlamys farreri[J].Journal of Anhui Agricultural Sciences,2009,37(9):4073-4075.(in Chinese)
[27] 张一江,曹文红,谷莹蕾.华贵栉孔扇贝香辣海鲜酱的研制[J].中国调味品,2020,45(8):74-77.
ZHANG Y J,CAO W H,GU Y L.Development of spicy seafood sauce with Chlamys nobilis[J].China Condiment,2020,45(8):74-77.(in Chinese)
[28] 陈华,易湘茜,陈忻,等.海洋胶原蛋白肽的制备及生物活性研究进展[J].中国食物与营养,2010(8):57-60.
CHEN H,YI X X,CHEN X,et al.Advancement of the preparation and bioactivities of ocean collagen peptides[J].Food and Nutrition in China,2010(8):57-60.(in Chinese)
[29] KANO T,NAGAKI M,TAKAHASHI T,et al.Plasma free amino acid pattern in chronic hepatitis as a sensitive and prognostic index[J].Gastroenterologia Japonica,1991,26(3):344-349.
[30] 宋正规,朱丽娜,张洪超,等.胃蛋白酶提取马面鱼皮胶原蛋白及结构分析[J].食品科学,2018,39(20):260-267.
SONG Z G,ZHU L N,ZHANG H C,et al.Extraction and structural characterization of collagen from skin of Thamnaconus modestus[J].Food Science,2018,39(20):260-267.(in Chinese)
[31] BU Y S,ELANGO J,ZHANG J Y,et al.Immunological effects of collagen and collagen peptide from blue shark cartilage on 6T-CEM cells[J].Process Biochemistry,2017,57:219-227.
[32] 高玲玲,王振宇,李铮,等.热处理对羊骨胶原蛋白结构的影响[J].中国食品学报,2019,19(3):67-74.
GAO L L,WANG Z Y,LI Z,et al.The effect of heat treatment on collagen structure from sheep[J].Journal of Chinese Institute of Food Science and Technology,2019,19(3):67-74.(in Chinese)
[33] 刘磊.海蜇胶原蛋白的提取、纯化及理化性质研究[D].无锡:江南大学,2009.
LIU L.Study on extraction and purification and the physical-chemical property of collagen from Rhopilema esculentum[D].Wuxi:Jiangnan University,2009.(in Chinese)
[34] LIU D S,NIKOO M,BORAN G,et al.Collagen and gelatin[J].Annual Review of Food Science and Technology,2015,6:527-557.
[35] 唐尚权,徐新华.胶原蛋白海绵在腰椎间盘突出手术中的止血作用[J].中国医药指南,2012,10(9):31-32.
TANG S Q,XU X H.The hemostatic effect of collagen sponge in the surgical treatment of lumbar disc herniation[J].Guide of China Medicine,2012,10(9):31-32.(in Chinese)
[36] 马帅.鲽鱼鱼皮胶原蛋白的提取及其理化和功能特性的研究[D].锦州:渤海大学,2017.
MA S.Study on the extraction of flounder skin’s collagen and physicochemical and functional characteristics[D].Jinzhou:Bohai University,2017.(in Chinese)