淮河(31°55′~36°36′N,111°55′~120°25′E)是中国的七大河流之一,其下游主要流经的地域为安徽省和江苏省,为最典型的生态交错带流域之一[1]。流域中还包含中国第四大淡水湖——洪泽湖,该湖属平原水库型湖泊,西纳淮河,东入长江和黄海,对维持流域生态稳定作用显著[2]。近年来,淮河及其流域环境污染严重[3-7]。目前,有关淮河流域的研究多集中于水体水质的空间异质性和水生生物的种类及分布特征等方面,包括淮河流域夏季降水年代际变化特征及相应的大气环流异常[8]、淮河(安徽段)沉积物中微量元素的空间分布规律[9]、污染特征及潜在生态风险、近30年来淮河流域和洪泽湖水质的演变趋势[1]、淮河干流沉积物中重金属含量及分布特征[10]等。微生物是河流环境有机物分解的重要组成部分,对水体中的化学、物理和生态环境的变化非常敏感,其组成可以用于评估生态状况和水质。已有学者研究了长江中上游[11-12]、长江下游[13]和黄河[14-15]等中国主要河流流域中微生物的组成特征,而关于淮河微生物组成和分布特征的研究尚未见报道。淮河沿岸城市分布较为密集,其水质安全与人体健康、社会经济发展等密切相关,尤其是微生物污染风险越来越受到学者重视[16],对其微生物群落结构组成和分布差异及其环境影响因素的研究,有利于全面地评估淮河中下游的水质健康状况。
本研究中,以淮河中下游流域安徽-江苏段为研究对象,利用16S rRNA高通量测序技术分析水体中菌群的分布,探究不同生境菌群的空间差异及其环境影响因子,并评估水体污染的程度,以期为淮河流域内不同水环境的水体状况监测提供基础数据和参考依据。
研究区域位于安徽-江苏段淮河流域,于2019年3月5日—12日(枯水期)采集水样。采样点分4组:中游安徽段的3个断面,其附近的支流汇入繁杂,划为支流组(ZL),洪泽湖断面单独列为洪泽湖组(HZ),下游江苏段4个断面均位于主河道,划为河道组(YH),淮河入江口断面划为入江口组(HK)。9个采样点由上游至下游依次为阜阳南照(FY,32°36′32″N,116°00′31″E),凤台(FT,32°41′12″N,116°41′34″E),蚌埠闸(BB,32°57′34″N,119°09′10″E),洪泽湖(HZ, 33°17′07″N,117°17′05″E),高良涧闸前(GL,33°19′29″N,118°51′33″E),淮安闸前(HA, 33°28′14″N,119°09′31″E),淮安闸与邵伯闸之间(SB,33°08′33″N,119°22′51″E),邵伯闸与施桥闸(SQ,32°28′13″N,119°29′26″E),河道入江口(HK,32°16′53″N,119°28′39″E)(图1)。
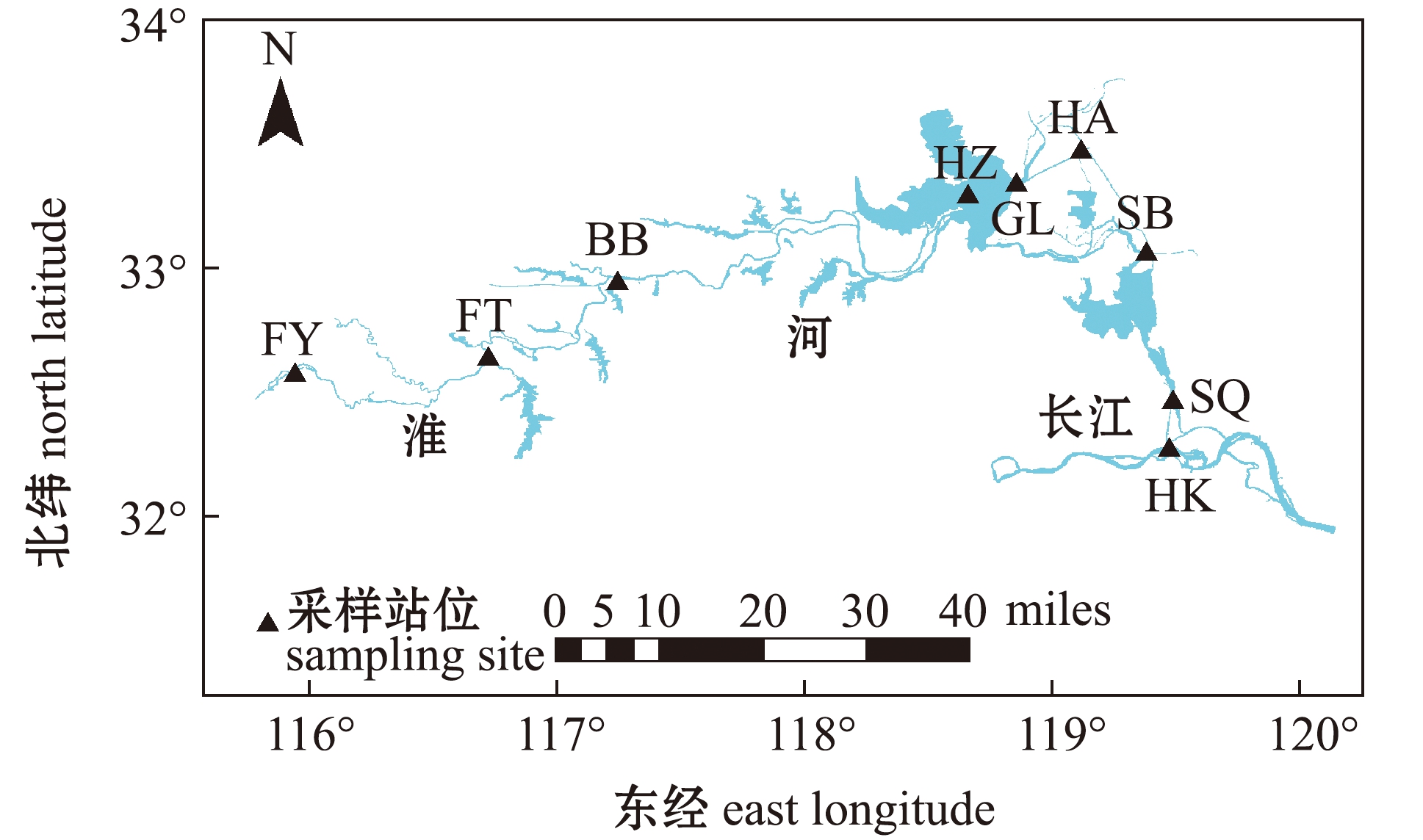
图1 淮河流域中下游水体样本采集位点
Fig.1 Collection sites of water samples in the middle and lower reaches of the Huaihe River Basin
1.2.1 样品采集和水体理化指标测定 每个位点采集3个样品,全部27个样品均利用1 L无菌手持式柱状玻璃采水器采集,取0.5 L表层水环境样本,装入无菌玻璃瓶中,现场将样品过滤到孔径为0.22 μm的聚酯纤维滤膜上,将滤膜放入无菌的冻存管中置于液氮中保存,回到实验室后立刻转移至-20 ℃冰箱中保存,样品采集完成后两周内完成DNA样本的提取。
测定各点位的15个水体理化指标。在现场分别采用黑白盘和测深仪测定水体透明度(SD)及水深(H),采用多参数水质检测仪(HACH-DS5XBASE)检测水温(T)、pH、溶解氧(DO)和浊度(TUR),随后用2.5 L有机玻璃采水器分别采集表层、中层和底层水样,现场混匀后采集5 L水样冷藏保存,并于48 h内完成分析。总氮(TN)、总磷(TP)、高锰酸盐指数(CODMn)、叶绿素a(Chl-a)、氨态氮![]() 亚硝态氮
亚硝态氮![]() 磷酸盐
磷酸盐![]() 溶解性总磷(TDP)和溶解性总氮(TDN)测定方法参照《湖泊富营养化调查规范》[17]。
溶解性总磷(TDP)和溶解性总氮(TDN)测定方法参照《湖泊富营养化调查规范》[17]。
根据《地表水环境质量标准》(GB 3838—2002)[18]对采样点的![]() 和TN进行评价。
和TN进行评价。
1.2.2 DNA的提取和高通量测序 将采集的滤膜剪碎,置于50 mL离心管中,按照DNA提取试剂盒说明书进行提取。采用E.Z.N.A.® Water DNA Kit(Omega Bio-tek,Norcross,GA,U.S.)提取基因组DNA,并用10 g/L琼脂糖凝胶电泳检测提取的DNA质量。选用细菌16S rRNA通用引物341F(5′ACTCCTACGGGAGGCAGCAG 3′)和806R(5′GGACTACHVGGGTWTCTAAT 3′)进行PCR扩增。PCR扩增程序:95 ℃下预变性2 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸30 s共进行25个循环;最后在72 ℃下再延伸5 min。利用琼脂糖凝胶电泳检测PCR产物,判断扩增后的DNA浓度是否达到了试验扩增要求。在武汉华大医学检验所有限公司的Illumina Hiseq2500平台进行测序。
1.2.3 高通量测序结果初筛和数据分析 首先运用QIIME 1.8.0软件(quantitative insights into microbial ecology,http://qiime.org/)[19]识别疑问序列,除要求序列长度≥150 bp且不允许存在模糊碱基N之外,还将剔除5′端引物错配碱基数>1的序列和含有连续相同碱基数>8的序列。随后调用Usearch 5.2.236程序(http://www.drive5. com/usearch/)检查并剔除嵌合体序列。
所有数据均采用QIIME软件和R 3.2.0软件进行统计分析。通过Greengenes(Release 13.8)[20]数据库对所得到的OTU进行分类比对,采用QIIME软件获取各样本在门、纲、目、科和属5个分类水平上的组成和丰度分布,对OTU丰度矩阵中每个样本的序列总数在不同深度下随机抽样,以每个深度下抽取到的序列数及其对应的OTU数绘制稀释曲线,并对每个样本计算Alpha多样性指数,包括Chao1、Ace、Simpson和Shannon指数。通过Galaxy在线分析平台(http://huttenhower.sph. harvard.edu/galaxy/),对菌群相对丰度矩阵进行LEfSe分析,其中,LDA score=效应系数×标准化后的特征向量,并对该值进行对数转换。
1.2.4 富营养化评价 依据《湖泊(水库)富营养化评价方法及分级技术规定》(中国环境监测总站,总站生字[2001]090号),采用综合营养状态指数TLI(∑)评价各采样点的富营养化状况。综合营养状态分级标准:TLI(∑)>50时为富营养,50~60时为轻度富营养,60~70时为中度富营养,70~100时为重度富营养。
试验数据均以平均值±标准差(mean±S.D.)表示,采用IBM SPSS Statistics 26.0软件对数据进行描述性统计分析和相关性分析,采用单因素(one-way ANOVA)和Tamhane’s T2法进行方差分析及多重比较(α=0.05)。采样图使用ArcGIS 10.2软件绘制,其他图表采用Origin 2017和OmicShare Tools软件绘制。
各站位的水质指标测定结果显示:SD范围为14.5~55.5 cm,由支流到河道总体呈现下降趋势;![]() 含量范围分别为0.057~0.308、2.202~5.408 mg/L,由支流到河道呈现递减趋势,最小值出现在入江口;TN和TP分别为1.340~2.790、0.040~0.156 mg/L,以洪泽湖为界,其上下游的TN和TP含量呈现出了相反的变化趋势;其余理化指标则无明显的变化趋势。各站位环境因子平均值见表1。
含量范围分别为0.057~0.308、2.202~5.408 mg/L,由支流到河道呈现递减趋势,最小值出现在入江口;TN和TP分别为1.340~2.790、0.040~0.156 mg/L,以洪泽湖为界,其上下游的TN和TP含量呈现出了相反的变化趋势;其余理化指标则无明显的变化趋势。各站位环境因子平均值见表1。
水质评价结果显示,淮河中下游的水体污染源主要为氮污染。根据综合营养状态分级标准,可以看出,除入江口外的其余断面水质均有不同程度的富营养化,其中,阜阳达到了中度富营养(表1)。
表1 各站位环境因子平均值
Tab.1 Average values of environmental factors in all sites
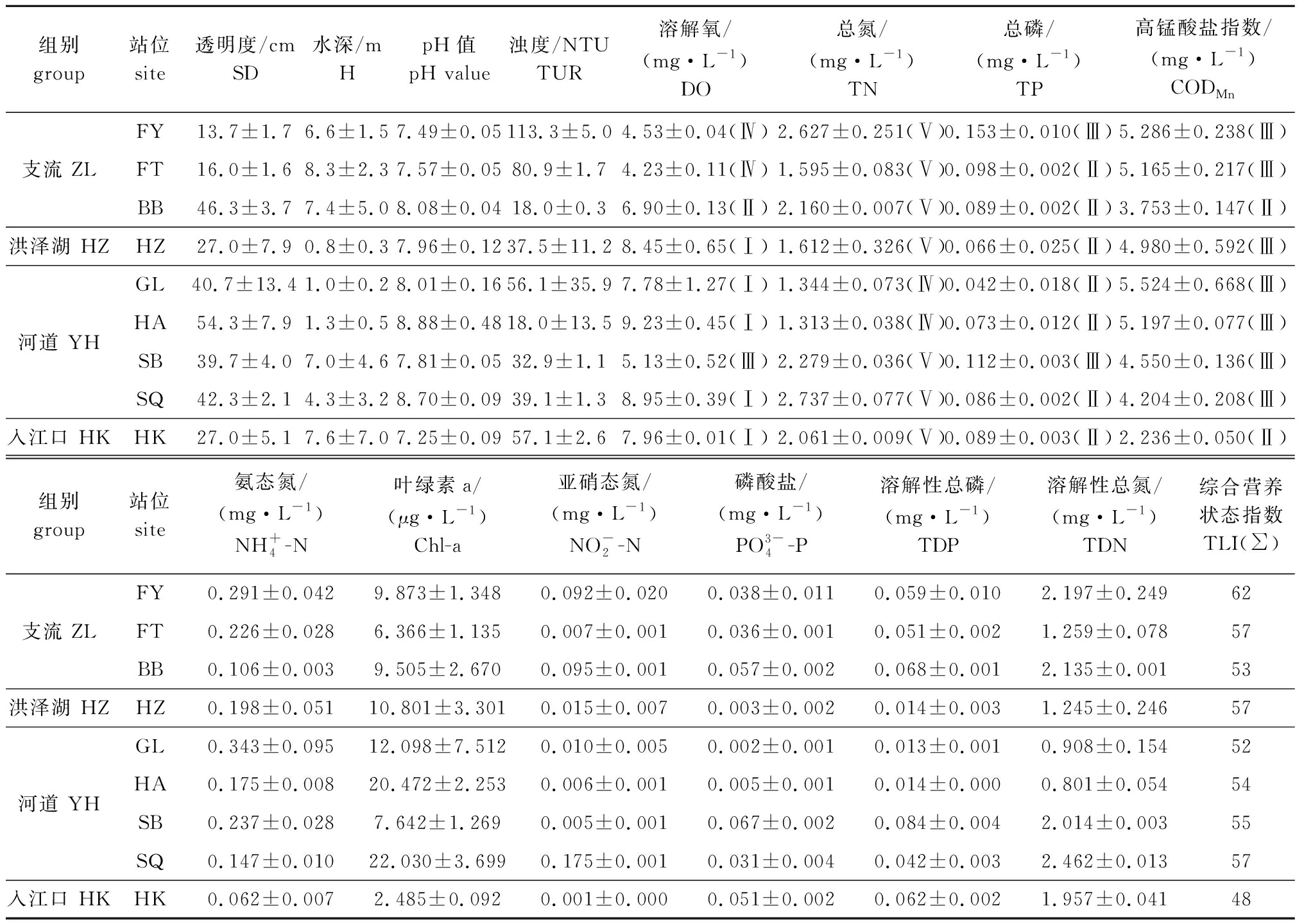
组别 group站位site透明度/cmSD水深/mHpH值pH value浊度/NTUTUR溶解氧/(mg·L-1)DO总氮/(mg·L-1)TN总磷/(mg·L-1)TP高锰酸盐指数/(mg·L-1)CODMnFY13.7±1.76.6±1.57.49±0.05113.3±5.04.53±0.04(Ⅳ)2.627±0.251(Ⅴ)0.153±0.010(Ⅲ)5.286±0.238(Ⅲ)支流 ZLFT16.0±1.68.3±2.37.57±0.0580.9±1.74.23±0.11(Ⅳ)1.595±0.083(Ⅴ)0.098±0.002(Ⅱ)5.165±0.217(Ⅲ)BB46.3±3.77.4±5.08.08±0.0418.0±0.36.90±0.13(Ⅱ)2.160±0.007(Ⅴ)0.089±0.002(Ⅱ)3.753±0.147(Ⅱ)洪泽湖 HZHZ27.0±7.90.8±0.37.96±0.1237.5±11.28.45±0.65(Ⅰ)1.612±0.326(Ⅴ)0.066±0.025(Ⅱ)4.980±0.592(Ⅲ)GL40.7±13.41.0±0.28.01±0.1656.1±35.97.78±1.27(Ⅰ)1.344±0.073(Ⅳ)0.042±0.018(Ⅱ)5.524±0.668(Ⅲ)河道 YHHA54.3±7.91.3±0.58.88±0.4818.0±13.59.23±0.45(Ⅰ)1.313±0.038(Ⅳ)0.073±0.012(Ⅱ)5.197±0.077(Ⅲ)SB39.7±4.07.0±4.67.81±0.0532.9±1.15.13±0.52(Ⅲ)2.279±0.036(Ⅴ)0.112±0.003(Ⅲ)4.550±0.136(Ⅲ)SQ42.3±2.14.3±3.28.70±0.0939.1±1.38.95±0.39(Ⅰ)2.737±0.077(Ⅴ)0.086±0.002(Ⅱ)4.204±0.208(Ⅲ)入江口 HKHK27.0±5.17.6±7.07.25±0.0957.1±2.67.96±0.01(Ⅰ)2.061±0.009(Ⅴ)0.089±0.003(Ⅱ)2.236±0.050(Ⅱ)组别 group站位site氨态氮/(mg·L-1)NH+4-N叶绿素a/(μg·L-1)Chl-a亚硝态氮/(mg·L-1)NO-2-N磷酸盐/(mg·L-1)PO3-4-P溶解性总磷/(mg·L-1)TDP溶解性总氮/(mg·L-1)TDN综合营养状态指数TLI(∑)FY0.291±0.0429.873±1.3480.092±0.0200.038±0.0110.059±0.0102.197±0.24962支流 ZLFT0.226±0.0286.366±1.1350.007±0.0010.036±0.0010.051±0.0021.259±0.07857BB0.106±0.0039.505±2.6700.095±0.0010.057±0.0020.068±0.0012.135±0.00153洪泽湖 HZHZ0.198±0.05110.801±3.3010.015±0.0070.003±0.0020.014±0.0031.245±0.24657GL0.343±0.09512.098±7.5120.010±0.0050.002±0.0010.013±0.0010.908±0.15452河道 YHHA0.175±0.00820.472±2.2530.006±0.0010.005±0.0010.014±0.0000.801±0.05454SB0.237±0.0287.642±1.2690.005±0.0010.067±0.0020.084±0.0042.014±0.00355SQ0.147±0.01022.030±3.6990.175±0.0010.031±0.0040.042±0.0032.462±0.01357入江口 HKHK0.062±0.0072.485±0.0920.001±0.0000.051±0.0020.062±0.0021.957±0.04148
注:括号内的Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ为参考GB 3838—2002标准的水质分级结果。
Note: Ⅰ,Ⅱ,Ⅲ,Ⅳ and Ⅴ in brackets refer to the water quality classification results in the standard GB 3838—2002.
2.2.1 菌群的多样性特征 经过质量检查和数据过滤后,从27个水环境样本中共获得945 846个序列,每个样品平均35 031个读数(每个样品 31 057~38 934个读数)。9个采样点的OTU数量和Alpha多样性指数见表2,各分组的特有OTU数分别为支流(31)、入江口(87)、河道(39)和洪泽湖(7),入江口的细菌群落丰富度高于其他3组,而多样性最高的是淮安闸,最低的是阜阳。
对淮河中下游微生物群落的多样性与环境因子进行Pearson相关性分析之前,对本研究中选取的15个环境数据进行共线性检验,其中,VIF>10时表示共线性显著,VIF为0~10时表示共线性不显著。在SPSS分析中剔除共线性显著的环境因子后,得到可以作为研究微生物多样性的影响因子。
将微生物的Alpha多样性指标与筛选的环境因子进行Pearson相关性分析(表3),其中,![]() CODMn与微生物的Ace和Chao1指数呈极显著负相关(P< 0.01),SD与微生物的Shannon指数呈极显著正相关(P<0.01),TUR、TN、TP则与Shannon指数呈极显著负相关(P<0.01)。
CODMn与微生物的Ace和Chao1指数呈极显著负相关(P< 0.01),SD与微生物的Shannon指数呈极显著正相关(P<0.01),TUR、TN、TP则与Shannon指数呈极显著负相关(P<0.01)。
表2 水样细菌群落的丰度和Alpha多样性统计
Tab.2 Statistics of abundance and alpha diversity of bacterial communities in water samples
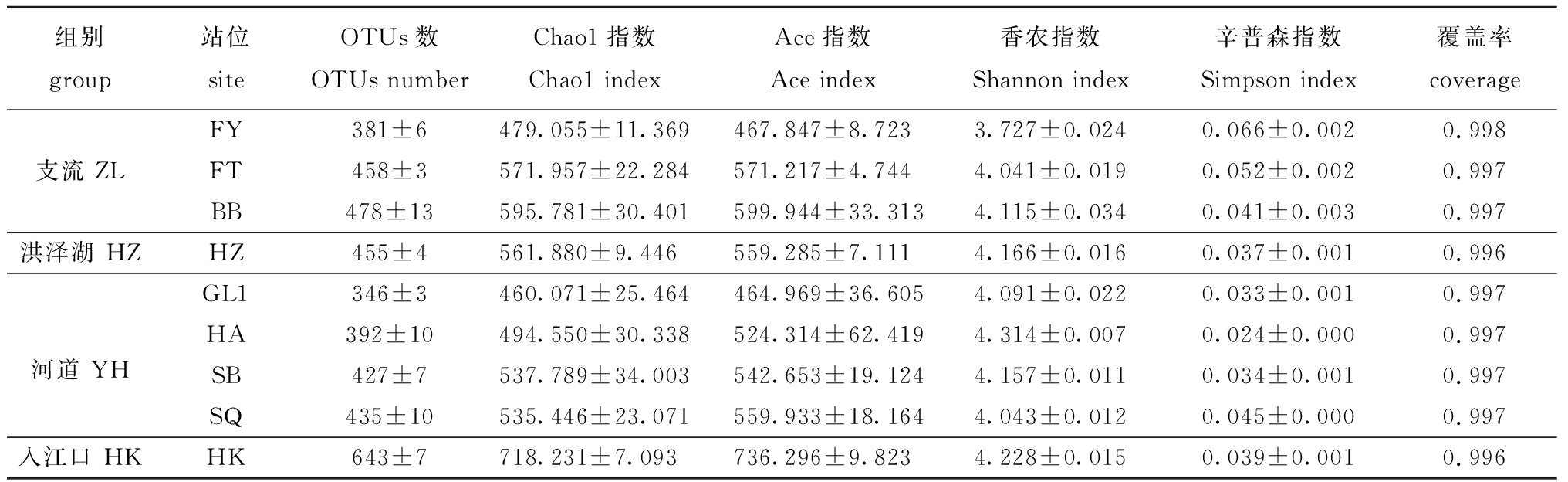
组别 group站位 siteOTUs数 OTUs numberChao1指数 Chao1 indexAce指数Ace index香农指数 Shannon index辛普森指数Simpson index覆盖率coverageFY381±6479.055±11.369467.847±8.7233.727±0.0240.066±0.0020.998支流 ZLFT458±3571.957±22.284571.217±4.7444.041±0.0190.052±0.0020.997BB478±13595.781±30.401599.944±33.3134.115±0.0340.041±0.0030.997洪泽湖 HZHZ455±4561.880±9.446559.285±7.1114.166±0.0160.037±0.0010.996GL1346±3460.071±25.464464.969±36.6054.091±0.0220.033±0.0010.997河道 YHHA392±10494.550±30.338524.314±62.4194.314±0.0070.024±0.0000.997SB427±7537.789±34.003542.653±19.1244.157±0.0110.034±0.0010.997SQ435±10535.446±23.071559.933±18.1644.043±0.0120.045±0.0000.997入江口 HKHK643±7718.231±7.093736.296±9.8234.228±0.0150.039±0.0010.996
表3 Alpha多样性指数与环境因子的相关关系(相关系数 R)
Tab.3 Pearson correlation analysis between diversity index and environmental factors
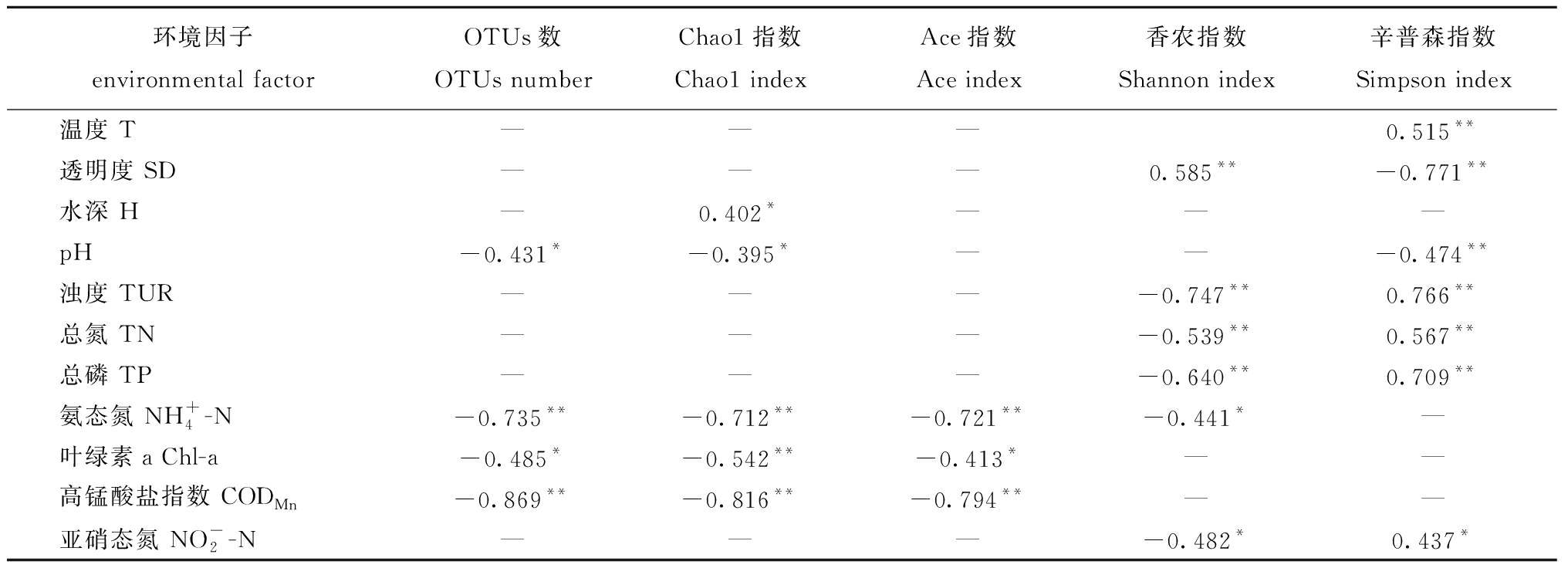
环境因子 environmental factorOTUs数 OTUs numberChao1指数 Chao1 indexAce指数Ace index香农指数 Shannon index辛普森指数Simpson index温度 T———0.515**透明度 SD———0.585**-0.771**水深 H—0.402*———pH-0.431*-0.395*——-0.474**浊度 TUR———-0.747**0.766**总氮 TN———-0.539**0.567**总磷 TP———-0.640**0.709**氨态氮 NH+4-N-0.735**-0.712**-0.721**-0.441*—叶绿素a Chl-a-0.485*-0.542**-0.413*——高锰酸盐指数 CODMn-0.869**-0.816**-0.794**——亚硝态氮 NO-2-N———-0.482*0.437*
注: *表示显著相关(P<0.05); **表示极显著相关(P<0.01)。
Note: * means significant correlations(P<0.05); **means very significant correlations(P<0.01).
2.2.2 微生物群落组成 将所有水体样本的OTU以97%的相似性阈值对其进行聚类,共鉴定出31门86纲148目229科326属细菌。各水体中微生物相对丰度排名前10的菌门如表4所示,其中,放线菌门Actinobacteria(各水体中相对丰度范围为30.1%~48.47%)、变形菌门Proteobacteria(25.36%~35.86%)和拟杆菌门Bacteroidetes(15.73%~31.76%)为所有水体样本中共同的优势类群,其余比例大于1%的门类细菌有2种,分别为疣微菌门Verrucomicrobia(2.05%~10.45%)和浮霉菌门Planctomycetes(0.59%~9.85%)。放线菌门主要由放线菌纲Actinobacteria(32.28%)组成,变形菌门主要由β-变形菌纲Betaproteobacteria(19.66%)、α-变形菌纲Alphaproteobacteria(4.90%)和γ-变形菌纲Gammaproteobacteria(3.53%)组成,拟杆菌门中黄杆菌纲Flavobacteriia和鞘脂杆菌纲Sphingobacteriia丰度最高。
每个分类单元在所有个体上的分布是不均匀的,门水平上,洪泽湖的浮霉菌门Planctomycetes丰度最高(P<0.05),变形菌门在蚌埠和入江口水样中相对丰度最高,分别为35.02%和32.68%,在其他站位的相对丰度范围为26.41%~29.76%,拟杆菌门在洪泽湖进入河道后丰度急剧增加,在淮安闸样点丰度最高(30.75%),至入江口时丰度又逐渐降低。入江口和支流样本中放线菌纲的丰度较高(35.63%, 37.10%),且入江口组的β-变形菌纲(25.75%)丰富度最高。浮霉菌纲Planctomycetia(8.5%)和Δ-变形菌纲Deltaproteobacteria(1.25%)在安徽段的相对丰度远高于下游江苏段,并且在洪泽湖中丰度最高,越往下游丰度越低。
从图2可见,在属水平上,黄杆菌属Flavobacterium、红育菌属Rhodoferax和Limnohabitans属在各位点中丰度最高,其余平均丰度超过1%的菌属有多核杆菌属Polynucleobacter、Fluviicola、沉积物杆状菌属Sediminibacterium和甲基娇养杆菌属Methylotenera等。河道组拥有发酵单胞菌属Zymomonas和甲基养菌属Methylibium两种特有的菌属,而HTCC、弓形杆菌属Arcobacter和突柄杆菌属Prosthecobacter则为河道组外的其他位点所特有。此外,阜阳的组线虫共生菌属Candidatus_Xiphinematobacter和Luteolibacter占比显著高于其他位点。图2中菌属对应的颜色越接近蓝色表示其丰度越低,颜色越接近红色表示其丰度越高。
表4 水体微生物在门水平上的相对丰度组成(相对丰度排名前10的菌门)
Tab.4 Relative abundance composition of bacteria in the water at a phylum level(top ten phyla in relative
abundance)%
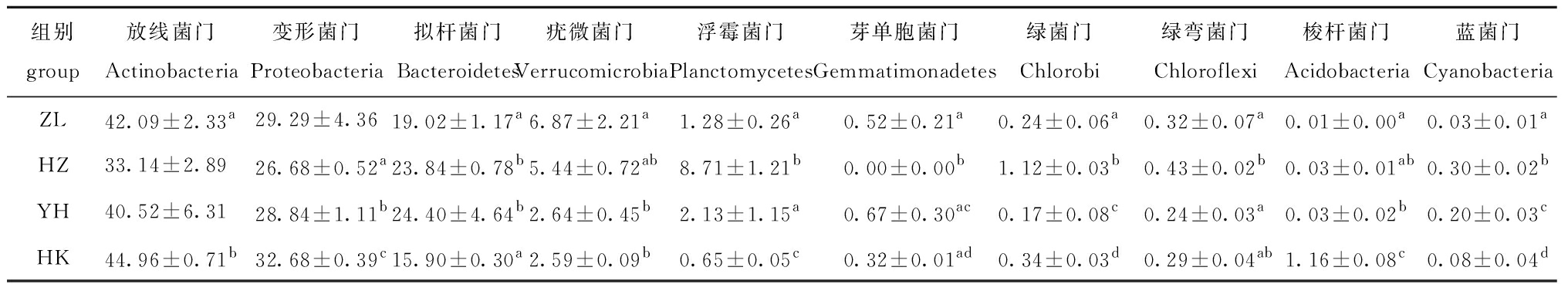
组别group放线菌门Actinobacteria变形菌门Proteobacteria拟杆菌门Bacteroidetes疣微菌门Verrucomicrobia浮霉菌门Planctomycetes芽单胞菌门Gemmatimonadetes绿菌门Chlorobi绿弯菌门Chloroflexi梭杆菌门Acidobacteria蓝菌门CyanobacteriaZL42.09±2.33a29.29±4.3619.02±1.17a6.87±2.21a1.28±0.26a0.52±0.21a0.24±0.06a0.32±0.07a0.01±0.00a0.03±0.01aHZ33.14±2.8926.68±0.52a23.84±0.78b5.44±0.72ab8.71±1.21b0.00±0.00b1.12±0.03b0.43±0.02b0.03±0.01ab0.30±0.02bYH40.52±6.3128.84±1.11b24.40±4.64b2.64±0.45b2.13±1.15a0.67±0.30ac0.17±0.08c0.24±0.03a0.03±0.02b0.20±0.03cHK44.96±0.71b32.68±0.39c15.90±0.30a2.59±0.09b0.65±0.05c0.32±0.01ad0.34±0.03d0.29±0.04ab1.16±0.08c0.08±0.04d
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note: The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences.
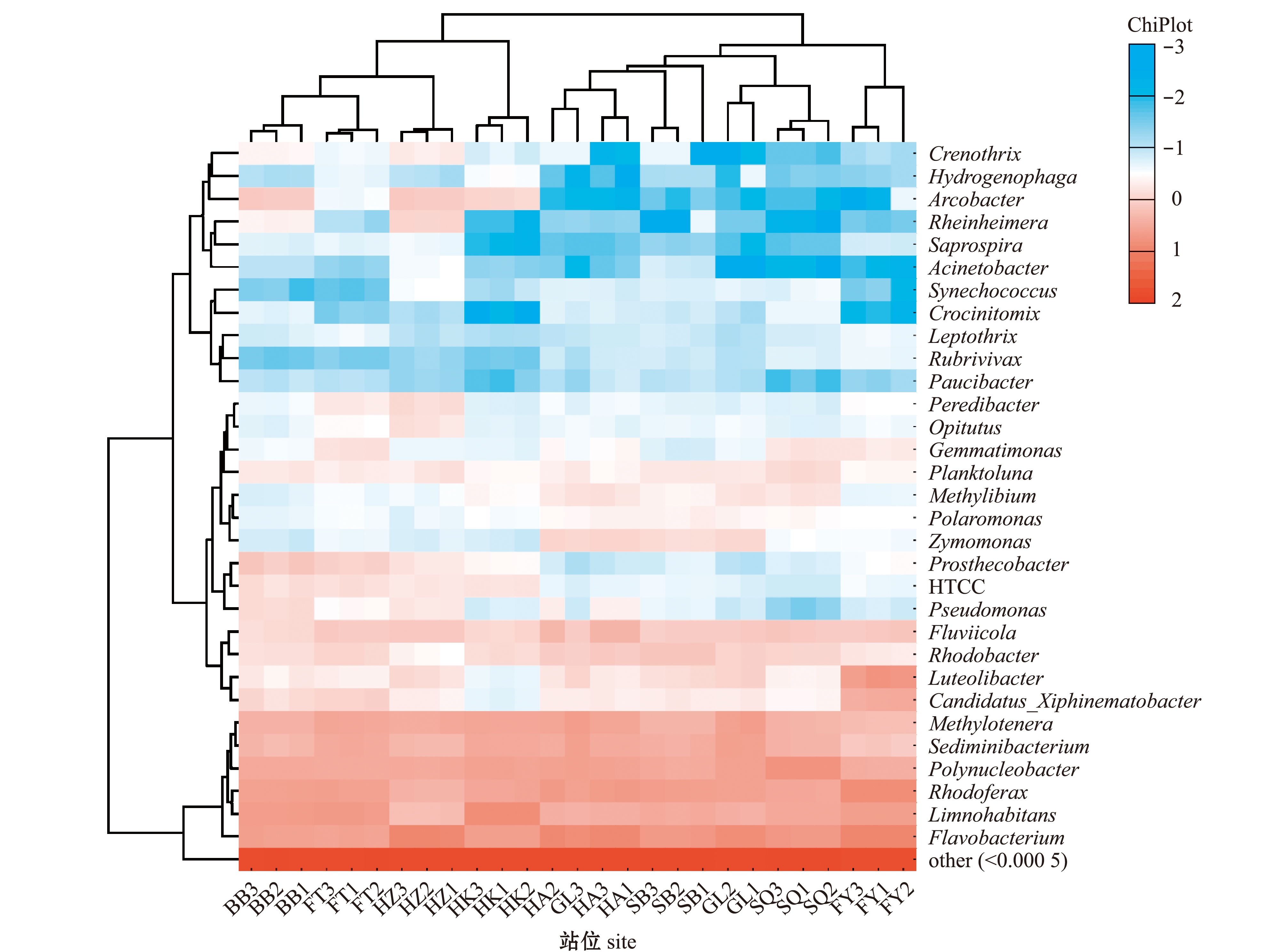
图2 各样本属水平菌群结构组成热图
Fig.2 Heat map of the the structure and composition of bacterial flora at each sampling site at genus level
使用线性判别分析(LDA)效应量(LEfSe)算法比较了4组水体样本的微生物组成(相对丰度)的差异(图3)。根据多种假设检验校正的Wilcoxon非参数t检验,38个物种的OTU存在显著性差异(P<0.05),其中,支流和洪泽湖两组差异性菌群与其他两组相差较大。
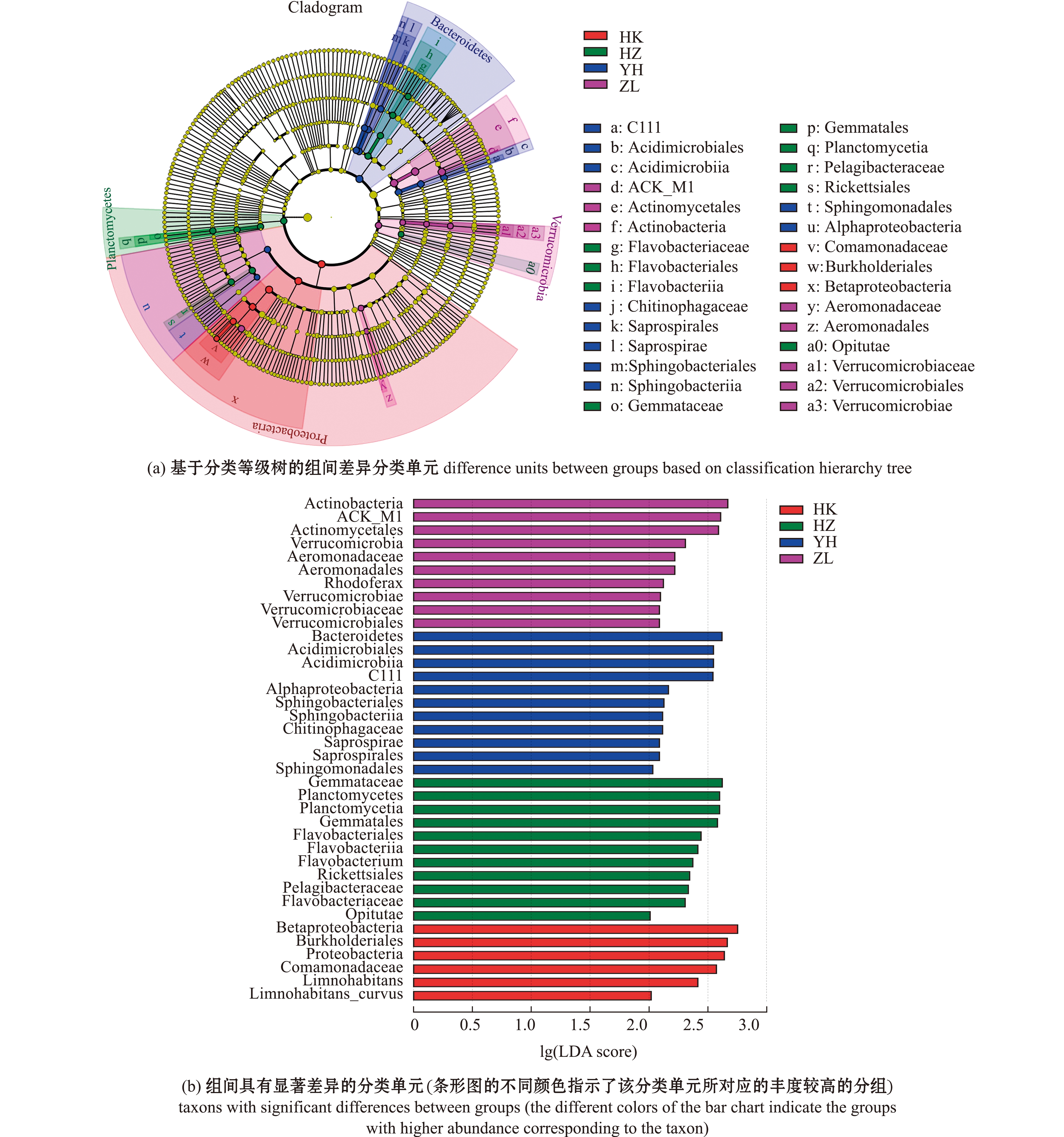
图3 基于LEfSe分析的分类谱系图
Fig.3 Taxonomic cladogram obtained from LEfSe analysis
将各分组共有菌属中丰度排名较高和各位点特有的菌属与环境因子做Pearson相关性分析,结果如图4所示,其中绿色框中为环境因子与优势菌属的相关关系。
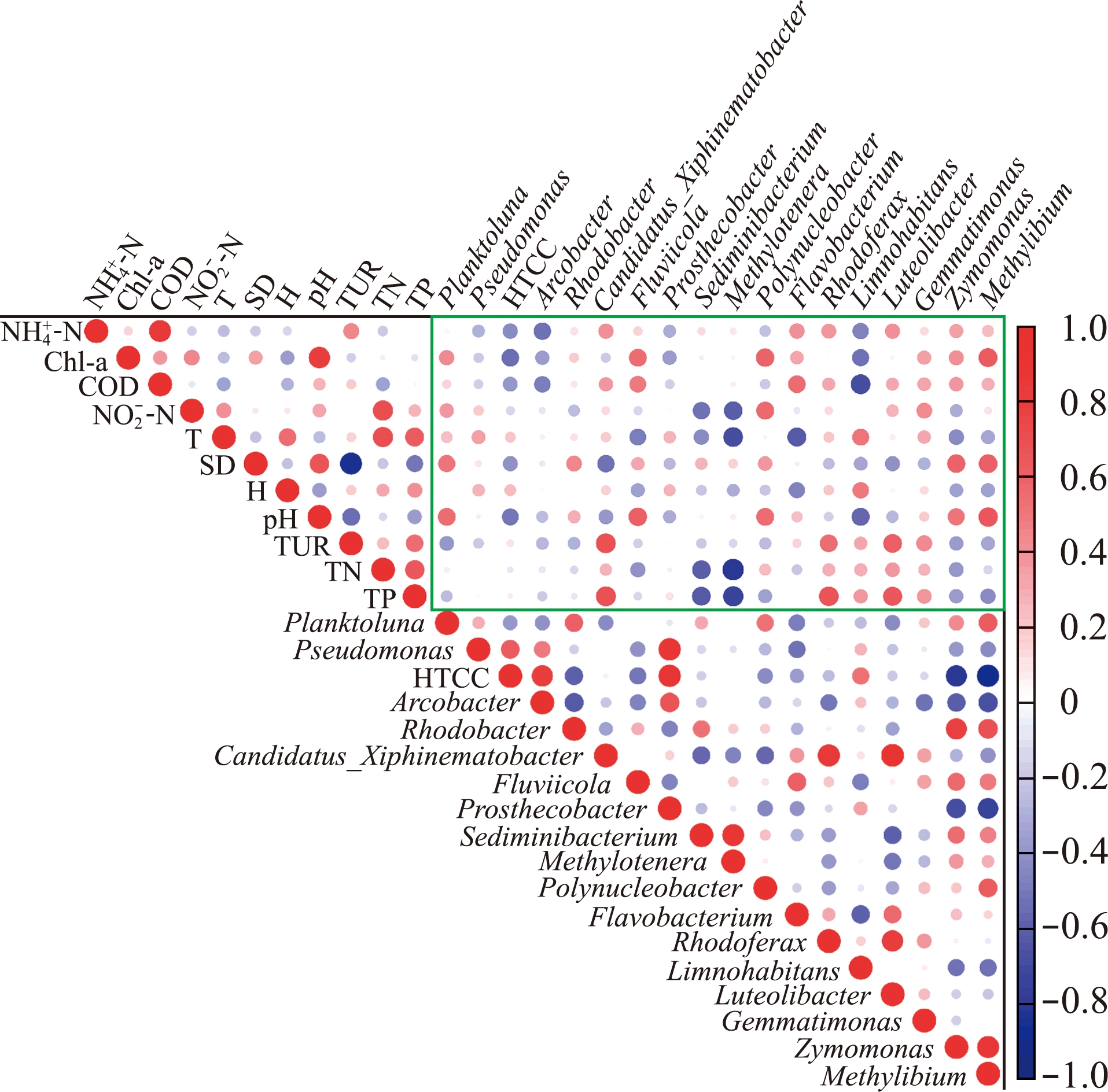
图4 属水平优势菌属与环境因子的Pearson相关性分析
Fig.4 Pearson correlation analysis between dominant bacteria and environmental factors at genus level
经过DCA(detrended correspondence analysis)分析,物种分布的最大梯度长度为4.855>3.0,因此,选择CCA对淮河微生物群落结构(基于OTU水平)与环境因子的相关性进行分析。2个坐标轴对微生物群落结构分布的总解释度为49.13%。图5展示了各样本菌群OTU及样本中丰度排名前10的OTU与环境因子间的相关关系。从图5可见:河道中的GL、HA、SB各位点菌群OTU相似度较高,与Chl-a、pH和CODMn等环境因子呈正相关;洪泽湖的HZ位点菌群OTU构成了独立分支,与TP和TUR呈负相关;支流中的FY位点构成了独立分支,与TUR和TP呈正相关,FT位点与TP和TUR呈正相关,与SD呈负相关,BB和HK距离较近,与![]() 和CODMn呈负相关。
和CODMn呈负相关。
自然水域中的微生物数量巨大,其对有机物降解及营养物质循环过程具有重要作用,是水生态系统的重要组成部分。全面了解水体微生物群落多样性、分布特征及其在生态系统中的功能和作用,对于管理和维护淮河中下游水生态环境具有深远的意义[21]。本研究中,采用 16S rRNA 高通量测序技术对淮河流域中下游(安徽-江苏段)水环境的细菌多样性进行探究,结果表明,放线菌门、变形菌门、拟杆菌门和浮霉菌门在各点位均有相对较高的丰度分布,这一结果也与其他关于淡水环境菌群的研究结果较为相似[22-23],这些类群与石油烃的降解和外来无机化合物的降解有较大关系[24],但不同空间分布的水体样品的细菌群落结构存在一定的差异性。厚壁菌门在淡水中也是较为常见的类群,但在本研究中其丰度极低,有研究表明,厚壁菌门与径流量呈正相关[25],2002年蚌埠闸扩建后淮河中下游河段流量的年平均极值降低,水流速度较为缓慢[1-2],推断可能是导致本研究中厚壁菌门丰度极低的主要原因。
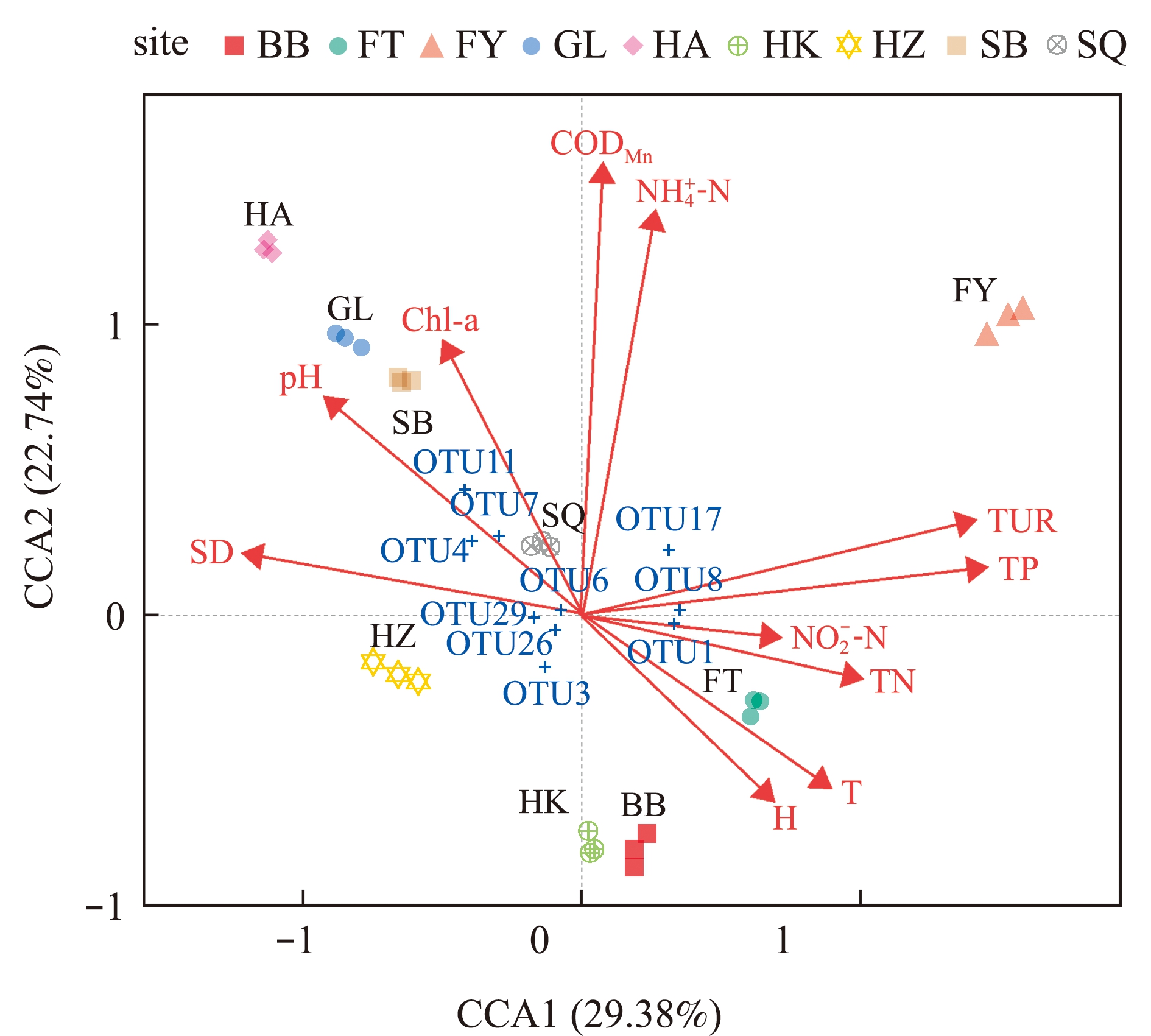
OTU1,OTU3 and OTU8—ACK-M1; OTU4—Gemmataceae; OTU6—Polynucleobacter; OTU7—Acidimicrobiales,C111;OTU11—Flavobac- terium;OTU17—Rhodoferax;OTU26,OTU29—Methylotenera_mobilis.
图5 微生物群落结构与环境因子的CCA分析
Fig.5 CCA analysis between microbial composition and environmental factors at the OTU level
安徽段支流中疣微菌门的相对丰度显著高于其他位点,此菌门一般在水环境或土壤中被发现,其中,疣微菌科Verrucomicrobiaceae多被发现在人类粪便中,同样气单胞菌科Aeromonadaceae也是人体和鱼类肠道中的病原菌,这可能与在淮河安徽段选取的3个位点沿岸受城市污水的影响较大有关。
洪泽湖中浮霉菌门的相对丰度较高,常发现该菌存在于污水处理系统中,另外,洪泽湖富含的黄杆菌属,常发现于酸沼泽及污水处理厂中,这与各种水体和土壤污染相关[26]。
河道中的高良涧闸、淮安闸和邵伯闸均位于淮安市,与其他位点不同,淮安闸的次级优势菌门为拟杆菌门,且由阜阳至淮安闸呈增长趋势,淮安闸位点丰度最高,蓝菌门的丰度趋势与拟杆菌门相同,这两种菌门均为淡水环境的常见优势菌门[27]。有研究表明,拟杆菌门丰度受蓝细菌影响较大[28-30],拟杆菌门中的类群可进一步沉降和分解有机物,还有研究表明,其中的黄杆菌科Flavobacteriaceae等异养细菌在聚合物的微生物降解中发挥着重要作用,这对于水生生态系统的健康发展具有非常重要的作用[28-30],它们还可以通过降解来源于蓝藻等藻类的有机质来获得自身生长的能量来源[31]。淮河中下游沿岸城市污水排放在一定程度上导致蓝藻等营养物质增多,从而影响拟杆菌门在水环境中的丰度。河道丰度较高的鞘脂单胞菌目通常在受污染的土壤中分离,其中一些物种能够利用多环芳烃(PAH)作为碳源,这种菌属的发现,可能与受到了船舶污染有关。发酵单胞菌属和甲基养菌属为河道特有的两种菌属,发酵单胞菌属具有MTBE(甲基叔丁基醚,Methyl tert-butyl ether)降解能力[32],甲基养菌属则是一种运用于乙醇发酵的菌属[33],这两种特有菌属的发现可能与河道沿岸的工业发展有关。
入江口中变形菌门和酸杆菌门丰度较高,变形菌门中的较多菌群是重金属污染土壤中的优势类群[34],酸杆菌门一般被认为是生活在重金属污染区域等酸性较强的环境中[35],这说明入江口可能存在酸化现象。另外,入江口还富集β-变形菌纲,它对环境具有较强的选择性,其中具有较多与反硝化相关的菌群,而伯克氏菌目Burkholderiales、从毛单胞菌科Comamonadaceae中的部分菌种均与重金属及石油污染相关[36-40]。由于入江口所处的特殊地理位置,以及多种因子间的交互作用,导致入江口处微生物多样性极其复杂,这种情况与渤海三湾有相似之处,均是受到了人类活动和河口输出的影响[41-42]。
参照《地表水环境质量标准》可发现,本次采样各位点中的氮含量相对较高,同时结合微生物组成的结果,黄杆菌属为反硝化细菌[43],红育菌属为异养脱氮菌[44],Limnohabitans属的作用是参与氮循环和分解蓝藻[11],这3种菌属为各分组丰度排名前3的共有菌属,其他占比超过1%的菌属Fluviicola(利用硝态氮)、沉积物杆状菌属[45]和甲基娇养杆菌属(脱氮菌属),它们的功能均指向水体中的氮利用。微生物群落也是水体富营养程度的重要生态指标,放线菌门在各采位点中均占主导地位,这与本次调查中普遍存在的水体富营养化密切相关[46]。
环境因子与Alpha多样性的关联分析结果显示,相关性较高的环境因子为![]() 和CODMn,各位点普遍存在的菌属受多种环境因子影响,而部分位点中的特有属与环境因子的相关性则较为明确。其中HTCC、Fluviicola、多核杆菌属、Limnohabitans、发酵单胞菌属和甲基养菌属与pH相关,水体pH是影响水体微生物群落结构的重要因素,可通过影响微生物的生命代谢活动等对微生物的群落结构产生影响[11],也是汾河入黄口[47]、李渡新区小流域[11]水体微生物群落结构的主要影响因子之一。本研究中,CCA分析结果显示,
和CODMn,各位点普遍存在的菌属受多种环境因子影响,而部分位点中的特有属与环境因子的相关性则较为明确。其中HTCC、Fluviicola、多核杆菌属、Limnohabitans、发酵单胞菌属和甲基养菌属与pH相关,水体pH是影响水体微生物群落结构的重要因素,可通过影响微生物的生命代谢活动等对微生物的群落结构产生影响[11],也是汾河入黄口[47]、李渡新区小流域[11]水体微生物群落结构的主要影响因子之一。本研究中,CCA分析结果显示,![]() 和pH是影响群落组成主要的环境因子。安徽段3个采样点的样本差异较大,环境影响因子也不同,可能与安徽段各采样点间存在闸口且汇入的支流较多有关。河道组的微生物群落结构相似,也具有类似的环境影响因子。
和pH是影响群落组成主要的环境因子。安徽段3个采样点的样本差异较大,环境影响因子也不同,可能与安徽段各采样点间存在闸口且汇入的支流较多有关。河道组的微生物群落结构相似,也具有类似的环境影响因子。
1)淮河中下游水体普遍存在富营养化情况,水质指标评价中总氮浓度普遍偏高,以及多种丰度较高的菌属与氮的相关关系,反映了各采样点的氮污染情况。
2)放线菌门、变形菌门和拟杆菌门是所有位点中共同的优势菌门,而安徽段疣微菌门相对丰度较高,洪泽湖中浮霉菌门的相对丰度较高,入江口中变形菌门和酸杆菌门相对丰度较高;黄杆菌属、红育菌属和Limnohabitans属在各位点中丰度最高,发酵单胞菌属和甲基养菌属是河道组特有的菌属,而HTCC、弓形杆菌属和突柄杆菌属则是入江口、支流和洪泽湖3个生境组所特有。优势类群的差异与不同生境组的污染状况及地理位置密切相关。
3)CODMn、Chl-a、TP、TUR、pH和![]() 是中下游水体微生物的主要环境影响因子,对微生物群落的丰富度、多样性及优势种均有一定影响,今后可以将微生物的组成和变化情况纳入淮河中下游水质的健康状况监测指标。
是中下游水体微生物的主要环境影响因子,对微生物群落的丰富度、多样性及优势种均有一定影响,今后可以将微生物的组成和变化情况纳入淮河中下游水质的健康状况监测指标。
[1] 李波,濮培民.淮河流域及洪泽湖水质的演变趋势分析[J].长江流域资源与环境,2003,12(1):67-73.
LI B,PU P M.Study on the evolution tendency of water quality in Huai River Basin and Hongze Lake[J].Resources and Environment in the Yangtze Basin,2003,12(1):67-73.(in Chinese)
[2] 魏卿,薛联青,张敏,等.淮河流域环境流变化及其对洪泽湖鱼类栖息地的生态影响[J].水资源保护,2019,35(4):89-94.
WEI Q,XUE L Q,ZHANG M,et al.Changes of environmental flow in Huaihe River Basin and its ecological impact on fish habitat in Hongze Lake[J].Water Resources Protection,2019,35(4):89-94.(in Chinese)
[3] 谭炳卿,吴培任,宋国君.论淮河流域水污染及其防治[J].水资源保护,2005,21(6):4-10.
TAN B Q,WU P R,SONG G J.Water pollution and control of the Huaihe River Basin[J].Water Resources Protection,2005,21(6): 4-10.(in Chinese)
[4] BAI Y,RUAN X H,XIE X C,et al.Antibiotic resistome profile based on metagenomics in raw surface drinking water source and the influence of environmental factor:a case study in Huaihe River Basin,China[J].Environmental Pollution,2019,248:438-447.
[5] WANG G G,FENG L J,QI J S,et al.Influence of human activities and organic matters on occurrence of polybrominated diphenyl ethers in marine sediment core:a case study in the Southern Yellow Sea,China[J].Chemosphere,2017,189:104-114.
[6] WANG J,LIU G J,LIU H Q,et al.Multivariate statistical evaluation of dissolved trace elements and a water quality assessment in the middle reaches of Huaihe River,Anhui,China[J].Science of the Total Environment,2017,583:421-431.
[7] LUO Z L,ZUO Q T,SHAO Q X.A new framework for assessing river ecosystem health with consideration of human service demand[J].Science of the Total Environment,2018,640/641:442-453.
[8] 罗连升,徐敏,何冬燕.2000年以来淮河流域夏季降水年代际特征及大气环流异常[J].干旱气象,2019,37(4):540-549.
LUO L S,XU M,HE D Y.Interdecadal characteristics of summer precipitation over Huaihe River Basin and the associated atmospheric circulation anomalies since 2000[J].Journal of Arid Meteorology,2019,37(4):540-549.(in Chinese)
[9] 王婕.淮河中游(安徽段)微量元素的环境地球化学研究[D].合肥:中国科学技术大学,2017.
WANG J.The environmental geochemistry of trace elements in the middle reaches of the Huaihe River,Anhui,China[D].Hefei:University of Science and Technology of China,2017.(in Chinese)
[10] 罗斌,刘玲,张金良,等.淮河干流沉积物中重金属含量及分布特征[J].环境与健康杂志,2010,27(12):1122-1127.
LUO B,LIU L,ZHANG J L,et al.Levels and distribution characteristics of heavy metals in sediments in main stream of Huaihe River[J].Journal of Environment and Health,2010,27(12):1122-1127.(in Chinese)
[11] 朱金山,秦海兰,孙启耀,等.冬季小流域水体微生物多样性及影响因素[J].环境科学,2020,41(11):5016-5026.
ZHU J S,QIN H L,SUN Q Y,et al.Microbial diversity and influencing factors in a small watershed in winter[J].Environmental Science,2020,41(11):5016-5026.(in Chinese)
[12] 陈兆进,丁传雨,朱静亚,等.丹江口水库枯水期浮游细菌群落组成及影响因素研究[J].中国环境科学,2017,37(1):336-344.
CHEN Z J,DING C Y,ZHU J Y,et al.Community structure and influencing factors of bacterioplankton during low water periods in Danjiangkou Reservoir[J].China Environmental Science,2017,37(1):336-344.(in Chinese)
[13] 东新旭,范立民,裘丽萍,等.长江下游水体微生物群落代谢多样性及影响因素研究[J].中国农学通报,2020,36(33):58-65.
DONG X X,FAN L M,QIU L P,et al.Metabolic diversity of microbial communities in the lower reaches of the Yangtze River and the influencing factors[J].Chinese Agricultural Science Bulletin,2020,36(33):58-65.(in Chinese)
[14] 李金业,陈庆锋,李青,等.黄河三角洲滨海湿地微生物多样性及其驱动因子[J].生态学报,2021,41(15):6103-6114.
LI J Y,CHEN Q F,LI Q,et al.Analysis of microbial diversity and driving factors in coastal wetlands of the Yellow River Delta[J].Acta Ecologica Sinica,2021,41(15):6103-6114.(in Chinese)
[15] 赵萌萌.黄河兰州段枯水期和丰水期水体理化性质变化及细菌群落结构特征[D].兰州:兰州交通大学,2018.
ZHAO M M.Variation characteristics of physical,chemical and bacterial community structure of water in Lanzhou section of Yellow River in dry and wet season[D].Lanzhou:Lanzhou Jiatong University,2018.(in Chinese)
[16] 苏建强,安新丽,胡安谊,等.城市环境生物安全研究的进展与挑战[J].环境科学,2021,42(6):2565-2572.
SU J Q,AN X L,HU A Y,et al.Advances and challenges in biosafety research for urban environments[J].Environmental Science,2021,42(6):2565-2572.(in Chinese)
[17] 金相灿,屠清瑛.湖泊富营养化调查规范[M].2版.北京:中国环境科学出版社,1990.
JIN X C,TU Q Y.The standard methods for obervation and analysis in lake eutrophication[M].2nd edition.Beijing:China Environmental Science Press,1990.(in Chinese)
[18] 国家环境保护总局,国家质量监督检验检疫总局.地表水环境质量标准:GB 3838—2002[S].北京:中国环境科学出版社,2002.
State Environmental Protection Administration of the People’s Republic of China,General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China.Environmental quality standards for surface water:GB 3838—2002[S].Beijing:China Environment Science Press,2002.(in Chinese)
[19] CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336.
[20] CHAUDHARY A,KAUSER I,RAY A,et al.Taxon-driven functional shifts associated with storm flow in an urban stream microbial community[J].mSphere,2018,3(4):e00194-e00118.
[21] 任丽娟,何聃,邢鹏, 等.湖泊水体细菌多样性及其生态功能研究进展[J].生物多样性,2013,21(4):422-433.
REN L J,HE D,XING P,et al.Bacterial diversity and ecological function in lake water bodies[J].Biodiversity Science,2013,21(4):422-433.(in Chinese)
[22] HAHN M W.The microbial diversity of inland waters[J].Current Opinion in Biotechnology,2006,17(3):256-261.
[23] LIU T,ZHANG A N,WANG J W,et al.Integrated biogeography of planktonic and sedimentary bacterial communities in the Yangtze River[J].Microbiome,2018,6:16.
[24] HE Y D,SEN B,ZHOU S Y,et al.Distinct seasonal patterns of bacterioplankton abundance and dominance of Phyla α-proteobacteria and cyanobacteria in Qinhuangdao coastal waters off the Bohai Sea[J].Frontiers in Microbiology,2017,8:1579.
[25] 陈波.南昌城区对赣江水化学和细菌群落特征的影响[D].南昌:江西师范大学,2017.
CHEN B.Impacts of Nanchang urban area on hydrochemical and bacterial community characteristics in Ganjiang River[D].Nanchang:Jiangxi Normal University,2017.(in Chinese)
[26] PARK M,RYU S H,VU T H T,et al.Flavobacterium defluvii sp.nov.,isolated from activated sludge[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(2):233-237.
[27] 邱楚雯,袁新程,施永海,等.池塘鱼菜立体种养系统的微生物群落结构分析[J].大连海洋大学学报,2021,36(3):454-461.
QIU C W,YUAN X C,SHI Y H,et al.Analysis of microbiota structure of the in-pond three-dimensional culture system[J].Journal of Dalian Ocean University,2021,36(3):454-461.(in Chinese)
[28] NIU Y,SHEN H,CHEN J,et al.Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu,China[J].Water Research,2011,45(14):4169-4182.
[29] 奚万艳,吴鑫,叶文瑾,等.太湖梅梁湾水域蓝藻水华前与水华末期细菌群落结构的变化[J].应用与环境生物学报,2007,13(1):97-103.
XI W Y,WU X,YE W J,et al.Changes in bacterial community structure during preceding and degraded period of cyanobacterial bloom in a bay of the Taihu Lake[J].Chinese Journal of Applied & Environmental Biology,2007,13(1):97-103.(in Chinese)
[30] 郑小红,肖琳,任晶,等.玄武湖微囊藻水华暴发及衰退期细菌群落变化分析[J].环境科学,2008,29(10):2956-2962.
ZHENG X H,XIAO L,REN J,et al.Variation of bacterial community composition in the outbreak and decline of Microcystis spp. bloom in lake Xuanwu[J].Environmental Science,2008,29(10):2956-2962.(in Chinese)
[31] MARUYAMA T,PARK H D,OZAWA K,et al.Sphingosinicella microcystinivorans gen.nov.,sp.nov.,a microcystin-degrading bacterium[J].International Journal of Systematic and Evolutionary Microbiology,2006,56(Pt 1):85-89.
[32] 褚其英,姚露露,吕雄标,等.生物滴滤塔净化甲基叔丁基醚废气的研究[J].环境科学,2018,39(2):633-639.
CHU Q Y,YAO L L,LÜ X B,et al.Treatment of the waste gas containing methyl tert-butyl ether via a biotrickling filter[J].Environmental Science,2018,39(2):633-639.(in Chinese)
[33] SWINGS J,DE LEY J.The biology of zymomonas[J].Bacteriological Reviews,1977,41(1):1-46.
[34] 江玉梅,张晨,黄小兰,等.重金属污染对鄱阳湖底泥微生物群落结构的影响[J].中国环境科学,2016,36(11):3475-3486.
JIANG Y M,ZHANG C,HUANG X L,et al.Effect of heavy metals in the sediment of Poyang Lake Estuary on microbial communities structure base on Mi-seq sequencing[J].China Environmental Science,2016,36(11):3475-3486.(in Chinese)
[35] 刘欣.胶州湾沉积物细菌多样性及菌群时空分布规律研究[D].青岛:中国科学院研究生院(海洋研究所),2010.
LIU X.Diversity and temporal-spatial variability of sediment bacterial communities in Jiaozhou Bay[D].Qingdao:Institute of Oceanology,Chinese Academy of Sciences,2010.(in Chinese)
[36] HALAK S,BASTA T,BÜRGER S,et al.4-sulfomuconolactone hydrolases from Hydrogenophaga intermedia S1 and Agrobacterium radiobacter S2[J].Journal of Bacteriology,2007,189(19):6998-7006.
[37] NISHINO S F,PAOLI G C,SPAIN J C.Aerobic degradation of dinitrotoluenes and pathway for bacterial degradation of 2,6-dinitrotoluene[J].Applied and Environmental Microbiology,2000,66(5):2139-2147.
[38] SINKKO H,LUKKARI K,SIHVONEN L M,et al.Bacteria contribute to sediment nutrient release and reflect progressed eutrophication-driven hypoxia in an organic-rich continental sea[J].PLoS One,2013,8(6):e67061.
[39] ZHANG W,CHEN L,ZHANG R,et al.High throughput sequencing analysis of the joint effects of BDE209-Pb on soil bacterial community structure[J].Journal of Hazardous Materials,2016,301:1-7.
[40] RAJAPAKSHA R M C P,TOBOR-KAP ON M A,BÅÅTH E.Metal toxicity affects fungal and bacterial activities in soil differently[J].Applied and Environmental Microbiology,2004,70(5):2966-2973.
ON M A,BÅÅTH E.Metal toxicity affects fungal and bacterial activities in soil differently[J].Applied and Environmental Microbiology,2004,70(5):2966-2973.
[41] 王彩霞,王毅波,刘鹏远,等.渤海三湾表层水域细菌群落结构多样性及其环境因子分析[J].微生物学通报,2018,45(9):1956-1971.
WANG C X,WANG Y B,LIU P Y,et al.Diversity of bacterial community structure and its driving factors in three bays of Bohai Sea[J].Microbiology China,2018,45(9):1956-1971.(in Chinese)
[42] 晏维金.人类活动影响下营养盐向河口/近海的输出和模型研究[J].地理研究,2006,25(5):825-835.
YAN W J.Summary of human activities on global nutrient export from watersheds to estuaries and coastal water:biogeochemical cycles and modeling[J].Geographical Research,2006,25(5):825-835.(in Chinese)
[43] CALV L,VILA X,ABELLA C A,et al.Use of the ammonia-oxidizing bacterial-specific phylogenetic probe Nso1225 as a primer for fingerprint analysis of ammonia-oxidizer communities[J].Applied Microbiology and Biotechnology,2004,63(6):715-721.
L,VILA X,ABELLA C A,et al.Use of the ammonia-oxidizing bacterial-specific phylogenetic probe Nso1225 as a primer for fingerprint analysis of ammonia-oxidizer communities[J].Applied Microbiology and Biotechnology,2004,63(6):715-721.
[44] 李小义,王丽萍,杜雅萍,等.好氧反硝化微生物多样性及其反硝化功能初步研究[J].氨基酸和生物资源,2016,38(2):37-45.
LI X Y,WANG L P,DU Y P,et al.Diversity of aerobic denitrifying microbes from various environment and analysis of their denitrification ability[J].Amino Acids & Biotic Resources,2016,38(2):37-45.(in Chinese)
[45] 江肖良,李孟,张少辉,等.4种不同工况生物滤池净化效能与微生物特性分析[J].环境科学,2018,39(12):5503-5513.
JIANG X L,LI M,ZHANG S H,et al.Purification efficiency and microbial characteristics of four biofilters operated under different conditions[J].Environmental Science,2018,39(12):5503-5513.(in Chinese)
[46] 文新宇,谌书,杨远坤,等.缓丘地带黄河镇水库微生物群落多样性特征[J].应用与环境生物学报,2022,28(1):167-174.
WEN X Y,CHEN S,YANG Y K,et al.Characteristics of microbial community diversity in the gentle hilly area-Huanghe Town Reservoir[J].Chinese Journal of Applied and Environmental Biology,2022,28(1):167-174.(in Chinese)
[47] 刘峰,冯民权,王毅博.汾河入黄口夏季微生物群落结构分析[J].微生物学通报,2019,46(1):54-64.
LIU F,FENG M Q,WANG Y B.Microbial community structure of estuary of the Fenhe River into the Yellow River in summer[J].Microbiology China,2019,46(1):54-64.(in Chinese)