刺参Apostichopus japonicus隶属于棘皮动物门Echinodermata海参纲Holothuroidea楯手目Aspidochirotida刺参科Stichopodidae仿刺参属Apostichopus,主要分布在日本、朝鲜、俄罗斯远东地区沿海,以及中国山东半岛和辽东半岛沿海。刺参具有极高的营养和药用价值,如肠道和体壁中富含人体必需元素(Fe、Cu、Mn和Zn等)和必需脂肪酸,同时,体壁中丰富的酸性黏多糖具有增强人体免疫的作用[1-2],因而备受消费者青睐。近年来,海参养殖业蓬勃发展,截至2020年,中国海参养殖产量达196 564 t[3],已成为海水养殖业的重要组成部分。消化道是刺参食物消化与吸收的主要场所,也是其生长和发育的重要基础,因此,开展消化道组织、形态和功能的研究,对于探索刺参摄食、消化、吸收和免疫等机制至关重要。目前,国内外学者对刺参消化道组织结构和消化酶相关研究较多,主要集中在消化道的组织学和组织化学[4-6],以及间歇投喂[7]、盐度胁迫[8]和氨氮胁迫[9]等模式下刺参消化酶活性变化等。
黏液细胞广泛存在于水生动物的消化道、表皮和呼吸器官中,属于腺体细胞[10]。在水生动物消化道中,由黏液细胞分泌产生的以黏蛋白为主的黏液,在维持消化道润滑、促进物质消化吸收和构建肠道上皮保护屏障等方面具有重要作用,并为数以亿计的肠道共生微生物提供寄居场所和部分食物来源,共同维护肠道微生态平衡[11]。目前,国内外关于水生动物消化道黏液细胞的研究主要集中在鱼类,如对大鳞副泥鳅Paramisgurnus dabryanus仔稚鱼[12]、豹纹鳃棘鲈Plectropomus leopardus[13]、大口黑鲈Micropterus samoides[14]、小黄鱼Larimichthys polyactis[15]、建鲤Cyprinus carpio var.Jian[16]和半滑舌鳎Cynoglossus semilaevis[17]等鱼类肠道黏液细胞的类型、分布、功能和黏液成分的研究。对无脊椎海洋动物消化道黏液细胞的相关研究主要集中在贝类,如对海湾扇贝Argopecten irradians[18]、文蛤Meretrix meretrix[19]的消化道黏液细胞类型和分布的研究。然而,有关刺参消化道黏液细胞的系统研究目前鲜有报道。本研究中,以刺参为试验材料,研究了其肠道不同部位(前肠、中肠和后肠)的组织结构、黏液细胞分布与消化酶活性的变化特征,以期为刺参后续的饲料开发、生态养殖和科学投喂等提供有益参考。
1 材料与方法
1.1 材料
试验用刺参于2020年5月购自山东烟台安源水产股份有限公司,个体体质量为(43.58±6.78)g。伊红(H.E)染色试剂盒及阿利新蓝-过碘酸雪夫(AB-PAS)染色试剂盒均为北京Solarbio科技有限公司生产。
1.2 方法
1.2.1 样品的采集 随机取10头刺参,解剖取其前、中、后肠,迅速置于Bouin’s液中固定24 h,然后保存于体积分数为70%的乙醇中,用于切片观察;随机取8头刺参,解剖取其前、中、后肠,放入液氮中速冻后于-80 ℃超低温冰箱中保存,用于肠道消化酶活性测定。
1.2.2 组织学和组织化学分析 采用常规石蜡切片方法,切片厚度为10 μm,用H.E染色,在Zeiss显微镜下观察并拍照。分别取3张肠道不同部位的切片,每张切片随机选取8个视野测量肠道黏膜层、黏膜下层、肌层和浆膜层的厚度,以及黏膜褶皱高度和数量。
将上述刺参肠道组织切片经AB-PAS染色,观察肠道黏液细胞的类型和分布特征。分别取3张肠道不同部位的切片,每张切片随机选取5个视野,对黏液细胞类型、分布和数量进行观察和统计,以每一视野中100 μm×100 μm范围内黏液细胞数量为标准。
依据本试验中AB-PAS组织切片染色结果和尹苗等[20]对黏液细胞的划分标准,将黏液细胞划分为4种类型:Ⅰ型黏液细胞含中性黏多糖,呈红色(AB阴性,PAS阳性);Ⅱ型黏液细胞含酸性黏多糖,呈蓝色(AB阳性,PAS阴性);Ⅲ型黏液细胞包含大量中性黏多糖和少量酸性黏多糖,呈紫红色(AB阳性,PAS阳性);Ⅳ型黏液细胞包含大量酸性黏多糖和少量中性黏多糖,呈蓝紫色(AB阳性,PAS阳性)。
1.2.3 消化酶活性测定 前、中、后肠样品经称重后,按质量与体积比为1∶9(g∶mL)加入Tris-HCl缓冲液[21](0.01 mol/L Tris-HCl,其中含0.1 mol/L EDTA-2Na、0.01 mol/L蔗糖、8 g/L NaCl, pH 7.4)匀浆,将制备好的质量分数为10%的组织匀浆液在4 ℃下以2 000 r/min离心15 min,取上清液。通过多功能酶标仪(Biotek,Epoch 2)和紫外可见光分光光度计(INESA,L5S)检测吸光度。采用南京建成科技有限公司生产的试剂盒测定脂肪酶、胰蛋白酶、碱性磷酸酶和淀粉酶活力,采用上海Beyotime生物技术有限公司生产的试剂盒测定蛋白质浓度。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,采用SPSS 18.0软件对试验数据进行单因素方差分析(one-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 刺参肠道不同部位的组织结构
刺参肠道组织切片显示,前、中、后肠组织结构相似,均由黏膜层、黏膜下层、肌层和浆膜层组成(图1)。
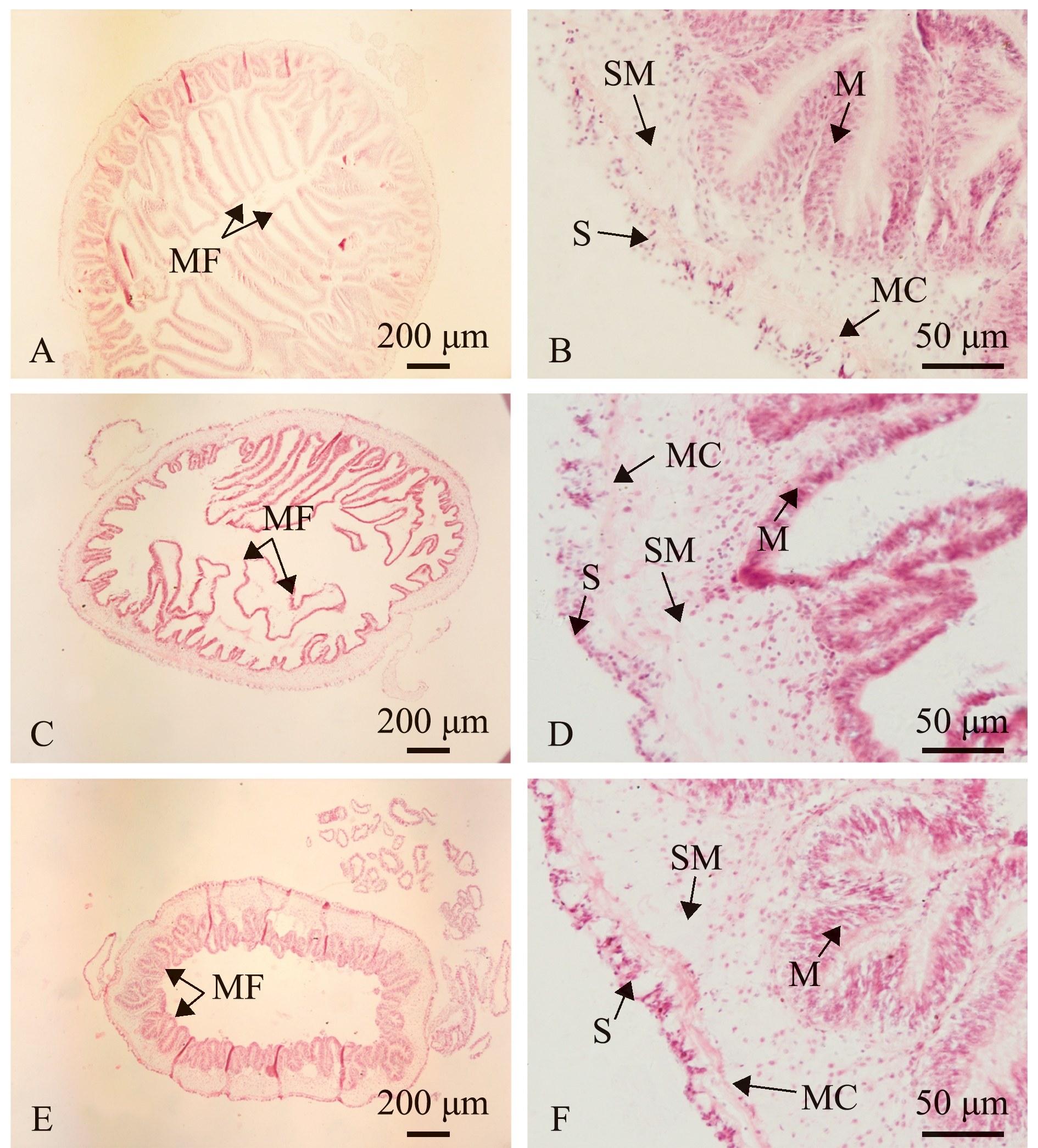
A、B—前肠;C、D—中肠;E、F—后肠;M—黏膜层;MC—肌肉层;MF—黏膜褶皱;S—浆膜层;SM—黏膜下层。
A and B—foregut; C and D—midgut; E and F—hindgut; M—mucosa; MC—muscularis; MF—mucosa fold; S—serosa; SM—submucosa.
图1 刺参肠道组织学结构
Fig.1 Histological structure of intestinal tract of sea cucumber Apostichopus japonicus
从表1可见:刺参肠道中,黏膜层厚度依次为前肠>中肠>后肠,其中,前肠黏膜层厚度显著高于中肠和后肠(P<0.05);黏膜下层厚度依次为后肠>中肠>前肠,且三者均存在显著性差异(P<0.05),其中前肠黏膜下层厚度仅为后肠的49.44%;肌层厚度依次为前肠>后肠>中肠,其中前肠肌层厚度显著高于中肠和后肠(P<0.05);前、中、后肠浆膜层厚度无显著性差异(P>0.05)。
刺参各肠段黏膜层上均散布黏膜褶皱(图1A、C、E),前肠黏膜褶皱数量和高度均高于中肠和后肠,后肠黏膜褶皱数量和高度最低(表1)。
表1 刺参肠道组织形态参数测量结果
Tab.1 Morphometric parameters of intestinal tract tissues of sea cucumber Apostichopus japonicus
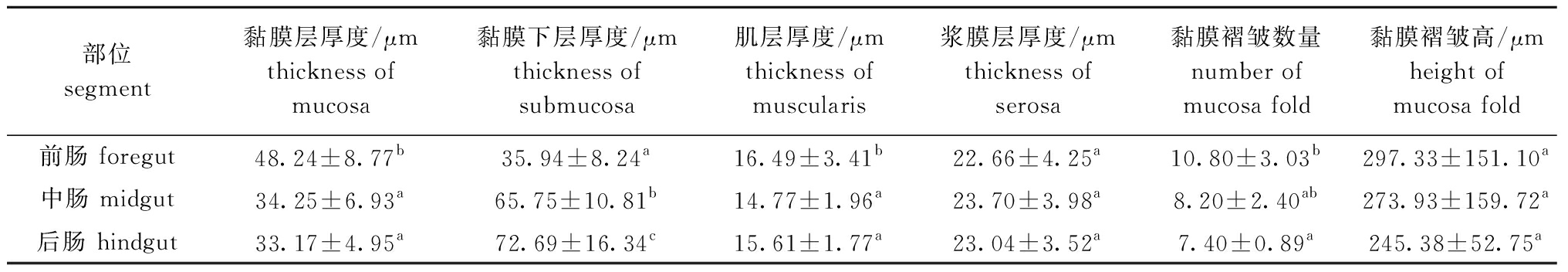
部位segment黏膜层厚度/μmthickness of mucosa黏膜下层厚度/μmthickness of submucosa肌层厚度/μmthickness of muscularis浆膜层厚度/μmthickness of serosa黏膜褶皱数量number of mucosa fold黏膜褶皱高/μmheight of mucosa fold前肠 foregut48.24±8.77b35.94±8.24a16.49±3.41b22.66±4.25a10.80±3.03b297.33±151.10a中肠 midgut34.25±6.93a65.75±10.81b14.77±1.96a23.70±3.98a8.20±2.40ab273.93±159.72a后肠 hindgut33.17±4.95a72.69±16.34c15.61±1.77a23.04±3.52a7.40±0.89a245.38±52.75a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note: The means with different letters within same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
2.2 刺参肠道不同部位黏液细胞类型及分布特征
刺参肠道中,前、中、后肠均含Ⅰ型、Ⅱ型、Ⅲ型和Ⅳ型4种类型的黏液细胞(图2)。
从黏液细胞数量来看:从前肠至后肠,黏液细胞总数量呈递减趋势,三者间无显著性差异(P>0.05),但各类型黏液细胞数量有一定差异;Ⅰ型黏液细胞数量依次为中肠>前肠>后肠,前肠和中肠Ⅰ型黏液细胞数量显著高于后肠(P<0.05);Ⅱ型黏液细胞数量依次为前肠>中肠>后肠,前肠和中肠Ⅱ型黏液细胞数量显著高于后肠(P<0.05),后肠Ⅱ型黏液细胞数量仅为前肠的44.44%;Ⅲ型和Ⅳ型黏液细胞数量依次为前肠>中肠>后肠,三者间存在显著性差异(P<0.05)(表2)。
从黏液细胞分布来看:前、中、后肠中,4种黏液细胞数量分布均为Ⅳ型>Ⅲ型>Ⅱ型>Ⅰ型,其中前、中、后肠Ⅳ型黏液细胞数量分别占黏液细胞总数的42.80%、40.07%和49.00%(表2)。
表2 刺参肠道一个视野(100 μm×100 μm)中黏液细胞的数量及其占比
Tab.2 Number and proportion of mucous cells in one field (100 μm×100 μm) of the intestinal tract of sea cucumber Apostichopus japonicus

部位 segmentⅠ型 typeⅠⅡ型 typeⅡⅢ型 type ⅢⅣ型 type Ⅳ总数量 total前肠 foregut6.00±3.04b(6.68%)16.20±6.83b(18.03%)29.20±7.15c(32.49%)38.46±7.79c(42.80%)89.86±14.28a中肠 midgut7.93±2.73b(10.50%)15.20±6.15b(20.13%)22.13±6.68b(29.30%)30.26±3.51b(40.07%)75.52±9.55a后肠 hindgut2.93±3.15a(5.86%)7.20±5.08a(14.38%)15.40±7.49a(30.76%)24.53±3.87a(49.00%)50.06±9.54a
注:括号内数值为前、中、后肠中不同类型黏液细胞数量分别占黏液细胞总数的百分比。
Note: The value in parentheses is the percentage of different types of mucous cells in the foregut, midgut and hindgut to the total number of mucous cells.
2.3 刺参肠道不同部位消化酶活性
从表3可见:刺参肠道中,前肠胰蛋白酶活力和淀粉酶活力最高,且显著高于中肠和后肠(P<0.05);脂肪酶活力依次为前肠>后肠>中肠,前肠脂肪酶活力显著高于中肠(P<0.05);碱性磷酸酶活力依次为前肠>中肠>后肠,前肠和中肠碱性磷酸酶活力显著高于后肠(P<0.05)。
表3 刺参肠道消化酶活力
Tab.3 Relative digestive enzyme activities of intestinal tract of sea cucumber Apostichopus japonicus U/mg prot

部位 segment胰蛋白酶 trypsin脂肪酶 lipase淀粉酶 amylase碱性磷酸酶 alkaline phosphatase前肠 foregut1 344.30±405.90b0.28±0.04b0.34±0.18b308.23±29.44b中肠 midgut732.15±473.73a0.18±0.12a0.17±0.09a246.10±80.29b后肠 hindgut269.27±239.77a0.24±0.04ab0.10±0.05a163.12±69.84a
3 讨论
3.1 刺参肠道组织结构
刺参肠道组织由内向外依次为黏膜层、黏膜下层、肌层和浆膜层[4,22-23],黏膜层上分布有发达的微绒毛和分泌黏液的黏液细胞,富含各种消化酶,因此,肠道黏膜层是刺参消化吸收的主要部位,肠道黏膜层的厚度直接影响着营养物质吸收和转运扩散的速度[24-25]。本研究表明,刺参肠道黏膜层厚度在不同部位具有明显差异,从前肠至后肠依次递减,且前肠黏膜层厚度显著高于中肠和后肠,与同属海参纲的花刺参Stichopus monotuberculatus[6]、许氏枝柄参Cladolabes schmeltzii[25]和黑海参Holothuria atra[26]肠道变化趋势十分相似。同时,肠道黏膜层向内凸起形成许多黏膜褶皱,表面纹状缘发达,增大了肠道消化吸收面积[27]。研究表明,黏膜褶皱的数量、厚度和完整性是衡量肠道消化吸收功能的重要指标[28]。本试验中,刺参前肠的黏膜褶皱数量和高度均高于中肠和后肠,后肠黏膜褶皱数量和高度最低,由此推测,刺参前肠的消化吸收能力强于中肠和后肠。
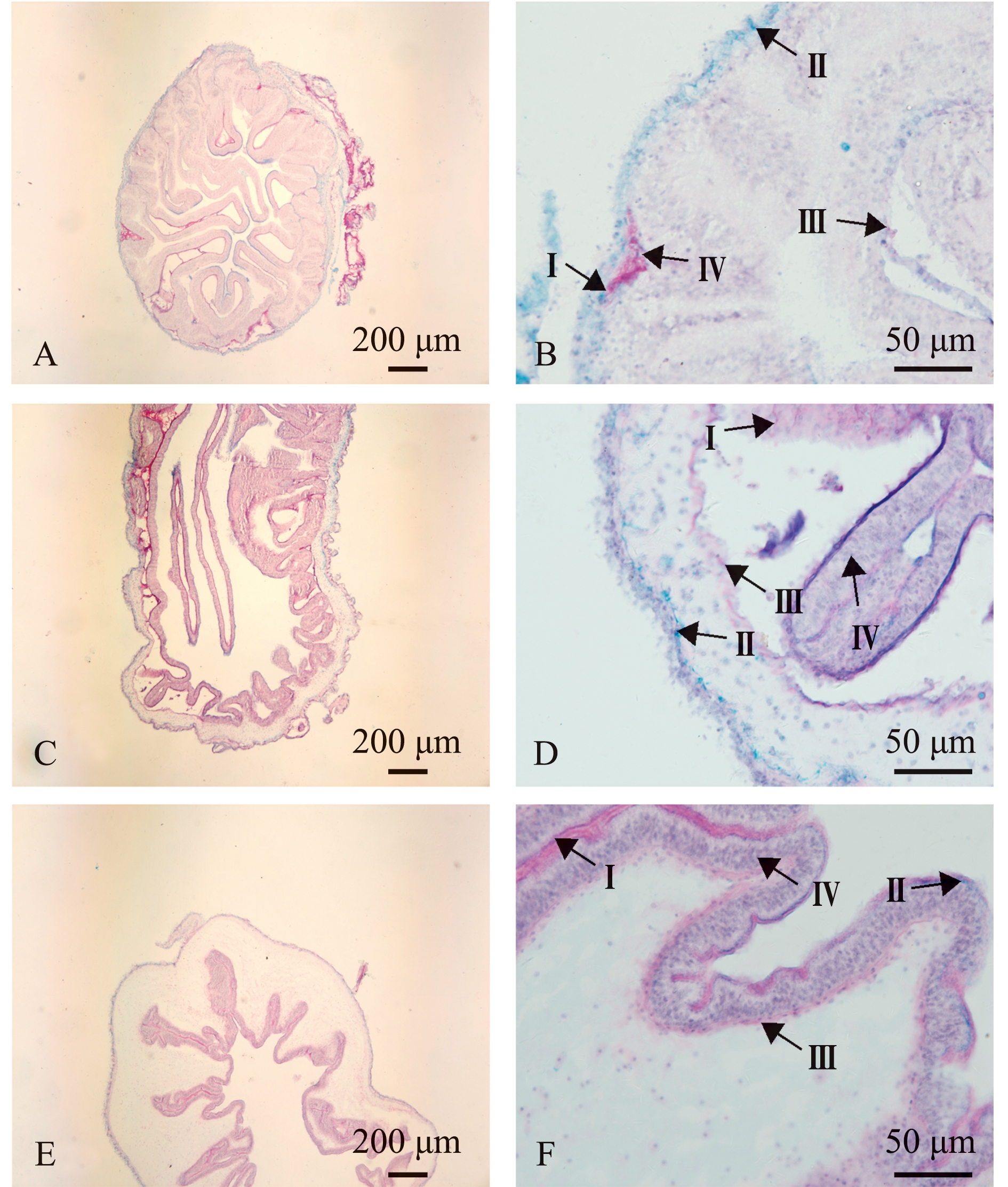
A、B—前肠;C、D—中肠;E、F—后肠;Ⅰ~Ⅳ—Ⅰ~Ⅳ型黏液细胞。
A and B—foregut; C and D—midgut; E amd F—hindgut; Ⅰ-Ⅳ—type Ⅰ to type Ⅳ mucous cells.
图2 刺参肠道黏液细胞分布
Fig.2 Distribution of mucous cell in intestinal tract of sea cucumber Apostichopus japonicus
刺参作为杂食性动物,其肠道内含物主要为各种无机微粒、贝壳碎片、棘皮动物骨骼残骸及碎屑颗粒等,为满足自身对营养物质的需求,刺参必须增加摄食的时间和数量[29-30]。本研究中发现,刺参肠道不同部位的肌层厚度依次为前肠>后肠>中肠,且前肠肌层厚度显著高于中肠和后肠。原因可能是:前肠肌层最厚且较发达,有助于食物和肠道消化酶进行充分接触,辅助增强消化吸收功能并推动食物团向中肠移动[31];其次,中肠肌层较前肠变薄,肠道蠕动减慢,以增加食物团消化吸收的时间;而后肠肌层再增厚,利于推动食物团的快速通过及食物残渣的排出[15]。
3.2 刺参肠道黏液细胞分布
消化道中的黏液细胞可以分泌黏液和消化酶,在促进营养物质吸收、维持肠道润滑通畅和抵御病原体侵害中具有重要作用[32]。因此,黏液细胞的数量、类型及分布特征可间接反映肠道的生理功能。对鱼类黏液细胞研究表明,在消化道的不同部位,黏液细胞的种类及数量分布具有明显差异[14,33]。本研究表明,刺参肠道不同部位的黏液细胞数量和类型分布亦存在一定的变化趋势,从黏液细胞数量上看,刺参前肠4种类型的细胞数量和黏液细胞总数量均高于中肠和后肠,推测刺参前肠具有较强的消化吸收功能,而后肠消化吸收功能较弱,与上述组织结构研究结果相一致;从黏液细胞分布类型看,刺参肠道各部位均包含4种黏液细胞类型,与对文蛤的研究结果一致[19]。同时,刺参肠道黏液细胞类型均以Ⅲ型和Ⅳ型为主,两类黏液细胞数量共占总黏液细胞数量比例达69%以上。研究表明,Ⅰ型和Ⅱ型黏液细胞为幼稚型,而Ⅲ型和Ⅳ型黏液细胞为成熟型[34],提示刺参消化道黏液细胞以成熟型为主,表明其具有稳定成熟的消化能力。本试验中,Ⅲ型黏液细胞在刺参前肠所占比例最高(32.49%),高于中肠和后肠(29.30%和30.76%)。由于Ⅲ型黏液细胞以中性黏蛋白为主,而中性黏蛋白能够降解大量食物颗粒,可配合碱性磷酸酶将食物转化成食糜[35],有助于食物的消化和吸收。由此推测,刺参前肠的黏液细胞类型组成有助于增强对食物颗粒的消化吸收能力。本试验中,Ⅳ型黏液细胞在刺参后肠所占比例最高(49.00%),高于前肠和中肠(42.80%和40.07%)。由于Ⅳ型黏液细胞以酸性黏蛋白为主,而酸性黏蛋白可包围并消除许多病原微生物,如硫酸化黏蛋白对细菌蛋白酶和糖苷酶的酶降解具有良好的抗性,有助于防止细菌定植,因此,可以保护肠道上皮细胞免受病原微生物的入侵[36-37];同时酸性黏蛋白还可减免食物团和残渣通过肠道时对肠道造成的机械损伤,促进后肠残留物的消除[38]。由此推测,相比前肠和中肠,后肠具有更强的酸性黏蛋白分泌能力,可能在肠道免疫保护及黏膜免疫方面发挥重要作用。
3.3 刺参肠道消化酶活性
刺参消化道具有包括胰蛋白酶、脂肪酶和淀粉酶在内的多种消化酶活性,这表明这些酶在刺参肠道蛋白质、脂类和糖类消化吸收方面发挥重要作用[39]。碱性磷酸酶主要存在于鱼类前肠上皮细胞的浅部和纹状缘上,是一种金属酶,与肠道脂类、葡萄糖、钙和无机磷的吸收存在正相关性[40]。本研究中发现,刺参肠道不同部位均具有碱性磷酸酶活性,表明碱性磷酸酶在促进刺参肠道营养物质吸收方面发挥重要作用,这与崔龙波等[4]、姜令续等[41]关于刺参消化道酶活力的测定结果一致。本研究表明,刺参的肠道酶活力主要集中在前肠,中肠酶活力减弱,后肠消化酶活力最弱,这一消化道酶活力趋势与众多鱼类研究结果一致,如大鳞副泥鳅[12]、鳕Merluccius merluccius[42]和细点牙鲷Dentex dentex[43]等。由此推测,刺参前肠消化吸收能力较强,中肠为过渡连接,消化能力较弱,后肠消化能力最弱,但后肠分泌酸性黏蛋白的能力较强,这与前述刺参肠道组织结构和黏液细胞分布特征的研究结果相一致。
4 结论
1)刺参肠道不同部位各组织层厚度、黏膜褶皱高度和数量具有明显差异,刺参肠道组织结构与其功能相适应,前肠消化吸收能力高于中肠和后肠。
2)刺参肠道黏液细胞总数量从前肠至后肠呈递减趋势,肠道黏液细胞的类型、数量和分布特征与其发挥的生理功能密切相关。
3)刺参的肠道消化酶活性主要集中在前肠,中肠消化酶活性减弱,后肠消化酶活性最弱,表明刺参前肠消化吸收能力最强,中肠较弱,后肠消化能力最弱,但后肠分泌酸性黏蛋白的能力较强。
[1] SUN W H,LENG K L,LIN H,et al.Analysis and evaluation of chief nutrient composition in different parts of Stichopus japonicus[J].Chinese Journal of Animal Nutrition,2010,22(1):212-220.
[2] 姜森颢,任贻超,唐伯平,等.我国刺参养殖产业发展现状与对策研究[J].中国农业科技导报,2017,19(9):15-23.
JIANG S H,REN Y C,TANG B P,et al.Development status and countermeasures of Apostichopus japonicus culture industry in China[J].Journal of Agricultural Science and Technology,2017,19(9):15-23.(in Chinese)
[3] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2021中国渔业统计年鉴[M].北京:中国农业出版社,2021:23.
Fishery Administration of Ministry of Agriculture and Rural Affairs,Natonal Fishertes Technology Extension Center,China Society of Fisheries.2021 China fishery statistical yearbook[M].Beijing:China Agriculture Press,2021:23.(in Chinese)
[4] 崔龙波,董志宁,陆瑶华.仿刺参消化系统的组织学和组织化学研究[J].动物学杂志,2000,35(6):2-4.
CUI L B,DONG Z N,LU Y H.Histological and histochemical studies on the digestive system of Apostichopus japonicus[J].Chinese Journal of Zoology,2000,35(6):2-4.(in Chinese)
[5] 王吉桥,唐黎,许重,等.仿刺参消化道的组织学及其4种消化酶活力的周年变化[J].水产科学,2007,26(9):481-484.
WANG J Q,TANG L,XU C,et al.Histological observation of alimentary tract and annual changes of four digestive enzymes in sea cucumber(Apostichopus japonicus)[J].Fisheries Science,2007,26(9):481-484.(in Chinese)
[6] 张玥,高菲,许强.花刺参幼参摄食和消化器官形态学和组织学研究[J].海洋通报,2021,40(2):198-205.
ZHANG Y,GAO F,XU Q.Morphology and histology of feeding and digestive organs in juvenile Stichopus monotuberculatus[J].Marine Science Bulletin,2021,40(2):198-205.(in Chinese)
[7] 韩莎,胡炜,李成林,等.间歇投喂模式对刺参摄食、生长和消化酶活性的影响[J].中国农业科技导报,2021,23(1):194-200.
HAN S,HU W,LI C L,et al.Effects of intermittent feeding mode on feed,growth and digestive enzyme activities of sea cucumber,Apostichopus japonicus Selenka[J].Journal of Agricultural Science and Technology,2021,23(1):194-200.(in Chinese)
[8] 赵斌,胡炜,李成林,等.低盐和高盐环境下刺参选育品系生长与摄食性能研究[J].渔业科学进展,2021,42(3):139-146.
ZHAO B,HU W,LI C L,et al.Growth and feeding performance of selected breeding sea cucumber(Apostichopus japonicus) in low and high salt environments[J].Progress in Fishery Sciences,2021,42(3):139-146.(in Chinese)
[9] 胡炜,赵斌,李成林,等.慢性氨氮胁迫对刺参摄食与消化酶活性的影响[J].中国水产科学,2018,25(1):137-146.
HU W,ZHAO B,LI C L,et al.Effects of chronic ammonia nitrogen stress on the feeding and digestive enzyme activities of sea cucumber(Apostichopus japonicas Selenka)[J].Journal of Fishery Sciences of China,2018,25(1):137-146.(in Chinese)
[10] 杨桂文,安利国.鱼类黏液细胞研究进展[J].水产学报,1999,23(4):403-408.
YANG G W,AN L G.A review on the researches of fish mucous cells[J].Journal of Fisheries of China,1999,23(4):403-408.(in Chinese)
[11] 黄春兰,曾悦.杯状细胞及肠道黏液屏障的功能研究[J].国际消化病杂志,2017,37(6):357-360.
HUANG C L,ZENG Y.Study on the function of goblet cells and intestinal mucous barrier[J].International Journal of Digestive Diseases,2017,37(6):357-360.(in Chinese)
[12] 刘亚秋,李芳,赵健蓉,等.大鳞副泥鳅仔稚鱼消化道黏液细胞分布及发育[J].动物学杂志,2016,51(4):623-632.
LIU Y Q,LI F,ZHAO J R,et al.Distribution and development of mucous cells in digestive tract of larvae and juvenile in loach(Paramisgurnus dabryanus)[J].Chinese Journal of Zoology,2016,51(4):623-632.(in Chinese)
[13] 王永波,张杰,李向民.豹纹鳃棘鲈消化道黏液细胞的类型与分布[J].海洋渔业,2016,38(5):478-486.
WANG Y B,ZHANG J,LI X M.Types and distribution of mucous cells in the digestive tract of Plectropomus leopardus[J].Marine Fisheries,2016,38(5):478-486.(in Chinese)
[14] 赵柳兰,陈侨兰,杨淞,等.大口黑鲈消化道组织结构及黏液细胞的类型和分布[J].四川农业大学学报,2018,36(4):549-554.
ZHAO L L,CHEN Q L,YANG S,et al.Analysis of the histological structure,the types and distribution of mucous cells of digestive tract in largemouth bass(Micropterus samoides)[J].Journal of Sichuan Agricultural University,2018,36(4):549-554.(in Chinese)
[15] 陈寅儿,郑学斌,高心明,等.小黄鱼(Larimichthys polyactis)消化道形态与组织学结构特征及其消化酶活性的研究[J].海洋与湖沼,2019,50(5):1116-1126.
CHEN Y E,ZHENG X B,GAO X M,et al.Morphology histology and digestive enzymes of the digestive tract of the small yellow croaker Iarimichthys polyactis[J].Oceanologia et Limnologia Sinica,2019,50(5):1116-1126.(in Chinese)
[16] 陈坤,孙敬锋,韩卓然,等.建鲤肠道中4种胞内酶和黏液细胞的分布及组织化学定位[J].大连海洋大学学报,2021,36(5):760-766.
CHEN K,SUN J F,HAN Z R,et al.Distribution and histochemical location of four types of intracellular enzymes and mucous cells in theintestines of common carp Cyprinus carpio var.Jian[J].Journal of Dalian Ocean University,2021,36(5):760-766.(in Chinese)
[17] WANG Y Z,SUN J F,LV A J,et al.Histochemical distribution of four types of enzymes and mucous cells in the gastrointestinal tract of reared half-smooth tongue sole Cynoglossus semilaevis[J].Journal of Fish Biology,2018,92(1):3-16.
[18] 王宜艳,孙虎山,孙修勤,等.海湾扇贝消化系统黏液细胞的类型与分布[J].中国水产科学,2003,10(3):254-257.
WANG Y Y,SUN H S,SUN X Q,et al.Types and distribution of mucous cells in the digestive system of scallop Argopecten irradians[J].Journal of Fishery Sciences of China,2003,10(3):254-257.(in Chinese)
[19] 杨宁,任素莲,宋微波.文蛤消化道黏液细胞研究[J].水产学报,2005,29(4):461-466.
YANG N,REN S L,SONG W B.Mucous cells in the alimentary tract of Meretrix meretrix[J].Journal of Fisheries of China,2005,29(4):461-466.(in Chinese)
[20] 尹苗,安利国,杨桂文,等.鲤鱼黏液细胞类型的研究[J].动物学杂志,2000,35(1):8-9.
YIN M,AN L G,YANG G W,et al.Study on the type of mucous cells in carps(Cyprinus carpio)[J].Chinese Journal of Zoology,2000,35(1):8-9.(in Chinese)
[21] 李巧梅,王清,于倩,等.As(Ⅲ)暴露对紫贻贝抗氧化酶活性和脂质过氧化的影响[J].海洋通报,2013,32(4):429-433.
LI Q M,WANG Q,YU Q,et al.Study on the effects of As(Ⅲ) exposure on antioxidant enzymes and lipid peroxidation of Mytilus galloprovincialis[J].Marine Science Bulletin,2013,32(4):429-433.(in Chinese)
[22] 李润玲,丁君,张玉勇,等.刺参(Apostichopus japonicus)夏眠期间消化道的组织学研究[J].海洋环境科学,2006,25(4):15-19.
LI R L,DING J,ZHANG Y Y,et al.Histological study on the digestive tract of the Apostichopus japonicus in aestivation[J].Marine Environmental Science,2006,25(4):15-19.(in Chinese)
[23] 樊英,于晓清,李乐,等.不同免疫增强剂对仿刺参肠道消化酶活性及组织结构的影响[J].水产学杂志,2014,27(4):46-51,59.
FAN Y,YU X Q,LI L,et al.Effect of different immunostimulants on digestive enzyme activities and histological structure in intestine of seacucumber,Apostichopus japonicus[J].Chinese Journal of Fisheries,2014,27(4):46-51,59.(in Chinese)
[24] KATOY,YU D H,SCHWARTZMZ.Glucagonlike peptide-2 enhances small intestinal absorptive function and mucosal mass in vivo[J].Journal of Pediatric Surgery,1999,34(1):18-21.
[25] KAMENEV Y O,DOLMATOV I Y,FROLOVA L T,et al.The morphology of the digestive tract and respiratory organs of the holothurian Cladolabes schmeltzii (Holothuroidea,Dendrochirotida)[J].Tissue and Cell,2013,45(2):126-139.
[26] 薛英楼,高菲,许强,等.黑海参(Holothuria atra)对环境沉积物的摄食选择及消化系统功能适应性研究[J].海洋与湖沼,2019,50(5):1070-1079.
XUE Y L,GAO F,XU Q,et al.Study on feeding selection of environmental sediments and digestive function adaptability of Holothuria atra[J].Oceanologia et Limnologia Sinica,2019,50(5):1070-1079.(in Chinese)
[27] 赵彦花,区又君,李加儿,等.黄唇鱼消化系统组织结构及黏液细胞分布特征[J].渔业科学进展,2019,40(3):80-86.
ZHAO Y H,OU Y J,LI J E,et al.Histology and distribution of mucous cells in digestive system of Bahaba flavolabiata[J].Progress in Fishery Sciences,2019,40(3):80-86.(in Chinese)
[28] 殷泽禄,赵晓玲.藏鸡研究进展及展望[J].青海畜牧兽医杂志,2015,45(1):42-45.
YIN Z L,ZHAO X L.Research progress and prospect of Tibetan chickens[J].Chinese Qinghai Journal of Animal and Veterinary Sciences,2015,45(1):42-45.(in Chinese)
[29] 华汉峰.刺参的生态习性[J].国外水产,1989(2):5-8.
HUA H F.The ecological habits of sea cucumber[J].Foreign Aquatic Products,1989(2):5-8.(in Chinese)
[30] LOPEZ G R,LEVINTON J S.Ecology of deposit-feeding animals in marine sediments[J].The Quarterly Review of Biology,1987,62(3):235-260.
[31] 涂永锋,宋代军.鱼类肠道组织结构及其功能适应性[J].江西饲料,2004(4):16-19.
TU Y F,SONG D J.Intestinal tissue structure and functional adaptability of fish[J].Jiangxi Feed,2004(4):16-19.(in Chinese)
[32] MCGUCKINM A,LIND NS K,SUTTON P,et al.Mucin dynamics and enteric pathogens[J].Nature Reviews Microbiology,2011,9(4):265-278.
NS K,SUTTON P,et al.Mucin dynamics and enteric pathogens[J].Nature Reviews Microbiology,2011,9(4):265-278.
[33] 谢木娇,区又君,温久福,等.四指马鲅消化道黏液细胞的发育规律[J].南方农业学报,2016,47(7):1222-1227.
XIE M J,OU Y J,WEN J F,et al.Development law of mucous cell in digestive tract of Eleutheronema tetradactylum[J].Journal of Southern Agriculture,2016,47(7):1222-1227.(in Chinese)
[34] 安利国,孟广勋,杨桂文,等.鲤稚幼体早期发育过程中黏液细胞的发生和变化[J].水生生物学报,2001,25(2):191-194.
AN L G,MENG G X,YANG G W,et al.Mucous cells in the earlydevelopmental stage of carp[J].Acta Hydrobiologica Sinica,2001,25(2):191-194.(in Chinese)
[35] CLARKE A J,WITCOMB D M.A study of the histology and morphology of the digestive tract of the common eel (Anguilla anguilla)[J].Journal of Fish Biology,1980,16(2):159-170.
[36] ROBERTON A M,WRIGHT D P.Bacterial glycosulphatases and sulphomucin degradation[J].Canadian Journal of Gastroenterology,1997,11:642360.
[37] BOSI G,DEPASQUALE J A,ROSSETTI E,et al.Difffferential mucins secretion by intestinal mucous cells of Chelon ramada in response to an enteric helminth Neoechinorhynchus agilis(Acanthocephala)[J].Acta Histochemica,2020,122(2):477-487.
[38] 石戈,王健鑫,刘雪珠,等.褐菖鮋消化道的组织学和组织化学[J].水产学报,2007,31(3):293-302.
SHI G,WANG J X,LIU X Z,et al.Study on histology and histochemistry of digestive tract in Sebastiscus marmoratus[J].Journal of Fisheries of China,2007,31(3):293-302.(in Chinese)
[39] TENGJAROENKUL B,SMITH B J,CACECI T,et al.Distribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia,Oreochromis niloticus L.[J].Aquaculture,2000,182(3/4):317-327.
[40] 陈慕雁,张秀梅,连建华.大菱鲆仔稚鱼期消化酶及碱性磷酸酶活性的变化[J].青岛海洋大学学报(自然科学版),2005,35(3):483-486.
CHEN M Y,ZHANG X M,LIAN J H.Development of some digestive enzymes and alkaline phosphatase activities in turbot Scophthalmus maximus larvae and juveniles[J].Journal of Ocean University of Qingdao(Natural Science Edition),2005,35(3):483-486.(in Chinese)
[41] 姜令绪,杨宁,李建,等.温度和pH对刺参(Apostichopus japonicus)消化酶活力的影响[J].海洋与湖沼,2007,38(5):476-480.
JIANG L X,YANG N,LI J,et al.Effects of temperature and ph on the activities of digestive enzymes in Apostichopus japonicus[J].Oceanologia et Limnologia Sinica,2007,38(5):476-480.(in Chinese)
[42] KOZARIC Z,KUZIR S,NEJEDLI S,et al.Histochemical distribution of digestive enzymes in hake,Merluccius merluccius L.[J].Veterinarski Arhiv,2004,74(4):299-308.
[43] P REZ-JIM
REZ-JIM NEZ A,CARDENETE G,MORALES A E,et al.Digestive enzymatic profile of Dentex dentex and response to different dietary formulations[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2009,154(1):157-164.
NEZ A,CARDENETE G,MORALES A E,et al.Digestive enzymatic profile of Dentex dentex and response to different dietary formulations[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2009,154(1):157-164.